Method Article
Riprogrammazione diretta in vivo delle cellule gliali residenti negli interneuroni mediante iniezione intracerebrale di vettori virali
In questo articolo
Riepilogo
Questo protocollo mira a generare interneuroni direttamente riprogrammati in vivo, utilizzando un sistema virale basato su AAV nel cervello e un giornalista GFP basato sulla sinapsi FLEX, che consente l'identificazione delle cellule e ulteriori analisi in vivo.
Abstract
La conversione della glia residente nel cervello in neuroni funzionali e specifici del sottotipo in vivo fornisce un passo avanti verso lo sviluppo di terapie alternative di sostituzione cellulare, creando anche strumenti per studiare il destino cellulare in situ. Fino ad oggi, è stato possibile ottenere neuroni tramite la riprogrammazione in vivo, ma il fenotipo preciso di questi neuroni o come maturano non è stato analizzato in dettaglio. In questo protocollo, descriviamo una conversione più efficiente e un'identificazione specifica delle cellule dei neuroni riprogrammati in vivo, utilizzando un sistema vettoriale virale basato su AAV. Forniamo anche un protocollo per la valutazione funzionale della maturazione neuronale delle cellule riprogrammate. Iniettando vettori flex (flip-escisione), contenenti i geni reporter riprogrammazione e synapsin a specifici tipi di cellule nel cervello che fungono da bersaglio per la riprogrammazione cellulare. Questa tecnica consente la facile identificazione dei neuroni appena riprogrammati. I risultati mostrano che i neuroni riprogrammati ottenuti maturano funzionalmente nel tempo, ricevono contatti sinaptici e mostrano proprietà elettrofisiologiche di diversi tipi di interneuroni. Utilizzando i fattori di trascrizione Ascl1, Lmx1a e Nurr1, la maggior parte delle cellule riprogrammate hanno proprietà di interneuroni contenenti parvalbumina a punta rapida.
Introduzione
L'obiettivo generale di questo metodo è quello di convertire in modo efficiente la glia residente del cervello in vivo in neuroni funzionali e specifici per sottotipo, come gli interneuroni che esprimono parvalbumina. Questo fornisce un passo avanti verso lo sviluppo di una terapia sostitutiva cellulare alternativa per le malattie cerebrali senza la necessità di una fonte cellulare esogena. Crea anche uno strumento per studiare gli interruttori del destino cellulare in situ.
Il cervello ha solo una capacità limitata per generare nuovi neuroni. Pertanto, nelle malattie neurologiche, c'è bisogno di fonti cellulari esogene per la riparazione del cervello. Per questo, diverse fonti di cellule sono state sottoposte a intense ricerche nel corso degli anni, comprese le cellule dal tessuto primario, cellule derivate da cellule staminali e cellule riprogrammate1,2,3. Riprogrammazione diretta delle cellule cerebrali residenti in neuroni è un approccio recente che potrebbe fornire un metodo attraente per la riparazione del cervello in quanto utilizza le cellule del paziente per generare nuovi neuroni all'interno del cervello. Ad oggi, diversi rapporti hanno dimostrato che la riprogrammazione in vivo attraverso la consegna di vettori virali nel cervello4,5,6,78,9 in diverse regioni del cervello come la corteccia, il midollo spinale, lo striato e il midbrain5,10,11, così come nel cervello intatto e lesione5,8,11,12. Entrambi i neuroni inibitori ed eccitatori sono stati ottenuti4,8, ma il fenotipo preciso o la funzionalità di queste cellule non è ancora stato analizzato in dettaglio.
In questo protocollo, descriviamo una riprogrammazione più efficiente e un'identificazione specifica delle cellule dei neuroni riprogrammati in vivo. Forniamo un protocollo per la valutazione funzionale della maturazione neuronale e della caratterizzazione del fenotipo in base alla funzionalità e ai tratti immunohistochimici.
Abbiamo usato un vettore AAV Cre-inducible e un reporter GFP per identificare i neuroni riprogrammati in vivo. Questa scelta di vettori virali ha il vantaggio di infettare sia le cellule divisorie che non divise del cervello, aumentando il numero di cellule mirate, in alternativa all'uso del retrovirus7,8. Un giornalista FLEX (GFP) specifico della sinapsi specifico del neurone, ci ha permesso di rilevare specificamente i neuroni appena generati. Studi precedenti hanno utilizzato promotori specifici di sottotipi per la riprogrammazione in vivo7,9, che consentono anche l'espressione di geni di riprogrammazione e reporter in tipi di cellule specifiche. Tuttavia, tale metodo richiede un'ulteriore identificazione dei neuroni riprogrammati mediante analisi post-mortem della co-espressione dei marcatori reporter e neuronali. L'uso di un reporter specifico del neurone, come quello descritto nel presente documento, consente un'identificazione diretta. Questo fornisce una prova diretta di una conversione di successo e consente un'identificazione delle cellule vive che è necessaria per l'elettrofisiologia patch-clamp.
Protocollo
Tutte le procedure sperimentali sono state eseguite ai sensi della direttiva dell'Unione europea (2010/63/UE) e approvate dal comitato etico per l'uso di animali da laboratorio presso l'Università di Lund e il Dipartimento svedese dell'agricoltura (Jordbruksverket). I topi sono alloggiati in un ciclo di 12 h di luce / buio con accesso ad libitum al cibo e all'acqua.
1. Vettori virali
- Clonazione di vettori AAV
- Per creare vettori AAV5 inducibili in Cre, inserire cDNA per GFP, Ascl1, Lmx1a e NR4A2 (Nurr1) in un orientamento inverso affiancato da due coppie di sequenze eterotipiche antiparallele loxP flip-excision (FLEX) (Table of Materials). Per l'inserimento di cDNA, utilizzare una spina dorsale come pAAV-Cba-FLEX o una con una struttura simile, contenente sequenze FLEX e un promotore di pollo beta actin (CBA).
- Inserire ogni singolo cDNA (ad esempio, Ascl1) nella spina dorsale dalla reazione a catena della polimerasi (PCR) e dagli enzimi di restrizione. Express GFP sotto il controllo di un promotore di sinapsi e Ascl1, Lmx1a, Nurr1 sotto il controllo di un promotore CBA espresso onnipresente.
NOT: Assicurarsi di avere DNA privo di endotossina utilizzando specifici kit di isolamento del DNA plasmide endotossina. - Eseguire la sequenza e l'analisi delle restrizioni sui costrutti prima dell'uso, al fine di verificare il successo del passaggio di clonazione.
- Produzione vettoriale virale AAV5
ATTENZIONE: Fare riferimento alle linee guida locali sulla biosicurezza durante la gestione del virus adeno-associato (AAV). In Svezia, l'AAV utilizzato in questo protocollo richiede il livello di biosicurezza 2 (BSL-2).- Celle di semi HEK293T con mezzi di coltura standard (DMEM-Glutamax - 10% FBS - penicillina (100 U/ml) streptomicina (100 g/mL), vedi Tabella dei materiali) in Flam5 flacca ad una densità di 3 x 106 cellule per fiaschetta. Conto 5 flaconi per lotto di AAV e pianificare 6 lotti alla volta.
- Quando le cellule raggiungono il 50-70% di confluenza, preparare il seguente mix per la trasfezione (per 175 cm2 fiaschetta).
- In un tubo di centrifugazione da 50 mL, aggiungere quantità equimolare di plasmide vettoriale e pDG serie plasmide (pDP5, pDP6), con una quantità totale di 72 g per 175 cm2 pallina.
- Aggiungere il buffer Tris-EDTA (buffer TE, 10 mM Tris-HCl, 1 mM EDTA) a un volume finale di 144 mL.
- Aggiungere acqua ultrapura in modo che il volume totale diventi 1296 mL e mescolare.
- Aggiungere 144 l2 di 2,5 M CaCl2 e mescolare. Aggiungete alla soluzione del DNA 1,92 l di HEPES Buffered Saline (HBS) (1,5 mM Na2HPO4 ,140 mM NaCl, 50 mM HEPES) e mescolate immediatamente mediante vortice.
- Incubare a temperatura ambiente (RT) per esattamente 60 s. Trasferire la soluzione a 28 mL di coltura cellulare fresca e mescolare.
- Sostituire il mezzo nei flaconi con un mezzo di coltura cellulare contenente la miscela di trasfezione.
- Tre giorni dopo la trasfezione, raccogliere le cellule versando fuori mezzo dai flaconi in un contenitore usa e getta per i rifiuti e aggiungere 5 mL di buffer di raccolta (EDTA aggiunto a Phosphate-Buffered Saline, vedi Tabella dei materiali, DPBS ad una concentrazione finale concentrazione di 5 mM) in ogni flacone per consentire il distacco cellulare.
- Versare la soluzione cellulare in un tubo di centrifuga da 50 mL. Aggiungere altri 4 mL di DPBS ad ogni fiaschetta per sciacquare le cellule rimanenti e piscina con prima soluzione cellulare. Centrifugare le cellule raccolte a 1.000 x g per 5 min a 4 gradi centigradi.
- Dopo la centrifugazione, rimuovere il supernatante e sciogliere i pellet in 15 mL di tampone di lisi (50 mM Tris-HCl pH 8.5, 150 mM NaCl, 1 mM MgCl2) vortice.
- Congelarli in bagnodio CO2-ghiaccio/etanolo per 15 min e conservarli in un congelatore -20 gradi centigradi. Scongelare il lisato a cellule raccolte in un bagno d'acqua a 37 gradi centigradi prima dell'uso.
- Purificazione del vettore virale AAV5
- Eseguire la purificazione AAV di Iodixanol Gradient Ultrafugation13 e utilizzare tubi di sigillazione a ultracentrifuga con centrifugazione a 350.000 x g per 1 h e 45 min a RT.
- Utilizzare una siringa da 10 mL con un ago 18G e inserire circa 2 mm sotto il bordo di fase 40/60% con lo smusso rivolto verso l'alto per estrarre la fase contenente AAV. Assicurarsi di fermarsi prima di raggiungere la fascia proteica dopo 5-6 mL è stato estratto.
- Conservare gli estratti di gradiente in bottiglie di vetro autoclaved a 4 gradi centigradi. Evitare di conservare i tempi più lunghi di durante la notte.
- Diluire l'estratto di gradiente Iodixanol 3 volte con pipettando lentamente in 12 mL di Iodixanol Elution (IE) buffer (20 mM Tris-HCl pH 8.0, 15 mM NaCl) mentre vorticoso.
- Purificare e concentrare il gradiente diluito dello Iodixanolo attraverso un filtro di scambio di anioni. Spingere lentamente con una velocità non più veloce di 1 goccia / s. Spingere 3 mL di buffer IE lentamente attraverso il filtro per lavarlo.
- Eluire in un'unità filtrazione centrifuga con 1-2 mL di tampone di eluizione (20 mMM Tris-HCl pH 8.0;250 mM NaCl). Aggiungere DPBS al dispositivo ad un volume finale di 4 mL. Centrifuga a 2.000 x g a RT fino a quando non meno di 0,5 mL viene lasciato nel filtro. Rimuovere il liquido dal fondo del tubo, riempire con 4 mL di DPBS e centrifugare di nuovo. Ripetere questo passaggio altre due volte. Assicurarsi che il volume del vettore concentrato sul filtro sia di circa 200 gradi l dopo l'ultima fase di centrifugazione.
- Rimuovere il vettore concentrato 200 con una pipetta e spingere il concentrato attraverso un filtro da 0,22 mm per sterilizzarlo. Aliquota 200 - Linto una fiala di vetro da 9 mm con inserto interbloccato (Tabella dei materiali).
NOT: Gli stock di vettori AAV5 possono essere immagazzinati in congelatori a -80 gradi centigradi per un lungo stoccaggio, o a 4 gradi centigradi se utilizzati entro 2 settimane.
- Determinazione del titro del vettore virale AAV5
- Determinare il titiero AAV5 utilizzando la catena quantitativa di polimerasi (qPCR) standard con i primer per la sequenzaITR(Inverted Terminal Repeat) e una sonda 5 - FAM / 3 - BHQ1 per la sequenza ITR (Tabella dei materiali). Utilizzare una curva standard ottenuta con quantità note di ITR contenenti plasmide. Ogni vettore AAV deve avere un intervallo di 1E14 – 1E 15 copie del genoma per millilitro se la sequenza ITR viene utilizzata per la determinazione del titro.
NOT: Una produzione di virus AAV5 di successo dà scorte con titer nella gamma minima di 3E13 – 7E13 unità /mL.
- Determinare il titiero AAV5 utilizzando la catena quantitativa di polimerasi (qPCR) standard con i primer per la sequenzaITR(Inverted Terminal Repeat) e una sonda 5 - FAM / 3 - BHQ1 per la sequenza ITR (Tabella dei materiali). Utilizzare una curva standard ottenuta con quantità note di ITR contenenti plasmide. Ogni vettore AAV deve avere un intervallo di 1E14 – 1E 15 copie del genoma per millilitro se la sequenza ITR viene utilizzata per la determinazione del titro.
2. Iniezione di fattori di riprogrammazione nel cervello
- Configurazione degli animali, posizionamento e perforazione stereotassici
nota:Questo protocollo si concentra sull'uso di Ascl1, Lmx1a e Nurr1 (ALN) per la riprogrammazione di NG2 glia in interneuroni. Nella nostra esperienza, gli interneuroni di un fenotipo simile possono essere ottenuti utilizzando altre combinazioni di fattori11 Del sistema di.- Prima dell'intervento, preparare la miscela virale contenente i vettori Cba-FLEX-Ascl1, Cba-FLEX-Lmx1a, Cba-FLEX-Nurr1 e il reporter vettore Syn-FLEX-GFP. Aggiungere ciascuno dei titoli preparati nella sezione 1 al mix finale, in modo che la soluzione virale finale abbia il 5% di ciascuno dei fattori di riprogrammazione (Ascl1, Lmx1a e Nurr1) e il 10% del costrutto del reporter (5% A, 5% L, 5% N e 10% GFP).
NOT: Le miscele vettoriali AAV5 possono essere conservate a 4 gradi centigradi e conservate per un uso futuro in vivo. - Anestesizzare il topo utilizzando 2% isoflurane in un mix di aria e protossido di azoto (N2O) con un rapporto 4:1. Monitorare la respirazione dell'animale osservando i movimenti del diaframma. Durante l'intervento, mantenere l'anestesia utilizzando 1–1,5 % isoflurane.
NOT: Il modello murino descritto consiste in una deformazione del topo che esprime specificamente Cre in glia NG2. La riprogrammazione in vivo può essere ottenuta utilizzando diversi ceppi di topo che esprimono Cre in altre popolazioni di cellule gliali (ad esempio, astrociti14). - Una volta che l'animale è completamente anestesizzato (adesempio, rilassamento muscolare completo e nessuna risposta a un pizzico nel pad del piede), radere l'area intorno al sito di incisione e portare l'animale al telaio stereotassico.
- Per mantenere la temperatura corporea dell'animale durante l'intervento chirurgico, collegare una piastra di riscaldamento alla base del telaio stereotassico. Posizionare il mouse su un tovagliolo di carta pulito e asciutto.
- Posizionare con attenzione la testa del mouse nelle barre dell'orecchio. Se posizionato correttamente, non deve essere osservato alcun movimento laterale della testa. Impostare la barra dell'orecchio sinistro a 4 mm, prima di iniziare a posizionare il mouse nel telaio stereotassico.
- Fissare la barra dei denti in posizione, quindi stringere la barra del naso. Assicurarsi che la testa non si muova in nessuna dimensione e punti dritto in avanti (la linea mediana è perpendicolare al piano delle barre dell'orecchio). Applicare unguento oftalmico per la protezione degli occhi.
- Prima dell'inizio dell'intervento, somministrare l'analgesia appropriata (ad esempio, 0,05 mg/kg di Buprenorfina, sottocutanea).
- Pulire l'area di incisione con una garza di cotone o una salvietta imbevuta di 70% EtOH, senza avvicinarsi alla zona degli occhi.
NOT: Per l'iniezione virale intracerebrale, viene utilizzata una siringa da 5 o 10 mL adattata con un capillare di vetro tirato. I capillari di vetro vengono tirati utilizzando un estrattore di micropipette, risultando in un capillare con una punta molto fine, che ridurrà al minimo l'invasività della procedura. Per adattare il capillare alla siringa, utilizzare un pezzo di tubo di gomma sopra la connessione tra l'ago della siringa e il vetro capillare e scioglierlo utilizzando una fonte di calore (ad esempio, un accendino). Una stretta connessione tra i due pezzi farà in modo che non ci siano perdite di liquido durante l'iniezione. Prima di iniziare l'intervento, provalo riempiendo la siringa con la salina e spingendo il liquido fuori dalla siringa. - Fare un'incisione di circa 0,5-0,8 cm lungo la linea mediana della testa. Tagliare attraverso entrambi gli strati cutanei e sottocutanei, con un bisturi.
- Ampliare i lembi della pelle su ogni lato dell'incisione. Pulire l'incisione di qualsiasi sangue e raschiare indietro gli strati sottocutanei con un batuffolo di cotone.
- Spostare il braccio M/L-D/V del telaio stereotaxic in posizione (sopra l'animale) e fissarlo.
NOT: Il telaio stereotassico consente la regolazione della siringa lungo l'asse Anteriore/Posteriore (A/P, Y), Mediale/Laterale (M/L, Asse X) e Dorsale/Ventrale (D/V, asse z). - Spostare la siringa lungo il diverso asse del telaio stereotassico, per portare la punta del capillare di vetro appena sopra bregma (il punto di giunzione dove si incontrano le diverse piastre del cranio).
- Assicurarsi che la punta capillare sia perfettamente dritta sia nei piani A/P che M/L. In caso di un bregma ambiguo, prendere la media delle suture laterali e media.
- Quando la punta del capillare è posizionata correttamente sopra il bregma, reimpostare entrambi i valori M/L e A/P su 0,0 sul contatore delle coordinate digitali.
- Per assicurarsi che la testa dell'animale si trova in una posizione perfettamente piatta, utilizzare il contatore delle coordinate digitali per misurare il valore della coordinata D/V, quando il braccio A/P è pari a 2,0 e -2,0 (M/L - 0,0), nonché quando il braccio M/L è pari a 2,0 e -2,0 (A/P - 0,0). Regolare di conseguenza l'altezza della barra dei denti e delle barre dell'orecchio.
- Spostare la siringa sulle coordinate desiderate per l'iniezione di vettori virali nello striato (A/P - 1,0; M/L -2,0, relativo a bregma).
- Sollevare leggermente la siringa e, osservando il sito di iniezione attraverso il microscopio, praticare un foro utilizzando un trapano dentale alle coordinate di iniezione. Iniziare a forare presso il sito, lavorando in modo circolare e delicato.
NOT: Non mettere troppa pressione verso il basso, come il trapano dovrebbe essere abbastanza affilato per passare attraverso l'osso senza forza aggiuntiva. Evitare la perforazione lunga e sostenuta in quanto questo crea calore. - Alla fine della perforazione, verificare che la dura mater rimanga intatta ed esposta per l'iniezione.
- Prima dell'intervento, preparare la miscela virale contenente i vettori Cba-FLEX-Ascl1, Cba-FLEX-Lmx1a, Cba-FLEX-Nurr1 e il reporter vettore Syn-FLEX-GFP. Aggiungere ciascuno dei titoli preparati nella sezione 1 al mix finale, in modo che la soluzione virale finale abbia il 5% di ciascuno dei fattori di riprogrammazione (Ascl1, Lmx1a e Nurr1) e il 10% del costrutto del reporter (5% A, 5% L, 5% N e 10% GFP).
- Preparazione della configurazione della siringa
- Posizionare un pezzo di garza di cotone sull'incisione aperta e lavare la siringa con soluzione salina.
- Dopo lo sciacquone, assorbire una bolla d'aria di 1–2 l, seguita da 1 l di soluzione contenente i vettori virali, evitando eventuali bolle involontarie. Assicurarsi che la soluzione virale può essere facilmente visualizzata sotto la bolla d'aria, mentre viene iniettato.
- Iniezione virale
- Rimuovere la garza di cotone dal sito di incisione e abbassare la siringa utilizzando il braccio D/V del telaio stereotassico. Quando la superficie del cranio viene avvicinata, guardare attentamente attraverso il microscopio e misurare il livello di D / V di dura mater - dovrebbe rigonfiare leggermente sotto pressione delicata.
- Mentre si tocca la dura mater con la punta del capillare, impostare la coordinata D/V su 0.0.
- Abbassare la siringa, avanzando lentamente fino alla profondità desiderata (D/V -2,7, rispetto alla dura mater). Assicurarsi che la traiettoria sia chiara dai frammenti ossei, in modo che non si osservi alcuna piegatura dell'ago/capillare.
NOT: Le coordinate presentate si riferiscono ad un'iniezione dei fattori di riprogrammazione nello striato dei topi NG2-Cre. Possono essere utilizzate coordinate corrispondenti ad altre regioni del cervello. Testare sempre le coordinate per l'iniezione prima utilizzando un colorante (ad esempio Trypan Blue), l'iniezione di perline colorate o un vettore virale reporter prima dell'iniezione di fattori di riprogrammazione nel cervello di un nuovo ceppo di topo. Se iniettando Trypan Blue, gli animali devono essere sacrificati subito dopo l'intervento chirurgico e il cervello sezionato fuori. Cervelli freschi possono essere tagliati utilizzando un microtoma, mentre congelato, e il sito di iniezione determinato dalla visualizzazione della posizione di tinri nel cervello. Se testare le coordinate utilizzando perline colorate, è possibile determinare il sito di iniezione su perfuso e tagliare i cervelli una settimana dopo l'iniezione. In alternativa, è possibile utilizzare un'iniezione con un vettore virale che trasporta un gene reporter e il sito di iniezione determinato in cervelli tagliati perfusi. - Iniettare 1 l della soluzione virale ad una velocità di 0,4 l/min. Quando l'intero volume viene iniettato, lasciare un periodo di diffusione di 2 min prima del ritiro della siringa.
- Dopo la diffusione, ritrarre lentamente la siringa fino a quando la punta del capillare è completamente fuori dal cervello.
- Mettere un pezzo di garza di cotone sopra la ferita e lavare la siringa con soluzione salina.
- Spostare il braccio M/L-D/V del telaio stereotaxic fuori dall'area di lavoro.
- Chiusura della ferita e procedure post-operatorie
- Suturare con attenzione l'incisione utilizzando filo di sutura.
NOT: Tutti i fili di sutura utilizzati negli animali iniettati devono essere smaltiti in una tazza/fiala contenente una soluzione detergente anti-virale. La stessa soluzione viene utilizzata per pulire tutte le superfici che circondano l'area di chirurgia che sono state a contatto con materiali chirurgici. Tutti gli strumenti chirurgici sono accuratamente lavati e autoclaved alla fine di ogni giorno di chirurgia. - Rimuovere l'animale dal telaio stereotaxic e posizionarlo in una stazione post-operatoria, che comprende una gabbia pulita e riscaldata, l'accesso al cibo e all'acqua e dove l'animale rimane completamente sveglio. Durante questo periodo, monitorare l'animale da vicino fino a quando la coscienza è riconquistata.
- Non ospitare animali operati con animali non operati fino a quando i primi non si sono completamente ripresi dall'intervento chirurgico.
- Supervisionare gli animali operati ogni giorno. A seconda delle suture utilizzate, assicurarsi che vengano rimosse se necessario. A tutti gli animali è stato somministrato Bupenorphinum (Temgesic a 1ml/kg) sottocutaneo come cura post-operatoria.
NOT: Se si utilizza la stessa siringa in due giorni consecutivi, sciacquarla con acqua, seguita da etanolo 70% e acqua di nuovo. Lasciare la siringa riempita con acqua durante la notte, per consentire la dissoluzione di eventuali residui.
- Suturare con attenzione l'incisione utilizzando filo di sutura.
3. Registrazioni elettrofisiologiche
- Preparazione della sezione dei tessuti per l'elettrofisiologia
ATTENZIONE: Una preparazione dei tessuti ben eseguita è necessaria per ottenere buone registrazioni elettrofisiologiche. Preparare la stanza con attenzione e posizionare gli strumenti per la perfusione e la dissezione sul ghiaccio.- Preparare la soluzione Krebs a freddo ghiaccio e ossigenato (95% O2 e 5% CO2) per la perfusione, la dissezione e il taglio (prepararlo lo stesso giorno dal brodo 10x diluendo la soluzione di stock in acqua ultrapura e aggiungendo NaHCO3 e glucosio). I componenti della soluzione Krebs in mM (dopo la diluizione a 1x) sono: 126 NaCl, 2.5 KCl, 1.2 NaH2PO4 H2O, 1,3 MgCl2x 6H2O, e 2.4 CaCl2.6H2O, 22 NaHCO3, 10 glucosio. Regolare il pH della soluzione a 7.4.
- Eseguire una calibrazione (Vibracheck) per il vibratome con una nuova lama di rasoio.
- Avviare il blocco di raffreddamento del vibratome (o riempire la camera circostante con ghiaccio), riempire la camera di taglio con soluzione Krebs per l'ossigenazione con 95 % O2 e 5 % CO2 almeno 30 min prima dell'uso.
- Mettere un piatto Petri sul ghiaccio e riempirlo con soluzione Krebs ossigenata. Posizionare la lama, le forbici e la piastra di montaggio sul ghiaccio.
ATTENZIONE: Portare la gabbia contenente il mouse nella stanza almeno 1 h prima di iniziare la procedura di acclimatazione. Lo stress ha un effetto negativo sulla condizione delle sezioni del tessuto cerebrale. - Anestesizzare terminalmente il topo iniettando un sovradosaggio di Pentobarbital e lasciare che l'animale si addormenti. Quando il riflesso delle palpebre è fuori e l'animale non risponde agli stimoli del dolore, perfupite trascardialmente l'animale con la soluzione Krebs ghiacciata per 2-3 min (a una velocità di 10-20 mL/min).
- Rapidamente, ma con attenzione, sezionare il cervello e metterlo a testa in giù nel Petri-piatto che viene posto sul ghiaccio (contenente soluzione Krebs).
NOT: Al fine di confrontare la maturazione funzionale dei neuroni riprogrammati, sacrificare gli animali per le registrazioni in diversi punti temporali iniezione post-virale. Valutare le proprietà di cottura di sottotipi distinti di neuroni in base alla letteratura esistente15 . - Fare un taglio coronale lungo il cervelletto medio e incollare questo lato sulla piastra di montaggio (anche ghiacciato) per il taglio vibratoma.
- Immergere il cervello incollato con attenzione nella camera tampone nel vibratome.
ATTENZIONE: Fare attenzione a non toccare la lama del rasoio per la propria sicurezza e in modo che la lama rimanga calibrata. - Tagliare dalla parte più rostrale del cervello fino al livello striatale ad alta velocità. Quindi tagliare lo striato coronalmente a 275 mm a velocità lenta (0,10 mm / s).
- Dopo ogni taglio, rimuovere con attenzione il lato striatale non iniettato (ad esempio, con un ago piegato) e trasferire il lato iniettato in un'altra fiala in un bagno d'acqua, contenente una rete inferiore (Tbg a riscossi ossigenati a RT) collocata in un bagno d'acqua. Tenere questo a RT fino a quando tutte le sezioni sono tagliate.
- Aumentare lentamente la temperatura del bagno d'acqua a 37 gradi centigradi e lasciarlo per 30 min. Spegnere quindi il riscaldatore e lasciare raffreddare fino a RT.
NOTA: a questo punto, è possibile mettere in pausa fino a quando non si avvia la registrazione. Le sezioni durano 4-6 h.
- Registrazioni di patch-clamp a tutta cell
- Trasferire la prima sezione di tessuto nella camera di registrazione sommersa in un flusso continuo di soluzione Krebs. Montare la sezione utilizzando pesi leggeri e sommergere l'obiettivo.
- Identificare la regione striata al microscopio e cercare neuroni GFP positivi (riprogrammati). Selezionare un neurone che è esteso in morfologia e non coperto da fasci di fibre o vasi sanguigni.
- Preparare le pipette di vetro di borosilicate (3–7 M) per la patch e riempire con la seguente soluzione intracellulare (in mM): 122.5 gluconato di potassio, 12.5 KCl, 0.2 EGTA, 10 HEPES, 2 MgATP, 0.3 Na3GTP e 8 NaCl, regolato al pH 7.3 con KOH.
- Per il riempimento di biocitina, aggiungere 1 mg di sale di biocitina a 1 mL di soluzione interna e vortice.
ATTENZIONE: Assicurarsi di filtrare la soluzione interna con biocitina in quanto ciò può altrimenti intasare l'elettrodo. - Attaccare la pipetta di vetro all'elettrodo di registrazione e immergere nella soluzione. Controllare due volte la resistenza dell'elettrodo. Quindi avvicinare lentamente la cellula con la pipetta, mantenendo una leggera pressione positiva nell'elettrodo per evitare di collegare la punta.
ATTENZIONE: Fare attenzione a tenere traccia della vostra cella durante la discesa dell'elettrodo e non sbiancare la fluorescenza nella cella (cioè, spegnere la lampada a fluorescenza quando non è necessario). - Sciacquare attentamente il tessuto circostante utilizzando la pressione positiva dell'elettrodo e avvicinarsi alla cellula con l'elettrodo. Individuare l'elettrodo direttamente sopra la cella e scendere fino a quando l'elettrodo ha toccato la membrana. Fare una guarnizioni giga-essia tra l'elettrodo e la membrana cellulare, e con impulsi di pressione negativa, rompere la membrana per creare un cerotto a tutta cell.
ATTENZIONE: I neuroni riprogrammati sono sensibili. Prestare attenzione quando si applica la patch e non mettere troppa pressione negativa quando si raggiunge una guarizione Giga-e o si apre la membrana cellulare. Inoltre, l'applicazione di patch su animali più vecchi richiede pratica e pazienza in quanto il loro tessuto connettivo è più spesso ed è più difficile visualizzare i neuroni. - Controllare i potenziali della membrana a riposo immediatamente dopo la rottura in modalità corrente-clamp e annotare per l'analisi.
- Nel morsetto corrente, mantenere la cella compresa tra -60 mV e -80 mV e iniettare correnti da 500 ms da -20 pA a 90 pA, con incrementi di 10 pA per indurre potenziali d'azione.
- Trasferire in voltat-morsetto e misurare il sodio verso l'interno e le correnti di potassio rettificante ritardate a passi depolarizzazione di 10 mV.
NOT: Le registrazioni dei morsetti di tensione sono meglio valutate utilizzando una soluzione interna diversa, composta da sostanze chimiche che bloccano in modo più efficiente la membrana. Tuttavia, per i neuroni riprogrammati, il numero di cellule che è possibile registrare da è pochi e il numero di sezioni di tessuto con questi neuroni è limitato. Quindi, è un vantaggio registrare sia in corrente-clamp e tensione-morsetto dalla stessa cella. - In modalità tensione-morsetto, registrare l'attività post-sinaptica spontanea a -70 mV. Distinguere gli eventi postinaptici inibitori a un potenziale di membrana di 0 mV da eventi eccitatori a -70 mV.
- Dopo aver raggiunto una linea di base stabile, aggiungere Picrotoxin, l'antagonista del recettore GABAA, alla soluzione Krebs che scorre nella camera di registrazione, per estrarre eventi eccitatori (aggiungere una soluzione stock di Picrotoxin ad una concentrazione finale di 50 mM in siringa tampone collegata alla perfusione della camera. Collegare il deflusso del buffer dalla camera a un sacchetto sottovuoto per uno smaltimento sicuro).
- Dopo 20 min, aggiungere CNQX (20 mM), un antagonista AMPA, alla soluzione Krebs che scorre nella camera di registrazione, per bloccare gli eventi inibitori (utilizzando la stessa procedura come per Picrotoxin). Lasciare agire per altri 20 min e poi lavare con la soluzione Krebs. Rimuovere la sezione del tessuto dalla camera.
- Dopo aver terminato le registrazioni, fai un'analisi offline delle correnti post-sinaptiche spontanee (EPSC) e delle correnti post-sinaptiche inibitorie (IPSC) utilizzando un rilevamento di eventi soglia (>5 pA) nel programma di analisi.
- Durante l'intera registrazione, la cellula verrà lentamente riempita con la soluzione interna contenente biocitina. Conservare il cerotto per almeno 20 minuti prima di rimuovere lentamente l'elettrodo per ottenere il riempimento completo della cella.
ATTENZIONE: Fare attenzione a non avere alcuna pressione positiva nell'elettrodo che potrebbe distruggere l'analisi morfologica consecutiva delle cellule in seguito. - Per la visualizzazione della biocitina, mettere la sezione dei tessuti nel 4 % di paraformaldeide (PFA) durante la notte a 4 gradi centigradi. Risciacquare la sezione nel buffer di fosfato di potassio da 0,02 M (KPBS) con 0,1 % Triton. Quindi, macchia per streptavidina- Ci3 (1: 600 in KPBS-T, 2 h), per l'identificazione della cellula riempita di biocitina e la visualizzazione morfologica del neurone riprogrammato.
NOT: Il riempimento di biocitina può essere utilizzato per l'analisi morfologica e le illustrazioni dei neuroni patchati.
4. Immunoistochimica, stereologia e quantificazione
NOT: Dedicare un gruppo specifico di topi per l'immunoistochimica, poiché le sezioni tissutali utilizzate per l'elettrofisiologia non sono ottimali per l'immunohistochimica.
- Anatesizzare i topi con un'iniezione i.p. di un sovradosaggio di pentobarbital e montare l'animale per la perfusione.
- Tracardialmente perfondono i topi, prima con una soluzione salina per rimuovere il sangue, e poi con gelata 4% PFA.
- Dissezionare il cervello e post-correzione per almeno 12 h in 4% PFA.
- Mettere il cervello in soluzione di saccarosio 25% (per la crioprotezione) per circa 12 h.
NOT: I cervelli sono pronti per essere tagliati quando affondano nella soluzione di saccarosio del 25%, indicando che il saccarosio è penetrato nell'intero cervello del topo. - Fare un taglio coronale attraverso il cervelletto, utilizzare la parte piatta, più caudale del cervello per posizionare il cervello su un microtoma e fissarlo in posizione utilizzando composto di temperatura di taglio ottimale (OCT).
- Tagliare il cervello a fette coronali con uno spessore di 35 mm e dividere il cervello in serie consecutive collocate in fiale o pozzi contenenti 0,02 M KPBS.
- Elaborare le sezioni per l'immunohistochimica utilizzando anticorpi contro GFP e marcatori interneuroni come GAD65/67, PV, Chat (acetiltransferase di colina) e NPY (Neuropeptide Y), secondo i protocolli standard16, 17.
NOT: Le fette di cervello possono essere conservate a 4 o -20 gradi centigradi in soluzione antigelo per lunghi periodi. - Al termine della colorazione, montare le sezioni su uno scivolo di vetro e coprire con un coperchio di vetro, utilizzando una soluzione di montaggio per fissarlo in posizione. Lasciare asciugare i coperchi dei vetrini per asciugare la notte.
NOT: Per i nostri studi, i cervelli interi sono tagliati in serie 1:8 (cioè, ogni fiala contenente sezioni conterrà un ottavo del cervello del topo11). - Analizzare le sezioni utilizzando una fluorescenza invertita e/o un microscopio confocale.
ATTENZIONE: La microscopia fluorescente è utile per una panoramica generale dei risultati e per l'acquisizione di immagini per il calcolo dell'efficienza di riprogrammazione. Per un'analisi più dettagliata dell'identità fenotipica mediante osservazione di cellule doppio positive, è necessario utilizzare l'imaging confocale. - Per la quantificazione dei diversi marcatori espressi in GFP- neuroni nello striato, contare il numero di cellule doppio-positivo in relazione al numero totale di gPOe cellule (cioè i neuroni riprogrammati), in almeno due campi di ciascuno sezione striatale.
- Per determinare il numero totale estrapolato approssimativo di neuroni riprogrammati per cervello, contare i valori GFPe neuroni presenti nello striato di una delle serie cerebrali tagliati in precedenza, e quindi moltiplicare per il numero totale di serie.
NOT: Diversi metodi di quantificazione possono essere utilizzati per esprimere l'efficienza di riprogrammazione, il numero di neuroni riprogrammati per animale e la percentuale di neuroni che esprimono alcuni marcatori fenotipici. Per ulteriori informazioni, vedere la pubblicazione precedente11. - Analizzare le differenze tra le condizioni utilizzando Graph Pad Prism o simili.
NOT: Per il calcolo dell'efficienza, abbiamo iniettato i topi NG2-Cre con i vettori di conversione ALN dipendenti dal CRE e il reporter GFP. Per stimare l'efficienza di conversione, abbiamo anche iniettato animali con un GFP dipendentedalla crenatura sotto l'onnipresente promotore cba, rendendo tutte le cellule mirate GFP . Utilizzando questo confronto, abbiamo stimato che 66.81% - 38.38% delle cellule mirate convertite in neuroni. Per la convalida dell'espressione di ciascuno dei geni, è possibile eseguire una doppia colorazione immunofluorescente complementare per GFP/Ascl1, GFP/Lmx1a e GFP/Nurr1. Inoltre, il sequenziamento del genoma come il sequenziamento dell'RNA a singola cellula può rivelare la presenza di ciascuno dei geni nelle cellule riprogrammate.
Risultati
L'iniezione di vettori AAV viene utilizzata per riprogrammare con successo le cellule glia NG2 residenti nei neuroni nello striato del topo NG2-Cre (Figura 1A). Per rivolgersi specificamente a NG2 glia, i vettori FLEX con geni di riprogrammazione/reporter, vengono inseriti in una direzione antisenso e affiancati da due coppie di siti loxP antiparalleli ed eterotipici (Figura 1B). Ognuno dei tre geni di riprogrammazione (Ascl1, Lmx1a e Nurr1) è posto sotto il controllo dell'onnipresente promotore cba su singoli vettori. Al fine di assicurarsi che l'espressione GFP sia limitata ai neuroni riprogrammati provenienti da una cellula che esprime la Crestia, la GFP viene posta sotto il controllo del promotore di sinapsi specifico del neurone, (anche in un vettore FLEX).
L'uso della combinazione di riprogrammazione e costrutti reporter consente la generazione di neuroni GFP-positivi nello striato del topo (Figura 1C,C'). L'uso del costrutto reporter senza la presenza di geni di riprogrammazione non produce neuroni GFP-positivi (Figura 1D).
I neuroni riprogrammati riempiti di biocitina sono visibili dopo l'immuno-colorazione post-mortem (Figura 2A). Se la conversione ha successo, ci dovrebbe essere ampia morfologia neuronale. Le registrazioni elettrofisiologiche dei neuroni riprogrammati mostrano la presenza di connessioni funzionali post-sinaptiche con misure di attività spontanea (Figura 2B, C). Questo può essere bloccato con blocco ionotropico GABAergic o glutamatergico (Picrotoxin o CNQX), suggerendo sia input sinaptico eccitatorio e inibitorio per i neuroni riprogrammati. L'insorgenza di attività spontanea aumenta con il tempo dopo l'iniezione virale (Figura 2D), indicando una maturazione graduale.
I potenziali d'azione indotti dall'attuale sono presenti nei neuroni funzionali. I potenziali di azione aumentano di numero nel tempo dopo la conversione (Figura 2E). Questo indica ulteriormente la maturazione nella funzione neuronale. In un neurone immaturo, la corrente indurrà nessuno o pochissimi potenziali d'azione (Figura 2F).
I modelli di cottura di un neurone sono specifici del tipo di cellula in quanto dipende da fattori come la morfologia delle cellule e l'espressione del canale15. I modelli registrati nei neuroni riprogrammati in vivo possono essere distinti in gruppi e confrontati con quelli di sottotipi neuronali endogeni, ad esempio interneuroni a chiodare veloce (Tipo di cella B, Figura 3B) o altri tipi di cellule (Figura 3A, C,D ). Le differenze elettrofisiologiche osservate possono essere confermate dalla presenza di specifici marcatori di sottotipi e co-espressione con GFP (Figura 3E-H). Complessivamente, questi dati indicano che i neuroni riprogrammati presenti nello striato hanno proprietà di diversi tipi di interneuroni, come Parvalbumin-, ChAt- e NPY- che esprimono interneuroni, così come l'identità striata del neurone spinoso medio (DARPP32) ( Figura 3E -H).
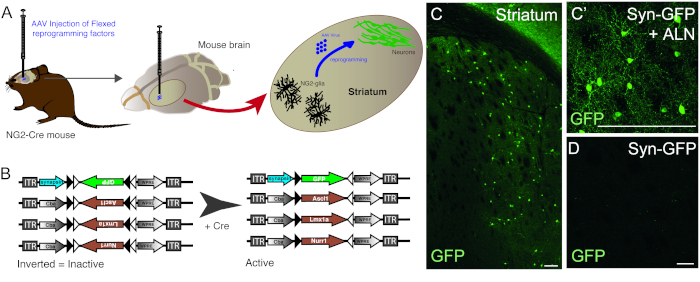
Figura 1: Riprogrammazione in vivo della glia NG2 residente in neuroni. (A) Rappresentazione schematica della riprogrammazione in vivo mediata dal virus AAV della striale NG2 glia. (B) Rappresentazione schematica dei costrutti AAV5 FLEX utilizzati per la riprogrammazione in vivo, in cui l'espressione genica è regolata dall'espressione Cre nelle cellule mirate. (C e C')Neuroni in vivo riprogrammati, risultanti dall'iniezione Syn-GFP - ALN nello Striatum. (D) L'assenza di neuroni riprogrammati quando non vengono aggiunti fattori di riprogrammazione nel cocktail virale e viene iniettato solo il costrutto reporter in vivo. Barre di scala: 100 mm (C), 25 mm (C'), 25 mm (D). Fare clic qui per visualizzare una versione più grande di questa figura.
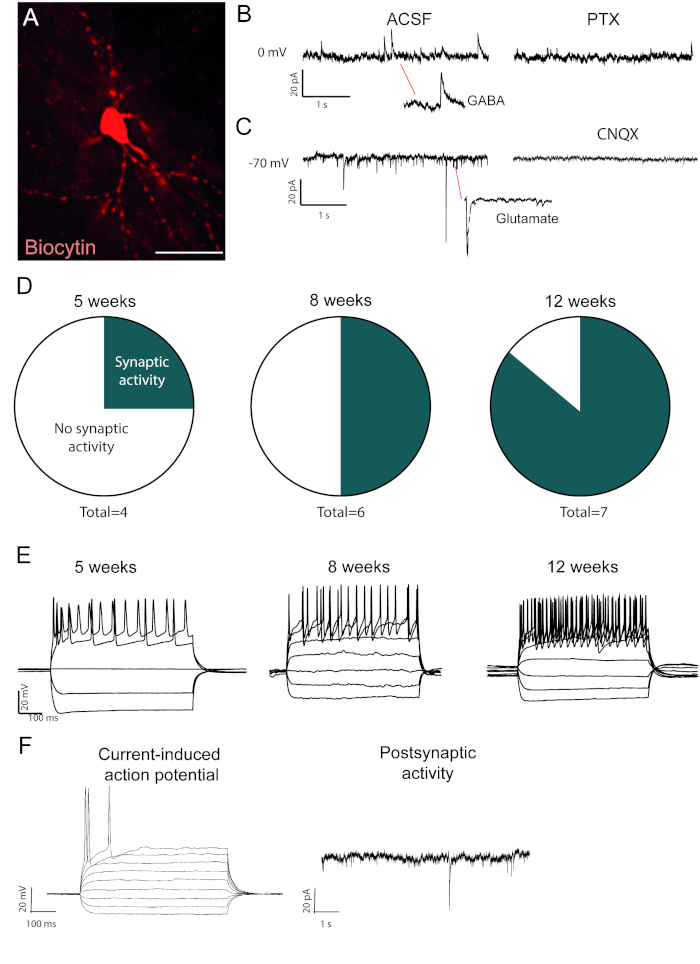
Figura 2: I neuroni riprogrammati in vivo sono funzionali e mostrano la maturazione nel tempo. (A) Neurone riprogrammato pieno di biocitina, mostra una morfologia neuronale matura, comprese le spine dendritiche. Tracce mostra (B) attività inibitoria (GABAergic) che è bloccato con picrotosina, un antagonista recettore GABAA e (C) attività eccitatoria che è bloccato con CNQX, un antagonista recettore AMPA. (D) Il numero di neuroni con attività post-sinaptica aumenta nel tempo. (E) I neuroni patchati mostrano una cottura ripetitiva già a 5 settimane dopo l'iniezione (w.p.i.) e continuano a mostrare che a 8 e 12 w.p.i. (F) Potenziale di azione indotta dall'attuale e attività post-sinaptica di un neurone immaturo, mostrando pochi eventi e pochi potenziali di azione rispetto alla barra di scala B e D. 25 mm Fare clic qui per visualizzare una versione più grande di questa figura.
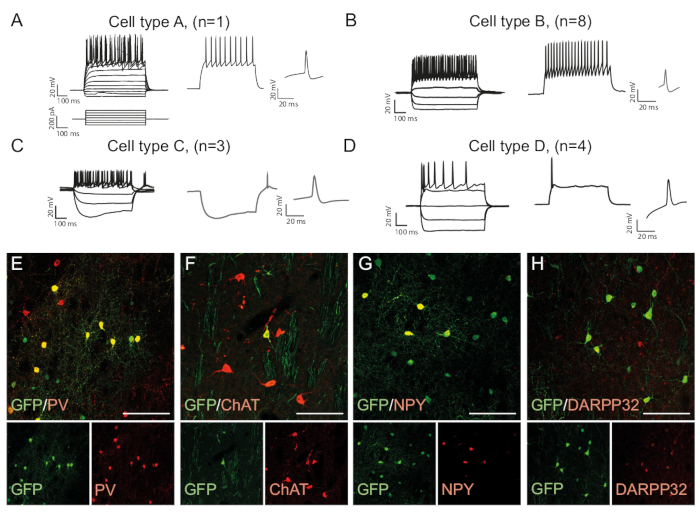
Figura 3: I neuroni riprogrammati in vivo mostrano le proprietà immunohistochimiche ed elettrofisiologiche degli interneuroni striatali. (A-D) I modelli di cottura dei neuroni riprogrammati in vivo possono essere di tipi distinti: (A) Il tipo A è simile al neurone spinoso medio endogeno (DARPP32); (B) simile agli interneuroni a chiodare veloce (PV) ; (C) simile ai neuroni chiodati a bassa soglia con cedimento prominente (NPY); (D) neuroni che sparano con grande post-iperpolarizzazione (Chat). (E-H) Immagini confocali che mostrano la co-localizzazione di GFP e dei marcatori interneuroni PV (E), ChAT (F), NPY (G) e marcatore neuronale di proiezione DARPP32 (H). Tutte le barre in scala - 50 mm. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
La riprogrammazione diretta in vivo può essere ottenuta utilizzando vettori AAV FLEX in ceppi di mouse che esprimono Cre. È importante notare che sono state osservate differenze tra i ceppi di topi per quanto riguarda l'efficacia della riprogrammazione. Per la riprogrammazione in vivo nello striato, la linea murino NG2-Cre si è dimostrata più efficiente rispetto ad altri ceppi. Prima di iniziare a utilizzare un nuovo ceppo animale, è importante controllare le linee guida del fornitore di topi per quanto riguarda l'espressione Cre nel tempo, poiché l'età degli animali spesso influisce sulla specificità di questa espressione proteica. Nei nostri studi, gli animali di età superiore a 12 settimane non sono stati utilizzati per la riprogrammazione in vivo in quanto vi era un rischio per l'espressione creina in cellule diverse da NG2 glia. Si consiglia la presenza costante e il monitoraggio degli animali di controllo iniettati solo con il costrutto Synapsin-FLEX-GFP. Ciò consente di monitorare gli animali per le cellule GFP-positive che non dovrebbero essere presenti se non vengono utilizzati geni di riprogrammazione (ALN).
Per identificare i neuroni appena riprogrammati, un metodo di identificazione specifico del neurone come quello descritto in questo protocollo è della massima importanza. Ciò consente una corretta identificazione e distinzione dei neuroni riprogrammati dalle cellule circostanti endogene che è di particolare rilevanza quando la riprogrammazione in una regione omotopica.
È anche importante indirizzare la struttura corretta per l'iniezione virale. Pertanto, la chirurgia stereotassica per l'iniezione virale è importante e deve essere affrontata con precisione, soprattutto quando si mirano strutture più piccole del cervello.
In precedenza abbiamo dimostrato11 che non è affidabile prevedere l'esito della riprogrammazione in vivo basata su esperimenti di riprogrammazione in vitro utilizzando gli stessi fattori di riprogrammazione. Tutti i fattori di interesse devono quindi essere testati in vivo. Nelle nostre mani, molte combinazioni di fattori diversi danno lo stesso sottotipo di neuroni (cioè interneuroni11 in vivo) nonostante il fatto che questi geni siano stati implicati nello sviluppo di altri neuroni.
Il morsetto a celle intere per i neuroni riprogrammati è una tecnica delicata e l'elaborazione dei tessuti è importante per un buon risultato. La perfusione con soluzione Krebs ghiacciata migliora la qualità dei tessuti. Inoltre, i neuroni patchati devono essere trattati con attenzione. Anche se la maturazione e l'identità fenotipica dei neuroni riprogrammati possono essere in qualche modo valutate utilizzando il morsetto di patch a tutta cellula, queste cellule non sono completamente comparabili alle loro controparti endogene. Ulteriori tipi di analisi, come il sequenziamento del genoma (ad esempio, il sequenziamento dell'RNA) dovrebbero essere utilizzati per confermare ulteriormente l'identità cellulare riprogrammata.
La tecnica qui descritta potrebbe essere considerata per lo sviluppo di future terapie in cui è necessaria la sostituzione neuronale nel cervello. Anche se la riprogrammazione in vivo è ancora nelle sue fasi iniziali e la traduzione negli esseri umani non è ancora prevista, questa tecnica potrebbe fornire un metodo per valutare la funzione genica esogena nel cervello e studiare la maturazione cellulare in vivo.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Marcella Birtele è stata finanziata dal Programma dell'Unione Europea Orizzonte 2020 (H2020-MSCA-ITN-2015) nell'ambito delle reti di formazione innovativa Marie Skaodowskae e dell'accordo di sovvenzione n. 676408. Daniella Rylander Ottosson è stata finanziata dal Consiglio svedese della ricerca (2017-01234).
Materiali
| Name | Company | Catalog Number | Comments |
| REAGENTS FOR AAV5 CLONING AND VIRAL VECTOR PREPARATION | |||
| pAAV-CA-FLEX | AddGene | 38042 | |
| Ascl1 | AddGene | 67291 | NM_008553.4 |
| Lmx1a | AddGene | 33013 | NM_0033652.5 |
| Nurr1 | AddGene | 35000 | NM_013613.2 |
| GFP-syn | AddGene | 30456 | |
| LoxP (FLEX) sequence 1 | GATCTccataacttcgtataaagtatcctatac gaagttatatcaaaataggaagaccaatgcttc accatcgacccgaattgccaagcatcaccatcg acccataacttcgtataatgtatgctatacgaa gttatactagtcccgggaaggcgaagacgcgga agaggctctaga | ||
| LoxP (FLEX) sequences 2 | tactagtataacttcgtataggatactttatac gaagttatcattgggattcttcctattttgatc caagcatcaccatcgaccctctagtccacatct caccatcgacccataacttcgtatagcatacat tatacgaagttatgtccctcgaagaggttcgaa ttcgtttaaacGGTACCCTCGAC | ||
| pDP5 | Plasmid Factory | PF435 | |
| pDP6 | Plasmid Factory | PF436 | |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 10010023 | |
| FBS (Fetal bovine serum) | Thermo Fisher Scientific | 10500064 | |
| Penicillin streptomycin | Thermo Fisher Scientific | 15140122 | |
| DMEM (Dulbecco's Modified Eagle Medium)+ Glutamax | Thermo Fisher Scientific | 61965026 | |
| DPBS (Dulbecco's Phosphate Buffer Saline) | Thermo Fisher Scientific | 14190094 | |
| HEK293 cells | Thermo Fisher Scientific | 85120602-1VL | |
| Flasks | BD Falcon | 10078780 | 175 cm2 |
| Tris H-CL | Sigma Aldrich | 10812846001 | For TE buffer use 10 mM, pH 8.0; for lysis buffer use 50mM, pH 8.5; for IE buffer use 20 mM, pH 8.0; for elution buffer use 20 mM, pH 8.0 |
| EDTA | EDTA: Invitrogen | EDTA: AM9260G | For TE buffer use 1 mM EDTA |
| Ultrapure water | see Ultrapure water system | ||
| CaCl2 | SigmaAldrich | C5080 | 2.5 M |
| Dulbecco´s phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190136 | |
| NaCl | Sigma-Aldrich | S3014 | FOR HBS use 140 mM; for Lysis Buffer use 150 mM; for IE buffer use 15 mM; for elution buffer use 250 mM |
| MgCl2 | Sigma-Aldrich | M8266-100G | For lysis Buffer: 1 mM |
| Ultracentrifuge sealing tubes | Beckman Coulter | Quick-Seal® Polypropylene Tube | |
| OptiPrep™ Density Gradient Medium | Sigma Aldrich | D1556-250ML | |
| 10-mL syringe-18G needle | BD | 305064 | |
| Laboratory glass bottles | VWR | ? | |
| Anion exchange filter | PALL laboratory | MSTG25Q6 | Acrodisc unit with Mustang Q membrane |
| Centrifugal filter unit | Merck | Z740210-24EA | Amicon Ultra-4 device |
| Endotoxin-Free Plasmid DNA Isolation Kits | Thermo Fisher Scientific | A33073 | |
| Na2PO4 | Sigma-Aldrich | S7907 | |
| HEPES | Sigma-Aldrich | H7523 | 15 mL |
| Falcon tube | Thermo Fisher Scientific | Corning 352196 | |
| Falcon tube | Thermo Fisher Scientific | Corning 352070 | |
| Glass Vials | Novatech | 30209-1232 | CGGCCTCAGFGAGCGA |
| Forward Primer for Inverted Terminal Repeat (ITR) sequence | GGAACCCCTAGTGATGGAGTT | ||
| Reverse Primer for Inverted Terminal Repeat (ITR) sequence | CACTCCCTCTCTGCGCGCTCG | ||
| 5´FAM / 3´BHQ1 probe | Jena Bioscience | ||
| 0.22 mm filter | Merck | SLGV004SL | Millex-GV filter |
| EQUIPMENT AAV5 VIRAL VECTOR PREPARATION | |||
| Freezer -20 °C | |||
| Freezer -80 °C | |||
| Fridge +4 °C | |||
| AAV viral room | |||
| Ultrapure Water system | Merck | Milli-Q® IQ 7000 | |
| Vortex mixer | VWR | 444-0004 | |
| Ultracentrifuge | Beckman Coulter | Beckman Optima LE-80K Ultracentrifuge | |
| Autoclave | Tuttnauer | 2540 EL | |
| Polymerase Chain Reaction (PCR) | BioRad | C1000 Touch Thermal Cycler | |
| Quantitative PCR (qPCR) | Roche | LightCycler® 480 System | |
| Centrifuge | Thermo Fisher Scientific | Sorvall ST16 | |
| Water Bath | Thermo Fisher Scientific | TSGP02 | |
| ANIMAL MODEL | |||
| NG2-Cre mice | Jackson | NG2-CrexB6129, Stock #008533 | |
| REAGENTS FOR INJECTION OF REPROGRAMMING FACTORS INTO THE BRAIN | |||
| Water | |||
| Saline | Apoteket AB | 70% | |
| Ethanol | Solveco | ||
| Isolfurane | Apoteket AB | Dilute to 1% solution with warm water. | |
| Virkon | Viroderm | 7511 | |
| Pentobarbital | Apoteket AB | P0500000 | i.p. for terminal procedure at the dose of 60 mg/ml. |
| Sucrose | Merck | S0389-500G | |
| Trypan Blu | Thermo Fisher Scientific | 15250061 | |
| Retrobeads | Lumafluor | R170 | |
| Buprenorphine | Apoteket AB | ||
| EQUIPMENT FOR INJECTION OF REPROGRAMMING FACTORS INTO THE BRAIN | From RSG Solingen. | ||
| Scissors | VWR | 233-1552 | From Biochem. |
| Tweezers | VWR | 232-0007 | |
| Forcep | VWR | 232-0120 | |
| Scalpel holder | VWR | RSGA106.621 | Number 20. |
| Scalpel | VWR | RSGA106.200 | |
| Stereotaxic frame | Stoelting Europe | 51500D | |
| Mouse ear bars | Stoelting Europe | 51648 | 5 ul |
| Syringe with Removable needle | Hamilton Company | 65 | 0,75 inner diameter and 1.5 outer diameter. |
| Glass capilaries | Stoelting | 50811 | |
| Glass capillary puller | Sutter company | P-1000 | |
| Dental drill | Agnthos AB | 1464 | |
| Shaver | Agnthos AB | GT420 | |
| Isoflurane Chamber and pump | Agnthos AB | 8323101 | 2 mL |
| Syringes | Merck | Z118400-30EA | 25G |
| Needles | Merck | Z192414 Aldrich | |
| Mouse and neonatal rat adaptor for stereotaxic fram | Stoelting | 51625 | |
| Heating pad | Braintree scientific, inc | 53800M | From Covidien 2187. |
| Cotton gauze | Fisher Scientific | 22-037-902 | |
| Rubber tube | Elfa Distrelec | HFT-A-9.5/4.8 PO-X BK 150 | |
| Cotton swabs | Fisher Scientific | 18-366-473 | |
| REAGENTS FOR WHOLE-CELL PATCH CLAMP RECORDINGS | |||
| NaCl | Sigma-Aldrich | S3014 | |
| KCl | Sigma-Aldrich | P9333 | |
| NaH2PO4-H2O | Sigma-Aldrich | S9638 | |
| MgCl2-6 H2O | Sigma-Aldrich | M2670 | |
| CaCl2-6 H2O | Sigma-Aldrich | C8106 | |
| MgSO4-7 H2O | Sigma-Aldrich | 230391 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| Glucose | Sigma-Aldrich | G7021 | see Ultrapure Water system |
| Ultrapure Water | Prepare 1 or 2M. | ||
| KOH | Sigma-Aldrich | P5958-500G | |
| K-D-gluconate | Sigma-Aldrich | G4500 Sigma | |
| KCl | Sigma-Aldrich | P9541 | |
| KOH-EGTA (Etilene glycol-bis-N-tetracetic acid) | Sigma-Aldrich | E3889 Sigma | |
| KOH- Hepes acid (N-2-hydroxyethylpiperazine-N’-2-ethanesulfonic acid) | Sigma-Aldrich | H7523 | |
| NaCl | Sigma-Aldrich | S3014 | |
| Mg2ATP | Sigma-Aldrich | A9187 | |
| Na3GTP | Sigma-Aldrich | G8877 | |
| Biocytin | Sigma-Aldrich | B4261 | |
| Picrotoxin | Merck | P1675 Sigma | |
| CNQX | Merck | C239 Sigma | |
| Ice | |||
| EQUIPMENT FOR WHOLE-CELL PATCH CLAMP RECORDINGS | |||
| Borosilicate glass pipette | Sutter Company | B150-86-10 | |
| Glass capillary puller | Sutter company | P-1000 | |
| Vibratome | Leica | Leica VT1000 S | |
| WaterBath | Thermo Fisher Scientific | TSGP02 | |
| Clampfit software | Molecular Devices | ||
| Multiclamp software | Molecular Devices | ||
| REAGENTS FOR IMMUNOHISTOCHEMISTRY | Use at a concentration of 4%. CAUTION: PFA is a potent fixative. Avoid ingestion and contact with skin. | ||
| Paraformaldehyde (PFA) | Merck Millipore | 1040051000 | Use at a concentration of 0.1%. |
| Triton X-100 | Fisher Scientific | 10254640 | Donkey.Use at a concentration of 1 : 400. |
| Serum | Merck Millipore | S30-100ML | Reconstitute the powder in Milli-Q water to 1 mg/mL. Aliquot and store at -20°C, light sensitive. Use at a concentration of 1 : 500. |
| 4′,6-Diamidino-2′-phenylindole dihydrochloride (DAPI) | Sigma Aldrich | D9542 | 1: 600 in KPBS-T. |
| streptavidin- Cy3 | Thermo Fisher Scientific | 434315 | 1:5000, rabbit. |
| Anti-GAD65/67 | Abcam | 1:2000, mouse. | |
| Anti-PV | Sigma | P3088 | 1:200, goat. |
| Anti-Chat | Merk | AB143 | 1:5000, rabbit. |
| Anti-NPY | Immunostar | 22940 | |
| K2HPO4 | Sigma-Aldrich | P3786 | |
| NaCl | Sigma-Aldrich | S3014 | |
| KH2PO4 | Sigma-Aldrich | NIST200B | 1:1000, chicken. |
| Anti-GFP | Abcam | ab13970 | |
| Mounting solution | Merck | 10981 | Polyvinyl alcohol mounting medium with DABCO®, antifading |
| OCT | Agar Scientific | ||
| Glycerol | Sigma-Aldrich | G9012-100ML | |
| Distilled water | |||
| Anti-freeze solution | Tissue Pro Technology | AFS05-1000N, 1000 mL/ea. | |
| EQUIPMENT FOR IMMUNOHISTOCHEMISTRY | |||
| Inverted fluorescence microscope | Leica | DMI6000 B | |
| Confocal microscope | Leica | TCS SP8 laser scanning confocal microscope. | |
| Prism | GraphPad | ||
| Microtome | Leica | SM2010R |
Riferimenti
- Barker, R. A., Parmar, M., Studer, L., Takahashi, J. Human Trials of Stem Cell-Derived Dopamine Neurons for Parkinson's Disease: Dawn of a New Era. Cell Stem Cell. 21 (5), 569-573 (2017).
- Southwell, D. G., et al. Interneurons from embryonic development to cell-based therapy. Science. 344 (6180), 1240622 (2014).
- Parmar, M., Torper, O., Drouin-Ouellet, J. Cell-based therapy for Parkinson's disease: A journey through decades toward the light side of the Force. European Journal of Neuroscience. , (2018).
- Torper, O., et al. In Vivo Reprogramming of Striatal NG2 Glia into Functional Neurons that Integrate into Local Host Circuitry. Cell Reports. 12 (3), 474-481 (2015).
- Su, Z., Niu, W., Liu, M. L., Zou, Y., Zhang, C. L. In vivo conversion of astrocytes to neurons in the injured adult spinal cord. Nature Communication. 5, 3338 (2014).
- Liu, Y., et al. Ascl1 Converts Dorsal Midbrain Astrocytes into Functional Neurons In Vivo. Journal of Neuroscience. 35 (25), 9336-9355 (2015).
- Guo, Z., et al. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer's disease model. Cell Stem Cell. 14 (2), 188-202 (2014).
- Grande, A., et al. Environmental impact on direct neuronal reprogramming in vivo in the adult brain. Nature Communication. 4, 2373 (2013).
- Niu, W., et al. In vivo reprogramming of astrocytes to neuroblasts in the adult brain. Nature Cell Biology. 15 (10), 1164-1175 (2013).
- Weinberg, M. S., Criswell, H. E., Powell, S. K., Bhatt, A. P., McCown, T. J. Viral Vector Reprogramming of Adult Resident Striatal Oligodendrocytes into Functional Neurons. Molecular Therapy. 25 (4), 928-934 (2017).
- Pereira, M., et al. Direct Reprogramming of Resident NG2 Glia into Neurons with Properties of Fast-Spiking Parvalbumin-Containing Interneurons. Stem Cell Reports. 9 (3), 742-751 (2017).
- Rivetti di Val Cervo, P., et al. Induction of functional dopamine neurons from human astrocytes in vitro and mouse astrocytes in a Parkinson's disease model. Nature Biotechnology. 35 (5), 444-452 (2017).
- Crosson, S. M., Dib, P., Smith, J. K., Zolotukhin, S. Helper-free Production of Laboratory Grade AAV and Purification by Iodixanol Density Gradient Centrifugation. Molecular Therapy Methods & Clinial Development. 10, 1-7 (2018).
- Torper, O., et al. Generation of induced neurons via direct conversion in vivo. Proceedings of the National Academy of Sciences of the United States of America. 110 (17), 7038-7043 (2013).
- Kawaguchi, Y., Kubota, Y. Correlation of physiological subgroupings of nonpyramidal cells with parvalbumin- and calbindinD28k-immunoreactive neurons in layer V of rat frontal cortex. Journal of Neurophysiology. 70 (1), 387-396 (1993).
- Grealish, S., et al. The A9 dopamine neuron component in grafts of ventral mesencephalon is an important determinant for recovery of motor function in a rat model of Parkinson's disease. Brain. 133 (Pt 2), 482-495 (2010).
- Thompson, L., Barraud, P., Andersson, E., Kirik, D., Bjorklund, A. Identification of dopaminergic neurons of nigral and ventral tegmental area subtypes in grafts of fetal ventral mesencephalon based on cell morphology, protein expression, and efferent projections. Journal of Neuroscience. 25 (27), 6467-6477 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon