Method Article
在Vivo直接重新编程居民胶质细胞到内神经通过病毒载体的脑内注射
摘要
该协议旨在利用大脑中基于AAV的病毒系统和FLEX突触素驱动的GFP报告器,在体内直接重新编程的内神经,从而在体内进行细胞识别和进一步分析。
摘要
将大脑中的常驻胶质体转化为体内功能性和亚型特异性神经元,为开发替代细胞替代疗法提供了一步,同时也创造了研究原位细胞命运的工具。迄今为止,通过体内重新编程获得神经元是可能的,但是这些神经元的精确表型或它们是如何成熟的,还没有得到详细的分析。在此协议中,我们使用基于 AAV 的病毒载体系统描述了对体内重新编程神经元的更有效的转换和细胞特异性识别。我们还为重新编程的细胞神经元成熟功能评估提供了一个协议。通过注射翻转切除(FLEX)载体,将重新编程和突生驱动报告基因注入大脑中作为细胞重新编程目标的特定细胞类型。这种技术允许轻松识别新重新编程的神经元。结果表明,获得重新编程的神经元功能随时间而成熟,接受突触接触,并显示出不同类型内神经元的电生理特性。使用转录因子Ascl1、Lmx1a和Nurr1,大多数重新编程的细胞具有快速窥探、含帕弗巴平的内神经元特性。
引言
该方法的总体目标是有效地将体内的大脑驻留胶质转化为功能性和亚型特异性神经元,如帕夫巴平表达内神经元。这为开发脑病替代疗法提供了一步,无需外源细胞源。它还创造了一个工具,研究细胞命运开关就地。
大脑产生新神经元的能力有限。因此,在神经系统疾病中,需要外源细胞源来修复大脑。为此,多年来,不同的细胞来源都进行了紧张的研究,包括来自原发组织的细胞、干细胞衍生细胞和重新编程的细胞1、2、3。将常驻脑细胞直接重新编程到神经元是最近的一种方法,它可以提供一个有吸引力的方法来修复大脑,因为它使用病人自己的细胞在大脑内产生新的神经元。迄今为止,已有几份报告显示,在体内通过病毒载体在大脑4、5、6、7 8、9的不同大脑区域进行病毒载体的重新编程,如皮层、脊髓、纹状体和中脑5、10、11,以及完整和病变的大脑5、8、11、12。抑制神经元和兴奋神经元都获得了4,8,但这些细胞的精确表型或功能尚未得到详细分析。
在此协议中,我们描述了对体内重新编程神经元的更有效的重新编程和细胞特异性识别。我们提供基于功能和免疫组织化学特征的神经元成熟和表型表型表征功能评估方案。
我们使用可诱导的AAV矢量和GFP报告器来识别体内重新编程的神经元。这种病毒载体的选择具有感染大脑分裂细胞和非分裂细胞的优点,增加靶向细胞的数量,作为使用逆转录病毒7,8的替代。神经元特异性突触蛋白驱动的FLEX报告器(GFP),使我们能够专门检测新生成的神经元。以前的研究已经使用亚型特异性启动子进行体内重新编程7,9,也允许在特定的细胞类型中表达重新编程的基因和报告器。然而,该方法需要进一步识别重新编程的神经元,通过死后分析报告和神经元标记的共同表达。使用神经元特定的报告器(如本文所述)允许直接识别。这提供了成功转换的直接证明,并允许修补夹电生理学所需的活细胞识别。
研究方案
所有实验程序均根据欧盟指令(2010/63/EU)进行,并经隆德大学和瑞典农业部(Jordbruksverket)实验室动物使用伦理委员会批准。老鼠被安置在12小时的光/暗循环中,并可自由获得食物和水。
1. 病毒载体
- AAV载体的克隆
- 要创建可诱导的 AAV5 矢量,请将 GFP、Ascl1、Lmx1a 和 NR4A2 (Nurr1) 的 cDNA 插入一个反向方向,两对异位、反平行的 LoxP 翻转切除 (FLEX) 序列(材料表)。对于 cDNA 插入,使用像 pAAV-Cba-FLEX 这样的骨干网或结构相似的骨干,包含 FLEX 序列和鸡βActin (CBA) 启动子。
- 通过聚合酶链反应 (PCR) 和限制性酶将每个单 cDNA(例如 Ascl1)插入骨干中。快车GFP在突触剂促进者和Ascl1的控制下,Lmx1a,Nurr1在一个无处不在的CBA促进者的控制下。
注:确保使用特定的无内毒素质质DNA分离试剂盒获得无内毒素的DNA。 - 在使用前对构造执行排序和限制分析,以检查克隆步骤的成功。
- AAV5病毒载体生产
警告:在处理腺相关病毒 (AAV) 时,请参阅当地生物安全指南。在瑞典,该协议中使用的 AAV 要求生物安全级别 2 (BSL-2)。- 种子HEK293T细胞与标准培养基 (DMEM+Glutamax = 10% FBS + 青霉素 (100 U/ml) 链霉素 (100 μg/mL, 参见材料表) 在T175瓶密度 3 x 106细胞每个烧瓶.占每批AAV5个烧瓶,计划一次6批。
- 当细胞达到50-70%的汇合时,准备以下混合物进行转染(每175厘米2瓶)。
- 在50 mL离心管中,加入量质粒和pDG系列帮助质粒(pDP5,pDP6)的等值量,每175厘米2瓶总量为72微克。
- 将 Tris-EDTA 缓冲液(TE 缓冲液,10 mM Tris-HCl,1 mM EDTA)添加到 144 mL 的最终体积中。
- 加入超纯水,使总体积变为1296 mL并混合。
- 加入 144 μL 的 2.5 M CaCl2并混合。在 DNA 溶液中加入 1.92 μL 的 HEPES 缓冲盐水 (HBS) (1.5 mM Na2HPO4 ,140 mM NaCl, 50 mM HEPES),并立即通过涡旋混合。
- 在室温(RT)下孵育正好60s.将溶液转移到28 mL新鲜细胞培养基和混合物。
- 用含有转染混合物的细胞培养基替换瓶中的介质。
- 转染三天后,将烧瓶中的培养基倒入一次性容器中,加入5 mL的收获缓冲液(EDTA添加到磷酸盐缓冲盐中,参见材料表,DPBS 至最终浓度),以收获细胞每个烧瓶中浓度为 5 mM 至 5 mM),以允许细胞分离。
- 将细胞溶液倒入 50 mL 离心管中。在每个烧瓶中再添加 4 mL 的 DPBS,用第一个细胞溶液冲洗剩余的细胞和池。在4°C下,在1,000 x g下将收获的细胞离心5分钟。
- 离心后,通过涡旋去除上清液并将颗粒溶解在15 mL的溶化缓冲液中(50 mM Tris-HCl pH 8.5,150 mM NaCl,1 mM MgCl2)。
- 将其冷冻在CO2-冰/乙醇浴中15分钟,并储存在-20°C冰柜中。使用前在37°C水浴中解冻收获的细胞液化。
- AAV5病毒载体纯化
- 通过 Iodixanol 梯度超离心13执行 AAV 纯化,并在 RT 使用离心管,在 350,000 x g下离心 1 小时 45 分钟。
- 使用带 18G 针头的 10 mL 注射器,将 40/60% 相位边界以下约 2 mm 插入斜面朝上,以提取含 AAV 的相位。提取了 5-6 mL 后,在达到蛋白质带之前,务必停止。
- 将梯度提取物储存在4°C的高压玻璃瓶中。避免存储时间比过夜长。
- 在涡旋时,在 12 mL 的 Iodixanol 洗脱 (IE) 缓冲液 (20 mM Tris-HCl pH 8.0, 15 mM NaCl) 中缓慢移液,将 Iodixanol 梯度提取物稀释 3 倍。
- 通过一个网换过滤器净化和浓缩稀释的 Iodixanol 梯度。以不超过1滴/s的速度缓慢地通过它。将3 mL的IE缓冲液缓慢地通过过滤器清洗。
- 电离式过滤单元,具有 1-2 mL 洗脱缓冲液(20 mM Tris-HCl pH 8.0;250 mM NaCl)。将 DPBS 添加到设备的最终音量为 4 mL。在 RT 处以 2,000 x g的离心,直到过滤器中剩余不到 0.5 mL。从管底部取出液体,用 4 mL 的 DPBS 重新加注,然后再次离心。重复此步骤两次。确保过滤器上的浓缩矢量体积在最后一个离心步骤后约为 200 μL。
- 使用移液器取出 200 μL 浓缩矢量,并将浓缩物推入 0.22 mm 过滤器进行消毒。与锁紧插入件(材料表)的 9 mm 玻璃瓶的 Aliquote 200 μLinto。
注:AAV5 矢量库存可储存在 -80°C 冷冻室中,用于长时间存放,如果使用 2 周内,则可储存在 4°C。
- AAV5病毒载体定位剂
- 使用标准定量聚合酶链反应 (qPCR) 确定 AAV5 牙底漆,带用于倒置端子重复(ITR) 序列的引物和用于 ITR 序列的 5 [FAM / 3 ] BHQ1 探针(材料表)。使用已知含有质粒的 ITR 量实现的标准曲线。如果 ITR 序列用于定位,则每个 AAV 载体的范围应为 1E±14 ± 1E=15基因组拷贝。
注:成功的 AAV5 病毒生产使具有端头的库存在最小范围为 3E±13 + 7E=13单位/mL。
- 使用标准定量聚合酶链反应 (qPCR) 确定 AAV5 牙底漆,带用于倒置端子重复(ITR) 序列的引物和用于 ITR 序列的 5 [FAM / 3 ] BHQ1 探针(材料表)。使用已知含有质粒的 ITR 量实现的标准曲线。如果 ITR 序列用于定位,则每个 AAV 载体的范围应为 1E±14 ± 1E=15基因组拷贝。
2. 将重新编程因子注入大脑
- 动物设置、立体放置和钻孔
注意:该协议侧重于使用 Ascl1、Lmx1a 和 Nurr1 (ALN) 将 NG2 胶质重新编程为内神经元。根据我们的经验,使用其他因子组合可以获得类似表型的内神经元11.- 手术前,准备含有载体Cba-FLEX-Ascl1、Cba-FLEX-Lmx1a、Cba-FLEX-Nurr1和报告载体Syn-FLEX-GFP的病毒混合物。将第 1 节中准备的每只股票添加到最终组合中,以便最终病毒解决方案具有每个重新编程因子(Ascl1、Lmx1a 和 Nurr1)的 5% 和报告器构造的 10%(5% A、5% L、5% N 和 10% GFP)。
注:AAV5 矢量混合物可储存在 4°C 下,并保存以供将来在体内使用。 - 在空气和一氧化二氮(N2 O)的混合中,以4:1的比例使用2%的异常胶对小鼠进行麻醉。通过观察隔膜的运动来监测动物的呼吸。在手术过程中,使用1~1.5%的外卢兰维持麻醉。
注:本文所述的小鼠模型由一种小鼠菌株组成,该菌株在 NG2 胶质中专门表示 Cre。在体内重新编程可以通过不同的小鼠菌株,表达Cre在其他胶质细胞种群(例如,星形细胞14)。 - 一旦动物被完全麻醉(例如,完全肌肉放松和对脚垫上的捏合没有反应),切开切口部位周围的区域,将动物带到立体框架。
- 为了在手术过程中保持动物的体温,在立体框架的底座上安装一个加热垫。将鼠标放在干净干燥的纸巾上。
- 小心地将鼠标头放入耳条中。如果放置正确,则不应观察到头部的横向移动。在开始将鼠标置于立体框架之前,将左耳杆设置为 4 mm。
- 将牙条固定到位,然后拧紧鼻梁。确保头部不以任何尺寸移动,并指向直前方(中线垂直于耳杆平面)。应用眼膏保护眼睛。
- 手术开始前,施用适当的麻醉(例如,0.05毫克/千克的布丙诺啡,下皮)。
- 用棉纱布或湿巾用 70% EtOH 浸泡清洁切口区域,不要接近眼部区域。
注:对于脑内病毒注射,使用5或10 mL注射器与拉玻璃毛细管适应。使用微移液拉拔器拉扯玻璃毛细血管,产生具有非常精细尖端的毛细管,从而将手术的侵入性降至最低。要将毛细管调整到注射器中,请使用一块橡胶管在注射器的针头和玻璃毛细管之间的连接上,并使用热源(例如打火机)将其熔化。两个部件之间的紧密连接将确保喷射过程中没有液体泄漏。在开始手术之前,通过在注射器中加满盐水并将液体从注射器中挤出来测试。 - 沿头部中线进行约 0.5-0.8 厘米的切口。用手术刀穿过皮肤层和下皮层。
- 扩大切口两侧的皮瓣。清洁任何血液的切口,用棉芽刮回皮下层。
- 将立体框架的 M/L-D/V 臂移到原位(动物上方)并将其固定。
注:立体框架允许沿前/后轴(A/P、Y 轴)、中线/边(M/L、X 轴)和地道/通风(D/V、Z 轴)轴调整注射器。 - 沿着立体框架的不同轴移动注射器,将玻璃毛细管的尖端放在 bregma 的正上方(不同头骨板的交汇点)。
- 确保毛细管尖端在 A/P 和 M/L 平面上完全直。在模棱两可的情况下,采取侧线和中线缝合的平均值。
- 当毛细管的尖端正确放置在布雷格马上方时,在数字坐标计数器上将 M/L 和 A/P 值重置为 0.0。
- 为了确保动物的头部处于完全平坦的位置,当 A/P 臂在 +2.0 和 -2.0 (M/L = 0.0) 时,以及当 M/L 臂位于 +2.0 和 -2.0 (A/P = 0.0) 时,使用数字坐标计数器测量 D/V 坐标值。相应地调整牙条和耳杆的高度。
- 将注射器移到所需的坐标处,以注射纹状体中的病毒载体(A/P = ±1.0;M/L = -2.0,相对于布雷格马)。
- 稍微抬起注射器,通过显微镜观察注射部位,在注射坐标处使用牙科钻头钻一个洞。开始在现场钻孔,以圆形和柔和的方式工作。
注:不要施加太多的向下压力,因为钻头应该足够锋利,无需额外的力即可穿过骨骼。避免长时间、持续的钻孔,因为这会产生热量。 - 在钻孔结束时,检查杜拉母体完好无损并暴露注射。
- 手术前,准备含有载体Cba-FLEX-Ascl1、Cba-FLEX-Lmx1a、Cba-FLEX-Nurr1和报告载体Syn-FLEX-GFP的病毒混合物。将第 1 节中准备的每只股票添加到最终组合中,以便最终病毒解决方案具有每个重新编程因子(Ascl1、Lmx1a 和 Nurr1)的 5% 和报告器构造的 10%(5% A、5% L、5% N 和 10% GFP)。
- 注射器设置准备
- 将一块棉纱布放在开切口上,用盐水溶液冲洗注射器。
- 冲洗后,取1⁄2μL的气泡,然后1μL的溶液中含有病毒载体,避免任何无意的气泡。确保病毒溶液在注射时易于在气泡下可视化。
- 病毒注射
- 从切口部位上取下棉纱布,并使用立体框架的 D/V 臂降低注射器。当接近头骨表面时,仔细观察显微镜并测量杜拉母体的 D/V 水平 - 在柔和的压力下,它应稍微凸起。
- 用毛细管尖端触摸 Dura 母体时,将 D/V 坐标设置为 0.0。
- 降低注射器,缓慢地前进到所需的深度(D/V = -2.7,相对于杜拉母体)。确保轨迹没有骨头碎片,以便不观察到针/毛细管的弯曲。
注:所呈现的坐标是指将重新编程因子注入NG2-Cre小鼠的纹状体。可使用与其他大脑区域对应的坐标。在将重新编程因子注入新小鼠菌株的大脑之前,务必首先使用染料(例如 Trypan Blue)、彩色珠注射或报告病毒载体测试注射的坐标。如果注射Trypan Blue,动物需要在手术后立即被牺牲,大脑被解剖掉。新鲜的大脑可以使用微缩,而冷冻,和注射的部位确定通过可视化的染料位置在大脑中。如果使用彩色珠子测试坐标,则有可能在注射一周后确定注射液和切脑的注射部位。或者,可以使用带有报告基因的病毒载体注射,并在注入的切脑中确定注射部位。 - 以0.4 μL/min的速率注射1μL的病毒溶液。当注射整个体积时,在注射器退出前等待2分钟的扩散期。
- 扩散后,慢慢缩回注射器,直到毛细管的尖端完全离开大脑。
- 在伤口上放置一块棉纱布,用盐水溶液冲洗注射器。
- 将立体框架的 M/L-D/V 臂移出工作区。
- 伤口关闭和术后程序
- 使用缝合线小心缝合切口。
注:注射动物中使用的所有缝合线应放在含有抗病毒洗涤剂溶液的杯/瓶中。相同的解决方案用于清洁手术区域周围与手术材料接触的所有表面。所有手术工具在每个手术日结束时都经过彻底清洗和高压灭菌。 - 将动物从立体框架中取出,并将其放置在手术后站,其中包括一个干净的加热笼子、食物和水,以及动物停留到完全清醒的地方。在此期间,密切监测动物,直到恢复意识。
- 在非手术动物完全康复之前,不要将操作的动物与非手术动物一起饲养。
- 每天监督操作的动物。根据所使用的缝合线,如有必要,请确保将其移除。所有动物都给予布皮诺菲南(1ml/kg的特吉西奇)皮下作为术后护理。
注:如果连续两天使用同一注射器操作,请用水冲洗,然后用乙醇70%再次注水。夜间将装满水的注射器留在水中,以便溶解任何可能的残留物。
- 使用缝合线小心缝合切口。
3. 电生理记录
- 电生理学的组织切片制备
警告:为了达到良好的电生理记录,必须进行良好的组织制备。仔细准备房间,并将灌注和解剖工具放在冰上。- 准备冰冷和氧化 (95% O2和 5% CO2) 克雷布斯溶液用于灌注、解剖和切割(在同一天从 10x 库存中通过稀释超纯水中的库存溶液并添加 NaHCO3和葡萄糖)制备此溶液)。以 mM 表示的 Krebs 溶液中的组件(稀释到 1 倍后)为:126 NaCl、2.5 KCl、1.2 NaH2PO4|H2O, 1.3 MgCl2+6H2O, 和 2.4 CaCl2+6H2O, 22 NaHCO3, 10 葡萄糖.将溶液的pH量调整到7.4。
- 使用新的剃刀刀片对振动波执行校准(Vibracheck)。
- 启动振动体冷却块(或用冰块填充周围腔室),在使用前至少 30 分钟用 95 % O2和 5 % CO2为切割室加注用于氧合。
- 将培养皿放在冰上,用含氧克雷布斯溶液填充。将刀片、剪刀和安装板放在冰上。
警告:在开始适应程序之前,将装有鼠标的笼子带到房间至少 1 小时。压力对脑组织部分的状况有负面影响。 - 通过注射过量的五巴比妥,让动物入睡,对小鼠进行最终麻醉。 当眨眼反射出来,动物对疼痛刺激没有反应时,在动物中用冰冷的克雷布斯溶液进行2-3分钟的透心(速率为10-20 mL/min)。
- 迅速,但仔细,解剖出大脑,并把它放在放在冰上的培养皿(包含克雷布斯溶液)。
注:为了比较重新编程的神经元的功能成熟,牺牲动物在病毒注射后的不同时间点进行记录。根据现有的文献15评估不同神经元亚型的发射特性。 - 沿中小脑做一个日冕切口,并将这一侧粘附在安装板上(也是冰冷的),用于振动切割。
- 小心地将粘附的大脑浸入振动器中的缓冲室。
警告:为了自身安全,小心不要触摸剃须刀刀片,以免刀片保持校准状态。 - 从大脑最玫瑰状部分以高速切割到纹状水平。然后以275 mm的速度以低速(0.10毫米/s)对纹状体进行切割。
- 每次切割后,小心地取出非注射的纹状侧(例如,用弯曲的针头),并将注射的一侧转移到水浴中的另一个小瓶中,其中包含放置在水浴中的底网(RT处的氧气化 Krebs)。在 RT 中保留此部分,直到剪切所有部分。
- 慢慢将水浴的温度升高到37°C,并保留30分钟。然后关闭加热器,让冷却,直到 RT。
注: 此时,您可以暂停,直到开始录制。各节持续 4-6 小时。
- 全细胞贴片夹记录
- 将第一个组织部分转移到淹没在克雷布斯溶液连续流中的记录室。使用轻量安装截面并浸入目标。
- 识别显微镜中的纹状区域并搜索 GFP 阳性(重新编程)神经元。选择形态广泛且未被纤维束或血管覆盖的神经元。
- 准备硼硅酸盐玻璃移液器(3~7 MΩ),用于修补和填充以下细胞内溶液(以mM表示):122.5葡萄糖酸钾、12.5 KCl、0.2 EGTA、10 HEPES、2MgATP、0.3 Na3GTP和8 NaCl,经KOH调节至pH 7.3。
- 对于生物细胞素填充,将1毫克生物细胞素盐加入1mL的内部溶液和涡旋。
警告:确保用生物锡过滤内部溶液,否则可能会堵塞电极。 - 将玻璃移液器连接到记录电极并浸入溶液中。仔细检查电极的电阻。然后用移液器缓慢接近电池,在电极中保持轻微的正压,以避免堵塞尖端。
警告:在降低电极时,小心跟踪电池,不要漂白电池中的荧光(即,在不需要时关闭荧光灯)。 - 使用电极的正压仔细冲洗周围组织,并用电极接近细胞。将电极直接定位在电池顶部,然后下降,直到电极接触膜。在电极和细胞膜之间形成Giga-+密封,用负压脉冲,破裂膜,形成全细胞贴片。
警告:重新编程的神经元是敏感的。修补时要小心,在达到 Giga-Ω 密封或打开细胞膜时不要施加太大的负压。此外,修补到年龄较大的动物需要练习和耐心,因为它们的结缔组织较厚,并且更难可视化神经元。 - 在电流夹击模式下,立即检查静止膜电位,并写下来进行分析。
- 在电流钳位中,保持-60 mV至-80 mV之间的电池,并注入500 ms电流,电流从-20 pA到+90 pA,以10 pA的增量诱导作用电位。
- 在 10 mV 的去极化步速下,转移到电压夹中并测量向内钠和延迟校正钾电流。
注:电压夹记录使用不同的内部解决方案更好地评估,由更高效夹紧膜的化学品组成。然而,对于重新编程的神经元,你可以记录的细胞数量很少,并且这些神经元的组织部分数量是有限的。因此,在同一单元的电流夹和电压夹中记录是一个优点。 - 在电压夹紧模式下,在-70 mV处记录自发的贴午活动。区分膜电位为 0 mV 的抑制性脱毛事件与 -70 mV 的兴奋事件。
- 达到稳定的基线后,将Picrotoin,GABAA受体拮抗剂,加入流入记录室的克雷布斯溶液中,以提取兴奋性事件(将皮洛毒素的库存溶液添加到50 mM的单独最终浓度中连接到腔室灌注的缓冲注射器。将缓冲液从造型室流出到真空袋,以便安全处置)。
- 20分钟后,将一种AMPA拮抗剂CNQX(20 mM)添加到流入记录室的Krebs溶液中,以阻止抑制事件(使用与Picrotoxin相同的程序)。再留20分钟,然后用克雷布斯溶液洗净。从腔室中取出组织部分。
- 完成录音后,使用分析程序中的阈值事件检测(>5 pA)对自发兴奋性突触后电流 (EPSC) 和抑制性突触后电流 (IPSC) 进行离线分析。
- 在整个记录过程中,细胞将缓慢地填充含生物细胞素的内部溶液。在缓慢取出电极之前,将贴片保持至少 20 分钟,以便完全填充电池。
警告:小心不要有任何正压在电极中,可能破坏细胞的连续形态分析后。 - 对于生物小辛可视化,将组织部分置于4%的甲醛(PFA)中过夜,温度为4°C。用0.1%的Triton冲洗0.02 M磷酸钾缓冲液(KPBS) 中。然后,染色链球菌-Cy3(KPBS-T中的1:600,2小时),用于识别生物细胞填充细胞和重新编程神经元的形态可视化。
注:生物青锡填充可用于形态分析和修补神经元的插图。
4. 免疫性化学、立体学和定量
注:将一组特定的小鼠用于免疫组织化学,因为用于电生理学的组织部分不是免疫组织化学的最佳部分。
- 用i.p.注射过量的五巴比妥麻醉小鼠,并安装动物进行灌注。
- 以心分法给小鼠注入,首先用盐水溶液去除血液,然后用冰冷的4%PFA。
- 在 4% PFA 中切除大脑和修复后至少 12 小时。
- 将大脑放入25%蔗糖溶液(用于冷冻保护)约12小时。
注:当大脑沉入25%的蔗糖溶液中时,大脑随时可以被切开,这表明蔗糖已经渗透到整个小鼠大脑中。 - 使日冕穿过小脑,使用大脑的平坦,最牛的一部分,将大脑放在一个微体上,并使用最佳切割温度化合物(OCT)固定到位。
- 将大脑切成厚度为35毫米的日冕切片,并将大脑分成连续系列,放入含有0.02 M KPBS的瓶或孔中。
- 根据标准协议16、17,使用针对GFP和内神经元标记物的抗体处理免疫组织化学部分,如GAD65/67、PV、Chat(胆碱乙酰转移酶)和NPY(神经肽Y)。
注:脑切片可在4°C或-20°C中长期保存在防冻溶液中。 - 染色完成后,将部分安装在玻璃玻片上,并用玻璃盖玻片盖住,使用安装解决方案将其固定到位。离开盖上滑动,在夜晚晾干。
注:在我们的研究中,整个大脑被切成1:8系列(即,每个包含部分的瓶将容纳老鼠大脑的八分之一11)。 - 使用倒荧光和/或共聚焦显微镜分析各部分。
警告:荧光显微镜可用于一般概述结果和捕获图像以计算重新编程效率。为了通过观察双阳性细胞来更详细地分析型型特征,应使用共聚焦成像。 - 对于在纹状体中表达的不同标记的量化,计算与GFP+细胞总数相关的双阳性细胞数量,每个区域至少有两个场纹状部分。
- 要确定每个大脑的重新编程神经元的近似外推总数,计算 GFP+早期切掉的一个大脑序列的纹状体中的神经元,然后乘以序列的总数。
注:不同的量化方法可用于表达重新编程效率、每个动物重新编程的神经元数以及表示某些型型标记的神经元的百分比。有关详细信息,请参阅以前的出版物11。 - 使用图形板棱镜或类似分析条件之间的差异。
注:为了进行效率计算,我们给NG2-Cre小鼠注射了CRE依赖性ALN转换载体和GFP报告器。为了估计转化效率,我们还在无处不在的cba启动子下给动物注射了一种依赖Cre的GFP,使所有靶向细胞都产生GFP=。通过这种比较,我们估计66.81%~38.38%的目标细胞转化为神经元。为了验证每个基因的表达,可以对GFP/Ascl1、GFP/Lmx1a和GFP/Nurr1进行互补双免疫荧光染色。此外,基因组测序,如单细胞RNA测序可以揭示每个基因在重新编程的细胞中的存在。
结果
AAV载体的注入用于成功地将常驻NG2胶质细胞重新编程到NG2-Cre小鼠纹状体中的神经元中(图1A)。为了专门针对NG2胶质,FLEX载体与重新编程/报告基因,插入在反义的方向,并两侧由两对反平行,异质性loxP位点(图1B)。三个重编程基因(Ascl1、Lmx1a和Nurr1)中的每一个都置于单个载体上无处不在的cba启动子的控制之下。为了确保GFP表达仅限于来自Cre-表达细胞的重新编程的神经元,GFP被置于神经元特异性突触素启动子(也在FLEX向量中)的控制之下。
使用重新编程和报告器构造的组合允许在小鼠纹状体中生成 GFP 阳性神经元(图 1C,C')。在没有重新编程基因的情况下使用报告器构造不会产生GFP阳性神经元(图1D)。
重新编程的神经元,是生物细胞内填充是可见的死后免疫染色(图2A)。如果转换成功,应该有广泛的神经元形态。重新编程神经元的电生理记录显示存在与自发活动测量的午睡功能连接(图2B,C)。这可以通过异位性GABAergic或谷氨酸阻滞剂(皮罗毒素或CNQX)来阻止,建议对重新编程的神经元进行兴奋和抑制性突触输入。自发活动的发生随着病毒注射后的时间而增加(图2D),表明逐渐成熟。
电流诱导作用电位存在于功能神经元中。转换后,操作电位会随时间而增加 (图 2E)。这进一步表明神经元功能的成熟。在未成熟的神经元中,电流将诱发无或非常少的动作电位(图2F)。
神经元的发射模式是细胞类型特定的,因为它取决于诸如细胞的形态和通道表达15等因素。体内重新编程的神经元中记录的模式可以区分为各组,与内源性神经元亚型(例如快速尖峰内神经元(细胞类型B,图3B)或其他细胞类型(图3A,C,D)进行比较).观察到的电生理差异可以通过存在特定的子类型标记和与GFP共表达(图3E-H)来证实。总体而言,该数据表明,纹状体中存在的重新编程的神经元具有不同类型的内神经元的特性,如帕夫巴宾、ChAt-和NPY-表达的内神经元,以及纹状中尖质神经元标识(DARPP32+) (图 3E-H)
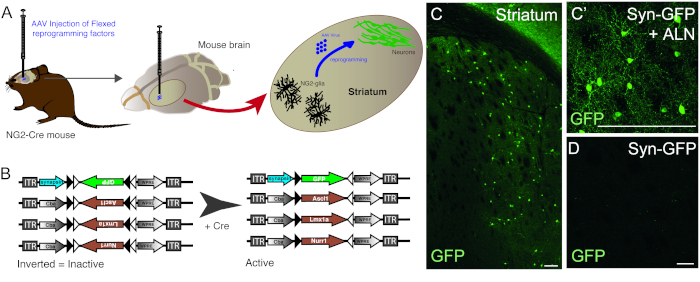
图1:在体内重新编程驻地NG2胶质到神经元。(A) AAV病毒介导在体内重新编程的纹状NG2胶质的架构表示。(B) 用于体内重新编程的AAV5 FLEX结构的原理表示,其中基因表达由靶中细胞中的Cre表达调节。(C和C') 体内重新编程的神经元,由 Syn-GFP + ALN 注射到 Striatum 中产生。(D) 没有重新编程的神经元,当没有重新编程的因素添加到病毒鸡尾酒,只有报告器构造注射在体内。刻度杆 = 100 毫米 (C),25 毫米(C'),25 毫米(D)。请点击此处查看此图的较大版本。
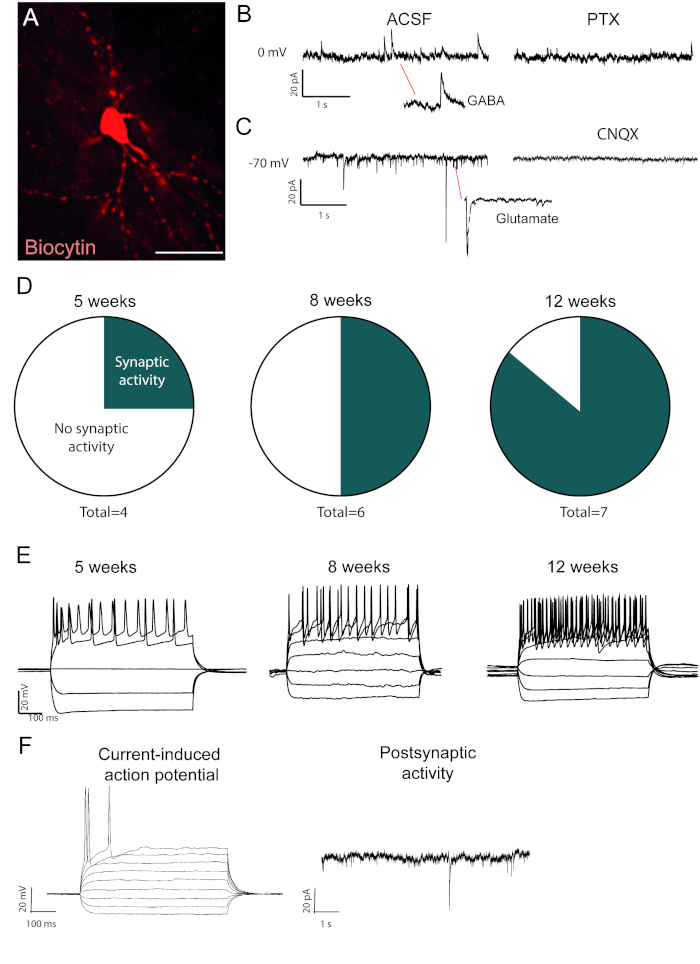
图2:体内重新编程的神经元功能正常,并随着时间的推移显示成熟。(A) 生物素填充的重新编程神经元,显示成熟的神经元形态,包括树突状脊柱。痕迹显示 (B) 抑制 (GABAergic) 活性被阻断与皮洛毒素, GABAA受体拮抗剂和 (C) 兴奋活性被阻塞与 CNQX, AMPA 受体拮抗剂.(D) 具有午睡活动的神经元数量随着时间的推移而增加。(E) 修补神经元在注射后5周(w.p.i.)显示重复激发,并继续显示在8和12 w.p.i. (F) 未成熟神经元的电流诱导作用电位和发后活动,显示很少的突触事件和几个行动潜力相比 B 和 D. 比例尺 = 25 毫米请点击这里查看此图的较大版本。
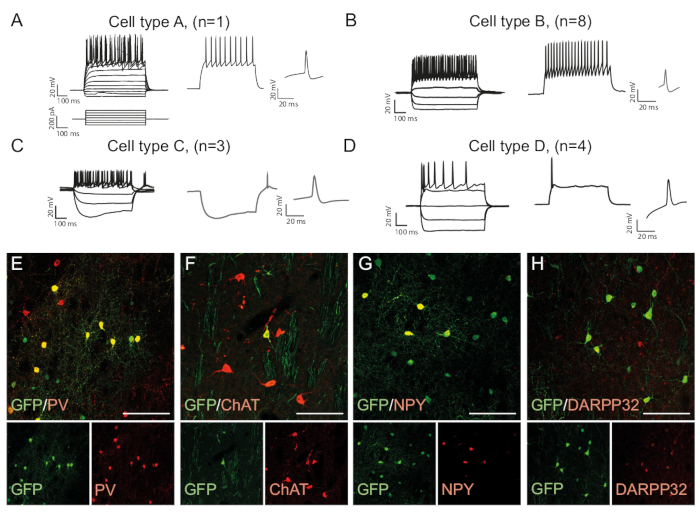
图3:体内重新编程的神经元显示纹状内神经的免疫性、化学和电生理特性。(A-D)体内重新编程神经元的发射模式可以是不同类型的:(A)A型类似于内源性中性脊柱神经元(DARPP32+);(B) 类似于快发 (PV+) 内神经;(C) 类似于具有突出下垂 (NPY+) 的低阈值尖峰神经元;(D) 神经元以大后超极化 (Chat+) 激发。(E-H)共聚焦图像显示GFP和内神经元标记PV(E)、ChAT(F)、NPY(G)和投影神经元标记DARPP32(H)的共同定位。所有刻度条 = 50 mm。请点击此处查看此图的较大版本。
讨论
在活体内,可以直接重新编程,可以使用AAV FLEX矢量在Cre-表达小鼠菌株。需要注意的是,小鼠菌株在重新编程功效方面存在差异。对于在纹状体中重新编程,NG2-Cre 小鼠线已证明比其他菌株更有效。在开始使用新的动物菌株之前,请务必检查小鼠提供者指南,随着时间的推移,Cre表达,因为动物的年龄经常影响这种蛋白质表达的特异性。在我们的研究中,超过12周的动物没有用于体内重新编程,因为NG2胶质以外的细胞存在Cre表达的风险。建议对只注射Synapsin-FLEX-GFP结构的控制动物进行持续存在和监测。这允许监测动物的GFP阳性细胞,如果没有重新编程基因(ALN),不应该存在。
为了识别新重新编程的神经元,一种神经元特定的识别方法,如该协议中描述的方法至关重要。这允许正确识别和区分重新编程的神经元从内源性周围细胞,这是特别相关的,当重编程在同源区域。
目标为病毒注射的正确结构也很重要。因此,病毒注射的立体手术很重要,需要准确处理,特别是在针对大脑较小结构时。
我们之前已经表明,基于使用相同重新编程因子的体外重新编程实验预测体内重新编程的结果是不可靠的。因此,所有感兴趣的因素都需要在体内进行测试。在我们手中,许多不同的因子组合给予相同的神经元亚型(即体内的内神经元11),尽管这些基因与其他神经元的发展有关。
重新编程神经元的全细胞贴片夹是一种精细的技术,组织处理对于良好的结果非常重要。用冰冷的克雷布斯溶液灌注可改善组织质量。此外,修补的神经元需要仔细处理。即使重新编程的神经元的成熟和型型特征可以通过全细胞贴片夹进行一些评估,这些细胞也不能完全与内源性神经元进行比较。应使用其他类型的分析,如基因组测序(例如RNA测序)来进一步确认重新编程的细胞身份。
本文描述的技术可以考虑发展未来治疗,其中神经元替代需要在大脑中。虽然在体内重新编程还处于早期阶段,而且人类的翻译尚未预见到,但这项技术可以提供一种评估大脑外源基因功能和研究体内细胞成熟的方法。
披露声明
作者没有什么可透露的。
致谢
Marcella Birtele 由欧盟 Horizon 2020 计划 (H2020-MSCA-ITN-2015) 资助,该计划由玛丽·斯科多夫斯卡-库里埃创新培训网络和第 676408 号赠款协议提供。丹尼尔拉·赖兰德·奥托松由瑞典研究理事会资助(2017-01234)。
材料
| Name | Company | Catalog Number | Comments |
| REAGENTS FOR AAV5 CLONING AND VIRAL VECTOR PREPARATION | |||
| pAAV-CA-FLEX | AddGene | 38042 | |
| Ascl1 | AddGene | 67291 | NM_008553.4 |
| Lmx1a | AddGene | 33013 | NM_0033652.5 |
| Nurr1 | AddGene | 35000 | NM_013613.2 |
| GFP-syn | AddGene | 30456 | |
| LoxP (FLEX) sequence 1 | GATCTccataacttcgtataaagtatcctatac gaagttatatcaaaataggaagaccaatgcttc accatcgacccgaattgccaagcatcaccatcg acccataacttcgtataatgtatgctatacgaa gttatactagtcccgggaaggcgaagacgcgga agaggctctaga | ||
| LoxP (FLEX) sequences 2 | tactagtataacttcgtataggatactttatac gaagttatcattgggattcttcctattttgatc caagcatcaccatcgaccctctagtccacatct caccatcgacccataacttcgtatagcatacat tatacgaagttatgtccctcgaagaggttcgaa ttcgtttaaacGGTACCCTCGAC | ||
| pDP5 | Plasmid Factory | PF435 | |
| pDP6 | Plasmid Factory | PF436 | |
| Phosphate-Buffered Saline (PBS) | Thermo Fisher Scientific | 10010023 | |
| FBS (Fetal bovine serum) | Thermo Fisher Scientific | 10500064 | |
| Penicillin streptomycin | Thermo Fisher Scientific | 15140122 | |
| DMEM (Dulbecco's Modified Eagle Medium)+ Glutamax | Thermo Fisher Scientific | 61965026 | |
| DPBS (Dulbecco's Phosphate Buffer Saline) | Thermo Fisher Scientific | 14190094 | |
| HEK293 cells | Thermo Fisher Scientific | 85120602-1VL | |
| Flasks | BD Falcon | 10078780 | 175 cm2 |
| Tris H-CL | Sigma Aldrich | 10812846001 | For TE buffer use 10 mM, pH 8.0; for lysis buffer use 50mM, pH 8.5; for IE buffer use 20 mM, pH 8.0; for elution buffer use 20 mM, pH 8.0 |
| EDTA | EDTA: Invitrogen | EDTA: AM9260G | For TE buffer use 1 mM EDTA |
| Ultrapure water | see Ultrapure water system | ||
| CaCl2 | SigmaAldrich | C5080 | 2.5 M |
| Dulbecco´s phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190136 | |
| NaCl | Sigma-Aldrich | S3014 | FOR HBS use 140 mM; for Lysis Buffer use 150 mM; for IE buffer use 15 mM; for elution buffer use 250 mM |
| MgCl2 | Sigma-Aldrich | M8266-100G | For lysis Buffer: 1 mM |
| Ultracentrifuge sealing tubes | Beckman Coulter | Quick-Seal® Polypropylene Tube | |
| OptiPrep™ Density Gradient Medium | Sigma Aldrich | D1556-250ML | |
| 10-mL syringe-18G needle | BD | 305064 | |
| Laboratory glass bottles | VWR | ? | |
| Anion exchange filter | PALL laboratory | MSTG25Q6 | Acrodisc unit with Mustang Q membrane |
| Centrifugal filter unit | Merck | Z740210-24EA | Amicon Ultra-4 device |
| Endotoxin-Free Plasmid DNA Isolation Kits | Thermo Fisher Scientific | A33073 | |
| Na2PO4 | Sigma-Aldrich | S7907 | |
| HEPES | Sigma-Aldrich | H7523 | 15 mL |
| Falcon tube | Thermo Fisher Scientific | Corning 352196 | |
| Falcon tube | Thermo Fisher Scientific | Corning 352070 | |
| Glass Vials | Novatech | 30209-1232 | CGGCCTCAGFGAGCGA |
| Forward Primer for Inverted Terminal Repeat (ITR) sequence | GGAACCCCTAGTGATGGAGTT | ||
| Reverse Primer for Inverted Terminal Repeat (ITR) sequence | CACTCCCTCTCTGCGCGCTCG | ||
| 5´FAM / 3´BHQ1 probe | Jena Bioscience | ||
| 0.22 mm filter | Merck | SLGV004SL | Millex-GV filter |
| EQUIPMENT AAV5 VIRAL VECTOR PREPARATION | |||
| Freezer -20 °C | |||
| Freezer -80 °C | |||
| Fridge +4 °C | |||
| AAV viral room | |||
| Ultrapure Water system | Merck | Milli-Q® IQ 7000 | |
| Vortex mixer | VWR | 444-0004 | |
| Ultracentrifuge | Beckman Coulter | Beckman Optima LE-80K Ultracentrifuge | |
| Autoclave | Tuttnauer | 2540 EL | |
| Polymerase Chain Reaction (PCR) | BioRad | C1000 Touch Thermal Cycler | |
| Quantitative PCR (qPCR) | Roche | LightCycler® 480 System | |
| Centrifuge | Thermo Fisher Scientific | Sorvall ST16 | |
| Water Bath | Thermo Fisher Scientific | TSGP02 | |
| ANIMAL MODEL | |||
| NG2-Cre mice | Jackson | NG2-CrexB6129, Stock #008533 | |
| REAGENTS FOR INJECTION OF REPROGRAMMING FACTORS INTO THE BRAIN | |||
| Water | |||
| Saline | Apoteket AB | 70% | |
| Ethanol | Solveco | ||
| Isolfurane | Apoteket AB | Dilute to 1% solution with warm water. | |
| Virkon | Viroderm | 7511 | |
| Pentobarbital | Apoteket AB | P0500000 | i.p. for terminal procedure at the dose of 60 mg/ml. |
| Sucrose | Merck | S0389-500G | |
| Trypan Blu | Thermo Fisher Scientific | 15250061 | |
| Retrobeads | Lumafluor | R170 | |
| Buprenorphine | Apoteket AB | ||
| EQUIPMENT FOR INJECTION OF REPROGRAMMING FACTORS INTO THE BRAIN | From RSG Solingen. | ||
| Scissors | VWR | 233-1552 | From Biochem. |
| Tweezers | VWR | 232-0007 | |
| Forcep | VWR | 232-0120 | |
| Scalpel holder | VWR | RSGA106.621 | Number 20. |
| Scalpel | VWR | RSGA106.200 | |
| Stereotaxic frame | Stoelting Europe | 51500D | |
| Mouse ear bars | Stoelting Europe | 51648 | 5 ul |
| Syringe with Removable needle | Hamilton Company | 65 | 0,75 inner diameter and 1.5 outer diameter. |
| Glass capilaries | Stoelting | 50811 | |
| Glass capillary puller | Sutter company | P-1000 | |
| Dental drill | Agnthos AB | 1464 | |
| Shaver | Agnthos AB | GT420 | |
| Isoflurane Chamber and pump | Agnthos AB | 8323101 | 2 mL |
| Syringes | Merck | Z118400-30EA | 25G |
| Needles | Merck | Z192414 Aldrich | |
| Mouse and neonatal rat adaptor for stereotaxic fram | Stoelting | 51625 | |
| Heating pad | Braintree scientific, inc | 53800M | From Covidien 2187. |
| Cotton gauze | Fisher Scientific | 22-037-902 | |
| Rubber tube | Elfa Distrelec | HFT-A-9.5/4.8 PO-X BK 150 | |
| Cotton swabs | Fisher Scientific | 18-366-473 | |
| REAGENTS FOR WHOLE-CELL PATCH CLAMP RECORDINGS | |||
| NaCl | Sigma-Aldrich | S3014 | |
| KCl | Sigma-Aldrich | P9333 | |
| NaH2PO4-H2O | Sigma-Aldrich | S9638 | |
| MgCl2-6 H2O | Sigma-Aldrich | M2670 | |
| CaCl2-6 H2O | Sigma-Aldrich | C8106 | |
| MgSO4-7 H2O | Sigma-Aldrich | 230391 | |
| NaHCO3 | Sigma-Aldrich | S5761 | |
| Glucose | Sigma-Aldrich | G7021 | see Ultrapure Water system |
| Ultrapure Water | Prepare 1 or 2M. | ||
| KOH | Sigma-Aldrich | P5958-500G | |
| K-D-gluconate | Sigma-Aldrich | G4500 Sigma | |
| KCl | Sigma-Aldrich | P9541 | |
| KOH-EGTA (Etilene glycol-bis-N-tetracetic acid) | Sigma-Aldrich | E3889 Sigma | |
| KOH- Hepes acid (N-2-hydroxyethylpiperazine-N’-2-ethanesulfonic acid) | Sigma-Aldrich | H7523 | |
| NaCl | Sigma-Aldrich | S3014 | |
| Mg2ATP | Sigma-Aldrich | A9187 | |
| Na3GTP | Sigma-Aldrich | G8877 | |
| Biocytin | Sigma-Aldrich | B4261 | |
| Picrotoxin | Merck | P1675 Sigma | |
| CNQX | Merck | C239 Sigma | |
| Ice | |||
| EQUIPMENT FOR WHOLE-CELL PATCH CLAMP RECORDINGS | |||
| Borosilicate glass pipette | Sutter Company | B150-86-10 | |
| Glass capillary puller | Sutter company | P-1000 | |
| Vibratome | Leica | Leica VT1000 S | |
| WaterBath | Thermo Fisher Scientific | TSGP02 | |
| Clampfit software | Molecular Devices | ||
| Multiclamp software | Molecular Devices | ||
| REAGENTS FOR IMMUNOHISTOCHEMISTRY | Use at a concentration of 4%. CAUTION: PFA is a potent fixative. Avoid ingestion and contact with skin. | ||
| Paraformaldehyde (PFA) | Merck Millipore | 1040051000 | Use at a concentration of 0.1%. |
| Triton X-100 | Fisher Scientific | 10254640 | Donkey.Use at a concentration of 1 : 400. |
| Serum | Merck Millipore | S30-100ML | Reconstitute the powder in Milli-Q water to 1 mg/mL. Aliquot and store at -20°C, light sensitive. Use at a concentration of 1 : 500. |
| 4′,6-Diamidino-2′-phenylindole dihydrochloride (DAPI) | Sigma Aldrich | D9542 | 1: 600 in KPBS-T. |
| streptavidin- Cy3 | Thermo Fisher Scientific | 434315 | 1:5000, rabbit. |
| Anti-GAD65/67 | Abcam | 1:2000, mouse. | |
| Anti-PV | Sigma | P3088 | 1:200, goat. |
| Anti-Chat | Merk | AB143 | 1:5000, rabbit. |
| Anti-NPY | Immunostar | 22940 | |
| K2HPO4 | Sigma-Aldrich | P3786 | |
| NaCl | Sigma-Aldrich | S3014 | |
| KH2PO4 | Sigma-Aldrich | NIST200B | 1:1000, chicken. |
| Anti-GFP | Abcam | ab13970 | |
| Mounting solution | Merck | 10981 | Polyvinyl alcohol mounting medium with DABCO®, antifading |
| OCT | Agar Scientific | ||
| Glycerol | Sigma-Aldrich | G9012-100ML | |
| Distilled water | |||
| Anti-freeze solution | Tissue Pro Technology | AFS05-1000N, 1000 mL/ea. | |
| EQUIPMENT FOR IMMUNOHISTOCHEMISTRY | |||
| Inverted fluorescence microscope | Leica | DMI6000 B | |
| Confocal microscope | Leica | TCS SP8 laser scanning confocal microscope. | |
| Prism | GraphPad | ||
| Microtome | Leica | SM2010R |
参考文献
- Barker, R. A., Parmar, M., Studer, L., Takahashi, J. Human Trials of Stem Cell-Derived Dopamine Neurons for Parkinson's Disease: Dawn of a New Era. Cell Stem Cell. 21 (5), 569-573 (2017).
- Southwell, D. G., et al. Interneurons from embryonic development to cell-based therapy. Science. 344 (6180), 1240622 (2014).
- Parmar, M., Torper, O., Drouin-Ouellet, J. Cell-based therapy for Parkinson's disease: A journey through decades toward the light side of the Force. European Journal of Neuroscience. , (2018).
- Torper, O., et al. In Vivo Reprogramming of Striatal NG2 Glia into Functional Neurons that Integrate into Local Host Circuitry. Cell Reports. 12 (3), 474-481 (2015).
- Su, Z., Niu, W., Liu, M. L., Zou, Y., Zhang, C. L. In vivo conversion of astrocytes to neurons in the injured adult spinal cord. Nature Communication. 5, 3338 (2014).
- Liu, Y., et al. Ascl1 Converts Dorsal Midbrain Astrocytes into Functional Neurons In Vivo. Journal of Neuroscience. 35 (25), 9336-9355 (2015).
- Guo, Z., et al. In vivo direct reprogramming of reactive glial cells into functional neurons after brain injury and in an Alzheimer's disease model. Cell Stem Cell. 14 (2), 188-202 (2014).
- Grande, A., et al. Environmental impact on direct neuronal reprogramming in vivo in the adult brain. Nature Communication. 4, 2373 (2013).
- Niu, W., et al. In vivo reprogramming of astrocytes to neuroblasts in the adult brain. Nature Cell Biology. 15 (10), 1164-1175 (2013).
- Weinberg, M. S., Criswell, H. E., Powell, S. K., Bhatt, A. P., McCown, T. J. Viral Vector Reprogramming of Adult Resident Striatal Oligodendrocytes into Functional Neurons. Molecular Therapy. 25 (4), 928-934 (2017).
- Pereira, M., et al. Direct Reprogramming of Resident NG2 Glia into Neurons with Properties of Fast-Spiking Parvalbumin-Containing Interneurons. Stem Cell Reports. 9 (3), 742-751 (2017).
- Rivetti di Val Cervo, P., et al. Induction of functional dopamine neurons from human astrocytes in vitro and mouse astrocytes in a Parkinson's disease model. Nature Biotechnology. 35 (5), 444-452 (2017).
- Crosson, S. M., Dib, P., Smith, J. K., Zolotukhin, S. Helper-free Production of Laboratory Grade AAV and Purification by Iodixanol Density Gradient Centrifugation. Molecular Therapy Methods & Clinial Development. 10, 1-7 (2018).
- Torper, O., et al. Generation of induced neurons via direct conversion in vivo. Proceedings of the National Academy of Sciences of the United States of America. 110 (17), 7038-7043 (2013).
- Kawaguchi, Y., Kubota, Y. Correlation of physiological subgroupings of nonpyramidal cells with parvalbumin- and calbindinD28k-immunoreactive neurons in layer V of rat frontal cortex. Journal of Neurophysiology. 70 (1), 387-396 (1993).
- Grealish, S., et al. The A9 dopamine neuron component in grafts of ventral mesencephalon is an important determinant for recovery of motor function in a rat model of Parkinson's disease. Brain. 133 (Pt 2), 482-495 (2010).
- Thompson, L., Barraud, P., Andersson, E., Kirik, D., Bjorklund, A. Identification of dopaminergic neurons of nigral and ventral tegmental area subtypes in grafts of fetal ventral mesencephalon based on cell morphology, protein expression, and efferent projections. Journal of Neuroscience. 25 (27), 6467-6477 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。