Method Article
تحليل تعتمد على DNAzyme من rRNA 2'-O-Methylation
In This Article
Summary
هنا نقدم بروتوكول لشق DNAzyme تعتمد على RNA. وهذا يتيح التحليل السريع والمعتمد على الموقع لRNA 2'-O-methylation. ويمكن استخدام هذا النهج للتقييم الأولي أو الرئيسي لنشاط النورا.
Abstract
دليل مربع C / D RNAs النيوكليولار الصغيرة (snoRNAs) تحفيز 2'-O-ميثيليشن من ريبوسومال والحمض النووي النووي الصغير. ومع ذلك، فإن عددا كبيرا من الرنا في eukaryotes أعلى قد تعترف بشكل متقطع الأنواع الأخرى RNA و2'-O-methylate أهداف متعددة. هنا، ونحن نقدم دليل خطوة بخطوة لتحليل سريع وغير مكلفة من موقع محدد 2'-O-ميثيليشن باستخدام طريقة راسخة تستخدم oligonucleotides الحمض النووي قصيرة تسمى DNAzymes. هذه الشظايا الحمض النووي تحتوي على تسلسلات الحفازة التي تتشقق الحمض النووي الريبي في مواقف توافق ية محددة، فضلا عن الأسلحة الهومولوجيا المتغيرة توجيه DNAzyme إلى أهدافها RNA. [دنزيم] منعت نشاط ب [2-'و-مثلأيشن] من ال [نوكليوتيد] مجاورة إلى الانقسام موقعة في ال [رنا]. وهكذا، DNAzymes، محدودة فقط من قبل توافق الآراء من تسلسل مشقق، هي أدوات مثالية للتحليل السريع للRNA بوساطة RNA 2'-O-methylation. قمنا بتحليل snRNA snR13- وsnR47-guided 2'-O-methylation من الحمض النووي الريبي 25S ribosomal في Saccharomyces cerevisiae لإظهار بساطة هذه التقنية وتوفير بروتوكول مفصل للفحص تعتمد DNAzyme.
Introduction
تلعب تعديلات الحمض النووي الريبي أدوارًا هامة في تنظيم التعبير الجيني. RNA 2'-O-methylation وpseudouridylation، التي تسترشد مربع C / D ومربع H / ACA RNAs النوكليولار الصغيرة (snoRNAs) على التوالي، وحماية الحمض النووي الريبي من التدهور وتثبيت هياكلها أعلى ترتيب1،2،3 . وقد حُددت أهداف الرنا أساساً في المناطق الرنمنة والنووية الصغيرة. ومع ذلك، في eukaryotes أعلى، وهناك يحتمل أن تكون مئات من snoRNA مع عدم وجود وظائف معينة وبعضها قد تعترف RNAs متعددة1،4،5،6،7. ولذلك، فإن الأساليب التي تسمح بتحديد وتحليل التعديلات الموجهة من قبل الرنا هي أدوات هامة في الكشف عن الآليات التي تحكم العمليات الخلوية.
يمكن تحديد موقع تحديد المعلوماتية المفترضة 2'-O-a-aaمن مربع C/D snoRNA الموجهة من قبل 2'-O-methylation وتأكيده تجريبياً من خلال العديد من التقنيات، بما في ذلك الانشقاق الموجه بـ RNase H، أو الأساليب الخاصة بالموقع والجينوم على نطاق الجينوم، والتي تستخدم النسخ العكسي في النيوكليوتيدات المنخفضة (dNTPs) نهج التركيز8،9،10،11. هذه التقنيات حساسة جدا ولكن أيضا شاقة ومكلفة، وبالتالي، قد لا تكون مناسبة للاختبار الأولي أو السريع. واحدة من أبسط ومنخفضة التكلفة طرق لتحديد 2'-O-ميثيليشن المواقع هو DNAzyme تعتمد RNA الانقسام12. DNAzymes قصيرة، واحدة تقطعت بهم السبل وجزيئات الحمض النووي النشطة الحفازة قادرة على الانقسام الاندونوكلي من الحمض النووي الريبي في مواقع محددة. وهي تتألف من تسلسل أساسي مُحفظ ونشط بشكل حفاز وأذرع ملزمة من 5 و3'، تتألف من تسلسلات متغيرة مصممة للتهجين بواسطة الاقتران الأساسي لواطسون-كريك إلى هدف الحمض النووي الريبي(الشكل 1). وهكذا، فإن الأسلحة 5 'و 3' تسليم تسلسل الحفاز إلى موقع RNA محددة. وتمنع الانقسام تعتمد DNAzyme من قبل 2 '-O-ميثيليشن من النيوكليوتيد المتمركزة مباشرة في أعلى المنبع من موقع الانقسام12،13. وهذا يجعل DNAzymes أدوات عملية جدا لتحليل مواقع الحمض النووي الريبي المفترض أو المعروف 2'-O-methylation.
يتم استخدام نوعين من DNAzymes لتعديلات الحمض النووي الريبي تحليلات12. التسلسل النشط من 10-23 DNAzyme(الشكل 1A)يتكون من 15 النيوكليوتيدات (5'RGGCTAGCTACAACGA3') التي تشكل حلقة حول الهدف RNA purine-pyrimidine (RY) dinucleotide وحفز الانقسام بين هذين النيوكليوتيدات. ليس ال [رنا] [بورين] ([ر]) [بس-كووووتد] مع ال [دنزيم] وال [2'-و-مثلأيشن] يقدّم على ال [دنزيم] يمنع الانقسام. الأسلحة ملزمة من 10-23 DNAzymes عادة ما تكون 10-15 النيوكليوتيدات طويلة. الفئة الثانية DNAzyme، 8-17 DNAzymes(الشكل 1B)تحتوي على 14-النيوكليوتيدات الحفاز ة تسلسل (5'TCCGAGCCGGACGA3'). النيوكليوتيدات C2،C3 و G4 زوج مع C9 G10 و G11 تشكيل هيكل حلقة الجذعية قصيرة. 8-17 DNAzymes شق الحمض النووي الريبي المنبع من أي غوانين التي يقترن بشكل ناقص مع الثيامين الأول من تسلسل DNAzyme النشطة. ال [رنا] [نوكليوتيد] [أوبّر] من ال [غنين] ليس [بس-كبينتد] مع [دنزيم] وه [2'-و-م-مثلأيشن] يضعف الانقسام. 8-17 [دنزيمس] يتطلّب [هومولوج] طويلة [أرمس] من حوالي 20 [نوكليوتيدس] أن يوجّه [دنزيم] إلى تسلسله خاصّة.
هنا، ونحن نقدم بروتوكول خطوة بخطوة لتحليل 2'-O-ميثيليشن من rRNA في Saccharomyces cerevisiae باستخدام 10-23 و 8-17 DNAzyme تعتمد على النهج12،13 (الشكل 1C). ويمكن تكييف هذا البروتوكول بسهولة مع الكائنات الحية الأخرى وأنواع الحمض النووي الريبي ويستخدم للتحليلات السريعة أو الأولية أو الرئيسية لمثيلة RNA 2'-O-methylation الخاصة بالموقع.
Protocol
1. سلالات، وسائل الإعلام، وصفات العازلة
- إعداد الخميرة(S. سيريفيسياي)وسائل الإعلام كما هو مفصل هنا: YP (1٪ ث / الخامس استخراج الخميرة، 2٪ ث / الخامس peptone البكتريولوجية)، والجلوكوز والجالاكتوز المخزونات في 20٪ ث / الخامس.
- إعداد خلات الصوديوم (NaAc)-EDTA (AE) العازلة كما هو مفصل هنا: 50 MM NaAc درجة الحموضة 5.3 و 10 MM EDTA.
- إعداد 10-23 DNAzyme 4X الحضانة العازلة كما هو مفصل هنا: 24 mM تريس درجة الحموضة 8.0، 60 مل NaCl و 10-23 DNAzyme 4X رد الفعل العازلة: 200 mM تريس pH 8.0 و 600 مل NaCl.
- إعداد 8-17 DNAzyme 2X رد الفعل العازلة كما هو مفصل هنا: 200 مل ككل، 800 مل كل، 100 مل HEPES درجة الحموضة 7.0، 15 مل ملغ كل2،و 15 مليون متر MnCl2.
- إعداد 10X MOPS العازلة على النحو المفصل هنا: 200 mM MOPS, 50 MM NaAc, 1 MM EDTA; pH 7.0 و 1.5x عينة Denaturing العازلة: 50٪ v / v الفورماميد، 20٪ الخامس / الخامس الفورمالديهايد، 1.5X MOPS العازلة.
- الحصول على سلالات S. سيريفيسياي، BY4741(MATa his3Δ1 leu2Δ0 met15Δ0 ura3Δ0)؛ GAL1::SNR13 (كما BY4741 ولكن GAL1::SNR13: كانماكس); GAL1::SNR47 (كما BY4741 ولكن GAL1::SNR47: HIS3mX). أي سلالة الخميرة الأخرى يمكن استخدامها لهذا التحليل.
2. DNAzyme تصميم
- البحث عن تسلسل RNA من الفائدة أو موقع المثيلة المفترضة باستخدام قاعدة بيانات مناسبة. لأهداف S. cerevisiae snoRNA، استخدم قاعدة بيانات الخميرة الرنا: http://people.biochem.umass.edu/fournierlab/snornadb/mastertable.php14
- للعثور على موقع المثيلة موضع الاهتمام، على سبيل المثال، الموقع المعتمد على snR13، حدد "snR13" ودوّن ملاحظة عن موضع النيوكليوتيد المعدل (على سبيل المثال، SnR13-guided A2281 في 25S rRNA).
- البحث عن تسلسلات المنبع والمتلقين للمعلومات من النيوكليوتيد اتّباعقاعدة البيانات المناسبة. بالنسبة لـ S. cerevisiae، استخدم قاعدة بيانات الجينوم Saccharomyces: https://www.yeastgenome.org/
- البحث عن اسم الجينات المستهدفة على سبيل المثال، RDN25 (الترميز 25S rRNA).
- من علامة التبويب "تسلسل"، حدد 10-15 النيوكليوتيدات المنبع (5' الذراع) والمصب (3 'الذراع) من موقع الميثيل عند استخدام 10-23 اختبار DNAzyme و 20 النيوكليوتيدات المنبع (5' الذراع) والمصب (3'arm) من موقع الميثيل لDNAzyme 8-17.
- إنشاء تسلسل اتّجاهات تكميلية من 5 'و 3' الأسلحة.
- الجناح 10-23 أو 8-17 DNAzyme تسلسل الحفاز مع تسلسل تكميلي من 5 'و 3' الأسلحة.
- طلب DNAzyme كحمض نووي طبيعي oligonucleotide من المورد.
3. S. سيريفيسياي شروط النمو
ملاحظة: S. cerevisiae BY4741 تم استخدام مشتقات سلالة، والتي يتم فيها دفع التعبير عن SNR13 أو SNR47 snoRNA من المروج GAL1 غير قابل للارتداء. من أجل الحث أو تثبيط توليفها، تنمو الخلايا على المتوسطة التي تحتوي على الجالاكتوز(GAL1تعتمد على النسخ على) أو الجلوكوز(GAL1تعتمد على النسخ قبالة). كتحكم، استخدم سلالة النوع البري (BY4741) المزروعة إما على الجالاكتوز أو الجلوكوز.
- تنمو سلالات الخميرة في المتوسطة المناسبة والظروف. لتحليل GAL1::SNR13 وGAL1::SNR47 سلالات فضلا عن سلالة نوع البرية isogenic، تنمو الخلايا في 50 مل من وسائل الإعلام YP مع إما 2٪ الجلوكوز (YPD) أو الجالاكتوز (YPGal) في 30 درجة مئوية إلى المرحلة الأسية الوسطى.
- خلايا الطرد المركزي في 1000 × ز،لمدة 3 دقائق في 4 درجة مئوية.
- تجاهل supernatant والحفاظ على الكريات.
- تجميد الكريات الخلية في النيتروجين السائل وتخزينها في -80 درجة مئوية.
تحذير: قد يسبب النيتروجين السائل حروقًا شديدة المبردة. ارتداء دائما الملابس الواقية وممارسة احتياطات السلامة.
ملاحظة: يمكن تخزين الكريات الخلية في -80 درجة مئوية تصل إلى 1 شهر. يمكن إيقاف البروتوكول مؤقتاً هنا إذا لزم الأمر.
4- عزل الجيش الملكي النيبالي15
ملاحظة: استخدم الطريقة الأنسب لعزل RNA. للخميرة S. سيريفيسياي،يمكن استخدام استخراج الحمض النووي الريبي الساخن الفينول.
- إضافة 1 مل من الماء المثلج، وإعادة تعليق الكريات ونقل الخلايا المعلقة إلى 1.5 مل الأنابيب الدقيقة.
- الطرد المركزي في 20،000 × ز لمدة 10 ق في 4 درجة مئوية وإزالة supernatant.
- إضافة 400 μL من المخزن المؤقت AE وإعادة تعليق الخلايا.
ملاحظة: يتم تنفيذ الخطوات 4.4-4.15 في درجة حرارة الغرفة ما لم يذكر خلاف ذلك. - إضافة 40 درجة مئوية من 10٪ SDS و 400 ميكرولتر من الفينول الحمضي (درجة الحموضة 4.5).
تحذير: الفينول هو سامة وينبغي التعامل معها تحت غطاء الدخان. ارتداء دائما معطف المختبر، والقفازات الواقية، والنظارات عند العمل مع الفينول. التخلص من النفايات وفقا للوائح المؤسسية. - يُمزج جيداً بالدوامة لمدة 20 s.
- حضانة في 65 درجة مئوية لمدة 10 دقائق. كل 2 دقيقة، فتح بلطف وإغلاق الأنبوب للإفراج عن الضغط والوجه أنبوب 2-3 مرات لخلط المراحل.
- نقل الأنابيب إلى -80 درجة مئوية وحضانة لمدة 10 دقائق.
- تذويب الأنابيب على مقاعد البدلاء والطرد المركزي في 20،000 × ز،لمدة 5 دقائق في درجة حرارة الغرفة.
- نقل المرحلة العليا إلى أنبوب جديد يحتوي على 400 ميكرولتر حمض الفينول: الكلوروفورم: الكحول isoamyl (25:24:1). لا تعطل الطور البيني.
تحذير: الكلوروفورم سام وينبغي التعامل معه تحت غطاء الدخان. ارتداء دائما معطف المختبر، والقفازات الواقية، والنظارات عند العمل مع الكلوروفورم. التخلص من النفايات وفقا للوائح المؤسسية. - مزيج جيدا من دوامة لمدة 30 s والطرد المركزي في 20،000 × ز لمدة 10 دقيقة في درجة حرارة الغرفة.
- نقل المرحلة العليا (~ 400 درجة مئوية) إلى أنبوب جديد يحتوي على 400 ميكرولتر كلوروفورم.
- يُمزج جيداً بالدوامة لمدة 30 s والطرد المركزي في 20,000 × ز لمدة 5 دقائق في درجة حرارة الغرفة.
- نقل المرحلة العليا (~ 300-350 درجة مئوية) إلى أنبوب جديد يحتوي على 1 مل من EtOH و 40 ميكرولتر من خلات الأمونيوم 7.5 M (NH4AC). مزيج عن طريق التقليب الأنبوب عدة مرات.
- الحضانة عند -80 درجة مئوية لمدة 2 ساعة أو بين عشية وضحاها عند -20 درجة مئوية.
ملاحظة: يمكن إيقاف الإجراء مؤقتاً هنا. - الطرد المركزي في 20،000 × ز،لمدة 10 دقيقة في 4 درجة مئوية. سوف تصبح صغيرة، بيليه RNA الأبيض مرئية في الجزء السفلي من الأنبوب.
- إزالة EtOH عن طريق الأنابيب لتجنب إزعاج بيليه.
- إضافة 1 مل من 70٪ EtOH والطرد المركزي في 20،000 × ز لمدة 5 دقائق في درجة حرارة الغرفة.
- إزالة 70٪ EtOH عن طريق الأنابيب.
- الطرد المركزي في 20،000 × ز لمدة 15 ثانية وإزالة EtOH المتبقية مع 2-20 درجة مئوية ماصة.
- ترك الأنبوب مفتوحا على مقاعد البدلاء لمدة 5 دقائق لتجفيف بيليه RNA.
ملاحظة: الحمض النووي الريبي بيليه يغير لونه من الأبيض إلى شفاف ة عند الجفاف. - إعادة تعليق بيليه RNA في 30 درجة مئوية من RNase / DNase خالية H2O، ونقل الأنبوب على الفور على الجليد وقياس تركيز الحمض النووي الريبي على microspectrophotometer.
- تجميد العينات في -20 درجة مئوية.
ملاحظة: يمكن تخزين الحمض النووي الريبي في -20 درجة مئوية حتى شهر واحد و -80 درجة مئوية حتى 1 سنة. يمكن إيقاف الإجراء مؤقتاً هنا أو انتقل مباشرة إلى الخطوة التالية.
5. هضم DNAzyme
-
10-23 [دنزيم] هضم
- في أنابيب 1.5 مل إعداد مزيج الحضانة عن طريق الجمع بين 5 ميكروغرام من الحمض النووي الريبي، 200 pmol من 10-23 DNAzyme (2 ميكرولتر من 100 مل حل الأسهم) و 2.5 ميكرولتر من 4X 10-23 حاجز الحضانة في حجم إجمالي قدره 10 درجة مئوية.
- نقل الأنابيب إلى كتلة الحرارة الجافة تعيين في 95 درجة مئوية وحضانة لمدة 3 دقائق.
- نقل الأنابيب على الفور على الجليد وحضانة لمدة 5 دقائق.
- تدور لفترة وجيزة ووضع الأنابيب مرة أخرى على الجليد.
- إضافة 20 U من مثبطات RNase (على سبيل المثال، 0.5 ميكرولتر RiboLock RNase المانع).
- ضع الأنابيب في كتلة حرارة جافة تعيين ل 25 درجة مئوية وحضانة لمدة 10 دقائق.
- في هذه الأثناء، قم بإعداد خليط التفاعل في أنبوب 1.5 ميكرولتر عن طريق الجمع بين 5 ميكرولتر من 4x 10-23 رد الفعل العازلة مع 4 ميكرولتر من 300 مل ملغ كل2 و 1 ميكرولتر H2O. ضع الأنبوب في كتلة جافة تعيين إلى 37 درجة مئوية.
- نقل مزيج الحضانة إلى كتلة الحرارة الجافة تعيين ل37 درجة مئوية وإضافة 10 درجة مئوية من مزيج رد الفعل قبل تسخينها.
- احتضان رد الفعل في 37 درجة مئوية لمدة 1 ساعة.
- نقل الأنابيب على الجليد والمضي قدما إلى الخطوة 5.3.1.
-
8-17 [دنزيم] هضم
- إعداد ميكروتوب 1.5 مل مع 5 ميكروغرام من الحمض النووي الريبي في حجم إجمالي قدره 6 درجة مئوية.
- إعداد ميكروتوب 1.5 مل مع 400 pmol من 8-17 DNAzyme (4 درجة مئوية من أصل 100 مليون متر مربع). أبقي الأنبوب على الثلج
- نقل الأنابيب إلى كتلة الحرارة الجافة تعيين ل 95 درجة مئوية وحضانة لمدة 2 دقيقة.
- نقل عينة الحمض النووي الريبي على الجليد.
- تدور أسفل الأنبوب مع DNAzyme لمدة 5 ثوان وحضانة في 25 درجة مئوية لمدة 10 دقائق.
- في الوقت نفسه، وإعداد أنبوب 1.5 مل مع 10 درجة مئوية من 2X 8-17 رد الفعل العازلة وحضانة في 25 درجة مئوية.
- إعداد خليط رد فعل عن طريق إضافة 10 درجة مئوية من قبل الاحماء 2X رد الفعل العازلة إلى الأنبوب مع DNAzyme.
- نقل 14 درجة مئوية من مزيج التفاعل إلى الأنبوب مع الحمض النووي الريبي وإضافة 20 U من مثبطات RNase.
- احتضان رد الفعل في 25 درجة مئوية لمدة 2 ساعة.
- نقل الأنبوب على الجليد والمضي قدما في تنقية RNA (الخطوة 5.3.1).
-
تنقية الحمض النووي الريبي
- إضافة 350 درجة مئوية من الماء و 400 ميكرولتر من الكلوروفورم إلى أنبوب التفاعل، ومزيج جيدا عن طريق دوامة لمدة 30 ثانية والطرد المركزي في 20،000 × ز لمدة 5 دقائق في درجة حرارة الغرفة.
- نقل المرحلة العليا (~ 300-350 درجة مئوية) إلى أنبوب جديد يحتوي على 1 مل من EtOH، 40 ميكرولتر من 7.5 M NH4AC و 1 ميكرولتر من الجليكوجين (10 ميكروغرام / ميكرولتر). مزيج عن طريق التقليب الأنبوب عدة مرات.
- الحضانة عند -80 درجة مئوية لمدة 2 ساعة أو بين عشية وضحاها عند -20 درجة مئوية.
ملاحظة: يمكن إيقاف الإجراء مؤقتاً هنا. - كرر الخطوات من 4.15 إلى 4.21.
- إعادة تعليق بيليه RNA في 10 درجة مئوية من RNase / DNase خالية H2O ونقل الأنابيب على الفور على الجليد.
- تجميد العينات في -20 درجة مئوية.
ملاحظة: يمكن تخزين الحمض النووي الريبي في -20 درجة مئوية حتى شهر و -80 درجة مئوية حتى 1 سنة. الإجراء يستطيع كنت مؤقتا هنا أو باشر إلى [رنا] [إلكتروفورسس].
6. RNA الكهربائي
- رش معدات الكهربائي (خزان، صينية، مشط) مع 1٪ SDS، وترك لمدة 15 دقيقة وشطف مع الكثير من ddH2O.
- حل 1.5 غرام من أغاروز في 127.5 مل من ddH2O عن طريق تسخينه في الميكروويف.
- إضافة 15 مل من 10X MOPS و 7.5 مل من 37٪ الفورمالديهايد إلى حل أغاروز (الحجم الإجمالي هو 150 مل).
تحذير: الفورمالديهايد هو سام وينبغي التعامل معها تحت غطاء محرك الدخان. ارتداء دائما معطف المختبر، والقفازات الواقية، والنظارات عند العمل مع الفورمالديهايد. التخلص من النفايات وفقا للوائح المؤسسية. - إضافة كمية مناسبة من وصمة عار هلام من الاختيار إلى حل أغاروز (على سبيل المثال، 15 درجة مئوية من SYBR آمنة الحمض النووي هلام وصمة عار). يُخلط المزيج جيّداً ويُسكب الأجاروز على الصينية.
- أدخل مشطًا في الجل على الفور.
- اتركها لمدة 45 دقيقة تحت غطاء الدخان. تغطية صينية مع رقائق الألومنيوم عند استخدام وصمة عار هلام حساسة للضوء.
- إعداد 600 مل من المخزن المؤقت MOPS 1x.
-
إعداد عينة RNA
- في أنبوب 1.5 مل، والجمع بين 10 ميكرولتر من عينة RNA المهضومة والنقية، 5 ميكرولتر من عينة Denaturing العازلة و 0.5 ميكرولتر من 6X صبغ التحميل.
تحذير: فورماميد سامة وينبغي التعامل معها تحت غطاء الدخان. ارتداء دائما معطف المختبر، والقفازات الواقية، والنظارات عند العمل مع formamide. التخلص من النفايات وفقا للوائح المؤسسية. - احتضان عينات الحمض النووي الريبي في 70 درجة مئوية لمدة 5 دقائق. الحضانة لمدة 5 دقائق.
- تدور لفترة وجيزة قبل التحميل على هلام.
- في أنبوب 1.5 مل، والجمع بين 10 ميكرولتر من عينة RNA المهضومة والنقية، 5 ميكرولتر من عينة Denaturing العازلة و 0.5 ميكرولتر من 6X صبغ التحميل.
- وضع هلام في خزان الكهربائي وملء مع 1X MOPS العازلة. تحميل حجم كامل من كل عينة (15 درجة مئوية) على هلام. تشغيل في 80 V حتى بروموفينول الأزرق يصل إلى 2/3 من طول هلام.
- صورة هلام باستخدام الصور المناسبة للكشف عن وصمة عار هلام المختارة (على سبيل المثال، الأشعة فوق البنفسجية transilluminator).
النتائج
وقد تبين مؤخرا فائدة الانقسام تعتمد DNAzyme في تحليل التعديلات rRNA في سياق النضج snoRNAs13. تم استخدام التبذير المعتمد على DNAzyme لإظهار أن عدم وجود 5'-نهاية المعالجة قبل سنورنا يؤثر على مستويات 2'-O-ميثيليشن من 25S و 18S rRNA في S. سيريفيسياي13.
هنا، استخدمنا نظام النسخ snoRNA غير قابل للامتزاج لإثبات فعالية وبساطة هذه التقنية. يُرشد المربع C/D snR13 المثيلة في موقعين في 25S rRNA، بما في ذلك الأيدينين 2281(الشكل 2A). يتبع هذا [نوكليوتيد] ب [أوركل], أيّ يمثّل الإجماع [دينوكلوتيد] ([ري]) [كلفبل] ب 10-23 [دنزيم]. صندوق C / D snR47 يرشد أيضا المثيلة من اثنين من النيوكليوتيدات في 25S rRNA(الشكل 2B). ويتبع الأدينين في موقف 2220 من قبل بقايا الغوانين وهذا dinucleotide يمكن أن يكون مشققا من قبل DNAzyme 8-17. من أجل الحث أو تثبيط توليف إما snR13 أو snR47 snoRNA، أدخلنا المروج GAL1 غير قابل للتشجيع من الجينات SNR13 أو SNR47 والخلايا المزروعة في المتوسطة التي تحتوي على الجالاكتوز(GAL1تعتمد على النسخ على) أو الجلوكوز(GAL1تعتمد على النسخ قبالة). بعد ذلك، تم احتضان الحمض النووي الريبي المعزول من GAL1::SNR13 الخلايا مع 10-23 DNAzyme مصممة لشق 25S rRNA في موقع تعتمد على snR13، في ما بين النيوكليوتيدات 2281 و 2282(الشكل 2C). تم التعامل مع الحمض النووي الريبي من سلالة GAL1::SNR47 مع 8-17 DNAzyme استهداف موقع تعتمد على snR47 في بين النيوكليوتيدات 2220 و 2221(الشكل 2D). كتحكم، تم احتضان الحمض النووي الريبي من سلالة BY4741 البرية التي تنمو على الجالاكتوز أو الجلوكوز مع كل من DNAzymes. الكهربائي من الحمض النووي الريبي DNAzyme المعالجة كشفت أن 25S rRNA المستخرجة من GAL1::SNR13 و GAL1::SNR47 سلالات تنمو على الجالاكتوز (GAL) ظلت سليمة(الشكل 3A،B؛ الممرات 3). وعلى النقيض من ذلك، تم هضم الحمض النووي الريبي المعزول عن الخلايا GAL1::SNR13 وGAL1::SNR47 التي تنمو على الجلوكوز (GLC) من قبل DNAzymes المعنية(الشكل 3A،B؛ الممرات 4). وفي كلتا الحالتين، انخفضت الفرقة 25S rRNA ولوحظت منتجات الانشقاق المقطوعة 5 و3'(A و B). وهذا يشير إلى أنه في سلالات GAL1::SNR13 وGAL1::SNR47، كانت 25S rRNA 2'-O-methylated في المواقع الموجهة snR13- أو snR47 عندما تم استخدام الجالاكتوز كمصدر للكربون وتم التعبير عن هذه السنرانات. عدم وجود 25S rRNA مثيلة عندما تم إيقاف snR13 أو snR47 التعبير على الجلوكوز يسمح للانشقاق تعتمد DNAzyme. لم يلاحظ أي هضم الحمض النووي الريبي لعينات من النوع البري(الشكل 3A،B؛ الممرات 1 و 2)، كما التعبير عن snR13 و snR47 هو الجالاكتوز / الجلوكوز مستقلة في هذه السلالة. ولذلك، كان عادة الحمض النووي الريبي وميثيلوأرد ومقاومة لذلك لنشاط DNAzymes.
عموما، تظهر تجربتنا أن نشاط الانقسام من 10-23(الشكل 3A)و 8-17(الشكل 3B)DNAzymes يرتبط مع عدم وجود مربع C / D snR13 أو snR47، مما يدل بوضوح على أن هذه snoRNA هي المسؤولة عن 25S rRNA 2'-O-ميثيليشن في مواقع معينة.
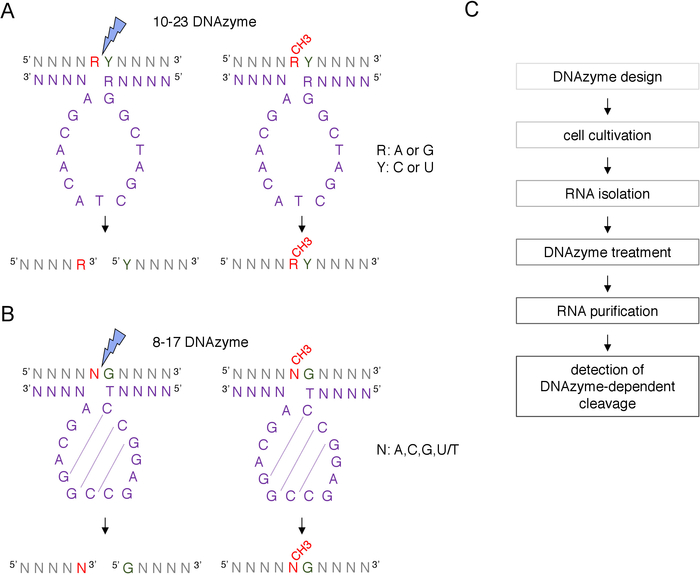
الشكل 1: DNAzymes وركائز الحمض النووي الريبي الخاصة بهم. (أ)10-23 DNAzymes شق purine-pyrimidine (RY) RNA dinucleotide. R في الحمض النووي الريبي لا يقترن DNAzyme، في حين أن Y مكملة لقاعدة R في DNAzyme. [مثلأيشن] من ال [بورين] ([ر]) في [رنا] يقمع [دنزيم-دبندنت] انشقاق. (ب)8-17 DNAzymes شق الحمض النووي الريبي المنبع من الغوانين التي يقترن بشكل ناقص مع الثيامين الأول في التسلسل الحفاز DNAzyme. لا يتم إقران النيوكليوتيد اتّبأ الغوانين ويحمي ها من الانقسام المعتمد على DNAzyme. يظهر الحمض النووي الريبي باللون الرمادي (وبصرف النظر عن موقع المثيلة)، يظهر DNAzyme باللون الأرجواني. N = أي نيوكليوتيد، R = البورين: أدينين أو غوانين، Y = بيريميدين: السيتوسين أو أوراسيل؛ CH3- يدل على مثيلة الحمض النووي الريبي. يتم وضع علامة الاقتران الأساسي داخل التسلسلات النشطة DNAzyme بواسطة خطوط منقط. صاعقة زرقاء تشير إلى موقع الانشقاق. (C)مخطط انسيابي يوضح خطوات تحليل تعتمد على DNAzyme. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: DNAzymes التي تستهدف مواقع المثيلة المعتمدة على snR13 وsnR47 في 25S rRNA. (ألف، باء) لقطات المتصفح تظهر snR13 تعتمد (A) وsnR47 تعتمد(B)مواقع المثيلة في 25S rRNA(C)25S rRNA تسلسل المحيطة snR13 تعتمد على موقع المثيلة (A2281) و 10-23 DNAzyme (هو مبين في الأرجواني) مصممة لشق الحمض النووي الريبي بين A2281 و U2282. لا يقترن2281 مع DNAzyme بينما U2282 يشكل زوج مع النيوكليوتيد الأول من تسلسل DNAzyme النشط (ملحوظ بخط أزرق). صاعقة زرقاء تدل على الانقسام (D)25S rRNA تسلسل المحيطة snR47-تعتمد على موقع المثيلة (A2220)و 8-17 DNAzyme (يظهر باللون الأرجواني) مصممة لشق الحمض النووي الريبي بين A2220 و G2221. لا يتم تهجينA 2220 مع DNAzyme بينما G2221 يقترن بشكل غير كامل مع الثيامين (المشار إليها مع خط متقطع). صاعقة زرقاء تشير إلى موقع الانشقاق. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تحليل المثيلة 2'-O-aمن 25S rRNA باستخدام 10-23 و8-17 تقييم تعتمد على DNAzyme. (أ)تحليل snR13 تعتمد 25S rRNA ميثيليشن باستخدام 10-23 DNAzyme. (ب)تحليل snR47 تعتمد 25S rRNA ميثيليشن باستخدام 8-17 DNAzyme. تم تصور الحمض النووي الريبي تلطيخ في هلام أغاروز denaturing. يتم وضع علامة على المنتجات الانقسام A و B بالأسهم الحمراء. WT = سلالة من النوع البري؛ GAL = الجالاكتوز، GLC = الجلوكوز. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يمكن استخدام الهضم المعتمد على DNAzyme كطريقة بسيطة وسريعة لتحليل RNA 2'-O-methylation12,13. DNAzymes شق RNA إذا لم يتم مثيلة النيوكليوتيدات من موقع الانقسام. على النقيض من النهج الأخرى، بما في ذلك RNase H-الموجهة الهضم، والتدهور القلوي أو النسخ العكسيفي تركيز النيوكليوتيدات منخفضة تليها PCR الكمية أو التسلسل8،10،11 ،16، يتطلب نهج DNAzyme oligonucleotide الحمض النووي بسيطة والكواشف الأساسية الموجودة في أي مختبر البيولوجيا الجزيئية. وعلاوة على ذلك، يمكن استخدام DNAzymes بطريقة مماثلة لتحليل pseudouridylation RNA بوساطة مربع H / ACA snoRNA12، مما يجعلها أدوات متعددة الاستخدامات في دراسة أهداف snoRNA.
يتم تقييد النهج المعتمدة على DNAzyme فقط من خلال تسلسل توافق الآراء موقع الانقسام17. 10-23 DNAzymes يمكن استخدامها لتحليل 2'-O-ميثيليشن فقط في موقف R من dinucleotide RY، في حين 8-17 DNAzymes تعترف بتعديل النيوكليوتيد الواقعة في المنبع من الغوانين. ونتيجة لذلك، لا يمكن تحليل التعديلات مثل 2'-O-methylation من النيوكليوتيد اتُهم في الدينوكليوتيدات غوانين-أدينين (GA)، وadenine-adenine (AA)، والبيريميدين-أدينين (YA) وبيريميدين بيريميدين (YY). وعلاوة على ذلك، ينبغي النظر في انخفاض كفاءة الانقسام المعتمد على DNAzyme12. على الرغم من أن بعض DNAzymes شق RNA تماما تقريبا (الشكل 3B)، والعديد من DNAzymes فقط جزئيا هضم أهدافها (الشكل 3B). قد تعتمد الكفاءة على التسلسل المحيط بموقع الانقسام. على سبيل المثال، قد تؤثر مناطق RNA مع امتدادات من نفس النيوكليوتيد على تحديد الموقع الصحيح للتسلسل النشط DNAzyme. وعلاوة على ذلك، قد مناطق RNA تشكيل بنية ثانوية قوية إعادة تهجين وقمع DNAzyme ملزمة للتسلسل المستهدف. للتغلب على هذه القضايا، يمكن تطبيق دورات التدفئة والتبريد من DNAzyme 10-23 والركيزة RNA18.
استخدمنا نهج DNAzyme للتحقيق 2'-O-ميثيليشن من rRNA. يمكن للمرء أيضا استخدام هذه التقنية لتحليل تعديلات الحمض النووي الريبي الأخرى، مثل N6-methyladenosine19. يمكن تحليل الحمض النووي الريبي، بسبب وفرة، عن طريق الكهربائي ويمكن تصور المنتجات الانقسام تحت ضوء الأشعة فوق البنفسجية. ومع ذلك، هذا لا ينطبق على RNAs أقل وفرة مثل RNA Polymerase II-المولدة الترميز RNAs (mRNA) وغير الترميز RNAs (ncRNA). لا يمكن الكشف عن هذه RNAs عادة مباشرة عن طريق تلطيخ الحمض النووي الريبي في هلام أغاروز أو polyacrylamide. في مثل هذه الحالات، يمكن تصور الانقسام المعتمد على DNAzyme عن طريق النشاف الشمالية، التي تم الكشف عنها بشكل غير مباشر من قبل PCR / PCR الكمية أو تحليلها من قبل PCR الكمية مع البوليمرات (على سبيل المثال، KlenTaq DNA Polymerase) قادرة على التمييز 2′-O-ميثيلاتد RNA من غير ميثيل الحمض النوويالريبي 20،21.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
نشكر مايا ويلسون وأنيكا ليني على القراءة النقدية للمخطوطة. وقد دعم هذا العمل زمالة السير هنري دايل التي اشترك في تمويلها صندوق ويلكوم الاستئماني والجمعية الملكية (200473/Z/16/Z).
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Acid phenol | SIGMA | P4682 | |
| Agarose | VWR | A2114 | |
| Ammonium acetate | SIGMA | A1542 | |
| Chlorophorm | Fisher scientific | 10293850 | |
| DNase/RNase free water | Fischer Scientific | 10526945 | |
| DNAzyme | Integrated DNA Technology | Custom oligo DNA | |
| EDTA | SIGMA | E9884 | |
| Ethanol Absolute | Fisher scientific | 10437341 | |
| Formaldehyde | Sigma | F8775 | |
| Formamide | sigma | F9037 | |
| Galactose | SIGMA | G0750 | |
| Gel Loading Dye | Thermo Fisher Scientific | R0611 | |
| Glucose | SIGMA | G7021 | |
| Glycogen | Thermo Fisher Scientific | R0561 | |
| HEPES | SIGMA | H3375 | |
| Isoamyl | SIGMA | W205702 | |
| KCl | SIGMA | P9333 | |
| MgCl2 | SIGMA | M8266 | |
| MnCl2 | SIGMA | 244589 | |
| MOPS | SIGMA | M1254 | |
| NaCl | SIGMA | S7653 | |
| Oxoid Peptone Bacteriological | Thermo Fisher Scientific | LP0037 | |
| Oxoid Yeast Extract Powder | Thermo Fisher Scientific | LP0021 | |
| RiboLock RNase Inhibitor (40 U/µL) | Thermo Fisher Scientific | EO0382 | |
| SDS | SIGMA | 74255 | |
| Sodium acetate trihydrate | SIGMA | S8625 | |
| SYBR Safe DNA Gel Stain | Thermo Fisher Scientific | S33102 | |
| Tris base | SIGMA | TRIS-RO | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 1.5 mL microtubes | Sarstedt | ||
| 152VR5C01M -80°C freezer | Thermo Fisher Scientific | ||
| 250 mL Erlenmeyer flasks | Cole-Parmer | ||
| 50 mL conical tubes | Sarstedt | ||
| Combicup VX200 vortex | Appleton Woods | ||
| DS-11 microspectrophotometer | Denovix | ||
| Electrophoresis chamber (20 cm tray) | SIGMA | ||
| FiveEasy F20 pH meter | Appleton Woods | ||
| Gel documentation system | Syngene | ||
| Heraeus Fresco 21 micro centrifuge | Fisher Scientific | ||
| Megafuge 8R centrifuge with rotator suitable for 50 mL conical tubes | Fisher Scientific | ||
| Mini Fuge Plus mini centrifuge | Starlab | ||
| Mixer HC thermal block | Starlab | ||
| OLS26 Shaking Water Bath | Grant | ||
| PowerPac power supplier | BioRad |
References
- Dieci, G., Preti, M., Montanini, B. Eukaryotic snoRNAs: a paradigm for gene expression flexibility. Genomics. 94 (2), 83-88 (2009).
- Watkins, N. J., Bohnsack, M. T. The box C/D and H/ACA snoRNPs: key players in the modification, processing and the dynamic folding of ribosomal RNA. Wiley Interdisciplinary Review RNA. 3 (3), 397-414 (2012).
- Kufel, J., Grzechnik, P. Small Nucleolar RNAs Tell a Different Tale. Trends in Genetics. , (2018).
- Li, T., Zhou, X., Wang, X., Zhu, D., Zhang, Y. Identification and characterization of human snoRNA core promoters. Genomics. 96 (1), 50-56 (2010).
- Jorjani, H., et al. An updated human snoRNAome. Nucleic Acids Research. 44 (11), 5068-5082 (2016).
- Hubbard, T. J., et al. Ensembl 2009. Nucleic Acids Research. 37 (Database issue), D690-D697 (2009).
- Makarova, J. A., Kramerov, D. A. SNOntology: Myriads of novel snoRNAs or just a mirage?. BMC Genomics. 12, 543 (2011).
- Yu, Y. T., Shu, M. D., Steitz, J. A. A new method for detecting sites of 2'-O-methylation in RNA molecules. RNA. 3 (3), 324-331 (1997).
- Decatur, W. A., Liang, X. H., Piekna-Przybylska, D., Fournier, M. J. Identifying effects of snoRNA-guided modifications on the synthesis and function of the yeast ribosome. Methods in Enzymology. 425, 283-316 (2007).
- Dong, Z. W., et al. RTL-P: a sensitive approach for detecting sites of 2'-O-methylation in RNA molecules. Nucleic Acids Research. 40 (20), e157 (2012).
- Birkedal, U., et al. Profiling of ribose methylations in RNA by high-throughput sequencing. Angewandte Chemie International Edition, England. 54 (2), 451-455 (2015).
- Buchhaupt, M., Peifer, C., Entian, K. D. Analysis of 2'-O-methylated nucleosides and pseudouridines in ribosomal RNAs using DNAzymes. Analytical Biochemistry. 361 (1), 102-108 (2007).
- Grzechnik, P., et al. Nuclear fate of yeast snoRNA is determined by co-transcriptional Rnt1 cleavage. Nature Communication. 9 (1), 1783 (2018).
- Piekna-Przybylska, D., Decatur, W. A., Fournier, M. J. New bioinformatic tools for analysis of nucleotide modifications in eukaryotic rRNA. RNA. 13 (3), 305-312 (2007).
- Schmitt, M. E., Brown, T. A., Trumpower, B. L. A rapid and simple method for preparation of RNA from Saccharomyces cerevisiae. Nucleic Acids Research. 18 (10), 3091-3092 (1990).
- Maden, B. E. Mapping 2'-O-methyl groups in ribosomal RNA. Methods. 25 (3), 374-382 (2001).
- Santoro, S. W., Joyce, G. F. A general purpose RNA-cleaving DNA enzyme. Proceedings of the National Academy of Science, U. S. A. 94 (9), 4262-4266 (1997).
- Hengesbach, M., Meusburger, M., Lyko, F., Helm, M. Use of DNAzymes for site-specific analysis of ribonucleotide modifications. RNA. 14 (1), 180-187 (2008).
- Sednev, M. V., et al. N(6) -Methyladenosine-Sensitive RNA-Cleaving Deoxyribozymes. Angewandte Chemie International Edition, England. 57 (6), 15117-15121 (2018).
- Aschenbrenner, J., Marx, A. Direct and site-specific quantification of RNA 2'-O-methylation by PCR with an engineered DNA polymerase. Nucleic Acids Research. 44 (8), 3495-3502 (2016).
- Lee, K. W., Bogenhagen, D. F. Assignment of 2'-O-methyltransferases to modification sites on the mammalian mitochondrial large subunit 16 S ribosomal RNA (rRNA). Journal of Biological Chemistry. 289 (36), 24936-24942 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved