Method Article
Днк-зависимый анализ rRNA 2'-O-Метилирования
В этой статье
Резюме
Здесь мы представляем протокол для DNAzyme-зависимого расщепления РНК. Это позволяет быстро и на основе места анализа РНК 2'-O-метилирования. Этот подход может быть использован для предварительной или крупной оценки активности сноРНА.
Аннотация
Направляющий ящик C/D малых нуклеолярных РНК (сноРНК) катализирует 2'-O-метилирование рибосомной и малой ядерной РНК. Тем не менее, большое количество сноРНН в высших эукариот может беспорядочно распознавать другие виды РНК и 2'-O-метилат несколько целей. Здесь мы предоставляем пошаговый путеводитель по быстрому и недорогостоящему анализу специфического сайта 2'-O-метилирования с использованием устоявого метода, использующего короткие олигонуклеотиды ДНК под названием DNAzymes. Эти фрагменты ДНК содержат каталитические последовательности, которые расщепляют РНК на конкретных консенсусных позициях, а также переменные гомологические руки, направляющие Днказим к своим целям РНК. Активность ДНАЗИМА тормозится 2-'O-метилированием нуклеотида, примыкающего к месту расщепления в РНК. Таким образом, DNAzymes, ограниченные только консенсусом расщепляемый последовательности, являются идеальными инструментами для быстрого анализа snoRNA-опосредованных РНК 2'-O-метилирования. Мы проанализировали snoRNA snR13- и snR47-управляемый 2'-O-метилирование 25S рибосомальной РНК в Saccharomyces cerevisiae, чтобы продемонстрировать простоту техники и предоставить подробный протокол для DNAzyme-зависимой анализа.
Введение
Изменения РНК играют важную роль в регуляции экспрессии генов. РНК 2'-O-метилирование и псевдоуридиляция, которые руководствуются полем C/D и коробкой H/ACA малых нуклеолярных РНК (snoRNAs) соответственно, защищают РНК от деградации и стабилизируют их структуры более высокого порядка1,2,3 . Цели сноРНК были определены главным образом в рибосомных РНК (РНК) и малых ядерных РНК (снРНК). Однако, в более высоких эукариот, Есть потенциально сотни snoRNA без назначенных функций, и некоторые из них могут распознавать несколько РНК1,4,5,6,7. Поэтому методы, позволяющие выявлять и анализмодификацить модификаций на основе сноРНК, являются важными инструментами в выявлении механизмов, регулирующих клеточные процессы.
Коробка C / D snoRNA-управляемый ориентир2'-O-метилирование сайт может быть идентифицирован биоинформатично и подтверждено экспериментально многими методами, в том числе RNase H-направленный расщепление, или сайт конкретных и генома всей методы, которые используют обратную транскрипцию в низких нуклеотидов (dNTPs) концентрация приблизится8,9,10,11. Эти методы очень чувствительны, но и трудоемким и дорогим, поэтому, не может быть пригодным для первоначального или быстрого тестирования. Один из самых простых и недорогих методов для выявления 2'-O-метилирования сайтов DNAzyme-зависимых РНК расщепления12. ДНКЗымы – это короткие, одноцепочечные и каталитически активные молекулы ДНК, способные к эндонуклелитатичному расщеплению РНК в определенных положениях. Они состоят из сохраненной и каталитически активной последовательности ядра и связывающих рук 5' и 3' составленных переменных последовательностей конструированных для гибридизации базой-сопряжением Watson-Crick к цели RNA (рисунок 1). Таким образом, 5' и 3' руки доставляют каталитическую последовательность к конкретному месту РНК. DNAzyme-зависимых декольте тормозится 2'-O-метилирование нуклеотида расположен непосредственно вверх по течению от расщепления сайта12,13. Это делает DNAzymes очень практичными инструментами для анализа предположенных или известных сайтов РНК 2'-O-метилирования.
Два типа DNAzymes используются для анализа рнковых модификаций12. Активная последовательность 10-23 DNAzyme(рисунок 1A) состоит из 15 нуклеотидов (5'RGGCTAGCTACAACGA3'), которые образуют петлю вокруг целевого РНК пурино-пиримидина (RY) динуклеотида и катализировать расщепление между этими двумя нуклеотидами. РНК пурина (R) не является базовым в паре с DNAzyme и 2'O-метилирование подарки на DNAzyme подавляет расщепление. Связывающие руки 10-23 DNAzymes обычно 10-15 нуклеотидов длиной. Второй класс DNAzyme, 8-17 DNAzymes(рисунок 1B) содержит 14-нуклеотидную каталитикическую последовательность (5'TCCGAGCCGGGA3'). Нуклеотиды C2,C3 и G4 пары с C9 G10 и G11 формирования короткой структуры стволовых петли. 8-17 DNAzymes расщеплять РНК вверх по течению любого гуанина, который несовершенно в паре с первым тиминым из DNAzyme активной последовательности. Нуклеотид РНК вверх по течению гуанина не является базовым в паре с DNAzyme и его 2'-O-метилирование ухудшает расщепление. 8-17 DNAzymes требуют более длинных рукояток гомологии около 20 нуклеотидов, чтобы направить DNAzyme к своей конкретной последовательности.
Здесь мы предоставляем пошаговый протокол для анализа 2'-O-метилирования rRNA в Saccharomyces cerevisiae с использованием 10-23 и 8-17 DNAzyme-зависимых подходов12,13 (Рисунок 1С). Этот протокол может быть легко адаптирован для других организмов и видов РНК и использоваться для быстрого, предварительного или крупного анализа специфической РНК 2'-O-метилирования.
протокол
1. Штаммы, СМИ и буфер Ные рецепты
- Подготовка дрожжей (S. cerevisiae) СМИ, как подробно здесь: YP (1% ж / V дрожжей экстракт, 2% ж / V бактериологический пептон), и глюкозы и галактоза запасов на 20% ж / V.
- Подготовьте буфер ацетата натрия (NaAc)-EDTA (AE), как описано здесь: 50 мМ NaAc pH 5.3 и 10 mM EDTA.
- Подготовка 10-23 DNAzyme 4x инкубационный буфер, как подробно здесь: 24 мм Tris рН 8,0, 60 мМ NaCl и 10-23 DNAzyme 4x Реакция буфера: 200 мм Tris pH 8,0 и 600 мм NaCl.
- Подготовка 8-17 DNAzyme 2x Реакция буфера, как подробно здесь: 200 мм KCl, 800 мм NaCl, 100 мм HEPES pH 7.0, 15 mM MgCl2, и 15 мм MCl2.
- Подготовьте 10x MOPS Buffer, как подробно здесь: 200 мМ MOPS, 50 мМ NaAc, 1 мМ EDTA; pH 7.0 и 1.5x Образец Денатурируя буфер: 50% v/v формамид, 20% v/v формальдегид, буфер 1.5x MOPS.
- Получить S. cerevisiae штаммов, BY4741 (MATa his3 '1 leu2 '0 met15 '0 ura3 '0); GAL1:SNR13 (как BY4741, но GAL1::SNR13:KANmX); GAL1:SNR47 (как BY4741, но GAL1::SNR47:HIS3mX). Любой другой штамм дрожжей может быть использован для этого анализа.
2. DNAzyme Дизайн
- Найти РНК последовательность интересов или ориентировоченный сайт метилирования с помощью соответствующей базы данных. Для целей S. cerevisiae snoRNA используйте базу данных дрожжей snoRNA: http://people.biochem.umass.edu/fournierlab/snornadb/mastertable.php14
- Чтобы найти интересующий метилирование, например, на сайте, зависящий от snR13, выберите "snR13" и сделайте примечание положение модифицированного нуклеотида (например, snR13-управляемый A2281 в 25S rRNA).
- Найдите последовательности вверх и вниз по течению модифицированного нуклеотида с помощью соответствующей базы данных. Для S. cerevisiae используйте базу данных генома Сахаромицес: https://www.yeastgenome.org/
- Поиск имени гена-мишени, например, RDN25 (кодирование 25S rRNA).
- Из вкладки "последовательность" выберите 10-15 нуклеотидов вверх по течению (5' рука) и вниз по течению (3 'рука) места метилирования при использовании 10-23 DNAzyme асссси и 20 нуклеотидов вверх по течению (5' рука) и вниз по течению (3'рука) сайта метилирования для 8-17 DNAzyme.
- Создавайте дополнительные последовательности 5' и 3' рук.
- Фланк 10-23 или 8-17 DNAzyme каталитическая последовательность с дополнительными последовательностями 5' и 3' оружия.
- Закажите DNAzyme как нормальный олигонуклеотид ДНК от поставщика.
3. С. cerevisiae Условия роста
ПРИМЕЧАНИЕ: S. cerevisiae BY4741 производные штамма были использованы, в котором выражение либо SNR13 или SNR47 snoRNA изгнан из индуцируемого GAL1 промоутер. Для того, чтобы вызвать или ингибировать их синтез, растут клетки на среде, содержащей галактозу(GAL1-зависимаятранскрипция на) или глюкозы(GAL1-зависимаятранскрипция). В качестве контроля используйте штамм дикого типа (BY4741), выращенный либо на галактозе, либо на глюкозе.
- Выращивайте дрожжевые штаммы в соответствующей среде и условиях. Для анализа GAL1::SNR13 и GAL1::SNR47 штаммов, а также изогенных диких штамм типа, растут клетки в 50 мл YP-носителей либо 2% глюкозы (YPD) или галактозы (YPGal) на 30 градусов по Цельсию до середины экспоненциальной фазы.
- Клетки центрифуги при 1000 х г,в течение 3 мин при 4 градусах Цельсия.
- Откажитесь от супернатанта и держите гранулы.
- Заморозить яточные гранулы в жидком азоте и хранить их при -80 градусах Цельсия.
ПРЕДЕКТО: Сжиженный азот может вызвать сильные криогенные ожоги. Всегда носите защитную одежду и применяйте меры предосторожности.
ПРИМЕЧАНИЕ: Пеллеты клеток могут храниться при -80 градусов по Цельсию до 1 месяца. Протокол может быть приостановлен здесь, если это необходимо.
4. Изоляция РНК15
ПРИМЕЧАНИЕ: Используйте наиболее подходящий метод для изоляции РНК. Для дрожжей S. cerevisiae,горячего фенола РНК экстракции могут быть использованы.
- Добавьте 1 мл ледяной воды, переплетайте гранулы и перенесите в микротрубки 1,5 мл.
- Центрифуга при 20000 х г на 10 с при 4 градусах Цельсия и удалить супернатант.
- Добавьте 400 qL буфера AE и переприостановите работу ячеек.
ПРИМЕЧАНИЕ: Шаги 4.4-4.15 выполняются при комнатной температуре, если не указано иное. - Добавьте 40 кл/ с 10% SDS и 400 л кислотного фенола (рН 4,5).
ПРЕДЕКТО: Фенол является токсичным и должны быть обработаны под дымом капот. Всегда носите лабораторное пальто, защитные перчатки и очки при работе с фенол. Утилизация отходов в соответствии с институциональными нормами. - Хорошо перемешать путем вихря на 20 с.
- Инкубировать при 65 градусах по Цельсию в течение 10 мин. Каждые 2 мин, осторожно открыть и закрыть трубку, чтобы освободить давление и перевернуть трубку 2-3 раза, чтобы смешать фазы.
- Перенесите трубки на -80 градусов и инкубировать в течение 10 мин.
- Разморозить трубки на скамейке и центрифуге при температуре 20 000 х г,в течение 5 минут при комнатной температуре.
- Перенесите верхнюю фазу в новую трубку, содержащую 400 кл. кислотный фенол: хлороформ:изоамиловый спирт (25:24:1). Не нарушайте межфазу.
ПРЕДЕКТО: Хлороформ является токсичным и должны быть обработаны под дымом капот. Всегда носите лабораторное пальто, защитные перчатки и очки при работе с хлороформом. Утилизация отходов в соответствии с институциональными нормами. - Хорошо перемешайте, завихряя 30 с и центрифуги при температуре 20 000 х г в течение 10 минут при комнатной температуре.
- Перенесите верхнюю фазу (400 евро) на новую трубку, содержащую 400 хлороформ.
- Хорошо перемешайте, завихряя 30 с и центрифуги при температуре 20 000 х г в течение 5 мин при комнатной температуре.
- Перенесите верхнюю фазу (300-350 л) на новую трубку, содержащую 1 мл EtOH и 40 л ацетата аммония 7,5 М (NH4AC). Смешайте, перевернув трубку несколько раз.
- Инкубировать при -80 градусах по Цельсию в течение 2 ч или на ночь при -20 градусах Цельсия.
ПРИМЕЧАНИЕ: Процедура может быть приостановлена здесь. - Центрифуга при 20 000 х г,в течение 10 мин при 4 градусах Цельсия. Небольшой белый рнк-гранулы станет видимым на дне трубки.
- Удалить EtOH путем pipetting, чтобы избежать нарушения гранулы.
- Добавьте 1 мл 70% EtOH и центрифугу при температуре 20 000 х г в течение 5 минут при комнатной температуре.
- Удалите 70% EtOH путем пипетки.
- Центрифуга при 20000 х г на 15 с и удалить оставшиеся EtOH с 2-20 л пипетка.
- Оставьте трубку открытой на скамейке в течение 5 минут, чтобы высушить гранулы РНК.
ПРИМЕЧАНИЕ: РНК-гранулы меняют свой цвет с белого на прозрачный при сухом. - Повторите рнк-гранулу в 30 Зл РЗА/DNase-free H2O, перенесите трубку немедленно на лед и измерьте концентрацию РНК на микроспектрофотометре.
- Заморозить образцы при -20 градусов по Цельсию.
ПРИМЕЧАНИЕ: РНК может храниться при -20 градусов до 1 месяца и при -80 градусов до 1 года. Процедура может быть приостановлена здесь или перейти непосредственно к следующему шагу.
5. ДНАЗИМе пищеварение
-
10-23 ДНАЗИМе пищеварения
- В 1,5 мл труб готовят инкубационную смесь, комбинируя 5 мкг РНК, 200 ммоль 10-23 ДНАЗИМ (2 л из 100 мм бульонного раствора) и 2,5 л 4x 10-23 Инкубационного буфера в общем объеме 10 мл. Держите трубки на льду.
- Перенесите трубки в сухой теплоблок, установленный при температуре 95 градусов по Цельсию, и инкубируйте в течение 3 мин.
- Перенесите трубки сразу на лед и инкубировать в течение 5 мин.
- Спин вниз кратко и положить трубки обратно на лед.
- Добавьте 20 U ингибитора RNase (например, ингибитор RiboLock RNase 0,5 л).
- Поместите трубки в сухой теплоблок, установленный на 25 градусов по Цельсию, и инкубируйте в течение 10 мин.
- В то же время, подготовить реакционную смесь в 1,5 л трубки, объединив 5 qL 4x 10-23 Реакция буфера с 4 ММ MgCl2 и 1 ЛЛ H2O. Поместите трубку в сухой блок установлен до 37 градусов по Цельсию.
- Перенесите инкубационную смесь в сухой теплоблок, установленный на 37 градусов по Цельсию, и добавьте 10 qL предварительно разогретой реакционной смеси.
- Инкубировать реакцию при 37 градусах по Цельсию в течение 1 ч.
- Перенесите трубки на лед и переходите к шагу 5.3.1.
-
8-17 ДНАЗИМе пищеварение
- Подготовьте микротрубку объемом 1,5 мл с 5 мкг РНК в общем объеме 6 л. Держите трубку на льду.
- Подготовьте микротрубку объемом 1,5 мл с 400 рмоль 8-17 DNAzyme (4 л из 100 мм). Держите трубку на льду.
- Перенесите трубки в сухой теплоблок, установленный на 95 градусов по Цельсию, и инкубируйте в течение 2 мин.
- Переместите образец РНК на лед.
- Спин вниз трубку с DNAzyme в течение 5 с и инкубировать при 25 кв КС в течение 10 минут.
- В то же время, подготовить трубку 1,5 мл с 10 л 2x 8-17 Реакция буфера и инкубировать при 25 градусов по Цельсию.
- Подготовка реакции смесь, добавив 10 л предварительно нагревается 2x Реакции буфера в трубку с DNAzyme.
- Передача 14 qL реакции смесь в трубку с РНК и добавить 20 U ингибитора RNase.
- Инкубировать реакцию при 25 градусах по Цельсию в течение 2 ч.
- Перенесите трубку на лед и приступите к очистке РНК (шаг 5.3.1).
-
Очищение РНК
- Добавьте в реакционную трубку 350 л/с воды и 400 л хлороформа, хорошо перемешайте путем вихря на 30 с и центрифуги при температуре 20 000 х г в течение 5 мин при комнатной температуре.
- Перенос верхней фазы (300-350 л) на новую трубку, содержащую 1 мл EtOH, 40 л 7,5 М НН4ac и 1 л гликогена (10 мкг/л). Смешайте, перевернув трубку несколько раз.
- Инкубировать при -80 градусах по Цельсию в течение 2 ч или на ночь при -20 градусах Цельсия.
ПРИМЕЧАНИЕ: Процедура может быть приостановлена здесь. - Повторите шаги от 4.15 до 4.21.
- Приостановите действие гранул РНК в 10 Зл RNase/DNase-free H2O и перенесите трубки немедленно на лед.
- Заморозить образцы при -20 градусов по Цельсию.
ПРИМЕЧАНИЕ: РНК может храниться при -20 градусов до месяца и при -80 градусов до 1 года. Процедура может быть приостановлена здесь или перейти к РНК электрофорез.
6. РНК Электрофорез
- Спрей электрофорез оборудования (танк, лоток, гребень) с 1% SDS, оставить на 15 мин и промыть с большим количеством dDH2O.
- Растворите 1,5 г агарозы в 127,5 мл дДГ2О, нагревая его в микроволновой печи.
- Добавьте в раствор агароза 15 мл 10-x MOPS и 7,5 мл 37% формальдегида (общий объем 150 мл).
ПРЕДЕКТО: Формальдегид является токсичным и должны быть обработаны под дымом капот. Всегда носите лабораторное пальто, защитные перчатки и очки при работе с формальдегидом. Утилизация отходов в соответствии с институциональными нормами. - Добавьте соответствующее количество гель-пятна по выбору в раствор агарозы (например, 15 зл sL пятна sYBR Safe DNA gel). Хорошо перемешать и залить агарозой к подносу.
- Вставьте гребень в гель немедленно.
- Оставьте его на 45 минут под капотом дыма. Обложка лоток с алюминиевой фольгой при использовании светочувствительных гель пятно.
- Подготовьте 600 мл 1x буфера MOPS.
-
Подготовка образца РНК
- В трубке 1,5 мл смешайте 10 л переваренного и очищенного образца РНК, 5 л образца буфера для денатурации и 0,5 л 6-x загрузки красителя.
ПРЕДЕКТО: Формамид токсичен и должен быть обработан под дымом капот. Всегда носите лабораторное пальто, защитные перчатки и очки при работе с формамидом. Утилизация отходов в соответствии с институциональными нормами. - Инкубировать образцы РНК при 70 градусах по Цельсию в течение 5 мин. Переложить пробы на лед. Инкубировать в течение 5 мин.
- Спин вниз кратко перед загрузкой на гель.
- В трубке 1,5 мл смешайте 10 л переваренного и очищенного образца РНК, 5 л образца буфера для денатурации и 0,5 л 6-x загрузки красителя.
- Положите гель в бак электрофорексис и заполнить с 1x MOPS буфера. Загрузите весь объем каждого образца (15 л) на гель. Запуск на 80 V до бромофенола синий достигает 2/3 от длины геля.
- Изображение геля с помощью изображения, подходящего для обнаружения выбранного пятна геля (например, УФ-трансиллюнкор).
Результаты
Полезность DNAzyme-зависимого расщепления в анализе модификаций RRNA была показана недавно в контексте созревания snoRNAs13. DNAzyme-зависимый ассс был использован, чтобы показать, что отсутствие 5'-конец предварительной сноРНК обработки влияет на 2'-O-метилирования уровней 25S и 18S rRNA в S. cerevisiae13.
Здесь мы использовали индуцируемую систему транскрипции snoRNA, чтобы продемонстрировать эффективность и простоту методики. Box C/D snR13 направляет метилирование на двух позициях в 25S rRNA, включая аденин 2281(рисунок 2A). Этот нуклеотид сопровождается uracil, который представляет собой консенсус динуклеотид (RY) cleavable по 10-23 DNAzyme. Box C/D snR47 также направляет метилирование двух нуклеотидов в 25S rRNA(рисунок 2B). Аденин в положении 2220 следует гуанина остатков и этот динуклеотид может быть расщепляется 8-17 DNAzyme. Для того, чтобы вызвать или ингибировать синтез snR13 или snR47 snoRNA, мы вставили индуцируемый промоутер GAL1 вверх по течению либо генов SNR13 или SNR47, а также культивируемые клетки в среде, содержащей галактозу (GAL1-зависимый транскрипции на) или глюкозы(GAL1-зависимойтранскрипции). Далее, РНК изолированы от GAL1::SNR13 клетки были инкубированы с 10-23 DNAzyme предназначен для расщепления 25S rRNA на snR13-зависимых сайте, между нуклеотидов 2281 и 2282 (Рисунок 2C). РНК от GAL1::SNR47 штамм был обработан с 8-17 DNAzyme ориентации snR47-зависимых сайт между нуклеотидов 2220 и 2221 (Рисунок 2D). В качестве контроля, РНК из дикого типа BY4741 штамм растет либо галактозы или глюкозы был инкубирован с обоих DNAzymes. Электрофорасиз DNAzyme-обработанных РНК показал, что 25S rRNA, извлеченные из GAL1::SNR13 и GAL1::SNR47 штаммов, растущих на галактозы (GAL) остались нетронутыми (Рисунок 3A,B; полосы 3). В отличие от этого, РНК, изолированная от GAL1::SNR13 и GAL1::SNR47 клетки, растущие на глюкозе (GLC) была переварена соответствующими DNAzymes(Рисунок 3A,B; полосы 4). В обоих случаях наблюдалось снижение диапазона 25S rRNA и наблюдались продукты расщепления 5' и 3' отсечения (A и B). Это указывает на то, что в GAL1::SNR13 и GAL1::SNR47 штаммов, 25S rRNA был 2'-O-метилированный на snR13- или snR47-управляемых сайтов, когда галактоза была использована в качестве источника углерода, и эти snoRNA были выражены. Отсутствие 25S rRNA метилирования, когда snR13 или snR47 выражение было выключено на глюкозу допускается для DNAzyme-зависимого расщепления. Никакого пищеварения РНК не наблюдалось для образцов дикого типа(рисунок 3A,B; полосы движения 1 и 2), так как выражение snR13 и snR47 является галактозой/глюкозой-независимым в этом штамме. Таким образом, рРНК, как правило, метилированные и так устойчивы к активности DNAzymes.
В целом, наш эксперимент показывает, что расщепление деятельности 10-23(рисунок 3A) и 8-17 (Рисунок 3B) DNAzymes коррелирует с отсутствием коробки C / D snR13 или snR47, четко указывая, что эти snoRNA несут ответственность за 25S rRNA 2'-O-метилирование на определенных участках.
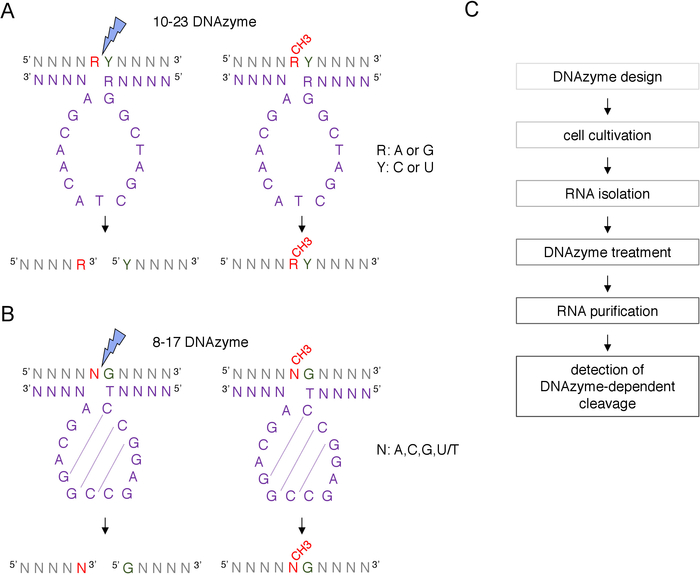
Рисунок 1: DNAzymes и их РНК субстраты. (A) 10-23 DNAzymes расщепйте пурино-пиримидиновы (RY) РНК динуклеотид. R в РНК не в паре с DNAzyme, в то время как Y дополняет базу R в DNAzyme. Метилирование пурина (R) в РНК подавляет DNAzyme-зависимых расщепления. (B) 8-17 DNAzymes расщеплять РНК вверх по течению гуанина, который несовершенно в паре с первым тимином в dNAzyme каталитического последовательности. Нуклеотид, предшествующий гуанину, не является парным, и его метилирование защищает от dNAzyme-зависимого расщепления. РНК показана серым цветом (кроме места метилирования), DNAzyme показан фиолетовым. N - любой нуклеотид, R и пурина: аденин или гуанин, Y й пиримидин: цитозин или uracil; CH3- обозначает метилирование РНК. Базовое сопряжение в рамках активных последовательностей DNAzyme характеризуется пунктирными линиями. Синяя молния отмечает место расщепления. (C) Диаграмма потока, показывающая шаги dNAzyme-зависимого анализа. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: DNAzymes ориентации snR13- и snR47-зависимых метилирования сайтов в 25S rRNA. (A, B) Браузер скриншоты показаны snR13-зависимых (A) и snR47-зависимых (B) метилирования сайтов в 25S rRNA (C) 25S rRNA последовательности окружающих snR13-зависимых метилирования сайта (A2281) и 10-23 DNAzyme (показано в фиолетовый) предназначен для расщеплять РНК междуA 2281 и U2282. A 2281 не сочетается с DNAzyme, в то время как U2282 образует пару с первым нуклеотидом из активной последовательности DNAzyme (отмеченсинее синей линией). Синяя молния отмечает расщепление. (D) 25S rRNA последовательность окружающих snR47-зависимых метилирования сайта (A2220) и 8-17 DNAzyme (показано в фиолетовый) предназначен для расщеплять РНК междуA 2220 и G2221. A 2220 не гибридизируется с DNAzyme, в то время как G2221 неидеально сочетается с тимином (обозначается с пунктирной линией). Синяя молния отмечает место расщепления. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Анализ конкретного участка 2'-O-метилирования 25S rRNA с использованием 10-23 и 8-17 DNAzyme-зависимых анализ. ()Анализ snR13-зависимого 25S rRNA метилирования с использованием 10-23 DNAzyme. (B) Анализ snR47-зависимого 25S rRNA метилирования с использованием 8-17 DNAzyme. РНК была визуализирована окрашивание в денатурный гель агарозы. Продукты расщепления A и B отмечены красными стрелками. WT - штамм дикого типа; ГАЛАктоза, ГЛК и глюкоза. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
ДНАЗИМ-зависимое пищеварение может быть использовано в качестве простого и быстрого метода для анализа специфической РНК 2'-O-метилирования12,13. DNAzymes расщеплять РНК, если нуклеотид вверх по течению от расщепления сайта не метилированный. В отличие от других подходов, включая RNase H-направленное пищеварение, щелочная деградация или обратная транскрипция в низкой концентрации нуклеотидов с последующим количественным ПЦР или секвенированием8,10,11 ,16, DNAzyme подход требует простой днк олигонуклеотида и основных реагентов, которые присутствуют в любой лаборатории молекулярной биологии. Кроме того, DNAzymes могут быть использованы аналогичным образом для анализа РНК псевдотурилигации опосредованно поле H / ACA snoRNA12, что делает их универсальными инструментами в изучении целей сноРН.
DNAzyme-зависимые подходы ограничены только последовательностями консенсуса сайта расщепления17. 10-23 DNAzymes могут быть использованы для анализа 2'-O-метилирования только в позиции R динуклеотида RY, в то время как 8-17 DNAzymes признают модификацию нуклеотида, расположенного вверх по течению гуанина. В результате, такие модификации, как 2'-O-метилирование первого нуклеотида в динуклеотидагуан-аденина (ГА), аденин-аденин (АА), пиримидин-аденин (YA) и пиримидин-пиримидин (YY) не могут быть проанализированы. Кроме того, следует учитывать низкую эффективность дислажа, зависящей отДНАЗим12. Хотя некоторые DNAzymes расщеплять РНК почти полностью (Рисунок 3B), многие DNAzymes лишь частично переварить свои цели(Рисунок 3B). Эффективность может зависеть от последовательности, окружающей место расщепления. Например, рнк-области с участками одного и того же нуклеотида могут повлиять на правильное позиционирование активной последовательности DNAzyme. Кроме того, рнк-регионы, формирующие сильную вторичную структуру, могут регибридизировать и подавлять привязку DNAzyme к целевой последовательности. Для преодоления этих проблем можно применитьциклынагрева и охлаждения 10-23 ДНАЗими и его РНК-субстрата.
Мы использовали подход DNAzyme для исследования 2'-O-метилирования рРНК. Можно также использовать этот метод для анализа других изменений РНК, таких как N 6-метиладенозин19. Рибосомальная РНК, из-за ее изобилия, может быть проанализирована с помощью электрофореза и декольте продукты могут быть визуализированы под ультрафиолетовым светом. Тем не менее, это не применимо для менее обильных РНК, таких как РНК-полимераза II генерируемых РНК кодирования РНК (мРНК) и некодирующих РНК (ncRNA). Эти РНК обычно не могут быть обнаружены непосредственно РНК окрашивания в агарозе или полиакриламид гели. В таких случаях, DNAzyme-зависимых расщепления может быть визуализирована Северной blotting, косвенно обнаружены ПЦР / количественные ПЦР или проанализированы количественными ПЦР с полимеразы (например, KlenTaq ДНК полимеразы), способных дискриминировать 2'O-метилированных РНК от неметилированная РНК20,21.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим Майю Уилсон и Анейку Лени за критическое прочтение рукописи. Эта работа была поддержана стипендией сэра Генри Дейла, совместно финансируемой Фондом Wellcome Trust и Королевским обществом (200473/No/16/)
Материалы
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Acid phenol | SIGMA | P4682 | |
| Agarose | VWR | A2114 | |
| Ammonium acetate | SIGMA | A1542 | |
| Chlorophorm | Fisher scientific | 10293850 | |
| DNase/RNase free water | Fischer Scientific | 10526945 | |
| DNAzyme | Integrated DNA Technology | Custom oligo DNA | |
| EDTA | SIGMA | E9884 | |
| Ethanol Absolute | Fisher scientific | 10437341 | |
| Formaldehyde | Sigma | F8775 | |
| Formamide | sigma | F9037 | |
| Galactose | SIGMA | G0750 | |
| Gel Loading Dye | Thermo Fisher Scientific | R0611 | |
| Glucose | SIGMA | G7021 | |
| Glycogen | Thermo Fisher Scientific | R0561 | |
| HEPES | SIGMA | H3375 | |
| Isoamyl | SIGMA | W205702 | |
| KCl | SIGMA | P9333 | |
| MgCl2 | SIGMA | M8266 | |
| MnCl2 | SIGMA | 244589 | |
| MOPS | SIGMA | M1254 | |
| NaCl | SIGMA | S7653 | |
| Oxoid Peptone Bacteriological | Thermo Fisher Scientific | LP0037 | |
| Oxoid Yeast Extract Powder | Thermo Fisher Scientific | LP0021 | |
| RiboLock RNase Inhibitor (40 U/µL) | Thermo Fisher Scientific | EO0382 | |
| SDS | SIGMA | 74255 | |
| Sodium acetate trihydrate | SIGMA | S8625 | |
| SYBR Safe DNA Gel Stain | Thermo Fisher Scientific | S33102 | |
| Tris base | SIGMA | TRIS-RO | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 1.5 mL microtubes | Sarstedt | ||
| 152VR5C01M -80°C freezer | Thermo Fisher Scientific | ||
| 250 mL Erlenmeyer flasks | Cole-Parmer | ||
| 50 mL conical tubes | Sarstedt | ||
| Combicup VX200 vortex | Appleton Woods | ||
| DS-11 microspectrophotometer | Denovix | ||
| Electrophoresis chamber (20 cm tray) | SIGMA | ||
| FiveEasy F20 pH meter | Appleton Woods | ||
| Gel documentation system | Syngene | ||
| Heraeus Fresco 21 micro centrifuge | Fisher Scientific | ||
| Megafuge 8R centrifuge with rotator suitable for 50 mL conical tubes | Fisher Scientific | ||
| Mini Fuge Plus mini centrifuge | Starlab | ||
| Mixer HC thermal block | Starlab | ||
| OLS26 Shaking Water Bath | Grant | ||
| PowerPac power supplier | BioRad |
Ссылки
- Dieci, G., Preti, M., Montanini, B. Eukaryotic snoRNAs: a paradigm for gene expression flexibility. Genomics. 94 (2), 83-88 (2009).
- Watkins, N. J., Bohnsack, M. T. The box C/D and H/ACA snoRNPs: key players in the modification, processing and the dynamic folding of ribosomal RNA. Wiley Interdisciplinary Review RNA. 3 (3), 397-414 (2012).
- Kufel, J., Grzechnik, P. Small Nucleolar RNAs Tell a Different Tale. Trends in Genetics. , (2018).
- Li, T., Zhou, X., Wang, X., Zhu, D., Zhang, Y. Identification and characterization of human snoRNA core promoters. Genomics. 96 (1), 50-56 (2010).
- Jorjani, H., et al. An updated human snoRNAome. Nucleic Acids Research. 44 (11), 5068-5082 (2016).
- Hubbard, T. J., et al. Ensembl 2009. Nucleic Acids Research. 37 (Database issue), D690-D697 (2009).
- Makarova, J. A., Kramerov, D. A. SNOntology: Myriads of novel snoRNAs or just a mirage?. BMC Genomics. 12, 543 (2011).
- Yu, Y. T., Shu, M. D., Steitz, J. A. A new method for detecting sites of 2'-O-methylation in RNA molecules. RNA. 3 (3), 324-331 (1997).
- Decatur, W. A., Liang, X. H., Piekna-Przybylska, D., Fournier, M. J. Identifying effects of snoRNA-guided modifications on the synthesis and function of the yeast ribosome. Methods in Enzymology. 425, 283-316 (2007).
- Dong, Z. W., et al. RTL-P: a sensitive approach for detecting sites of 2'-O-methylation in RNA molecules. Nucleic Acids Research. 40 (20), e157 (2012).
- Birkedal, U., et al. Profiling of ribose methylations in RNA by high-throughput sequencing. Angewandte Chemie International Edition, England. 54 (2), 451-455 (2015).
- Buchhaupt, M., Peifer, C., Entian, K. D. Analysis of 2'-O-methylated nucleosides and pseudouridines in ribosomal RNAs using DNAzymes. Analytical Biochemistry. 361 (1), 102-108 (2007).
- Grzechnik, P., et al. Nuclear fate of yeast snoRNA is determined by co-transcriptional Rnt1 cleavage. Nature Communication. 9 (1), 1783 (2018).
- Piekna-Przybylska, D., Decatur, W. A., Fournier, M. J. New bioinformatic tools for analysis of nucleotide modifications in eukaryotic rRNA. RNA. 13 (3), 305-312 (2007).
- Schmitt, M. E., Brown, T. A., Trumpower, B. L. A rapid and simple method for preparation of RNA from Saccharomyces cerevisiae. Nucleic Acids Research. 18 (10), 3091-3092 (1990).
- Maden, B. E. Mapping 2'-O-methyl groups in ribosomal RNA. Methods. 25 (3), 374-382 (2001).
- Santoro, S. W., Joyce, G. F. A general purpose RNA-cleaving DNA enzyme. Proceedings of the National Academy of Science, U. S. A. 94 (9), 4262-4266 (1997).
- Hengesbach, M., Meusburger, M., Lyko, F., Helm, M. Use of DNAzymes for site-specific analysis of ribonucleotide modifications. RNA. 14 (1), 180-187 (2008).
- Sednev, M. V., et al. N(6) -Methyladenosine-Sensitive RNA-Cleaving Deoxyribozymes. Angewandte Chemie International Edition, England. 57 (6), 15117-15121 (2018).
- Aschenbrenner, J., Marx, A. Direct and site-specific quantification of RNA 2'-O-methylation by PCR with an engineered DNA polymerase. Nucleic Acids Research. 44 (8), 3495-3502 (2016).
- Lee, K. W., Bogenhagen, D. F. Assignment of 2'-O-methyltransferases to modification sites on the mammalian mitochondrial large subunit 16 S ribosomal RNA (rRNA). Journal of Biological Chemistry. 289 (36), 24936-24942 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены