Method Article
Análisis dependiente de DNAzyme de rRNA 2'-O-Methylation
En este artículo
Resumen
Aquí presentamos un protocolo para el escote dependiente de DNAzyme de ARN. Esto permite un análisis rápido y dependiente del sitio del ARN 2'-O-metilación. Este enfoque se puede utilizar para la evaluación preliminar o importante de la actividad del esnoRNA.
Resumen
La caja guía C/D pequeños ARN nucleolares (snoRNAs) cataliza 2'-O-metilación de ARN ribosomal y pequeño nuclear. Sin embargo, un gran número de esnoRNA en eucariotas más altas pueden reconocer promiscuamente otras especies de ARN y objetivos múltiples de 2'-O-metilato. Aquí, proporcionamos una guía paso a paso para el análisis rápido y no costoso de la 2'-O-metilación específica del sitio utilizando un método bien establecido que emplea oligonucleótidos de ADN cortos llamados DNAzymes. Estos fragmentos de ADN contienen secuencias catalíticas que ensantan el ARN en posiciones de consenso específicas, así como brazos de homología variable que dirigen DNAzyme a sus objetivos de ARN. La actividad de DNAzyme se inhibe por 2-'O-metilación del nucleótido adyacente al sitio de escisión en el ARN. Por lo tanto, los DNAzymes, limitados únicamente por el consenso de la secuencia de cleaved, son herramientas perfectas para el análisis rápido del ARN 2'-O-metilación mediado por el ARN del ARN snoRNA. Analizamos el snoRNA snR13- y snR47-guided 2'-O-methylation de 25S ribosomal RNA en Saccharomyces cerevisiae para demostrar la simplicidad de la técnica y proporcionar un protocolo detallado para el ensayo dependiente de DNAzyme.
Introducción
Las modificaciones del ARN desempeñan un papel importante en la regulación de la expresión génica. ARN 2'-O-metilación y pseudouridilación, que se guían por la caja C/D y la caja H/ACA pequeños ARN nucleolares (snoARN) respectivamente, protegen el ARN de la degradación y estabilizan sus estructuras de orden superior1,2,3 . Los objetivos de snoRNA se han identificado principalmente en ARN ribosomales (ARR) y arn a pequeñas nucleares (ARN). Sin embargo, en eucariotas más altas, hay potencialmente cientos de snoRNA sin funciones asignadas y algunos de ellos pueden reconocer múltiples ARN1,4,5,6,7. Por lo tanto, los métodos que permiten la identificación y el análisis de modificaciones guiadas por el snoRNA son herramientas importantes para descubrir mecanismos que rigen los procesos celulares.
Un sitio putativo 2'-O-metilación guiado por snoRNA C/D de caja puede ser identificado bioinformáticamente y confirmado experimentalmente por muchas técnicas, incluyendo el escote dirigido por RNase H, o métodos específicos del sitio y de todo el genoma, que emplean transcripción inversa en nucleótidos bajos (dNTP) enfoque de concentración8,9,10,11. Estas técnicas son muy sensibles pero también laboriosas y costosas, por lo tanto, pueden no ser adecuadas para las pruebas iniciales o rápidas. Uno de los métodos más simples y de bajo costo para identificar sitios de 2'-O-metilación es el escisión de ARN dependiente de DNAzyme12. Los DNAzymes son moléculas de ADN cortas, de una sola cadena y catalíticamente activas capaces de escote endonucleólitico del ARN en posiciones específicas. Consisten en una secuencia de núcleo conservada y catalíticamente activa y brazos de unión de 5' y 3' compuestos de secuencias variables diseñadas para hibridar por Watson-Crick el emparejamiento base con el objetivo de ARN(Figura 1). Por lo tanto, los brazos de 5' y 3' entregan la secuencia catalítica al sitio específico del ARN. El escote dependiente del DNAzyme se inhibe mediante la 2'-O-metilación del nucleótido situado directamente aguas arriba del sitio de escisión12,13. Esto hace que DNAzymes herramientas muy prácticas para el análisis de sitios putativos o conocidos de ARN 2'-O-metilación.
Se utilizan dos tipos de DNAzymes para los análisis de modificaciones de ARN12. La secuencia activa de 10-23 DNAzyme(Figura 1A)consta de 15 nucleótidos (5'RGGCTAGCTACAACGA3') que forman un bucle alrededor del dinucleótido de rnapurina-pirimidina (RY) objetivo y catalizan la escisión entre estos dos nucleótidos. La purina de ARN (R) no está emparejada con la base con el DNAzyme y la 2'-O-metilación presente en el DNAzyme inhibe el escote. Los brazos de unión de 10-23 DNAzymes suelen tener 10-15 nucleótidos de largo. La segunda clase DNAzyme, 8-17 DNAzymes(Figura 1B)contiene una secuencia catalítica de 14 nucleótidos (5'TCCGAGCCGGACGA3'). Los nucleótidos C2,C3 y G4 se emparejan con C9 G10 y G11 formando una estructura corta de bucle de tallo. 8-17 DNAzymes cleave ARN aguas arriba de cualquier guanina que se empareje imperfectamente con la primera timina de la secuencia activa DNAzyme. El nucleótido de ARN aguas arriba de la guanina no está emparejado con la base con DNAzyme y su 2'-O-metilación afecta el escote. 8-17 DNAzymes requieren brazos de homología más largos de alrededor de 20 nucleótidos para dirigir DNAzyme a su secuencia específica.
Aquí, proporcionamos un protocolo paso a paso para el análisis de 2'-O-metilación de rRNA en Saccharomyces cerevisiae utilizando 10-23 y 8-17 enfoques dependientes de DNAzyme12,13 (Figura 1C). Este protocolo se puede adaptar fácilmente para otros organismos y especies de ARN y emplearse para los análisis rápidos, preliminares o importantes del ARN 2'-O-metilación específico del sitio.
Protocolo
1. Las cepas, los medios de comunicación y las recetas de búfer
- Preparar los medios de levadura (S. cerevisiae) como se detalla aquí: YP (1% p/v extracto de levadura, 2% pandto bacteriológico w/v), y las reservas de glucosa y galactosa al 20% p/v.
- Prepare el tampón EDTA (AE) de acetato de sodio (NaAc)-EDTA (AE) como se detalla aquí: 50 mM NaAc pH 5.3 y 10 mM EDTA.
- Preparar 10-23 DNAzyme 4x Tampón de incubación como se detalla aquí: 24 mM Tris pH 8.0, 60 mM NaCl y 10-23 DNAzyme 4x Búfer de reacción: 200 mM Tris pH 8.0 y 600 mM NaCl.
- Preparar 8-17 DNAzyme 2x Búfer de reacción como se detalla aquí: 200 mM KCl, 800 mM NaCl, 100 mM HEPES pH 7.0, 15 mM MgCl2y 15 mM MnCl2.
- Prepare 10x MOPS Buffer como se detalla aquí: 200 mM MOPS, 50 mM NaAc, 1 mM EDTA; pH 7.0 y 1.5x Búfer de desnaturalización de muestras: 50% v/v formamida, 20% v/v formaldehyde, 1.5x búfer MOPS.
- Obtener cepas de S. cerevisiae, BY4741 (MATa his3 s1 leu20 met15 0 ura30); GAL1::SNR13 (como BY4741 pero GAL1::SNR13:KANmX); GAL1::SNR47 (como BY4741 pero GAL1::SNR47:HIS3mX). Cualquier otra cepa de levadura se puede utilizar para este análisis.
2. Diseño DNAzyme
- Encuentre la secuencia de ARN de interés o el sitio de metilación putativa utilizando una base de datos apropiada. Para los objetivos de snoRNA de S. cerevisiae, utilice la base de datos de snoRNA de levadura: http://people.biochem.umass.edu/fournierlab/snornadb/mastertable.php14
- Para encontrar el sitio de metilación de interés, por ejemplo, el sitio dependiente de snR13, seleccione "snR13" y tome nota de la posición del nucleótido modificado (por ejemplo, snR13-guiado A2281 en 25S rRNA).
- Encuentre secuencias aguas arriba y aguas abajo del nucleótido modificado utilizando la base de datos adecuada. Para S. cerevisiae, utilice la base de datos del genoma de Saccharomyces: https://www.yeastgenome.org/
- Busque el nombre del gen objetivo, por ejemplo, RDN25 (codificación 25S rRNA).
- En la pestaña "secuencia", seleccione 10-15 nucleótidos aguas arriba (5' brazo) y aguas abajo (3 'brazo) del sitio de metilación cuando utilice un ensayo DNAzyme 10-23 y 20 nucleótidos aguas arriba (5' brazo) y aguas abajo (3'brazo) del sitio de metilación para un DNAzyme 8-17.
- Crea secuencias complementarias de brazos de 5' y 3'.
- Flanqueado 10-23 u 8-17 DNAzyme secuencia catalítica con secuencias complementarias de 5' y 3' brazos.
- Ordene DNAzyme como un oligonucleótido de ADN normal del proveedor.
3. Condiciones de crecimiento de S. cerevisiae
NOTA: Se utilizaron derivados de cepa S. cerevisiae BY4741, en los que la expresión del esnoRNA SNR13 o SNR47 es impulsada por el promotor INducible GAL1. Con el fin de inducir o inhibir su síntesis, cultivar células en medio que contiene galactosa (transcripción dependientede GAL1en) o glucosa ( transcripción dependientede GAL1desactivada). Como control, utilice la cepa de tipo silvestre (BY4741) cultivada ya sea con galactosa o glucosa.
- Cultivar cepas de levadura en un medio y condiciones adecuados. Para analizar las cepas GAL1::SNR13 y GAL1::SNR47, así como la cepa de tipo silvestre isogénico, crecen células en 50 ml de medios YP con 2% de glucosa (YPD) o galactosa (YPGal) a 30 oC a la fase exponencial media.
- Células centrífugas a 1.000 x g,durante 3 min a 4oC.
- Deseche el sobrenadante y contense los pellets.
- Congele los gránulos de células en nitrógeno líquido y guárdelos a -80 oC.
PRECAUCION: El nitrógeno líquido puede causar quemaduras criogénicas graves. Use siempre ropa protectora y precauciones de seguridad para el ejercicio.
NOTA: Los pellets celulares se pueden almacenar a -80 oC hasta 1 mes. El protocolo se puede pausar aquí si es necesario.
4. Aislamiento de ARN15
NOTA: Utilice el método más adecuado para aislar el ARN. Para la levadura S. cerevisiae,se puede utilizar la extracción de ARN de fenol caliente.
- Añadir 1 ml de agua helada, resuspender los pellets y transferir células resuspendidas a microtubos de 1,5 ml.
- Centrifugar a 20.000 x g durante 10 s a 4oC y retirar el sobrenadante.
- Agregue 400 l de búfer AE y vuelva a suspender las celdas.
NOTA: Los pasos 4.4-4.15 se realizan a temperatura ambiente a menos que se indique lo contrario. - Añadir 40 oL de 10% de SDS y 400 l de fenol ácido (pH 4,5).
PRECAUCION: El fenol es tóxico y debe manipularse bajo una campana de humo. Use siempre una capa de laboratorio, guantes de protección y gafas cuando trabaje con fenol. Deseche los residuos de acuerdo con la normativa institucional. - Mezclar bien por vórtice para 20 s.
- Incubar a 65oC durante 10 min. Cada 2 minutos, abra y cierre suavemente el tubo para liberar la presión y voltear el tubo 2-3 veces para mezclar las fases.
- Transfiera los tubos a -80 oC e incubar durante 10 min.
- Descongelar los tubos en el banco y centrifugar a 20.000 x g,durante 5 min a temperatura ambiente.
- Transfiera la fase superior a un nuevo tubo que contenga 400 l de ácido fenol:cloroformo:alcohol isoamilo (25:24:1). No interrumpa la interfase.
PRECAUCION: El cloroformo es tóxico y debe manipularse bajo una campana extractora. Use siempre una capa de laboratorio, guantes de protección y gafas cuando trabaje con cloroformo. Deseche los residuos de acuerdo con las regulaciones institucionales. - Mezclar bien por vórtice para 30 s y centrífuga a 20.000 x g durante 10 min a temperatura ambiente.
- Transfiera la fase superior (400 l) a un tubo nuevo que contenga cloroformo de 400 ml.
- Mezclar bien por vórtice para 30 s y centrífuga a 20.000 x g durante 5 min a temperatura ambiente.
- Transfiera la fase superior (300-350 l) a un tubo nuevo que contenga 1 ml de EtOH y 40 ml de acetato de amonio de 7,5 M (NH4AC). Mezcle girando el tubo un par de veces.
- Incubar a -80oC durante 2 h o durante la noche a -20oC.
NOTA: El procedimiento se puede pausar aquí. - Centrífuga a 20.000 x g,durante 10 min a 4oC. Un pequeño pellet de ARN blanco se hará visible en la parte inferior del tubo.
- Retire EtOH pipeteando para evitar perturbar el pellet.
- Añadir 1 ml de 70% EtOH y centrifugar a 20.000 x g durante 5 min a temperatura ambiente.
- Retire 70% EtOH mediante pipeteo.
- Centrifugar a 20.000 x g durante 15 s y retirar el EtOH restante con una pipeta de 2-20 ml.
- Deje el tubo abierto en el banco durante 5 minutos para secar el pellet de ARN.
NOTA: El pellet de ARN cambia su color de blanco a transparente cuando se seca. - Resuspenda el pellet de ARN en 30 ml de H2O libre de RNase/DNase, transfiera el tubo inmediatamente sobre el hielo y mida la concentración de ARN en el microespectrofotómetro.
- Congele las muestras a -20 oC.
NOTA: El ARN se puede almacenar a -20 oC hasta 1 mes y a -80 oC hasta 1 año. El procedimiento se puede pausar aquí o continuar directamente con el siguiente paso.
5. Digestión DNAzyme
-
10-23 Digestión DNAzyme
- En los tubos de 1,5 ml se prepara una mezcla de incubación combinando 5 g de ARN, 200 pmol de 10-23 DNAzyme (2 l de solución de caldo de 100 mM) y 2,5 ml de 4x 10-23 Incubación Tampón en un volumen total de 10 l. Mantener los tubos en hielo.
- Transfiera los tubos a un bloque de calor seco a 95 oC e incubar durante 3 min.
- Transfiera los tubos inmediatamente sobre hielo e incubar durante 5 min.
- Gire brevemente y vuelva a poner los tubos en el hielo.
- Añadir 20 U de inhibidor de la RNase (p. ej., inhibidor de la ribolock rnalosa de 0,5 l).
- Colocar los tubos en un bloque de calor seco para 25 oC e incubar durante 10 minutos.
- Mientras tanto, prepare una mezcla de reacción en un tubo de 1,5 l combinando 5 ml de tampón de reacción de 4x 10-23 con 4 ml de MgCl2 y 1 l De2O. Coloque el tubo en un bloque seco ajustado a 37 oC.
- Transfiera la mezcla de incubación a un bloque de calor seco ajustado a 37 oC y añada 10 ml de mezcla de reacción precalentada.
- Incubar la reacción a 37oC durante 1 h.
- Transfiera los tubos sobre hielo y proceda al paso 5.3.1.
-
8-17 Digestión DNAzyme
- Preparar un microtubo de 1,5 ml con 5 g de ARN en un volumen total de 6 l. Mantener el tubo sobre hielo.
- Preparar un microtubo de 1,5 ml con 400 pmol de 8-17 DNAzyme (4 l de 100 mM de stock). Mantenga el tubo en hielo.
- Transfiera los tubos a un bloque de calor seco para 95 oC e incubar durante 2 min.
- Mueva la muestra de ARN sobre hielo.
- Girar por el tubo con DNAzyme durante 5 s e incubar a 25 oC durante 10 min.
- Al mismo tiempo, prepare un tubo de 1,5 ml con 10 ml de 2x 8-17 Tampón de reacción e incubar a 25 oC.
- Preparar una mezcla de reacción añadiendo 10 ml de búfer de reacción precalentado 2x al tubo con DNAzyme.
- Transfiera 14 s de la mezcla de reacción al tubo con ARN y agregue 20 U de inhibidor de la RNase.
- Incubar la reacción a 25oC durante 2 h.
- Transfiera el tubo sobre hielo y proceda a la purificación del ARN (paso 5.3.1).
-
Purificación de ARN
- Añadir 350 s de agua y 400 l de cloroformo al tubo de reacción, mezclar bien por vórtice durante 30 s y centrifugar a 20.000 x g durante 5 min a temperatura ambiente.
- Transfiera la fase superior (300-350 l) a un tubo nuevo que contenga 1 ml de EtOH, 40 ml de 7,5 M NH4CA y 1 l de glucógeno (10 g/l). Mezcle girando el tubo un par de veces.
- Incubar a -80oC durante 2 h o durante la noche a -20oC.
NOTA: El procedimiento se puede pausar aquí. - Repita los pasos de 4.15 a 4.21.
- Resuspenda el pellet de ARN en 10 ml de RNase/DNase-free H2O y transfiera los tubos inmediatamente sobre hielo.
- Congele las muestras a -20 oC.
NOTA: El ARN se puede almacenar a -20 oC hasta un mes y a -80 oC hasta 1 año. El procedimiento se puede pausar aquí o proceder a la electroforesis de ARN.
6. Electroforesis de ARN
- Rocíe el equipo de electroforesis (tanque, bandeja, peine) con 1% de SDS, deje durante 15 minutos y enjuague con abundante ddH2O.
- Disolver 1,5 g de agarosa en 127,5 ml de ddH2O calentándola en el microondas.
- Añadir 15 ml de 10x MOPS y 7,5 mL de 37% de formaldehído a la solución de agarosa (el volumen total es de 150 ml).
PRECAUCION: El formaldehído es tóxico y debe manipularse bajo una campana extractora. Use siempre un abrigo de laboratorio, guantes de protección y gafas cuando trabaje con formaldehyde. Deseche los residuos de acuerdo con las regulaciones institucionales. - Añadir una cantidad adecuada de una mancha de gel de elección a la solución de agarosa (por ejemplo, 15 l de mancha de gel SYBR Safe DNA). Mezclar bien y verter la agarosa a la bandeja.
- Inserte un peine en el gel inmediatamente.
- Déjalo durante 45 minutos bajo la campana de humos. Cubra la bandeja con papel de aluminio cuando utilice una mancha de gel sensible a la luz.
- Prepare 600 ml de 1 búfer MOPS 1x.
-
Preparación de la muestra de ARN
- En un tubo de 1,5 ml, combine 10 ml de la muestra de ARN digerido y purificado, 5 ml de tampón de desnaturalización de muestras y 0,5 ml de tinte de carga de 6x.
PRECAUCION: Formamida es tóxica y debe manipularse bajo una campana de humo. Use siempre un abrigo de laboratorio, guantes de protección y gafas cuando trabaje con formamida. Deseche los residuos de acuerdo con las regulaciones institucionales. - Incubar muestras de ARN a 70 oC durante 5 min. Transfiera las muestras sobre hielo. Incubar durante 5 min.
- Gire hacia abajo brevemente antes de cargar en el gel.
- En un tubo de 1,5 ml, combine 10 ml de la muestra de ARN digerido y purificado, 5 ml de tampón de desnaturalización de muestras y 0,5 ml de tinte de carga de 6x.
- Coloque el gel en el tanque de electroforesis y llene con 1 búfer MOPS. Cargue todo el volumen de cada muestra (15 l) en el gel. Correr a 80 V hasta que el azul bromofenol alcance 2/3 de la longitud del gel.
- Imagen del gel utilizando un imager apropiado para detectar la mancha de gel elegida (por ejemplo, transiluminador UV).
Resultados
La utilidad del escote dependiente de DNAzyme en el análisis de las modificaciones de RRNA se ha demostrado recientemente en el contexto de la maduración de los snoRNA13. El ensayo dependiente de DNAzyme se utilizó para mostrar que la falta de procesamiento previo al ARN5'-end afecta a los niveles de 2'-O-metilación de 25S y 18S rRNA en S. cerevisiae13.
Aquí, utilizamos un sistema de transcripción de snoRNA inducible para demostrar la eficacia y simplicidad de la técnica. El recuadro C/D snR13 guía la metilación en dos posiciones en 25S rRNA, incluida la adenina 2281(Figura 2A). Este nucleótido es seguido por uracil, que constituye el consenso dinucleótido (RY) escleable por un DNAzyme 10-23. El recuadro C/D snR47 también guía la metilación de dos nucleótidos en arNM 25S(Figura 2B). La adenina en la posición 2220 es seguida por un residuo de guanina y este dinucleótido puede ser cebado por un 8-17 DNAzyme. Con el fin de inducir o inhibir la síntesis de snR13 o snR47 snoRNA, insertamos el promotor GAL1 inducible aguas arriba de los genes SNR13 o SNR47 y células cultivadas en medios que contienen galactosa(dependiente de GAL1 transcripción en) o glucosa (transcripción dependiente deGAL1desactivada). A continuación, el ARN aislado de las células GAL1::SNR13 se incubaron con 10-23 DNAzyme diseñado para cleave 25S rRNA en el sitio dependiente de snR13, entre los nucleótidos 2281 y 2282(Figura 2C). ARN de GAL1::SNR47 cepa fue tratada con 8-17 DNAzyme apuntando a snR47-dependiente del sitio entre nucleótidos 2220 y 2221(Figura 2D). Como control, el ARN de la cepa by4741 de tipo salvaje que crece en galactosa o glucosa se incubaba con ambos DNAzymes. La electroforesis del ARN tratado con DNAzyme reveló que las cepas de rRNA 25S extraídas de las cepas GAL1::SNR13 y GAL1::SNR47 que crecen en galactosa (GAL) permanecieron intactas(Figura 3A,B; carriles 3). Por el contrario, el ARN aislado de las células GAL1::SNR13 y GAL1::SNR47 que crecen sobre glucosa (GLC) fue digerido por dNAzymes respectivos(Figura 3A,B;carriles 4). En ambos casos, la banda de rRNA 25S disminuyó y se observaron productos de escote de corte de 5' y 3' (A y B). Esto indica que en las cepas GAL1::SNR13 y GAL1::SNR47, 25S rRNA fue 2'-O-metilado en sitios guiados por snR13- o snR47 cuando se utilizó la galactosa como fuente de carbono y estos snoRNA se expresaron. La falta de metilación de ARNm 25S cuando la expresión snR13 o snR47 se apagó en la glucosa permitida para el escote dependiente de DNAzyme. No se observó digestión de ARN para muestras de tipo silvestre(Figura 3A,B; carriles 1 y 2), ya que la expresión de snR13 y snR47 es independiente de la galactosa/glucosa en esta cepa. Por lo tanto, el RRNA era normalmente metilado y tan resistente a la actividad de DNAzymes.
En general, nuestro experimento muestra que la actividad de escisión de 10-23(Figura 3A)y 8-17(Figura 3B) DNAzymes se correlacionó con la ausencia de caja C/D snR13 o snR47, lo que indica claramente que estos snoRNA son responsables de 25S rRNA 2'-O-metilación en sitios particulares.
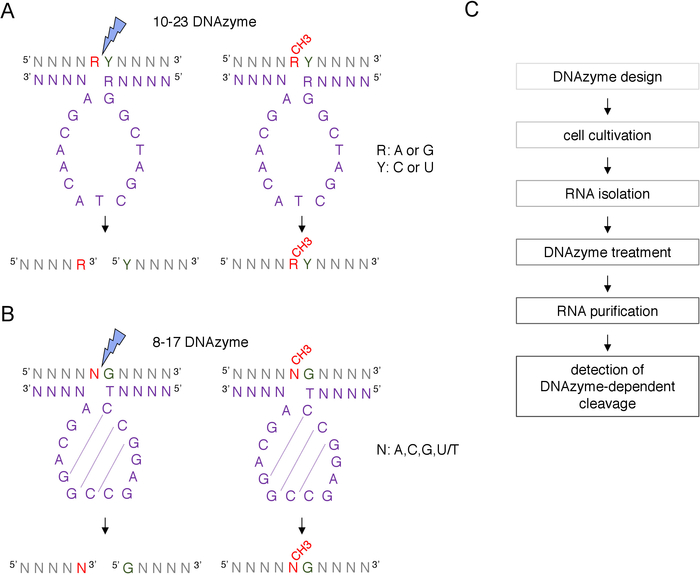
Figura 1: DNAzymes y sus sustratos de ARN. (A) 10-23 DNAzymes separan un dinucleótido de ARN de purina-pirimidina (RY). R en el ARN no se empareja con DNAzyme, mientras que Y es complementario a la base R en el DNAzyme. La metilación de la purina (R) en el ARN suprime el escote dependiente de DNAzyme. (B) 8-17 DNAzymes cleave ARN aguas arriba de la guanina que se empareja imperfectamente con la primera timina en la secuencia catalítica DNAzyme. El nucleótido anterior a la guanina no está emparejado y su metilación protege del escote dependiente de DNAzyme. El ARN se muestra en gris (aparte del sitio de metilación), DNAzyme se muestra en púrpura. N - cualquier nucleótido, R á purina: adenina o guanina, Y - pirimidina: citosina o uracilo; CH3- denota la metilación del ARN. El emparejamiento base dentro de las secuencias activas de DNAzyme se marca mediante líneas punteadas. Un rayo azul marca el sitio de escote. (C) Un diagrama de flujo que muestra los pasos de un análisis dependiente de DNAzyme. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: DNAzymes dirigidos a sitios de metilación dependientes de snR13 y snR47 en 25S rRNA. (A, B) Capturas de pantalla del navegador que muestran sitios de metilación dependientes de snR13 (A) y snR47(B) en 25S rRNA (C) secuencia de arNM 25S que rodea el sitio de metilación dependiente de snR13 (A2281) y 10-23 DNAzyme (mostrado en púrpura) diseñado para cleave RNA entre A2281 y U2282. Un2281 no está emparejado con el DNAzyme, mientras que U2282 forma un par con el primer nucleótido de la secuencia activa DNAzyme (marcado por una línea azul). Un rayo azul marca el escote. (D) Secuencia de ARNm 25S que rodea el sitio de metilación dependiente de snR47 (A2220) y 8-17 DNAzyme (mostrado en púrpura) diseñado para cleave RNA entre A2220 y G2221. Un2220 no se hibrida con el DNAzyme mientras que el G2221 está emparejado imperfectamente con timina (denotado con una línea discontinua). Un rayo azul marca el sitio de escote. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Análisis del ensayo específico del sitio 2'-O-metilación de 25S rRNA utilizando 10-23 y 8-17 dNAzyme-dependiente del ensayo. (A) Análisis de la metilación de rRNA 25S dependiente de snR13 utilizando 10-23 DNAzyme. (B) Análisis de la metilación de rRNA 25S dependiente de snR47 utilizando 8-17 DNAzyme. El ARN se visualizó la tinción en un gel de agarosa desnaturalizador. Los productos Cleavage A y B están marcados por flechas rojas. WT - cepa de tipo salvaje; GAL - galactosa, GLC á glucosa. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La digestión dependiente de DNAzyme se puede utilizar como un método simple y rápido para analizar el ARN 2'-O-metilación específico del sitio12,13. DNAzymes cleave RNA si el nucleótido aguas arriba del sitio de escisión no está metilado. A diferencia de otros enfoques, como la digestión dirigida por RNase H, la degradación alcalina o la transcripción inversa en baja concentración de nucleótidos seguida de PCR cuantitativa o secuenciación8,10,11 ,16, el enfoque DNAzyme requiere un simple oligonucleótido de ADN y reactivos básicos que están presentes en cualquier laboratorio de biología molecular. Además, DNAzymes se puede utilizar de manera similar para analizar la pseudouridylación de ARN mediada por el snoRNA12de la caja H/ACA, lo que los convierte en herramientas versátiles en el estudio de objetivos de ARN.
Los enfoques dependientes de DNAzyme están limitados únicamente por las secuencias de consenso del sitio de escisión17. 10-23 DNAzymes se puede utilizar para analizar 2'-O-metilación sólo en la posición R del dinucleótido RY, mientras que 8-17 DNAzymes reconocen la modificación del nucleótido situado aguas arriba de la guanina. Como resultado, no se pueden analizar modificaciones como 2'-O-metilación del primer nucleótido en los dinucleótidos guanina-adenina (GA), adenina-adenina (AA), pirimidina-adenina (YA) y pirimidina-pirimidina (YY). Además, debe tenerse en cuenta la baja eficiencia del escote12 dependiente de DNAzyme. Aunque algunos DNAzymes cleave RNA casi por completo(Figura 3B), muchos DNAzymes sólo digieren parcialmente sus objetivos(Figura 3B). La eficiencia puede depender de la secuencia que rodea el sitio de escote. Por ejemplo, las regiones de ARN con estiramientos del mismo nucleótido pueden afectar al posicionamiento correcto de la secuencia activa DNAzyme. Además, las regiones de ARN que forman una estructura secundaria fuerte pueden rehibridar y suprimir la unión DNAzyme a la secuencia objetivo. Para superar estos problemas, los ciclos de calentamiento y enfriamiento del 10-23 DNAzyme y su sustrato de ARN se pueden aplicar18.
Usamos el enfoque DNAzyme para investigar 2'-O-metilación de rRNA. También se puede utilizar esta técnica para analizar otras modificaciones de ARN, como N6-metiladenosina19. El ARN ribosomal, debido a su abundancia, puede ser analizado por electroforesis y los productos de escisión se pueden visualizar bajo la luz UV. Sin embargo, esto no es aplicable para ARN menos abundantes como ARN de codificación de ARN (mRNA) generados por ARN (mRNA) y ARN no codificantes (NCRNA). Estos ARN generalmente no pueden ser detectados directamente por la tinción de ARN en geles de agarosa o poliacrilamida. En tales casos, la división dependiente de DNAzyme puede visualizarse mediante la hincha del norte, detectada indirectamente por PCR/PCR cuantitativa o analizada por PCR cuantitativa con polimerasas (por ejemplo, KlenTaq DNA Polymerase) capaces de discriminar el ARN 2o-O-metilado ARN no metilado20,21.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Maya Wilson y Aneika Leney por la lectura crítica del manuscrito. Este trabajo fue apoyado por una beca Sir Henry Dale financiada conjuntamente por Wellcome Trust y la Royal Society (200473/Z/16/Z).
Materiales
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Acid phenol | SIGMA | P4682 | |
| Agarose | VWR | A2114 | |
| Ammonium acetate | SIGMA | A1542 | |
| Chlorophorm | Fisher scientific | 10293850 | |
| DNase/RNase free water | Fischer Scientific | 10526945 | |
| DNAzyme | Integrated DNA Technology | Custom oligo DNA | |
| EDTA | SIGMA | E9884 | |
| Ethanol Absolute | Fisher scientific | 10437341 | |
| Formaldehyde | Sigma | F8775 | |
| Formamide | sigma | F9037 | |
| Galactose | SIGMA | G0750 | |
| Gel Loading Dye | Thermo Fisher Scientific | R0611 | |
| Glucose | SIGMA | G7021 | |
| Glycogen | Thermo Fisher Scientific | R0561 | |
| HEPES | SIGMA | H3375 | |
| Isoamyl | SIGMA | W205702 | |
| KCl | SIGMA | P9333 | |
| MgCl2 | SIGMA | M8266 | |
| MnCl2 | SIGMA | 244589 | |
| MOPS | SIGMA | M1254 | |
| NaCl | SIGMA | S7653 | |
| Oxoid Peptone Bacteriological | Thermo Fisher Scientific | LP0037 | |
| Oxoid Yeast Extract Powder | Thermo Fisher Scientific | LP0021 | |
| RiboLock RNase Inhibitor (40 U/µL) | Thermo Fisher Scientific | EO0382 | |
| SDS | SIGMA | 74255 | |
| Sodium acetate trihydrate | SIGMA | S8625 | |
| SYBR Safe DNA Gel Stain | Thermo Fisher Scientific | S33102 | |
| Tris base | SIGMA | TRIS-RO | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 1.5 mL microtubes | Sarstedt | ||
| 152VR5C01M -80°C freezer | Thermo Fisher Scientific | ||
| 250 mL Erlenmeyer flasks | Cole-Parmer | ||
| 50 mL conical tubes | Sarstedt | ||
| Combicup VX200 vortex | Appleton Woods | ||
| DS-11 microspectrophotometer | Denovix | ||
| Electrophoresis chamber (20 cm tray) | SIGMA | ||
| FiveEasy F20 pH meter | Appleton Woods | ||
| Gel documentation system | Syngene | ||
| Heraeus Fresco 21 micro centrifuge | Fisher Scientific | ||
| Megafuge 8R centrifuge with rotator suitable for 50 mL conical tubes | Fisher Scientific | ||
| Mini Fuge Plus mini centrifuge | Starlab | ||
| Mixer HC thermal block | Starlab | ||
| OLS26 Shaking Water Bath | Grant | ||
| PowerPac power supplier | BioRad |
Referencias
- Dieci, G., Preti, M., Montanini, B. Eukaryotic snoRNAs: a paradigm for gene expression flexibility. Genomics. 94 (2), 83-88 (2009).
- Watkins, N. J., Bohnsack, M. T. The box C/D and H/ACA snoRNPs: key players in the modification, processing and the dynamic folding of ribosomal RNA. Wiley Interdisciplinary Review RNA. 3 (3), 397-414 (2012).
- Kufel, J., Grzechnik, P. Small Nucleolar RNAs Tell a Different Tale. Trends in Genetics. , (2018).
- Li, T., Zhou, X., Wang, X., Zhu, D., Zhang, Y. Identification and characterization of human snoRNA core promoters. Genomics. 96 (1), 50-56 (2010).
- Jorjani, H., et al. An updated human snoRNAome. Nucleic Acids Research. 44 (11), 5068-5082 (2016).
- Hubbard, T. J., et al. Ensembl 2009. Nucleic Acids Research. 37 (Database issue), D690-D697 (2009).
- Makarova, J. A., Kramerov, D. A. SNOntology: Myriads of novel snoRNAs or just a mirage?. BMC Genomics. 12, 543 (2011).
- Yu, Y. T., Shu, M. D., Steitz, J. A. A new method for detecting sites of 2'-O-methylation in RNA molecules. RNA. 3 (3), 324-331 (1997).
- Decatur, W. A., Liang, X. H., Piekna-Przybylska, D., Fournier, M. J. Identifying effects of snoRNA-guided modifications on the synthesis and function of the yeast ribosome. Methods in Enzymology. 425, 283-316 (2007).
- Dong, Z. W., et al. RTL-P: a sensitive approach for detecting sites of 2'-O-methylation in RNA molecules. Nucleic Acids Research. 40 (20), e157 (2012).
- Birkedal, U., et al. Profiling of ribose methylations in RNA by high-throughput sequencing. Angewandte Chemie International Edition, England. 54 (2), 451-455 (2015).
- Buchhaupt, M., Peifer, C., Entian, K. D. Analysis of 2'-O-methylated nucleosides and pseudouridines in ribosomal RNAs using DNAzymes. Analytical Biochemistry. 361 (1), 102-108 (2007).
- Grzechnik, P., et al. Nuclear fate of yeast snoRNA is determined by co-transcriptional Rnt1 cleavage. Nature Communication. 9 (1), 1783 (2018).
- Piekna-Przybylska, D., Decatur, W. A., Fournier, M. J. New bioinformatic tools for analysis of nucleotide modifications in eukaryotic rRNA. RNA. 13 (3), 305-312 (2007).
- Schmitt, M. E., Brown, T. A., Trumpower, B. L. A rapid and simple method for preparation of RNA from Saccharomyces cerevisiae. Nucleic Acids Research. 18 (10), 3091-3092 (1990).
- Maden, B. E. Mapping 2'-O-methyl groups in ribosomal RNA. Methods. 25 (3), 374-382 (2001).
- Santoro, S. W., Joyce, G. F. A general purpose RNA-cleaving DNA enzyme. Proceedings of the National Academy of Science, U. S. A. 94 (9), 4262-4266 (1997).
- Hengesbach, M., Meusburger, M., Lyko, F., Helm, M. Use of DNAzymes for site-specific analysis of ribonucleotide modifications. RNA. 14 (1), 180-187 (2008).
- Sednev, M. V., et al. N(6) -Methyladenosine-Sensitive RNA-Cleaving Deoxyribozymes. Angewandte Chemie International Edition, England. 57 (6), 15117-15121 (2018).
- Aschenbrenner, J., Marx, A. Direct and site-specific quantification of RNA 2'-O-methylation by PCR with an engineered DNA polymerase. Nucleic Acids Research. 44 (8), 3495-3502 (2016).
- Lee, K. W., Bogenhagen, D. F. Assignment of 2'-O-methyltransferases to modification sites on the mammalian mitochondrial large subunit 16 S ribosomal RNA (rRNA). Journal of Biological Chemistry. 289 (36), 24936-24942 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados