Method Article
التحقيق في انهيار الحاجز المعوي في الأعضاء الحية
* These authors contributed equally
In This Article
Summary
هنا نصف تقنية لتحديد سلامة الحاجز من الأعضاء المعوية الصغيرة. حقيقة أن الطريقة تقوم على الكائنات الحية تمكن التحقيق المتتابعة من مختلف سلامة الحاجز تحوير المواد أو تركيبات منها بطريقة زمنية حلها.
Abstract
Organoids وثقافات الخلايا ثلاثية الأبعاد (3D) تسمح بالتحقيق في الآليات البيولوجية المعقدة واللوائح في المختبر، والتي لم تكن ممكنة في السابق في أحادية ثقافة الخلايا الكلاسيكية. وعلاوة على ذلك، الثقافات خلية أحادية الطبقات جيدة في أنظمة نموذج المختبر ولكن لا تمثل عمليات التمايز الخلوية المعقدة والوظائف التي تعتمد على هيكل 3D. ولم يكن ذلك ممكناً حتى الآن إلا في التجارب على الحيوانات، التي هي شاقة وتستغرق وقتاً طويلاً ويصعب تقييمها من خلال التقنيات البصرية. هنا نصف القول لتحديد كميا سلامة الحاجز مع مرور الوقت في الذين يعيشون صغيرة الجهازية الماوس المعوي. للتحقق من صحة نموذجنا، قمنا بتطبيق الإنترفيرون غاما (IFN-ο) كتحكم إيجابي لتدمير الحاجز والمنأرغويدات المشتقة من مستقبلات IFN-ο 2 ضرب الفئران كتحكم سلبي. سمح لنا الامتصاص بتحديد تأثير IFN-ο على سلامة الحاجز المعوي والتدهور المستحث لبروتينات التقاطع الضيقة كلودين-2 و-7 و-15. ويمكن أيضا أن تستخدم هذه الإمكانية للتحقيق في تأثير المركبات الكيميائية، والبروتينات، والسموم، والبكتيريا، أو المسابير المشتقة من المريض على سلامة الحاجز المعوي.
Introduction
يتم الحفاظ على سلامة الحاجز الظهاري من قبل مجمع تقاطع apical (AJC) ، والتي تتكون من تقاطع ضيق (TJ) وتقاطع الالتزام (AJ) البروتينات1. الهيكل الاستقطابي للAJC أمر حاسم لوظيفته في الجسم الحي. Dysregulation من AJC موجود في مختلف الأمراض ويشتبه في أن يكون محفزا هاما لمسببات التهاب الأمعاء. فقدان وظيفة الحاجز المعوي يمثل الحدث الذي بدأ المرض. نقل التالية من البكتيريا commensal والاستجابات الالتهابية هي العواقب المؤلمة2.
وقد وضعت مختلف في المختبر وفي نماذج على نطاق الكاف للتحقيق في تنظيم AJC. ويستند ازى ترانسويل على أحادية الخلية ثنائية الأبعاد (2D) التي تم اشتقاقها من خطوط الخلايا السرطانية. هذه النظم جيدة للتقييم بالطرق البصرية والبيوكيميائية وتمكين تحليل العديد من العينات في نفس الوقت ولكنتفتقر إلى العديد من ميزات الخلايا الأولية وعمليات التمايز الموجودة في الجسمالحي. التحقيق في سلامة الحاجز ممكن أيضا في النماذج الحيوانية. في التجارب النهائية ، يمكن قياس آثار علاجات محددة في الجسم الحي على نفاذية الأمعاء بأكملها. ومع ذلك ، تتطلب هذه النماذج عددًا كبيرًا من الحيوانات ، ولا تسمح بتصور مفصل للعمليات الجزيئية الأساسية. في الوقت الحاضر تحسين 3D في نماذج المختبر متوفرة أن تلخيص عمليات التمايز الخلية عن كثب، والاستقطاب الخلية، وتمثل بنية سرداب فيلوس من الأمعاء3. يتطلب تطبيق الأعضاء المعوية ثلاثية الأبعاد للتحليلات الوظيفية تكييف الأساليب المتاحة من النماذج 2D. هنا نصف نموذج للتحقيق في سلامة الحاجز المعوي في الكائنات الحية الصغيرة الماوس المعوي. تم إنشاء الفحص للتحقيق في تأثير IFN-ο على سلامة الحاجز وبروتينات التقاطع الضيقة المعنية8.
على النقيض من تقنية تطبيقها ليزلي4، زيتيك5، أو بيرس6، الذي يقيس الفلورسينس بعد إزالة لوسيفر الأصفر (LY) من المتوسط ، نهجنا يسمح قياس كمية من التراكم المضيئ ة للفلوروفور مع مرور الوقت. لذلك ، تمثل النتيجة حركية ديناميكية للأخذ ويمكننا من القول تطبيق محفزات أو مثبطات إضافية أثناء التجربة. حقيقة أن كلا المقاييس قياس الزيادة من الجانب الباسوري الخارجي إلى السطح apical داخل في تناقض واضح مع الوضع في الجسم الحي. وفي نموذج وصفه هيل وآخرون7،تم استكشاف هذا الموضوع. عند الحقن المجهري للفلوروفور في تجويف الجهاز ، تم قياس الفلورسينس. يمثل اتجاه الانتشار الاتجاه الموجود في الجسم الحي. الجهد التقني للحقن المجهري يقلل بوضوح من إنتاجية هذه الطريقة. وعلى النقيض من النموذج الموصوف هنا، فإن طريقة الحقن المجهري تمكن من قياس الآثار التي تتطلب التنشيط البيولوجي على السطح الظهاري apical.
ويستند نموذج سلامة الحاجز المنهي المعروض هنا على المجهر الحي للخلايا ويمكّن من تحليل التغيرات الديناميكية داخل لائحة AJC بمرور الوقت. يمكن تطبيق الإعداد لاختبار التأثير الدوائي للمواد المسببة وتثبيط سلامة الحاجز المعوي. وعلاوة على ذلك، تساعد النماذج القائمة على الأنرجوية على تقليل عدد الحيوانات المستخدمة في الدراسات الدوائية.
Protocol
وقد اكتملت جميع الخطوات وفقاً لجميع المبادئ التوجيهية التنظيمية والمؤسسية ذات الصلة لرعاية الحيوانات والامتثال لها.
1. طلاء الأرغنية
- عزل organoids كما هو موضح سابقا3. ويرد أدناه وصف موجز للإجراء.
- جمع الأمعاء الدقيقة من الفئران.
- فتح الأمعاء الدقيقة طوليا وإزالة نصائح فيلي عن طريق كشط الأنسجة المعوية الداخلية مع غطاء.
- قطع الأنسجة المعوية في قطع صغيرة باستخدام مقص.
- غسل القطع 5x في الباردة الفوسفات المخزنة مؤقتا المالحة (PBS) عن طريق الأنابيب القطع 10x صعودا وهبوطا مع ماصة 25 مل.
- احتضان قطع الأنسجة في الباردة 2 mM EDTA الحل على الجليد لمدة 30 دقيقة على منصة اهتزاز أفقي. السماح لقطع الأنسجة إلى الرواسب.
- استبدال حل EDTA مع المخزن المؤقت PBS مرة واحدة في قطع الأنسجة تسوية في الجزء السفلي. تجاهل supernatant وإضافة 20 مل من برنامج تلفزيوني.
- الافراج عن سراديب الأمعاء من الأنسجة عن طريق أنبوب بقوة 10x صعودا وهبوطا مع ماصة 10 مل.
- جمع supernatant في أنابيب الطرد المركزي وفحصها عن طريق المجهر على النقيض من المرحلة. للقيام بذلك، إضافة قطرة من supernatant إلى لوحة ثقافة الخلية 96 جيدا. الحفاظ على أنابيب الطرد المركزي على الجليد.
- كرر الخطوات 1.1.6-1.1.8 حتى ينخفض عدد السراديب المعوية في الـ supernatant التي تم جمعها.
- تمرير الكسور التي تحتوي على معظم السراديب من خلال مصفاة خلية 70 ميكرومتر.
- طرد مركزي تعليق سرداب في 300 × ز،4 درجة مئوية لمدة 5 دقيقة.
- تجاهل supernatant وإعادة تعليق بيليه في برنامج تلفزيوني الباردة من أجل غسل السراديب. ثم كرر خطوة الطرد المركزي كما هو موضح في 1.1.11.
- إعادة تعليق بيليه في ما مجموعه 25 ميكرولتر لكل بئر من خليط 1:1 من حل مصفوفة الخلية والوسائط ثقافة المورين ولوحة organoids في 48 لوحات ثقافة الخلية جيدا.
- احتضان organoids في 37 درجة مئوية، 5٪ CO2،, لمدة 20 دقيقة للسماح للمحلول مصفوفة الخلية لترسيخ.
- تغطية organoids مع 300 ميكرولتر من متوسطة الماتورين الجهازية لكل بئر.
- ثقافة organoids في 37 درجة مئوية ، 5 ٪ CO2، وتغيير المتوسطة كل 2-3 أيام.
- استخدام organoids للتجارب بعد 7 أيام من الثقافة.
- إعداد organoids لقياس سلامة الحاجز.
- Precoat جميع أنابيب الطرد المركزي التي سيتم استخدامها لتخزين organoids خلال عملية الطلاء مع الزل في مصل البقري (BSA) عن طريق إضافة ما يكفي من محلول BSA 0.1٪ في PBS لتغطية جميع الأسطح البلاستيكية. ثم قم بإزالة محلول BSA مرة أخرى وتخزين أنابيب الطرد المركزي على الجليد.
- إذابة حل مصفوفة الخلية والمتوسطة ثقافة organoid على الجليد.
- لفصل organoids، وإزالة بعناية المتوسطة الثقافة وإعادة تعليق organoids من بئر واحد من لوحة بئر 48 في 1 مل من برنامج تلفزيوني الباردة. إذابة مصفوفة الخلية عن طريق الأنابيب قوية. دائما الحفاظ على تعليق الجهازية في أنابيب الطرد المركزي المغلفة مسبقا مع BSA وتبقي دائما على الجليد.
ملاحظة: تتأثر كثافة وحجم وموقف organoids داخل شريحة الغطاء المغرفة بنسبة الانقسام ، وتركيز حل مصفوفة الخلية ، والتعامل مع تعليق مصفوفة الخلية العضوية. من المستحسن ممارسة التعامل مع حل مصفوفة الخلية مقدمًا. عادة ثمانية جيدا غرف الزجاج الغرف هي مناسبة للازه. Organoids المستمدة من بئر واحد من لوحة بئر 48 ملتوية يمكن تقسيمها إلى بئرين من ثمانية coverslip غرفة جيدا (40 ميكرولتر من بيليه مصفوفة الخلايا الجهازية لكل بئر). - طرد مركزي تعليق الجهازية في 300 × ز في 4 درجة مئوية لمدة 5 دقيقة.
- تجاهل بعناية supernatant وإعادة تعليق بيليه مع 1 مل من برنامج تلفزيوني الباردة.
- الطرد المركزي تعليق الجهاز ية في 300 × ز،4 درجة مئوية لمدة 5 دقيقة.
- تجاهل supernatant تماما وإعادة تعليق organoids المستمدة من بئر واحد من لوحة بئر 48 في 40 ميكرولتر من الوسط البارد. تجزئة الهياكل العضوية الكبيرة عن طريق الأنابيب تعليق الجهازية 5x من خلال تلميح ماصة 10 ميكرولتر لجمع هياكل بحجم 40-60 ميكرومتر للبذر.
ملاحظة: استخدم نصيحة 10 ميكرولتر على طرف ماصة 100 ميكرولتر لتجزئة الهياكل الاعضاء، ومارس الخطوة 1.7 مقدمًا لضمان نتائج متسقة. التحكم في حجم organoids عن طريق التنظير الدقيق للمرحلة على النقيض داخل أنبوب الطرد المركزي. تأكد من عدم وجود المزيد من الأعضاء متعددة الفروع وأن الشظايا الاعضاء يبلغ طولها حوالي 40-60 ميكرومتر. - بمجرد الحصول على الأعضاء الحجم المطلوب ، قم بمزجها مع 40 ميكرولتر من محلول مصفوفة الخلية (حل مصفوفة الخلية المتوسطة : الخلية = 1:1).
ملاحظة: يجب الحفاظ على نسبة حل مصفوفة المصفوفة المتوسطة إلى الخلية ثابتة لتحقيق نتائج متسقة. يخفف من محلول مصفوفة الخلية يقلل من صلابة النقطة الاعضاء ويؤثر على خصائص انتشاره. استخدم نصائح pipet المبردة مسبقًا (-20 درجة مئوية) لجميع عمليات التعليق التي تحتوي على حل مصفوفة الخلية. - ضع 40 ميكرولتر من تعليق حل مصفوفة الخلايا العضوية في وسط كل بئر من 8 غطاء جيد الغرفة.
- الحفاظ على الشريحة على حزمة الجليد لمدة 5 دقيقة. هذا يحافظ على خلية مصفوفة السائل تعليق الجهازية ويزيد من تركيز organoid على سطح coverslip عن طريق الجاذبية.
- احتضان لمدة 20 دقيقة في 37 درجة مئوية و 5٪ CO2 لتمكين البلمرة من النقطة مصفوفة الخلايا الاعضاء.
- إضافة 150 ميكرولتر من الثقافة الاعضاء المتوسطة لكل بئر واحتضان لمدة 24 ساعة في 37 درجة مئوية و 5٪ CO2 قبل الشروع في العلاج التجريبي.
- استخدام هذه الفترة لعلاج organoids وتعدل سلامة حاجزها وفقا للفرضية العلمية المقابلة. للتحكم الإيجابي، علاج organoids لمدة 48 ساعة مع IFN-ο من أجل التحقيق IFN-ο المرتبطة تدهور تقاطع ضيق وزيادة نفاذية. تحفيز السيطرة الإيجابية مع 10 U/mL (10 نانوغرام /مل) المورين المؤتلف IFN-ο. ترك organoids واحدة غير المعالجة بشكل جيد.
- الثقافة organoids في 37 درجة مئوية و 5٪ CO2 لمدة تصل إلى 48 ساعة.
2. ازهالة المنقاة المنقاة
- جلب غرفة حضانة المجهر إلى 37 درجة مئوية على الأقل 2 ساعة قبل البدء في التجربة للحد من الانجراف الحراري أثناء تصوير organoids.
- إعداد حل 100 m من LY في برنامج تلفزيوني. تخزين على الجليد المحمية من الضوء.
- إعداد حل 200 m من EGTA في برنامج تلفزيوني. اخزنه على الثلج
- نقل غطاء غرفة بما في ذلك organoids في غرفة الحضانة من المجهر مقلوب العاكسة وبدوره على حضانة CO2 (5٪). تأكد من أن المغطاة المغلقة مقفلة بإحكام داخل مرحلة المجهر.
- باستخدام organoids في واحد وكذلك مرجع ، وضبط إعدادات التصوير من المجهر. أضف LY (3 ميكرولتر من 100 مل LY في 150 ميكرولتر من المتوسط) للحصول على حجم نهائي قدره 1 mM LY في 300 ميكرولتر من المتوسط. احتضان على المجهر لمدة 1 ساعة وضبط التركيز لتصوير تجويف اتمن الأعضاء. حدد طاقة الليزر المطلوبة لإثارة LY (488 نانومتر) وحساسية الكشف الخاصة بالأداة ومحاولة صورة مفلورة LY بنسبة 30-40٪ من النطاق الديناميكي المتاح للأداة المستخدمة.
ملاحظة: ضبط الطاقة الإثارة الليزر وكفاءة الكشف على organoids غير المعالجة 70 دقيقة بعد إضافة LY. تأكد من أن الطاقة الإثارة عالية بما يكفي للحصول على صورة مكشوفة بشكل جيد. لتجنب تشبع الفلورسين LY داخل الصور المجهرية ، يوصى بضبط هذه الإعدادات بعد أن يصل انتشار LY إلى حالة ثابتة. - تحديد موضع الأعضاء عن طريق تباين التداخل التفاضلي (DIC) التصوير الحي. في محاولة لتصوير organoids مع أقطار مماثلة (80 ± 30 ميكرومتر) والتركيز على شريحة مركزية من organoids لتصوير تجويف بهم. تحديد ما يقرب من 10 organoids لكل بئر ومحاولة لتصوير فقط organoids على مقربة من سطح coverslip مع بنية كروية.
ملاحظة: يعتمد عدد الأعضاء التي يمكن تصويرها لكل شوط على سرعة المجهر. فمن المستحسن لتصوير organoids في غضون فترة 5 دقيقة. على المجهر العادي ة المسح بالليزر ، 40 موقف في المجموع هي نقطة انطلاق معقولة. - سجل DIC وFLUORescence LY من كل موقف لتوثيق شكل الجهاز وautofluorescence قبل إضافة LY إلى الآبار، وتستخدم لشهادة سلامة الحاجز.
- لا تقم بصور الأورجادات التي تعرض الفلورالنسيالعالي العالي. ويرجع ذلك إلى تراكم الخلايا الميتة داخل تجويف الجهاز، ونتائج organoids autofluorescent من الصعب تحليلها بعد ذلك.
- تمييع 3 ميكرولتر من محلول LY المعد (100 مل LY في 150 ميكرولتر من المتوسط) وإضافة هذا بعناية إلى كل بئر دون لمس قسيمة الغطاء المغرفة. التركيز الموصى به من LY لكل بئر هو 1 mM. وينبغي أن يكون الحجم النهائي لكل بئر 300 ميكرولتر.
- تحقق بسرعة من التركيز على المواقف المحددة والصحيح إذا لزم الأمر.
ملاحظة: LY ينتشر بسرعة من خلال مصفوفة الخلية. لذلك ، يجب بدء التصوير البؤري في غضون 3 دقيقة بعد إضافة الفلوروفور. - بدء تصوير الفاصل الزمني على المجهر. تأخذ صورة الفلورسينس لكل موقف كل 5 دقيقة لما مجموعه 70 دقيقة.
ملاحظة: تم تصوير organoids في 5 فترات دقيقة لتصور الطرح LY مع مرور الوقت. لقياس انهيار الحاجز المعوي ، يكفي تسجيل الفلورسينس قبل و 60 دقيقة بعد إضافة LY ومرة أخرى 10 دقيقة بعد إضافة EGTA. - إضافة 3 μL من حل EGTA أعدت جيدا دون لمس coverslip غرفة. التركيز الموصى به داخل غطاء غرفة من EGTA هو 2 mM. وينبغي أن يكون الحجم الإجمالي لكل بئر 300 ميكرولتر.
- بدء الفاصل الزمني الثاني. سجل الفلورسنسي من organoids المعرفة مرة أخرى مع فاصل زمني قدره 5 دقيقة لما مجموعه 30 دقيقة.
- تجاهل كل شيء وفقا للوائح السلامة المحلية.
ملاحظة: يمكن إيقاف البروتوكول مؤقتًا هنا.
3- تحليل البيانات
- تحليل فقط نتائج organoids التي تناولLY بعد إضافة EGTA.
- ويمكن قياس النتائج كميا مع فيجي ImageJ.
- فتح مجموعة البيانات في ImageJ بالنقر فوق ملف | فتح بيانات الصورة وتحديدها. في الخيارات التالية BIO-تنسيقات استيراد خيارات حدد عرض المكدس مع: Hyperstack.
- افتح مدير المنطقة ذات الاهتمام (ROI) بالنقر فوق تحليل | أدوات | مدير عائد الاستثمار.
- رسم عائد الاستثمار البيضاوي من خلال النقر على زر التحديد البيضاوي في شريط القائمة ImageJ. رسم تحديد يحتوي على تجويف الداخلية من الجهاز. ثم اضغط إضافة في مدير عائد الاستثمار.
- كرر الخطوات لثلاث مناطق تمثيلية خارج الجهاز.
- انقر على تحليل في شريط القائمة وحدد تعيين القياسات. تمكين القيمة الرمادية المتوسطة فقط وتعطيل أي قياس آخر. ثم انقر فوق موافق.
- تأكد من تحديد كافة ROIs في مدير عائد الاستثمار. في مدير عائد الاستثمار، انقر فوق المزيد | قياس متعدد. في الحوار الخيار حدد قياس جميع شرائح [...] وصف واحد لكل شريحة. ثم انقر فوق موافق.
- حدد كافة القيم الموجودة في إطار النتائج ونسخها في تطبيق جدول بيانات لمزيد من التحليل.
ملاحظة: إذا تحرك موضع الجهاز أثناء التصوير الفاصل الزمني ، يجب تعديل عائد الاستثمار وفقًا لذلك. للقيام بذلك، حدد عائد الاستثمار الصحيح في مدير عائد الاستثمار ونقله إلى الوظيفة الجديدة. ثم انقر فوق تحديث في مدير عائد الاستثمار. قم بإجراء القياس لكل نقطة زمنية بشكل فردي بالنقر فوق قياس في مدير عائد الاستثمار، ثم قم بالتبديل إلى نقطة الوقت التالية في إطار الصورة باستخدام الشريط الموجود في الأسفل. جمع جميع القياسات في جدول بيانات. يتطلب الشكل الفردي وحركة الأعضاء خلال فترة التصوير تحليل البيانات بطريقة يدوية. - حساب متوسط قيمة كثافة الأقراص ثلاثية الأقراص خارج الجهاز ية لكل نقطة زمنية.
- تقسيم كثافة العائد على الاستثمار داخل تجويف الجهازية حسب متوسط كثافة العائد على الاستثمار في الخارج وشدة المتوسط داخل الجهاز.
- من أجل حساب الزيادة النسبية للفلورسال الجهازية المضيئة، قم بتقسيم الفلورسينس النسبي (انظر الخطوة 3.11) في كل نقطة زمنية يتم التصوير بها بواسطة الحد الأدنى من الفلورسال النسبي.
ملاحظة: استخدام الحد الأدنى من الفلورسيز النسبي، لأنه في بعض الأحيان انتشار الفلوروفور يمكن أن يكون بطيئا في بداية التجربة.
النتائج
للتحقق من صحة تطبيق الأعضاء الماوية المعوية الصغيرة ثلاثية الأبعاد كنموذج لقياس تأثير المركبات التي تنظم سلامة الحاجز المعوي ، طبقنا IFN-ο. للقيام بذلك، ونحن معزولة ومثقف organoids المستمدة من IFN-ο نوع البرية استجابة وIFN-ο-مستقبلات-2 الفئران خروج المغلوب، والتي لا تستجيب لIFN-ο8. عند العلاج لمدة 48 ساعة مع IFN-ο أو PBS (التحكم) ، تعرضت جميع organoids لـ LY وصورتها بواسطة قرص دوار مُصَلٍ في 5 فواصل زمنية لمدة 70 دقيقة. أدت السلامة الوظيفية للحاجز المعوي في هذا النموذج إلى استبعاد LY من تجويف الجهاز بينما كان تراكم intraluminal LY يعني تدمير TJ. الممثل الصور المجهرية الفلورية بعد 70 دقيقة من الحضانة مع LY تثبت بوضوح أن intraluminal LY fluorescence كان مرئيا فقط في organoids من الحيوانات من نوع البرية المعالجة مع IFN-ο. في الضوابط غير المحفزة (PBS) ولا في organoids المستمدة من ضرب الحيوانات (IFN-οR2ΟIEC, الشكل 1),لا يوجد مفلورLY INTRaluminal موجودة بعد 70 دقيقة.
إضافة EGTA يسبب انهيار غير محدد لسلامة الحاجز المعوي عن طريق عزل العوامل المساعدة TJ. وقد استخدم هذا التحكم دائما في نهاية التجربة لإثبات قدرة الجهازية المعنية على تناول LY(الشكل 1). إذا لم يتم الكشف عن عدم وجود الفلورسين اللين اللافي على العلاج EGTA، تم استبعاد الجهاز من التجربة.
للتقييم الكمي للنتائج المجهرية ، تم قياس الفلورسينس LY داخل تجويف الجهاز وخارج الجهاز. تم حساب قيم الكثافة النسبية (الفلورسينس داخل / الفلورسين خارج + داخل) وتظهر لكل نقطة زمنية يتم التصوير بها. فمن المستحسن لتجنب تصوير organoids من أحجام مختلفة. اخترنا التركيز على organoids مع قطر 80 ± 30 ميكرومتر(الشكل 2). يتم عرض مخطط للبروتوكول مع صور تمثيلية في الشكل 3. يتم عرض بعض المشاكل الرئيسية وتقنيات استكشاف الأخطاء وإصلاحها ومناقشتها في الشكل 4.
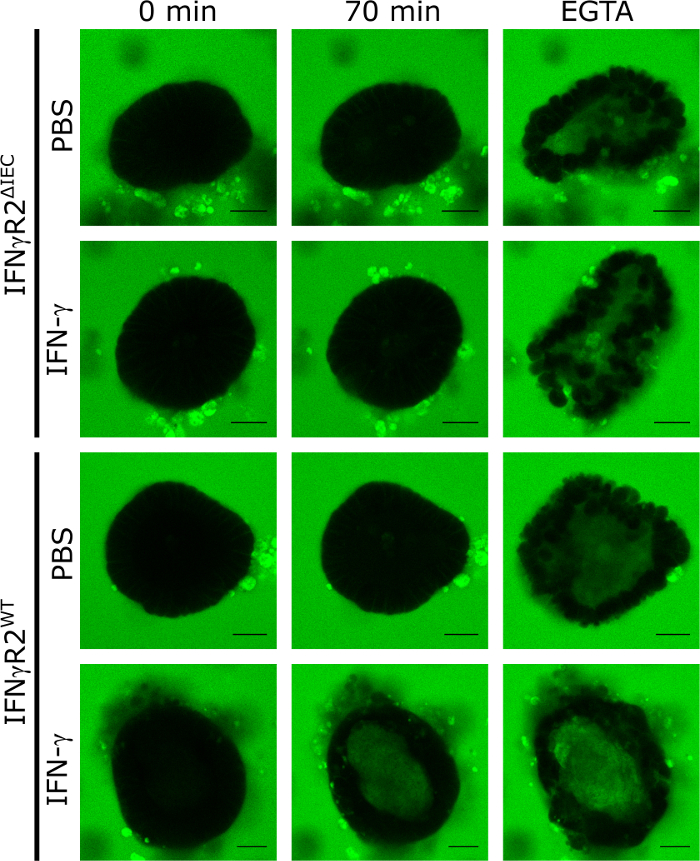
الشكل 1: يمكن تحليل سلامة الحاجز المعوي في الأعضاء ية الماوس. تم استزراع الأعضاء المعوية من IFN-οR2WT و IFN-οR2ΟIEC في وجود IFN-ο لمدة 48 ساعة أو تركت دون علاج. للتحقيق في سلامة الحاجز المعوي ، تمت إضافة LY (457 Da) وتم التقاط صور الفلورسنت البؤرية في 5 فواصل زمنية لمدة إجمالية قدرها 70 دقيقة. شريط المقياس = 20 ميكرومتر). وقد تم تعديل هذا الرقم من باردينباخر وآخرون8. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
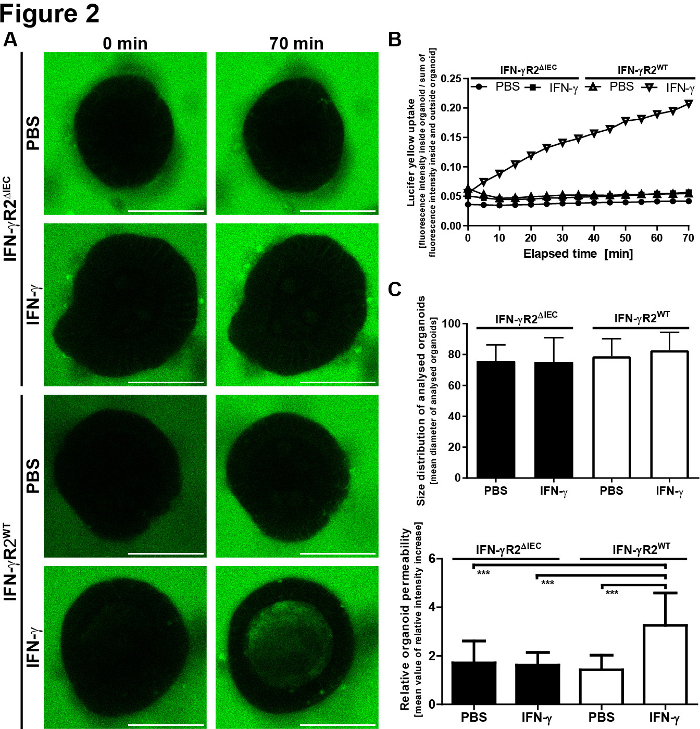
الشكل 2: نموذج تكامل الحاجز الهضمي الصغير يوفر نتائج كمية. (أ)تم تحديد الفلورسينس LY داخل وخارج الجهاز. تم حساب قيم الكثافة النسبية (داخل / الفلورسينس خارج + داخل) بالنسبة إلى الكثافة النسبية الأولية + SEM وتظهر لكل نقطة زمنية. (ب)توزيع حجم الأعضاء التي تم تحليلها. للحد من الانحراف المعياري والأخطاء الناجمة عن التغيرات في نسبة سطح إلى حجم، قمنا بتحليل الأعضاء فقط مع قطر 80 ± 30 ميكرومتر. يتم عرض متوسط قيم الأقطار الأعضاء ية ذات الصلة + SD (IFN-οR2WT، n = 20؛ IFN-οR2ΟIEC، n = 18). لم يختلف متوسط قيم القطر بشكل كبير بين المجموعات المختلفة (ANOVA أحادية الاتجاه). (C)تم تحديد نفاذية الأعضاء 70 دقيقة بعد إضافة LY. تم تعريفه بقسمة شدة الفلورسينال يُجرى بعد 70 دقيقة على الحد الأدنى من شدة الفلورسان النسبي ة التي تم قياسها خلال فترة المراقبة. يمثل كل شريط القيم المتوسطة + SD ، مقاسة في 10 organoids المستمدة من تجربتين مستقلتين (IFN-οR2WT، n = 20 ؛ IFN-οR2ΟIEC، n = 18). زيادة كبيرة IFN-а الزيادة في الطرح LY فقط في IFN-οR2WT organoids. p-value <0.001 في اختبار t للطالب. وقد تم تعديل هذا الرقم من باردينباخر وآخرون8. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
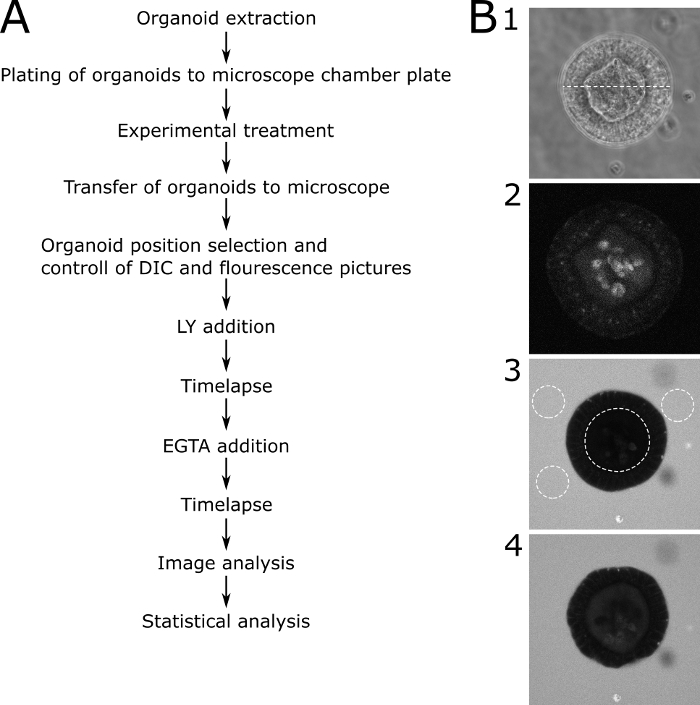
الشكل 3: بروتوكول تخطيطي مع صور تمثيلية. (أ)الوصف التخطيطي للخطوات الرئيسية للبروتوكول. (ب)صور تمثيلية للخطوات الرئيسية للبروتوكول. (B1) صورة المجهر DIC لشريحة مركزية من خلال organoid المناسبة التي تم اختيارها لتحليل نفاذية. يمثل الخط المنقط عرضًا قدره 89 ميكرومترًا(B2)صورة المجهر الفلوري لنفس العضو في(B1)قبل إضافة LY. تُظهر الصورة الفلورات الذاتية للعضوية. (B3) جهاز عضوي 70 دقيقة بعد إضافة LY. لا يظهر الجهازية المصورة أي تناول لـ LY وبالتالي وظيفة حاجز سليمة. خطوط منقط تظهر ROIs لمزيد من التحليل. تم وضع علامة على التجويف الداخلي للعضوية وثلاث مناطق تمثيلية حول الجهاز. (B4) جهاز عضوي بعد إضافة EGTA. الجهاز يُعَمَل ُ للحصول على مزيد من التحليل لأنه يُظهر التناول LY بعد علاج EGTA. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
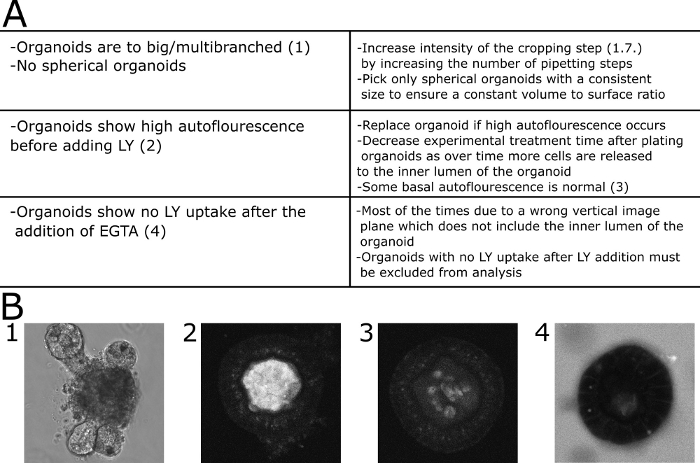
الشكل 4: استكشاف الأخطاء وإصلاحها من المشاكل الشائعة. (أ)الجدول مع المشاكل المشتركة والحلول. (ب)صور مثالية. (B1) صورة DIC لعضوكبير متعدد الفروع غير مناسب لهذا القول. (B2). صورة بؤرية لـ organoid تعرض الفلورات عالية قبل أن يتم إضافة LY إلى الوسط. تم استبعاد الجهاز من القياس الكمي. (B3) صورة بؤرية لـ organoid عرض الفلورات المنخفضة قبل LY تمت إضافتها إلى الوسط. تم قياس الفلورسيفيفي هذه الحالة. (B4) Organoid تظهر أي ارتفاع LY من متوسط 30 دقيقة بعد إضافة EGTA وبالتالي استبعد من القياس الكمي. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هذا القول يقدم تقنية لدراسة سلامة الحاجز المعوي داخل الأعضاء الحية. ويستند الفحص كله على الأعضاء الماوس المعوية الصغيرة والمجهر الخلية الحية confocal. لذلك ، من الإلزامي ممارسة المناولة السليمة للعضويات مسبقًا. عند العزلة ، يمكن تقسيم organoids بشكل روتيني وتخزينها عن طريق التجميد البارد3،9. لهذا القول نوصي تقسيم organoids 48 ساعة قبل أن يبدأ العلاج. هذه الفترة يعطي organoids فرصة لإغلاق تماما وتشكيل هياكل كروية. البذر من organoids للتجربة هو خطوة حاسمة داخل المنازب. لتقليل اختلافات المناولة الفردية، نوصي بإجراء روتيني لعملية البذر. هذه الخطوة أمر بالغ الأهمية، وبروتوكول معالجة روتينييقلل بوضوح من الاختلافات التجريبية.
أثناء إجراء البذر (الخطوة 1.7) تتفتت الأجزاء المنزرعة عن طريق التمرير المتكرر من خلال طرف ماصة 10 ميكرولتر قياسي. حجم المسام من هذا المنتج يختلف من شركة إلى أخرى. يجب أن يتم ممارسة هذا الإجراء مسبقاً، وينبغي دائماً التحقق من النتيجة عن طريق المجهر على النقيض من المرحلة. بمجرد أن تصل الأعضاء التي تم الحصول عليها إلى الحجم المطلوب ، لا تغير الإجراء.
يجب تحسين البذر من organoids وتكييفها لإعداد المجهرية المتاحة. لتكون قادرة على الثقافة والصورة organoids لمدة لا تقل عن 48 ساعة ، مطلوب تماما غرفة المجهر المحتضن. اختر قسيمة تغطية غرفة تطابق متطلباتك. عند بذر الأورغيات، تأكد من تركيز الأعضاء على سطح الانزلاق. هذا ممكن عن طريق الحفاظ على غطاء غرفة على حزمة الجليد لمدة 5 دقيقة بعد وضع خلية مصفوفة الجهازية تعليق. هذه الخطوة مهمة لزيادة جودة التصوير بالخلايا الحية. دقة محورية ومسافة العمل من عدسات المجهر البؤري محدودة بشكل خاص. كلما اقتربت من إحضار العينة إلى العدسة ، كلما كان بإمكانك صورتها بشكل أفضل ، وهناك حاجة إلى طاقة ليزر أقل لإثارة الفلورسينس LY.
Phototaxis هي قضية هامة عندما يتعلق الأمر المجهري الخلية الحية. ضمن هذا القول نستبعد هذا الخيار. AJC وظيفية مرئية عن طريق استبعاد LY من تجويف الجهاز(الشكل 1، PBS). إضافة EGTA في نهاية التجربة يسبب عزل الأيونات bivalent، والتي هي العوامل المشتركة لبروتينات AJC. يتم استبعاد LY من تجويف الجهاز فقط في الأعضاء الحيوية مع مجمع AJC وظيفية. بشكل عام ، يمكن استخدام جزيئات الفلورسنت لقياس سلامة الحاجز المعوي. اخترنا LY بدلا من الفلوروفوريات الأخرى المستخدمة عادة مثل الفلورسيسين المسمى dextran لأن تلك يتم نقلها عبر الخلايا في الخلايا المعوية من القاعدية إلى المقصورة apical9. اخترنا أيضا LY بسبب صغر حجمها. LY لديه وزن جزيئي من 457 دا، وبالتالي يسهل التحقيق في نفاذية الحاجز للجزيئات الصغيرة. جزيء الفلورسنت يجب أن يتم اختياره اعتمادا على السؤال العلمي الذي تم التحقيق فيه. نظرًا لوجود عيوب AJC السامة للضوء ، يجب تقليل طاقة الإثارة بالليزر أو تمديد فترة التصوير. تقنية التصوير المحوري الأمثل لهذا الفحص هو تدوير المجهر القرص. تمكن الأدوات ذات الصلة التصوير البؤري مع وقت تعرض قصير عند طاقة الليزر المنخفضة.
وقد وضعت بالفعل نماذج مختلفة لدراسة سلامة الحاجز المعوي في المختبر. في حين أن استخدام المقالات على أساس monolayers خط الخلية أو التجارب في الجسم الحي آخذة في الانخفاض، وزيادة الأساليب القائمة على الجهاز. على النقيض من الأساليب الموصوفة سابقا4،5،6،7، لدينا طريقة تسمح تحديد حجم وظيفة الحاجز مع مرور الوقت. وهذا يسمح بالتعرض للمنبهات الإضافية على مدار التجربة. هنا نطبق EGTA كحافز ثان في نهاية التجربة كتحكم إيجابي.
على النقيض من الوضع في الجسم الحي، في لدينا مقدرة LY يضاف إلى الوسط ويخترق الجهازية من الجانب الظهاري basolateral خارج نحو تجويف apical داخل. وLY صغيرة ويستخدم فقط لتصور ضيق الحاجز المعوي. الجزيئات والمحفزات التي تعدل الطبقة الظهارية على سطح apical تحتاج إلى حقنها في تجويف الجهاز ية7. للحد من الجهد التجريبي ولتكون قادرة على قياس سلامة الحاجز من العديد من organoids في نفس الوقت، اخترنا لتطبيق صبغة الفلورسنت من الخارج.
استخدمنا القول للتحقيق في وظيفة IFN-ο على تقاطع ضيق من organoids الماوس المعوية الصغيرة. حقيقة أننا تمكنا من تحليل سلامة الحاجز في الأعضاء الحية يوفر إمكانيات مستقبلية لتطبيق هذه التقنية لوصف مثبطات للانهيار الناجم عن الالتهاب للحاجز المعوي. المواد التي تتصدى لوظيفة الحاجز الضعيف الناجمة عن IFN-ο يمكن أن تكون مرشحة لعلاج أمراض الأمعاء الالتهابية ، حيث تكون وظيفة الحاجز الضعيف واحدة من العوامل المسببة للأمراض10.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
وقد دعم هذا العمل بمنح من المؤسسة الألمانية للبحوث [KFO257(، ومشروع 4 إلى M.S. و المشروع من 1 إلى C.B.; FOR2438، المشروع 2 إلى M.S. و E.N. والمشروع 5 إلى C.B. مشروع SFB1181 C05 إلى C.B.; TRR241، المشروع A06 إلى N.B.L. و M.S.، المشروع A03 إلى C.B.، BR5196/2-1 إلى N.B.L. و BE3686/2 إلى C.B.]؛ مركز متعدد التخصصات للبحوث السريرية (IZKF) من المركز السريري إرلانغن (إلى M.S. ، E.N. ، وM.B.) ، وW. Lutz Stiftung (إلى M.S.) وForschungsstiftung Medizin من المركز السريري إرلانجن (إلى M.S. ). تم تنفيذ هذا العمل في (جزئي) الوفاء بمتطلبات الحصول على درجة الدكتور ميد من ماركو باردينباخر.
Materials
| Name | Company | Catalog Number | Comments |
| 48-well culture plate | Thermo Fisher Scientific | #150687 | |
| 8-well chamber slides | Ibidi | #80826 | |
| 96-well culture plate | Greiner Bio-One | #655101 | |
| Axio Observer.Z1 - spinning disc | Zeiss | excitation laser 488 nm / emission filter 525/25 | |
| Bovine serum albumin | Sigma-Aldrich | A3059-100G | |
| Cell strainer | Falcon | 352350 | |
| Centrifugation tube 15 mL | Thermo Fisher Scientific | 11507411 | |
| Centrifugation tube 50 mL | Thermo Fisher Scientific | 10788561 | |
| EDTA | Sigma-Aldrich | 431788-25g | |
| EGTA | Sigma-Aldrich | 431788 | |
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | L0259 | |
| Matrigel, growth factor reduced, phenol red free | Corning | 356231 | Cell matrix solution |
| Mice | The Jackson Laboratory | M. musculus C57/Bl6 | |
| Microscope coverslip | 24 mm x 60 mm | ||
| Organoid Growth Medium mouse | Stemcell Technologies | #06005 | |
| Phosphate buffered saline | Biochrom | L182-05 | |
| Recombinant murine IFN-γ | Biolegend | Cat#575304 |
References
- López-Posadas, R., Stürzl, M., Atreya, I., Neurath, M. F., Britzen-Laurent, N. Interplay of GTPases and Cytoskeleton in Cellular Barrier Defects during Gut Inflammation. Frontiers in Immunology. 8, 1240 (2017).
- Zhang, Y. Z., Li, Y. Y. Inflammatory bowel disease: pathogenesis. World Journal of Gastroenterology. 20 (1), 91-99 (2014).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Leslie, J. L., et al. Persistence and toxin production by Clostridium difficile within human intestinal organoids result in disruption of epithelial paracellular barrier function. Infection and Immunity. 83 (1), 138-145 (2015).
- Zietek, T., Rath, E., Haller, D., Daniel, H. Intestinal organoids for assessing nutrient transport, sensing and incretin secretion. Scientific Reports. 5 (1), 16831 (2015).
- Pearce, S. C., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19 (2018).
- Hill, D. R., Huang, S., Tsai, Y. H., Spence, J. R., Young, V. B. Real-time Measurement of Epithelial Barrier Permeability in Human Intestinal Organoids. Journal of Visualized Experiments. (130), e56960 (2017).
- Bardenbacher, M., et al. Permeability analyses and three dimensional imaging of interferon gamma-induced barrier disintegration in intestinal organoids. Stem Cell Research. 35, 101383 (2019).
- Tomita, M., Hotta, Y., Ohkubo, R., Awazu, S. Polarized transport was observed not in hydrophilic compounds but in dextran in Caco-2 cell monolayers. Biological and Pharmaceutical Bulletin. 22 (3), 330-331 (1999).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature Reviews: Immunology. 9 (11), 799-809 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved