Method Article
Untersuchung des Darmbarriereabbaus bei lebenden Organoiden
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier beschreiben wir eine Technik zur Quantifizierung der Barriereintegrität kleiner Darmorganoide. Die Tatsache, dass die Methode auf lebenden Organoiden basiert, ermöglicht die sequenzielle Untersuchung verschiedener Barriereintegritätsmodulisierungssubstanzen oder Kombinationen davon in einer zeitaufgelösten Weise.
Zusammenfassung
Organoide und dreidimensionale (3D) Zellkulturen ermöglichen die Untersuchung komplexer biologischer Mechanismen und Vorschriften in vitro, was in klassischen Zellkultur-Monolayern bisher nicht möglich war. Darüber hinaus sind monolayer Zellkulturen gute In-vitro-Modellsysteme, stellen aber nicht die komplexen zellulären Differenzierungsprozesse und -funktionen dar, die auf 3D-Strukturbasieren. Dies war bisher nur in Tierversuchen möglich, die mühsam, zeitaufwändig und mit optischen Techniken schwer einzuschätzen sind. Hier beschreiben wir einen Assay, um die Barriereintegrität im Laufe der Zeit bei lebenden kleinen Darm-Mausorganoiden quantitativ zu bestimmen. Um unser Modell zu validieren, haben wir Interferon-Gamma (IFN-) als positive Kontrolle zur Barrierezerstörung und Organoide, die von IFN-Rezeptor 2 abgeleitet wurden, Mäuse als Negativkontrolle ausschalten. Der Test ermöglichte es uns, die Auswirkungen von IFN-A auf die Darmbarriereintegrität und den IFN-induzierten Abbau der engen Knotenproteine Claudin-2, -7 und -15 zu bestimmen. Dieser Test könnte auch verwendet werden, um die Auswirkungen von chemischen Verbindungen, Proteinen, Toxinen, Bakterien oder patientenabgeleiteten Sonden auf die Integrität der Darmbarriere zu untersuchen.
Einleitung
Die Integrität der Epithelbarriere wird durch den apikalen Kreuzungskomplex (AJC) aufrechterhalten, der aus engen Kreuzungen (TJ) und Adhärenjunction (AJ) Proteinenbesteht 1. Die polarisierte Struktur des AJC ist entscheidend für seine Funktion in vivo. Dysregulation der AJC ist bei verschiedenen Krankheiten vorhanden und wird vermutet, ein wichtiger Auslöser der entzündlichen Darmpathogenese zu sein. Der Verlust der Darmbarrierefunktion stellt das anregungs Ereignis der Krankheit dar. Die folgende Translokation von Kommensalen und Entzündungsreaktionen sind die schmerzhaften Folgen2.
Zur Untersuchung der Regulierung des AJC wurden verschiedene In-vitro- und In-vivo-Modelleentwickelt. Der Transwell-Assay basiert auf zweidimensionalen (2D) Zellmonolayern, die aus Tumorzelllinien abgeleitet wurden. Diese Systeme sind gut zu bewerten mit optischen und biochemischen Methoden und ermöglichen die Analyse vieler Proben gleichzeitig, aber es fehlen viele Merkmale der Primärzellen und der Differenzierungsprozesse in vivo. Die Untersuchung der Barriereintegrität ist auch in Tiermodellen möglich. In terminalen Experimenten können die Auswirkungen spezifischer Behandlungen in vivo auf die Durchlässigkeit des gesamten Darms quantifiziert werden. Diese Modelle erfordern jedoch eine große Anzahl von Tieren, und sie erlauben keine detaillierte Visualisierung der zugrunde liegenden molekularen Prozesse. Heutzutage sind verbesserte 3D-In-vitro-Modelle verfügbar, die Zelldifferenzierungsprozesse, Zellpolarisation und die kryptisch-villus Struktur des Darms3darstellen. Die Anwendung von 3D-Darmorganoiden für funktionelle Analysen erfordert die Anpassung der verfügbaren Methoden aus 2D-Modellen. Hier beschreiben wir ein Modell zur Untersuchung der Integrität der Darmbarriere bei lebenden kleinen Darmmausorganoiden. Der Assay wurde eingerichtet, um die Wirkung von IFN-A auf die Barriereintegrität und die jeweiligen engen Knotenproteine8zu untersuchen.
Im Gegensatz zu der von Leslie4, Zietek5oder Pearce6angewandten Technik, die die Fluoreszenz misst, nachdem luzifergelb (LY) aus dem Medium entfernt wurde, ermöglicht unser Ansatz die Quantifizierung der luminalen Aufnahme des Fluorophors im Laufe der Zeit. Daher stellt das Ergebnis eine dynamische Aufnahmekinetik dar und unser Assay ermöglicht die Anwendung zusätzlicher Reize oder Inhibitoren während des Experiments. Die Tatsache, dass beide Assays die Aufnahme von der äußeren basolateralen Seite zur inneren apikalen Oberfläche messen, steht in klarem Gegensatz zur Situation in vivo. In einem von Hill et al.7beschriebenen Modell wurde dieses Thema untersucht. Bei der Mikroinjektion des Fluorophors in das Lumen des Organoids wurde die Fluoreszenz quantifiziert. Die Diffusionsrichtung stellt die in vivo vorliegende Richtung dar. Der technische Aufwand der Mikroinjektion reduziert den Durchsatz dieser Methode deutlich. Im Gegensatz zu dem hier beschriebenen Modell ermöglicht das Mikroinjektionsverfahren die Messung von Effekten, die eine biologische Aktivierung auf der apikalen Epitheloberfläche erfordern.
Das hier vorgestellte Organoid-Barriereintegritätsmodell basiert auf der Live-Zellmikroskopie und ermöglicht die Analyse dynamischer Veränderungen innerhalb der AJC-Regelung im Laufe der Zeit. Das Setup kann angewendet werden, um die pharmakologischen Auswirkungen von Substanzen zu testen, die die Integrität der Darmbarriere induzieren und hemmen. Darüber hinaus tragen organoidbasierte Modelle dazu bei, die Anzahl der Tiere zu reduzieren, die für pharmakologische Studien verwendet werden.
Protokoll
Alle Schritte wurden in Übereinstimmung mit allen relevanten regulatorischen und institutionellen Tierpflegerichtlinien abgeschlossen.
1. Beschichtung von Organoiden
- Isolieren Sie Organoide wie zuvor beschrieben3. Das Verfahren wird im Folgenden kurz beschrieben.
- Sammeln Sie den Dünndarm von Mäusen.
- Öffnen Sie den Dünndarm längs und entfernen Sie Zottenspitzen, indem Sie das innere Darmgewebe mit einem Deckelschlupf kratzen.
- Schneiden Sie das Darmgewebe in kleine Stücke mit einer Schere.
- Waschen Sie Stücke 5x in kaltphosphatgepufferter Saline (PBS), indem Sie die Stücke 10x nach oben und unten mit einer 25 ml Pipette pipetieren.
- Die Gewebeteile in kalter 2 mM EDTA Lösung auf Eis für 30 min auf einer horizontalen Schüttelplattform inkubieren. Lassen Sie die Gewebeteile sedimentieren.
- Ersetzen Sie die EDTA-Lösung durch einen PBS-Puffer, sobald sich die Gewebestücke unten absetzen. Entsorgen Sie den Überstand und fügen Sie 20 ml PBS hinzu.
- Lassen Sie die Darmkrypten aus dem Gewebe, indem Sie 10x mit einer 10 ml Pipette kräftig nach oben und unten pfeifen.
- Sammeln Sie den Überstand in Zentrifugationsröhrchen und inspizieren Sie ihn durch Phasenkontrastmikroskopie. Dazu fügen Sie einen Tropfen des Überstandes zu einer 96-Well-Zellkulturplatte hinzu. Zentrifugationsrohre auf Eis halten.
- Wiederholen Sie die Schritte 1.1.6–1.1.8, bis die Anzahl der Darmkrypten im gesammelten Überstand abnimmt.
- Übergeben Sie die Fraktionen, die die meisten Krypten enthalten, durch ein 70-m-Zellsieb.
- Zentrifugieren Sie die Kryptaaufhängung bei 300 x g, 4 °C für 5 min.
- Entsorgen Sie den Überstand und setzen Sie das Pellet in kaltem PBS wieder auf, um die Krypten zu waschen. Wiederholen Sie dann den Zentrifugationsschritt, wie in 1.1.11 beschrieben.
- Setzen Sie das Pellet in einer Gesamtmenge von 25 l pro Brunnen einer 1:1-Mischung aus Zellmatrixlösung und muriner Organoidkulturmedium aus und veranschlagen Sie die Organoide in einer 48-Well-Zell-Kulturplatte.
- Inkubieren Sie die Organoide bei 37 °C, 5%CO2, für 20 min, damit sich die Zellmatrixlösung verfestigen kann.
- Bedecken Sie die Organoide mit 300 L murinen Organoidmedium pro Brunnen.
- Die Organoide bei 37 °C, 5%CO2kulturieren und das Medium alle 2–3 Tage verändern.
- Verwenden Sie die Organoide für Experimente nach 7 Tagen Kultur.
- Bereiten Sie die Organoide auf die Barriereintegritätsmessung vor.
- Vorlackieren Sie alle Zentrifugationsröhren, die für die Lagerung der Organoide während des Beschichtungsprozesses verwendet werden, mit Rinderserumalbumin (BSA), indem Sie genügend einer 0,1% BSA-Lösung in PBS hinzufügen, um alle Kunststoffoberflächen abzudecken. Dann die BSA-Lösung wieder entfernen und die Zentrifugationsrohre auf Eis aufbewahren.
- Die Zellmatrixlösung und das Organoidkulturmedium auf Eis auftauen.
- Um die Organoide zu trennen, entfernen Sie vorsichtig das Kulturmedium und suspendieren Sie die Organoide aus einem Brunnen einer 48-Well-Platte in 1 ml kalten PBS. Lösen Sie die Zellmatrix durch kräftige Pipettierung auf. Halten Sie die organoide Suspension immer in Zentrifugationsröhren mit BSA vorbeschichtet und immer auf Eis.
HINWEIS: Die Dichte, Größe und Position der Organoide innerhalb des kammerförmigen Coverslip-Dias werden durch das Split-Verhältnis, die Konzentration der Zellmatrixlösung und die Handhabung der Organoid-Zell-Matrixsuspension beeinflusst. Es wird empfohlen, den Umgang mit der Zellmatrixlösung im Voraus zu üben. Normalerweise eignen sich acht gut gekammerte Glasabdeckungen für den Assay. Organoide, die aus einem Brunnen einer konfluenten 48-Well-Platte gewonnen werden, können in zwei Brunnen eines acht gut kammerförmigen Coverslips (40 l des Organoid-Zell-Matrix-Pellets pro Brunnen) aufgeteilt werden. - Zentrifugieren Sie die organoide Suspension bei 300 x g bei 4 °C für 5 min.
- Den Überstand vorsichtig entsorgen und das Pellet mit 1 ml kaltem PBS wieder aufhängen.
- Zentrifugieren Sie die organoide Suspension bei 300 x g, 4 °C für 5 min.
- Entsorgen Sie den Überstand vollständig und setzen Sie die Von einem Brunnen von einer 48-Well-Platte in 40 l kalten Medium abgeleiteten Organoide wieder auf. Fragmentieren Sie große organoide Strukturen, indem Sie die Organoidsuspension 5x durch eine 10-L-Pipettenspitze pipetieren, um Strukturen mit einer Größe von 40–60 m für die Aussaat zu sammeln.
HINWEIS: Verwenden Sie die 10-L-Spitze auf einer 100-L-Pipettenspitze für die Fragmentierung der Organoidstrukturen, und üben Sie Schritt 1.7 im Voraus, um konsistente Ergebnisse zu gewährleisten. Steuern Sie die Größe der Organoide durch Phasenkontrastmikroskopie innerhalb des Zentrifugationsrohrs. Stellen Sie sicher, dass keine multiverzweigten Organoide mehr vorhanden sind und dass die Organoidfragmente etwa 40–60 m lang sind. - Sobald die Organoide die gewünschte Größe erreicht haben, mischen Sie sie mit 40 l der Zellmatrixlösung (mittel:Zellmatrixlösung = 1:1).
HINWEIS: Das Verhältnis von mittlerer zu Zellmatrix-Lösung muss konstant gehalten werden, um konsistente Ergebnisse zu erzielen. Die Verdünnung der Zellmatrixlösung reduziert die Steifigkeit des Organoid-Blobs und wirkt sich auf seine Diffusionseigenschaften aus. Verwenden Sie vorgekühlte Pipettenspitzen (-20 °C) für alle Suspensionen, die eine Zellmatrixlösung enthalten. - Legen Sie 40 l der Organoid-Zell-Matrix-Lösung suspension in der Mitte jedes Brunnens eines 8 well kammerförmigen Deckelrutsches.
- Halten Sie die Rutsche auf einer Eispackung für 5 min. Dies bewahrt die Organoidsuspensionsflüssigkeit der Zellmatrix und erhöht die Organoidkonzentration an der deckförmigen Oberfläche durch Schwerkraft.
- 20 min bei 37 °C und 5%CO2 inkubieren, um eine Polymerisation des Organoid-Zell-Matrixblobs zu ermöglichen.
- Fügen Sie 150 l Organoidkulturmedium pro Brunnen hinzu und inkubieren Sie 24 h bei 37 °C und 5 %CO2, bevor Sie mit der experimentellen Behandlung fortfahren.
- Verwenden Sie diesen Zeitraum, um die Organoide zu behandeln und ihre Barriereintegrität gemäß der entsprechenden wissenschaftlichen Hypothese zu modulieren. Für die Positivkontrolle behandeln Sie die Organoide für 48 h mit IFN-A, um den IFN-assoziierten engen Knotenabbau und die Permeabilitätserhöhung zu untersuchen. Stimulieren Sie die Positivkontrolle mit 10 U/ml (10 ng/ml) rekombinantem murinen IFN-. Lassen Sie die Organoide eines gut behandelt.
- Kulturorganoide bei 37 °C und 5%CO2 für bis zu 48 h.
2. OrganoidPermeability Assay
- Bringen Sie die Inkubationskammer des Mikroskops mindestens 2 h auf 37 °C, bevor Sie mit dem Experiment beginnen, um die Wärmedrift zu reduzieren, während Sie die Organoide bildgeben.
- Bereiten Sie eine 100 mM Lösung von LY in PBS vor. Auf eisgeschütztem Eis aufbewahren.
- Bereiten Sie eine 200 mM Lösung von EGTA in PBS vor. Auf Eis aufbewahren.
- Übertragen Sie den kammerförmigen Deckelschlupf einschließlich der Organoide in die Inkubationskammer eines invertierten konfokalen Mikroskops und schalten Sie dieCO2-Inkubation ein (5%). Stellen Sie sicher, dass der kammerkammerige Deckelschlupf im Stadium des Mikroskops fest verriegelt ist.
- Passen Sie die bildgebenden Einstellungen des Mikroskops mit den Organoiden in einem Rahmen und einer Referenz an. Fügen Sie LY (3 l von 100 mM LY in 150 l Medium) hinzu, um ein Endvolumen von 1 mM LY in 300 l Medium zu erhalten. Inkubieren Sie auf dem Mikroskop für 1 h und passen Sie den Fokus für die Bildgebung des Lumens der Organoide an. Definieren Sie die benötigte Laserenergie für die LY-Erregung (488 nm) und die entsprechende Detektionsempfindlichkeit des Instruments und versuchen Sie, die LY-Fluoreszenz bei 30–40% des verfügbaren Dynamikbereichs des verwendeten Instruments abzubilden.
HINWEIS: Stellen Sie die Laseranregungsenergie und Detektionseffizienz bei unbehandelten Organoiden 70 min nach Zugabe von LY ein. Stellen Sie sicher, dass die Anregungsenergie hoch genug ist, um ein gut belichtetes Bild zu erhalten. Um eine Sättigung der LY-Fluoreszenz innerhalb der mikroskopischen Bilder zu vermeiden, wird empfohlen, diese Einstellungen anzupassen, nachdem die LY-Diffusion einen stabilen Zustand erreicht hat. - Definieren Sie die Position der Organoide durch Differential Interferenzkontrast (DIC) Live-Bildgebung. Versuchen Sie, Organoide mit vergleichbaren Durchmessern (80 x 30 m) abzubilden und sich auf die zentrale Scheibe der Organoide zu konzentrieren, um ihr Lumen abzubilden. Definieren Sie ungefähr 10 Organoide pro Brunnen und versuchen Sie, nur Organoide in der Nähe der Deckslip-Oberfläche mit einer kugelförmigen Struktur abzubilden.
HINWEIS: Die Anzahl der Organoide, die pro Durchlauf abgebildet werden können, hängt von der Geschwindigkeit des Mikroskops ab. Es wird empfohlen, die Organoide innerhalb eines Abstands von 5 min abzubilden. Bei einem normalen Laserscanmikroskop sind insgesamt 40 Positionen ein vernünftiger Ausgangspunkt. - Zeichnen Sie die DIC- und die LY-Fluoreszenz jeder Position auf, um die Form und Autofluoreszenz des Organoids zu dokumentieren, bevor Sie die LY zu den Brunnen hinzufügen, die für den Barriereintegritätstest verwendet werden.
- Bildorganoide, die eine hohe Autofluoreszenz aufweisen, nicht abbilden. Dies ist aufgrund der Anhäufung von abgestorbenen Zellen innerhalb des Lumens des Organoids, und die Ergebnisse von autofluoreszierenden Organoiden sind danach schwer zu analysieren.
- Verdünnen Sie 3 l der vorbereiteten LY-Lösung (100 mM LY in 150 l Medium) und fügen Sie diese sorgfältig zu jedem Brunnen hinzu, ohne den kammerierten Deckelschlupf zu berühren. Die empfohlene Konzentration von LY pro Bohrgut beträgt 1 mM. Das Endvolumen pro Bohrung sollte 300 l betragen.
- Überprüfen Sie schnell den Fokus der definierten Positionen und korrigieren Sie ihn bei Bedarf.
HINWEIS: LY diffundiert schnell durch die Zellmatrix. Daher muss die konfokale Bildgebung innerhalb von 3 min nach Zugabe des Fluorophors gestartet werden. - Starten Sie eine Zeitraffer-Bildgebung am Mikroskop. Nehmen Sie ein Fluoreszenzbild jeder Position alle 5 min für insgesamt 70 min.
HINWEIS: Die Organoide wurden in 5-min-Intervallen abgebildet, um die LY-Aufnahme im Laufe der Zeit zu visualisieren. Um den Darmbarriereabbau zu messen, reicht es aus, die Fluoreszenz vor und 60 min nach LY-Zugabe und erneut 10 min nach Zugabe von EGTA zu erfassen. - Fügen Sie 3 l der vorbereiteten EGTA-Lösung pro Brunnen hinzu, ohne den kammerierten Deckelschlupf zu berühren. Die empfohlene Konzentration innerhalb des kammerierten Deckellipses von EGTA beträgt 2 mM. Das Gesamtvolumen pro Bohrgut sollte 300 l betragen.
- Starten Sie einen zweiten Zeitraffer. Nehmen Sie die Fluoreszenz der definierten Organoide mit einem Intervall von 5 min für insgesamt 30 min wieder auf.
- Entsorgen Sie alles gemäß den örtlichen Sicherheitsvorschriften.
HINWEIS: Das Protokoll kann hier angehalten werden.
3. Datenanalyse
- Analysieren Sie nur die Ergebnisse der Organoide, die LY nach EGTA-Zugabe aufgenommen haben.
- Ergebnisse können mit Fiji ImageJ quantifiziert werden.
- Öffnen Sie das Dataset in ImageJ, indem Sie auf Datei | Öffnen und wählen Sie Bilddaten aus. Wählen Sie im folgenden Dialogfeld BIO-Formate Importoptionen Stapel anzeigen mit: Hyperstack.
- Öffnen Sie den ROI-Manager (Region of Interest), indem Sie auf Analysieren | Werkzeuge | ROI Manager.
- Zeichnen Sie einen ovalen ROI, indem Sie auf die Schaltfläche Ovale Auswahl in der ImageJ-Menüleiste klicken. Zeichnen Sie eine Auswahl, die das innere Lumen des Organoids enthält. Drücken Sie dann im ROI-Manager hinzufügen.
- Wiederholen Sie die Schritte für drei repräsentative Bereiche außerhalb des Organoids.
- Klicken Sie in der Menüleiste auf Analysieren und wählen Sie Messungen festlegenaus. Aktivieren Sie nur den mittleren Grauwert, und deaktivieren Sie jede andere Messung. Klicken Sie dann auf OK.
- Stellen Sie sicher, dass alle ROIs im ROI Manager ausgewählt sind. Klicken Sie im ROI-Manager auf Mehr | Multi-Maßnahme. Wählen Sie im Optionsdialog Alle % der Slices und eine Zeile pro Sliceaus. Klicken Sie dann auf OK.
- Wählen Sie alle Werte im Ergebnisfenster aus, und kopieren Sie sie zur weiteren Analyse in eine Tabellenkalkulationsanwendung.
HINWEIS: Wenn sich die Position des Organoids während der Zeitraffer-Bildgebung bewegt, muss der ROI entsprechend angepasst werden. Wählen Sie dazu den richtigen ROI im ROI-Manager aus und verschieben Sie ihn in die neue Position. Klicken Sie dann im ROI-Manager auf Aktualisieren. Führen Sie die Messung für jeden Zeitpunkt einzeln durch, indem Sie im ROI-Manager auf Messen klicken und dann mit der Leiste unten zum nächsten Zeitpunkt im Bildfenster wechseln. Sammeln Sie alle Messungen in einer Kalkulationstabelle. Die individuelle Form und die Bewegung von Organoiden während der Bildgebungsphase erfordert die manuelle Analyse der Daten. - Berechnen Sie den mittleren Intensitätswert der drei ROIs außerhalb des Organoids für jeden Zeitpunkt.
- Teilen Sie die Intensität des ROI innerhalb des Lumens des Organoids durch die mittlere Intensität des ROI außen und die mittlere Intensität innerhalb des Organoids.
- Um den relativen Anstieg der luminalen organoiden Fluoreszenz zu berechnen, teilen Sie die relative Fluoreszenz (siehe Schritt 3.11) zu jedem Zeitpunkt, der durch die minimale relative Fluoreszenz dargestellt wird.
HINWEIS: Verwenden Sie die minimale relative Fluoreszenz, da manchmal die Diffusion des Fluorophors zu Beginn des Experiments langsam sein kann.
Ergebnisse
Um die Anwendung von 3D-Kleinen Darm-Mausorganoiden als Modell zur Quantifizierung der Wirkung von Verbindungen zu validieren, die die Integrität der Darmbarriere regulieren, haben wir IFN-A angewendet. Dazu isolierten und kultivierten Organoide, die von IFN-responsiven Wildtyp- und IFN-Rezeptor-2-Knockout-Mäusen abgeleitet wurden, die nicht aufIFN-8reagieren. Bei Behandlung von 48 h mit IFN- oder PBS (Steuerung) wurden alle Organoide LY ausgesetzt und durch konfokale Spinnscheiben-Livezellmikroskopie in 5 min Abständen über einen Zeitraum von 70 min abgebildet. Die funktionelle Integrität der Darmbarriere in diesem Modell führte zum Ausschluss von LY aus dem Lumen des Organoids, während die intraluminale Akkumulation von LY die Zerstörung des TJ bedeutete. Die repräsentativen fluoreszenzmikroskopischen Bilder nach 70 min Inkubation mit LY zeigen deutlich, dass intraluminale LY-Fluoreszenz nur bei Organoiden von Wildtieren sichtbar war, die mit IFN-A behandelt wurden. Bei nicht stimulierten (PBS) Kontrollen oder organoiden, die von Ausstoßtieren abgeleitet wurden (IFN-R2IEC, Abbildung 1), war nach 70 min keine intraluminale LY-Fluoreszenz vorhanden.
Die Zugabe von EGTA führt zu einem unspezifischen Abbau der Darmbarriereintegrität durch Sequestrierung von TJ-Kofaktoren. Diese Kontrolle wurde immer am Ende des Experiments verwendet, um die Fähigkeit des jeweiligen Organoids zu demonstrieren, LY aufzunehmen (Abbildung 1). Wurde bei der EGTA-Behandlung keine intraluminale LY-Fluoreszenz festgestellt, wurde das Organoid vom Experiment ausgeschlossen.
Für die quantitative Auswertung der mikroskopischen Ergebnisse wurde die LY-Fluoreszenz innerhalb des Lumens des Organoids und außerhalb des Organoids gemessen. Relative Intensitätswerte wurden berechnet (Fluoreszenz innen/Fluoreszenz außen + innen) und werden für jeden abgebildeten Zeitpunkt angezeigt. Es wird empfohlen, die Bildgebung von Organoiden unterschiedlicher Größe zu vermeiden. Wir haben uns entschieden, uns auf Organoide mit einem Durchmesser von 80 x 30 m zu konzentrieren (Abbildung 2). Ein Schaltplan des Protokolls mit repräsentativen Bildern ist in Abbildung 3dargestellt. Einige wichtige Probleme und Fehlerbehebungstechniken werden in Abbildung 4dargestellt und erläutert.
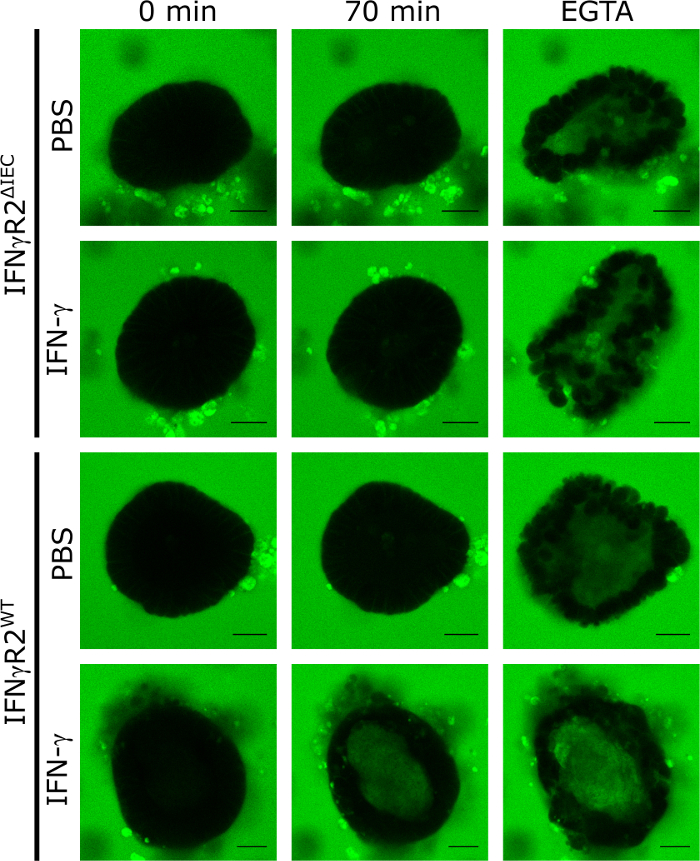
Abbildung 1: Die Integrität der Darmbarriere kann in Mausorganoiden analysiert werden. Darmorganoide aus IFN-R2WT und IFN-R2-IEC wurden in Gegenwart von IFN-A für 48 h kultiviert oder unbehandelt gelassen. Um die Integrität der Darmbarriere zu untersuchen, wurde LY (457 Da) hinzugefügt und konfokale fluoreszierende Bilder wurden in 5 min Intervallen für insgesamt 70 min aufgenommen. Repräsentative Bilder zum Zeitpunkt 0 min, 70 min und nach Zugabe von EGTA werden gezeigt (grün = Luzifergelb; Skalenbalken = 20 m). Diese Zahl wurde von Bardenbacher et al.8geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
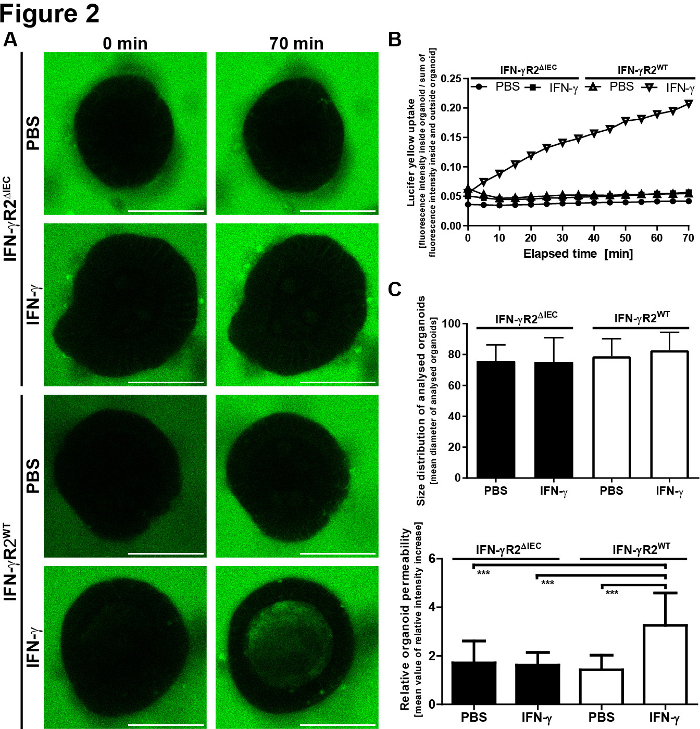
Abbildung 2: Das Modell der Integrität der integritätsischen Barriere in Darm liefert quantitative Ergebnisse. (A) Die LY-Fluoreszenz wurde innerhalb und außerhalb des Organoids bestimmt. Relative Intensitätswerte wurden (innen/fluoreszenz außen + innen) relativ zur anfänglichen relativen Intensität + SEM berechnet und für jeden Zeitpunkt angezeigt. (B) Größenverteilung der analysierten Organoide. Um die Standardabweichung und Fehler aufgrund von Veränderungen im Flächen-Volumen-Verhältnis zu reduzieren, haben wir nur Organoide mit einem Durchmesser von 80 x 30 m analysiert. Mittelwerte der jeweiligen Organoiddurchmesser werden angezeigt + SD (IFN--R2WT, n = 20; IFN-R2,n = 18). Die mittleren Durchmesserwerte variierten nicht signifikant zwischen den verschiedenen Gruppen (einwegige ANOVA). (C) Die Durchlässigkeit der Organoide wurde 70 min nach Zugabe von LY bestimmt. Es wurde definiert, indem die intraluminalen Fluoreszenzintensitäten nach 70 min durch die minimalen relativen Fluoreszenzintensitäten dividiert wurden, die während des Beobachtungszeitraums gemessen wurden. Jeder Balken steht für Mittelwerte + SD, gemessen in 10 Organoiden, die aus zwei unabhängigen Experimenten abgeleitet wurden (IFN-R2WT, n = 20; IFN-R2,n = 18). Die IFN-A erhöhte die LY-Aufnahme nur beiIFN-R2-WT-Organoiden signifikant. p-Wert <0.001 im t-Test des Schülers. Diese Zahl wurde von Bardenbacher et al.8geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
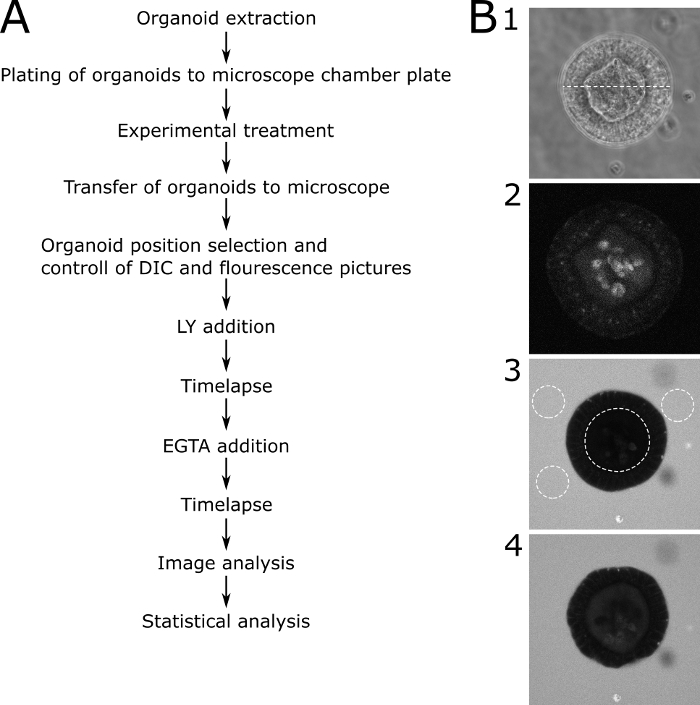
Abbildung 3: Schematisches Protokoll mit repräsentativen Bildern. (A) Schematische Beschreibung der hauptschrittedes Protokoll. (B) Repräsentative Bilder der wichtigsten Schritte des Protokolls. (B1) DIC-Mikroskopiebild einer zentralen Scheibe durch ein geeignetes Organoid, das für die Permeabilitätsanalyse ausgewählt wurde. Die gepunktete Linie stellt eine Breite von 89 m dar. (B2) Fluoreszenzmikroskopiebild desselben Organoids in (B1) vor dem Hinzufügen von LY. Das Bild zeigt die Autofluoreszenz des Organoids. (B3) Ein Organoid 70 min nach Zugabe von LY. Das abgebildete Organoid zeigt keine Aufnahme von LY und damit eine intakte Barrierefunktion. Gepunktete Linien zeigen die ROIs zur weiteren Analyse an. Das innere Lumen des Organoids und drei repräsentative Bereiche um das Organoid sind markiert. (B4) Ein Organoid nach der Zugabe von EGTA. Das Organoid ist für die weitere Analyse nutzbar, da es die LY-Aufnahme nach der EGTA-Behandlung zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
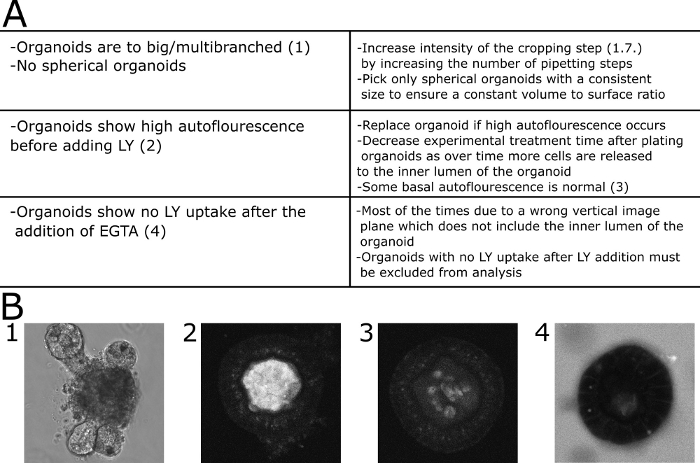
Abbildung 4: Problembehandlung bei häufig auftretenden Problemen. (A) Tabelle mit häufigen Problemen und Lösungen. (B) Beispielhafte Bilder. (B1) DIC-Bild eines großen multiverzweigten Organoids, das für diesen Test nicht geeignet ist. (B2). Konfokales Bild eines Organoids mit hoher Autofluoreszenz, bevor LY dem Medium hinzugefügt wurde. Das Organoid wurde von der Quantifizierung ausgeschlossen. (B3) Konfokales Bild eines Organoids mit geringer Autofluoreszenz, bevor LY dem Medium hinzugefügt wurde. Die Fluoreszenz wurde in diesem Fall quantifiziert. (B4) Organoid zeigt keine LY-Aufnahme aus dem Medium 30 min nach Zugabe von EGTA und daher von der Quantifizierung ausgeschlossen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieser Test bietet eine Technik, um die Darmbarriere Integrität in lebenden Organoiden zu studieren. Der gesamte Assay basiert auf kleinen Darm-Mausorganoiden und konfokaler Lebendzellmikroskopie. Daher ist es obligatorisch, den richtigen Umgang mit Organoiden im Voraus zu üben. Bei Isolation können Organoide routinemäßig geteilt und durch Kryofreezing gespeichert werden3,9. Für diesen Test empfehlen wir, die Organoide 48 h vor Beginn der Behandlung zu spalten. Diese Periode gibt den Organoiden die Möglichkeit, sich völlig zu schließen und sphärische Strukturen zu bilden. Die Aussaat der Organoide für das Experiment ist ein kritischer Schritt innerhalb des Assays. Um individuelle Handhabungsvarianten zu reduzieren, empfehlen wir ein Routineverfahren für den Aussaatprozess. Dieser Schritt ist entscheidend, und ein routinemäßiges Handling-Protokoll reduziert experimentelle Variationen deutlich.
Während des Aussaatvorgangs (Schritt 1.7) werden die Organoide durch wiederholtes Passieren durch eine Standard-Pipettespitze von 10 l fragmentiert. Die Porengröße dieses Produkts variiert von Unternehmen zu Unternehmen. Dieses Verfahren sollte im Voraus geübt werden, und das Ergebnis sollte immer durch Phasenkontrastmikroskopie überprüft werden. Sobald die erhaltenen Organoide die gewünschte Größe erreichen, ändern Sie das Verfahren nicht.
Die Aussaat der Organoide muss optimiert und an das verfügbare mikroskopische Setup angepasst werden. Um Organoide mindestens 48 h kulturieren und abbilden zu können, ist eine inkubierte Mikroskopkammer unbedingt erforderlich. Wählen Sie einen kammerierten Coverslip, der Ihren Anforderungen entspricht. Achten Sie bei der Aussaat der Organoide darauf, die Organoide auf die deckförmige Oberfläche zu konzentrieren. Dies ist möglich, indem der kammerförmige Coverslip für 5 min nach dem Platzieren der Zellmatrix-Organoidsuspension auf einer Eispackung gehalten wird. Dieser Schritt ist wichtig, um die Qualität der konfokalen Live-Zell-Bildgebung zu erhöhen. Die axiale Auflösung und der Arbeitsabstand von konfokalen Mikroskoplinsen sind besonders begrenzt. Je näher Sie die Probe zur Linse bringen, desto besser können Sie sie abbilden und desto weniger Laserenergie wird benötigt, um die LY-Fluoreszenz zu erregen.
Phototaxis ist ein wichtiges Thema, wenn es um die Lebende Zellmikroskopie geht. Innerhalb dieses Assays schließen wir diese Option aus. Ein funktioneller AJC ist sichtbar, indem LY aus dem Lumen des Organoids ausgeschlossen wird (Abbildung 1, PBS). Die Zugabe von EGTA am Ende des Experiments bewirkt die Sequestrierung bivalenter Ionen, die Kofaktoren für AJC-Proteine sind. LY ist vom Lumen des Organoids nur bei lebenswichtigen Organoiden mit einem funktionellen AJC-Komplex ausgeschlossen. Im Allgemeinen können fluoreszierende Moleküle verwendet werden, um die Integrität der Darmbarriere zu messen. Wir haben uns für LY anstelle anderer gebräuchlich erwählter Fluorophore wie Fluorescein mit Dextran, da diese transzellular in Darmzellen vom Basal in das apikale Fach9transportiert werden. Wir haben uns auch für LY aufgrund seiner geringen Größe entschieden. LY hat ein Molekulargewicht von 457 Da und erleichtert somit die Untersuchung der Barrieredurchlässigkeit für kleine Moleküle. Das fluoreszierende Molekül muss je nach untersuchter wissenschaftlicher Frage ausgewählt werden. Da phototoxische AJC-Defekte vorhanden sind, muss die Laseranregungsenergie reduziert oder das Bildgebungsintervall verlängert werden. Die optimale konfokale Bildgebungstechnik für diesen Test ist die Spinnbandmikroskopie. Entsprechende Instrumente ermöglichen konfokale Bildgebung mit kurzer Belichtungszeit bei geringer Laserleistung.
Verschiedene Modelle wurden bereits entwickelt, um die Integrität der Darmbarriere in vitro zu untersuchen. Während die Verwendung von Assays auf Basis von Zelllinien-Monolayern oder Experimenten in vivo abnimmt, nehmen organoidbasierte Methoden zu. Im Gegensatz zu den zuvor beschriebenen Methoden4,5,6,7ermöglicht unsere Methode die Quantifizierung der Barrierefunktion im Zeitverlauf. Dies ermöglicht die Exposition der Organoide zu zusätzlichen Reizen im Laufe des Experiments. Hier wenden wir EGTA als zweiten Stimulus am Ende des Experiments als positivan.
Im Gegensatz zur Situation invivo wird in unserem Test LY in das Medium aufgenommen und dringt von der äußeren basolateralen Epithelseite in das innere apikale Lumen ein. Die LY ist klein und wird nur verwendet, um die Dichtheit der Darmbarriere zu visualisieren. Moleküle und Reize, die die Epithelschicht an der apikalen Oberfläche modulieren, müssen in dasLumendes Organoids 7 injiziert werden. Um den experimentellen Aufwand zu reduzieren und gleichzeitig die Barriereintegrität vieler Organoide messen zu können, haben wir uns dafür entschieden, den Fluoreszenzfarbstoff von außen anzuwenden.
Wir verwendeten den Assay, um die Funktion von IFN-A an der engen Kreuzung kleiner Darm-Maus-Organoide zu untersuchen. Die Tatsache, dass wir die Barriereintegrität bei lebenden Organoiden analysieren konnten, bietet zukünftige Möglichkeiten, diese Technik anzuwenden, um Inhibitoren für den entzündungsinduzierten Abbau der Darmbarriere zu beschreiben. Stoffe, die der durch IFN-A verursachten eingeschränkten Barrierefunktion entgegenwirken, könnten Kandidaten für die Behandlung entzündlicher Darmerkrankungen sein, bei denen eine eingeschränkte Barrierefunktion einer der pathogenen Faktoren ist10.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde durch Stipendien der Deutschen Forschungsgemeinschaft (DFG) [KFO257, Projekt 4 bis M.S. und Projekt 1 bis C.B. unterstützt; FOR2438, Projekt 2 bis M.S. und E.N. und Projekt 5 bis C.B.; SFB1181 Projekt C05 bis C.B.; TRR241, Projekt A06 bis N.B.L. und M.S., Projekt A03 zu C.B., BR5196/2-1 bis N.B.L. und BE3686/2 bis C.B.]; das Interdisziplinäre Zentrum für Klinische Forschung (IZKF) des Klinischen Zentrums Erlangen (nach M.S., E.N. und M.B.), die W. Lutz Stiftung (zu M.S.) und die Forschungsstiftung Medizin des Klinischen Zentrums Erlangen (zu M.S.). Die vorliegende Arbeit erfolgte in (teilweiser) Erfüllung der Voraussetzungen für den Abschluss Dr. Med. von Marco Bardenbacher.
Materialien
| Name | Company | Catalog Number | Comments |
| 48-well culture plate | Thermo Fisher Scientific | #150687 | |
| 8-well chamber slides | Ibidi | #80826 | |
| 96-well culture plate | Greiner Bio-One | #655101 | |
| Axio Observer.Z1 - spinning disc | Zeiss | excitation laser 488 nm / emission filter 525/25 | |
| Bovine serum albumin | Sigma-Aldrich | A3059-100G | |
| Cell strainer | Falcon | 352350 | |
| Centrifugation tube 15 mL | Thermo Fisher Scientific | 11507411 | |
| Centrifugation tube 50 mL | Thermo Fisher Scientific | 10788561 | |
| EDTA | Sigma-Aldrich | 431788-25g | |
| EGTA | Sigma-Aldrich | 431788 | |
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | L0259 | |
| Matrigel, growth factor reduced, phenol red free | Corning | 356231 | Cell matrix solution |
| Mice | The Jackson Laboratory | M. musculus C57/Bl6 | |
| Microscope coverslip | 24 mm x 60 mm | ||
| Organoid Growth Medium mouse | Stemcell Technologies | #06005 | |
| Phosphate buffered saline | Biochrom | L182-05 | |
| Recombinant murine IFN-γ | Biolegend | Cat#575304 |
Referenzen
- López-Posadas, R., Stürzl, M., Atreya, I., Neurath, M. F., Britzen-Laurent, N. Interplay of GTPases and Cytoskeleton in Cellular Barrier Defects during Gut Inflammation. Frontiers in Immunology. 8, 1240 (2017).
- Zhang, Y. Z., Li, Y. Y. Inflammatory bowel disease: pathogenesis. World Journal of Gastroenterology. 20 (1), 91-99 (2014).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Leslie, J. L., et al. Persistence and toxin production by Clostridium difficile within human intestinal organoids result in disruption of epithelial paracellular barrier function. Infection and Immunity. 83 (1), 138-145 (2015).
- Zietek, T., Rath, E., Haller, D., Daniel, H. Intestinal organoids for assessing nutrient transport, sensing and incretin secretion. Scientific Reports. 5 (1), 16831 (2015).
- Pearce, S. C., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19 (2018).
- Hill, D. R., Huang, S., Tsai, Y. H., Spence, J. R., Young, V. B. Real-time Measurement of Epithelial Barrier Permeability in Human Intestinal Organoids. Journal of Visualized Experiments. (130), e56960 (2017).
- Bardenbacher, M., et al. Permeability analyses and three dimensional imaging of interferon gamma-induced barrier disintegration in intestinal organoids. Stem Cell Research. 35, 101383 (2019).
- Tomita, M., Hotta, Y., Ohkubo, R., Awazu, S. Polarized transport was observed not in hydrophilic compounds but in dextran in Caco-2 cell monolayers. Biological and Pharmaceutical Bulletin. 22 (3), 330-331 (1999).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature Reviews: Immunology. 9 (11), 799-809 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten