Method Article
Indagare la rottura della barriera intestinale negli organiidi viventi
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui descriviamo una tecnica per quantificare l'integrità della barriera di piccoli organoidi intestinali. Il fatto che il metodo si basi su organoidi viventi consente l'indagine sequenziale di diverse sostanze o combinazioni di integrità della barriera in modo risolto nel tempo.
Abstract
Gli organoidi e le colture cellulari tridimensionali (3D) consentono lo studio di complessi meccanismi biologici e regolamenti invitro, che in precedenza non erano possibili nei monostrati classici della coltura cellulare. Inoltre, le colture cellulari monostrato sono buoni sistemi di modelli in vitro, ma non rappresentano i complessi processi di differenziazione cellulare e le funzioni che si basano sulla struttura 3D. Ciò è stato finora possibile solo negli esperimenti sugli animali, che sono laboriosi, dispendiosi in termini di tempo e difficili da valutare con tecniche ottiche. Qui descriviamo un saggio per determinare quantitativamente l'integrità della barriera nel tempo nel vivere piccoli organoidi murini intestinali. Per convalidare il nostro modello, abbiamo applicato la gamma di interferone (IFN-z) come controllo positivo per la distruzione della barriera e gli organoidi derivati dal recettore IFN-z - i topi come controllo negativo. Il test ci ha permesso di determinare l'impatto dell'IFN-z sull'integrità della barriera intestinale e sulla degradazione indotta da IFN-z delle proteine di giunzione strette claudin-2, -7 e -15. Questo test potrebbe anche essere usato per studiare l'impatto di composti chimici, proteine, tossine, batteri o sonde derivate dal paziente sull'integrità della barriera intestinale.
Introduzione
L'integrità della barriera epiteliale è mantenuta dal complesso giunzionale apile (AJC), che consiste in proteine di giunzione stretta (TJ) e di aderenza (AJ)1. La struttura polarizzata dell'AJC è fondamentale per la sua funzione in vivo. La disregolazione dell'AJC è presente in varie malattie ed è sospettato di essere un importante innesco di patogenesi infiammatoria intestinale. La perdita della funzione di barriera intestinale rappresenta l'evento di atto della malattia. La seguente traslocazione di batteri commensie e risposte infiammatorie sono le conseguenze dolorose2.
Sono stati sviluppati vari modelli in vitro e in. vivo per studiare la regolazione dell'AJC. Il saggio Transwell si basa su monostrati cellulari bidimensionali (2D) derivati da linee cellulari tumorali. Questi sistemi sono buoni da valutare con metodi ottici e biochimici e consentono l'analisi di molti campioni allo stesso tempo, ma mancano di molte caratteristiche delle cellule primarie e dei processi di differenziazione presenti in vivo. È possibile studiare l'integrità della barriera anche nei modelli animali. Negli esperimenti terminali, gli effetti di trattamenti specifici in vivo sulla permeabilità dell'intero intestino possono essere quantificati. Tuttavia, questi modelli richiedono un gran numero di animali e non consentono una visualizzazione dettagliata dei processi molecolari sottostanti. Al giorno d'oggi sono disponibili modelli 3D in vitro migliorati che ricapitolano da vicino i processi di differenziazione cellulare, polarizzazione cellulare, e rappresentano la struttura cripta-villus dell'intestino3. L'applicazione di organoidi intestinali 3D per analisi funzionali richiede l'adattamento dei metodi disponibili da modelli 2D. Qui descriviamo un modello per studiare l'integrità della barriera intestinale nel vivere piccoli organoidi intestinali. Il test è stato istituito per studiare l'effetto dell'IFN-z sull'integrità della barriera e sulle rispettive proteine di giunzione strette8.
In contrasto con la tecnica applicata da Leslie4, sèetek5, o Pearce6, che misura la fluorescenza dopo aver rimosso il giallo lucifero (LY) dal mezzo, il nostro approccio consente la quantificazione dell'assorbimento luminoale del fluoroforo nel tempo. Pertanto, il risultato rappresenta una cinetica di assorbimento dinamico e il nostro saggio consente l'applicazione di stimoli o inibitori aggiuntivi durante il corso dell'esperimento. Il fatto che entrambi i saggi misurino l'assorbimento dal lato basolaterale esterno alla superficie apicale interna è in palese contrasto con la situazione in vivo. In un modello descritto da Hill et al.7, questo argomento è stato esplorato. Dopo la microiniezione del fluoroforo nel lume dell'organoide, la fluorescenza è stata quantificata. La direzione della diffusione rappresenta la direzione presente in vivo. Lo sforzo tecnico della microiniezione riduce chiaramente la produttività di questo metodo. A differenza del modello qui descritto, il metodo di microiniezione consente la misurazione degli effetti che richiedono l'attivazione biologica sulla superficie epiteliale apicale.
Il modello di integrità della barriera organoide qui presentato si basa sulla microscopia delle cellule vive e consente l'analisi dei cambiamenti dinamici all'interno del regolamento AJC nel tempo. L'installazione può essere applicata per testare l'impatto farmacologico delle sostanze che inducono e inibiscono l'integrità della barriera intestinale. Inoltre, i modelli a base di organoidi aiutano a ridurre il numero di animali utilizzati per gli studi farmacologici.
Protocollo
Tutte le fasi sono state completate in conformità e nel rispetto di tutte le pertinenti linee guida normative e istituzionali per la cura degli animali.
1. Placcatura degli organiidi
- Isolare gli organoidi come descritto in precedenza3. La procedura è brevemente descritta di seguito.
- Raccogliere l'intestino tenue dai topi.
- Aprire l'intestino tenue longitudinalmente e rimuovere le punte di villi raschiando il tessuto intestinale interno con un coperchio.
- Tagliare il tessuto intestinale in piccoli pezzi utilizzando le forbici.
- Lavare i pezzi 5 volte in salina fredda con buffer di fosfato (PBS) pipettando i pezzi 10 volte su e giù con una pipetta da 25 mL.
- Incubare i pezzi di tessuto a freddo 2 mM soluzione EDTA sul ghiaccio per 30 min su una piattaforma di agitazione orizzontale. Lasciare sedimentare i pezzi di tessuto.
- Sostituire la soluzione EDTA con il buffer PBS una volta che i pezzi di tessuto si depositano nella parte inferiore. Eliminare il supernatante e aggiungere 20 mL di PBS.
- Rilasciare le cripte intestinali dal tessuto pipettando vigorosamente 10 volte su e giù con una pipetta da 10 mL.
- Raccogliere il supernatante in tubi di centrifugazione e ispezionarlo mediante microscopia a contrasto di fase. Per fare questo, aggiungere una goccia del supernatante a una piastra di coltura di cellule 96 bene. Tenere i tubi di centrifugazione sul ghiaccio.
- Ripetere i passaggi da 1.1.6– 1.1.8 fino a quando il numero di cripte intestinali nelle cripte supernatali raccolte diminuisce.
- Passare le frazioni contenenti il maggior numero di cripte attraverso un colino cellulare di 70 m.
- Centrifugare la sospensione cripta a 300 x g, 4 gradi c per 5 min.
- Scartare il supernatante e risospendere il pellet nella PBS fredda per lavare le cripte. Ripetere quindi la fase di centrifugazione come descritto in 1.1.11.
- Risospendere il pellet in un totale di 25 l per pozzetto di una miscela 1:1 di soluzione a matrice cellulare e mezzo di coltura organicile murina e placcare gli organoidi in un 48 piastre di coltura cellulare bene.
- Incubare gli organoidi a 37 gradi centigradi, 5% CO2, per 20 min per consentire alla soluzione della matrice cellulare di solidificare.
- Coprire gli organoidi con 300 gradi di mezzo organoide murino per pozzo.
- Coltura gli organoidi a 37 gradi centigradi, 5% CO2, cambiando il mezzo ogni 2-3 giorni.
- Utilizzare gli organoidi per gli esperimenti dopo 7 giorni di cultura.
- Preparare gli organoidi per la misurazione dell'integrità della barriera.
- Precoat tutti i tubi di centrifugazione che verranno utilizzati per conservare gli organoidi durante il processo di placcatura con albumina siero bovino (BSA) aggiungendo abbastanza di una soluzione BSA 0.1% in PBS per coprire tutte le superfici plastiche. Quindi rimuovere nuovamente la soluzione BSA e conservare i tubi di centrifugazione sul ghiaccio.
- Scongelare la soluzione della matrice cellulare e il mezzo di coltura organoide sul ghiaccio.
- Per separare gli organoidi, rimuovere con cura il mezzo di coltura e risospendere gli organoidi da un pozzo di una piastra di 48 mL in 1 mL di PBS freddo. Sciogliere la matrice cellulare con una pipettatura vigorosa. Mantenere sempre la sospensione organoide in tubi di centrifugazione prerivestiti con BSA e tenere sempre sul ghiaccio.
NOT: La densità, le dimensioni e la posizione degli organoidi all'interno del vetrino a vetrino a camere sono influenzate dal rapporto di divisione, dalla concentrazione della soluzione della matrice cellulare e dalla gestione della sospensione della matrice di cellule organoidi. Si raccomanda di praticare in anticipo la gestione della soluzione di matrice cellulare. Di solito otto coperture in vetro ben camereantiisono adatti per il saggio. Gli organiidi derivati da un pozzo di una piastra confluente 48 possono essere suddivisi in due pozzetti di un coperchio di otto vetrini ben camerati (40 l del pellet a matrice organoide-cellula per pozzo). - Centrifugare la sospensione organoide a 300 x g a 4 gradi centigradi per 5 min.
- Scartare con cura il supernatante e risospendere il pellet con 1 mL di PBS freddo.
- Centrifugare la sospensione organoide a 300 x g, 4 gradi centigradi per 5 min.
- Scartare completamente il supernatante e risospendere gli organoidi derivati da un pozzo da una piastra di 48 pozze in 40 gradi di mezzo freddo. Frammenta grandi strutture organoidi convogliando la sospensione organoide 5 volte attraverso una punta di pipetta da 10 .L per raccogliere strutture di dimensioni di 40-60 m per il seeding.
NOT: Per la frammentazione delle strutture organoidi, utilizzare la punta da 10 l su una punta da 100 ,l, e praticare in anticipo la fase 1.7 per garantire risultati coerenti. Controllare le dimensioni degli organoidi mediante microscopia a contrasto di fase all'interno del tubo di centrifugazione. Assicurarsi che non siano presenti più organoidi multibranchi a più branchi e che i frammenti di organoididi siano lunghi circa 40-60 m. - Una volta che gli organoidi hanno ottenuto la dimensione desiderata, mescolarli con 40 gradi l della soluzione della matrice cellulare (soluzione media: matrice cellulare : 1:1).
NOT: Il rapporto di soluzione della soluzione di matrice medio-cellulare deve essere mantenuto costante per ottenere risultati coerenti. La diluizione della soluzione a matrice cellulare riduce la rigidità del blob organoide e influisce sulle sue proprietà di diffusione. Utilizzare punte di pipet preraffreddate (-20 gradi centigradi) per tutte le sospensioni contenenti la soluzione a matrice cellulare. - Posizionare 40 ll della sospensione della soluzione a matrice di cellule organidiche al centro di ogni pozzetto di un coperchio 8 ben camerato.
- Tenere il vetrino su una confezione di ghiaccio per 5 min. Questo mantiene la matrice cellulare liquido di sospensione organoide e aumenta la concentrazione organoide sulla superficie dello scivolo per gravità.
- Incubare per 20 min a 37 s C e 5% CO2 per consentire la polimerizzazione del blob di matrice di cellule organoidi.
- Aggiungete 150 l di mezzo di coltura organoide per pozzo e incubate per 24 ore a 37 oC e il 5% di CO2 prima di procedere con il trattamento sperimentale.
- Utilizzare questo periodo per trattare gli organoidi e modulare la loro integrità barriera secondo l'ipotesi scientifica corrispondente. Per il controllo positivo, trattare gli organoidi per 48 h con IFN-z al fine di studiare la degradazione stretta della giunzione associata a IFN-z e l'aumento della permeabilità. Stimolare il controllo positivo con 10 U/mL (10 ng/mL) ricombinante murine IFN-z. Lasciare gli organoidi di uno ben non trattata.
- Organidi coltura a 37 e 5% CO2 per un massimo di 48 h.
2. Assaggio di organidPermeabilità
- Portare la camera di incubazione del microscopio a 37 gradi centigradi almeno 2 h prima di iniziare l'esperimento per ridurre la deriva termica durante l'imaging degli organoidi.
- Preparare una soluzione da 100 mM di LY in PBS. Conservare sul ghiaccio protetto dalla luce.
- Preparare una soluzione da 200 mM di EGTA in PBS. Conservalo sul ghiaccio.
- Trasferire il coperchio camerato compresi gli organoidi nella camera di incubazione di un microscopio confocale invertito e accendere l'incubazione di CO2 (5%). Assicurarsi che il coperchio camerato sia strettamente bloccato all'interno dello stadio del microscopio.
- Utilizzando gli organoidi in uno così come un riferimento, regolare le impostazioni di imaging del microscopio. Aggiungere LY (3 - L di 100 mM LY in 150 - L di mezzo) per ottenere un volume finale di 1 mM LY in 300 - L di media. Incubare al microscopio per 1 h e regolare la messa a fuoco per l'imaging del lume degli organoidi. Definire l'energia laser necessaria per l'eccitazione LY (488 nm) e la rispettiva sensibilità di rilevamento dello strumento e cercare di immaginare la fluorescenza LY al 30-40% della gamma dinamica disponibile dello strumento utilizzato.
NOT: Regolare l'energia di eccitazione laser e l'efficienza di rilevamento su organoidi non trattati 70 min dopo l'aggiunta di LY. Assicurarsi che l'energia di eccitazione sia sufficientemente alta da ottenere un'immagine ben esposta. Per evitare la saturazione della fluorescenza LY all'interno delle immagini microscopiche, si consiglia di regolare queste impostazioni dopo che la diffusione LY raggiunge uno stato costante. - Definire la posizione degli organoidi mediante imaging live DIC (Differential interference contrast). Provate a immaginare organoidi con diametri comparabili (80 x 30 m) e concentratevi sulla fetta centrale degli organoidi per immaginare il loro lume. Definire circa 10 organoidi per pozzo e cercare di immaginare solo organoidi vicino alla superficie coverslip con una struttura sferica.
NOT: Il numero di organoidi che possono essere immagine per corsa dipende dalla velocità del microscopio. Si consiglia di immaginare gli organoidi entro un intervallo di 5 min. Su un microscopio a scansione laser regolare, 40 posizioni in totale sono un punto di partenza ragionevole. - Registrare il DIC e la fluorescenza LY di ogni posizione per documentare la forma e l'autofluorescenza dell'organoide prima di aggiungere la LY ai pozzi, utilizzati per il saggio di integrità della barriera.
- Non immaginire organoidi che mostrano un'elevata autofluorescenza. Ciò è dovuto all'accumulo di cellule morte all'interno del lume dell'organoide, e i risultati degli organoidi autofluorescenti sono difficili da analizzare in seguito.
- Diluire 3 l della soluzione LY preparata (100 mMLY in 150 gradi di mezzo) e aggiungerlo con cura a ogni pozzo senza toccare lo scivolo camerato. La concentrazione raccomandata di LY per pozzo è di 1 mM. Il volume finale per pozzo dovrebbe essere 300.
- Controllare rapidamente la messa a fuoco delle posizioni definite e correggere se necessario.
NOT: LY si diffonde rapidamente attraverso la matrice cellulare. Pertanto, l'imaging confocale deve essere avviato entro 3 min dopo l'aggiunta del fluoroforo. - Avviare un'immagine time-lapse al microscopio. Prendere un'immagine di fluorescenza di ogni posizione ogni 5 min per un totale di 70 min.
NOT: Gli organoidi sono stati immagine in intervalli di 5 min per visualizzare l'assorbimento DI LY nel tempo. Per misurare la rottura della barriera intestinale, è sufficiente registrare la fluorescenza prima e 60 min dopo l'aggiunta LY e ancora una volta 10 min dopo l'aggiunta di EGTA. - Aggiungere 3 le le soluzione EGTA preparate per bene senza toccare il coperchio camerato. La concentrazione raccomandata all'interno della coverslip camerata di EGTA è di 2 mM. Il volume totale per pozzo dovrebbe essere 300.
- Iniziare un secondo time-lapse. Registrare nuovamente la fluorescenza degli organoidi definiti con un intervallo di 5 min per un totale di 30 min.
- Eliminare tutto secondo le norme di sicurezza locali.
NOT: Il protocollo può essere messo in pausa qui.
3. Analisi dei dati
- Analizzare solo i risultati degli organoidi che hanno assunto LY dopo l'aggiunta di EGTA.
- I risultati possono essere quantificati con Fiji ImageJ.
- Aprire il dataset in ImageJ facendo clic su File Aprire e selezionare i dati immagine. Nella seguente finestra di dialogo Opzioni di importazione dei formati BIO, selezionare Visualizza pila con: Hyperstack.
- Aprire il gestore della regione di interesse (ROI) facendo clic su Analizza. Proprietà Tools (Strumenti) Gestione ROI.
- Disegnare un ROI ovale facendo clic sul pulsante di selezione ovale nella barra dei menu di ImageJ. Disegnare una selezione contenente il lume interno dell'organoide. Quindi premere Aggiungi in Gestione ROI.
- Ripetere i passaggi per tre aree rappresentative al di fuori dell'organoide.
- Fare clic su Analizza nella barra dei menu e selezionare Imposta misure. Attivare solo Valore grigio medio e disabilitare qualsiasi altra misurazione. Quindi fare clic su OK.
- Assicurarsi che tutti i ROI siano selezionati in Gestione ROI. In Gestione ROI, fare clic su Altro. Multi misura. Nella finestra di dialogo delle opzioni, selezionate Misura tutte le sezioni [...] e Una riga per sezione. Quindi fare clic su OK.
- Selezionare tutti i valori nella finestra Risultati e copiarli in un'applicazione per fogli di calcolo per un'ulteriore analisi.
NOT: Se la posizione dell'organoide si è spostata durante l'imaging time-lapse, il ROI deve essere regolato di conseguenza. A tale scopo, selezionare il ROI corretto nel gestore del ROI e spostarlo nella nuova posizione. Quindi fare clic su Aggiorna nel gestore del ROI. Eseguire la misurazione per ogni timepoint singolarmente facendo clic su Misura nel gestore del ROI, quindi passare al punto temporale successivo nella finestra dell'immagine utilizzando la barra in basso. Raccogliere tutte le misurazioni in un foglio di calcolo. La forma individuale e il movimento degli organoidi durante il periodo di imaging richiedono l'analisi dei dati in modo manuale. - Calcolare il valore medio di intensità dei tre ROI al di fuori dell'organoid per ogni punto temporale.
- Dividere l'intensità del ROI all'interno del lume dell'organoide per l'intensità media del ROI esterno e l'intensità media all'interno dell'organoide.
- Per calcolare l'aumento relativo della fluorescenza organoide luminale, dividere la fluorescenza relativa (vedi passo 3.11) ad ogni punto temporale immagine della fluorescenza relativa minima.
NOT: Utilizzare la fluorescenza relativa minima, perché a volte la diffusione del fluoroforo può essere lenta all'inizio dell'esperimento.
Risultati
Per convalidare l'applicazione di piccoli organoidi intestinali 3D come modello per quantificare l'effetto dei composti che regolano l'integrità della barriera intestinale, abbiamo applicato IFN-z. Per farlo, abbiamo isolato e coltivato organoidi derivati da IFN-z responsive wild type e IFN-z-receptor-2 knockout topi, che non rispondono aIFN-8. Dopo il trattamento per 48 h con IFN-z o PBS (controllo), tutti gli organoidi sono stati esposti a LY e immagini per microscopia a celle vive del disco di filatura confocale in intervalli di 5 min per un periodo di 70 min. L'integrità funzionale della barriera intestinale in questo modello ha provocato l'esclusione di LY dal lume dell'organoide, mentre l'accumulo intraluminale di LY significava distruzione del TJ. Le immagini microscopiche a fluorescenza rappresentativa dopo 70 min di incubazione con LY dimostrano chiaramente che la fluorescenza LY intraluminale era visibile solo negli organoidi di animali selvatici trattati con IFN-z. Nei controlli non stimolati (PBS) né negli organoidi derivati dagli animali knock out (IFN-R2 -IEC, Figura 1), non era presente alcuna fluorescenza LY intraluminale dopo 70 min.
L'aggiunta di EGTA provoca una ripartizione non specifica dell'integrità della barriera intestinale sequestrando i cofattori TJ. Questo controllo è sempre stato utilizzato alla fine dell'esperimento per dimostrare la capacità del rispettivo organoide di assumere LY (Figura 1). Se al momento del trattamento EGTA non è stata rilevata alcuna fluorescenza LY intraluminale, l'organoide è stato escluso dall'esperimento.
Per la valutazione quantitativa dei risultati microscopici, la fluorescenza LY è stata misurata all'interno del lume dell'organoid e al di fuori dell'organoide. I valori di intensità relativa sono stati calcolati (fluorescenza all'interno/fluorescenza all'esterno all'interno) e vengono visualizzati per ogni punto temporale immagine. Si raccomanda di evitare l'imaging di organoidi di varie dimensioni. Abbiamo scelto di concentrarci sugli organoidi con un diametro di 80 x 30 m (Figura 2). Uno schema del protocollo con immagini rappresentative è illustrato nella figura 3. Alcuni problemi principali e tecniche di risoluzione dei problemi sono illustrati e discussi nella Figura 4.
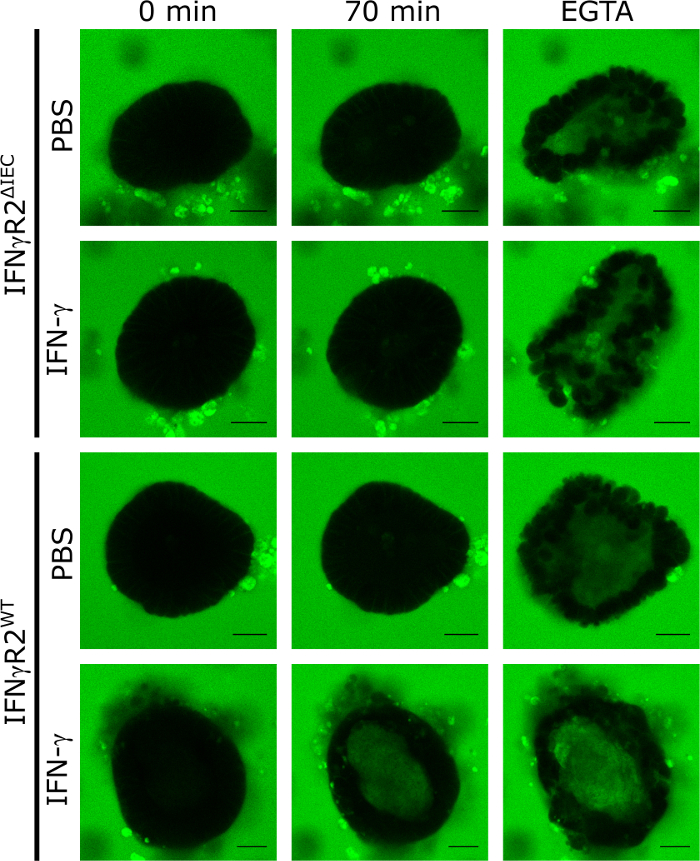
Figura 1: L'integrità della barriera intestinale può essere analizzata negli organoidi del topo. Gli organoidi intestinali dell'IFN--R2WT e dell'IFN-R2ΔIEC sono stati coltivati in presenza di IFN-1o-48 h o non trattati. Per studiare l'integrità della barriera intestinale, è stato aggiunto LY (457 Da) e sono state catturate immagini fluorescenti confocali e sono state catturate a intervalli di 5 min per un totale di 70 min. immagini rappresentative al punto temporale 0 min, 70 min, e dopo l'aggiunta di EGTA sono mostrate (verde : Lucifero giallo; Barra della scala: 20 m. Questa cifra è stata modificata da Bardenbacher et al.8. Fare clic qui per visualizzare una versione più grande di questa figura.
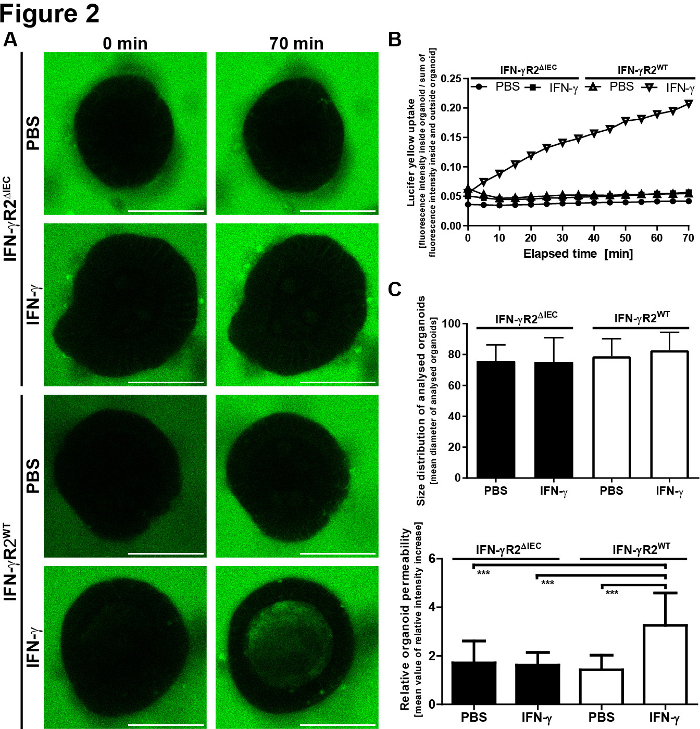
Figura 2: Piccolo modello di integrità della barriera organoide intestinale fornisce risultati quantitativi. (A) la fluorescenza LY è stata determinata all'interno e all'esterno dell'organoide. I valori di intensità relativa sono stati calcolati (all'interno/fluorescenza all'esterno) rispetto all'intensità relativa iniziale, ovvero SEM, e vengono visualizzati per ogni punto temporale. (B) Distribuzione delle dimensioni degli organoidi analizzati. Per ridurre la deviazione standard e gli errori dovuti a cambiamenti nel rapporto superficie-volume, abbiamo analizzato solo gli organoidi con un diametro di 80 x 30 m. Vengono indicati i valori medi dei rispettivi diametri organoidi, ovvero SD (IFN-R2WT, n - 20; IFN - -IEC, n , 18). I valori del diametro medio non sono variati in modo significativo tra i diversi gruppi (ANOVA unidirezionale). (C) La permeabilità degli organoidi è stata determinata 70 min dopo l'aggiunta di LY. È stato definito dividendo le intensità di fluorescenza intraluminale dopo 70 minuti per le intensità minime di fluorescenza relativa misurata durante il periodo di osservazione. Ogni barra rappresenta i valori medi, la SD, misurati in 10 organoidi derivati da due esperimenti indipendenti (IFN-R2WT, n - 20; IFN - -IEC, n , 18). L'indice IFN-z aumentò significativamente l'assorbimento di LY solo negli organoidi IFN-R2WT. p-value <0.001 nel test t di Student. Questa cifra è stata modificata da Bardenbacher et al.8. Fare clic qui per visualizzare una versione più grande di questa figura.
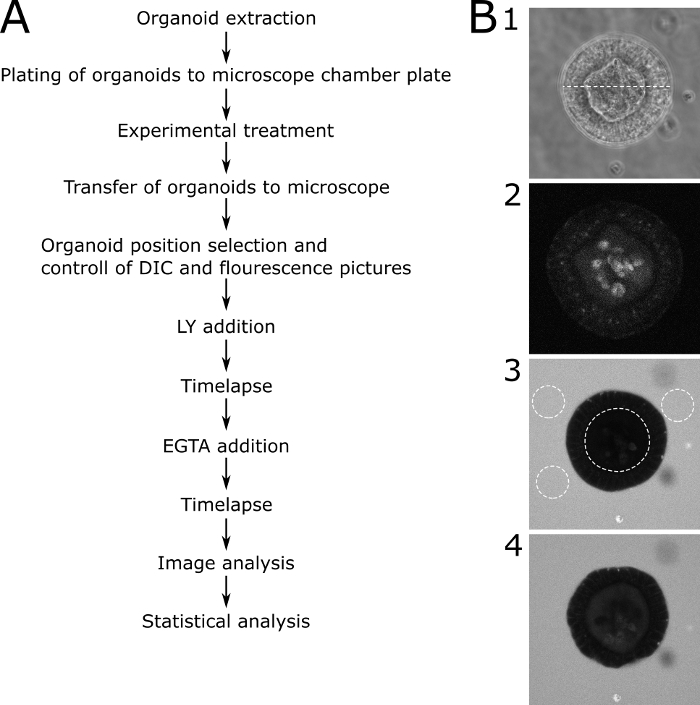
Figura 3: Protocollo schematico con immagini rappresentative. (A) Descrizione schematica dei passaggi principali del protocollo. (B) Immagini rappresentative delle principali fasi del protocollo. (B1) Immagine di microscopia DIC di una fetta centrale attraverso un organoide adatto che è stato selezionato per l'analisi della permeabilità. La linea tratteggiata rappresenta una larghezza di 89 m. (B2) Immagine microscopia a fluorescenza dello stesso organoide in (B1) prima di aggiungere LY. L'immagine mostra l'autofluorescenza dell'organoide. (B3) Un organoide 70 min dopo l'aggiunta di LY. L'organoide raffigurato non mostra alcun assorbimento di LY e quindi una funzione di barriera intatta. Le linee punteggiate mostrano i ROI per un'ulteriore analisi. Il lume interno dell'organoid e tre aree rappresentative intorno all'organoide sono contrassegnati. (B4) Un organoide dopo l'aggiunta di EGTA. L'organoide è utilizzabile per ulteriori analisi perché mostra l'assorbimento di LY dopo il trattamento EGTA. Fare clic qui per visualizzare una versione più grande di questa figura.
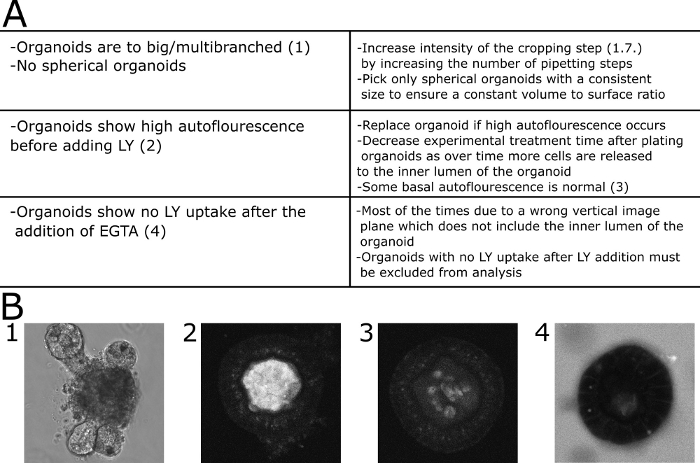
Figura 4: Risoluzione dei problemi comuni. (A) Tabella con problemi e soluzioni comuni. (B) Immagini esemplari. (B1) Immagine DIC di un organoide multibranchato di grandi dimensioni che non è adatto a questo analisi. (B2). Immagine confocale di un organoide che mostra un'elevata autofluorescenza prima di LY è stato aggiunto al mezzo. L'organoide è stato escluso dalla quantificazione. (B3) Immagine confocale di un organoide che mostra bassa autofluorescenza prima di LY è stato aggiunto al mezzo. La fluorescenza è stata quantificata in questo caso. (B4) Organoide che non mostra alcun assorbimento di LY dal mezzo 30 min dopo l'aggiunta di EGTA e quindi escluso dalla quantificazione. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Questo test offre una tecnica per studiare l'integrità della barriera intestinale all'interno degli organoidi viventi. L'intero assaggio si basa su piccoli organoidi intestinali e microscopia a cellule vive confocali. Pertanto, è obbligatorio praticare in anticipo la corretta gestione degli organoidi. Dopo l'isolamento, gli organoidi possono essere regolarmente divisi e conservati dal criocongelamento3,9. Per questo test si consiglia di dividere gli organoidi 48 h prima di iniziare il trattamento. Questo periodo dà agli organoidi la possibilità di chiudere totalmente e formare strutture sferiche. La seminazione degli organoidi per l'esperimento è un passo critico all'interno del saggio. Per ridurre le variazioni di movimentazione individuale, si consiglia una procedura di routine per il processo di seeding. Questo passaggio è fondamentale e un protocollo di gestione di routine riduce chiaramente le variazioni sperimentali.
Durante la procedura di seeding (passaggio 1.7) gli organoidi vengono frammentati ripetitiva passando attraverso una punta di pipetta standard da 10 L. La dimensione dei pori di questo prodotto varia da azienda a azienda. Questa procedura deve essere praticata in anticipo e il risultato deve sempre essere controllato mediante microscopia a contrasto di fase. Una volta che gli organoidi ottenuti raggiungono la dimensione desiderata, non modificare la procedura.
La seeding degli organoidi deve essere ottimizzata e adattata per l'installazione microscopica disponibile. Per essere in grado di coltura e organoidi immagine per almeno 48 h, una camera al microscopio incubato è assolutamente necessaria. Scegli una copertina camerata che soddisfi le tue esigenze. Quando si esegue il seeding degli organoidi, assicurarsi di concentrare gli organoidi sulla superficie del coperchio. Ciò è possibile mantenendo lo scivolo di copertura camerato su una confezione di ghiaccio per 5 min dopo aver posizionato la sospensione matrice-organoide della cellula. Questo passaggio è importante per aumentare la qualità dell'imaging confocale delle cellule vive. La risoluzione assiale e la distanza di lavoro delle lenti al microscopio confocale sono particolarmente limitate. Più vicino si porta il campione alla lente, meglio si può immagine e meno energia laser è necessaria per eccitare la fluorescenza LY.
Phototaxis è una questione importante quando si tratta di microscopia a cellule vive. All'interno di questo saggio escludiamo questa opzione. Un AJC funzionale è visibile per esclusione di LY dal lume dell'organoid(Figura 1, PBS). L'aggiunta di EGTA alla fine dell'esperimento causa il sequestro di ioni bivalenti, che sono cofattori per le proteine AJC. LY è escluso dal lume dell'organoide solo in organoidi vitali con un complesso ajC funzionale. In generale, le molecole fluorescenti possono essere utilizzate per misurare l'integrità della barriera intestinale. Abbiamo scelto LY invece di altri fluorofori comunemente usati come la fluoresceina etichettata dextran perché questi vengono trasportati transcellularemente in cellule intestinali dal basale al compartimento apicale9. Abbiamo anche scelto LY per le sue piccole dimensioni. LY ha un peso molecolare di 457 Da e quindi facilita lo studio della permeabilità barriera per piccole molecole. La molecola fluorescente deve essere scelta a seconda della questione scientifica studiata. Poiché sono presenti difetti aJC fototossici, l'energia di eccitazione laser deve essere ridotta o l'intervallo di imaging esteso. La tecnica di imaging confocale ottimale per questo saggio è la microscopia a disco rotante. I rispettivi strumenti consentono l'imaging confocale con tempi di esposizione brevi a bassa potenza laser.
Diversi modelli sono già stati sviluppati per studiare l'integrità della barriera intestinale in vitro. Mentre l'uso di saggi basati su monostrati cellulari o esperimenti in vivo è in declino, i metodi basati su organoidi stanno aumentando. A differenza dei metodi descritti in precedenza4,5,6,7, il nostro metodo consente la quantificazione della funzione di barriera nel tempo.7 Ciò consente l'esposizione degli organoidi a stimoli aggiuntivi nel corso dell'esperimento. Qui applichiamo EGTA come secondo stimolo alla fine dell'esperimento come controllo positivo.
In contrasto con la situazione invivo, nel nostro saggio LY viene aggiunto nel mezzo e penetra l'organoide dall'esterno lato epiteliale basolaterale verso il lume apicale interno. Il LY è piccolo e viene utilizzato solo per visualizzare la tenuta della barriera intestinale. Le molecole e gli stimoli che modulano lo strato epiteliale sulla superficie apicale devono essere iniettati nel lume dell'organoide7 . Per ridurre lo sforzo sperimentale ed essere in grado di misurare l'integrità della barriera di molti organoidi allo stesso tempo, abbiamo scelto di applicare il tinrito fluorescente dall'esterno.
Abbiamo usato il saggio per studiare la funzione dell'IFN-z sulla stretta giunzione di piccoli organoidi murini intestinali. Il fatto che siamo stati in grado di analizzare l'integrità della barriera negli organoidi viventi offre possibilità future di applicare questa tecnica per descrivere gli inibitori per la ripartizione indotta dall'infiammazione della barriera intestinale. Sostanze che contrastano la funzione di barriera alterata causata da IFN-z potrebbero essere candidati per il trattamento delle malattie infiammatorie intestinali, in cui la funzione di barriera alterata è uno dei fattori patogeni10.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalle sovvenzioni della Fondazione tedesca per la ricerca (DFG) [KFO257, progetto 4 a M.S. e progetto da 1 a C.B.; FOR2438, progetto 2 per M.S. e E.N. e progetto 5 a C.B.; Progetto SFB1181 da C05 a C.B.; TRR241, progetto da A06 a N.B.L. e M.S., progetto da A03 a C.B., da BR5196/2-1 a N.B.L. e da BE3686/2 a C.B.]; il Centro Interdisciplinare per la Ricerca Clinica (I-KF) del Centro Clinico Erlangen (a M.S., E.N., e M.B.), il W. Lutz Stiftung (a M.S.) e il Forschungsstiftung Medizin del Centro Clinico Erlangen (a M.S.). Il presente lavoro è stato svolto nell'adempimento (parziale) dei requisiti per ottenere il grado di dottorato Med.
Materiali
| Name | Company | Catalog Number | Comments |
| 48-well culture plate | Thermo Fisher Scientific | #150687 | |
| 8-well chamber slides | Ibidi | #80826 | |
| 96-well culture plate | Greiner Bio-One | #655101 | |
| Axio Observer.Z1 - spinning disc | Zeiss | excitation laser 488 nm / emission filter 525/25 | |
| Bovine serum albumin | Sigma-Aldrich | A3059-100G | |
| Cell strainer | Falcon | 352350 | |
| Centrifugation tube 15 mL | Thermo Fisher Scientific | 11507411 | |
| Centrifugation tube 50 mL | Thermo Fisher Scientific | 10788561 | |
| EDTA | Sigma-Aldrich | 431788-25g | |
| EGTA | Sigma-Aldrich | 431788 | |
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | L0259 | |
| Matrigel, growth factor reduced, phenol red free | Corning | 356231 | Cell matrix solution |
| Mice | The Jackson Laboratory | M. musculus C57/Bl6 | |
| Microscope coverslip | 24 mm x 60 mm | ||
| Organoid Growth Medium mouse | Stemcell Technologies | #06005 | |
| Phosphate buffered saline | Biochrom | L182-05 | |
| Recombinant murine IFN-γ | Biolegend | Cat#575304 |
Riferimenti
- López-Posadas, R., Stürzl, M., Atreya, I., Neurath, M. F., Britzen-Laurent, N. Interplay of GTPases and Cytoskeleton in Cellular Barrier Defects during Gut Inflammation. Frontiers in Immunology. 8, 1240 (2017).
- Zhang, Y. Z., Li, Y. Y. Inflammatory bowel disease: pathogenesis. World Journal of Gastroenterology. 20 (1), 91-99 (2014).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Leslie, J. L., et al. Persistence and toxin production by Clostridium difficile within human intestinal organoids result in disruption of epithelial paracellular barrier function. Infection and Immunity. 83 (1), 138-145 (2015).
- Zietek, T., Rath, E., Haller, D., Daniel, H. Intestinal organoids for assessing nutrient transport, sensing and incretin secretion. Scientific Reports. 5 (1), 16831 (2015).
- Pearce, S. C., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19 (2018).
- Hill, D. R., Huang, S., Tsai, Y. H., Spence, J. R., Young, V. B. Real-time Measurement of Epithelial Barrier Permeability in Human Intestinal Organoids. Journal of Visualized Experiments. (130), e56960 (2017).
- Bardenbacher, M., et al. Permeability analyses and three dimensional imaging of interferon gamma-induced barrier disintegration in intestinal organoids. Stem Cell Research. 35, 101383 (2019).
- Tomita, M., Hotta, Y., Ohkubo, R., Awazu, S. Polarized transport was observed not in hydrophilic compounds but in dextran in Caco-2 cell monolayers. Biological and Pharmaceutical Bulletin. 22 (3), 330-331 (1999).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature Reviews: Immunology. 9 (11), 799-809 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon