Method Article
研究活体器官的肠道屏障分解
* 这些作者具有相同的贡献
摘要
在这里,我们描述了一种量化小肠道器官的屏障完整性的技术。该方法以活器官为基础,能够以时间解析的方式对不同的屏障完整性调节物质或其组合进行顺序调查。
摘要
有机体和三维(3D)细胞培养允许在体外研究复杂的生物机制和规律,这在古典细胞培养单层中以前是不可能的。此外,单层细胞培养物是很好的体外模型系统,但不代表依赖3D结构的复杂细胞分化过程和功能。到目前为止,这只有在动物实验中才可能实现,因为动物实验既费力,又费时,很难用光学技术来评估。在这里,我们描述了一种测定,定量地确定在生活小肠小鼠器官的屏障完整性随着时间的推移。为了验证我们的模型,我们应用干扰素伽马(IFN-+)作为屏障破坏的正控制,并从IFN-β受体2中提取的器官作为负对照击倒小鼠。该测定使我们能够确定IFN-+对肠道屏障完整性的影响,IFN-α诱导紧密结蛋白克劳丁-2、-7和-15的降解。该测定还可用于研究化合物、蛋白质、毒素、细菌或患者衍生的探针对肠道屏障完整性的影响。
引言
上皮屏障的完整性由尖峰结结复合体(AJC)保持,由紧密结(TJ)和附着结(AJ)蛋白1组成。犹太委员会的极化结构对其体内功能至关重要。AJC的病害存在于各种疾病中,被怀疑是炎症性肠发病机制的重要诱因。肠道屏障功能丧失代表疾病的发病事件。以下交代的共性细菌和炎症反应是痛苦的后果2。
各种体外和体内模型已经开发,以调查AJC的法规。Transwell 测定基于从肿瘤细胞系派生的二维(2D) 细胞单层。这些系统是很好的评估光学和生化方法,并能够分析许多样品在同一时间,但缺乏许多功能的原细胞和分化过程存在于体内。在动物模型中也可以调查屏障完整性。在终端实验中,可以量化活体特定治疗对整个肠道渗透性的影响。然而,这些模型需要大量的动物,它们不允许对底层分子过程进行详细的可视化。目前改进的3D体外模型是密切相关的细胞分化过程,细胞极化,并代表肠的暗室结构3。3D肠道器官在功能分析中的应用需要适应2D模型中的可用方法。在这里,我们描述了一个模型,以调查肠道屏障完整性在活小肠小鼠器官。该测定是为调查IFN-+对屏障完整性和分别紧密结蛋白8的影响而建立的。
与 Leslie 4、Zietek5或 Pearce6应用的技术不同,该技术在从介质中去除荧黄 (LY) 后测量荧光,我们的方法允许随着时间的推移对荧光磷的亮度接受进行定量。4因此,该结果代表一个动态的接受动力学,我们的测定允许在实验过程中应用额外的刺激或抑制剂。这两种测定都测量了从外侧的面到内层的从表面的升得,这与体内的情况形成鲜明对比。在希尔等人7描述的模型中,探讨了这个主题。将荧光素微入器官的荧光素中时,荧光被量化。扩散方向表示体内存在的方向。微注射的技术努力明显降低了该方法的吞吐量。与此处描述的模型不同,微注射方法能够测量需要生物激活的上皮表面的效果。
此处介绍的器官屏障完整性模型基于活细胞显微镜,能够分析 AJC 法规中随时间变化的动态变化。该设置可用于测试诱导和抑制肠道屏障完整性的物质的药理作用。此外,基于器官的模型有助于减少用于药理学研究的动物数量。
研究方案
所有步骤都按照并符合所有相关监管和机构动物护理准则完成。
1. 有机体的电镀
- 分离器官,如前面所述的3。该过程将简要描述如下。
- 从老鼠身上收集小肠。
- 纵向打开小肠,用盖玻片刮掉内肠组织,去除绒尖。
- 用剪刀把肠道组织切成小块。
- 用 25 mL 移液器上下移液 10 倍,在冷磷酸盐缓冲盐水 (PBS) 中清洗件 5 倍。
- 在水平摇动平台上将冰面上的 2 mM EDTA 溶液中的组织片孵育 30 分钟。让组织碎片沉积。
- 一旦组织片在底部沉降,将 EDTA 溶液替换为 PBS 缓冲液。丢弃上清液并添加 20 mL 的 PBS。
- 使用 10 mL 移液器上下大力移液 10 倍,将肠道隐液从组织中释放出来。
- 收集离心管中的上清液,并通过相位对比显微镜检查。为此,在96井细胞培养板中加入一滴中清液。将离心管保持在冰上。
- 重复步骤 1.1.6_1.1.8,直到收集的上清液中的肠道隐器数量减少。
- 通过 70 μm 细胞滤网传递包含最隐室的分数。
- 将冷冻液悬浮液在 300 x g、4°C 下离心 5 分钟。
- 丢弃上清液,在冷PBS中重新悬浮颗粒,以清洗墓穴。然后重复 1.1.11 中描述的离心步骤。
- 细胞基质溶液和鼠形培养基的1:1混合物,每口25μL中重新悬浮颗粒,并在48个井细胞培养板中盘片。
- 在37°C,5%CO2孵育2器官20分钟,使细胞基质溶液凝固。
- 每口用300μL的毛素器官介质覆盖器官。
- 在37°C、5%CO2下培养器官,2每2~3天更换一次介质。
- 在7天的培养后,使用器官进行实验。
- 准备用于屏障完整性测量的器官。
- 通过在PBS中加入足够0.1%的BSA溶液来覆盖所有塑料表面,预涂所有用于在电镀过程中用牛血清白蛋白(BSA)储存器官的离心管。然后再次取出BSA溶液,并将离心管储存在冰上。
- 解冻冰上细胞基质溶液和器官培养基。
- 要分离器官,请小心地去除培养介质,并将风管从 48 孔板的孔中重新悬浮在 1 mL 的冷 PBS 中。通过强能移液溶解细胞基质。始终将器官悬浮液放在离心管中,预涂有BSA,并始终保持在冰上。
注:造型套板滑道内器官的密度、大小和位置受分裂比、细胞基质溶液浓度和器官细胞基质悬浮液处理的影响。建议提前练习单元矩阵溶液的处理。通常八个井室玻璃盖玻片适合测定。从流48孔板的一口井中提取的有机体可以分为两口,8口井套盖板(每口40μL的器官细胞基丸)。 - 在 4 °C 下以 300 x g将器官悬架离心 5 分钟。
- 小心地丢弃上清液,用 1 mL 的冷 PBS 重新悬浮颗粒。
- 将器官悬浮液在 300 x g、4°C 下离心 5 分钟。
- 完全丢弃上清液,重新悬浮从40μL冷介质中48口孔中衍生出的器官。通过10 μL移液器尖端移液器官悬浮液5倍,收集尺寸为40~60μm的结构进行播种,从而分割大型器官结构。
注:在 100 μL 移液器尖端上使用 10 μL 尖端进行器官结构的破碎,并提前执行步骤 1.7 以确保结果一致。通过相位对比显微镜在离心管内控制器官的大小。确保不再有多分支器官,并且器官片段长约 40-60 μm。 - 一旦有机体达到所需尺寸,将它们与40μL的细胞基质溶液(中:细胞基质溶液 = 1:1)混合。
注:中元基质基质溶液比必须保持恒定,以实现一致的结果。细胞基质溶液的稀释降低了器官斑点的刚度,并影响其扩散特性。对于包含细胞基质溶液的所有悬浮液,请使用预冷却移液笔尖 (-20 °C)。 - 将器官细胞基质溶液悬浮液的40μL放在8个孔的中央。
- 将幻灯片放在冰袋上 5 分钟。这保存了细胞基体器官悬浮液,并通过重力增加盖玻片表面的器官浓度。
- 在37°C和5%CO2孵育20分钟,2实现器官-细胞基质斑点的聚合。
- 每口加入150μL的风管培养介质,在37°C下孵育24小时,在进行实验治疗前孵育5%CO2。
- 利用这一时期根据相应的科学假设来治疗器官并调节其屏障完整性。对于正控制,使用IFN-α处理48小时的器官,以调查IFN-相关紧密结降解和渗透性增加。使用 10 U/mL (10 ng/mL) 重组鼠 IFN-* 刺激正控制。离开一个良好处理的器官。
- 培养器官在37°C和5%CO2,长达48小时。
2. 器官渗透性测定
- 在开始实验之前,将显微镜的孵育室至少降至37°C,以减少热漂移,同时成像器官。
- 在 PBS 中准备 100 mM LY 解决方案。储存在防光的冰上。
- 在 PBS 中准备 EGTA 的 200 mM 解决方案。把它储存在冰上。
- 将腔室盖玻片(包括器官)转移到倒置共聚焦显微镜的孵育室,并打开CO2孵育(5%)。确保室盖玻片紧锁在显微镜的阶段内。
- 在一个井中使用器官作为参考,调整显微镜的成像设置。在 150 μL 介质中加入 LY(3 μL 100 mM LY),在 300 μL 介质中获得最终体积为 1 mM LY。在显微镜上孵育1小时,并调整对焦,以成像器官的流明。定义用于 LY 激发 (488 nm) 所需的激光能量以及仪器各自的检测灵敏度,并尝试在所用仪器可用动态范围的 30-40% 处成像 LY 荧光。
注:加入LY后70分钟,调整未经处理的器官上的激光激发能量和检测效率。确保激发能量足够高,以获得一个暴露良好的图像。为了避免在显微图像中出现LY荧光饱和,建议在LY扩散达到稳定状态后调整这些设置。 - 通过差分干扰对比度 (DIC) 实时成像定义器官的位置。尝试成像直径相当(80 × 30 μm)的器官,并专注于器官的中心切片,以成像其流明。定义每个井大约10个器官,并尝试用球形结构只成像靠近盖玻表面的器官。
注:每次运行可以成像的器官数量取决于显微镜的速度。建议在 5 分钟间隔内对器官进行成像。在常规激光扫描显微镜上,总共40个位置是一个合理的起点。 - 记录每个位置的 DIC 和 LY 荧光,以记录器官的形状和自荧光,然后再将 LY 添加到用于屏障完整性测定的井中。
- 不要成像显示高自荧光的器官。这是由于器官流明中死细胞的积累,随后难以分析自荧光器官的结果。
- 稀释 3 μL 制备的 LY 溶液(150 μL 介质中的 100 mM LY),并小心地将其添加到每个井中,而不会接触室盖板。每口井的LY建议浓度为1 mM。每口井的最终体积应为 300 μL。
- 快速检查已定义位置的焦点,并根据需要进行校正。
注:LY 通过单元格矩阵快速扩散。因此,共聚焦成像必须在增加荧光磷后3分钟内开始。 - 在显微镜上开始延时成像。每 5 分钟拍摄每个位置的荧光图像,共 70 分钟。
注:器官以5分钟间隔成像,以可视化LY的升天情况。为了测量肠道屏障分解,在LY添加后60分钟和添加EGTA后再次记录10分钟后的荧光就足够了。 - 在不接触造型盖玻片的情况下,每口加入3 μL的制备 EGTA 溶液。EGTA 的造型盖玻片内推荐的浓度为 2 mM。每口井的总体积应为300μL。
- 开始第二次延时。再次记录已定义器官的荧光,间隔为5分钟,共30分钟。
- 根据当地安全规定丢弃所有内容。
注:协议可以在这里暂停。
3. 数据分析
- 仅分析 EGTA 添加后服用 LY 的有机体的结果。
- 结果可以通过斐济 ImageJ 进行量化。
- 单击"文件" 打开 ImageJ 中的数据集 |打开并选择图像数据。在以下 BIO 格式导入选项对话框中,选择"查看堆栈:超堆栈"。
- 单击"分析" 打开感兴趣的区域 (ROI) 管理器 |工具|ROI 经理。
- 单击 ImageJ 菜单栏中的"椭圆选择"按钮,绘制椭圆形 ROI。绘制包含器官内流明的选择。然后按"在ROI 管理器中添加"。
- 对器官外的三个代表性区域重复这些步骤。
- 单击菜单栏中的"分析",然后选择"设置度量"。仅启用均值灰色值并禁用任何其他测量。然后单击"确定"。
- 请确保在 ROI 管理器中选择了所有 ROI。在 ROI 管理器中,单击"更多" |多度量。在选项对话框中,选择"测量所有 [...] 切片"和每个切片一行。然后单击"确定"。
- 选择"结果"窗口中的所有值,并将其复制到电子表格应用程序中以进行进一步分析。
注:如果器官的位置在延时成像期间移动,则必须相应地调整 ROI。为此,请在 ROI 经理中选择正确的 ROI 并将其移动到新职位。然后单击 ROI 管理器中的"更新"。单击 ROI 管理器中的"度量",然后使用底部的栏切换到图像窗口中的下一个时间点,从而单独执行每个时间点的测量。收集电子表格中的所有测量值。在成像期间,单个形状和器官的运动需要手动分析数据。 - 计算每个时间点外三个 RO 的均强度值。
- 将器官流明内的投资回报率强度除以外部投资回报率的平均强度和器官内的平均强度。
- 为了计算发光器官荧光的相对增加,将每个时间点的相对荧光(参见步骤 3.11)除以最小相对荧光的图像。
注:使用最小的相对荧光,因为有时荧光波的扩散在实验开始时可能很慢。
结果
为了验证3D小肠小鼠器官作为模型的应用,以量化调节肠道屏障完整性的化合物的效果,我们应用了IFN-α。为此,我们分离和培养了来自IFN-=反应性野生型和IFN-β受体-2敲除小鼠的有机体,它们对IFN-=8没有反应。8使用IFN-α或PBS(控制)治疗48小时后,所有器官均暴露于LY,并通过共聚焦旋转盘活细胞显微镜以5分钟间隔进行成像,为期70分钟。本模型中肠道屏障的功能完整性导致LY从器官的流明中排除,而LY的氧化铝内积累意味着TJ的破坏。与LY进行孵育70分钟后,具有代表性的荧光显微图像清楚地表明,在使用IFN-+治疗的野生类动物的有机体中,只有可见内露水内LY荧光。在未刺激 (PBS) 对照中,也指从击倒动物(IFN-_R2+IEC,图 1)衍生的器官中,70 分钟后不存在任何内发光 LY 荧光。
EGTA 的加入通过隔离 TJ 辅助因子会导致肠道屏障完整性的非特定分解。这种控制总是在实验结束时使用,以证明各器官接受LY的能力(图1)。如果在EGTA治疗时未检测到任何内发光LY荧光,则该器官被排除在实验之外。
为了对微观结果进行定量评估,在器官的流明和器官外测量了LY荧光。计算了相对强度值(内部荧光/外部荧光 = 内部),并显示每次点图像。建议避免对不同大小的器官进行成像。我们选择专注于直径为80~30μm的器官(图2)。图3显示了具有代表性图像的协议的示意图。图4显示了一些主要问题和故障排除技术并讨论了这些技巧。
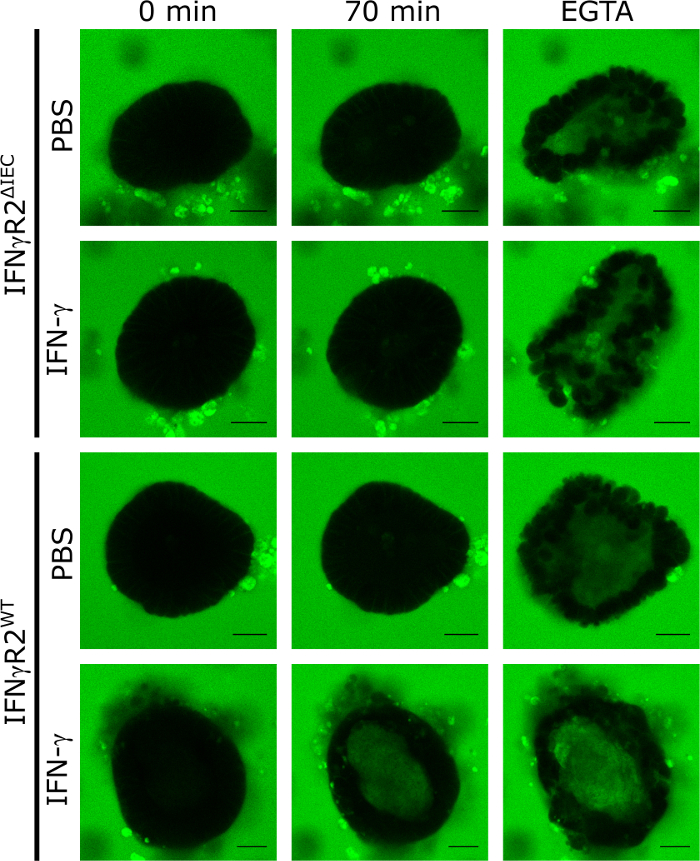
图1:可在小鼠器官中分析肠道屏障完整性。IFN-+R2WT和IFN-R2_IEC的肠道ΔIEC器官在IFN-α存在的情况下培养48小时或未经治疗。为了调查肠道屏障的完整性,添加了LY(457 Da),以5分钟间隔捕获共70分钟的共聚焦荧光图像。 时点为0分钟,70分钟,并显示EGTA添加后(绿色= 路西法黄色;刻度柱 = 20 μm)。这个数字是从巴登巴赫等人8.请点击此处查看此图形的较大版本。
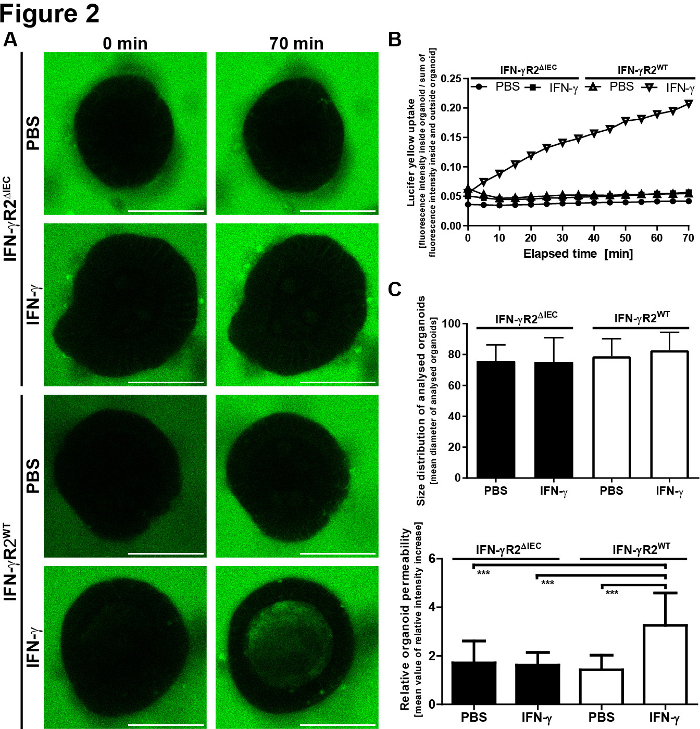
图2:小肠器官屏障完整性模型提供定量结果。(A) LY 荧光在器官内外被确定。相对强度值相对于初始相对强度 = SEM 计算(内部/外部/荧光),并显示每个时间点。(B) 分析器官的大小分布。为了减少由于表面体积比变化而导致的标准偏差和误差,我们只分析了直径为80~30μm的器官体。 显示各器官直径的平均值 = SD(IFN-_R2WT,n= 20);IFN-_R2=IEC,n = 18)。平均直径值在不同组(单向ANOVA)之间没有显著差异。(C) 在加入LY后70分钟,确定器官的渗透性。其定义是70分钟后的铝内荧光强度除以观察期间测量的最小相对荧光强度。每个条形表示平均值 = SD,以从两个独立实验(IFN-_R2WT,n= 20)派生的10个器官进行测量;IFN-_R2=IEC,n = 18)。IFN-* 显著增加了IFN-#R2WT有机体中的LY摄入量。学生 t 测试中的 p 值 <0.001。这个数字是从巴登巴赫等人8.请点击此处查看此图形的较大版本。
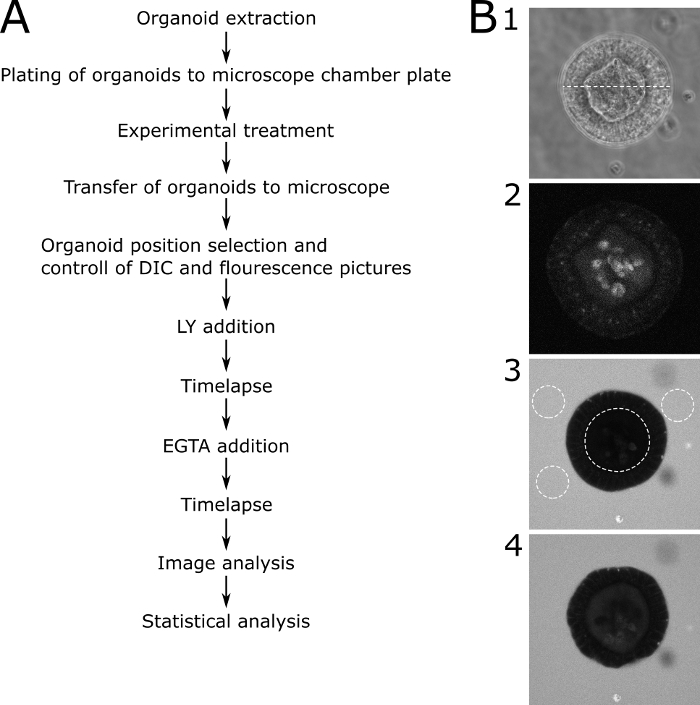
图 3:具有代表性图像的原理图协议。(A) 协议主要步骤的原理图描述。(B) 议定书主要步骤的代表性图片。(B1)DIC中心切片的显微镜图像通过一个合适的器官,被选中进行渗透性分析。虚线表示 89 μm 的宽度(B2) 荧光显微镜图片的同一器官 (B1) 之前添加 LY.图片显示了器官的自荧光。(B3)加入LY后70分钟的器官。所描绘的器官没有显示LY的接受,因此具有完整的屏障功能。虚线显示供进一步分析的 RO。器官的内部流明和器官周围的三个代表性区域被标记。(B4)添加 EGTA 后的器官。该器官可用于进一步分析,因为它显示在EGTA治疗后服用LY。请点击此处查看此图形的较大版本。
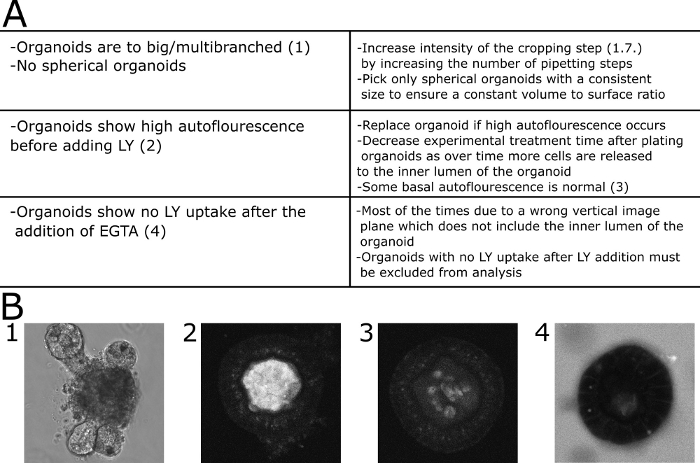
图 4:常见问题的故障排除。(A) 具有常见问题和解决方案的表。(B) 模范图像。(B1)不适合此测定的大型多分支器官的 DIC 图像。(B2).在 LY 被添加到介质之前显示高自荧光的器官的共聚焦图像。器官被排除在定量之外。(B3)在 LY 添加到介质之前显示低自荧光的器官的共聚焦图像。在这种情况下,荧光被量化了。(B4)在添加 EGTA 后,从中度 30 分钟中显示没有 LY 摄取,因此被排除在定量之外。请点击此处查看此图形的较大版本。
讨论
该测定提供了一种研究活器官内肠道屏障完整性的技术。整个测定基于小肠小鼠器官和共聚焦活细胞显微镜。因此,必须事先对器官进行适当处理。分离后,可定期通过冷冻33、99分离和储存器官。对于这个测定,我们建议在治疗开始前48小时分裂器官。这一时期使器官有机会完全关闭和形成球形结构。为实验播种器官是测定中的关键步骤。为了减少单个处理变化,我们建议为播种过程设置常规程序。此步骤至关重要,常规处理协议可明显减少实验变异。
在播种过程中(步骤 1.7),器官通过标准 10 μL 移液器尖端的重复传递而变得支离破碎。这种产品的毛孔大小因公司而异。此过程应提前执行,并且应始终通过相位对比显微镜检查结果。一旦获得器官达到所需尺寸,请勿更改程序。
器官的种子必须针对可用的微观设置进行优化和调整。为了能够培养和图像器官至少48小时,绝对需要孵化显微镜室。选择符合您要求的室内套板。播种器官时,请确保将器官集中在盖玻片表面。在放置细胞基质-器官悬架后,将室盖玻片在冰包上保持5分钟,这是可能的。此步骤对于提高共聚焦活细胞成像的质量非常重要。共聚焦显微镜镜片的轴向分辨率和工作距离特别有限。将样品带到镜头越近,图像效果越好,激发 LY 荧光所需的激光能量也越少。
光轴是活细胞显微镜的一个重要问题。在此测定中,我们排除了此选项。通过将 LY 排除在器官的流明之外(图 1, PBS), 功能性 AJC 可见。在实验结束时加入EGTA会导致双价离子的封存,而双价离子是AJC蛋白质的辅助因子。LY 仅在具有功能 AJC 复合物的重要器官中排除在器官的流明中。一般来说,荧光分子可以用来测量肠道屏障的完整性。我们选择了LY,而不是其他常用的氟细胞,如标有dextran的氟辛,因为这些是细胞间从基底到球室9的细胞。我们还选择LY,因为它的小尺寸。LY 的分子量为 457 Da,因此有助于研究小分子的阻隔渗透性。荧光分子必须根据所研究的科学问题进行选择。由于存在光毒性 AJC 缺陷,因此必须降低激光激发能量或延长成像间隔。这种测定的最佳共聚焦成像技术是旋转盘显微镜。在低激光功率下,不同的仪器可实现曝光时间短的共聚焦成像。
已经开发出不同的模型来研究体外肠道屏障完整性。虽然基于细胞系单体或体内实验的测定的使用正在减少,但基于器官的方法却在增加。与前面描述的方法4,4、5、6、7 不同,我们的方法允许随时间对阻隔函数进行量化。5,6,7这允许在实验过程中将器官暴露于额外的刺激中。在这里,我们将EGTA作为实验结束时的第二个刺激作为积极的控制。
与体内的情况相反,在我们的测定中,LY被添加到介质中,从外侧的上皮侧渗透到内侧尖峰。LY 很小,仅用于可视化肠道屏障的紧固性。调节上皮层的分子和刺激需要注入器官的流明7。为了减少实验努力,同时能够测量许多器官的屏障完整性,我们选择从外部应用荧光染料。
我们用该测定法对小肠小鼠器官的紧密结部IFN-α的功能进行了调查。事实上,我们能够分析活器官的屏障完整性,这为将来有可能应用这种技术来描述炎症引起的肠道屏障分解的抑制剂。对抗IFN-_-α引起的障碍功能受损物质可能是治疗炎症性肠病的候选物,其中障碍功能受损是致病因素之一。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了德国研究基金会[KFO257]的资助,向M.S.提供项目4,项目1给C.B.;FOR2438,项目2至M.S.和E.N.,项目5到C.B.;SFB1181 项目 C05 到 C.B.;TRR241,项目A06到N.B.L.和M.S.,项目A03到C.B.,BR5196/2-1到N.B.L.和BE3686/2到C.B.*;埃尔兰根临床中心(至M.S.,E.N.和M.B.)、W.卢茨·斯蒂夫通(至M.S.)和埃尔兰根临床中心(至M.S.)的福辛斯特通梅迪津跨学科临床研究中心(IZKF)。本工作是在(部分)满足获得马可·巴登巴赫博士学位的要求时进行的。
材料
| Name | Company | Catalog Number | Comments |
| 48-well culture plate | Thermo Fisher Scientific | #150687 | |
| 8-well chamber slides | Ibidi | #80826 | |
| 96-well culture plate | Greiner Bio-One | #655101 | |
| Axio Observer.Z1 - spinning disc | Zeiss | excitation laser 488 nm / emission filter 525/25 | |
| Bovine serum albumin | Sigma-Aldrich | A3059-100G | |
| Cell strainer | Falcon | 352350 | |
| Centrifugation tube 15 mL | Thermo Fisher Scientific | 11507411 | |
| Centrifugation tube 50 mL | Thermo Fisher Scientific | 10788561 | |
| EDTA | Sigma-Aldrich | 431788-25g | |
| EGTA | Sigma-Aldrich | 431788 | |
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | L0259 | |
| Matrigel, growth factor reduced, phenol red free | Corning | 356231 | Cell matrix solution |
| Mice | The Jackson Laboratory | M. musculus C57/Bl6 | |
| Microscope coverslip | 24 mm x 60 mm | ||
| Organoid Growth Medium mouse | Stemcell Technologies | #06005 | |
| Phosphate buffered saline | Biochrom | L182-05 | |
| Recombinant murine IFN-γ | Biolegend | Cat#575304 |
参考文献
- López-Posadas, R., Stürzl, M., Atreya, I., Neurath, M. F., Britzen-Laurent, N. Interplay of GTPases and Cytoskeleton in Cellular Barrier Defects during Gut Inflammation. Frontiers in Immunology. 8, 1240 (2017).
- Zhang, Y. Z., Li, Y. Y. Inflammatory bowel disease: pathogenesis. World Journal of Gastroenterology. 20 (1), 91-99 (2014).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Leslie, J. L., et al. Persistence and toxin production by Clostridium difficile within human intestinal organoids result in disruption of epithelial paracellular barrier function. Infection and Immunity. 83 (1), 138-145 (2015).
- Zietek, T., Rath, E., Haller, D., Daniel, H. Intestinal organoids for assessing nutrient transport, sensing and incretin secretion. Scientific Reports. 5 (1), 16831 (2015).
- Pearce, S. C., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19 (2018).
- Hill, D. R., Huang, S., Tsai, Y. H., Spence, J. R., Young, V. B. Real-time Measurement of Epithelial Barrier Permeability in Human Intestinal Organoids. Journal of Visualized Experiments. (130), e56960 (2017).
- Bardenbacher, M., et al. Permeability analyses and three dimensional imaging of interferon gamma-induced barrier disintegration in intestinal organoids. Stem Cell Research. 35, 101383 (2019).
- Tomita, M., Hotta, Y., Ohkubo, R., Awazu, S. Polarized transport was observed not in hydrophilic compounds but in dextran in Caco-2 cell monolayers. Biological and Pharmaceutical Bulletin. 22 (3), 330-331 (1999).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature Reviews: Immunology. 9 (11), 799-809 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。