Method Article
Yaşayan Organoidlerde Bağırsak Bariyerinin Bozulmasının Araştırılması
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada ince bağırsak organoidlerinin bariyer bütünlüğünü ölçmek için bir teknik açıklanmıştır. Yöntemin canlı organoidlere dayanması, farklı bariyer bütünlüğünün maddeleri veya bunların kombinasyonlarını zaman içinde çözümlü bir şekilde modüle ederek sıralı olarak araştırılmasını sağlar.
Özet
Organoidler ve üç boyutlu (3D) hücre kültürleri karmaşık biyolojik mekanizmaların ve düzenlemelerin incelenmesine izin in vitro, daha önce klasik hücre kültürü monolayers mümkün değildi. Ayrıca, monolayer hücre kültürleri in vitro model sistemleri iyi ama karmaşık hücresel farklılaşma süreçleri ve 3D yapısına dayanan fonksiyonları temsiletmez. Bu şimdiye kadar sadece zahmetli, zaman alıcı ve optik teknikler tarafından değerlendirmek zor hayvan deneyleri, mümkün olmuştur. Burada, canlı ince bağırsak fare süloidlerinde zaman içinde bariyer bütünlüğünü nicel olarak belirlemek için bir titreşiyi tanımlıyoruz. Modelimizi doğrulamak için bariyer yıkımı ve IFN-γ reseptör 2'den elde edilen organoidler için pozitif kontrol olarak interferon gama (IFN-γ) uyguladık. Tetkik bize bağırsak bariyer bütünlüğü ve sıkı kavşak proteinleri claudin-2, -7 ve -15 IFN-γ ingradation üzerindeki etkisini belirlemek için izin verdi. Bu tetki kİmse bileşiklerin, proteinlerin, toksinlerin, bakterilerin veya hasta kaynaklı probların bağırsak bariyerbütünlüğü üzerindeki etkisini araştırmak için de kullanılabilir.
Giriş
Epitel bariyerin bütünlüğü, sıkı kavşak (TJ) ve bağlılık kavşak (AJ) proteinlerinden oluşan apikal kavşak kompleksi (AJC) tarafındankorunur. AJC polarize yapısı in vivo işlevi için çok önemlidir. AJC disregülasyonu çeşitli hastalıklarda mevcuttur ve inflamatuar barsak patogenezinin önemli bir tetikleyicisi olduğundan şüphelenilir. Bağırsak bariyerfonksiyonunun kaybı hastalığın başlatılması olay temsil eder. Kommensal bakterilerin ve inflamatuar yanıtların aşağıdaki translokasyonu ağrılı sonuçlardır2.
AJC'nin regülasyonlarını araştırmak için çeşitli in vitro ve in vivo modellerigeliştirilmiştir. Transwell test tümör hücre hatları türetilmiştir iki boyutlu (2D) hücre monolayers dayanmaktadır. Bu sistemler optik ve biyokimyasal yöntemlerle değerlendirmek ve aynı anda birçok numuneanalizi sağlamak için iyi ama birincil hücrelerin birçok özelliği ve farklılaşma süreçleri in vivo mevcuteksikliği. Bariyer bütünlüğünün araştırılması hayvan modellerinde de mümkündür. Terminal deneylerde, tüm bağırsak geçirgenliği üzerinde vivo belirli tedavilerin etkileri ölçülebilir. Ancak, bu modeller çok sayıda hayvan gerektirir ve altta yatan moleküler süreçlerin ayrıntılı görselleştirilmesine izin vermezler. Günümüzde geliştirilmiş 3D in vitro modelleri yakından hücre farklılaşma süreçleri, hücre polarizasyon özetlemek ve bağırsak crypt-villus yapısını temsil mevcuttur3. Fonksiyonel analizler için 3D intestinal organoidlerin uygulanması, 2B modellerden mevcut yöntemlerin uyarlanıntını gerektirir. Burada yaşayan ince bağırsak fare organoidlerinde bağırsak bariyerinin bütünlüğünü araştırmak için bir model açıklıyoruz. Tetki bariyer bütünlüğü ve ilgili sıkı kavşak proteinleri üzerinde IFN-γ etkisini araştırmak için kurulmuştur8.
Leslie4, Zietek5veya Pearce6tarafından uygulanan tekniğin aksine, orta dan lucifer sarı (LY) çıkardıktan sonra floresan ölçer, bizim yaklaşım zaman içinde florofor luminal alımının nicel sağlar. Bu nedenle, sonuç dinamik bir alım kinetik temsil eder ve bizim tizin deney sırasında ek uyaranların veya inhibitörlerin uygulanmasını sağlar. Her iki tahlillerin de dış bazolateral taraftan iç apikal yüzeye doğru alımını ölçmesi, in vivo'daki duruma açık bir tezat oluşturuyor. Hill ve ark.7tarafından açıklanan bir modelde, bu konu araştırıldı. Floroforun organoidlüne mikroenjeksiyon ulaştırılması üzerine floresan ölçüldü. Difüzyon yönü in vivo'da mevcut yönü temsil eder. Mikroenjeksiyonun teknik çabası bu yöntemin üretim ini açıkça azaltır. Burada açıklanan modelin aksine, mikroenjeksiyon yöntemi apikal epitel yüzeyinde biyolojik aktivasyon gerektiren etkilerin ölçülmesini sağlar.
Burada sunulan organoid bariyer bütünlüğü modeli canlı hücre mikroskobu dayanmaktadır ve ajc regülasyonu içinde zaman içinde dinamik değişikliklerin analizini sağlar. Kurulum bağırsak bariyerinin bütünlüğünü indükleyen ve inhibe maddelerin farmakolojik etkisini test etmek için uygulanabilir. Ayrıca, organoid tabanlı modeller farmakolojik çalışmalarda kullanılan hayvan sayısını azaltmaya yardımcı olur.
Protokol
Tüm adımlar, ilgili tüm düzenleyici ve kurumsal hayvan bakım yönergelerine uygun olarak tamamlanmıştır.
1. Organoidlerin Kaplaması
- Daha önce açıklandığı gibi organoidleri izole3. Yordam aşağıda kısaca açıklanmıştır.
- Farelerden ince bağırsakları toplayın.
- İnce bağırsakları uzunlamasına açın ve iç bağırsak dokusunu bir kapak kaymaile kazıyarak villi uçlarını çıkarın.
- Makasla bağırsak dokusunu küçük parçalar halinde kesin.
- Parçaları 25 mL'lik pipetle 10 kat yukarı ve aşağı borulandırarak 5x'i soğuk fosfat tamponlu salinde (PBS) yıkayın.
- Doku parçalarını soğuk 2 mM EDTA çözeltisi içinde yatay bir sallayarak platformda 30 dk boyunca buz üzerinde kuluçkaya yatırın. Doku parçalarının tortuya izin ver.
- Doku parçaları alta yerleştikten sonra EDTA çözeltisini PBS tamponuile değiştirin. Supernatant atın ve PBS 20 mL ekleyin.
- 10 mL'lik bir pipetle 10 x yukarı ve aşağı boru lar atarak bağırsak mahzenlerini dokudan serbest bırakın.
- Santrifüj tüpleri supernatant toplamak ve faz kontrast mikroskopisi ile inceleyin. Bunu yapmak için, bir 96 iyi hücre kültür plakasupernatant bir damla ekleyin. Santrifüj tüplerini buzda tutun.
- Toplanan supernatant bağırsak crypts sayısı azalır kadar tekrar adımları 1.1.6-1.1.8.
- En çok kriptoiçeren kesirleri 70 μm'lik bir hücre süzgecinden geçirin.
- 300 x g,4 °C'de 5 dk.'lık bir alanda mezar süspansiyonuna santrifüj edin.
- Supernatant atın ve crypts yıkamak için soğuk PBS pelet resuspend. Daha sonra 1.1.11'de açıklandığı gibi santrifüj adımını tekrarlayın.
- Hücre matris çözeltisi ve murine organoid kültür ortamının 1:1 karışımının kuyu başına toplam 25 μL'lik kısmını yeniden askıya alın ve 48 kuyuhücre kültürü plakasında organoidleri plakalayın.
- Hücre matris çözeltisinin katılaşmasını sağlamak için organoidleri 20 dk boyunca 37 °C, %5 CO22'de kuluçkaya yatırın.
- Organoidleri kuyu başına 300 μL murine organoid orta ile kapatın.
- Kültür 37 °C, 5% CO2,her 2-3 günde bir orta değişen organoidler.
- Kültür 7 gün sonra deneyler için organoidler kullanın.
- Bariyer bütünlüğü ölçümü için organoidleri hazırlayın.
- Tüm plastik yüzeyleri kapsayacak şekilde PBS'de %0.1 BSA çözeltisi ekleyerek, kaplama işlemi sırasında organoidlerin sığır serum albumini (BSA) ile depolanmasında kullanılacak tüm santrifüj tüpleri önceden kaplayın. Daha sonra BSA çözeltisini tekrar çıkarın ve santrifüj tüplerini buzüzerinde saklayın.
- Hücre matris çözeltisi ve organoid kültür ortamıbuz üzerinde çözül.
- Organoidleri ayırmak için, kültür ortamını dikkatlice çıkarın ve 1 mL soğuk PBS'de 48 kuyuluk tabakasının bir kuyusundan organoidleri yeniden uzaklaştırın. Güçlü pipetleme ile hücre matrisini çözün. Organoid süspansiyonu her zaman Santrifüj tüplerinde BSA ile önceden kaplanmış tutun ve her zaman buzda tutun.
NOT: Odalı kapak kayması kaydıraklarında bulunan organoidlerin yoğunluğu, büyüklüğü ve konumu, bölünme oranı, hücre matris çözeltisi konsantrasyonu ve organoid-hücre matris süspansiyonunun işlenmesinden etkilenir. Hücre matrisi çözeltisinin işlenmesini önceden uygulamanız önerilir. Genellikle sekiz iyi odalı cam kapakları tayça için uygundur. Bir confluent 48 kuyu plakasının bir kuyudan elde edilen organoidler, sekiz kuyulu coverslip'in iki kuyuya ayrılabilir (her kuyubaşına organoid hücreli matris peletin 40°L). - Organoid süspansiyonu 300 x g 4 °C'de 5 dk santrifüj edin.
- Supernatant'ı dikkatlice atın ve 1 mL soğuk PBS ile peleti yeniden askıya alın.
- 300 x g,4 °C'de 5 dk.'da organoid süspansiyonu santrifüj edin.
- Supernatant'ı tamamen atın ve 40 μL soğuk ortamdaki 48 kuyuplakasından elde edilen organoidleri yeniden askıya alın. Fideleme için 40-60 μm büyüklüğündeki yapıları toplamak için organoid süspansiyonu 5 x 10 μL pipet ucuile pipetleyerek büyük organoid yapıları parçalayın.
NOT: Organoid yapıların parçalanması için 100°L pipet ucundaki 10 μL ucu kullanın ve tutarlı sonuçlar elde etmek için adım 1.7'yi önceden uygulayın. Santrifüj tüpü içinde faz kontrast mikroskobu ile organoidlerin boyutunu kontrol edin. Daha fazla çok dallı organoid olmadığından ve organoid parçalarının kabaca 40-60 μm uzunluğunda olduğundan emin olun. - Organoidler istenilen boyutu elde ettikten sonra, hücre matris çözeltisinin 40 μL'lik kısmıyla karıştırın (orta:hücre matris çözeltisi = 1:1).
NOT: Tutarlı sonuçlar elde etmek için orta hücre matris çözüm oranı sabit tutulmalıdır. Hücre matris çözeltisinin seyreltilmesi organoid lekesertliğini azaltır ve difüzyon özelliklerini etkiler. Hücre matris çözeltisi içeren tüm süspansiyonlar için önceden soğutulmuş pipet uçlarını (-20 °C) kullanın. - Organoid-hücre matris solüsyonu süspansiyonunun 40 μL'sini 8 kuyunun her kuyunun ortasına yerleştirin.
- 5 dakika boyunca bir buz paketi üzerinde slayt tutun. Bu hücre matris organoid süspansiyon sıvı korur ve yerçekimi ile coverslip yüzeyinde organoid konsantrasyonu artar.
- Organoid hücreli matriks lekesinin polimerizasyonunu sağlamak için 37 °C'de 20 dakika ve %5 CO2'de kuluçkaya yatırın.
- Deneysel tedaviye başlamadan önce kuyu başına 150 μL organoid kültür ortamı ve 37 °C'de 24 saat ve %5 CO2 için kuluçkaya yatırın.
- Organoidleri tedavi etmek ve bariyer bütünlüklerini ilgili bilimsel hipoteze göre modüle etmek için bu dönemi kullanın. Pozitif kontrol için, IFN-γ ilişkili sıkı kavşak bozulması ve geçirgenlik artışını araştırmak için 48 saat boyunca organoidleri IFN-γ ile tedavi edin. 10 U/mL (10 ng/mL) rekombinant murine IFN-γ ile pozitif kontrolü teşvik edin. Tedavi edilmeyen birinin organoidlerini bırakın.
- Kültür organoidleri 37 °C ve %5 CO2'de 48 saate kadar.
2. OrganoidPermeability Tsay
- Organoidleri görüntülerken termal sürüklenmeyi azaltmak için deneye başlamadan önce mikroskobun kuluçka odasını en az 2 saat 37 °C'ye getirin.
- PBS'de 100 mM LY çözeltisi hazırlayın. Işıktan korunan buz üzerinde saklayın.
- PBS'de 200 mM EGTA çözeltisi hazırlayın. Buzda saklayın.
- Organoidler de dahil olmak üzere odacıklı kapak fişini ters konfokal mikroskobunun kuluçka odasına aktarın ve CO2 kuluçka sını açın (%5). Odacıklı kapak kaymasıkıca mikroskop aşamasında kilitli olduğundan emin olun.
- Bir referans olarak organoidler kullanarak, mikroskobun görüntüleme ayarlarını ayarlayın. 300 μL orta alanda 1 mM LY'lik son bir hacim elde etmek için LY (100 mM LY'nin 3 μL'sini 150°L orta) ekleyin. Mikroskobu 1 saat boyunca kuluçkaya yatırın ve organoidlerin lümeninin görüntülenmesi için odağı ayarlayın. LY uyarma için gerekli lazer enerjisini (488 nm) ve cihazın algılama hassasiyetini tanımlayın ve kullanılan cihazın mevcut dinamik aralığının %30-40'ında LY floresanını göremeye çalışın.
NOT: LY'nin eklenmesinden 70 dk sonra tedavi edilmeyen organoidlerde lazer uyarma enerjisini ve algılama verimliliğini ayarlayın. Uyarma enerjisinin iyi pozlanmış bir görüntü elde etmek için yeterince yüksek olduğundan emin olun. Mikroskobik görüntülerde LY floresandosu doygunluğunu önlemek için, LY difüzyonu sabit bir duruma ulaştıktan sonra bu ayarların ayarlanması önerilir. - Diferansiyel girişim kontrastı (DIC) canlı görüntüleme ile organoidlerin konumunu tanımlayın. Benzer çaplarda (80 ± 30 μm) organoidleri resmetmeye çalışın ve lümenlerini görmek için organoidlerin merkezi dilimine odaklanın. Kuyu başına yaklaşık 10 organoid tanımlayın ve küresel bir yapıya sahip kapak yüzeyine sadece organoidleri göremeye çalışın.
NOT: Her koşuda görüntülenebilen organoidlerin sayısı mikroskobun hızına bağlıdır. Organoidlerin 5 dk aralıkta görüntülemi tavsiye edilir. Düzenli bir lazer tarama mikroskobunda, toplam 40 pozisyon makul bir başlangıç noktasıdır. - Bariyer bütünlüğü için kullanılan LY'yi kuyulara eklemeden önce organoidin şeklini ve otofloresansını belgelemek için her pozisyonun DIC ve LY floresanını kaydedin.
- Yüksek otofloresan gösteren organoidleri görüntülemeyin. Bu organoid lümen içinde ölü hücrelerin birikimi nedeniyle, ve otofloresan organoidlerin sonuçları daha sonra analiz etmek zordur.
- Hazırlanan LY çözeltisinin 3 μL'sini seyreltin (150°L ortadaki 100 mM LY) ve odacıklı kapak kaymasına dokunmadan her kuyuya dikkatlice ekleyin. Kuyu başına önerilen LY konsantrasyonu 1 mM'dir. Kuyu başına son hacim 300 μL olmalıdır.
- Tanımlanan pozisyonların odak noktasını hızlı bir şekilde kontrol edin ve gerekirse düzeltin.
NOT: LY hücre matrisi aracılığıyla hızlı bir şekilde yayılır. Bu nedenle, konfokal görüntüleme florofor ilavesi sonra 3 dakika içinde başlanmalıdır. - Mikroskopta hızlandırılmış bir görüntüleme başlatın. Toplam 70 dakika boyunca her 5 dakikada bir her pozisyonun floresan görüntüsünü alın.
NOT: Organoidler LY alımını zaman içinde görselleştirmek için 5 dakika aralıklarla görüntülendi. Bağırsak bariyerinin bozulmasını ölçmek için LY ilavesinden önce ve 60 dk sonra ve EGTA ilavesinden sonra bir kez daha 10 dk floresan kaydetmek yeterlidir. - Hazneli kapak kaymadokunmadan iyi başına hazırlanan EGTA çözeltisi 3 μL ekleyin. EGTA'nın odalı kapak kayması içinde önerilen konsantrasyon 2 mM'dir. Kuyu başına toplam hacim 300 μL olmalıdır.
- İkinci bir zaman atlamalı başlatın. Tanımlanan organoidlerin floresansını toplam 30 dakika boyunca 5 dk aralıkla tekrar kaydedin.
- Yerel güvenlik yönetmeliklerine göre her şeyi atın.
NOT: Protokol burada duraklatılmış olabilir.
3. Veri Analizi
- Sadece EGTA ilavesi sonrası LY'ye gelen organoidlerin sonuçlarını analiz edin.
- Sonuçlar Fiji ImageJ ile ölçülebilir.
- Dosya'ya tıklayarak ImageJ'de veri kümesini açın | Resim verilerini açın ve seçin. Aşağıdaki BIO-Formats Alma seçenekleri iletişim kutusunda Aşağıdaki Ile Görünüm yığınını seçin: Hyperstack.
- Analyze 'ı tıklatarak ilgi alanı (YG) yöneticisini açın | Araçlar | YRK Yöneticisi.
- ImageJ menü çubuğundaki Oval seçim düğmesine tıklayarak oval bir yatırım getirisi çizin. Organoidiç lümeniçeren bir seçim çizin. Ardından Yatırım Getirisi Yöneticisi'ni Ekle'ye basın.
- Organoid dışında üç temsili alanlar için adımları tekrarlayın.
- Menü çubuğunda Analiz et'e tıklayın ve Ölçüleri Ayarla'yıseçin. Yalnızca Ortalama Gri Değeri etkinleştirin ve diğer ölçümleri devre dışı alın. Sonra Tamam'ıtıklatın.
- Tüm ROI'ların YG Yöneticisi'nde seçildiğinden emin olun. Yatırım Getirisi Yöneticisi'nde Daha Fazla | Çok ölçü . Seçenek iletişim kutusunda tüm [...] dilimlerini ve dilim başına bir satırıölçün'i seçin. Sonra Tamam'ıtıklatın.
- Sonuçlar penceresindeki tüm değerleri seçin ve daha fazla analiz için bunları bir elektronik tablo uygulamasına kopyalayın.
NOT: Zaman atlamalı görüntüleme sırasında organoidin pozisyonu hareket ettiyse, Yatırım Getirisi buna göre ayarlanmalıdır. Bunu yapmak için, YG yöneticisinde doğru yg'yi seçin ve yeni konuma taşıyın. Ardından YG yöneticisinde Güncelleştir'i tıklatın. YG yöneticisinde Ölçü'yü tıklatarak her zaman noktası için ölçümü ayrı ayrı gerçekleştirin ve alttaki çubuğu kullanarak görüntü penceresindeki bir sonraki zaman noktasına geçin. Tüm ölçümleri elektronik tabloda toplayın. Görüntüleme döneminde organoidlerin bireysel şekli ve hareketi verilerin manuel bir şekilde analizini gerektirir. - Her zaman dilimi için organoid dışında üç ROI ortalama yoğunluk değerini hesaplayın.
- Roi'nin organoidlünin lümeniçindeki yoğunluğunu dışarıdaki yatırım getirisinin ortalama yoğunluğu namına ve organoidin içindeki ortalama yoğunluğuna bölün.
- Luminal organoid floresangöreceli artış hesaplamak için, en az bağıl floresan tarafından görüntülanan her zaman noktasında bağıl floresan (bkz. adım 3.11) bölün.
NOT: Florofordifüzyon uyğun deneyin başında yavaş olabilir, çünkü minimal göreceli floresan kullanın.
Sonuçlar
Bağırsak bariyerinin bütünlüğünü düzenleyen bileşiklerin etkisini ölçmek için bir model olarak 3D ince bağırsak fare organoidlerinin uygulanmasını doğrulamak için IFN-γ uyguladık. Bunu yapmak için, IFN-γ duyarlı yabani tip ve IFN-γ-reseptör-2 nakavt fareler, IFN-γ8yanıt vermeyen türetilen izole ve kültürlü organoidler . IFN-γ veya PBS (kontrol) ile 48 saat süren tedavi sonucunda tüm organoidler LY'ye maruz kaldı ve 5 dk aralıklarla 5 dk aralıklarla konfokal dönen disk canlı hücre mikroskopisi ile 70 dakika süreyle görüntülendi. Bu modelde bağırsak bariyerinin fonksiyonel bütünlüğü LY'nin organoidlünin lümeninden dışlanmasına neden olurken, LY'nin intraluminal birikimi TJ'nin yıkımına işaret etti. LY ile 70 dk kuluçkadan sonraki temsili floresan mikroskobik görüntüler, intraluminal LY floresansının sadece IFN-γ ile tedavi edilen yabani tip hayvanlardan organoidlerde görülebilen bir görüntü olduğunu açıkça göstermektedir. Uyarılmamış (PBS) kontrollerde veya knock out hayvanlardan elde edilen organoidlerde (IFN-γR2ΔIEC, Şekil 1), 70 dakika sonra intraluminal LY floresansı bulunmaz.
EGTA eklenmesi TJ kofaktörlerini ayırarak bağırsak bariyerbütünlüğünün spesifik olmayan bir şekilde bozulmasına neden olur. Bu kontrol, deney sonunda her zaman ilgili organoidin LY'yi alma yeteneğini göstermek için kullanılmıştır (Şekil 1). EGTA tedavisinde intraluminal LY floresan saptanmadıysa, organoid deney dışında tutuldu.
Mikroskobik sonuçların kantitatif değerlendirilmesi için LY floresan, organoidlünin lümeni içinde ve organoid in dışında ölçüldü. Bağıl yoğunluk değerleri hesaplandı (floresan iç / floresan dışında + iç) ve görüntülanan her zaman noktası için gösterilir. Farklı boyutlarda ki organoidlerin görüntülenmesinden kaçınılması tavsiye edilir. Çapı 80 ± 30 μm olan organoidlere odaklanmayı seçtik (Şekil 2). Temsili görüntülerle protokolün şeması Şekil 3'tegösterilmiştir. Bazı önemli sorunlar ve sorun giderme teknikleri Şekil 4'tegösterilmiştir ve tartışılır.
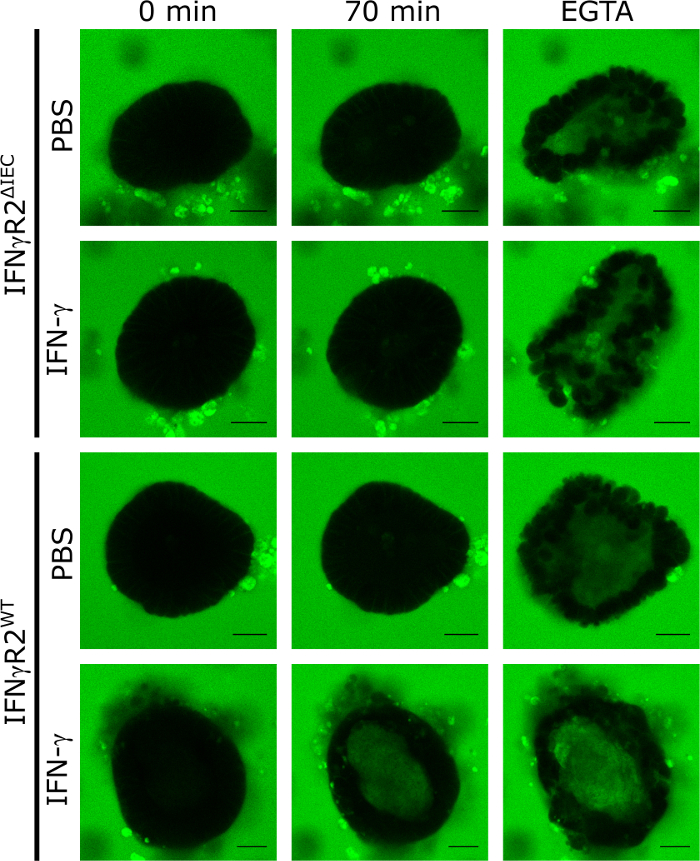
Şekil 1: Bağırsak bariyerbütünlüğü fare organoidlerinde analiz edilebilir. IFN-γR2WT ve IFN-γR2ΔIEC'in bağırsak organoidleri IFN-γ varlığında 48 saat kültürlü veya tedavi edilmemiş olarak bırakıldı. Bağırsak bariyerinin bütünlüğünü araştırmak için LY (457 Da) eklendi ve toplam 70 dk. Zaman noktasında temsili görüntüler 5 dk aralıklarla çekildi ve EGTA eklendikten sonra gösterilir (yeşil = Lucifer sarısı; Ölçek çubuğu = 20 μm). Bu rakam Bardenbacher ve ark.8'dendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
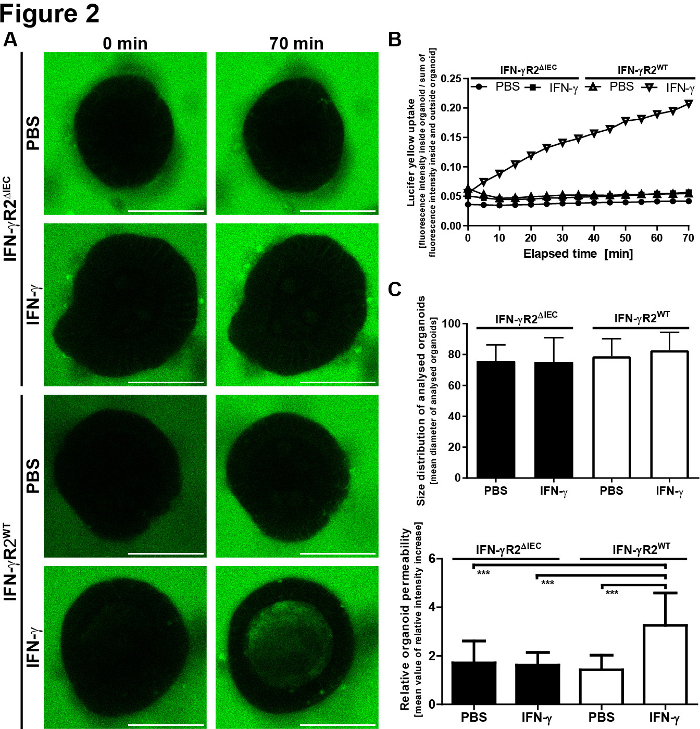
Şekil 2: İnce intestinal organoid bariyer bütünlüğü modeli kantitatif sonuçlar sağlar. (A) LY floresansı organoidin içinde ve dışında saptıldı. Bağıl yoğunluk değerleri ilk bağıl yoğunluk + SEM göre hesaplanır (iç /floresan dışında + iç) ve her zaman noktası için gösterilir. (B) Analiz edilen organoidlerin boyut dağılımı. Yüzey-hacim oranındaki değişikliklerden kaynaklanan standart sapma ve hataları azaltmak için, sadece çapı 80 ± 30 μm olan organoidleri analiz ettik.WT IFN-γR2ΔIEC, n = 18). Ortalama çap değerleri farklı gruplar (tek yönlü ANOVA) arasında önemli ölçüde farklılık gösteremedi. (C) Organoidlerin geçirgenliği LY'nin eklenmesinden 70 dk sonra belirlendi. 70 dakika dan sonra intraluminal floresan yoğunluklarının gözlem döneminde ölçülen minimal bağıl floresan yoğunluklarına bölünmesi ile tanımlanmıştır. Her çubuk, iki bağımsız deneyden elde edilen 10 organoidle ölçülen ortalama değerleri + SD'yi temsil eder (IFN-γR2WT, n = 20; IFN-γR2ΔIEC, n = 18). IFN-γ sadece IFN-γR2WT organoidlerinde LY alımını önemli ölçüde artırmıştır. p-değer <0.001 öğrencinin t-testinde. Bu rakam Bardenbacher ve ark.8'dendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
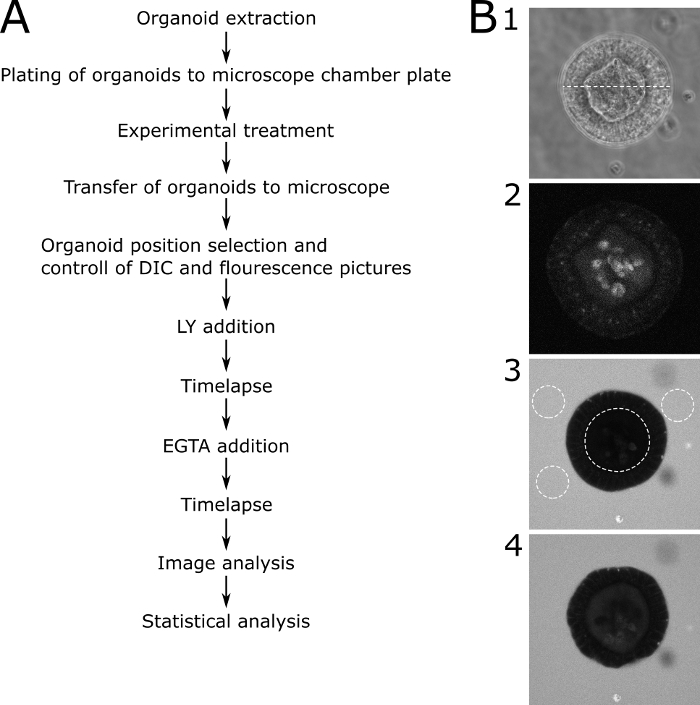
Şekil 3: Temsili görüntülerle şematik protokol. (A) Protokolün ana adımlarının şematik açıklaması. (B) Protokolün ana adımlarının temsili resimleri. (B1) Geçirgenlik analizi için seçilen uygun bir organoid aracılığıyla merkezi bir dilimIN DIC mikroskopi görüntüsü. Noktalı çizgi, LY eklemeden önce aynı organoidin(B1)floresan mikroskopi resminin 89 μm.(B2)genişliğini temsil eder. Görüntü organoid otofloresans gösterir. (B3) LY eklenmesinden sonra bir organoid 70 dk. Betimlenen organoid LY'nin alımı nın ve dolayısıyla sağlam bir bariyer fonksiyonunun olmadığını göstermektedir. Noktalı çizgiler daha fazla analiz için ROI'ları gösterir. Organoidin iç lümeni ve organoid çevresindeki üç temsili alan işaretlenmiştir. (B4) EGTA eklenmesinden sonra bir organoid. EGTA tedavisinden sonra LY alımı gösterdiği için organoid daha fazla analiz için kullanılabilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
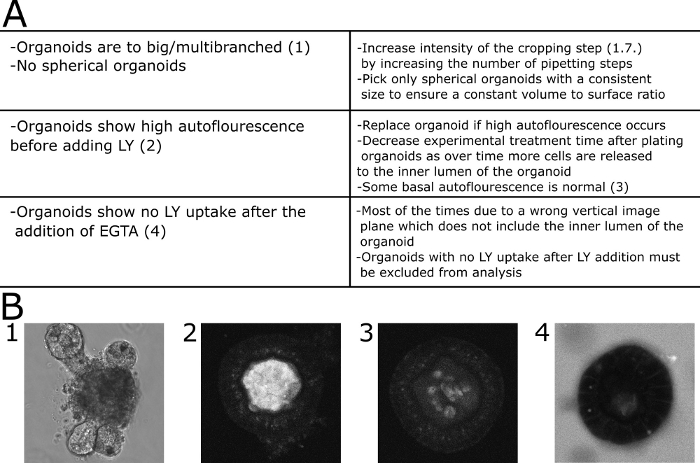
Şekil 4: Sık karşılaşılan sorunların giderme. (A) Ortak sorunları ve çözümleri ile tablo. (B) Örnek görüntüler. (B1) Bu teşp için uygun olmayan büyük bir çok dallı organoid DIC görüntü. (B2). LY ortama eklenmeden önce yüksek otofloresans gösteren bir organoidin konfokal görüntüsü. Organoid sayısaldan çıkarıldı. (B3) LY ortama eklenmeden önce düşük otofloresans gösteren bir organoidin konfokal görüntüsü. Bu durumda floresan ölçüldü. (B4) EGTA ilave edildikten sonra orta 30 dk'dan LY alımı olmayan organoid ve bu nedenle nicelleştirme nin dışında tutulmuştür. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu çalışma, canlı organoidler içinde bağırsak bariyeri bütünlüğünü incelemek için bir teknik sunuyor. Tüm test ince bağırsak fare organoidleri ve konfokal canlı hücre mikroskobu dayanmaktadır. Bu nedenle, organoidlerin uygun şekilde işlenmesini önceden uygulamak zorunludur. İzolasyon üzerine, organoidler rutin olarak bölünebilir ve kriyodon3,,9ile saklanabilir. Bu teşp için tedaviye başlamadan önce organoidlerin 48 saat bölmesini öneririz. Bu dönem organoidlere küresel yapıları tamamen kapatma ve şekillendirme şansı verir. Deney için organoidlerin tohumlanması, tsurel içinde kritik bir adımdır. Bireysel kullanım varyasyonlarını azaltmak için, tohumlama işlemi için rutin bir yordam öneririz. Bu adım çok önemlidir ve rutin bir işleme protokolü deneysel varyasyonları açıkça azaltır.
Tohumlama işlemi sırasında (adım 1.7) organoidler standart 10 μL pipet ucundan tekrarlayan geçişler yaparak parçalanırlar. Bu ürünün gözenek boyutu şirketten şirkete değişir. Bu işlem önceden uygulanmalı ve sonuç her zaman faz kontrast mikroskobu ile kontrol edilmelidir. Elde edilen organoidler istenilen boyuta ulaştıktan sonra işlemi değiştirmeyin.
Organoidlerin tohumlanması mevcut mikroskobik kurulum için optimize edilmeli ve uyarlanmalıdır. Organoidleri en az 48 saat boyunca kültür ve imaj alabilmek için kuluçkaya yatan bir mikroskop odasına kesinlikle ihtiyaç vardır. İhtiyaçlarınıza uygun odalı bir kapak fişi seçin. Organoidleri tohumlarken, organoidleri kapak yüzeyinde yoğunlaştırdığından emin olun. Bu hücre matris-organoid süspansiyon yerleştirdikten sonra 5 dakika boyunca bir buz paketi üzerinde odacıklı kapak tutulması ile mümkündür. Bu adım konfokal canlı hücre görüntüleme kalitesini artırmak için önemlidir. Konfokal mikroskop lenslerin eksenel çözünürlüğü ve çalışma mesafesi özellikle sınırlıdır. Örneği merceğe ne kadar yakın getirirseniz, o kadar iyi görüntüleyebilir ve LY floresanını heyecanlandırmak için o kadar az lazer enerjisine ihtiyaç duyulabilirsiniz.
Fototaksi canlı hücre mikroskobu söz konusu olduğunda önemli bir konudur. Bu titrenin içinde bu seçeneği hariç tutarız. Fonksiyonel AJC, LY'nin organoidlülünden dışlanmasıyla görülebilir(Şekil 1, PBS). Deney sonunda EGTA eklenmesi, AJC proteinleri için kofaktör olan bivalent iyonların ayrılmasına neden olur. LY, organoidlünin lümeni sadece fonksiyonel AJC kompleksi olan hayati organoidlerde dışlanır. Genel olarak, floresan moleküller bağırsak bariyerinin bütünlüğünü ölçmek için kullanılabilir. Floresin etiketli dextran gibi yaygın olarak kullanılan diğer floroforlar yerine LY'yi seçtik çünkü bunlar bazaldan apikal kompartmana kadar bağırsak hücrelerinde transhücresel olarak taşınır9. Ly'yi de küçük boyutu ndan dolayı seçtik. LY molekül ağırlığı 457 Da'dır ve bu nedenle küçük moleküller için bariyer geçirgenliğinin araştırılmasını kolaylaştırır. Floresan molekül, araştırılan bilimsel soruya bağlı olarak seçilmelidir. Fototoksik AJC defektleri mevcut olduğundan, lazer uyarma enerjisi azaltılmalıdır veya görüntüleme aralığı uzamalıdır. Bu araştırma için en uygun konfokal görüntüleme tekniği disk mikroskobu ipliktir. İlgili cihazlar düşük lazer gücünde kısa pozlama süresi ile konfokal görüntüleme sağlar.
Farklı modeller zaten in vitro bağırsak bariyer bütünlüğü çalışma geliştirilmiştir. Hücre hattı monokatmanlarına veya in vivo deneylerine dayalı tahliller azalırken, organoid tabanlı yöntemler artmaktadır. Daha önce açıklanan yöntemlerin aksine4,5,6,7, bizim yöntem zamanla bariyer fonksiyonunun nicel sağlar. Bu deney boyunca ek uyaranlara organoidlerin maruz kalma sağlar. Burada pozitif kontrol olarak deneyin sonunda ikinci bir uyarıcı olarak EGTA uygulayın.
Vivo'daki durumunaksine, bizim denemely ly orta içine eklenir ve iç apikal lümen doğru dış basolateral epitel tarafında organoid nüfuz. LY küçüktür ve sadece bağırsak bariyerinin sıkılığını görselleştirmek için kullanılır. Apikal yüzeydeki epitel tabakasını modüle eden molekül ve uyaranların organoidlülünin lümenine enjekte edilmesi gerekmektedir7. Deneysel çabayı azaltmak ve birçok organoidin bariyer bütünlüğünü aynı anda ölçebilmek için floresan boyayı dışarıdan uygulamayı seçtik.
İnce bağırsak fare süloidlerinin sıkı kavşağında IFN-γ'in işlevini araştırmak için titreşiyi kullandık. Canlı organoidlerdeki bariyer bütünlüğünü analiz edebildiğimiz gerçeği, bağırsak bariyerinin inflamasyona bağlı dökümü için inhibitörleri tanımlamak için bu tekniği uygulamak için gelecekteki olasılıkları sunmaktadır. IFN-γ'in neden olduğu bozulmuş bariyer fonksiyonunu etkisiz hale getiren maddeler, bariyer fonksiyonlarının bozulduğu inflamatuar barsak hastalıklarının tedavisi için aday olabilir10.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma Alman Araştırma Vakfı 'nın (DFG) [KFO257, Proje 4'ten M.S.'ye ve 1.proje 1.C.B.'den gelen bağışlarla desteklenmiştir; FOR2438, M.S. ve E.N. için proje 2 ve C.B.'ye 5 proje; SFB1181 projesi C05'den C.B.'ye; TRR241, Proje A06 N.B.L. ve M.S., proje A03 C.B., BR5196/2-1 N.B.L. ve BE3686/2 C.B.]; Klinik Merkezi Erlangen (M.S., E.N., ve M.B.), W. Lutz Stiftung (M.S.) ve Forschungsstiftung Medizin Klinik Merkezi Erlangen (M.S.) disiplinlerarası Merkezi (M.S.) için. Mevcut çalışma Marco Bardenbacher'dan Dr. Med. derecesini almak için gerekli şartların (kısmi) yerine getirilmesinde gerçekleştirilmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 48-well culture plate | Thermo Fisher Scientific | #150687 | |
| 8-well chamber slides | Ibidi | #80826 | |
| 96-well culture plate | Greiner Bio-One | #655101 | |
| Axio Observer.Z1 - spinning disc | Zeiss | excitation laser 488 nm / emission filter 525/25 | |
| Bovine serum albumin | Sigma-Aldrich | A3059-100G | |
| Cell strainer | Falcon | 352350 | |
| Centrifugation tube 15 mL | Thermo Fisher Scientific | 11507411 | |
| Centrifugation tube 50 mL | Thermo Fisher Scientific | 10788561 | |
| EDTA | Sigma-Aldrich | 431788-25g | |
| EGTA | Sigma-Aldrich | 431788 | |
| Lucifer Yellow CH dilithium salt | Sigma-Aldrich | L0259 | |
| Matrigel, growth factor reduced, phenol red free | Corning | 356231 | Cell matrix solution |
| Mice | The Jackson Laboratory | M. musculus C57/Bl6 | |
| Microscope coverslip | 24 mm x 60 mm | ||
| Organoid Growth Medium mouse | Stemcell Technologies | #06005 | |
| Phosphate buffered saline | Biochrom | L182-05 | |
| Recombinant murine IFN-γ | Biolegend | Cat#575304 |
Referanslar
- López-Posadas, R., Stürzl, M., Atreya, I., Neurath, M. F., Britzen-Laurent, N. Interplay of GTPases and Cytoskeleton in Cellular Barrier Defects during Gut Inflammation. Frontiers in Immunology. 8, 1240 (2017).
- Zhang, Y. Z., Li, Y. Y. Inflammatory bowel disease: pathogenesis. World Journal of Gastroenterology. 20 (1), 91-99 (2014).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Leslie, J. L., et al. Persistence and toxin production by Clostridium difficile within human intestinal organoids result in disruption of epithelial paracellular barrier function. Infection and Immunity. 83 (1), 138-145 (2015).
- Zietek, T., Rath, E., Haller, D., Daniel, H. Intestinal organoids for assessing nutrient transport, sensing and incretin secretion. Scientific Reports. 5 (1), 16831 (2015).
- Pearce, S. C., et al. Marked differences in tight junction composition and macromolecular permeability among different intestinal cell types. BMC Biology. 16 (1), 19 (2018).
- Hill, D. R., Huang, S., Tsai, Y. H., Spence, J. R., Young, V. B. Real-time Measurement of Epithelial Barrier Permeability in Human Intestinal Organoids. Journal of Visualized Experiments. (130), e56960 (2017).
- Bardenbacher, M., et al. Permeability analyses and three dimensional imaging of interferon gamma-induced barrier disintegration in intestinal organoids. Stem Cell Research. 35, 101383 (2019).
- Tomita, M., Hotta, Y., Ohkubo, R., Awazu, S. Polarized transport was observed not in hydrophilic compounds but in dextran in Caco-2 cell monolayers. Biological and Pharmaceutical Bulletin. 22 (3), 330-331 (1999).
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature Reviews: Immunology. 9 (11), 799-809 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır