A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إنشاء أنظمه تحديد البروتين المستحثة كيميائيا للغاية بواسطة الاختيار المتدرج لمكتبه الأجسام المضادة أحاديه المجال التوافقية
In This Article
Summary
إنشاء أنظمه البروتين المستحث كيميائيا مع التقارب والخصوصية المطلوبة لأي من الجزيئات الصغيرة المعطية والتي تحتوي علي العديد من تطبيقات الاستشعار البيولوجي والتفعيل. هنا ، نقوم بوصف طريقه فعاله وقابله للتعميم للهندسة الهندسية للانظمه المستحثة كيميائيا عن طريق الاختيار المتدرج لمكتبه الأجسام المضادة أحاديه المجال التوافقية المعروضة.
Abstract
الاحداث البروتينية البروتين التي تحدث فقط في وجود الاربطه جزيء صغير وتمكين تطوير الجزيئات الصغيرة الحيوية لتشريح والتلاعب في المسارات البيولوجية. حاليا ، لا يوجد سوي عدد محدود من النظم المستحثة كيميائيا (CID) والهندسة الجديدة مع الحساسية المطلوبة والانتقائية ل يغاندس الجزيئات الصغيرة المحددة لا تزال تشكل تحديا في مجال هندسه البروتين. نقدم هنا وصفا لطريقه الفحص العالية الانتاجيه ، وهي انتخابات المباحث الجنائية التي تجريها شركه دي نوفو للهندسة من أجل الانظمه الجنائية المطبقة علي مجموعه كبيره ومتنوعة من الليغانز. يستخدم هذا الأسلوب الاختيار من خطوتين من مكتبه nanobody التوافقية المعروضة phage للحصول علي 1) "الموثقات مرساه" التي ربط أولا إلى يجند الفائدة ثم 2) "الموثقات ديميريشن" التي تربط فقط لمرساه الموثق-يجند المجمعات. لتحديد الموثقات مرساه ، يتم فحص مكتبه التوافقية من أكثر من 109 التكامل تحديد المنطقة (CDR)-العشوائية nanobodies مع liginylated ويتم التحقق من الإصابات مع الاربطه غير المسمية بواسطة قياس التداخل الطبقة الحيوية (BLI). للحصول علي المجلدات التعريفية ، يتم فحص مكتبه nanobody مع الموثق مرساه-ligand المجمعات كاهداف للفحص الإيجابي والموثقات مرساه غير منضم للفحص السلبي. الجمع بين-CID ينطبق علي نطاق واسع لتحديد المجلدات CID مع الغلوبولين المناعي الأخرى ، غير الغلوبولين المناعي ، أو السقالات مصممه حسابيا لخلق الاستشعار البيولوجي لفي المختبر والجسم الحيوي الكشف عن المخدرات ، والأيض ، والجزيئات الإشارات ، الخ.
Introduction
نظم CID ، التي اثنين من البروتينات dimerize فقط في وجود الحرف جزيء صغير (الشكل 1) ، وتقدم أدوات متعددة لتشريح والتلاعب الأيض ، والإشارات ، وغيرها من المسارات البيولوجية1. وقد أظهرت القدرات في التشغيل البيولوجي, مثل المخدرات التي تسيطر عليها التنشيط الخلية t2 والمبرمج3,4, لتحسين سلامه وفعالية العلاج الخلوي t التبني. الاضافه إلى ذلك ، فانها توفر منهجيه جديده للكشف عن أهداف الجزيئات الصغيرة في الجسم المجري أو في المختبر. علي سبيل المثال ، يمكن ان تكون البروتينات CID تنصهر وراثيا مع نظم مراسل مضان (علي سبيل المثال ، نقل الطاقة بالرنين الفلوري (الحنق)5 والبروتينات الفلورية المشعة دائري)6 للوقت الحقيقي في القياسات المجرية ، أو بمثابه الكواشف التقارب لانزيم المناعي المرتبطة مقايسة (اليسا)-مثل
وعلي الرغم من تطبيقاتها الواسعة ، فان إنشاء أنظمه جديده للتحكم الجنائي يمكن التحكم فيها بواسطة الجزيئات الصغيرة المعطية والتي تواجه تحديات كبيره. إنشاء البروتين الموثق الأساليب الهندسية بما في ذلك التطعيم الحيواني7، في اختيار المختبر8،9، والحاسوبية تصميم البروتين10 يمكن ان تولد البروتينات الربط التي تعمل عن طريق ثنائي البروتين-يجند التفاعلات. ومع ذلك ، فان هذه الطرق لديها صعوبات في إنشاء مجمع CID الثلاثي المستحث. بعض الطرق إنشاء CID عن طريق ربط كيميائيا اثنين من يغاندس التي ترتبط بشكل مستقل إلى نفس أو مختلف البروتينات11,12,13,14,15,16 أو الاعتماد علي اختيار البروتينات الموثق مثل الأجسام المضادة التي تستهدف الموجودة مسبقا جزيء البروتين المجمعات17,18, التالي يكون خيارا محدودا من li
وقد قمنا مؤخرا بوضع الانتخاباتالخاصة بالإجراءات الجنائية الخاصة بأسلوب "الجمع بين المباحث الجنائية"من أجل الهندسة الهندسية لأنظمه المباحث الجنائية19. يمكن لهذه الطريقة الحصول علي خصوصية عاليه من الربط المستحث بالضغط (علي سبيل المثال ، ثابت الانفصال الموثق مرساه ، كد (بدون Ligand)/كد (مع ligand) > 1,000). يتم تحقيق الخصوصية باستخدام المجلدات مرساه مع مواقع ملزمه مرنه التي يمكن ان تدخل تغييرات المطابقة علي الربط ، وتوفير أساس لاختيار الموثقات انتقائية المطابقة فقط الاعتراف الموثقات مرساه الربط. لقد أظهرنا دليلا علي المبدا من خلال خلق الاختلافات الناجمة عن الكانبديه (CBD) من نانوبوديس ، وهو جزء من 12 إلى 15 من الأجسام المضادة الوظيفية من الكامريد التي تتالف من سقالة عالميه وثلاث حلقات مرنهلل CDR(الشكل 2)20، والتييمكن ان تشكل جيب ملزم مع احجام قابله للتكيف وعلي وجه الخصوص ، فان اختيار مكتبه البروتين التوافقي في المختبر ينبغي ان يكون فعالا من حيث التكلفة وقابلا للتعميم بالنسبة لهندسه CID لان نفس المكتبة ذات الجودة العالية يمكن تطبيقها علي العديد من الligands.
في هذا البروتوكول والفيديو ، ونحن نركز علي وصف الاختيار من خطوتين في المختبر والتحقق من مرساه (الشكل 3ا) والمجلدات ديميريشن (الشكل 3ب) عن طريق فحص مكتبه nanobody التوافقية مع تنوع اعلي من 109 باستخدام اتفاقيه التنوع البيولوجي كهدف ، ولكن ينبغي ان ينطبق البروتوكول علي مكتبات البروتين وعاده ما يستغرق فحص المجلدات الخاصة بالمباحث الجنائية ما بين 6 و 10 أسابيع (الشكل 4).
Access restricted. Please log in or start a trial to view this content.
Protocol
1-بناء المكتبات
- استخدام مكتبه الأجسام المضادة أحاديه المجال التوافقية الاصطناعية مع تنوع من ~ 1.23 – 7-14 x 109، كما هو موضح سابقا19. علي الرغم من ان هذا البروتوكول لا يتضمن إنشاء المكتبة ، الا انه يمكن تطبيقه علي مكتبات موثقه أخرى للدمج.
2-التعكر الحيوي للهدف أو اليجند
- الحيوية المحددة ، علي سبيل المثال ، CBD و تتراهيدروكانابينول (THC)19، عن طريق استراتيجيات التوليف الكيميائية المختلفة ، اعتمادا علي مواقع الحيوية المناسبة للهدف.
3. مرساه الموثق الفرز
- بداية الاختيار
- تبدا كل جولة من الاختيار عن طريق تلقيح مستعمره واحده TG1 ، نمت طازجه في 6 مل من 2YT في 37 درجه مئوية و 250 الثورات في الدقيقة الواحدة (rpm) إلى 600 nm (OD600) الامتصاص من ~ 0.5. احتضان الخلايا علي الجليد لاستخدامها في الخطوة 3-5.
- اختيار السلبية مع البيوتين--ملزمه الخرز سترافيالدين
- اعداد "حبات الاختيار السلبية" عن طريق غسل 300 μL من الخرز المغناطيسي المغلفة العقديات باستخدام رف الفصل المغناطيسي ، 3x مع 0.05 ٪ الفوسفات مخزنه المالحة مع توين العازلة (PBST ، 1 × تلفزيوني مع 0.05 ٪ المجلد/المجلد توين 20 ٪) و 2x مع 1 × تلفزيوني.
- أعاده تعليق الخرز مع 1 مل من الكازين 1 ٪ في 1 × تلفزيوني (pH = 7.4) ، وتشبع الخرز عن طريق أضافه 5x قدره ملزمه المبلغ عنها باستخدام البيوتين. احتضان في درجه حرارة الغرفة (RT) علي مدوره لمده 1 ساعة.
- غسل الخرز 5x باستخدام 0.05 ٪ PBST و 3x باستخدام 1 × تلفزيوني ، لما مجموعه ثمانيه يغسل.
- أضافه ~ 1013 الجزيئات بالعاثيه في 1 ٪ الكازين/1 ٪ بوسني في 1 × تلفزيوني (pH = 7.4) واحتضان في RT علي المدورة لمده 1 ساعة.
- بعد الحضانة ، وجمع ماده طافي لاستخدامها في الخطوة 3.3.6.
- اختيار إيجابي مع الخرز العقديات الحيوية المربوطة
- اعداد "حبات اختيار ايجابيه" باستخدام 1/2 حجم الخرز المستخدمة ل "حبات الاختيار السلبية" بعد الخطوات 3-2-1.
- أعاده تعليق الخرز مع 1 مل الكازين 1 ٪ في 1 × تلفزيوني ، 7.4 الأس الهيدروجيني وتشبع الخرز عن طريق أضافه 5x قدره كامله ملزمه محسوبة علي أساس دليل باستخدام الliginylated والاختيار . احتضان في RT علي مدوره لمده 1 ساعة.
- غسل الخرز 5x باستخدام 0.05 ٪ PBST و 3x باستخدام 1 × تلفزيوني ، لما مجموعه ثمانيه يغسل.
- كتله الخرز مع 1 مل من الكازين 1 ٪/1 ٪ من الجيش الصربي البوسني في 1 × تلفزيوني (pH = 7.4) واحتضان في RT علي المدورة لمده 1 ساعة لمنع ربط غير محدد بين والعاثيات والخرز المغناطيسي المغلفة العقديات.
- غسل الخرز المغناطيسي المغلفة العقديات 3x باستخدام 0.05 ٪ PBST ومره واحده باستخدام 1 × تلفزيوني ، لما مجموعه أربعه يغسل.
- أعاده تعليق الخرز المغناطيسي العقديات المغلفة باستخدام والعاثيات غير منضم ماخوذه من 3.2.5 الخطوة واحتضانها في RT علي المدورة لمده 1 ساعة.
- استخراج ماده طافي دون إزعاج الخرز المغناطيسي. حفظ والعاثيات غير منضم كادخال ، لاستخدامها في الخطوة 3-5.
- غسل الخرز 10x باستخدام 0.05 ٪ PBST و 5x باستخدام 1 × تلفزيوني. في بين كل ثلاثه يغسل نقلها إلى أنبوب جديد لتجنب والعاثيات غير محدد منضم إلى جدران الأنبوب.
- التملص من نانوفوديس المعروضة phage
- التالي فانه باضافه 450 μL من الاربطه غيرالحيوية ، باستخدام تركيز في نطاق ميكرومولار (علي سبيل المثال ، 10-50 μM) واحتضان في RT علي مدوره لمده 30 دقيقه. يعتمد الربط المحدد للحصول علي الامتصاص التنافسي للفوج المنضمة علي المطلوب كد من "الموثق مرساه". ويمكن ان تكون تركيزات الاربطه عاليه نسبيا في جولات الاختيار الاوليه ثم تنخفض في الطلقات اللاحقة.
- جمع ماده طافي وحفظ والعاثيات التملص كما الإخراج ، لاستخدامها في الخطوة 3.5.2.
- معايره الإدخال/الإخراج والعدوى
- لإدخال المعايرة ، واعداد المخففات التسلسلية 10x في 1 × تلفزيوني حتى 109-اضعاف مع بالعاثيه المدخلات من الخطوة 3.3.7. استخدام 107-109 تخفيفات المسلسل للقيام بالعدوى عن طريق نقل 10 μl الإدخال بالعاثيه من كل تخفيف إلى 70 μl TG1 الخلايا (OD600 من ~ 0.5). احتضان في 37 درجه مئوية ل 45 دقيقه ، لوحه الخلايا TG1 المصابة علي 3 90 مم 2yt-أجار الاطباق التي تحتوي علي 100 ميكروغرام/مل الامبيسلين و 2 ٪ (wt/vol) الجلوكوز ، واحتضان بين عشيه وضحيها في 37 درجه مئوية. من لوحات بين عشيه وضحيها ، يمكن حساب المدخلات بالعاثيه علي النحو التالي:
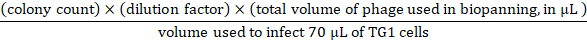
- للعدوى الناتج والمعايرة ، نقل والعاثيات التي لا يمكن التملص منها من الخطوة 3.4 إلى 3 مل من خلايا TG1 (OD600 من ~ 0.5). احتضان في حمام مائي في 37 درجه مئوية لمده 45 دقيقه. ثم اعداد تخفيفات التسلسلي 10x في 2yt تصل إلى 103اضعاف ، لوحه كل تخفيف علي 90 مم 2yt-أجار الاطباق ، واحتضان بين عشيه وضحيها في 37 درجه مئوية. من لوحات بين عشيه وضحيها ، يمكن حساب الإنتاج بالعاثيه علي النحو التالي:
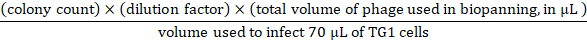
- تقسيم الخلايا TG1 المصابة المتبقية علي 3 150 مم 2yt-أجار لوحات تحتوي علي 100 ميكروغرام/مل الامبيسلين و 2 ٪ (wt/vol) الجلوكوز. احتضان لوحات بين عشيه وضحيها في 37 درجه مئوية.
- لإدخال المعايرة ، واعداد المخففات التسلسلية 10x في 1 × تلفزيوني حتى 109-اضعاف مع بالعاثيه المدخلات من الخطوة 3.3.7. استخدام 107-109 تخفيفات المسلسل للقيام بالعدوى عن طريق نقل 10 μl الإدخال بالعاثيه من كل تخفيف إلى 70 μl TG1 الخلايا (OD600 من ~ 0.5). احتضان في 37 درجه مئوية ل 45 دقيقه ، لوحه الخلايا TG1 المصابة علي 3 90 مم 2yt-أجار الاطباق التي تحتوي علي 100 ميكروغرام/مل الامبيسلين و 2 ٪ (wt/vol) الجلوكوز ، واحتضان بين عشيه وضحيها في 37 درجه مئوية. من لوحات بين عشيه وضحيها ، يمكن حساب المدخلات بالعاثيه علي النحو التالي:
- تضخيم المكتبة واستعادتها لجولات الاختيار الأخرى
- أضافه 3 مل من 2YT لكل لوحه ، كشط مع مكشطه خليه معقمه وجمع كل الخلايا في أنبوب مخروطي 50 mL. تخلط الخلايا التي تم جمعها مع الجلسرين المعقم (20 ٪ وزن/المجلد التركيز النهائي). قياس OD600 من الخليط وجعل 3-5 الأوراق المالية الأسهم. يخزن في-80 درجه مئوية للتخزين علي المدى الطويل.
- للإنقاذ بالعاثيه ، تمييع خليط البكتيريا التي تحتوي علي TG1 باستخدام 25 مل من وسائل الاعلام 2yt تستكمل مع 2 ٪ الجلوكوز و 100 ميكروغرام/مل الامبيسلين إلى600 OD من ~ 0.1. ثقافة الخلايا في 37 درجه مئوية و 250 دوره في الدقيقة إلى OD600 من ~ 0.5.
- تصيب الخلايا عن طريق أضافه CM13 المساعد بالعاثيه في 5 × 109 pfu/مل واحتضان في 37 درجه مئوية و 250 دوره في الدقيقة لمده 45 دقائق. بالعاثيه المساعد CM13 يوفر المطلوبة البروتينات معطف بالعاثيه لتجميع جزيئات بالعاثيه كامله.
- الطرد المركزي الثقافة في 8,000 x g لمده 10 دقيقه لأزاله الجلوكوز. أعاده تعليق الخلايا باستخدام 50 mL من وسائل الاعلام 2yt تستكمل مع 100 ميكروغرام/مل الامبيسلين و 50 ميكروغرام/مل كاناميسين واحتضان في 25 درجه مئوية و 250 دوره في الدقيقة بين عشيه وضحيها.
- طرد مركزي الخلايا من الثقافة بين عشيه وضحيها في 9,000 x g، 4 درجه مئوية لمده 30 دقيقه نقل ماده طافي إلى أنبوب جديد ويعجل والعاثيات في ماده طافي باستخدام 1/5 حجم PEG/كلوريد الصوديوم الحل (20 ٪ wt/المجلد البولي إيثيلين جلايكول-6,000 و 2.5 M nacl). اخلطيه برفق وضعيه علي الثلج لمده 1 ساعة.
- جمع جزيئات بالعاثيه بواسطة طرد باستخدام 12,000 x g في 4 درجه مئوية لمده 30 دقيقه. أعاده التعليق الكريات باستخدام 1 مل من 1 × تلفزيوني ، ونقل تعليق إلى أنبوب الطرد المركزي. الطرد المركزي أنبوب في 20,000 x g و 4 درجه مئوية لمده 10 دقيقه لأزاله البكتيريا المتبقية.
- نقل ماده طافي إلى أنبوب الطرد المركزي الجديد دون إزعاج بيليه البكتيرية. استخدام التخفيف 1:100 لقياس امتصاص في 269 nm و 320 nm. يمكن حساب العدد الإجمالي من الوالعاثيات باستخدام الصيغة التالية23:
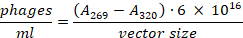
- تخزين مكتبه بالعاثيه في 4 درجه مئوية للاستخدام علي المدى القصير أو مع 25 ٪ الجلسرين في-80 درجه مئوية للتخزين علي المدى الطويل.
- تكرار جولات الاختيار (الخطوات من 3-1 إلى 3-6) لمده 3 إلى 6 جولات أو حتى يتم ملاحظه الإثراء المطلوب (راجع قسم النتائج). لوحه واختيار استنساخ واحد (القسم 4) من أجل توصيف التقارب والخصوصية لل يجند (الأقسام 5 – 7).
4. واحد استنساخ العزلة
- لعزل الاستنساخ الفردية من المكتبة الفرعية المخصب ، واعداد التخفيفات التسلسلية 10x من خلايا TG1 المصابة phage (الخطوة 3.5.2). المخففات التسلسلية لوحه علي 90 مم 2YT-أجار الاطباق التي تحتوي علي 100 ميكروغرام/مل الامبيسلين و 2 ٪ (wt/vol) الجلوكوز واحتضان في 37 درجه مئوية بين عشيه وضحيها.
- من لوحات بين عشيه وضحيها ، واختيار مستعمرات واحده في 250 μl من وسائل الاعلام 2yt تستكمل مع 100 ميكروغرام/مل الامبيسلين في بئر في لوحات عميقة العقيمة وتنمو في 37 درجه مئوية بين عشيه وضحيها.
- من الثقافات بين عشيه وضحيها ، تطعيم 10 μL إلى 500 μL من وسائل الاعلام 2YT الطازجة تستكمل مع 100 ميكروغرام/مل ampicillin.
- تنمو الخلايا إلى600 OD من 0.5 ~ ، أضافه CM13 المساعد بالعاثيه في 5 × 109 pfu/mL واحتضانها في 37 درجه مئوية و 250 دوره في الدقيقة ل 45 min.
- أضافه 500 μL من وسائل الاعلام 2YT تستكمل مع 100 ميكروغرام/مل الامبيسلين و 50 ميكروغرام/مل كاناميسين. احتضان في 25 درجه مئوية و 250 لفه في الدقيقة بين عشيه وضحيها.
- الطرد المركزي لوحات عميقة البئر من الثقافات بين عشيه وضحيها في 3,000 x g لمده 10 دقيقه جمع ماده طافي التي تحتوي علي جزيئات بالعاثيه دون إزعاج بيليه الخلية.
- يمكن استخدام الجسيمات phage ل ELISA لتحديد خصوصية المستنسخين المختارين إلى ligand. البيوتين أو homolog الهيكلية للهدف يمكن استخدامها كعنصر تحكم سلبي.
5. التحقق من صحة الموثق مرساه من قبل اليسا
- معطف 96 جيدا لوحات اليسا باستخدام 100 μL من 5 ميكروغرام/مل العقديات في العازلة طلاء (100 mM العازلة كربونات ، pH = 8.6) في 4 °C بين عشيه وضحيها.
- غسل لوحات اليسا 3x باستخدام 0.05 ٪ PBST وأضافه 100 μL من 1 μM الهدف بيوتينيلاتيد إلى الآبار المستهدفة. أضافه 100 μL من 1 μM البيوتين أو الهدف homolog إلى ابار التحكم. احتضان في RT لمده 1 ساعة.
- غسل لوحات 5x باستخدام 0.05 ٪ PBST وكتله ملزمه غير محدده عن طريق أضافه 300 μL من الكازين 1 ٪ في 1 × تلفزيوني. احتضان في RT لمده 1 ساعة.
- غسل لوحات اليسا 3x باستخدام 0.05 ٪-PBST وأضافه supernatant المنقي. احتضان لمده 1 ساعة في RT.
- غسل لوحات اليسا 10x باستخدام 0.05 ٪ PBST وأضافه 100 μL الفجل البيروكسيداز (الM13)--المضادة الرئيسية معطف البروتين الأجسام الكبيرة (1:10000 التخفيف مع 1 × تلفزيوني مع 1 ٪ الكازين). احتضان في RT لمده 1 ساعة.
- غسل لوحات اليسا 3x باستخدام 0.05 ٪ PBST وأضافه 100 μL tetramايثيل البنزيدين (TMB) الركيزة. احتضان لمده 10 دقيقه أو حتى يتم ملاحظه تغيير لون مرئية. وقف رد الفعل عن طريق أضافه 100 μL من 1 M HCl. قراءه لوحه في 450 nm علي مقياس طيفي.
- للتعبير عن البروتين وتنقيه ، واختيار المستنسخين تظهر تقارب عاليه وخصوصية للهدف (انظر المناقشة).
6. البروتين التعبير ، تنقيه ، والتعكر الحيوي
- كما ذكر سابقا19، استنساخ المستنسخين المختارة من القسم 5 والتعبير عن C-الطرفية أفي-الموسومة والموسومة nanobodies.
- اكسبرس nanobodies مختاره في الخلايا القولونية من e. كولاي WK6 (عاده في 1 L الثقافة) ، والإفراج عن طريق الصدمة الاسموزي ، وتنقيه باستخدام عمود النيكل-NTA (انظر جدول المواد).
- تبادل المخزن المؤقت مع عمود تحليه (1 × تلفزيوني مع 5 ٪ الجلسرين ، انظر جدول المواد).
- نانوبيومات الحيوية باستخدام مجموعه تجاريه (انظر جدول المواد) لمزيد من الاستخدام.
7. توصيف الموثق مرساه من قبل BLI
- تحليل ترابط ربط وحركيه من الموثقين مرساه المحددة من خلال التعبئة 200 nM الموثقات مرساه بيوتينيلات علي العقديات الحيوية (انظر جدول المواد) مع ملزمه الفحص العازلة (1 × تلفزيوني (pH = 7.4) ، 0.05 ٪ توين 20 ، 0.2 ٪ بوسنيا ، 3 ٪ الميثانول).
- حساب ثوابت التفكك (KD) من ربط الموثق-ligand التفاعلات بواسطة تحليل الحالة الثابتة باستخدام برنامج تحليل البيانات (انظر جدول المواد). يتم الحصول علي قيم KD المكتسبة عاده من ميكرومولار أحاديه الرقم.
8-فحص الموثق الديميريشن
ملاحظه: فحص القرصنة البيولوجية من "المجلدات الثنائية" يشبه الموثقات مرساه ، باستثناء خطوتين حاسمتين: 1) يتم تحديد الموثقات ديميريشن باستخدام الموثق مرساه المحددة الحيوية والموثق مرساه-ligand معقده لسلبيه والاختيارات الايجابيه ، علي التوالي. 2) خلال الخطوة التملص ، ويستخدم 100 mM ثلاثي الايثيلامين إلى الوت إيجابيا الوالعاثيات التي كانت ملزمه فقط إلى مرساه الموثق--ligand الهدف المعقدة. يتم استخدام محلول تريميثيلامين 100 mM (pH = 11.5) لاستنساخ الايجابيه الوت عن طريق تعطيل تفاعلات البروتين.
- بداية الاختيار
- تبدا كل جولة من الاختيار عن طريق تطعيم مستعمره خليه واحده TG1 ، نمت طازجه علي وسائل الاعلام الحد الأدنى ، في 6 مل 2YT في 37 درجه مئوية و 250 دوره في الدقيقة إلى OD600 من ~ 0.5. احتضان الخلايا علي الجليد.
- أزاله nanobodies المختارة سلبا
- اعداد "أنبوب الطرح" باستخدام 400 μL من الخرز المغناطيسي المغلفة العقديات واتبع الخطوة 3.2. ومع ذلك ، بدلا من تشبع مع البيوتين ، أضافه 5x قدره الربط الكامل محسوبة باستخدام الموثق مرساه بيوتينيلاتيد المحددة وحفظ والعاثيات غير منضم لاستخدامها في الخطوة 8.3.3.
- اختيار النانو المختارة بشكل إيجابي
- اعداد "أنبوب التقاط" باستخدام 1/2 حجم الخرز المغناطيسي المغلفة العقديات المستخدمة في "أنبوب الطرح" والخطوات التالية 3-3-2 إلى 3-3-3. ومع ذلك ، بدلا من التشبع بالاربطه الحيوية ، أضف خمسه اضعاف سعة الربط الكاملة المحسوبة باستخدام الموثق الارتساء المحدد بيوينيلتد.
- لتشكيل الموثق مرساه-يجند المعقدة لتحديد الموثق الايجابيه ديميريشن ، أضافه تركيز عال بما فيه الكفاية من liginylated غير-. هذا سيسمح معظم الموثق مرساه منضم لتشكيل المعقدة ligand منضم.
- اتبع الخطوات 3-3-3 ل3.3.8 ، وذلك باستخدام والعاثيات غير منضم ماخوذه من "أنبوب الطرح".
- التملص من nanobodies مختاره إيجابيا
- Elute الوالعاثيات منضما إلى مرساه الموثق-ligand معقده من خلال أضافه 450 μl من 100 mM triethylamine ، واحتضان في RT علي المدورة لمده 10 دقيقه.
- جمع والعاثيات التي لا يمكن التنافس عليها واتبع الخطوات من 3.4 إلى 3.4.
- جولات أخرى من اختيار الموثق التنقيط
- اتبع الخطوات 3.5 و 3.6 لتضخيم واستعاده المكتبة من أجل اجراء جولات اضافيه من الاختيار. تكرار جولات الاختيار لمده 3-6 جولات أو حتى يتم ملاحظه الإثراء المطلوب. لوحه واختيار استنساخ واحد (الرجوع إلى القسم 4) من أجل توصيف تقاربها وخصوصيتها للهدف.
9. توصيف الموثق من قبل اليسا
- اتبع الخطوات المنصوص عليها في القسم 4 لعزل المستنسخين الفردية لتوصيفها عن طريق ELISA.
- لاختبار تقارب المرشحين الموثق ديميريشن إلى الموثق مرساه-ligand معقده ، ومعطف لوحه الهدف اليسا باستخدام 100 μL من 100 nM الموثق مرساه بيوتينيلاتيد. بعد الحضانة ل 1 ح ، أضافه 1 μM من الهدف لتشكيل مرساه الموثق-يجند معقده.
- يجب ان تكون مغلفه لوحه التحكم باستخدام الموثق مرساه بيوتينيلاتيد وحدها لشاشه الاستنساخ التي يمكن أيضا ربط الموثق مرساه الحرة. أضافه 100 μL من 100 nM الموثق مرساه بيوتينيلاتيد واحتضان في RT ل 1 ح.
- اتبع الأقسام 5.3 – 5.7.
10. توصيف الموثق من قبل BLI
- ويمكن تحليل الترابط الملزم وحركيه المجلدات الثنائية للربط الموثق--ligand معقده عن طريق التعبئة الموثقات ديميريشن الحيوية علي العقديات (SA) الاستشعار البيولوجي مع العازلة المقايسة ملزمه وثم التهاوي مع 1 μM مرساه الموثق قبل معايرتها مع تخفيفات التسلسلي من ligand. يمكن حساب k Dو k on و kالخروج من التفاعلات باستخدام الطريقة التي تم الإبلاغعنها19.
Access restricted. Please log in or start a trial to view this content.
النتائج
ونحن نوضح الاختيار من خطوتين في المختبر والتحقق من الموثقات مرساه والتهجين من خلال فحص مكتبه nanobody التوافقية مع تنوع اعلي من 109 باستخدام اتفاقيه التنوع البيولوجي كهدف. ومن المهم تقييم إثراء القرصنة البيولوجية خلال الجولات المتعاقبة من الاختيار لكل من المرساة والمجلدات الثنائية. نتا...
Access restricted. Please log in or start a trial to view this content.
Discussion
ومن المهم لاختيار التركيزات الصحيحة من المكتبات بالعاثيه الإدخال لجولات مختلفه من القرصنة البيولوجية. بدانا عاده من مكتبه المدخلات من ~ 1012-1013 الجسيمات بالعاثيه مع التنوع > 109، والسماح ~ 100-1000 نسخه من كل استنساخ بالعاثيه ليتم تقديمها في السحب إلى أسفل المقايسة. إذا كان التر?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
وقد قدمت جامعه واشنطن براءة اختراع مؤقته تتعلق بهذا العمل.
Acknowledgements
وقد تم دعم هذا العمل من قبل جائزه جامعه واشنطن للابتكار (إلى L.G.) ، وهي منحه من المعاهد الوطنية الامريكيه للصحة (1R35GM128918 إلى L.G.) ، وصندوق لبدء التشغيل من جامعه واشنطن (إلى L.G.). وقد تم دعم اتش جي) من قبل الزمالة الجامعية لمؤسسه واشنطن للأبحاث. وقد تم دعم K.W. من قبل زمالة جامعيه من معهد جامعه واشنطن لتصميم البروتين.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1-Step Ultra TMB ELISA substrate solution | Thermo Fisher Scientific | 34029 | |
| Agar | Thermo Fisher Scientific | BP1423-2 | |
| Amicon Ultra-15 Centrifugal Filter unit (3 kDa cutoff) | Millipore | UFC900324 | |
| Ampicillin | Thermo Fisher Scientific | BP1760-25 | |
| Bio-Rad Protein Assay Kit II | Bio-Rad | 5000002 | |
| BirA biotin-protein ligase standard reaction kit | Avidity | BirA500 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A2153-50G | |
| Casein | Sigma-Aldrich | C7078-1KG | |
| CM13 Helper phage | Antibody Design Labs | PH020L | |
| D-(+)-Glucose monohydrate | Alfa Aesar | A11090 | |
| Dynabeads M-280 Streptavidin | Thermo Fisher Scientific | 11205D | |
| DynaMag-2 Magnet | Thermo Fisher Scientific | 12321D | |
| EDTA | Thermo Fisher Scientific | BP120-1 | |
| Fast DNA Ladder | New England Biolabs | N3238S | |
| FastDigest BglI | Thermo Fisher Scientific | FD0074 | |
| Glycerol | Thermo Fisher Scientific | BP229-1 | |
| HiLoad 16/600 Superdex 200 pg | GE Healthcare | 28989335 | |
| HiPrep 26/10 Desalting Column | GE Healthcare | 17508701 | |
| HisTrap-FF-1ml | GE Healthcare | 11000458 | |
| Imidazole | Alfa Aesar | 161-0718 | |
| IPTG | Thermo Fisher Scientific | 34060 | |
| Kanamycin | Thermo Fisher Scientific | BP906-5 | |
| M13 Major Coat Protein Antibody | Santa Cruz Biotechnology | sc-53004 | |
| NaCl | Sigma-Aldrich | S3014-500G | |
| NanoDrop 2000/2000c Spectrophotometers | Thermo Fisher Scientific | ND-2000 | |
| Nunc 96-Well Polypropylene DeepWell Storage Plates | Thermo Fisher Scientific | 260251 | |
| Nunc MaxiSorp | Thermo Fisher Scientific | 44-2404-21 | |
| Octet RED96 | ForteBio | N/A | |
| pADL-23c Phagemid Vector | Antibody Design Labs | PD0111 | |
| PEG-6000 | Sigma-Aldrich | 81260-1KG | |
| Platinum SuperFi DNA Polymerase | Invitrogen | 12351010 | |
| PureLink PCR Purification Kit | Thermo Fisher Scientific | K310001 | |
| QIAprep Spin M13 Kit | Qiagen | 27704 | |
| Recovery Medium | Lucigen | 80026-1 | |
| SpectraMax Plus 384 | Molecular Devices | N/A | |
| Sucrose | Sigma-Aldrich | S0389-1KG | |
| Super Streptavidin (SSA) Biosensors | ForteBio | 18-5057 | |
| Superdex 75 increase 10/300 GL Column | GE Healthcare | 28-9909-44 | |
| T4 DNA Ligase | Thermo Fisher Scientific | 15224-025 | |
| TG1 Electrocompetent Cells | Lucigen | 60502-1 | |
| Triethylamine | Sigma-Aldrich | 471283-100mL | |
| Trizma Base | Sigma-Aldrich | T1503 | |
| Tryptone | Thermo Fisher Scientific | BP9726-5 | |
| Tween 20 | Thermo Fisher Scientific | BP337-500 | |
| Yeast Extract | Thermo Fisher Scientific | BP1422-2 | |
| Zeba Spin Desalting Column | Thermo Fisher Scientific | 89882 |
References
- Stanton, B. Z., Chory, E. J., Crabtree, G. R. Chemically induced proximity in biology and medicine. Science. 359 (6380), (2018).
- Wu, C. Y., Roybal, K. T., Puchner, E. M., Onuffer, J., Lim, W. A. Remote control of therapeutic T cells through a small molecule-gated chimeric receptor. Science. 350 (6258), (2015).
- Straathof, K. C., et al. An inducible caspase 9 safety switch for T-cell therapy. Blood. 105 (11), 4247-4254 (2005).
- Di Stasi, A., et al. Inducible apoptosis as a safety switch for adoptive cell therapy. The New England Journal of Medicine. 365 (18), 1673-1683 (2011).
- Mank, M., et al. A FRET-based calcium biosensor with fast signal kinetics and high fluorescence change. Biophysical Journal. 90 (5), 1790-1796 (2006).
- Nagai, T., Sawano, A., Park, E. S., Miyawaki, A. Circularly permuted green fluorescent proteins engineered to sense Ca2+. Proceedings of the National Academy of Sciences of the United States of America. 98 (6), 3197-3202 (2001).
- Hunter, M. M., Margolies, M. N., Ju, A., Haber, E. High-affinity monoclonal antibodies to the cardiac glycoside, digoxin. Journal of Immunology. 129 (3), 1165-1172 (1982).
- Bradbury, A. R. M., Sidhu, S., Dubel, S., McCafferty, J. Beyond natural antibodies: the power of in vitro display technologies. Nature Biotechnology. 29 (3), 245-254 (2011).
- Chen, G., et al. Isolation of high-affinity ligand-binding proteins by periplasmic expression with cytometric screening (PECS). Nature. Biotechnology. 19 (6), 537-542 (2001).
- Tinberg, C. E., et al. Computational design of ligand-binding proteins with high affinity and selectivity. Nature. 501 (7466), 212-216 (2013).
- Spencer, D. M., Wandless, T. J., Schreiber, S. L., Crabtree, G. R. Controlling signal transduction with synthetic ligands. Science. 262 (5136), 1019-1024 (1993).
- Ho, S. N., Biggar, S. R., Spencer, D. M., Schreiber, S. L., Crabtree, G. R. Dimeric ligands define a role for transcriptional activation domains in reinitiation. Nature. 382 (6594), 822-826 (1996).
- Belshaw, P. J., Ho, S. N., Crabtree, G. R., Schreiber, S. L. Controlling protein association and subcellular localization with a synthetic ligand that induces heterodimerization of proteins. Proceedings of the National Academy of Sciences of the United States of America. 93 (10), 4604-4607 (1996).
- Farrar, M. A., AlberolaIla, J., Perlmutter, R. M. Activation of the Raf-1 kinase cascade by coumermycin-induced dimerization. Nature. 383 (6596), 178-181 (1996).
- Erhart, D., et al. Chemical Development of Intracellular Protein Heterodimerizers. Chemistry & Biology. 20 (4), 549-557 (2013).
- Ballister, E. R., Aonbangkhen, C., Mayo, A. M., Lampson, M. A., Chenoweth, D. M. Localized light-induced protein dimerization in living cells using a photocaged dimerizer. Nature Communications. 17 (5), 5475(2014).
- Hill, Z. B., Martinko, A. J., Nguyen, D. P., Wells, J. A. Human antibody-based chemically induced dimerizers for cell therapeutic applications. Nature Chemical Biology. 14 (2), 112-117 (2018).
- Foight, G. W., et al. Multi-input chemical control of protein dimerization for programming graded cellular responses. Nature Biotechnology. 37 (10), 1209-1216 (2019).
- Kang, S., et al. COMBINES-CID: An efficient method for de novo engineering of highly specific chemically induced protein dimerization systems. Journal of the American Chemical Society. 141 (28), 10948-10952 (2019).
- Muyldermans, S. Nanobodies: natural single-domain antibodies. Annual Review of Biochemistry. 82, 775-797 (2013).
- Fanning, S. W., Horn, J. R. An anti-hapten camelid antibody reveals a cryptic binding site with significant energetic contributions from a nonhypervariable loop. Protein Science. 20 (7), 1196-1207 (2011).
- Zavrtanik, U., Luken, J., Loris, R., Lah, J., Hadzi, S. Structural basis of epitope recognition by heavy-chain camelid antibodies. Journal of Molecular Biology. 430 (21), 4369-4386 (2018).
- Denhardt, D. T., Dressler, D., Ray, D. S. The Single-Stranded DNA Phages. , 605-625 (1978).
- Virnekas, B., et al. Trinucleotide phosphoramidites: ideal reagents for the synthesis of mixed oligonucleotides for random mutagenesis. Nucleic Acids Research. 22 (25), 5600-5607 (1994).
- Gu, L., et al. Multiplex single-molecule interaction profiling of DNA-barcoded proteins. Nature. 515 (7528), 554-557 (2014).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved