Method Article
تصور المقاومة البكتيرية باستخدام تحقيقات المضادات الحيوية الفلورية
In This Article
Summary
المضادات الحيوية الموسومة بالفلورسنت هي أدوات قوية يمكن استخدامها لدراسة جوانب متعددة من مقاومة مضادات الميكروبات. تصف هذه المقالة إعداد المضادات الحيوية الموسومة بالفلورسنت وتطبيقها لدراسة مقاومة المضادات الحيوية في البكتيريا. يمكن استخدام المسابير لدراسة آليات المقاومة البكتيرية (على سبيل المثال، efflux) عن طريق قياس الطيف الضوئي، وقياس التدفق الخلوي، والمجهر.
Abstract
المضادات الحيوية الفلورية هي أدوات بحثية متعددة الأغراض تستخدم بسهولة لدراسة مقاومة مضادات الميكروبات ، نظرًا لميزتها الكبيرة على الطرق الأخرى. لإعداد هذه المسابير، يتم تصنيع مشتقات الأزيد من المضادات الحيوية، ثم يقترن الكين فلوروفورس باستخدام أزيد-ألكين ديبولبالإضافةس فوق الكيمياء. بعد التنقية ، يتم اختبار نشاط المضادات الحيوية للمضادات الحيوية الفلورية عن طريق تقييم الحد الأدنى من التركيز المثبط. من أجل دراسة التراكم البكتيري ، يمكن استخدام قياس الطيف الضوئي أو قياس التدفق الخلوي ، مما يسمح بتحليل أبسط بكثير من الطرق التي تعتمد على مشتقات المضادات الحيوية المشعة. وعلاوة على ذلك، يمكن استخدام المجهر التكوسي لفحص التوطين داخل البكتيريا، وتوفير معلومات قيمة حول طريقة العمل والتغيرات التي تحدث في الأنواع المقاومة. استخدام تحقيقات المضادات الحيوية الفلورية في دراسة مقاومة مضادات الميكروبات هو طريقة قوية مع الكثير من الإمكانات للتوسع في المستقبل.
Introduction
مقاومة مضادات الميكروبات هي أزمة متصاعدة تشكل تهديداً كبيراً لصحة الإنسان في جميع أنحاء العالم. وقد تم الإبلاغ عن مقاومة معظم المضادات الحيوية، وظهرت العدوى الناجمة عن البكتيريا المقاومة لجميع الأدوية المتاحة سريريا. ومن أجل مكافحة ارتفاع معدل الوفيات، نحتاج إلى زيادة فهمنا لهذه الظاهرة المتعددة الأوجه والآليات والتفاعلات الأساسية بين المضادات الحيوية والبكتيريا. أحد الجوانب التي كانت تاريخيا سيئة الفهم هو نفاذ المضادات الحيوية إلى البكتيريا، جنبا إلى جنب مع ظواهر التراكم وefflux. هذه المعرفة أمر حاسم في تصميم أدوية جديدة وفهم آليات المقاومة. ومن ثم، فإن هذا يلعب دوراً حاسماً في بحوث AMR.
هناك نهجان رئيسيان يمكن اتخاذهما لقياس تركيز المضادات الحيوية: قياس الدواء مباشرة أو وضع علامات على موى مصمم لتسهيل القياس الكمي. على الرغم من أن وضع علامات على المضادات الحيوية يحسن الكشف ، فإن هذا يمكن أن ياضطراب النشاط البيولوجي للدواء ، مثل النشاط المضاد للميكروبات ونفاذيته. هذه ليست مشكلة للأساليب غير الموسومة; ومع ذلك، يمكن أن يكون الكشف تحديا. في السنوات القليلة الماضية ، أدت التطورات التكنولوجية إلى طفرة في البحوث باستخدام قياس الطيف الكتلي (MS) لقياس تركيز المضادات الحيوية مباشرة في البكتيريا1،2،3،4،5،6. وقد أظهرت هذه الدراسات أنه من الممكن دراسة تراكم داخل الخلايا في مجموعة متنوعة من البكتيريا، مع البكتيريا السلبية الغرام الأكثر دراسة على نطاق واسع. ثم تم ربط القياس الكمي لنفاذية الجزيء بالنشاط واستخدامها لإعلام تطوير الدواء2،3،4، على الرغم من الحذر يجب اتخاذه عند الخلط المباشر بين التراكم والنشاط المستهدف5. قبل تطور التصلب المتعدد ، كانت المضادات الحيوية الوحيدة التي يمكن قياس تركيزها مباشرة هي تلك التي تمتلك الفلورسين الأصيل ، مثل التتراسيكلين والكينولون8و9و10و11. وعلى الرغم من أن التراكم والتدفق الكمي محدودان بوضوح في نطاقهما، فقد تم فحصهما وقياسهما، مما يوضح فائدة القياس الكمي القائم على الفلورسينس.
وقد استخدمت المضادات الحيوية الموسومة لعدة عقود لدراسة التوزيعات، وأساليب العمل، والمقاومة، مع العلامات المشعة والفلورية شائعة. وللتحقيقات الموسومة بالراديو ميزة كونها مطابقة تقريباً للمركب الأصلي، ومن ثم فمن غير المرجح أن يكون النشاط البيولوجي مختلفاً اختلافاً كبيراً. وقد استخدمت النظائر مثل 3H و 14C و 15N بشكل متكرر بسبب بروز هذه العناصر في المضادات الحيوية ، وتم فحص مجموعة متنوعة من سقالات المضادات الحيوية1،10،12،13. وفي حين أن الكشف عن المسابير الراديوية بسيط، فإن هناك عدداً من الشواغل اللوجستية (مثل السلامة، ونصف العمر النظيري) التي حدت من استخدام هذا النهج. استراتيجية أخرى هي المضادات الحيوية الموسومة بالفلورسنت. ويمكن استخدام هذه المسابير لدراسة توزيع وطرق العمل والمقاومة للدواء الأم، وذلك باستخدام تكنولوجيا أبسط من مرض التصلب العصبي المتعدد ودون المشاكل اللوجستية للإشعاع8. العيب الرئيسي لهذا النهج هو أن المضادات الحيوية هي عموما جزيئات صغيرة نسبيا، وبالتالي إدخال موي الفلورسنت يشكل تغييرا كيميائيا كبيرا. يمكن أن يؤثر هذا التغيير على الخصائص الفيزيائية ونشاط مضاد للبكتيريا. لذلك ، يجب توخي الحذر لتقييم هذه العوامل من أجل توليد نتائج تمثل المضادات الحيوية الأم.
في هذا العمل ، يتم وصف طريقة لتوليف وتقييم واستخدام المضادات الحيوية الفلورية ، كما هو الحال في منشوراتنا السابقة14،15،16. ومن خلال العمل السابق، تم إعداد عدد من المضادات الحيوية الفلورية واستخدامها لأغراض متنوعة (انظر Stone et al.8). من أجل تقليل احتمال التأثير على النشاط البيولوجي ، يتم استخدام فلوروفوريات صغيرة جدًا في هذا العمل: النيتروبنزوكديازيول (NBD ، الأخضر) و 7-(dimethylamino)-2-oxo-2 H-chromen-4-yl (DMACA ، أزرق). علاوة على ذلك ، يتم وصف تقييم النشاط المضاد للبكتيريا باستخدام الحد الأدنى من تخفيف microbroth (MIC) ، بحيث يمكن قياس تأثير التعديلات على النشاط. يمكن استخدام هذه المسابير الموسومة بالفلورسنت في الاختبارات الطيفية الضوئية، وقياس التدفق الخلوي، والمجهر. مجموعة من التطبيقات الممكنة حيث تكمن ميزة المضادات الحيوية الفلورية. يمكن قياس التراكم الخلوي وتصنيفه وتصوره، وهو أمر غير ممكن باستخدام التصلب المتعدد وحده. ومن المؤمل أن تساعد المعرفة المكتسبة من خلال استخدام المضادات الحيوية الفلورية في فهمنا للمقاومة، ومكافحة المضادات الحيوية.
Protocol
1- تركيب الألكين - فلوروفوريس
- توليف NBD-alkyne (7-nitro-N-(prop-2-yn-1-yl)benzo[c]1,2,5] أوكساديازول-4-أمين)
- إذابة 1031 ملغ من 4-كلورو-7-نيترو بنزوفيوران (5.181 ملليمول) في 60 مل من رباعي هيدروفوران (THF). أضف 1,857 ملغ من CsCO3 (5.696 ملليمول)، ثم 0.39 مل من البرأرجيلامين (6.1 ملليمول). سخني رد الفعل إلى 50 درجة مئوية لمدة ساعتين، والتي ستتحول من اللون البني إلى الأخضر، ثم تبرد إلى درجة حرارة الغرفة (RT).
- تصفية رد الفعل باستخدام مساعدة تصفية (انظر جدول المواد)،وغسل مع خلات الإيثيل (EA). تركيز filtrate تحت ضغط مخفض، ثم حل بقايا في 150 مل من EA والانتقال إلى قمع فصل 500 مل.
- اغسل محلول EA بـ 100 مل بالماء ومحلول ملحي على التوالي. ثم الجمع بين المراحل المائية وغسل 2x مع 100 مل من EA.
- تجفيف المراحل العضوية مجتمعة على كبريتات المغنيسيوم اللامائية، ثم تصفية والتركيز تحت ضغط أقل.
- تنقية المنتج الخام عن طريق الكروماتوغرافيا فلاش على هلام السيليكا (20-30٪ EA في الأثير النفطي [PE])، والتحقق من النقاء عن طريق قياس الطيف الكتلي اللوني السائل (LCMS، [M +H]+ = 219.1) و / أو الرنين المغناطيسي النووي (NMR) الطيفي، والتحولات الكيميائية على النحو التالي:
1 H NMR (CD3OD, 600 MHz) ο 8.54 (d, J = 8.7 Hz, 1H), 6.35 (d, J = 8.4 Hz, 1H), 4.31 (dd, J = 5.7 Hz, J = 2.5 هرتز, 2H), 2.43 (t, J = 2.5 هرتز, 1H); 13 C NMR (CD3OD, 150 ميغاهرتز) 144.3, 143.7, 142.2, 135.8, 125.7, 100.0, 76.5, 74.2, 33.4.
ملاحظة: عند إجراء التنقية بواسطة الكروماتوغرافيا هلام السيليكا، وإعداد العمود باستخدام أقل القطبية من المذيبات المذكورة. قد يتم تحميل مركب الخام كحل مركز أو امتزاز على السيليكا إذا كان الذوبان لا يسمح بذلك. بعد إضافة المركب إلى الجزء العلوي من السيليكا ، قم بتشغيل 1-2 من أحجام الأعمدة من نفس المذيب المستخدم في ترطيب السيليكا. ثم تبدأ مع نسبة المذيبات المذكورة، من خلال تشغيل ما لا يقل عن 1 حجم العمود من كل مذيب، والتأكد من عدم جعل يقفز كبيرة في تكوين المذيبات. جمع الكسور، والتحقق من النقاء / الهوية من قبل LCMS أو TLC (الكروماتوغرافيا طبقة رقيقة). الجمع بين الكسور النقية والتركيز تحت ضغط أقل عن طريق التبخر الدوار.
- توليف DMACA-ألكين (2-(7-(dimethylamino)-2-oxo-2H-chromen-4-yl)-N-(دعامة-2-yn-1-yl)acetamide).
- حل 5.02 غرام من الفينول 3-(dimethylamino)الفينول (36.6 مليمول) في 30 مل من الإيثانول، ثم أضف 6.7 مل من ديثيل 1،3-acetonedicarboxylate (36 مليمول). إضافة 10.5 غرام من ZnCl2 (77.2 mmol)، ثم الجزر الحل الأحمر لمدة 42 ساعة. إضافة 9.20 غرام إضافية من ZnCl2 (67.6 mmol)، ثم الجزر لمدة 8 ساعة.
- تبريد رد الفعل والتركيز تحت ضغط مخفض. تفريق الصلبة الحمراء الناتجة في 200 مل من EA، تصفية، ثم نقل إلى قمع فصل 500 مل.
- غسل EA مع 200 مل كل من الماء ومحلول ملحي، ثم تجف على كبريتات المغنيسيوم اللامائية. تصفية المرحلة العضوية المجففة والتركيز تحت ضغط أقل.
- تنقية الصلبة الحمراء (الإيثيل 2-(7-(dimethylamino)-2-oxo-2 H-chromen-4-yl))خلات) بواسطة كروماتوغرافيا فلاش على هلام السيليكا (0-100٪ EA في PE)، والتحقق من النقاء من قبل LCMS ([M +H]+ = 275.1) و / أو NMR، والتحولات الكيميائية على النحو التالي:
1 H NMR (CDCl3، 600 ميغاهرتز) 7.30 (د ، J = 8.9 هرتز، 1H)، 6.52 (dd، J = 8.9 هرتز، J = 2.6 هرتز، 1H)، 6.40 (د، J = 2.6 هرتز، 1H)، 5.87 (م، 1H)، 2.96 (م، 8H)، 2.25 (د، J = 1.2 هرتز، 3H). - إذابة 488 ملغ من الإيثيل 2-(7-(dimethylamino)-2-oxo-2 H-chromen-4-yl) خلات (1.18 ملليمول) في 10 مل من THF، ثم إضافة محلول من 157 ملغ من LiOH· H2O (3.74 مليمول) في 15 مل من الماء. حرك رد الفعل في RT لمدة 3 ساعة ، ثم انتقل إلى قمع فصل وتمييع مع 50 مل إضافية من الماء.
- غسل خليط التفاعل 2x مع 50 مل من الأثير ديثيل (Et2O)، ثم اغسل المرحلة العضوية مجتمعة 2x مع 25 مل من الماء. خذ أي ترسب أصفر مع الطبقة العضوية. تركيز المرحلة العضوية تحت ضغط مخفض باستخدام المبخر الدوار.
- تحمض المرحلة المائية إلى درجة الحموضة = 2 مع HCl المركزة، وبارد إلى 4 درجة مئوية بين عشية وضحاها. تصفية المرحلة المائية الحمضية وإضافة الصلبة الصفراء إلى المرحلة العضوية المركزة.
ملاحظة: يمكن استخدام حمض الخليك 2-(7-(dimethylamino)-2-oxo-2 H-chromen-4-yl) دون مزيد من التنقية، ولكن يمكن التحقق من ذلك بواسطة LCMS ([M+H]+ = 247.1) و/أو NMR، والتحولات الكيميائية على النحو التالي:
1 H NMR (CDCl3، 600 ميغاهرتز) 7.41 (د ، J = 9.0 هرتز، 1H)، 6.62 (dd، J = 9.2 هرتز، J = 2.8 هرتز، 1H)، 6.52 (د، J = 2.8 هرتز، 1H)، 5.98 (د، J = 0.9 هرتز، 1H)، 3.05 (s، 6H)، 2.35 (د، J = 0.9 هرتز، 2H)؛ 13 C NMR (CDCl3, 150 MHz) 162.2, 155.7, 152.9, 152.8, 125.3, 109.7, 109.3, 109.1, 108.8, 98.3, 40.2, 18.5. - حل 466 ملغ من 2-(7-(dimethylamino)-2-oxo-2 H-chromen-4-yl) حمض الخليك (1.89 مليمول) في 7 مل من Nالجافة،N-dimethylformmee(DMF) ومكان تحت جو من النيتروجين.
- تذوب 0.33 مل من بروبروأرغلامين (5.1 مليمول) في 7 مل من DMF الجافة تحت النيتروجين. إضافة 1.30 مل من أمين دي إيزوبروبليثيل (DIPEA، 7.50 مليمول) إلى محلول الصبغة، ثم 535 ملغ من O-(1H-6-chlorobenzotriazole-1-yl)-1،1،3،3-tetramethyluronium سداسي فلوروفوسفات (HCTU، 1.29 mmol). حرك محلول الصبغة المنشط لمدة 15 دقيقة في RT، ثم أضف محلول الأمين المنسدل، واتركه ليحرك بين عشية وضحاها.
- في اليوم التالي، تمييع رد الفعل مع 35 مل من الماء ثم تركز تحت ضغط أقل.
- تقسيم الصلبة البرتقالي الناتج بين EA ومحلول ملحي (100 مل لكل منهما) في قمع فصل 250 مل. فصل الطبقات (تشغيل طبقتين إلى قوارير مختلفة)، وغسل المرحلة المائية مع 100 مل من EA.
- تركيز المراحل العضوية مجتمعة تحت ضغط مخفض، ثم إعادة حل الصلبة البرتقالية في 3 مل من 1:1 أسيتونتريل (ACN) / الماء (v/v). تنقية المنتج الخام عن طريق الحقن على نظام كروماتوغرافيا سائل ة متوسطة الضغط للمرحلة العكسية (MPLC) مجهزة بعمود خرطوشة C18 (المذيبات A: water, المذيبات B: ACN).
- تحقق الكسور للنقاء من قبل LCMS ([M +H]+ = 284.1 ، التحولات الكيميائية NMR الواردة أدناه) ، ثم الجمع بين وlyophilize الكسور المناسبة لإعطاء 2-(7-(dimethylamino)-2-oxo-2H-chromen-4-yl) - N-(prop-2-yn-1-yl)acetamide ، التحولات الكيميائية NMR على النحو التالي:
1 H NMR (600 ميغاهرتز، DMSO-d6)ο 8.65 (t، J = 5.4Hz، 1H)، 7.52 (د، J = 9.0Hz، 1H)، 6.72 (dd، J = 9.1، 2.6 هرتز، 1H)، 6.55 (د، J = 2.6 هرتز، 1H)، 6.00 (s، 1H)، 3.88-3.87 (م، 2H)، 3.62 (s، 2H)، 3.13 (t، J = 2.5 هرتز، 1H)، 3.01 (s، 6H)؛ 13 C NMR (125 ميغاهرتز، DMSO-d6)167.7، 160.7، 155.4، 152.9، 151.0، 126.0، 109.4، 109.1، 108.1، 97.5، 80.9، 73.3، 39.7، 38.4، 28.2.
2- تركيب المضادات الحيوية الفلورية
- إعداد مشتق أزايد من مضاد حيوي كما هو موضح سابقا14،15،16.
ملاحظة: الإجراء خاص بكل مضاد حيوي ويتطلب فحصًا دقيقًا لعلاقة نشاط الهيكل (SAR) للجزيء الأم لضمان احتفاظ المضادات الحيوية الوظيفية بنشاط مشابه للأصل. (على سبيل المثال، سيبروفلوكساسين16،linezolid14،وتريميثوبريم15). انظر الشكل 1 للاطلاع على أمثلة المضادات الحيوية الفلورية المنشورة، ومخطط التوليف العام. - انقر فوق إجراء رد الفعل A
ملاحظة: بالنسبة لمعظم المضادات الحيوية، اتبع الإجراء المفصل هنا لالنحاس حفز Huisgen [2+3] cycloaddition من أزيد (الخطوة 2.1) والألكين الفلوري (أعدت في الخطوة 1).- ضع المضادات الحيوية الأزايد في قارورة قاع مستديرة وإضافة tert-butanol(tBuOH) والماء (1:1 v/v, 25 مل لكل مايمول أزايد).
- أضف الفلوروفور-ألكين المعدة في الخطوة 1.1 (3 مكافئ) وتسخين التفاعل إلى 50 درجة مئوية. ثم أضف كبريتات النحاس (100 مم في الماء، 0.6 مكافئ) إلى التفاعل، تليها حمض الأسكوربيك (500 مم في الماء، 2.4 مكافئ).
- اثارة رد الفعل في 50 درجة مئوية لمدة 1 ساعة، أو حتى التحليل من قبل LCMS بناء على إشارة إلى اكتمال رد الفعل (الاستهلاك الكامل للبدء azide).
- تبريد رد الفعل وتنقية حسب الاقتضاء لسقالة المضادات الحيوية والمضي قدما لتنقية إما عن طريق الخطوة 2.3 أو 2.4.
ملاحظة: العديد من طرق تنقية مختلفة ممكنة، اعتمادا على قطبية واستقرار السقالة.
- انقر فوق إجراء رد الفعل B
ملاحظة: اتبع هذا الإجراء للمضادات الحيوية القائمة على الببتيد، لتوفير ظروف تفاعل أقوى (عمل غير منشور، فيتسانغ، 2019).- ضع الببتيد azide-المضادات الحيوية في قارورة أسفل جولة وإضافة ما يكفي من DMF (750 مل / ملليمول أزيد) لتذوب.
- أضف الفلوروفور-ألكين المعدة في الخطوة 1 (5 مكافئ) وتسخين رد الفعل إلى 50 درجة مئوية لمدة ساعة واحدة.
- إضافة النحاس (I) يوديد (20 مكافئ)، ثم DIPEA (120 مكافئ)، ثم حمض الخليك (240 مكافئ).
- حرك رد الفعل عند درجة حرارة 50 درجة مئوية لمدة ساعة واحدة ، أو حتى يشير التحليل من قبل LCMS إلى اكتمال التفاعل (أي الاستهلاك الكامل للأزيد البدأ). تبريد رد الفعل والمضي قدما لتنقية الطريقة 1 (انظر الخطوة 2.3).
- طريقة التنقية 1 (المستخدمة لسيبروفلوكساسين، تريميثوبريم، وlinezolid)
- حقن رد فعل انقر تبريد مباشرة على عمود خرطوشة MPLC C18.
- دمج مرحلة غسيل طويلة (حوالي 10 دقيقة) في بداية المدى (100٪ مذيب A)، ثم تشغيل التدرج تصل إلى 100٪ المذيبات B، تليها العودة إلى المذيبات A.
ملاحظة: يمكن اختيار المذيبات A من الماء، 0.05-0.1٪ حمض فورميك (FA) في الماء، 0.05-0.1٪ حمض ثلاثي الفلوروacetic (TFA) في الماء، اعتمادا على الذوبان، والاستقرار، وأفضل قرار من القمم. يمكن اختيار المذيبات B من الأسيتونتريل (ACN)، 0.05-0.1٪ FA في ACN، 0.05-0.1٪ TFA في ACN، لمطابقة المذيبات A. إذا ثبت صعوبة الإلوتيون، يمكن استخدام الميثانول بدلاً من ACN. - جمع والجمع بين الكسور المناسبة، كما هو مبين من قبل LCMS واللون (الكتلة الصحيحة ينظر، ذروة المفرد)، ثم lyophilize لإعطاء (شبه) المضادات الحيوية الفلورية النقية.
- مزيد من تنقية المنتج إذا لزم الأمر. تقييم النقاء من قبل NMR و / أو LCMS والكروماتوغرافيا السائلة عالية الضغط (HPLC) ، وذلك باستخدام عمود وطريقة مناسبة للسقالة.
- طريقة التنقية 2
ملاحظة: إذا كان الذوبان يسمح، قد يتم إجراء التنقية المسبقة بواسطة العمل مائي (المستخدمة للmacrolides، العمل غير المنشور، الحجر 2019).- تمييع رد فعل النقر المبرد بالماء وEt2O (1:1 v/v ، تخفيف 10 أضعاف تقريبًا من حجم التفاعل الأولي) ، ونقل إلى قمع فصل الحجم المناسب.
- فصل الطبقات وغسل المرحلة المائية مرتين مع Et2O.
- غسل المراحل العضوية مجتمعة 2x مع الماء (حجم متساو مع المرحلة العضوية)، ثم تجف على أكثر من نا2SO4.
- تصفية المرحلة العضوية المجففة والتركيز تحت ضغط أقل.
- تنقية المنتج الخام من قبل MPLC و / أو HPLC كما هو موضح في الخطوة 2.4.4.
ملاحظة: راجع الشكل 2 للحصول على أمثلة من ردود فعل النقر غير مكتملة وكاملة ونقية LCMS. الغلة المنقى النموذجية لتفاعلات النقر بين المضادات الحيوية والفلوروفور تتراوح بين 30-80٪.
تنبيه: معظم المواد الكيميائية المستخدمة في هذه التوليفات تمتلك مخاطر سلامة محددة. يجب توخي الحذر في جميع الأوقات، بما في ذلك استخدام معدات الحماية الشخصية. Et2O, tBuOH, FA, حمض الخليك, PE, EA, THF, ACN, DMF, EtOH, DIPEA, propargylamine, وHCTU كلها قابلة للاشتعال; تجنب الاتصال مع مصادر الحرارة أو شرارة. THF، بروبروأرغلامين، DIPEA، تيبوه، FA، DMF، وPE كلها سامة؛ تجنب التعرض. بروبروأرغلامين، CsCO3،ZnCl2،LiOH-H2O، DIPEA، كوي، FA، حمض الخليك، وHCl كلها تآكل؛ تجنب الاتصال وتكون على علم من الاتصال السطحي. ZnCl2، كوسو4، CuI ، PE تمثل المخاطر البيئية؛ أن تضع في اعتبارها شروط التخلص. THF يمكن أن تشكل بيروكسيدات المتفجرة; رعاية مع ظروف التخزين. الإيزيدس العضوية متفجرة. رعاية خاصة مع الإنتاج على نطاق واسع.
3- تقييم نشاط مضادات الميكروبات
ملاحظة: يجب أن تتم جميع الأعمال التي تنطوي على البكتيريا في ظروف معقمة لتجنب تلوث إما من التحاليل أو المختبر. يجب أن تكون جميع وسائل الإعلام بالتعقيم قبل الاستخدام ، ويجب أن تبقى الأجهزة البلاستيكية والمعدات مثل الماصة معقمة. من المستحسن أن يتم العمل في غطاء الاحتواء الحيوي (النوع 2).
- المخزونات الغليسيرول الشرائط من السلالات البكتيرية المناسبة لسقالة المضادات الحيوية على الليسوجيني مرق أغار (LB, أعدت وفقا لتعليمات الشركة المصنعة), وتنمو بين عشية وضحاها في 37 درجة مئوية.
ملاحظة: يجب اختيار البكتيريا لاختبار النشاط المضاد للبكتيريا على أساس سقالة المضادات الحيوية المستخدمة. وينبغي اختيار مجموعة تمثيلية من 5-10 البكتيريا من الأنواع التي من المعروف أن تكون عرضة للمضادات الحيوية، مع إيلاء الاعتبار للقدرات اللوجستية للمختبر. إذا كان ذلك ممكنا، وينبغي أيضا اختبار البكتيريا المقاومة. البروتوكول الوارد أدناه سوف تعمل على معظم البكتيريا، ولكن تحقق إذا كانت هناك حاجة إلى ظروف خاصة (على سبيل المثال، CO2،وسائل الإعلام الخاصة) وإجراء تعديلات حسب الضرورة. البكتيريا بنجاح assayed باستخدام هذه الشروط تشمل Staphylococci، Streptococci، Bacilli، E. القولونية، Klebsiella الالتهاب الرئوي، Pseudomonas aeruginosa، وEnterococcus فايكيوم. - اختيار مستعمرة واحدة من لوحة، والثقافة بين عشية وضحاها في 5 مل من الميشن تعديلها مولر-هينتون المرق (CAMHB، أعدت وفقا لتعليمات الشركة المصنعة) في 37 درجة مئوية.
- تمييع الثقافات بين عشية وضحاها ~ 40 أضعاف في CAMHB وتنمو إلى مرحلة منتصف السجل، والكثافة البصرية في 600 نانومتر (OD600)= 0.4-0.8، حجم 5 مل).
- إعداد حلول المخزون من كل مضاد حيوي الفلورسنت في 1.28 ملغ / مل في الماء المعقم، وماصة 10 ميكرولتر من المضادات الحيوية إلى العمود الأول من لوحة بئر 96.
- أضف 90 ميكرولتر من CAMHB إلى العمود الأول و50 ميكرولتر إلى جميع الآبار الأخرى. ثم، قم بإجراء تخفيف تسلسلي مرتين عبر اللوحة.
- مزيج تماما، ثم تمييع الثقافات مرحلة منتصف سجل إلى ~ 106 وحدات تشكيل مستعمرة (CFU)/mL وإضافة 50 ميكرولتر إلى جميع الآبار، لتوفير تركيز نهائي من ~ 5 × 105 CFU/mL.
حجم الثقافة (مل) = (حجم الوسائط في mL)/(OD600 × 1000)
على سبيل المثال، بالنسبة لـ OD600 = 0.5 ثقافة في حجم وسائط مرغوب فيه يبلغ 12 مل، أضف (12/(0.5 × 1000) = 0.024 مل من الثقافة إلى 12 مل من الوسائط - غطي الصحون بالأغطية واحتضناها عند درجة حرارة 37 درجة مئوية لمدة 18-24 ساعة دون اهتزاز.
- تفقد بصريا لوحات، مع هيئة التصنيع العسكري يجري أدنى تركيز جيدا مع عدم وجود نمو مرئية.
ملاحظة: انظر الجدول 1 للاطلاع على بعض الأمثلة على المضادات الحيوية الفلورية النشطة وغير النشطة.
4. تحليل تراكم التحقيق عن طريق القياس الطيفي والتدفق الخلوي
ملاحظة: تم تحسين هذه الأوقات centrifugation لالقولونية E.، لذلك قد تكون هناك حاجة إلى تعديلات طفيفة لأنواع أخرى. تم الإبلاغ عن بيانات تمثيلية لتراكم المسبار لمسبرة السيبروفلوكساسين المسمى NBD.
- المخزونات الغليسيرول المتتالية من السلالات البكتيرية على أجار LB وتنمو بين عشية وضحاها في 37 درجة مئوية.
- اختيار مستعمرة واحدة من لوحة والثقافة بين عشية وضحاها في LB في 37 درجة مئوية.
- تمييع الثقافات بين عشية وضحاها ~ 50 أضعاف في وسائل الإعلام وتنمو إلى مرحلة منتصف السجل (OD600 = 0.4-0.8).
- الطرد المركزي الثقافات في 1470 × ز لمدة 25 دقيقة وdecant وسائل الإعلام.
- إعادة تعليق البكتيريا في 1 مل من الفوسفات العازلة المالحة (PBS)، ثم الطرد المركزي في 1470 × ز لمدة 15 دقيقة.
- Decant وسائل الإعلام وإعادة تعليق الكريات غسلها في برنامج تلفزيوني إلى ODالنهائي 600 = 2.
- إذا رغبت في ذلك، أضف 10.1 ميكرولتر من سيانيد الكربونيل 3-chlorophenylhydrazone (CCCP، 10 mM في PBS) إلى 1 مل من البكتيريا (التركيز النهائي 100 ميكرومتر) واحتضان عند 37 درجة مئوية لمدة 10 دقيقة.
ملاحظة: CCCP هو مثبط مضخة efflux. إضافة CCCP سوف تسمح بفحص تأثير efflux. - الطرد المركزي الثقافات في 18،000 ز لمدة 4 دقيقة في 20 درجة مئوية وdecant وسائل الإعلام.
- أضف 1 مل من محلول المضادات الحيوية الفلورية (10-100 ميكرومتر في PBS) إلى البيليه، واحتضانه عند 37 درجة مئوية لمدة 30 دقيقة.
- الطرد المركزي الثقافات في 18،000 ز لمدة 7 دقيقة في 4 درجة مئوية وdecant وسائل الإعلام.
- إعادة تعليق البكتيريا في 1 مل من برنامج تلفزيوني بارد، وكرر الخطوة 4.9.
- كرر الخطوة 4.10 ما مجموعه 4x.
- إذا رغبت في ذلك، بكتيريا الليسيه عن طريق إضافة 180 ميكرولتر من العازلة الليسيس (20 mM تريس-HCl، ودرجة الحموضة 8.0، و 2 MM الصوديوم EDTA) ثم 70 ميكرولتر من الليسوزيم (72 ملغ/مل في H2O).
- تحضن عند 37 درجة مئوية لمدة 30 دقيقة، ثم تجمد ذوبان 3x (−78 درجة مئوية لمدة 5 سنوات، ثم 34 درجة مئوية لمدة 15 دقيقة).
- سونيكات العينات لمدة 20 دقيقة، ثم الحرارة إلى 65 درجة مئوية لمدة 30 دقيقة.
- الطرد المركزي العينات المنسّحة (18,000 x g,8 دقيقة)، ثم تصفية من خلال غشاء مرشح 10 كيلو دا.
- غسل مرشح 4x مع 100 ميكرولتر من الماء.
- نقل الليزات إلى لوحة بئر 96 سوداء مسطحة القاع وقياس شدة الفلورسينس على قارئ لوحة مع الإثارة والأطوال الموجية للانبعاثات المناسبة للفلوروفور (أي DMACA: οex = 400 نانومتر،em = 490 نانومتر؛ NBD:ο ex = 475 نانومتر،em = 545 نانومتر).
ملاحظة: انظر الشكل 3 للحصول على أمثلة من التحليلات الطيفية للبكتيريا باستخدام المضادات الحيوية السيبروفلوكساسين NBD المسمى الفلورسنت. - للتحليل عن طريق قياس التدفق الخلوي ، يمكن استخدام نفس ظروف النمو وتلطيخ (الخطوات 4.1-4.17) ، مع تغييرات فقط في الإعداد النهائي.
- رفع الحجم الإجمالي إلى 1 مل من برنامج تلفزيوني.
- قراءة العينات على مقياس تدفق الخلايا بمعدل تدفق حوالي 60 ميكرولتر/دقيقة، باستخدام التضخيم اللوغاريتمي للحصول على البيانات (الإثارة F1 = 488 نانومتر؛ الانبعاثات = 525/20 نانومتر).
- سجل ما مجموعه 10000 حدث ، ثم قم بتحليل البيانات باستخدام البرامج المناسبة.
- رسم كثافة الفلورية من F1 ضد عدد من الأحداث التهم، وتقدير متوسط كثافة الفلورسمنس من قمم الرسم البياني بعد أن كانت ملطخة البكتيريا.
ملاحظة: انظر الشكل 4 للحصول على أمثلة من تحليلات قياس الخلايا تدفق البكتيريا باستخدام المضادات الحيوية السيبروفلوكساسين المسمى NBD.
5. التحضير للتحليل المجهري
- تنمو الثقافات الفرعية إلى OD600 = 0.4، كما هو الحال بالنسبة لتقييم هيئة التصنيع العسكري، ثم تقسيمها إلى 1 مل aliquots والطرد المركزي في 18،000 × ز لمدة 3-5 دقيقة.
- Decant ومرمى وسائل الإعلام، ثم إعادة تعليق بيليه البكتيرية في 500 ميكرولتر من HBSS.
- جهاز طرد مركزي عند 18,000 × ز لمدة 3 دقيقة، ثم إزالة التخلص من الوسائط وتجاهلها.
- إعداد حلول مسابير المضادات الحيوية في HBSS بتركيزات 1-100 ميكرومتر.
- إعادة تعليق البكتيريا المغسولة في 500 ميكرولتر من محلول المسبار ، واحتضانها عند 37 درجة مئوية لمدة 30 دقيقة.
- كرر الخطوة 5.3. لتجربة وضع العلامات متعددة، إعادة تعليق بيليه في 500 ميكرولتر من صبغة الحمض النووي الملونة تقويم العظام. بالنسبة للأخضر، استخدم Syto9 (5 ميكرومتر في HBSS)؛ للأزرق، استخدم Hoechst 33342 (20 ميكروغرام/مل في HBSS). احتضان في RT لمدة 15-30 دقيقة.
- كرر الخطوة 5.3، ثم إعادة تعليق في 500 ميكرولتر من FM4-64FX (5 ميكروغرام/مل في HBSS) واحتضان في RT لمدة 5 دقيقة.
- كرر الخطوة 5.3، ثم أعد تعليقه في 500 ميكرولتر من HBSS، وكرر الخطوة 5.3 مرة أخرى.
- كرر الخطوة 5.8 ، ثم تعليق البكتيريا المغسولة والمغوّلة أخيرًا في 15 ميكرولتر من وسط التركيب (انظر جدول المواد).
- ماسيت تصاعد المتوسطة على شريحة المجهر وأعلى مع زلة غطاء عالية الأداء، ثم ختم حواف مع طلاء الأظافر واضحة.
ملاحظة: انظر الشكل 5 للحصول على أمثلة من الصور المجهرية المُتَّخذة باستخدام المضادات الحيوية السيبروفلوكساسين وتريميثوبريم المسمى NBD، والشكل 6 للمضادات الحيوية المسماة بـ DMACA oxazolidinone (linezolid).
النتائج
الشكل 1 يوضح رد فعل الكيمياء انقر الرئيسية(A)لإعداد المضادات الحيوية الفلورية، ومع(B)أمثلة من هياكل المضادات الحيوية الفلورية المنشورة لدينا على أساس سيبروفلوكساسين (سيبرو)، تريميثوبريم (TMP)، وlinezolid. تم تصنيع جميع هذه المسابير من المضادات الحيوية المقابلة عن طريق وسيط الأزيد. ثم تم اقترانها بـ NBD و DMACA fluorophores ، كل منها يعمل بألكين.
ويبين الشكل 2 على سبيل المثال آثار LCMS من تفاعل نقرة ciprofloxacin-N3 و NBD-alkyne ، حيث يوصف الأزيد عند 3.2 دقيقة والمنتج في 3.8 دقيقة. الأطياف 3 إظهار تأثير التنقية، مع قمم خاطئة تختفي من آثار MS والأشعة فوق البنفسجية. يمكن قياس كل من النقاء وتقدم رد الفعل من خلال دمج ذروة المنتج وأي قمم الشوائب.
يوضح الشكل 3 النتائج النموذجية من تقييم التراكم داخل الخلايا عن طريق التحليل الطيفي الفلوري في وجود وعدم وجود efflux. في هذه التجربة، تم التعامل مع الإشريكية القولونية مع TMP-NBD مع أو بدون إضافة CCCP، الذي ينهار قوة دافع البروتون (PMF). كان الفلورية داخل الخلايا للبكتيريا أعلى بكثير عند المعالجة المسبقة مع CCCP ، مما يشير إلى أن الـ efflux قلل من التراكم في هذه البكتيريا. وتكررت هذه التجربة باستخدام البكتيريا التي تعاني من نقص في التولك، وعرض قدرة هذا الفحص لفحص تأثير مكونات مضخة efflux الفردية. في هذه الحالة ، على الرغم من وجود زيادة في الفلورسين داخل الخلايا مقارنة بالبكتيريا البرية ، لا يزال تراكم CCCP يزداد. هذه النتائج تشير إلى أن tolC يشارك inTMP efflux ولكن ليس الوحيد PMF محرك مضخة المعنية.
يوضح الشكل 4 نتيجة نفس التجربة كالشكل 2، ولكن مع التراكم الذي يقاس بقياس التدفق الخلوي بدلاً من التحليل الطيفي. ولوحظت نفس اتجاهات البيانات، مما يدل على أنه يمكن استخدام أي من التقنيين لدراسة ظاهرة التراكم بوساطة التسيفات داخل الخلايا.
الشكل 5 يظهر صور المجهر confocal التمثيلية من الغرام إيجابية(S. aureus)والبكتيريا السلبية الغرام(E. coli)المسمى مع TMP-NBD(1)وcipro-NBD(2 + 3)تحقيقات الفلورسنت، على التوالي. في كلتا الحالتين، تمت إضافة صبغة الغشاء الأحمر FM4-64FX من أجل مقارنة المشاركة في التعريب. بالنسبة لـ TMP-NBD ، تم استخدام صبغة الحمض النووي الأزرق Hoechst-33342 أيضًا. من خلال تراكب هذه الصور ، تم تصور توطين المضادات الحيوية في البكتيريا. المقارنة بين لوحات 2 و 3 يبين كيف تم فحص تأثير efflux، مع مثبط efflux CCCP المستخدمة في 2،مما أدى إلى تراكم داخل الخلايا. في اللوحة 3، لم يتم إضافة CCCP. وبالتالي ، efflux نشطة ولم ينظر إلى تراكم التحقيق.
الشكل 6 يظهر صور المجهر confocal التمثيلية من غرام إيجابية(S. aureus)البكتيريا المسمى مع DMACA المسمى أوكسازوليدينون التحقيق Lz-NBD. تمت إضافة صبغة الغشاء الأحمر FM4-64FX من أجل مقارنة المشاركة في التعريب ، كما تم استخدام صبغة الحمض النووي الأخضر Hoechst-33342. من خلال تراكب هذه الصور ، تم تصور توطين المضادات الحيوية في البكتيريا ، مما يظهر التعريب الداخلي المتميز عن الغشاء والحمض النووي.
ويبين الجدول 1 قيم هيئة التصنيع العسكري لثلاث سلاسل من المضادات الحيوية الفلورية، السيبروفلوكساسين، وتريميثوبريم (TMP)، وكلانزوليد (Lz)، مع بيانات قدمت للمضادات الحيوية الأم، NBD ومشتقات DMACA لكل منها. تم اختيار الأنواع التمثيلية لكل مضاد حيوي، بما في ذلك كل من الجرام الإيجابي والجرام السلبي. بالنسبة لسلسلة السيبروفلوكساسين ، فقد كلا المسبارين الفلوريين نشاط المضادات الحيوية مقارنة بالدواء الأم ، لكنهما احتفظا ببعض النشاط ضد جميع الأنواع. وبالمثل، فقدت تحقيقات خط الزوليد بعض النشاط، ولكنها ظلت مضادًا حيويًا متوسطًا إلى ضعيفًا. فقدت تحقيقات TMP تقريبا كل نشاط ضد البكتيريا نوع البرية، ولكن كانت نشطة ضد نقص efflux E. القولونية،مما يشير إلى أن فقدان النشاط المضاد للبكتيريا كان بسبب عدم وجود تراكم.

الشكل 1: تركيب وبنية المسابير المشتقة من المضادات الحيوية. (أ)مخطط رد الفعل العام لتركيب مسابير المضادات الحيوية الفلورية من المضادات الحيوية الأزيدة والألكين-فلوروفوريات. (ب)هياكل تحقيقاتنا المنشورة على أساس سيبروفلوكساسين، تريميثوبريم، وlinezolid. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
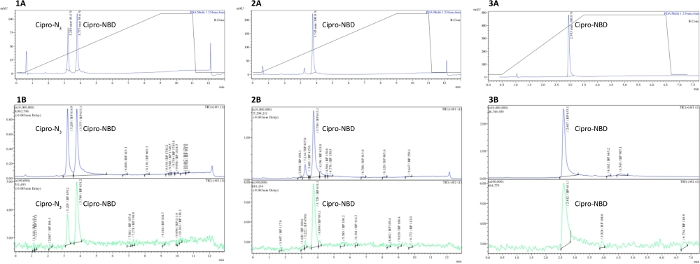
الشكل 2: قياس نقاء المسبار المشتق من المضادات الحيوية من قبل LCMS. آثار LCMS التحليلية من (1) غير مكتملة ، (2) كاملة ، و (3) HPLC تنقية ciprofloxacin - N3 + NBD - alkyne ردود الفعل انقر مما يدل على اختفاء المواد بدءا من الانتهاء من التفاعل ، وقمم متنوعة على تنقية. A = تتبع الأشعة فوق البنفسجية فيس (امتصاص في 250 نانومتر)، B = تتبع MS (الوضع الإيجابي والسلبي). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: قياس قارئ الصفائح لتراكم المسبار المشتق من المضادات الحيوية. قياس الطيف الفلوري للتراكم الخلوي لـ TMP-NBD (50 ميكرومتر) في النوع البري (1، ATCC 25922)وtolC (2، ATCC 25922) E. القولونية المحتضنة(A)مع و(B)دون إضافة CCCP (100 ميكرومتر). تظهر الأهمية الإحصائية (**p ≤ 0.01؛ ***p ≤ 0.001) بين غياب أو وجود CCCP وبين النوع البريوtolCE. coli. البيانات المبلغ عنها هي متوسط ± SD لثلاث تجارب. يتم تكييف هذا الرقم من منشورنا السابق15، ويوضح استخدام التحليل الطيفي لتوضيح دور efflux على التراكم داخل الخلايا. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
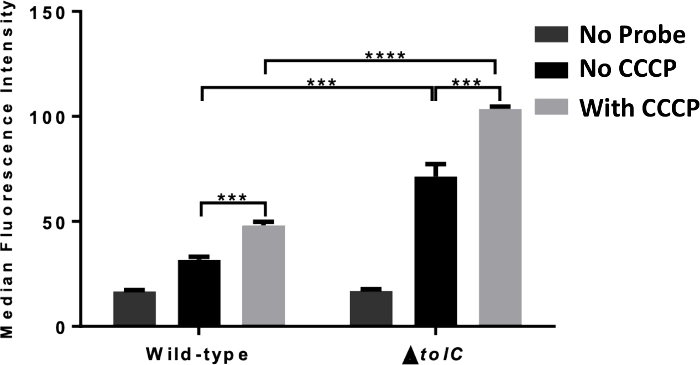
الشكل 4: قياس التدفق الخلوي لتراكم المسبار المشتق من المضادات الحيوية. قياس قياس الخلايا تدفق تراكم الخلوية باستخدام TMP-NBD في في النوع البري (1، ATCC 25922)وtolC (2، ATCC 25922) E. القولونية المحتضنة مع وبدون إضافة CCCP (100 ميكرومتر). يظهر متوسط نشاط الفلورسينس من 10000 حادث بكتيري ، الأهمية الإحصائية (***، p ≤ 0.001 ؛ ****، p ≤ 0.0001) بين غياب ووجود CCCP وبين النوع البريوTolCE. coli. البيانات المبلغ عنها هي متوسط ± SD لثلاث تجارب. يتم تكييف هذا الرقم من منشورنا السابق15، ويوضح استخدام قياس التدفق الخلوي لتوضيح دور efflux على التراكم داخل الخلايا. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: التصور المجهري التكوّر لتوطين مسبار NBD. صور المجهر كونالبؤر من 1) يعيش S. aureus المسمى مع Hoechst-33342 (الأزرق، الحمض النووي)، TMP-NBD (الأخضر)، FM4-64FX (أحمر، غشاء)، وتراكب؛ 2) يعيش E. القولونية تعامل مع CCCP (مثبط efflux) وصفت مع cipro-NBD (الأخضر)، FM4-64FX (الأحمر، غشاء)، وتراكب؛ 3) يعيش E. القولونية المسمى مع cipro-NBD (الأخضر)، FM4-64FX (الأحمر، غشاء)، وتراكب. هذا الرقم مقتبس من منشوراتنا السابقة15،16، ويوضح استخدام المجهر لفحص توطين المسبار ، بما في ذلك تأثير efflux. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: التصور المجهري التكوّر لتوطين مسبار DMACA. صور المجهر كونتشاالبؤر من العيش S. aureus المسمى مع أوكسازوليدين التحقيق Lz-DMACA (الأزرق), Sytox الأخضر (الأخضر, الحمض النووي), وFM4-64FX (غشاء أحمر, غشاء). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
| هيئة التصنيع العسكري (ميكروغرام/مل) | |||||||||||
| الانواع | سلاله | سيبرو | سيبرو-NBD | سيبرو دماكا | Tmp | TMP-NBD | TMP-DMACA | لاينزوليد (Lz) | LZ-NBD | Lz-DMACA | |
| المكورات العنقودية الأوريوس | ATCC 25923 | 0.125 - 0.5 | 32 - ≥ 64 | 16 | 1 | 16 | > 64 | ||||
| ATCC 43300 | 1 | 16 | > 64 | ||||||||
| التهاب رئوي العقدي | ATCC 700677 | 1 | 4 | 64 | |||||||
| المكورات المعوية فيكيوم | ATCC 35667 | 1 - 8 | 32 | 32 - ≥ 64 | |||||||
| ATCC 51559 | 2 | 16 | 32 | ||||||||
| كليبسيلا الالتهاب الرئوي | ATCC 13883 | 0.015 - 0.06 | 8 - 16 | 8 - 32 | |||||||
| Pseudomonas aeruginosa | ATCC 27853 | 0.25 - 1 | 32 - ≥ 64 | 32 - ≥ 64 | |||||||
| إيتشيريشيا كولاي | ATCC 25922 | ≤ 0.004 | 8 | 2 | 0.5 | > 64 | > 64 | ||||
| متحولة ΟtolC | 0.125 | 0.25 | 2 | ||||||||
الجدول 1 - ما إذا كانت هناك أنشطة المضادات الحيوية من تحقيقات المضادات الحيوية الفلورية على أساس سيبروفلوكساسين، تريميثوبريم، وlinezolid ضد السلالات البكتيرية المناسبة ذات الصلة سريريا، كما تقاس بالتحليل MIC MICRODILUTION مرق. في معظم الحالات ، فقدت المسابير بعض النشاط مقارنة بالدواء الأم ، ولكنها احتفظت ببعض فاعلية المضادات الحيوية القابلة للقياس (كافية لتكون مفيدة في دراسات أخرى).
Discussion
يجب أن يبدأ إنشاء مسبار مضاد حيوي فلوري ناجح بتخطيط ودراسة دقيقين للعقار الأم. وإذا لم يكن البحث عن الـ SAR معروفاً أو مستكشفاً بالكامل، فقد يلزم اختبار عدة خيارات للعثور على موقع يمكن تعديله بشكل انتقائي دون إلغاء النشاط البيولوجي. وبمجرد تحديد موقع/مواقع، يكون تركيب رابط الوات ضروري في كثير من الأحيان من أجل توفير المباعدة بين الموقع البيولوجي للعمل والفلوروفور غير النشط. يجب توخي الحذر من أن التفاعل المستخدم لإرفاق الرابط إلى المضادات الحيوية يترك مجموعة وظيفية مستقرة بيولوجيا، وتجنب، على سبيل المثال، استرات التي هي عرضة للانشقاق من قبل esterases في الجسم الحي. اعتمادا على التشكيل الجانبي الدوائية والدوائية للمضاد الحيوي، يمكن استخدام رابط الألكيل بسيطة، أو آخر ينبغي النظر في خيار أقل lipophilic مثل البولي ايثيلين جليكول (PEG) رابط. مع الرابط المرفقة ، يجب تقييم النشاط المضاد للبكتيريا لضمان أن تكون البلدان المتوسطة الدخل ضد البكتيريا ذات الصلة مشابهة للمركب الأم.
في هذا العمل، نوصي باستخدام Huigsen azide-alkyne [3+2] ديبولابالإضافة (انقر فوق الكيمياء، انظر الشكل 1)لligate الفلوروفور إلى المضادات الحيوية، لعدد من الأسباب. ردود الفعل انقر انتقائية للغاية، وهذا يعني أن حماية المجموعات التفاعلية على المضادات الحيوية ليست ضرورية، وعلاوة على ذلك، فإن رد الفعل يترك مستقرة، بيوية moiety triazole. يتم إدخال عنصر الأزيد إلى جزء المضادات الحيوية في إجراءاتنا ، حيث يتم إنجاز هذا بشكل عام بسهولة أكبر مع مجموعة متنوعة من الأنواع الهيكلية من إدخال ألكين. يتم وصف توليفات اثنين من الفلوروفوروفوريات المشتقة من الألكين هنا ، على الرغم من أنه يمكن استكشاف البعض الآخر إذا رغبت في ذلك. تم اختيار NBD و DMACA بسبب صغر حجمها ، مما يقلل من إمكانية التدخل في اختراق الخلايا والتفاعل المستهدف. يتم تنفيذ رد فعل النقر نفسه باستخدام الحفز النحاسي ، حيث يمكن استخدام Cu2 + (CuSO4، مع عامل تقليل حمض الأسكوربيك) أو Cu+ (CuI) ككاشف بدء. بعد تنقية(الشكل 2)، وينبغي بعد ذلك اختبار MICs كما هو الحال مع الأزيد. حتى مع النظر بعناية في اختيار الفلوروفور وموقع التعلق ، فمن الممكن ملاحظة نشاط المضادات الحيوية الضعيف. هذا لا يعني، مع ذلك، أن التحقيق غير نشط هو دون استخدام. كما هو موضح مع تحقيقات TMP ، قد لا تزال ترتبط المركبات ذات النشاط المضاد للبكتيريا الضعيفة بنفس هدف الدواء الأم. وهذا يمكن أن يتيح إجراء دراسات عن طريقة العمل وفحص الظواهر المؤدية إلى المقاومة، مثل efflux.
كما هو موضح في قسم البروتوكولات ، من الممكن تحليل الوسم البكتيري بواسطة المضادات الحيوية الفلورية باستخدام إما اختبار قياس الطيف البسيط(الشكل 3)أو قياس التدفق الخلوي(الشكل 4). كلا الطريقتين قادرة على قياس التراكم الخلوي ، وعن طريق إزالة الخلايا وفحص توطين الفلورسينس في اللايسات ، من الممكن تقييم التراكم داخل الخلايا. في هذا البروتوكول ، يتم وصف استخدام الليسوزيم لخلايا الخلايا ، لأن هذا هو سريع ، تقنية عالمية. كما تم استخدام حالات الانلاح الأخرى، مثل العلاج الليلي بالجليسين-HCl7،بنجاح. باستخدام هذه التقنية ، من الممكن دراسة تأثير efflux على تراكم المضادات الحيوية الخلوية ، وهي آلية رئيسية للمقاومة. إذا efflux هو موجود بالفعل في البكتيريا، وسوف يلاحظ عدم تراكم داخل الخلايا، على الرغم من أن هذا يمكن إنقاذها باستخدام مثبط اتفلوج مثل CCCP.
ويمكن أيضا إجراء المجهر لفحص بصري توطين التحقيق في البكتيريا المختلفة، وجمع المعلومات عن طريقة العمل، وربما أيضا المقاومة (انظر الشكل 5 للحصول على أمثلة تمثيلية). من أجل رؤية التعريب داخل البكتيريا ، مطلوب مجهر بؤري عالي الدقة ، مجهز بقدرات مثل SIM (المجهر الإضاءة المنظم) ، SR-SIM (Superresolution-SIM) ، Airyscan ، أو STED (استنفاد الانبعاثات المحفزة). وعلاوة على ذلك، ينبغي استخدام قسائم التغطية عالية الأداء، وإجراء تحليل ما بعد التصوير على برنامج مناسب (مثل فيجي، أو زن، أو إيماريس). تتم مقارنة توطين المسابير بالأصباغ التي تلطخ معماريات محددة ، مثل Hoechst-33342 (الأزرق ، الحمض النووي) ، Syto-9 (الأخضر ، الحمض النووي) ، وFM4-64FX (أحمر ، غشاء). وينبغي أن يتم اختيار الأصباغ لتتناسب مع المضادات الحيوية الفلورية، بحيث كل لون المستخدمة لديها الحد الأدنى من التداخل الطيفي. من أجل الحصول على أفضل الصور الممكنة ، قد تكون هناك حاجة إلى التحسين. على سبيل المثال، إذا كانت البكتيريا مزدحمة جدا على الشريحة، واتخاذ جزء فقط من بيليه علقت، ثم تمييع مع أكثر تصاعد المتوسطة. في المقابل، إذا كانت البكتيريا متناثرة جدا على الشريحة، ببساطة تبدأ مع المزيد من البكتيريا. في هذا البروتوكول ، يوصى باستخدام هلام حراري قابل للعكس متوافق مع الخلايا الحية (على سبيل المثال ، Cygel) لتصوير الخلايا الحية ، لأنه يشل البكتيريا (بما في ذلك البكتيريا المتحركة) ، ولكن تم استخدام الوسائط المتزايدة الأخرى أو الآغا روز بنجاح.
وعموماً، وعلى الرغم من التحديات التي قد تواجه في إعداد مشتقات المضادات الحيوية الفلورية النشطة بيولوجياً، فإن بساطة استخدامها وتعدد استخداماتها يجعلان هذه المسابير أدوات جذابة للبحث في المضادات الحيوية المضادة للميكروبات. العمل المستقبلي باستخدام المضادات الحيوية الفلورية لديه القدرة على توفير نظرة ثاقبة لآليات مقاومة المضادات الحيوية، وتحسين فهمنا لكيفية عمل المضادات الحيوية الحالية، والمساعدة في تطوير أدوية أفضل.
Disclosures
وليس لدى صاحبي البلاغ ما يعلنانه.
Acknowledgements
يتم دعم MRLS من قبل جائزة الدراسات العليا الأسترالية (APA) وجائزة معهد العلوم الحيوية الجزيئية للنهوض بالبحوث. تم دعم Wanida Phetsang من قبل جامعة كوينزلاند الدولية للمنح الدراسية (UQI) وجائزة IMB للدراسات العليا (IMBPA). لجنة الهدنة العسكرية هو زميل البحوث NHMRC المبدأ (APP1059354) ويحمل أيضا تعيين زميل أستاذي كسور في جامعة كوينزلاند، مع الوقت المتبقي له كرئيس تنفيذي لشركة Inflazome المحدودة، وهي شركة تطوير الأدوية لتلبية الاحتياجات السريرية غير الملباة في الأمراض الالتهابية. يتم دعم MATB جزئيًا من قبل منحة ويلكوم ترست الاستراتيجية WT1104797/Z/14/Z ومنحة تطوير NHMRC APP1113719. تم إجراء الفحص المجهري في المؤسسة الأسترالية لأبحاث السرطان (ACRF) / معهد العلوم الجزيئية البيولوجية مرفق تصوير بيولوجيا السرطان، الذي أنشئ بدعم من ACRF.
Materials
| Name | Company | Catalog Number | Comments |
| 3-(dimethylamino)phenol | Alfa-Aesar | B23067 | |
| 4-chloro-7-nitro-benzofuran | Sigma-Aldrich | 163260-5G | |
| Amicon Ultra-0.5 centrifugal filter unit with Ultracel- 10 membrane | Merck | UFC501096 | |
| Atlantis Prep T3 OBD (100 A, 5 uM, 10x250 mm) | Waters | 186008205 | |
| Atlantis T3 column (100 A, 5 uM, 2.1 × 50 mm) | Waters | 186003734 | |
| Bruker Avance 600 MHz spectrometer | Bruker | ||
| Buchi Reveleris C18 12g Cartridge | Buchi | BUC145152103 | |
| CCCP | Sigma-Aldrich | C2759 | |
| Celite 545 | Sigma-Aldrich | 22140-5KG-F | |
| Cygel | ABCAM | Ab109204 | |
| Elyra PS,1 SIM/STORM confocal microscope | Zeiss | ||
| FM4-64FX, fixable analog of FM™ 4-64 membrane stain | Life Technologies Australia Pt | F34653 | |
| Gallios flow cytometer | Beckman Coulter | ||
| Gamma 2-16 LSCplus lyophilise | CHRIST | ||
| Gilson HPLC 2020 | Gilson | ||
| Hanks' Balanced Salt solution, Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | H6648-500ML | |
| Hettich Zentrifugen Rotofix 32 | Hettich | ||
| High performance #1.5 cover slips (18 x 18 mm) | Schott/Zeiss | 474030-9000-000 | |
| Hoechst 33342, Trihydrochloride, Trihydrate - Fluo | Life Technologies Australia Pt | H21492 | |
| LB | AMRESCO | J106 | |
| Leica STED 3X Super Resolution Microscope with White Light Laser excitation | Leica | ||
| Lysozyme from chicken egg white lyophilized powder | Sigma-Aldrich | L6876 | |
| Mueller Hinton II Broth Cation adjusted | Becton Dickinson | 212322 | |
| Propargylamine | Sigma-Aldrich | P50900-5G | |
| Reveleris GRACE MPLC | Buchi | ||
| Shimadzu LCMS-2020 | Shimadzu | ||
| Sigma 1-15 Microcentrifuge | Sigma-Aldrich | ||
| Silica gel 60 (0.040-0.063 mm) for column chromatography (230-400 mesh ASTM) | Merck | 1093859025 | |
| SYTO 9 Green Fluorescent Nucleic Acid Stain | Life Technologies Australia Pt | S34854 | |
| TECAN Infinite M1000 PRO | TECAN |
References
- Cai, H., Rose, K., Liang, L. H., Dunham, S., Stover, C. Development of a liquid chromatography/mass spectrometry-based drug accumulation assay in Pseudomonas aeruginosa. Analytical Biochemistry. 385 (2), 321-325 (2009).
- Bhat, J., Narayan, A., Venkatraman, J., Chatterji, M. LC-MS based assay to measure intracellular compound levels in Mycobacterium smegmatis: Linking compound levels to cellular potency. Journal of Microbiological Methods. 94 (2), 152-158 (2013).
- Davis, T. D., Gerry, C. J., Tan, D. S. General Platform for Systematic Quantitative Evaluation of Small-Molecule Permeability in Bacteria. ACS Chemical Biology. 9 (11), 2535-2544 (2014).
- Richter, M. F., et al. Predictive compound accumulation rules yield a broad-spectrum antibiotic. Nature. 545, 299 (2017).
- Iyer, R., et al. Evaluating LC-MS/MS To Measure Accumulation of Compounds within Bacteria. ACS Infectious Diseases. 4 (9), 1336-1345 (2018).
- Prochnow, H., et al. Subcellular Quantification of Uptake in Gram-Negative Bacteria. Analytical Chemistry. 91 (3), 1863-1872 (2019).
- Dumont, E., et al. Antibiotics and efflux: combined spectrofluorimetry and mass spectrometry to evaluate the involvement of concentration and efflux activity in antibiotic intracellular accumulation. Journal of Antimicrobial Chemotherapy. 74 (1), 58-65 (2019).
- Stone, M. R. L., Butler, M. S., Phetsang, W., Cooper, M. A., Blaskovich, M. A. T. Fluorescent Antibiotics: New Research Tools to Fight Antibiotic Resistance. Trends in Biotechnology. 36 (5), 523-536 (2018).
- Piddock, L. J. V., Johnson, M. M. Accumulation of 10 fluoroquinolones by wild-type or efflux mutant Streptococcus pneumoniae. Antimicrobial Agents and Chemotherapy. 46 (3), 813-820 (2002).
- Mortimer, P. G. S., Piddock, L. J. V. A comparison of methods used for measuring the accumulation of quinolones by enterobacteriaceae, pseudomonas aeruginosa and staphylococcus aureus. Journal of Antimicrobial Chemotherapy. 28 (5), 639-653 (1991).
- Li, X. Z., Nikaido, H., Poole, K. Role of MexA-MexB-OprM in antibiotic efflux in Pseudomonas aeruginosa. Antimicrobial Agents and Chemotherapy. 39 (9), 1948-1953 (1995).
- Vince, R., Weiss, D., Pestka, S. Binding of N-substituted erythromycylamines to ribosomes. Antimicrobial Agents and Chemotherapy. 9 (1), 131-136 (1976).
- Vazquez, D. Antibiotics affecting chloramphenicol uptake by bacteria Their effect on amino acid incorporation in a cell-free system. Biochimica et Biophysica Acta (BBA) - Nucleic Acids and Protein Synthesis. 114 (2), 289-295 (1966).
- Phetsang, W., et al. An azido-oxazolidinone antibiotic for live bacterial cell imaging and generation of antibiotic variants. Bioorganic and Medicinal Chemistry. 22 (16), 4490-4498 (2014).
- Phetsang, W., et al. Fluorescent trimethoprim conjugate probes to assess drug accumulation in wild type and mutant Escherichia coli. ACS Infectious Diseases. 2 (10), 688-701 (2016).
- Stone, M. R. L., et al. Fluoroquinolone-derived fluorescent probes for studies of bacterial penetration and efflux. MedChemComm. 10 (6), 901-906 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved