Method Article
使用荧光抗生素探针对细菌耐药性的可视化
摘要
荧光标记的抗生素是强大的工具,可用于研究抗菌素耐药性的多个方面。本文介绍了荧光标记抗生素的制备及其在细菌中抗生素耐药性研究中的应用。探针可用于通过分光光度测定法、流式细胞测定和显微镜研究细菌抗性机制(例如,排泄物)。
摘要
荧光抗生素是一种多用途的研究工具,由于其比其他方法具有显著优势,因此很容易用于抗菌素耐药性的研究。为了制备这些探针,合成抗生素的阿齐德衍生物,然后通过点击化学与烷基-烷基-氟荧光素结合使用阿奇德-烷基二极环状添加物。纯化后,荧光抗生素的抗生素活性通过最低抑制浓度评估进行检测。为了研究细菌积累,可以使用分光光度或流式细胞测定法,以便比依赖放射性抗生素衍生物的方法进行更简单的分析。此外,共聚焦显微镜可用于检查细菌内的定位,提供有关抗性物种的行动模式和变化的宝贵信息。在抗菌素耐药性研究中使用荧光抗生素探针是一种强有力的方法,具有巨大的应用潜力。
引言
抗微生物药物耐药性(AMR)是一个日益严重的危机,对全世界人类健康构成重大威胁。据报告,大多数抗生素具有耐药性,所有临床上可用的药物的耐药细菌引起的感染正在出现。为了对抗AMR的兴起,我们需要增进对这一多方面现象以及抗生素和细菌之间基本机制和相互作用的理解。历史上一直鲜为人知的一个方面是抗生素渗透到细菌中,以及积累和排泄的现象。这些知识对于设计新药和理解抗药性机制至关重要。因此,这在AMR研究中起着至关重要的作用。
为了测量抗生素浓度,可以采取两种主要方法:直接测量药物或使用旨在促进定量的莫氏标记。虽然标记抗生素可以改善检测,但这可能干扰药物的生物活性,如抗菌活性和渗透性。对于未标记的方法,这不是问题;因此,对于未标记的方法,则为 细菌1、2、3、4、5、6、7细菌中的抗生素浓度的研究热潮。这些研究表明,可以研究各种细菌的细胞内积累,其中对革兰氏阴性细菌的研究最为广泛。分子渗透性的定量然后与活性相关联,并用于通知药物开发2,3,4,但必须谨慎,当直接结合积累和目标活动5。在MS开发之前,唯一可以直接测量浓度的抗生素是那些具有内在荧光的抗生素,如四环素和奎诺酮8、9、10、11。虽然在范围上明显有限,但检查和量化了积累和排泄物,说明基于荧光的定量的有用性。
几十年来,标记抗生素一直用于研究分布、作用模式和耐药性,放射性和荧光标记很常见。无线电标记的探针具有与母化合物几乎相同的优点,因此生物活性不太可能有显著差异。由于这些元素在抗生素中突出,诸如3H、14C和15N等同位素被频繁使用,并且对1、10、12、13的各种抗生素支架进行了检查。 虽然无线电探针的探测很简单,但存在一些后勤问题(例如安全、同位素半寿命),限制了这种方法的使用。另一种策略是荧光标记的抗生素。这些探头可用于检查母药的分布、作用模式和抗药性,使用比MS更简单的技术,并且没有辐射8的物流问题。这种方法的主要缺点是抗生素通常是相对较小的分子,因此引入荧光功能会带来显著的化学变化。这种改变会影响物理化学性质和抗菌活性。因此,必须注意评估这些因素,以便产生代表父抗生素的结果。
在这项工作中,描述了一种合成、评估和使用荧光抗生素的方法,如我们以前出版的第14、15、16号出版物中所述。通过以前的工作,一些荧光抗生素已经制备,并用于各种目的(见斯通等人8)。为了尽量减少影响生物活性的可能性,这项工作中使用了非常小的荧光团:硝基苯二氮二氮(NBD,绿色)和7-(二甲基氨基)-2-oxo-2H-铬-4-yl(DMACA,蓝色)。此外,还描述了使用微溴稀释最小抑制浓度(MIC)测定的抗菌活性评估,从而可以测量修饰对活性的影响。这些荧光标记探头可用于分光光度测定、流式细胞测定和显微镜。荧光抗生素的优势在于可能的应用范围。细胞积累可以量化、分类和可视化,这是单靠MS是不可能的。希望通过使用荧光抗生素获得的知识将有助于我们理解耐药性,并对抗AMR。
研究方案
1. 烷基-荧光酸的合成
- NBD-烷基奈的合成(7-硝基-(prop-2-yn-1-yl)苯过佐[1,2,5]奥二二二醇-4胺)
- 在60毫欧林(THF)中溶解1,031毫克4-氯-7-硝基苯甲酸(5.181毫摩尔)。加入1,857毫克的CsCO 3(5.696毫摩尔),然后0.39 mL的丙丙胺(6.1毫摩尔)。将反应加热至 50°C 2 小时,从棕色变为绿色,然后冷却至室温 (RT)。
- 使用过滤辅助工具过滤反应(参见材料表),并用乙酸乙酯(EA)清洗。在减压下浓缩滤液,然后将残留物溶解在 150 mL 的 EA 中,并移动到 500 mL 分离漏斗。
- 分别用水和盐水用100 mL清洗EA溶液。然后结合水相,用100 mL的EA洗涤2x。
- 在无水硫酸镁上干燥组合的有机相,然后在减压下过滤和浓缩。
- 在硅胶上通过闪光色谱法(石油醚[PE]中20~30%EA)净化原油产品,通过液相色谱质谱法(LCMS,[M+H]= = 219.1)和/或核磁共振(NMR)光谱法检查纯度,化学变化如下:
1H NMR (CD3OD, 600 MHz) = 8.54 (d, J = 8.7 Hz, 1H), 6.35 (d, J = 8.4 Hz, 1H), 4.31 (dd, J = 5.7 Hz, J = 2.5 Hz, 2H), 2.43 (t, J = 2.5 Hz, 1H);13C NMR (CD3OD, 150 MHz) = 144.3, 143.7, 142.2, 135.8, 125.7, 100.0, 76.5, 74.2, 33.4。
注:使用硅胶色谱法进行纯化时,使用所列溶剂的极性较小,准备立柱。如果溶解度不允许,粗化合物可以作为浓缩溶液加载或吸附到二氧化硅上。将化合物添加到二氧化硅顶部后,穿过用于二氧化硅润湿的相同溶剂的 1⁄2 柱体积。然后从列出的溶剂比开始,贯穿每个溶剂的至少1列体积,并确保溶剂成分不会出现大的跳跃。收集分数,并通过LCMS或TLC(薄层色谱)检查纯度/标识。通过旋转蒸发将纯馏分结合在减压下浓缩。
- DMACA-烷基奈的合成(2-(7-(二甲基氨基)-2-氧-2H-铬-4-yl)-N-(prop-2-yn-1-yl)乙酰胺)。
- 在30 mL乙醇中溶解5.02克3-(二甲基氨基)酚(36.6毫摩尔),然后加入6.7 mL的二乙基1,3-丙酮二甲苯甲酸酯(36毫摩尔)。加入10.5克ZnCl 2(77.2毫摩尔),然后倒流红色溶液42小时。再加入9.20克ZnCl 2(67.6毫摩尔),然后倒流8小时。
- 冷却反应,在减压下浓缩。将产生的红色固体分散到 200 mL 的 EA 中,过滤,然后转移到 500 mL 分离漏斗中。
- 用200 mL的水和盐水清洗EA,然后用无水硫酸镁干燥。过滤干燥的有机相,并在减压下浓缩。
- 通过在硅胶(PE 中 0–100% EA)的闪热色谱(0–100% EA),通过 LCMS([M+H]= = 275.1) 和/或 NMR,通过闪光色谱法净化红色固体(乙基 2-(7-(二甲基氨基)-2-oxo-2 H-chromen-4-yl)醋酸酯,通过 LCMS 检查纯度,化学变化如下:
1H NMR (CDCl3, 600 MHz) = 7.30 (d, J = 8.9 Hz,1H),6.52 (dd, J = 8.9 Hz, J = 2.6 Hz, 1H), 6.40 (d, J = 2.6 Hz, 1H), 5.87 (米, 1H), 2.96 (米, 8H), 2.25 (d, J = 1.2 Hz, 3H). - 在10 mL的THF中溶解488毫克乙基2-(7-(二甲基氨基)-2-oxo-2H-铬-4-基)醋酸酯(1.18毫摩尔),然后加入157mg的LiOH* 溶液。H2O (3.74 mmol)在 15 mL 水中。在RT处搅拌反应3小时,然后移至分离漏斗,再用50 mL的水稀释。
- 用50 mL二乙醚(Et2O)清洗反应混合物2x,然后用25 mL的水清洗组合的有机相2x。取任何黄色沉淀与有机层。使用旋转蒸发器在减压下浓缩有机相。
- 用浓缩的HCl将水相酸化至pH= 2,并在一夜之间冷却至4°C。过滤酸化水相,将黄色固体加入浓缩有机相中。
注:2-(7-(二甲基氨基)-2-oxo-2H-铬-4-yl)醋酸无需进一步纯化即可使用,但可以通过LCMS([M+H]= = 247.1)和/或NMR检查,化学变化如下:
1H NMR (CDCl3, 600 MHz) = 7.41 (d, J = 9.0 Hz,1H),6.62 (dd, J = 9.2 Hz, J = 2.8 Hz, 1H), 6.52 (d, J = 2.8 Hz, 1H), 5.98 (d, J = 0.9 Hz, 1H), 3.05 (s, 6H), 2.35 (d, J = 0.9 Hz, 2H);13C NMR (CDCl3, 150 MHz) = 162.2, 155.7, 152.9, 152.8, 125.3, 109.7, 109.3, 109.1, 108.8, 98.3, 40.2, 18.5。 - 将466mg的2-(7-(二甲基氨基)-2-oxo-2H-铬-4-基)醋酸(1.89毫摩尔)溶解在7mL的干N,N-二甲基甲酰胺(DMF)中,并置于氮气的大气中。
- 在氮气下7 mL的干DMF中溶解0.33 mL的蛋白胺(5.1毫摩尔)。在染料溶液中加入1.30 mL的二丙烯胺(DIPEA,7.50 mmol),然后加入535毫克的O-(1H-6-氯苯甲酰胺-1-yl)-1,1,1,3,3-四甲基六氟磷酸二铵(HCTU,1.29 mmol)。在RT处搅拌活性染料溶液15分钟,然后滴滴加入胺溶液,然后过夜搅拌。
- 第二天,用35 mL的水稀释反应,然后在减压下浓缩。
- 在 250 mL 分离漏斗中,在 EA 和盐水(每个 100 mL)之间划分生成的橙色固体。分离层(将两层运行到不同的烧瓶中),用 100 mL 的 EA 洗涤水相。
- 在减压下浓缩组合的有机相,然后将橙固体重新溶解在 3 mL 的 1:1 醋酸酯 (ACN)/水 (v/v)。通过将原油注射到配备 C18 墨盒柱的反向相位中压液相色谱 (MPLC) 系统中(溶剂 A:水、溶剂 B:ACN)来纯化原油产品。
- 通过LCMS([M+H]= = 284.1,NMR化学移位,然后结合和冻干适当的分数,以给出2-(7-(二甲基氨基)-2-ox-2 H-chromen-4-yl)-N-(prop-2-yn-1-yl)乙酰乙酰乙酰乙酰胺,NMR化学移位如下:
1H NMR (600 MHz, DMSO-d6) = 8.65 (t, J = 5.4Hz, 1H), 7.52 (d, J = 9.0Hz, 1H)、6.72(dd、J = 9.1、2.6 Hz、1H)、6.55(d、J = 2.6 Hz、1H)、6.00(s、1H)、3.88~3.87(米、2H)、3.62(s、2H)、3.13(t、J = 2.5 Hz、1H)、3.01(s、6H); 13C NMR (125 MHz, DMSO-d6) = 167.7, 160.7, 155.4, 152.9, 151.0, 126.0, 109.4, 109.1, 108.1, 97.5, 80.9, 73.3, 39.7, 38.4, 28.2.
2. 荧光抗生素的合成
- 如前文所述的抗生素的阿齐德衍生物,如前14、15、16所述。
注:该程序是特定于每种抗生素的,需要仔细检查母分子的结构活性关系 (SAR),以确保功能化的抗生素保持与父抗生素相当的活动。(例如,西普洛沙辛16,线子14,和三聚氰胺15)。有关已发布的荧光抗生素和一般合成方案的示例,请参阅图 1。 - 单击反应程序 A
注:对于大多数抗生素,请遵循此处详述的铜催化惠氏原 [2[3] 环状添加阿齐德(步骤 2.1)和荧光烷基(在步骤 1 中准备)的步骤。- 将阿齐德抗生素放入圆形底瓶中,加入三丁醇(tBuOH)和水(1:1 v/v,每mmol azide,每瓶25 mL)。
- 加入步骤1.1(3 eq.)中制备的氟磷-烷基,并将反应加热到50°C。然后加入硫酸铜(水中100 mM,0.6 eq.),然后加入抗坏血酸(水中500 mM,2.4 eq)。
- 在50°C下搅拌反应1小时,或直到LCMS在指示反应完成(完全消耗启动阿齐德)进行分析。
- 冷却反应,并酌情为抗生素支架进行净化,然后按步骤2.3或2.4进行纯化。
注:根据支架的极性和稳定性,可以使用几种不同的净化方法。
- 单击反应程序 B
注:按照此程序对肽类抗生素,以提供更强的反应条件(未发表的工作,Phetsang,2019年)。- 将肽阿齐德抗生素放入圆形底瓶中,加入足够的DMF(750 mL/mmol阿齐德)溶解。
- 加入步骤1(5 eq.)中制备的氟磷烷基,并将反应加热至50°C1小时。
- 加入铜(I)碘化物(20 eq),然后加入DIPEA(120 eq),然后加入醋酸(240 eq.)。
- 在 50°C 下搅拌反应 1 小时,或直到 LCMS 分析表明反应完成(即完全消耗起始支节)。冷却反应,然后按照方法1进行纯化(参见步骤2.3)。
- 纯化方法1(用于西普洛沙星、三聚氰胺和线子)
- 将冷却的咔嗒声直接注射到 MPLC C18 墨盒柱上。
- 在运行开始时加入一个长洗涤阶段(大约 10 分钟),然后运行高达 100% 溶剂 B 的梯度,然后返回到溶剂 A。
注:溶剂A可以从水中选择,水中的0.05~0.1%为甲酸(FA),水中的三氟乙酸(TFA)为0.05~0.1%,这取决于溶解度、稳定性和峰值的最佳分辨率。溶剂 B 可以从乙酰乙酸酯 (ACN) 中选择,ACN 中为 0.05–0.1% FA,在 ACN 中选择 0.05–0.1% TFA,以匹配溶剂 A。如果洗脱证明困难,甲醇可以代替ACN。 - 收集并组合适当的分数,如LCMS和颜色(正确的质量看到,奇异峰),然后冻干给予(半)纯荧光抗生素。
- 如果需要,进一步净化产品。使用适用于脚手架的柱和方法来评估 NMR 和/或 LCMS 和高压液相色谱 (HPLC) 的纯度。
- 纯化方法2
注:如果溶解度允许,预净化可能由水性工作进行(用于宏石,未发表的工作,Stone 2019)。- 用水和 Et2O(1:1 v/v,从初始反应体积中稀释约 10 倍)稀释冷却的咔嗒声反应,转移到适当大小的分离漏斗。
- 用 Et2O 分离层并洗涤水相两次。
- 用水清洗组合的有机相2x(与有机相相等的体积),然后在Na2SO4上干燥。
- 过滤干燥的有机相,并在减压下浓缩。
- 按步骤 2.4.4 中所述,通过 MPLC 和/或 HPLC 纯化原油产品。
注:有关不完整、完整和纯化的点击反应 LCMS 跟踪的示例,请参阅图 2。抗生素-荧光磷点击反应的典型纯化产量范围为30-80%。
注意:这些合成中使用的大多数化学品都有特定的安全隐患。必须始终保持警惕,包括使用个人防护设备。Et2O、 tBuOH、 FA、 醋酸、 PE、 EA、 THF、 ACN、 DMF、 EtOH、 DIPEA、 propargylamine 和 HCTU 都是易燃的;避免与热源或火花源接触。THF、丙二甲胺、DIPEA、t BuOH、FA、DMF和PE都是有毒的;避免暴露。丙二酮,CsCO3,ZnCl2, LiOH-H2O, DIPEA, CuI, FA, 醋酸, 和 HCl 都是腐蚀性的;避免接触并注意表面接触。锌2、CuSO4、CuI和PE存在环境危害;注意处置条件。THF可形成爆炸性过氧化物;注意存储条件。有机阿齐德是爆炸性的;尤其要注意大规模生产。
3. 抗菌活性评价
注:所有涉及细菌的工作都应在无菌条件下进行,以避免检测或实验室受到污染。所有介质在使用前都应进行灭菌,塑料器具和设备(如移液器)必须保持无菌。建议在生物围护罩(类型 2)中完成工作。
- 适合抗生素支架的细菌菌株的条纹甘油库存,用于向乳酸肉汤琼脂(LB,根据制造商的说明制备),并在37°C生长过夜。
注:根据所使用的抗生素支架,必须选择细菌来测试抗菌活性。应从已知易感染抗生素的物种中选择具有代表性的5-10种细菌,并考虑实验室的后勤能力。如果可能的话,还应测试耐药细菌。下面给出的协议将工作对大多数细菌,但检查是否需要特殊条件(例如,CO2,特殊介质),并根据需要进行更改。使用这些条件成功测定的细菌包括葡萄球菌、链球菌、巴氏杆菌、大肠杆菌、肺炎克氏杆菌、假单核菌和肠球菌。 - 从板中挑选单个菌落,并在 5 mL 的阳离子调整的穆勒-欣顿兄弟(CAMHB,根据制造商的说明准备)在 37 °C 过夜培养。
- 稀释 CAMHB 中过夜培养物 +40 倍,并增长到中对数阶段,光密度在 600 nm (OD600) = 0.4×0.8,体积 5 mL)。
- 在无菌水中以1.28mg/mL制备每种荧光抗生素的库存溶液,将10μL的抗生素移液器制备至96孔板的第一列。
- 向第一列添加 90 μL 的 CAMHB,向所有其他井添加 50 μL。然后,在板内执行连续 2 倍稀释。
- 彻底混合,然后稀释中日志相培养,至+106菌落形成单元(CFU)/mL,并在所有井中加入50μL,提供±5 x 105 CFU/mL的最终浓度。
培养量(mL) = (介质容量(以 mL 表示)/(OD600 x 1,000)
例如,对于在 12 mL 所需介质体积下使用 OD600 = 0.5 培养,在 12 mL 介质中添加(12/(0.5 x 1,000) = 0.024 mL 的培养素 - 用盖子盖住板,在 37°C 孵育 18-24 小时,不摇晃。
- 目视检查板,MIC 是浓度最低的井,没有可见增长。
注:有关活性和非活性荧光抗生素的一些示例,请参阅表 1。
4. 分光光度和流式细胞测定对探针积累的分析
注:这些离心时间已经针对大肠杆菌进行了优化,因此其他物种可能需要稍作改动。报告NBD标记的西普洛沙星探针探针的探针积累代表性数据。
- 细菌菌株的条纹甘油储存在LB琼脂上,在37°C下一夜生长。
- 在 37 °C 的 LB 中从板和培养中选择单个菌落。
- 稀释培养物+50倍的介质,并增长到中日志阶段(OD600 = 0.4±0.8)。
- 在 1,470 x g下将培养物离心 25 分钟,并分离介质。
- 将细菌重新悬浮在1mL的磷酸盐缓冲盐水(PBS)中,然后在1,470 x g下离心15分钟。
- 将介质解压,并将 PBS 中洗过的颗粒重新悬浮到最终 OD600 = 2。
- 如果需要,在1mL细菌(最终浓度为100μM)中加入10.1μL的碳基氰化物3-氯苯基氢酮(CCCP,PBS为10 mM),并在37°C孵育10分钟。
注:CCCP是一种排泄泵抑制剂。增加CCCP将允许检查排泄物的影响。 - 在 20°C 下在 18,000 x g下将培养物离心 4 分钟,并分离介质。
- 在颗粒中加入1mL荧光抗生素溶液(PBS中10~100μM),并在37°C孵育30分钟。
- 在 18,000 x g下将培养物在 4°C 下离心 7 分钟,并分离介质。
- 将细菌悬浮在1 mL的冷PBS中,并重复步骤4.9。
- 重复步骤 4.10 共 4 倍。
- 如果需要,通过加入180 μL的液化缓冲液(20 mM Tris-HCl、pH 8.0和2 mM EDTA钠)来给细菌提供莱糖,然后加入70 μL的液化酶(72 mg/mL,在H2O中)。
- 在37°C孵育30分钟,然后冷冻解冻3倍(+78°C5分钟,然后34°C15分钟)。
- 将样品声波20分钟,然后加热至65°C30分钟。
- 离心的分离样品(18,000 x g,8分钟),然后过滤通过10 kDa滤膜。
- 用 100 μL 的水将滤芯清洗 4 倍。
- 将解辐射转移到平底黑色 96 孔板,并测量具有适合荧光的激发和发射波长的板读取器上的荧光强度(即 DMACA: =ex = 400 nm,μem = 490 nm;NBD: =ex = 475 nm,μem = 545 nm)。
注:参见图3,了解使用荧光NBD标记环丙沙星抗生素的细菌分光度分析示例。 - 对于流式细胞学分析,可使用相同的生长和染色条件(步骤 4.1_4.17),仅在最终准备中发生变化。
- 使 PBS 的总音量达到 1 mL。
- 以大约 60 μL/min 的流速读取流式细胞仪上的样品,使用对数放大进行数据采集(F1 激励 = 488 nm;发射 = 525/20 nm)。
- 记录总共 10,000 个事件,然后使用适当的软件分析数据。
- 根据事件计数绘制 F1 的荧光强度,估计细菌染色后直方图峰值的荧光强度中位数。
注:参见图4,了解使用NBD标记环丙沙星抗生素对细菌进行流动细胞学分析的示例。
5. 微观分析准备
- 将亚培养物生长到 OD600 = 0.4,与 MIC 评估一样,然后分成 1 mL 等分和离心机在 18,000 x g下 3⁄5 分钟。
- 去粘和丢弃介质,然后在500μL的HBSS中重新悬浮细菌颗粒。
- 在 18,000 x g下离心 3 分钟,然后去皮和丢弃介质。
- 在浓度为1~100μM的HBSS中制备抗生素探针溶液。
- 将洗涤的细菌重新悬浮在500μL的探针溶液中,并在37°C下孵育30分钟。
- 重复步骤 5.3。对于多个标记实验,将颗粒重新悬浮在 500 μL 的正交色核酸染料中。对于绿色,请使用 Syto9(HBSS 中的 5 μM);对于蓝色,请使用 Hoechst 33342(HBSS 中 20 μg/mL)。在 RT 孵育 15-30 分钟。
- 重复步骤5.3,然后在500μL的FM4-64FX中重新悬浮(HBSS中为5微克/mL),并在RT孵育5分钟。
- 重复步骤 5.3,然后在 500 μL 的 HBSS 中重新挂起,然后再次重复步骤 5.3。
- 重复步骤5.8,最后将洗涤、染色的细菌悬浮在15μL的安装介质中(见材料表)。
- 移液器安装介质在显微镜幻灯片和顶部带有高性能盖滑,然后用清晰的指甲油密封边缘。
注:参见图5,了解使用NBD标记的柠檬沙星和三聚氰胺抗生素拍摄的共聚焦显微镜图像,图6为DMACA标记的奥索利酮(线子利丁)抗生素。
结果
图 1说明荧光抗生素制备的关键点击化学反应 (A), 以及基于西普洛沙星 (cipro)、三聚氰胺 (TMP) 和线子的已发表的荧光抗生素的结构示例 (B)。这些探针都是通过阿齐德中间体从相应的抗生素合成的。然后,它们与NBD和DMACA荧光管结合,每个荧光管都使用烷基。
图2显示了来自西普洛沙辛-N3和NBD-烷基尼点击反应的LCMS痕迹,其中azide在3.2分钟洗脱,产品在3.8分钟洗脱。 比较1和2显示了点击反应的进展如何随后出现阿齐德峰(紫外线或MS探测器)。Spectra 3显示了纯化的影响,错误的峰值从 MS 和 UV 痕迹中消失。纯度和反应进度都可以通过产品峰值和任何杂质峰的集成来量化。
图3显示了在存在和不存在排泄物的情况下,荧光光谱对细胞内积累评估的典型结果。在本实验中,大肠杆菌在是否加入CCCP时使用TMP-NBD进行处理,使质子动力(PMF)崩溃。使用CCCP预处理时,细菌的细胞内荧光明显较高,表明排泄物减少了这些细菌的积累。该实验使用缺乏托克的细菌重复进行,显示了该测定检测单个电子泵成分的影响的能力。在这种情况下,虽然与野生型细菌相比,细胞内荧光增加,但CCCP积累仍然增加。这些发现表明,TolC参与TMP排泄物,但不是唯一涉及的PMF驱动泵。
图4显示了与图2相同的实验结果,但用流式细胞学代替光谱测量的积累。观察到相同的数据趋势,表明这两种技术都可用于研究细胞内细胞内细胞内介导现象。
图5显示了分别标有TMP-NBD(1)和cipro-NBD(2+3)荧光探针的克阳性(S.金黄色)和克阴性细菌(大肠杆菌)的代表性共聚焦显微镜图像。在这两种情况下,都添加了红膜染料FM4-64FX,以便比较共同定位。对于TMP-NBD,也使用了蓝色核酸染料Hoechst-33342。通过叠加这些图像,将细菌中的抗生素定位可视化。比较面板2和3显示了如何检查排泄物的影响,在2中使用的排泄抑制剂CCCP,导致细胞内积累。在面板3中,未添加CCCP。因此,排泄物处于活动状态,未看到探针累积。
图6显示了标有DMACA标记的牛黄酮探针Lz-NBD的具有代表性的共聚焦显微镜图像的革兰氏阳性(S.aureus)细菌。为比较共定位,添加了红膜染料FM4-64FX,并使用了绿色核酸染料Hoechst-33342。通过叠加这些图像,将细菌中的抗生素定位可视化,显示其内部定位不同于膜和核酸。
表1显示了三种荧光抗生素、柠檬素、三甲苯丙胺(TMP)和线子(Lz)的MIC值,并给出了每种抗生素、NBD和DMACA衍生物的数据。每个抗生素的代表性物种被选择,包括克阳性和克阴性。对于西普洛沙星系列,两种荧光探针与母药相比失去了抗生素活性,但保留了一些针对所有物种的活性。同样,线子探针失去一些活性,但仍是中度至弱抗生素。TMP探针几乎失去了对野生型细菌的所有活性,但对缺乏排泄物的大肠杆菌具有活性,表明抗菌活性的丧失是由于缺乏积累造成的。

图1:抗生素衍生探针的合成和结构。(A) 从阿齐德抗生素和烷基-荧光素合成荧光抗生素探针的一般反应方案。(B) 我们基于西普洛沙星、三聚氰胺和线子的已公布的探针的结构。请点击此处查看此图的较大版本。
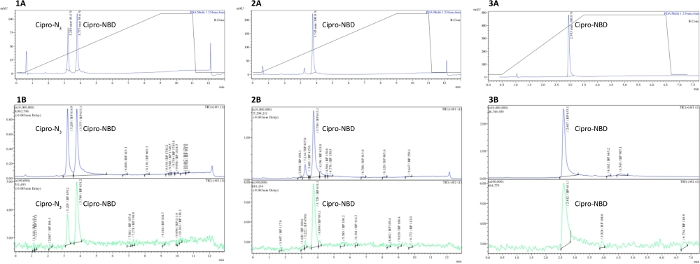
图2:LCMS测定抗生素衍生探针纯度。分析LCMS痕迹从(1)不完整,(2)完成,和(3)HPLC纯化柠檬素-N3 + NBD-烷基键反应,表明起始材料在反应完成后消失,和在纯化杂峰。A = UV-Vis 微量(250 nm 处的吸光度)、B = MS 曲线(正模和负数模式)。请点击此处查看此图的较大版本。

图3:抗生素衍生探针积累板读取器测量。野生类型(1,ATCC 25922)和β-托克(2,ATCC 25922)大肠杆菌的细胞积累荧光光谱测量,无需添加CCCP(100μM)。统计显著性(*p = 0.01;[p = 0.001)在缺乏或存在CCCP之间以及野生类型和β-tolC大肠杆菌之间显示。报告的数据是三个实验的平均值 = SD。这个数字改编自我们上一份15号出版物,并说明了光谱学的用法来阐明排泄物在细胞内积累中的作用。请点击此处查看此图的较大版本。
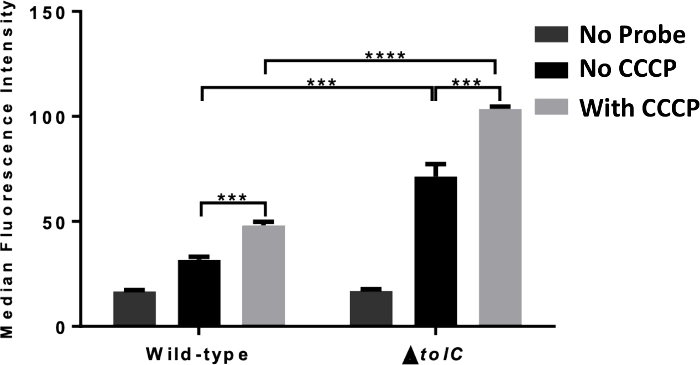
图4:抗生素衍生探针积累流式细胞测定测量。使用TMP-NBD在野生类型(1,ATCC 25922)和β-tolC(2,ATCC 25922)中用TMP-NBD对细胞积累的流动细胞学测量,大肠杆菌在未添加CCCP(100 μM)的情况下孵育。中位荧光活性从10,000个细菌事件显示,统计显著性(*,p = 0.001;*,p = 0.0001)显示在CCCP的缺失和存在之间,以及野生类型和β-tolC大肠杆菌之间。报告的数据是三个实验的平均值 = SD。这个数字改编自我们上一份15号出版物,并说明了流式细胞学的用法来阐明排泄物在细胞内积累中的作用。请点击此处查看此图的较大版本。

图5:NBD探针定位的共聚焦显微镜可视化。共聚焦显微镜图像 1) 活S. aureus标记与 Hoechst-33342 (蓝色, 核酸), TMP-NBD (绿色), FM4-64FX (红色, 膜), 和覆盖;2) 用CCCP(排泄抑制剂)处理的活大肠杆菌,标有cipro-NBD(绿色)、FM4-64FX(红色、膜)和覆盖物;3) 带柠檬-NBD(绿色)、FM4-64FX(红色、膜)和覆盖的活大肠杆菌。这个数字改编自我们以前出版的第15、16篇,并说明了显微镜对探针定位的使用,包括efflux的影响。请点击此处查看此图的较大版本。

图6:DMACA探针定位的共聚焦显微镜可视化。标有奥沙地酮探针Lz-DMACA(蓝色)、西毒克绿色(绿色、核酸)和FM4-64FX(红色、膜)的活S.aureus的共聚焦显微镜图像。请点击此处查看此图的较大版本。
| 麦克风(μg/mL) | |||||||||||
| 物种 | 应变 | 奇普罗 | Cipro-NBD | 西普罗-达马卡 | Tmp | TMP-NBD | TMP-DMACA | 利索利德(Lz) | Lz-NBD | Lz-DMACA | |
| 金黄色葡萄球菌 | ATCC 25923 | 0.125 - 0.5 | 32 - +64 | 16 | 1 | 16 | >64 | ||||
| ATCC 43300 | 1 | 16 | >64 | ||||||||
| 肺炎链球菌 | ATCC 700677 | 1 | 4 | 64 | |||||||
| 肠球菌 | ATCC 35667 | 1 - 8 | 32 | 32 - +64 | |||||||
| ATCC 51559 | 2 | 16 | 32 | ||||||||
| 克雷布西拉肺炎 | ATCC 13883 | 0.015 - 0.06 | 8 - 16 | 8 - 32 | |||||||
| 伪多蒙纳·阿鲁吉诺萨 | ATCC 27853 | 0.25 - 1 | 32 - +64 | 32 - +64 | |||||||
| 大肠杆菌 | ATCC 25922 | ±0.004 | 8 | 2 | 0.5 | >64 | >64 | ||||
| 突变 [醇酸C] | 0.125 | 0.25 | 2 | ||||||||
表 1.荧光抗生素探针的抗生素活性基于柠檬素、三甲苯和线子,针对适当的临床相关细菌菌株,通过溴微稀释MIC测定法进行测定。在大多数情况下,与母药相比,探针失去了一些活性,但保留了一些可测量的抗生素效力(足以在进一步研究中有用)。
讨论
成功的荧光抗生素探针的创建必须从仔细规划和考虑母药的SAR开始。如果对特区不为人所知或充分探索,可能需要测试若干选择,以找到一个在不取消生物活动的情况下有选择地加以修改的地点。一旦确定一个地点,安装链接器moiety通常是必不可少的,以便在作用的生物位点和非活性荧光酸之间提供稳脚间距。必须注意,用于将链接器附着在抗生素上的反应会留下一个生物稳定的功能组,避免,例如,在体内的酯类易发生裂解。根据抗生素的药效和药代动力学配置文件,可以使用简单的烷基连结剂,或者考虑使用少脂性选项,如聚乙烯乙二醇 (PEG) 链接器。在连接后,应评估抗菌活性,以确保针对相关细菌的MICs与母化合物相似。
在本作品中,我们建议使用Huigsen azide-烷基因[3[2]双极环增剂(点击化学,见图1)来将荧光酸醇稀释至抗生素,原因有很多。点击反应是高度选择性的,这意味着对抗生素反应群的保护是不必要的,此外,反应还留下一个稳定的、生物相容性的三氮。阿齐德成分被引入到抗生素部分在我们的程序中,因为这通常更容易完成与引入烷基烷的各种结构类型。此处描述了两种烷基衍生荧光团的合成,但如果需要,可以探索其他荧光团。NBD 和 DMACA 由于其体积小而被选中,从而最大限度地减少了干扰细胞渗透和目标相互作用的可能性。咔嗒反应本身使用铜催化进行,其中Cu2+(CuSO 4,带抗坏血酸还原剂)或Cu +(CuI)可用作起始试剂。纯化后(图2),然后应像使用azide一样测试MCC。即使仔细考虑了荧光酸的选择和附着部位,也有可能观察到抗生素活性差。但是,这并不意味着非活动探测没有使用。如TMP探针所示,抗菌活性较差的化合物可能仍与母药结合到同一靶点。这可以使研究行动模式和检查导致阻力的现象,如排泄物。
如协议部分所述,可以使用简单的分光光度测定(图3)或流式细胞测定(图4)分析荧光抗生素的细菌标记。这两种方法都能够量化细胞积累,通过对细胞进行分化并检查流合酶中的荧光定位,可以评估细胞内积累。在此协议中,描述了对细胞莱沙酶的使用,这是一种快速的通用技术。其他解说条件,如甘氨酸-HCl7的隔夜治疗,也已成功使用。利用这种技术,可以研究排泄物对抗生素细胞积累的影响,抗生素细胞积累是抗药性的主要机制。如果细菌中确实存在排泄物,则观察到细胞内积累的缺乏,不过这可以通过使用像CCCP这样的排泄抑制剂来挽救。
也可以进行显微镜检查,以目视检查不同细菌的探针定位,收集有关行动方式的信息,并可能还有抗药性(参见图5,了解代表性的例子)。为了观察细菌内的定位,需要高分辨率共聚焦显微镜,配备 SIM(结构化照明显微镜)、SR-SIM(超分辨率-SIM)、Airyscan 或 STED(刺激发射损耗)等功能。此外,还应使用高性能盖玻片,并在适当的软件(例如 FIJI、Zen 或 Imaris)上进行成像后分析。探针的定位与染色特定结构的染料进行比较,如Hoechst-33342(蓝色、核酸)、Syto-9(绿色、核酸)和FM4-64FX(红色、膜)。应选择染料以匹配荧光抗生素,以便使用的每种颜色的光谱重叠最小。为了获得最佳图像,可能需要优化。例如,如果滑道上的细菌过于拥挤,则只服用悬浮颗粒的一部分,然后用更多的安装介质稀释。相反,如果幻灯片上的细菌太稀疏,只需从更多的细菌开始。在此协议中,建议使用与活细胞(例如 Cygel)兼容的热可逆凝胶进行活细胞成像,因为它固定了细菌(包括活动细菌),但其他安装介质或腺胶也已成功使用。
总体而言,尽管在制备生物活性荧光抗生素衍生物方面可能面临挑战,但使用简单性及其多功能性使这些探针成为AMR研究的诱人工具。今后使用荧光抗生素的工作有可能深入了解抗生素耐药性机制,提高我们对当前抗生素运作方式的理解,并有助于开发更好的药物。
披露声明
作者没有什么可申报的。
致谢
MRLS获得澳大利亚研究生奖(APA)和分子生物科学研究促进奖的支持。万达·菲桑获得UQ国际奖学金(UQI)和IMB研究生奖(IMBPA)的支持。MAC 是 NHMRC 原则研究员 (APP1059354),还担任昆士兰大学的部分教授研究员,剩余时间担任 Inflazome Ltd 的首席执行官,该公司开发药物,以解决炎症疾病临床未满足的需求。MATB 部分由威康信托战略赠款 WT1104797/Z/Z 和 NHMRC 开发赠款 APP1113719 支持。显微镜是在澳大利亚癌症研究基金会(ACRF)/分子生物科学研究所癌症生物学成像设施进行的,该设施是在ACRF的支持下建立的。
材料
| Name | Company | Catalog Number | Comments |
| 3-(dimethylamino)phenol | Alfa-Aesar | B23067 | |
| 4-chloro-7-nitro-benzofuran | Sigma-Aldrich | 163260-5G | |
| Amicon Ultra-0.5 centrifugal filter unit with Ultracel- 10 membrane | Merck | UFC501096 | |
| Atlantis Prep T3 OBD (100 A, 5 uM, 10x250 mm) | Waters | 186008205 | |
| Atlantis T3 column (100 A, 5 uM, 2.1 × 50 mm) | Waters | 186003734 | |
| Bruker Avance 600 MHz spectrometer | Bruker | ||
| Buchi Reveleris C18 12g Cartridge | Buchi | BUC145152103 | |
| CCCP | Sigma-Aldrich | C2759 | |
| Celite 545 | Sigma-Aldrich | 22140-5KG-F | |
| Cygel | ABCAM | Ab109204 | |
| Elyra PS,1 SIM/STORM confocal microscope | Zeiss | ||
| FM4-64FX, fixable analog of FM™ 4-64 membrane stain | Life Technologies Australia Pt | F34653 | |
| Gallios flow cytometer | Beckman Coulter | ||
| Gamma 2-16 LSCplus lyophilise | CHRIST | ||
| Gilson HPLC 2020 | Gilson | ||
| Hanks' Balanced Salt solution, Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | H6648-500ML | |
| Hettich Zentrifugen Rotofix 32 | Hettich | ||
| High performance #1.5 cover slips (18 x 18 mm) | Schott/Zeiss | 474030-9000-000 | |
| Hoechst 33342, Trihydrochloride, Trihydrate - Fluo | Life Technologies Australia Pt | H21492 | |
| LB | AMRESCO | J106 | |
| Leica STED 3X Super Resolution Microscope with White Light Laser excitation | Leica | ||
| Lysozyme from chicken egg white lyophilized powder | Sigma-Aldrich | L6876 | |
| Mueller Hinton II Broth Cation adjusted | Becton Dickinson | 212322 | |
| Propargylamine | Sigma-Aldrich | P50900-5G | |
| Reveleris GRACE MPLC | Buchi | ||
| Shimadzu LCMS-2020 | Shimadzu | ||
| Sigma 1-15 Microcentrifuge | Sigma-Aldrich | ||
| Silica gel 60 (0.040-0.063 mm) for column chromatography (230-400 mesh ASTM) | Merck | 1093859025 | |
| SYTO 9 Green Fluorescent Nucleic Acid Stain | Life Technologies Australia Pt | S34854 | |
| TECAN Infinite M1000 PRO | TECAN |
参考文献
- Cai, H., Rose, K., Liang, L. H., Dunham, S., Stover, C. Development of a liquid chromatography/mass spectrometry-based drug accumulation assay in Pseudomonas aeruginosa. Analytical Biochemistry. 385 (2), 321-325 (2009).
- Bhat, J., Narayan, A., Venkatraman, J., Chatterji, M. LC-MS based assay to measure intracellular compound levels in Mycobacterium smegmatis: Linking compound levels to cellular potency. Journal of Microbiological Methods. 94 (2), 152-158 (2013).
- Davis, T. D., Gerry, C. J., Tan, D. S. General Platform for Systematic Quantitative Evaluation of Small-Molecule Permeability in Bacteria. ACS Chemical Biology. 9 (11), 2535-2544 (2014).
- Richter, M. F., et al. Predictive compound accumulation rules yield a broad-spectrum antibiotic. Nature. 545, 299(2017).
- Iyer, R., et al. Evaluating LC-MS/MS To Measure Accumulation of Compounds within Bacteria. ACS Infectious Diseases. 4 (9), 1336-1345 (2018).
- Prochnow, H., et al. Subcellular Quantification of Uptake in Gram-Negative Bacteria. Analytical Chemistry. 91 (3), 1863-1872 (2019).
- Dumont, E., et al. Antibiotics and efflux: combined spectrofluorimetry and mass spectrometry to evaluate the involvement of concentration and efflux activity in antibiotic intracellular accumulation. Journal of Antimicrobial Chemotherapy. 74 (1), 58-65 (2019).
- Stone, M. R. L., Butler, M. S., Phetsang, W., Cooper, M. A., Blaskovich, M. A. T. Fluorescent Antibiotics: New Research Tools to Fight Antibiotic Resistance. Trends in Biotechnology. 36 (5), 523-536 (2018).
- Piddock, L. J. V., Johnson, M. M. Accumulation of 10 fluoroquinolones by wild-type or efflux mutant Streptococcus pneumoniae. Antimicrobial Agents and Chemotherapy. 46 (3), 813-820 (2002).
- Mortimer, P. G. S., Piddock, L. J. V. A comparison of methods used for measuring the accumulation of quinolones by enterobacteriaceae, pseudomonas aeruginosa and staphylococcus aureus. Journal of Antimicrobial Chemotherapy. 28 (5), 639-653 (1991).
- Li, X. Z., Nikaido, H., Poole, K. Role of MexA-MexB-OprM in antibiotic efflux in Pseudomonas aeruginosa. Antimicrobial Agents and Chemotherapy. 39 (9), 1948-1953 (1995).
- Vince, R., Weiss, D., Pestka, S. Binding of N-substituted erythromycylamines to ribosomes. Antimicrobial Agents and Chemotherapy. 9 (1), 131-136 (1976).
- Vazquez, D. Antibiotics affecting chloramphenicol uptake by bacteria Their effect on amino acid incorporation in a cell-free system. Biochimica et Biophysica Acta (BBA) - Nucleic Acids and Protein Synthesis. 114 (2), 289-295 (1966).
- Phetsang, W., et al. An azido-oxazolidinone antibiotic for live bacterial cell imaging and generation of antibiotic variants. Bioorganic and Medicinal Chemistry. 22 (16), 4490-4498 (2014).
- Phetsang, W., et al. Fluorescent trimethoprim conjugate probes to assess drug accumulation in wild type and mutant Escherichia coli. ACS Infectious Diseases. 2 (10), 688-701 (2016).
- Stone, M. R. L., et al. Fluoroquinolone-derived fluorescent probes for studies of bacterial penetration and efflux. MedChemComm. 10 (6), 901-906 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。