Method Article
Visualización de la resistencia bacteriana mediante sondas fluorescentes antibióticas
En este artículo
Resumen
Los antibióticos etiquetados fluorescentemente son herramientas poderosas que se pueden utilizar para estudiar múltiples aspectos de la resistencia a los antimicrobianos. Este artículo describe la preparación de antibióticos etiquetados fluorescentemente y su aplicación para estudiar la resistencia a los antibióticos en bacterias. Las sondas se pueden utilizar para estudiar mecanismos de resistencia bacteriana (por ejemplo, eflujo) por espectrofotometría, citometría de flujo y microscopía.
Resumen
Los antibióticos fluorescentes son herramientas de investigación multipropósito que se utilizan fácilmente para el estudio de la resistencia a los antimicrobianos, debido a su ventaja significativa sobre otros métodos. Para preparar estas sondas, se sintetizan los derivados de la azida de los antibióticos, luego se combinan con alquino-fluoróforos usando azide-alkyne dipolar cycloaddition por la química del clic. Después de la purificación, la actividad antibiótica del antibiótico fluorescente se prueba mediante una evaluación de la concentración inhibitoria mínima. Para estudiar la acumulación bacteriana, se puede utilizar espectrofotometría o citometría de flujo, lo que permite un análisis mucho más sencillo que los métodos que dependen de derivados antibióticos radiactivos. Además, la microscopía confocal se puede utilizar para examinar la localización dentro de las bacterias, proporcionando información valiosa sobre el modo de acción y los cambios que se producen en especies resistentes. El uso de sondas antibióticas fluorescentes en el estudio de la resistencia a los antimicrobianos es un método potente con mucho potencial para la expansión futura.
Introducción
La resistencia a los antimicrobianos es una crisis en ascenso que representa una gran amenaza para la salud humana en todo el mundo. Se ha notificado resistencia a la mayoría de los antibióticos, y están surgiendo infecciones causadas por bacterias resistentes a todos los medicamentos clínicamente disponibles. Para combatir el auge de la RESISTENCIA, necesitamos aumentar nuestra comprensión de este fenómeno multifacético y los mecanismos e interacciones subyacentes entre antibióticos y bacterias. Un aspecto que históricamente ha sido mal entendido es la permeación de antibióticos en bacterias, junto con los fenómenos de acumulación y eflujo. Este conocimiento es crucial en el diseño de nuevos fármacos y la comprensión de los mecanismos de resistencia. Por lo tanto, esto desempeña un papel crítico en la investigación de la RMN.
Hay dos enfoques principales que se pueden tomar para medir la concentración de antibióticos: medir el medicamento directamente o etiquetar con una mitad diseñada para facilitar la cuantificación. Aunque etiquetar el antibiótico mejora la detección, esto puede perturbar la actividad biológica del fármaco, como la actividad antimicrobiana y la permeabilidad. Esto no es un problema para los métodos sin etiquetar; sin embargo, la detección puede ser difícil. En los últimos años, los avances tecnológicos han llevado a un auge en la investigación utilizando espectrometría de masas (MS) para medir directamente la concentración de antibióticos en bacterias1,2,3,4,5,6,7. Estos estudios han demostrado que es posible estudiar la acumulación intracelular en una variedad de bacterias, con bacterias gramnegativas más ampliamente estudiadas. La cuantificación de la permeabilidad de las moléculas se ha relacionado con la actividad y se ha utilizado para informar sobre el desarrollo de fármacos2,3,4, aunque se debe tener precaución al confuncionar directamente la acumulación y la actividad objetivo5. Antes del desarrollo de la EM, los únicos antibióticos cuya concentración podía medirse directamente eran los que poseían fluorescencia intrínseca, como la tetraciclina y las quinolonas8,9,10,11. Aunque evidentemente se examinó y cuantificó su alcance, la acumulación y el eflujo, lo que ilustra la utilidad de la cuantificación basada en fluorescencia.
Los antibióticos etiquetados se han utilizado durante muchas décadas para estudiar distribuciones, modos de acción y resistencia, siendo comunes las etiquetas radiactivas y fluorescentes. Las sondas radioetiquetadas tienen la ventaja de ser casi idénticas al compuesto principal, por lo tanto, es poco probable que la actividad biológica sea significativamente diferente. Los isótopos como 3H, 14C y 15N se han utilizado con frecuencia debido a la prominencia de estos elementos en antibióticos, y se han examinado una variedad de andamiosantibiótico1,10,12,13. Si bien la detección de radiosondas es simple, hay una serie de preocupaciones logísticas (por ejemplo, seguridad, vida media isótopo) que han limitado el uso de este enfoque. Otra estrategia son los antibióticos etiquetados fluorescentemente. Estas sondas se pueden utilizar para examinar la distribución y los modos de acción y resistencia del fármaco principal, utilizando una tecnología más sencilla que la EP y sin los problemas logísticos de la radiación8. El principal inconveniente de este enfoque es que los antibióticos son generalmente moléculas relativamente pequeñas, de ahí que la introducción de una mitad fluorescente suponga un cambio químico significativo. Esta alteración puede afectar las propiedades fisioquímicas y la actividad antibacteriana. Por lo tanto, se debe tener cuidado de evaluar estos factores con el fin de generar resultados representativos del antibiótico padre.
En este trabajo, se describe un método para sintetizar, evaluar y utilizar antibióticos fluorescentes, como en nuestras publicaciones anteriores14,15,16. A través de trabajos anteriores, se han preparado y utilizado una serie de antibióticos fluorescentes para una variedad de propósitos (ver Stone et al.8). Con el fin de minimizar la probabilidad de afectar la actividad biológica, fluoróforos muy pequeños se utilizan en este trabajo: nitrobenzoxadizol (NBD, verde) y 7-(dimetilamino)-2-oxo-2H-chromen-4-yl (DMACA, azul). Además, se describe la evaluación de la actividad antibacteriana utilizando el ensayo de concentración mínima de inhibición de dilución de microcalina (MIC), de modo que se pueda medir el efecto de las modificaciones sobre la actividad. Estas sondas etiquetadas fluorescentemente se pueden utilizar en ensayos espectrofotométricos, citometría de flujo y microscopía. La gama de posibles aplicaciones es donde radica la ventaja de los antibióticos fluorescentes. La acumulación celular se puede cuantificar, categorizar y visualizar, algo que no es posible utilizando la EM por sí sola. Se espera que los conocimientos adquiridos mediante el uso de antibióticos fluorescentes ayuden en nuestra comprensión de la resistencia y la lucha contra la resistencia alos.
Protocolo
1. Síntesis de alquino-fluoróforos
- Síntesis de NBD-alkyne (7-nitro-N-(prop-2-yn-1-yl)benzo[c][1,2,5]oxadiazol-4-amine)
- Disolver 1.031 mg de 4-cloro-7-nitro-benzofurano (5.181 mmol) en 60 ml de tetrahidrofurano (THF). Añadir 1,857 mg de CsCO3 (5.696 mmol), luego 0,39 ml de propargilamina (6,1 mmol). Calentar la reacción a 50 oC durante 2 h, que cambiará de marrón a verde, luego se enfría a temperatura ambiente (RT).
- Filtrar la reacción con una ayuda de filtrado (ver Tabla de Materiales)y lavar con acetato de etilo (EA). Concentrar el filtrado bajo presión reducida, luego disolver el residuo en 150 ml de EA y pasar a un embudo separador de 500 ml.
- Lave la solución de EA con 100 ml con agua y salmuera respectivamente. A continuación, combinar las fases acuosas y lavar 2x con 100 mL de EA.
- Secar las fases orgánicas combinadas sobre el sulfato de magnesio anhidro, luego filtrar y concentrar bajo presión reducida.
- Purificar el producto crudo mediante cromatografía flash en gel de sílice (20-30% EA en éter de petróleo [PE]), comprobando la pureza mediante espectrometría de masas de cromatografía líquida (LCMS, [M+H]+ 219.1) y/o espectroscopia de resonancia magnética nuclear (RMN), cambios químicos de la siguiente manera:
1 H NMR (CD3OD, 600 MHz) a 8,54 (d, J a 8,7 Hz, 1H), 6,35 (d, J a 8,4 Hz, 1H), 4,31 (dd, J a 5,7 Hz, J a 2,5 Hz, 2H), 2,43 (t, J a 2,5 Hz, 1H); 13 NMR de C (CD3OD, 150 MHz) 144,3, 143,7, 142,2, 135,8, 125,7, 100,0, 76,5, 74,2, 33,4.
NOTA: Al realizar la purificación mediante cromatografía de gel de sílice, prepare la columna utilizando el menos polar de los disolventes enumerados. El compuesto crudo puede cargarse como una solución concentrada o adsorbido en la sílice si la solubilidad no lo permite. Después de que el compuesto se ha añadido a la parte superior de la sílice, ejecutar a través de 1-2 volúmenes de columna del mismo disolvente utilizado para la humectación de sílice. A continuación, comience con la relación de disolvente enumerada, corriendo a través de al menos 1 volumen de columna de cada disolvente, y asegurándose de no hacer grandes saltos en la composición del disolvente. Recoger fracciones, y comprobar la pureza / identidad por LCMS o TLC (cromatografía de capa fina). Combine fracciones puras y concentre bajo presión reducida por evaporación rotativa.
- Síntesis de DMACA-alkyne (2-(7-(dimethylamino)-2-oxo-2H-chromen-4-yl)-N-(prop-2-yn-1-yl)acetamida).
- Disolver 5,02 g de 3-(dimetilamino)fenol (36,6 mmol) en 30 ml de etanol, luego añadir 6,7 ml de dietilo 1,3-acetonadilboxilato (36 mmol). Añadir 10,5 g de ZnCl2 (77,2 mmol), luego reflujo de la solución roja durante 42 h. Añadir 9,20 g adicionales de ZnCl2 (67,6 mmol), luego reflujo durante 8 h.
- Enfríe la reacción y concentre bajo presión reducida. Disperse el sólido rojo resultante en 200 ml de EA, filtre y, a continuación, transfiera a un embudo separador de 500 ml.
- Lave el EA con 200 ml cada uno de agua y salmuera, luego seque sobre sulfato de magnesio anhidro. Filtrar la fase orgánica seca y concentrar bajo presión reducida.
- Purificar el sólido rojo (etil 2-(7-(dimethylamino)-2-oxo-2H-chromen-4-yl)acetato) mediante cromatografía flash en gel de sílice (0–100% EA en PE), comprobación de pureza por LCMS ([M+H]+ 275.1) y/o RMN, cambios químicos de la siguiente manera:
1 H NMR (CDCl3, 600 MHz) 7,30 (d, J a 8,9 Hz, 1H), 6,52 (dd, J a 8,9 Hz, J a 2,6 Hz, 1H), 6,40 (d, J a 2,6 Hz, 1H), 5,87 (m, 1H), 2,96 (m, 8H), 2,25 (d, J a 1,2 Hz, 3H). - Disolver 488 mg de etil 2-(7-(dimethylamino)-2-oxo-2H-chromen-4-yl)acetato (1,18 mmol) en 10 ml de THF, luego añadir una solución de 157 mg de LiOH H2O (3,74 mmol) en 15 ml de agua. Revuelva la reacción a RT durante 3 h, luego pase a un embudo separador y diluya con 50 ml adicionales de agua.
- Lavar la mezcla de reacción 2x con 50 ml de éter dietílico (Et2O), luego lavar la fase orgánica combinada 2x con 25 ml de agua. Tome cualquier precipitado amarillo con la capa orgánica. Concentre la fase orgánica bajo presión reducida utilizando un evaporador rotativo.
- Acidificar la fase acuosa a pH 2 con HCl concentrado, y enfriar a 4 oC durante la noche. Filtrar la fase acuosa acidificada y añadir el sólido amarillo a la fase orgánica concentrada.
NOTA: El ácido acético 2-(7-(dimethylamino)-2-oxo-2H-chromen-4-yl)se puede utilizar sin purificación adicional, pero esto puede ser comprobado por LCMS ([M+H]+ 247.1) y/o NMR, cambios químicos de la siguiente manera:
1 H NMR (CDCl3, 600 MHz) 7,41 (d, J a 9,0 Hz, 1H), 6,62 (dd, J a 9,2 Hz, J a 2,8 Hz, 1H), 6,52 (d, J a 2,8 Hz, 1H), 5,98 (d, J a 0,9 Hz, 1H), 3,05 (s, 6H), 2,35 (d, J a 0,9 Hz, 2H); 13 C NMR (CDCl3, 150 MHz) 162,2, 155,7, 152,9, 152,8, 125,3, 109,7, 109,3, 109.1, 108.8, 98.3, 40.2, 18.5. - Disolver 466 mg de 2-(7-(dimethylamino)-2-oxo-2H-chromen-4-yl)ácido acético (1,89 mmol) en 7 ml de nseco,N-dimetilformamida (DMF) y colocar bajo una atmósfera de nitrógeno.
- Disolver 0,33 ml de proargilamina (5,1 mmol) en 7 ml de DMF seco bajo nitrógeno. Añadir 1,30 ml de di-isopropilinil amina (DIPEA, 7,50 mmol) a la solución de tinte, luego 535 mg de O-(1H-6-clorobenzotriazol-1-yl)-1,1,3,3-tetrametiluroniumafluorofosfato (HCTU, 1.29 mmol). Revuelva la solución de tinte activada durante 15 minutos a RT, luego agregue la solución de amina en sentido de gota y deje que se revuelva durante la noche.
- Al día siguiente, diluir la reacción con 35 ml de agua y luego concentrarse bajo presión reducida.
- Particione el sólido naranja resultante entre EA y salmuera (100 ml cada uno) en un embudo separador de 250 ml. Separe las capas (ejecute las dos capas en diferentes matraces) y lave la fase acuosa con 100 ml de EA.
- Concentrar las fases orgánicas combinadas bajo presión reducida, luego volver a disolver el sólido naranja en 3 ml de 1:1 acetonitrilo (ACN)/agua (v/v). Purificar el producto crudo inyectándolo en un sistema de cromatografía líquida de presión media de fase inversa (MPLC) equipado con una columna de cartucho C18 (solvente A: agua, disolvente B: ACN).
- Compruebe la pureza de las fracciones por LCMS ([M+H]+ 284.1, cambios químicos de RMN que se indican a continuación), luego combine y liofilice las fracciones apropiadas para dar 2-(7-(dimethylamino)-2-oxo-2H-chromen-4-yl)-N-(prop-2-yn-1-yl)acetamide, NMR cambios químicos de la siguiente manera:
1 H NMR (600 MHz, DMSO-d6) a 8,65 (t, J a 5,4 Hz, 1H), 7,52 (d, J a 9,0 Hz, 1H), 6,72 (dd, J a 9,1, 2,6 Hz, 1H), 6,55 (d, J a 2,6 Hz, 1H), 6,00 (s, 1H), 3,88–3,87 (m, 2H), 3,62 (s, 2H), 3,13 (t, J, 2,5 Hz, 1H), 3,01 (s, 6H); 13 C NMR (125 MHz, DMSO-d6) 167,7, 160,7, 155,4, 152,9, 151,0, 126,0, 109,4, 109.1, 108.1, 97.5, 80.9, 73.3, 39.7, 38.4, 28.2.
2. Síntesis de antibióticos fluorescentes
- Preparar un derivado de azida de un antibiótico como se describió anteriormente14,15,16.
NOTA: El procedimiento es específico de cada antibiótico y requiere un examen cuidadoso de la relación de actividad de la estructura (SAR) de la molécula padre para asegurarse de que el antibiótico funcionalizado conserva una actividad comparable a la del padre. (por ejemplo, ciprofloxacino16, linezolid14y trimetoprim15). Consulte la Figura 1 para ver ejemplos de antibióticos fluorescentes publicados y el esquema de síntesis general. - Procedimiento de reacción de clic A
NOTA: Para la mayoría de los antibióticos, siga el procedimiento detallado aquí para el huisgeno catalizado de cobre [2+3] cicloadición de azida (paso 2.1) y alquino fluorescente (preparado en el paso 1).- Colocar el antibiótico de azida en un matraz de fondo redondo y añadir tert-butanol (tBuOH) y agua (1:1 v/v, 25 mL cada uno por mmol azide).
- Añadir el fluoróforo-alquino preparado en el paso 1.1 (3 eq.) y calentar la reacción a 50 oC. A continuación, añadir sulfato de cobre (100 mM en agua, 0,6 eq.) a la reacción, seguido de ácido ascórbico (500 mM en agua, 2,4 eq.).
- Revuelva la reacción a 50 oC durante 1 h, o hasta que el LCMS lo realice tras la indicación de la finalización de la reacción (consumo completo de azida inicial).
- Enfriar la reacción y purificar según corresponda para el andamio antibiótico y proceder a la purificación ya sea por el paso 2.3 o 2.4.
NOTA: Son posibles varios métodos de purificación diferentes, dependiendo de la polaridad y estabilidad del andamio.
- Procedimiento de reacción de clic B
NOTA: Siga este procedimiento para los antibióticos basados en péptidos, para proporcionar condiciones de reacción más fuertes (trabajo inédito, Phetsang, 2019).- Coloque el péptido de azida-antibiótico en un matraz de fondo redondo y agregue suficiente DMF (750 ml/mmol de azida) para disolver.
- Añadir el fluoróforo-alquino preparado en el paso 1 (5 eq.) y calentar la reacción a 50 oC durante 1 h.
- Añadir cobre (I) yoduro (20 eq.), luego DIPEA (120 eq.), luego ácido acético (240 eq.).
- Remueva la reacción a 50 oC durante 1 h, o hasta que el análisis por LCMS indique la finalización de la reacción (es decir, el consumo completo de azida inicial). Enfriar la reacción y proceder a la purificación por el método 1 (ver paso 2.3).
- Método de purificación 1 (utilizado para ciprofloxacino, trimetoprim y linezolid)
- Inyecte la reacción de clic enfriada directamente en una columna de cartucho MPLC C18.
- Incorporar una fase de lavado largo (aproximadamente 10 min) al comienzo de la carrera (100% disolvente A), luego ejecutar un gradiente hasta 100% disolvente B, seguido de un retorno al disolvente A.
NOTA: El disolvente A se puede elegir del agua, 0.05–0.1% ácido fórmico (FA) en agua, 0.05–0.1% ácido trifluoroacético (TFA) en agua, dependiendo de la solubilidad, estabilidad, y la mejor resolución de picos. El disolvente B se puede elegir entre acetonitrilo (ACN), 0,05–0,1% FA en ACN, 0,05–0,1% TFA en ACN, para que coincida con el disolvente A. Si la elución resulta difícil, el metanol se puede utilizar en lugar de ACN. - Recoger y combinar fracciones apropiadas, como se indica por LCMS y color (masa correcta vista, pico singular), a continuación, liofilizar para dar el (semi)antibiótico fluorescente puro.
- Purificar aún más el producto si es necesario. Evaluar la pureza por RMN y/o LCMS y cromatografía líquida de alta presión (HPLC), utilizando una columna y un método apropiados para el andamio.
- Método de purificación 2
NOTA: Si la solubilidad lo permite, la prepurificación puede ser llevada a cabo por el trabajo acuoso (utilizado para macrólidos, trabajo inédito, Piedra 2019).- Diluir la reacción de clic enfriada con agua y Et2O (1:1 v/v, aproximadamente 10 veces la dilución del volumen de reacción inicial), transfiriendo a un embudo separador de tamaño adecuado.
- Separe las capas y lave la fase acuosa dos veces con Et2O.
- Lavar las fases orgánicas combinadas 2x con agua (igual volumen con fase orgánica), luego secar sobre Na2SO4.
- Filtrar la fase orgánica seca y concentrar bajo presión reducida.
- Purificar el producto crudo por MPLC y/o HPLC como se describe en el paso 2.4.4.
NOTA: Consulte la Figura 2 para ver ejemplos de seguimientos LCMS de reacción de clic incompletos, completos y purificados. Los rendimientos purificados típicos para las reacciones de clic de antibióticos y fluoróforos oscilan entre el 30 y el 80 %.
ADVERTENCIA: La mayoría de los productos químicos utilizados en estas síntesis poseen riesgos específicos para la seguridad. Se debe tener precaución en todo momento, incluido el uso de equipos de protección personal. Et2O, tBuOH, FA, ácido acético, PE, EA, THF, ACN, DMF, EtOH, DIPEA, propargilamina, y HCTU son todos inflamables; evitar el contacto con fuentes de calor o chispas. THF, propargilamina, DIPEA, tBuOH, FA, DMF, y PE son todos tóxicos; evitar la exposición. Propargilamina, CsCO3, ZnCl2, LiOH-H2O, DIPEA, CuI, FA, ácido acético, y HCl son todos corrosivos; evitar el contacto y estar al tanto del contacto con la superficie. ZnCl2, CuSO4, CuI, y PE presentan peligros ambientales; ser conscientes de las condiciones de eliminación. THF puede formar peróxidos explosivos; cuidar de las condiciones de almacenamiento. Las azidas orgánicas son explosivas; especialmente con la producción a gran escala.
3. Evaluación de la actividad antimicrobiana
NOTA: Todos los trabajos relacionados con bacterias deben llevarse a cabo en condiciones estériles para evitar la contaminación del ensayo o del laboratorio. Todos los medios deben ser autoclavedos antes de su uso, y los materiales plásticos y equipos tales como pipetas deben mantenerse estériles. Se recomienda que el trabajo se realice en una campana de biocontención (tipo 2).
- Las reservas de glicerol de rayas de cepas bacterianas apropiadas para el andamio antibiótico sobre el agar caldo de lisógenia (LB, preparado según las instrucciones del fabricante), y crecen durante la noche a 37 oC.
NOTA: La elección de las bacterias para probar la actividad antibacteriana debe hacerse sobre la base del andamio antibiótico que se utiliza. Se debe elegir una gama representativa de 5-10 bacterias de las especies que se sabe que son susceptibles al antibiótico, teniendo en cuenta las capacidades logísticas del laboratorio. Si es posible, también se deben probar bacterias resistentes. El protocolo que se indica a continuación funcionará en la mayoría de las bacterias, pero compruebe si se requieren condiciones especiales (por ejemplo, CO2,medios especiales) y realice modificaciones según sea necesario. Las bacterias que se ensayon con éxito utilizando estas condiciones incluyen Staphylococci, Streptococci, Bacilli, E. coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, y Enterococcus faecium. - Escoge una sola colonia de la placa, y el cultivo durante la noche en 5 ml de caldo Mueller-Hinton ajustado catiónico (CAMHB, preparado según las instrucciones del fabricante) a 37 oC.
- Diluir los cultivos nocturnos 40 veces en CAMHB y crecer hasta una fase de registro medio, densidad óptica a 600 nm (OD600) a 0,4–0,8, volumen 5 mL).
- Preparar las soluciones de stock de cada antibiótico fluorescente a 1,28 mg/ml en agua estéril, y pipetear 10 l de antibiótico a la primera columna de una placa de 96 pozos.
- Añadir 90 l de CAMHB a la primera columna y 50 l a todos los demás pozos. A continuación, realice una dilución en serie 2 veces a través de la placa.
- Mezclar a fondo, luego diluir los cultivos de fase de registro medio a 106 unidades formadoras de colonias (CFU) / ml y añadir 50 l a todos los pozos, para proporcionar una concentración final de 5 x 105 CFU / ml.
volumen de cultivo (mL) (volumen de medios en ml)/(OD600 x 1.000)
p. ej., para un cultivo de600 o00 o 0,5 oD en un volumen de medios deseado de 12 ml, añada (12/(0,5 x 1.000) a 0,024 ml de cultivo a 12 ml de medios - Cubra las placas con tapas e incubar a 37 oC durante 18-24 h sin agitar.
- Inspeccione visualmente las placas, siendo el MIC el pozo de concentración más bajo sin crecimiento visible.
NOTA: Consulte la Tabla 1 para ver algunos ejemplos de antibióticos fluorescentes activos e inactivos.
4. Análisis de la acumulación de sondas por espectrofotometría y citometría de flujo
NOTA: Estos tiempos de centrifugación han sido optimizados para E. coli,por lo que pueden ser necesarias ligeras alteraciones para otras especies. Se informa de datos representativos para la acumulación de sondas para la sonda ciprofloxacino etiquetada por NBD.
- Las reservas de glicerol de rayas de las cepas bacterianas sobre el agar LB crecen durante la noche a 37 oC.
- Escoge una sola colonia de la placa y el cultivo durante la noche en LB a 37oC.
- Diluir los cultivos nocturnos 50 veces en los medios de comunicación y crecer hasta la fase de registro medio (OD600 a 0,4–0,8).
- Centrifugar las culturas a 1.470 x g durante 25 min y decantar los medios de comunicación.
- Resuspenda las bacterias en 1 ml de solución salina con fosfato (PBS), luego centrífuga a 1.470 x g durante 15 min.
- Decantar los medios y resuspender los pellets lavados en PBS a una OD final600 x 2.
- Si lo desea, añadir 10,1 ml de cianuro de carbonilo 3-clorofenilhidrazona (CCCP, 10 mM en PBS) a 1 ml de bacterias (concentración final 100 oM) e incubar a 37 oC durante 10 min.
NOTA: El PCC es un inhibidor de la bomba de eflujo. La adición de PCCC permitirá examinar el impacto del eflujo. - Centrifugar los cultivos a 18.000 x g durante 4 min a 20oC y decantar los medios.
- Añadir 1 ml de solución antibiótica fluorescente (10–100 m en PBS) al pellet, e incubar a 37 oC durante 30 min.
- Centrifugar los cultivos a 18.000 x g durante 7 min a 4oC y decantar los medios.
- Resuspenda las bacterias en 1 ml de PBS frío y repita el paso 4.9.
- Repita el paso 4.10 un total de 4x.
- Si se desea, las bacterias de la lia seglucen añadiendo 180 ml de tampón de lisis (20 mM Tris-HCl, pH 8,0 y 2 mM de EDTA sódico) y, a continuación, 70 ml de lisozyma (72 mg/ml en H2O).
- Incubar a 37oC durante 30 min y, a continuación, congelar-descongelar 3x (78 oC durante 5 min, y luego 34oC durante 15 min).
- Sonicar las muestras durante 20 min, luego calentar a 65 oC durante 30 min.
- Centrifugar las muestras lysed (18.000 x g,8 min) y luego filtrar a través de una membrana de filtro de 10 kDa.
- Lavar el filtro el 4x con 100 s de agua.
- Transfiera el lisado a una placa de pozo negra 96 de fondo plano y mida la intensidad de la fluorescencia en un lector de placas con longitudes de onda de excitación y emisión apropiadas para el fluoróforo (es decir, DMACA:por ejemplo, 400 nm,a em a 490 nm; NBD:ex a 475 nm,a 545 nm.
NOTA: Consulte la Figura 3 para ver ejemplos de análisis espectrofotométricos de bacterias utilizando el antibiótico fluorescente ciprofloxacino etiquetado con NBD. - Para el análisis por citometría de flujo, se pueden utilizar las mismas condiciones de crecimiento y tinción (pasos 4.1–4.17), con cambios únicamente en la preparación final.
- Lleve el volumen total a 1 ml de PBS.
- Lea las muestras en un catómetro de flujo a un caudal de aproximadamente 60 l/min, utilizando la amplificación logarítmica para la adquisición de datos (excitación F1 a 488 nm; emisión a 525/20 nm).
- Registre un total de 10.000 eventos y, a continuación, analice los datos utilizando el software adecuado.
- Trazar la intensidad de la fluorescencia de F1 contra el número de recuentos de eventos, estimando la intensidad media de fluorescencia de los picos del histograma después de que la bacteria se manceló.
NOTA: Consulte la Figura 4 para ver ejemplos de análisis de citometría de flujo de bacterias utilizando el antibiótico ciprofloxacina con etiqueta NBD.
5. Preparación para el análisis microscópico
- Cultivar subcultivos a OD600 a 0,4, en cuanto a la evaluación de MIC, luego dividir en alícuotas de 1 ml y centrífuga a 18.000 x g durante 3-5 min.
- Decantar y desechar los medios, luego resuspender el pellet bacteriano en 500 l de HBSS.
- Centrifugar a 18.000 x g durante 3 min, luego decantar y descartar medios.
- Preparar soluciones de sondas antibióticas en HBSS a concentraciones de 1–100 M.
- Resuspender las bacterias lavadas en 500 s de la solución de la sonda, e incubar a 37 oC durante 30 min.
- Repita el paso 5.3. Para un experimento de etiquetado múltiple, resuspenda el pellet en 500 ml de un tinte de ácido nucleico ortogonalmente coloreado. Para el verde, utilice Syto9 (5 m en HBSS); para el azul, utilice Hoechst 33342 (20 g/ml en HBSS). Incubar a RT durante 15-30 min.
- Repita el paso 5.3, luego resuspenda en 500 s de FM4-64FX (5 g/ml en HBSS) e incuba rinde a RT durante 5 min.
- Repita el paso 5.3, luego resuspenda en 500 sde HBSS y repita el paso 5.3 una vez más.
- Repita el paso 5.8 y, a continuación, suspenda finalmente las bacterias lavadas y tetoridas en 15 ml de medio de montaje (ver Tabla de Materiales).
- Soporte de montaje de pipeta en una diapositiva de microscopio y parte superior con un deslizamiento de cubierta de alto rendimiento, luego selle los bordes con esmalte de uñas transparente.
NOTA: Consulte la Figura 5 para ver ejemplos de imágenes de microscopía confocal tomadas con ciprofloxacino con etiqueta NBD y antibióticos trimetoprim, y la Figura 6 para el antibiótico oxazolidinona (linezolid) con etiqueta DMACA.
Resultados
Figura 1 Ilustra la reacción química de clic clave (A) para la preparación de los antibióticos fluorescentes, y con (B) ejemplos de estructuras de nuestros antibióticos fluorescentes publicados basados en ciprofloxacino (cipro), trimetoprim (TMP), y linezolid. Todas estas sondas fueron sintetizadas a partir de los antibióticos correspondientes a través de un intermedio de azida. Luego se acoplaron a los fluoróforos NBD y DMACA, cada uno funcionalizado con un alquino.
La Figura 2 muestra trazas LCMS de ejemplo de una reacción de clic ciprofloxacin-N3 y NBD-alkyne, donde la azida eluida a 3,2 min y el producto a 3,8 min. Comparación de 1 y 2 muestra cómo el progreso de la reacción de clic podría ser seguido por la desaparición del pico de azida (por detector UV o MS). Spectra 3 demuestra el impacto de la purificación, con picos erróneos desapareciendo de las huellas de la EP y los rayos UV. Tanto la pureza como el progreso de la reacción podrían cuantificarse mediante la integración del pico del producto y cualquier pico de impureza.
La Figura 3 muestra los resultados típicos de la evaluación de la acumulación intracelular por espectroscopia de fluorescencia en presencia y ausencia de eflujo. En este experimento, E. coli fue tratado con TMP-NBD con o sin la adición de CCCP, que colapsa la fuerza motriz de protones (PMF). La fluorescencia intracelular de la bacteria fue significativamente mayor cuando se pretrató con PCCC, lo que indica que el eflujo redujo la acumulación en estas bacterias. Este experimento se repitió utilizando bacterias deficientes en tolC,mostrando la capacidad de este ensayo para examinar el impacto de los componentes individuales de la bomba de eflujo. En este caso, aunque hubo un aumento en la fluorescencia intracelular en comparación con las bacterias de tipo salvaje, la acumulación de PCCC todavía aumentó. Estos hallazgos indican que tolC participa en el eflujo de TMP, pero no es la única bomba de accionamiento PMF involucrada.
La Figura 4 muestra el resultado del mismo experimento que la Figura 2,pero con la acumulación medida por citometría de flujo en lugar de espectroscopia. Se observaron las mismas tendencias de datos, lo que demuestra que cualquiera de las dos técnicas puede utilizarse para estudiar el fenómeno de la acumulación intracelular mediada por eflujo.
La Figura 5 muestra imágenes representativas de microscopía confocal de bacterias grampositivas (S. aureus)y gramnegativas (E. coli) etiquetadas con TMP-NBD (1) y cipro-NBD ( 2+ 3) sondas fluorescentes, respectivamente. En ambos casos, se añadió el tinte de membrana roja FM4-64FX para comparar la colocalización. Para TMP-NBD, también se utilizó el tinte ácido nucleico azul Hoechst-33342. Al superponer estas imágenes, se visualizó la localización del antibiótico en las bacterias. La comparación de los paneles 2 y 3 muestra cómo se examinó el impacto del eflujo, con el inhibidor de eflujo CCCP utilizado en 2, lo que resulta en acumulación intracelular. En el panel 3, no se añadió CCCP. Por lo tanto, el eflujo está activo y no se vio acumulación de sonda.
La Figura 6 muestra imágenes representativas de microscopía confocal de bacterias Gram-positivas (S. aureus) etiquetadas con sonda de oxazolidinona etiquetada con DMACA Lz-NBD. El tinte de membrana roja FM4-64FX fue añadido con el fin de comparar la colocalización, y también se utilizó el tinte ácido nucleico verde Hoechst-33342. Al superponer estas imágenes, se visualizó la localización del antibiótico en las bacterias, mostrando una localización interna distinta de la membrana y el ácido nucleico.
La Tabla 1 muestra los valores MIC para tres series de antibióticos fluorescentes, ciprofloxacino, trimetoprim (TMP) y linezolid (Lz), con datos presentados para los derivados primarios de antibióticos, NBD y DMACA de cada uno. Se eligieron especies representativas para cada antibiótico, incluyendo tanto grampositivo como gramnegativo. Para la serie ciprofloxacina, ambas sondas fluorescentes perdieron actividad antibiótica en comparación con el fármaco principal, pero retuvieron cierta actividad contra todas las especies. Del mismo modo, las sondas de linezolid perdieron cierta actividad, pero siguieron siendo un antibiótico moderado a débil. Las sondas TMP perdieron casi toda la actividad contra bacterias de tipo salvaje, pero fueron activas contra e. colideficiente de eflujo, lo que indica que la pérdida de actividad antibacteriana se debió a la falta de acumulación.

Figura 1: Síntesis y estructuras de sondas derivadas de antibióticos. (A) El esquema de reacción general para la síntesis de sondas de antibióticos fluorescentes a partir de antibióticos de azida y alquinos fluoróforos. (B) Las estructuras de nuestras sondas publicadas basadas en ciprofloxacino, trimetoprim y linezolid. Haga clic aquí para ver una versión más grande de esta figura.
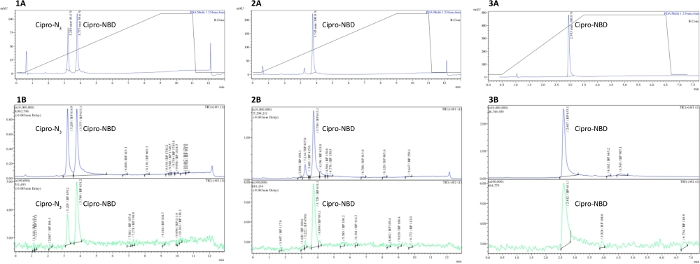
Figura 2: Medición de la pureza de la sonda derivada de antibióticos por LCMS. Rastros analíticos de LCMS de (1) reacciones de clic incompletas, (2) completas y (3) ciprofloxacina purificada HPLC-N3 + NBD-alkyne que demuestran la desaparición del material de partida tras la finalización de la reacción, y picos varios en la purificación. Una traza UV-Vis (absorbancia a 250 nm), B - Traza MS (modo positivo y negativo). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Medición del lector de placas de la acumulación de sonda derivada de antibióticos. Medición espectroscópica de fluorescencia de la acumulación celular de TMP-NBD (50 m) en tipo silvestre (1, ATCC 25922) ytolC (2, ATCC 25922) E. coli incubado (A) con y (B) sin adición de CCCP (100 OM). La significancia estadística (**p a 0,01; ***p a 0,001) se muestra entre la ausencia o presencia de CCCP y entre el tipo salvaje y eltolCE. coli. Los datos reportados son la media de SD para tres experimentos. Esta figura está adaptada de nuestra publicación anterior15,e ilustra el uso de la espectroscopia para dilucidar el papel del eflujo en la acumulación intracelular. Haga clic aquí para ver una versión más grande de esta figura.
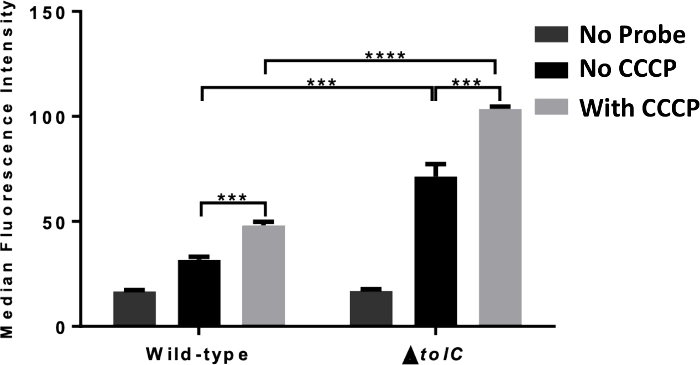
Figura 4: Medición de la citometría de flujo de la acumulación de sonda derivada de antibióticos. Medición de la citometría de flujo de la acumulación celular utilizando TMP-NBD en el tipo salvaje (1, ATCC 25922) y eltolC (2, ATCC 25922) E. coli incubado con y sin adición de PcCC (100 m). La mediana de la actividad de fluorescencia se muestra a partir de 10.000 eventos bacterianos, Se muestra la importancia estadística (***, p a 0,001; ****, p a 0,0001) entre la ausencia y la presencia de PCCC y entre el tipo silvestre y eltolCE. coli. Los datos reportados son la media de SD para tres experimentos. Esta figura está adaptada de nuestra publicación anterior15,e ilustra el uso de la citometría de flujo para dilucidar el papel del eflujo en la acumulación intracelular. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Visualización por microscopía confocal de la localización de la sonda NBD. Imágenes de microscopía confocal de 1) S. aureus en vivo etiquetado con Hoechst-33342 (azul, ácido nucleico), TMP-NBD (verde), FM4-64FX (rojo, membrana), y superpuesto; 2) E. coli vivo tratado con CCCP (inhibidor de eflujo) etiquetado con cipro-NBD (verde), FM4-64FX (rojo, membrana) y superpuesto; 3) E. coli vivo etiquetado con cipro-NBD (verde), FM4-64FX (rojo, membrana), y superpuesto. Esta figura está adaptada de nuestras publicaciones anteriores15,16,e ilustra el uso de la microscopía para examinar la localización de la sonda, incluido el impacto del eflujo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Visualización por microscopía confocal de la localización de la sonda DMACA. Imágenes de microscopía confocal de S. aureus en vivo etiquetado con sonda oxazolidinona Lz-DMACA (azul), Verde Sytox (verde, ácido nucleico) y FM4-64FX (rojo, membrana). Haga clic aquí para ver una versión más grande de esta figura.
| MIC (g/mL) | |||||||||||
| Especies | Cepa | Cipro | Cipro-NBD | Cipro-DMACA | Tmp | TMP-NBD | TMP-DMACA | Linezolid (Lz) | Lz-NBD | Lz-DMACA | |
| Staphylococcus aureus | ATCC 25923 | 0.125 - 0.5 | 32 - 64 | 16 | 1 | 16 | >64 | ||||
| ATCC 43300 | 1 | 16 | >64 | ||||||||
| Streptococcus pneumoniae | ATCC 700677 | 1 | 4 | 64 | |||||||
| Enterococcus faecium | ATCC 35667 | 1 - 8 | 32 | 32 - 64 | |||||||
| ATCC 51559 | 2 | 16 | 32 | ||||||||
| Klebsiella pneumoniae | ATCC 13883 | 0.015 - 0.06 | 8 - 16 | 8 - 32 | |||||||
| Pseudomonas aeruginosa | ATCC 27853 | 0.25 - 1 | 32 - 64 | 32 - 64 | |||||||
| Escherichia coli | ATCC 25922 | 0,004 | 8 | 2 | 0.5 | >64 | >64 | ||||
| Mutante de la C.OC | 0.125 | 0.25 | 2 | ||||||||
Tabla 1. Actividades antibióticas de sondas antibióticas fluorescentes basadas en ciprofloxacino, trimetoprim y linezolid contra cepas bacterianas apropiadas clínicamente relevantes, medida por ensayos MIC de microdilución de caldo. En la mayoría de los casos, las sondas perdieron cierta actividad en comparación con el fármaco principal, pero retuvieron cierta potencia antibiótica mensurable (suficiente para ser útil en estudios posteriores).
Discusión
La creación de una sonda de antibióticos fluorescentes exitosa debe comenzar con una planificación cuidadosa y la consideración de la RAE de la droga principal. Si el SAR no se conoce o se explora completamente, es posible que sea necesario probar varias opciones para encontrar un sitio que pueda ser modificado selectivamente sin abolir la actividad biológica. Una vez que se ha identificado un sitio o sitios, la instalación de una mitad del vinculador es a menudo esencial con el fin de proporcionar un espaciado escoseado entre el sitio biológico de acción y el fluoróforo inactivo. Se debe tener cuidado de que la reacción utilizada para unir el vinculador al antibiótico deje un grupo funcional bioestable, evitando, por ejemplo, ésteres susceptibles a la escisión por esterasas in vivo. Dependiendo del perfil farmacodinámico y farmacocinético del antibiótico, se puede utilizar un vinculador de alquilo simple, o de lo contrario se debe considerar una opción menos lipofílica como un vinculador de polietilenglicol (PEG). Con el vinculador unido, se debe evaluar la actividad antibacteriana para garantizar que los CIC contra las bacterias pertinentes sean similares al compuesto principal.
En este trabajo, recomendamos el uso de Huigsen azide-alkyne [3+2] cicloadición dipolar (haga clic en química, ver Figura 1) para ligar el fluoróforo a antibiótico, por una serie de razones. Las reacciones de clic son altamente selectivas, lo que significa que la protección de los grupos reactivos en el antibiótico no es necesaria, y además, la reacción deja una mitad de triazol estable y biocompatible. El componente azida se introduce en la porción de antibióticos en nuestros procedimientos, ya que esto generalmente se logra más fácilmente con una variedad de tipos estructurales que la introducción de un alquino. Las síntesis de dos fluoróforos derivados de alquino se describen aquí, aunque otras podrían ser exploradas si se desea. NBD y DMACA fueron elegidos debido a su pequeño tamaño, minimizando la posibilidad de interferir con la penetración celular y la interacción objetivo. La reacción de clic en sí se lleva a cabo utilizando catálisis de cobre, donde se puede utilizar Cu2+ (CuSO4, con un agente reductor de ácido ascórbico) o Cu+ (CuI) como reactivo inicial. Después de la purificación(Figura 2),los CIC deben probarse al igual que con la azida. Incluso teniendo en cuenta cuidadosamente la elección del fluoróforo y el lugar de fijación, es posible que se observe una mala actividad antibiótica. Sin embargo, esto no significa que una sonda inactiva no sea útil. Como se muestra con las sondas TMP, los compuestos con mala actividad antibacteriana todavía pueden unirse al mismo objetivo que el medicamento principal. Esto puede permitir estudios sobre el modo de acción y el examen de fenómenos que conducen a la resistencia, como el eflujo.
Como se describe en la sección de protocolos, es posible analizar el etiquetado bacteriano mediante los antibióticos fluorescentes utilizando un ensayo simple de espectrofotometría (Figura 3) o citometría de flujo(Figura 4). Ambos métodos son capaces de cuantificar la acumulación celular, y al lysing células y examinar la localización de fluorescencia en el lisato, es posible evaluar la acumulación intracelular. En este protocolo, se describe el uso de lisozyme para la lisis celular, ya que se trata de una técnica rápida y universal. Otras afecciones de lisis, como el tratamiento durante la noche con glicina-HCl7,también se han utilizado con éxito. Utilizando esta técnica, es posible estudiar el impacto del eflujo en la acumulación celular de antibióticos, que es un mecanismo importante de resistencia. Si el eflujo está presente en las bacterias, se observará una falta de acumulación intracelular, aunque esto puede ser rescatado usando un inhibidor de eflujo como CCCP.
La microscopía también se puede llevar a cabo para inspeccionar visualmente la localización de la sonda en diferentes bacterias, obteniendo información sobre el modo de acción, y potencialmente también resistencia (ver Figura 5 para ejemplos representativos). Para ver la localización dentro de las bacterias, se requiere un microscopio confocal de alta resolución, equipado con capacidades tales como SIM (microscopía de iluminación estructurada), SR-SIM (superresolución-SIM), Airyscan o STED (agotamiento de emisiones estimulada). Además, se deben utilizar comprobaciones de cubierta de alto rendimiento y realizar análisis posteriores a la toma de imágenes en un software adecuado (por ejemplo, FIJI, Zen o Imaris). La localización de sondas se compara con tintes que manchan arquitecturas específicas, como Hoechst-33342 (azul, ácido nucleico), Syto-9 (verde, ácido nucleico) y FM4-64FX (rojo, membrana). La elección de los colorantes debe hacerse para que coincida con el antibiótico fluorescente, de modo que cada color utilizado tenga una superposición espectral mínima. Para obtener las mejores imágenes posibles, puede ser necesaria una optimización. Por ejemplo, si las bacterias están demasiado abarrotadas en el portaobjetos, tome sólo una parte del pellet suspendido y luego diluya con más medio de montaje. Por el contrario, si las bacterias son demasiado escasas en la diapositiva, simplemente comience con más bacterias. En este protocolo, se recomienda el uso de un gel termoreversible que es compatible con células vivas (por ejemplo, Cygel) para imágenes de células vivas, ya que inmoviliza bacterias (incluidas las bacterias móviles), pero también se han utilizado con éxito otros medios de montaje o agarosa.
En general, a pesar de los desafíos que pueden enfrentarse en la preparación de un antibiótico fluorescente biológicamente activo, la simplicidad de su uso y su versatilidad hacen que estas sondas sean atractivas herramientas para la investigación en AMR. El trabajo futuro con antibióticos fluorescentes tiene el potencial de proporcionar información sobre los mecanismos de resistencia a los antibióticos, mejorar nuestra comprensión de cómo funcionan los antibióticos actuales y ayudar al desarrollo de mejores medicamentos.
Divulgaciones
Los autores no tienen nada que declarar.
Agradecimientos
MRLS cuenta con el apoyo de un Premio Australiano de Posgrado (APA) y un Premio al Avance de la Investigación del Instituto de Biociencias Moleculares. Wanida Phetsang recibió el apoyo de la UQ International Scholarship (UQI) y el IMB Postgraduate Award (IMBPA). MAC es un investigador de principios de la NHMRC (APP1059354) y también tiene un nombramiento de profesor fraccionado en la Universidad de Queensland, con su tiempo restante como CEO de Inflazome Ltd, una empresa que desarrolla medicamentos para abordar las necesidades clínicas no satisfechas en enfermedades inflamatorias. MATB es apoyado en parte por Wellcome Trust Strategic Grant WT1104797/Z/14/Z y NHMRC Development grant APP1113719. La microscopía se realizó en la Australian Cancer Research Foundation (ACRF)/Institute for Molecular Bioscience Cancer Biology Imaging Facility, que se estableció con el apoyo de la ACRF.
Materiales
| Name | Company | Catalog Number | Comments |
| 3-(dimethylamino)phenol | Alfa-Aesar | B23067 | |
| 4-chloro-7-nitro-benzofuran | Sigma-Aldrich | 163260-5G | |
| Amicon Ultra-0.5 centrifugal filter unit with Ultracel- 10 membrane | Merck | UFC501096 | |
| Atlantis Prep T3 OBD (100 A, 5 uM, 10x250 mm) | Waters | 186008205 | |
| Atlantis T3 column (100 A, 5 uM, 2.1 × 50 mm) | Waters | 186003734 | |
| Bruker Avance 600 MHz spectrometer | Bruker | ||
| Buchi Reveleris C18 12g Cartridge | Buchi | BUC145152103 | |
| CCCP | Sigma-Aldrich | C2759 | |
| Celite 545 | Sigma-Aldrich | 22140-5KG-F | |
| Cygel | ABCAM | Ab109204 | |
| Elyra PS,1 SIM/STORM confocal microscope | Zeiss | ||
| FM4-64FX, fixable analog of FM™ 4-64 membrane stain | Life Technologies Australia Pt | F34653 | |
| Gallios flow cytometer | Beckman Coulter | ||
| Gamma 2-16 LSCplus lyophilise | CHRIST | ||
| Gilson HPLC 2020 | Gilson | ||
| Hanks' Balanced Salt solution, Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | H6648-500ML | |
| Hettich Zentrifugen Rotofix 32 | Hettich | ||
| High performance #1.5 cover slips (18 x 18 mm) | Schott/Zeiss | 474030-9000-000 | |
| Hoechst 33342, Trihydrochloride, Trihydrate - Fluo | Life Technologies Australia Pt | H21492 | |
| LB | AMRESCO | J106 | |
| Leica STED 3X Super Resolution Microscope with White Light Laser excitation | Leica | ||
| Lysozyme from chicken egg white lyophilized powder | Sigma-Aldrich | L6876 | |
| Mueller Hinton II Broth Cation adjusted | Becton Dickinson | 212322 | |
| Propargylamine | Sigma-Aldrich | P50900-5G | |
| Reveleris GRACE MPLC | Buchi | ||
| Shimadzu LCMS-2020 | Shimadzu | ||
| Sigma 1-15 Microcentrifuge | Sigma-Aldrich | ||
| Silica gel 60 (0.040-0.063 mm) for column chromatography (230-400 mesh ASTM) | Merck | 1093859025 | |
| SYTO 9 Green Fluorescent Nucleic Acid Stain | Life Technologies Australia Pt | S34854 | |
| TECAN Infinite M1000 PRO | TECAN |
Referencias
- Cai, H., Rose, K., Liang, L. H., Dunham, S., Stover, C. Development of a liquid chromatography/mass spectrometry-based drug accumulation assay in Pseudomonas aeruginosa. Analytical Biochemistry. 385 (2), 321-325 (2009).
- Bhat, J., Narayan, A., Venkatraman, J., Chatterji, M. LC-MS based assay to measure intracellular compound levels in Mycobacterium smegmatis: Linking compound levels to cellular potency. Journal of Microbiological Methods. 94 (2), 152-158 (2013).
- Davis, T. D., Gerry, C. J., Tan, D. S. General Platform for Systematic Quantitative Evaluation of Small-Molecule Permeability in Bacteria. ACS Chemical Biology. 9 (11), 2535-2544 (2014).
- Richter, M. F., et al. Predictive compound accumulation rules yield a broad-spectrum antibiotic. Nature. 545, 299 (2017).
- Iyer, R., et al. Evaluating LC-MS/MS To Measure Accumulation of Compounds within Bacteria. ACS Infectious Diseases. 4 (9), 1336-1345 (2018).
- Prochnow, H., et al. Subcellular Quantification of Uptake in Gram-Negative Bacteria. Analytical Chemistry. 91 (3), 1863-1872 (2019).
- Dumont, E., et al. Antibiotics and efflux: combined spectrofluorimetry and mass spectrometry to evaluate the involvement of concentration and efflux activity in antibiotic intracellular accumulation. Journal of Antimicrobial Chemotherapy. 74 (1), 58-65 (2019).
- Stone, M. R. L., Butler, M. S., Phetsang, W., Cooper, M. A., Blaskovich, M. A. T. Fluorescent Antibiotics: New Research Tools to Fight Antibiotic Resistance. Trends in Biotechnology. 36 (5), 523-536 (2018).
- Piddock, L. J. V., Johnson, M. M. Accumulation of 10 fluoroquinolones by wild-type or efflux mutant Streptococcus pneumoniae. Antimicrobial Agents and Chemotherapy. 46 (3), 813-820 (2002).
- Mortimer, P. G. S., Piddock, L. J. V. A comparison of methods used for measuring the accumulation of quinolones by enterobacteriaceae, pseudomonas aeruginosa and staphylococcus aureus. Journal of Antimicrobial Chemotherapy. 28 (5), 639-653 (1991).
- Li, X. Z., Nikaido, H., Poole, K. Role of MexA-MexB-OprM in antibiotic efflux in Pseudomonas aeruginosa. Antimicrobial Agents and Chemotherapy. 39 (9), 1948-1953 (1995).
- Vince, R., Weiss, D., Pestka, S. Binding of N-substituted erythromycylamines to ribosomes. Antimicrobial Agents and Chemotherapy. 9 (1), 131-136 (1976).
- Vazquez, D. Antibiotics affecting chloramphenicol uptake by bacteria Their effect on amino acid incorporation in a cell-free system. Biochimica et Biophysica Acta (BBA) - Nucleic Acids and Protein Synthesis. 114 (2), 289-295 (1966).
- Phetsang, W., et al. An azido-oxazolidinone antibiotic for live bacterial cell imaging and generation of antibiotic variants. Bioorganic and Medicinal Chemistry. 22 (16), 4490-4498 (2014).
- Phetsang, W., et al. Fluorescent trimethoprim conjugate probes to assess drug accumulation in wild type and mutant Escherichia coli. ACS Infectious Diseases. 2 (10), 688-701 (2016).
- Stone, M. R. L., et al. Fluoroquinolone-derived fluorescent probes for studies of bacterial penetration and efflux. MedChemComm. 10 (6), 901-906 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados