Method Article
Visualização da resistência bacteriana usando sondas de antibióticos fluorescentes
Neste Artigo
Resumo
Antibióticos fluorescentes são ferramentas poderosas que podem ser usadas para estudar múltiplos aspectos da resistência antimicrobiana. Este artigo descreve a preparação de antibióticos fluorescentes e sua aplicação para estudar a resistência a antibióticos em bactérias. As sondas podem ser usadas para estudar mecanismos de resistência bacteriana (por exemplo, efflux) por espectrofotometria, citometria de fluxo e microscopia.
Resumo
Antibióticos fluorescentes são ferramentas de pesquisa multiuso que são prontamente utilizadas para o estudo da resistência antimicrobiana, devido à sua vantagem significativa sobre outros métodos. Para preparar essas sondas, os derivados azidas de antibióticos são sintetizados, em seguida, juntamente com alquine-fluoroforres usando azide-alkyne dipolar cicloaddition por química click. Após a purificação, a atividade antibiótica do antibiótico fluorescente é testada por avaliação mínima de concentração inibitória. Para estudar o acúmulo bacteriano, pode ser utilizada espectrofometria ou citometria de fluxo, permitindo uma análise muito mais simples do que os métodos que dependem de derivados radioativos de antibióticos. Além disso, a microscopia confocal pode ser usada para examinar a localização dentro da bactéria, com informações valiosas sobre o modo de ação e mudanças que ocorrem em espécies resistentes. O uso de sondas fluorescentes de antibióticos no estudo da resistência antimicrobiana é um método poderoso com muito potencial para expansão futura.
Introdução
A resistência antimicrobiana (RMM) é uma crise crescente que representa uma grande ameaça à saúde humana em todo o mundo. A resistência à maioria dos antibióticos foi relatada, e infecções causadas por bactérias resistentes a todos os medicamentos clinicamente disponíveis estão surgindo. Para combater a ascensão da RMA, precisamos aumentar nossa compreensão deste fenômeno multifacetado e dos mecanismos e interações subjacentes entre antibióticos e bactérias. Um aspecto historicamente mal compreendido é a permeação de antibióticos em bactérias, juntamente com os fenômenos do acúmulo e da efflux. Esse conhecimento é crucial na concepção de novas drogas e na compreensão de mecanismos de resistência. Assim, isso desempenha um papel crítico na pesquisa da RMM.
Existem duas abordagens principais que podem ser tomadas para medir a concentração de antibióticos: medir a droga diretamente ou marcar com um moiety projetado para facilitar a quantificação. Embora a marcação do antibiótico melhore a detecção, isso pode perturbar a atividade biológica da droga, como atividade antimicrobiana e permeabilidade. Este não é um problema para métodos não marcados; no entanto, a detecção pode ser desafiadora. Nos últimos anos, os avanços tecnológicos levaram a um boom de pesquisas utilizando espectrometria de massa (MS) para medir diretamente a concentração de antibióticos em bactérias1,2,3,4,5,6,7. Esses estudos mostraram que é possível estudar o acúmulo intracelular em uma variedade de bactérias, com bactérias gram-negativas as mais estudadas. A quantificação da permeabilidade das moléculas tem sido então ligada à atividade e usada para informar o desenvolvimento de medicamentos2,3,4, embora seja preciso ter cautela ao confundir diretamente o acúmulo e a atividade-alvo5. Antes do desenvolvimento de EsM, os únicos antibióticos cuja concentração poderia ser diretamente medida foram aqueles que possuem fluorescência intrínseca, como tetraciclina e as quinolones8,9,10,11. Embora obviamente limitado em escopo, acúmulo e efflux foram examinados e quantificados, ilustrando a utilidade da quantificação baseada em fluorescência.
Antibióticos marcados têm sido usados por muitas décadas para estudar distribuições, modos de ação e resistência, com tags radioativas e fluorescentes sendo comuns. Sondas marcadas por rádio têm a vantagem de serem quase idênticas ao composto pai, portanto, é improvável que a atividade biológica seja significativamente diferente. Isótopos como 3H, 14C e 15N têm sido frequentemente usados devido à proeminência desses elementos em antibióticos, e uma variedade de andaimes antibióticos foram examinados1,10,12,13. Embora a detecção de radiosondas seja simples, há uma série de preocupações logísticas (por exemplo, segurança, isótopos de meia-vida) que limitaram o uso dessa abordagem. Outra estratégia são antibióticos fluorescentes. Essas sondas podem ser usadas para examinar a distribuição e os modos de ação e resistência da droga-mãe, usando tecnologia mais simples do que a Ems e sem os problemas logísticos da radiação8. A principal desvantagem para essa abordagem é que os antibióticos são geralmente moléculas relativamente pequenas, daí a introdução de um moiety fluorescente representa uma mudança química significativa. Essa alteração pode impactar propriedades fisioquímicas e atividade antibacteriana. Portanto, deve-se ter cuidado para avaliar esses fatores para gerar resultados representativos do antibiótico pai.
Neste trabalho, um método é descrito para sintetizar, avaliar e usar antibióticos fluorescentes, como em nossas publicações anteriores14,15,16. Através de trabalhos anteriores, vários antibióticos fluorescentes foram preparados e usados para uma variedade de propósitos (ver Stone et al.8). Para minimizar a probabilidade de impactar a atividade biológica, fluoroforres muito pequenos são utilizados neste trabalho: nitrobenzoxadiazol (NBD, verde) e 7-(dimetilamino)-2-oxo-2H-cromado-4-yl (DMACA, azul). Além disso, é descrita a avaliação da atividade antibacteriana utilizando o ensaio de concentração mínima de inibição de diluição de microbroche (MIC), para que o efeito das modificações na atividade possa ser medido. Essas sondas fluorescentes podem ser usadas em ensaios espectrofotométricos, citometria de fluxo e microscopia. A gama de aplicações possíveis é onde reside a vantagem dos antibióticos fluorescentes. O acúmulo de celular pode ser quantificado, categorizado e visualizado, algo que não é possível usando apenas esm. Espera-se que o conhecimento adquirido através do uso de antibióticos fluorescentes ajude na nossa compreensão da resistência e na luta contra a RM.
Protocolo
1. Síntese de Alkyne-fluoroforres
- Síntese de NBD-alkyne (7-nitro-N-(prop-2-yn-1-yl)benzo[c][1,2,5]oxadiazol-4-amine)
- Dissolva 1.031 mg de 4-chloro-7-nitro-benzofuran (5.181 mmol) em 60 mL de tetrahidrofurano (THF). Adicione 1.857 mg de CsCO3 (5.696 mmol), depois 0,39 mL de propargylamina (6,1 mmol). Aqueça a reação a 50 °C por 2 h, que passará de marrom para verde, depois esfrie para temperatura ambiente (RT).
- Filtre a reação usando um aparelho de filtragem (ver Tabela de Materiais)e lave com acetato etílico (EA). Concentre o filtramento pressão reduzida, depois dissolva o resíduo em 150 mL de EA e passe para um funil de separação de 500 mL.
- Lave a solução EA com 100 mL com água e salmoura, respectivamente. Em seguida, misture as fases aquosas e lave 2x com 100 mL de EA.
- Seque as fases orgânicas combinadas sobre sulfato de magnésio anidro, depois filtre e concentre-se pressão reduzida.
- Purificar o produto bruto por cromatografia flash em gel de sílica (20-30% EA em éter de petróleo [PE]), verificando a pureza por espectrometria de massa de cromatografia líquida (LCMS, [M+H]+ = 219,1) e/ou ressonância magnética nuclear (NMR), mudanças químicas da seguinte forma:
1 H NMR (CD3OD, 600 MHz) δ 8.54 (d, J = 8,7 Hz, 1H), 6,35 (d, J = 8,4 Hz, 1H), 4,31 (dd, J = 5,7 Hz, J = 2,5 Hz, 2H), 2,43 (t, J = 2,5 Hz, 1H); 13 C NMR (CD3OD, 150 MHz) δ 144.3, 143.7, 142.2, 135.8, 125.7, 100.0, 76,5, 74.2, 33,4.
NOTA: Ao realizar a purificação pela cromatografia do gel de sílica, prepare a coluna usando o menos polar dos solventes listados. O composto bruto pode ser carregado como uma solução concentrada ou adsorlado na sílica se a solubilidade não permitir. Depois que o composto foi adicionado ao topo da sílica, passe por volumes de coluna de 1-2 do mesmo solvente usado para muslica molhada. Em seguida, comece com a relação solvente listada, passando pelo volume de pelo menos 1 coluna de cada solvente, e certificando-se de não fazer grandes saltos na composição de solventes. Colete frações e verifique a pureza/identidade por LCMS ou TLC (cromatografia de camada fina). Combine frações puras e concentre-se pressão reduzida por evaporação rotativa.
- Síntese de DMACA-alkyne (2-(7-(dimetilamino)-2-oxo-2H-cromado-4-yl)-N-(prop-2-yn-1-yl)acetamide).
- Dissolva 5,02 g de 3-(dimetilamino)fenol (36,6 mmol) em 30 mL de etanol, em seguida, adicione 6,7 mL de diethyl 1,3-acetonedicarboxylate (36 mmol). Adicione 10,5 g de ZnCl2 (77,2 mmol), depois refluxo a solução vermelha por 42 h. Adicione mais 9,20 g de ZnCl2 (67,6 mmol), em seguida, refluxo para 8 h.
- Esfrie a reação e concentre-se pressão reduzida. Disperse o sólido vermelho resultante em 200 mL de EA, filtro, em seguida, transfira para um funil de separação de 500 mL.
- Lave o EA com 200 mL cada água e salmoura, depois seque sobre sulfato de magnésio de anidro. Filtre a fase orgânica seca e concentre-se pressão reduzida.
- Purificar o sólido vermelho (etiletilamino)-2-oxo-2H-cromado-4-yl)acetato) por cromatografia flash em gel de sílica (0-100% EA em PE), verificando a pureza por LCMS ([M+H]+ = 275,1) e/ou NMR, mudanças químicas da seguinte forma:
1 H NMR (CDCl3,600 MHz) δ 7.30 (d, J = 8,9 Hz, 1H), 6,52 (dd, J = 8,9 Hz, J = 2,6 Hz, 1H), 6,40 (d, J = 2,6 Hz, 1H), 5,87 (m, 1H), 2,96 (m, 8H), 2,25 (d, J = 1,2 Hz, 3H). - Dissolver 488 mg de etilo 2-(7-(dimetilamino)-2-oxo-2H-chromen-4-yl)acetato (1,18 mmol) em 10 mL de THF, em seguida, adicionar uma solução de 157 mg de LiOH· H2O (3,74 mmol) em 15 mL de água. Mexa a reação na RT por 3 h, depois mova-se para um funil separado e dilua com mais 50 mL de água.
- Lave a mistura de reação 2x com 50 mL de eter diethyl (Et2O), em seguida, lave a fase orgânica combinada 2x com 25 mL de água. Tome qualquer precipitação amarela com a camada orgânica. Concentre a fase orgânica pressão reduzida usando um evaporador rotativo.
- Acidifique a fase aquosa para pH = 2 com HCl concentrado, e esfrie até 4 °C durante a noite. Filtre a fase aquosa acidificada e adicione o sólido amarelo à fase orgânica concentrada.
NOTA: O ácido acético 2-(7-(7-(dimetilamino)-2-oxo-2H-cromado-4-yl)ácido acético pode ser usado sem maior purificação, mas isso pode ser verificado por LCMS ([M+H]+ = 247,1) e/ou NMR, mudanças químicas da seguinte forma:
1 H NMR (CDCl3,600 MHz) δ 7.41 (d, J = 9,0 Hz, 1H), 6,62 (dd, J = 9,2 Hz, J = 2,8 Hz, 1H), 6,52 (d, J = 2,8 Hz, 1H), 5,98 (d, J = 0,9 Hz, 1H), 3,05 (s, 6H), 2,35 (d, J = 0,9 Hz, 2H); 13 C NMR (CDCl3,150 MHz) δ 162.2, 155.7, 152.9, 152.8, 125.3, 109.7, 109.3, 109.1, 108.8, 98,3, 40.2, 18,5. - Dissolva 466 mg de ácido acético de 2-(7-(7-(dimetilamino)-2-oxo-2H-cromado-4-yl)ácido acético (1,89 mmol) em 7 mL de Nseco,N-dimetilformamida (DMF) e coloque uma atmosfera de nitrogênio.
- Dissolver 0,33 mL de propargylamina (5,1 mmol) em 7 mL de DMF seco nitrogênio. Adicione 1,30 mL de amina di-isopropilethyl (DIPEA, 7,50 mmol) à solução de tintura, depois 535 mgde O-(1H-6-clororobenzotriazol-1-yl)-1,1,3-tetrametiluronium hexafluorophophophofato (HCTU, 1,29 mmolmol). Mexa a solução de tinta ativada por 15 min na RT, depois adicione a solução de amina em sentido e deixe se mexer durante a noite.
- No dia seguinte, diluir a reação com 35 mL de água e concentrar-se pressão reduzida.
- Particione o sólido laranja resultante entre EA e salmoura (100 mL cada) em um funil de separação de 250 mL. Separe as camadas (execute as duas camadas em diferentes frascos) e lave a fase aquosa com 100 mL de EA.
- Concentre as fases orgânicas combinadas pressão reduzida e, em seguida, redissolva o sólido laranja em 3 mL de 1:1 aceonitrila (ACN)/água (v/v). Purificar o produto bruto injetando em um sistema de cromatografia líquida de média pressão (MPLC) de fase inversa equipado com uma coluna de cartuchoC18 (solvente A: água, solvente B: ACN).
- Verifique as frações de pureza por LCMS ([M+H]+ = 284,1, alterações químicas nmr dadas abaixo), em seguida, combinar e lyofamizar frações apropriadas para dar 2-(7-(dimetilamino)-2-oxo-2H-cromado-4-yl)-N-(prop-2-yn-1-yl)acetamide, nmr mudanças químicas como segue:
1 H NMR (600 MHz, DMSO-d6) δ 8.65 (t, J = 5,4Hz, 1H), 7,52 (d, J = 9,0Hz, 1H), 6,72 (dd, J = 9,1, 2,6 Hz, 1H), 6,55 (d, J = 2,6 Hz, 1H), 6,00 (s, 1H), 3.88-3.87 (m, 2H), 3,62 (s, 2H), 3,13 (t, J = 2,5 Hz, 1H), 3.01 (s, 6H); 13 C NMR (125 MHz, DMSO-d6) δ 167.7, 160.7, 155.4, 152.9, 151.0, 126.0, 109.4, 109.1, 108.1, 97,5, 80.9, 73,3, 39,7, 38.4, 28,2.
2. Síntese de Antibióticos Fluorescentes
- Prepare um azide-derivado de um antibiótico como descrito anteriormente14,15,16.
NOTA: O procedimento é específico para cada antibiótico e requer um exame cuidadoso da relação de atividade da estrutura (SAR) da molécula-mãe para garantir que o antibiótico funcional mantenha a atividade comparável ao pai. (por exemplo, ciprofloxacina16, linezolid14, e trimethoprim15). Veja a Figura 1 como exemplos de antibióticos fluorescentes publicados e o esquema geral de síntese. - Clique no procedimento de reação A
NOTA: Para a maioria dos antibióticos, siga o procedimento detalhado aqui para huisgen catalisado de cobre [2+3] cicloaddition de azide (passo 2.1) e alquine fluorescente (preparado na etapa 1).- Coloque o antibiótico azide em um frasco inferior redondo e adicione tert-butanol(tBuOH) e água (1:1 v/v, 25 mL cada por azide mmol).
- Adicione o fluoroforre-alquina preparado na etapa 1.1 (3 eq.) e aqueça a reação a 50 °C. Em seguida, adicione sulfato de cobre (100 mM na água, 0,6 eq.) à reação, seguido de ácido ascórbico (500 mM na água, 2,4 eq.).
- Mexa a reação a 50 °C por 1 h, ou até análise por LCMS mediante indicação da conclusão da reação (consumo completo de azide inicial).
- Esfrie a reação e purificar conforme apropriado para o andaime antibiótico e proceda para purificação pela etapa 2.3 ou 2.4.
NOTA: Vários métodos diferentes de purificação são possíveis, dependendo da polaridade e estabilidade do andaime.
- Clique no procedimento de reação B
NOTA: Siga este procedimento para antibióticos à base de peptídeos, para fornecer condições de reação mais fortes (trabalho inédito, Phetsang, 2019).- Coloque o peptídeo azida-antibiótico em um frasco inferior redondo e adicione DMF suficiente (750 mL/mmol azide) para dissolver.
- Adicione o fluorofófo-alquina preparado na etapa 1 (5 eq.) e aqueça a reação a 50 °C por 1 h.
- Adicione cobre (I) iodeto (20 q.), depois DIPEA (120 q.), depois ácido acético (240 q.).
- Mexa a reação a 50 °C por 1 h, ou até que a análise por LCMS indique conclusão de reação (ou seja, consumo completo de azide inicial). Esfrie a reação e prossiga para purificação pelo método 1 (ver passo 2.3).
- Método de purificação 1 (usado para ciprofloxacina, trimetoprim e linezolid)
- Injete a reação do clique resfriado diretamente em uma coluna de cartuchos MPLC C18.
- Incorpore uma longa fase de lavagem (cerca de 10 min) no início da corrida (100% solvente A), em seguida, execute um gradiente até 100% solvente B, seguido de um retorno ao solvente A.
NOTA: Solvente A pode ser escolhido a partir de água, 0,05-0,1% ácido fórmico (FA) na água, 0,05-0,1% ácido trifluorocético (TFA) na água, dependendo da solubilidade, estabilidade e da melhor resolução dos picos. Solvente B pode ser escolhido entre acetonitrila (ACN), 0,05-0,1% FA na ACN, 0,05-0,1% TFA na ACN, para igualar solvente A. Se a elusão se mostrar difícil, o metanol pode ser usado no lugar da ACN. - Coletar e combinar frações apropriadas, como indicado pela LCMS e cor (massa correta vista, pico singular), então liofilize para dar o (semi)puro antibiótico fluorescente.
- Purificar ainda mais o produto, se necessário. Avalie a pureza por NMR e/ou LCMS e a cromatografia líquida de alta pressão (HPLC), utilizando uma coluna e método apropriados para o andaime.
- Método de purificação 2
NOTA: Se a solubilidade permitir, a preepurificação pode ser realizada pelo trabalho aquoso (usado para macrolides, trabalho inédito, Pedra 2019).- Diluir a reação de clique resfriado com água e Et2O (1:1 v/v, aproximadamente 10 vezes diluição do volume inicial de reação), transferindo-se para um funil separador de tamanho apropriado.
- Separe as camadas e lave a fase aquosa duas vezes com Et2O.
- Lave as fases orgânicas combinadas 2x com água (volume igual com fase orgânica), depois seque sobre Na2SO4.
- Filtre a fase orgânica seca e concentre-se pressão reduzida.
- Purificar o produto bruto pela MPLC e/ou HPLC descrito na etapa 2.4.4.
NOTA: Veja a Figura 2 como exemplos de traços LCMS de reação de clique incompletos, completos e purificados. Os rendimentos purificados típicos para as reações de clique antibiótico-fluoroforre variam de 30 a 80%.
ATENÇÃO: A maioria dos produtos químicos usados nessas sintes possuem riscos específicos de segurança. A cautela deve ser tomada o tempo todo, incluindo o uso de equipamentos de proteção individual. Et2O, tBuOH, FA, ácido acético, PE, EA, THF, ACN, DMF, EtOH, DIPEA, propargylamina e HCTU são todos inflamáveis; evitar contato com fontes de calor ou faísca. THF, propargylamina, DIPEA, tBuOH, FA, DMF e PE são todos tóxicos; evitar exposição. Propargylamina, CsCO3, ZnCl2, LiOH-H2O, DIPEA, CuI, FA, ácido acético e HCl são todos corrosivos; evitar contato e estar atento ao contato superficial. ZnCl2, CuSO4,CuI e PE apresentam riscos ambientais; estar atento às condições de descarte. ThF pode formar peróxidos explosivos; tome cuidado com as condições de armazenamento. Azidas orgânicas são explosivas; tomar cuidado especialmente com a produção em larga escala.
3. Avaliação da Atividade Antimicrobiana
NOTA: Todo o trabalho envolvendo bactérias deve ser realizado em condições estéreis para evitar a contaminação do ensaio ou do laboratório. Todos os meios de comunicação devem ser autolavados antes do uso, e o plástico e equipamentos como pipetas devem ser mantidos estéreis. Recomenda-se que o trabalho seja feito em um capô de biocontenção (tipo 2).
- Os estoques de glicerol de raia de cepas bacterianas apropriadas para o andaime antibiótico no ágar de caldo lisogeniano (LB, preparado pelas instruções do fabricante) e crescem durante a noite a 37 °C.
NOTA: A escolha das bactérias para testar a atividade antibacteriana deve ser feita com base no andaime antibiótico que está sendo usado. Uma faixa representativa de 5 a 10 bactérias deve ser escolhida a partir da espécie que é conhecida por ser suscetível ao antibiótico, considerando-se as capacidades logísticas do laboratório. Se possível, bactérias resistentes também devem ser testadas. O protocolo dado abaixo funcionará na maioria das bactérias, mas verifique se são necessárias condições especiais (por exemplo, CO2,mídia especial) e faça alterações conforme necessário. As bactérias com sucesso que usam essas condições incluem Staphylococci, Streptococci, Bacilli, E. coli, Klebsiella pneumoniae, Pseudomonas aeruginosa e Enterococcus faecium. - Escolha uma única colônia da placa, e cultura durante a noite em 5 mL de caldo Mueller-Hinton ajustado (CAMHB, preparado pelas instruções do fabricante) a 37 °C.
- Diluir as culturas durante a noite ~40 vezes em CAMHB e crescer até uma fase média de log, densidade óptica a 600 nm (OD600) = 0,4-0,8, volume 5 mL).
- Prepare as soluções de estoque de cada antibiótico fluorescente a 1,28 mg/mL em água estéril, e pipette 10 μL de antibiótico para a primeira coluna de uma placa de poço de 96.
- Adicione 90 μL de CAMHB à primeira coluna e 50 μL a todos os outros poços. Em seguida, realize diluição serial de duas vezes através da placa.
- Misture completamente, em seguida, diluir as culturas de fase de tronco médio para ~106 unidades de formação de colônia (CFU)/mL e adicionar 50 μL a todos os poços, para fornecer uma concentração final de ~5 x 105 CFU/mL.
volume de cultura (mL) = (volume de mídia em mL)/(OD600 x 1.000)
por exemplo, para uma cultura OD600 = 0,5 em um volume de mídia desejado de 12 mL, adicione (12/(0,5 x 1.000) = 0,024 mL de cultura para 12 mL de mídia - Cubra as placas com tampas e incuba a 37 °C por 18-24 h sem tremer.
- Inspecione visualmente as placas, com o MIC sendo a menor concentração bem sem crescimento visível.
NOTA: Consulte a Tabela 1 para alguns exemplos de antibióticos fluorescentes ativos e inativos.
4. Análise do Acúmulo de Sondas por Espectrofotometria e Citometria de Fluxo
NOTA: Esses tempos de centrífuga foram otimizados para E. coli,de modo que pequenas alterações podem ser necessárias para outras espécies. Dados representativos para acúmulo de sondas são relatados para a sonda ciprofloxacina com rótulo NBD.
- Os estoques de glicerol de raia das cepas bacterianas em ágar LB e crescem durante a noite a 37 °C.
- Escolha uma única colônia da placa e cultura durante a noite em LB a 37 °C.
- Diluir culturas durante a noite ~50 vezes na mídia e crescer até a fase média do log (OD600 = 0,4-0,8).
- Centrífuga simem as culturas a 1.470 x g por 25 min e decantam a mídia.
- Resuspender as bactérias em 1 mL de soro soro alvejado de fosfato (PBS), depois centrífuga sacada a 1.470 x g por 15 min.
- Decante a mídia e resuspenda as pelotas lavadas na PBS para um OD600 = 2 final.
- Se desejar, adicione 10,1 μL de cianeto carbonil 3-clorofenihididágua (CCCP, 10 mM em PBS) a 1 mL de bactérias (concentração final de 100 μM) e incubar a 37 °C por 10 min.
NOTA: CCCP é um inibidor da bomba efflux. A adição da CCCP permitirá o exame do impacto da efflux. - Centrífuga sicule as culturas a 18.000 x g por 4 min a 20 °C e decante a mídia.
- Adicione 1 mL de solução de antibiótico fluorescente (10-100 μM em PBS) à pelota, e incuba a 37 °C por 30 min.
- Centrífuga sicule as culturas a 18.000 x g por 7 min a 4 °C e decante a mídia.
- Resuspender as bactérias em 1 mL de PBS frio, e repita a etapa 4.9.
- Repita o passo 4.10 um total de 4x.
- Se desejar, as bactérias lise adicionando 180 μL de tampão de lise (20 mM Tris-HCl, pH 8.0 e 2 mM edta de sódio) em seguida 70 μL de lysozyme (72 mg/mL em H2O).
- Incuba-se a 37°C por 30 min, depois congele-degelo 3x (-78 °C para 5 min, depois 34 °C para 15 min).
- Sone as amostras por 20 min, depois aqueça até 65 °C por 30 min.
- Centrífuga sed amostras (18.000 x g, 8 min), em seguida, filtrar através de uma membrana de filtro de 10 kDa.
- Lave o filtro o 4x com 100 μL de água.
- Transfira o lysato para uma placa preta de fundo plano 96 e meça a intensidade da fluorescência em um leitor de placa com comprimentos de onda de excitação e emissão apropriados para o fluoroforre (ou seja, DMACA: λex = 400 nm, λem = 490 nm; NBD: λex = 475 nm, λem = 545 nm).
NOTA: Veja a Figura 3 como exemplos de análises espectrofotométricas de bactérias usando o antibiótico de ciprofloxacina com rótulo NBD fluorescente. - Para análise por citometria de fluxo, podem ser utilizadas as mesmas condições de crescimento e coloração (etapas 4.1-4,17), com mudanças exclusivamente na preparação final.
- Leve o volume total para 1 mL de PBS.
- Leia amostras em um címetro de fluxo a uma taxa de fluxo de aproximadamente 60 μL/min, utilizando amplificação logarítmica para aquisição de dados (excitação de F1 = 488 nm; emissão = 525/20 nm).
- Registre um total de 10.000 eventos e, em seguida, analise os dados usando software apropriado.
- Traçar a intensidade da fluorescência da F1 contra o número de ocorrências, estimando a intensidade mediana da fluorescência dos picos de histograma depois que a bactéria foi manchada.
NOTA: Veja a Figura 4 como exemplos de análises de citometria de fluxo de bactérias usando o antibiótico ciprofloxacina com rótulo NBD.
5. Preparação para Análise Microscópica
- Cresça subculturas para OD600 = 0,4, quanto à avaliação do MIC, depois divida em 1 mL alíquotas e centrífugas em 18.000 x g por 3-5 min.
- Decante e descarte mídia, em seguida, resuspender a pelota bacteriana em 500 μL de HBSS.
- Centrífuga a 18.000 x g por 3 min, depois decanta e descarta mídia.
- Prepare soluções de sondas de antibióticos no HBSS em concentrações de 1 a 100 μM.
- Resuspender as bactérias lavadas em 500 μL da solução da sonda, e incuba a 37 °C por 30 min.
- Repita o passo 5.3. Para um experimento de rotulagem múltipla, resuspenda a pelota em 500 μL de um corante ácido nucleiano de cor ortogonal. Para verde, use Syto9 (5 μM em HBSS); para azul, use Hoechst 33342 (20 μg/mL no HBSS). Incubar na RT por 15-30 min.
- Repita a etapa 5.3, depois resuspenda em 500 μL de FM4-64FX (5 μg/mL no HBSS) e incuba r$ 5 min.
- Repita a etapa 5.3, depois resuspenda em 500 μL de HBSS e repita a etapa 5.3 mais uma vez.
- Repita a etapa 5.8, depois suspenda as bactérias lavadas e dyed em 15 μL de meio de montagem (ver Tabela de Materiais).
- Pipette montando meio em um slide de microscópio e cubra com um deslizamento de tampa de alto desempenho, em seguida, selar bordas com esmalte claro.
NOTA: Veja a Figura 5 como exemplos de imagens de microscopia confocal tiradas com antibióticos de ciprofloxacina e trimetoprim com rótulo de NBD, e figura 6 para antibiótico de oxazolidinona com rótulo DMACA (linezolid).
Resultados
Figura 1 Ilustra a reação química do clique-chave (A)para a preparação dos antibióticos fluorescentes, e com (B) exemplos de estruturas de nossos antibióticos fluorescentes publicados à base de ciprofloxacina (cipro), trimethoprim (TMP) e linezolid. Todas essas sondas foram sintetizadas a partir dos antibióticos correspondentes através de um intermediário azida. Eles foram então acoplados aos fluoroforos NBD e DMACA, cada um funcionalizado com uma alquina.
A Figura 2 mostra exemplo lcms traços de uma reação de clique ciprofloxacin-N3 e NBD-alkyne, onde o azida elutou a 3,2 min e o produto a 3,8 min. Comparar 1 e 2 mostra como o progresso da reação do clique poderia ser seguido pelo desaparecimento do pico azide (por UV ou detector de MS). O Espectro 3 demonstra o impacto da purificação, com picos errôneos desaparecendo dos traços de MS e UV. Tanto o progresso da pureza quanto da reação podem ser quantificados pela integração do pico do produto e quaisquer picos de impureza.
A Figura 3 demonstra resultados típicos da avaliação do acúmulo intracelular por espectroscopia de fluorescência na presença e ausência de efflux. Neste experimento, a E. coli foi tratada com TMP-NBD com ou sem a adição da CCCP, que desaba da força motriz próton (PMF). A fluorescência intracelular da bactéria foi significativamente maior quando pré-tratada com CCCP, indicando que a efflux reduziu o acúmulo dessas bactérias. Este experimento foi repetido usando bactérias deficientes no TOLC,mostrando a capacidade deste ensaio para examinar o impacto dos componentes individuais da bomba efflux. Neste caso, embora tenha havido um aumento da fluorescência intracelular em relação às bactérias do tipo selvagem, o acúmulo de CCCP ainda aumentou. Esses achados indicam que o TOLC participa da EFFLUX inTMP, mas não é a única bomba de movimentação de PMF envolvida.
A Figura 4 mostra o resultado do mesmo experimento da Figura 2,mas com o acúmulo medido pela citometria de fluxo em vez de espectroscopia. As mesmas tendências de dados foram observadas, demonstrando que qualquer técnica pode ser usada para estudar o fenômeno do acúmulo intracelular mediado pela efflux.
A Figura 5 mostra imagens representativas de microscopia confocal de gram-positive (S. aureus) e bactérias gram-negativas(E. coli) rotuladas com TMP-NBD (1) e cipro-NBD ( 2+ 3) sondas fluorescentes, respectivamente. Em ambos os casos, foi adicionado o corantes da membrana vermelha FM4-64FX para comparar a co-localização. Para tmp-NBD, também foi utilizado o dye ácido nucleico azul Hoechst-33342. Ao sobrepor essas imagens, a localização do antibiótico na bactéria foi visualizada. Comparar painéis 2 e 3 mostra como foi examinado o impacto da efflux, com o inibidor de efflux CCCP utilizado em 2,resultando em acúmulo intracelular. No painel 3,nenhum CCCP foi adicionado. Assim, a efflux está ativa e nenhum acúmulo de sonda foi visto.
A Figura 6 mostra imagens representativas de microscopia confocal de bactérias Gram-positive (S. aureus) rotuladas com a sonda de oxazolidinona com rótulo DMACA Lz-NBD. O corante de membrana vermelha FM4-64FX foi adicionado para comparar a co-localização, e o corante ácido nucleico verde Hoechst-33342 também foi usado. Ao sobrepor essas imagens, a localização do antibiótico na bactéria foi visualizada, mostrando localização interna distinta da membrana e ácido nucleico.
A Tabela 1 mostra valores MIC para três séries de antibióticos fluorescentes, ciprofloxacina, trimetoprim (TMP) e linezolid (Lz), com dados apresentados para os derivados do antibiótico pai, NBD e DMACA de cada um. Espécies representativas para cada antibiótico foram escolhidas, incluindo grama-positivo e grama negativo. Para a série ciprofloxacina, ambas as sondas fluorescentes perderam a atividade antibiótica em comparação com a droga-mãe, mas mantiveram alguma atividade contra todas as espécies. Da mesma forma, as sondas linezolid perderam alguma atividade, mas permaneceram um antibiótico moderado a fraco. As sondas TMP perderam quase toda a atividade contra bactérias do tipo selvagem, mas estavam ativas contra efflux deficiente E. coli,indicando que a perda de atividade antibacteriana foi devido à falta de acúmulo.

Figura 1: Síntese e estruturas de sondas derivadas de antibióticos. (A)O esquema de reação geral para a síntese de sondas de antibióticos fluorescentes de antibióticos azidas e alquine-fluoroforres. (B)As estruturas de nossas sondas publicadas baseadas em ciprofloxacina, trimetoprim e linezolid. Clique aqui para ver uma versão maior deste valor.
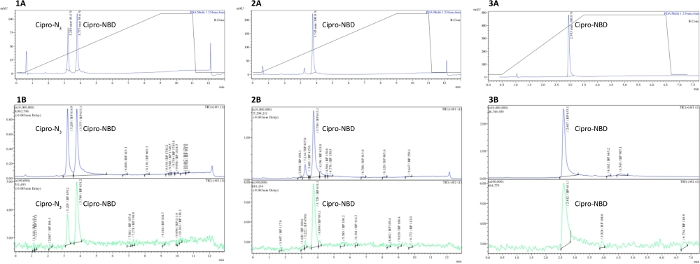
Figura 2: Medição da pureza da sonda derivada de antibióticos pela LCMS. LcMS analítico traça de (1) incompleto, (2) completo, e (3) HPLC purificado ciprofloxacin-N3 + NBD-alkyne clique reações demonstrando o desaparecimento do material inicial após a conclusão da reação, e picos diversos sobre a purificação. A = traço UV-Vis (absorção a 250 nm), B = traço MS (modo positivo e negativo). Clique aqui para ver uma versão maior deste valor.

Figura 3: Medição do leitor de placas de acúmulo de sondas derivadas de antibióticos. Fluorescência espectroscópica medição do acúmulo celular de TMP-NBD (50 μM) em tipo selvagem (1, ATCC 25922) e ΔtolC (2, ATCC 25922) E. coli incubado(A) com e(B) sem adição de CCCP (100 μM). A significância estatística (**p ≤ 0,01; ***p ≤ 0,001) é mostrada entre a ausência ou presença de CCCP e entre o tipo selvagem e δtolCE. coli. Os dados relatados são a média ± SD para três experimentos. Esse número é adaptado da nossa publicação anterior15, e ilustra o uso da espectroscopia para elucidar o papel da efflux no acúmulo intracelular. Clique aqui para ver uma versão maior deste valor.
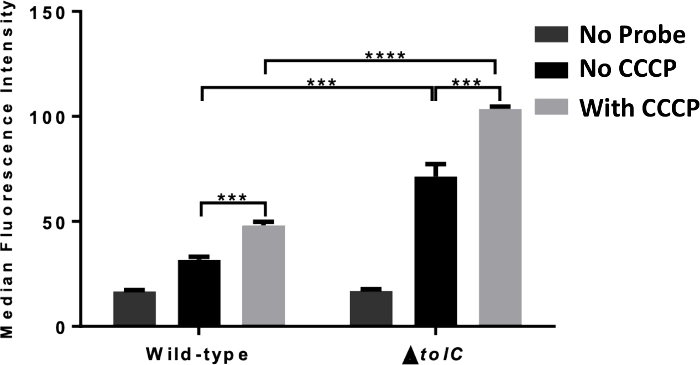
Figura 4: Medição de citometria de fluxo do acúmulo de sondas derivadas de antibióticos. Medição de citometria de fluxo de acúmulo celular utilizando TMP-NBD em tipo selvagem (1, ATCC 25922) e ΔtolC (2, ATCC 25922) E. colicubado com e sem adição de CCCP (100 μM). A atividade mediana de fluorescência é mostrada a partir de 10.000 eventos bacterianos, significância estatística (***, p ≤ 0,001; ****, p ≤ 0,0001) é mostrada entre a ausência e presença de CCCP e entre o tipo selvagem e δtolCE. coli. Os dados relatados são a média ± SD para três experimentos. Esse número é adaptado da nossa publicação anterior15, e ilustra o uso da citometria de fluxo para elucidar o papel da efflux no acúmulo intracelular. Clique aqui para ver uma versão maior deste valor.

Figura 5: Visualização de microscopia confocal da localização da sonda NBD. Imagens de microscopia confocal de 1) S. aureus ao vivo rotuladas com Hoechst-33342 (ácido azul, nucleico), TMP-NBD (verde), FM4-64FX (vermelho, membrana) e sobreposto; 2) E. coli vivo tratado com CCCP (inibidor efflux) rotulado com cipro-NBD (verde), FM4-64FX (vermelho, membrana) e sobreposto; 3) E. coli ao vivo rotulado com cipro-NBD (verde), FM4-64FX (vermelho, membrana) e sobreposto. Esse número é adaptado de nossas publicações anteriores15,16, e ilustra o uso de microscopia para examinar a localização da sonda, incluindo o impacto da efflux. Clique aqui para ver uma versão maior deste valor.

Figura 6: Visualização de microscopia confocal da localização da sonda DMACA. Imagens de microscopia confocal de S. aureus vivos rotulados com sonda de oxazolidinona Lz-DMACA (azul), verde Sytox (verde, ácido nucleico) e FM4-64FX (vermelho, membrana). Clique aqui para ver uma versão maior deste valor.
| MIC (μg/mL) | |||||||||||
| Espécie | Tensão | Cipro | Cipro-NBD | Cipro-DMACA | Tmp | TMP-NBD | TMP-DMACA | Linezolid (Lz) | Lz-NBD | Lz-DMACA | |
| Staphylococcus aureus | ATCC 25923 | 0.125 - 0.5 | 32 - ≥64 | 16 | 1 | 16 | >64 | ||||
| ATCC 43300 | 1 | 16 | >64 | ||||||||
| Streptococcus pneumoniae | ATCC 700677 | 1 | 4 | 64 | |||||||
| Enterococcus faecium | ATCC 35667 | 1 - 8 | 32 | 32 - ≥64 | |||||||
| ATCC 51559 | 2 | 16 | 32 | ||||||||
| Klebsiella pneumoniae | ATCC 13883 | 0.015 - 0.06 | 8 - 16 | 8 - 32 | |||||||
| Pseudomonas aeruginosa | ATCC 27853 | 0.25 - 1 | 32 - ≥64 | 32 - ≥64 | |||||||
| Escherichia coli | ATCC 25922 | ≤0,004 | 8 | 2 | 0.5 | >64 | >64 | ||||
| Mutante ΔtolC | 0.125 | 0.25 | 2 | ||||||||
Mesa 1. Atividades antibióticos de sondas de antibióticos fluorescentes baseadas em ciprofloxacina, trimetoprim e linezolid contra cepas bacterianas clinicamente relevantes apropriadas, medida por ensaios mic de microdiluição caldo. Na maioria dos casos, as sondas perderam alguma atividade em comparação com a droga-mãe, mas retiveram alguma potência antibiótico mensurável (suficiente para ser útil em estudos posteriores).
Discussão
A criação de uma sonda de antibióticos fluorescentes bem sucedida deve começar com um planejamento cuidadoso e consideração do SAR da droga-mãe. Se o SAR não for conhecido ou totalmente explorado, várias opções podem precisar ser testadas para encontrar um site que possa ser seletivamente modificado sem abolir a atividade biológica. Uma vez identificado um local/s, a instalação de um moiety de linker é muitas vezes essencial para fornecer espaçamento estérico entre o local biológico de ação e o fluorofóbico inativo. Deve-se tomar cuidado para que a reação usada para anexar o linker ao antibiótico deixe um grupo funcional bioestável, evitando, por exemplo, esters suscetíveis ao decote por esterases in vivo. Dependendo do perfil farmacodinâmico e farmacocinético do antibiótico, um simples linker alkyl pode ser usado, ou então uma opção menos lipofílica, como um linker de polietileno glicol (PEG) deve ser considerado. Com o linker ligado, a atividade antibacteriana deve ser avaliada para garantir que os MICs contra bactérias relevantes sejam semelhantes ao composto pai.
Neste trabalho, recomendamos o uso de Huigsen azide-alkyne [3+2] cicloaddition dipolar (clique em química, ver Figura 1) para ligar o fluoroforor ao antibiótico, por uma série de razões. As reações de cliquesão são altamente seletivas, o que significa que a proteção de grupos reativos no antibiótico não é necessária, e além disso, a reação deixa um moiety de triazole estável e biocompatível. O componente azide é introduzido na porção de antibióticos em nossos procedimentos, pois isso é geralmente mais facilmente realizado com uma variedade de tipos estruturais do que a introdução de um alquino. As sintetas de dois fluoroforos alquinos derivados são descritas aqui, embora outras possam ser exploradas se desejadas. NbD e DMACA foram escolhidos devido ao seu pequeno tamanho, minimizando a possibilidade de interferir na penetração celular e na interação com o alvo. A reação do clique em si é realizada utilizando catalisise de cobre, onde tanto2+ (CuSO4, com um agente redutor de ácido ascórbico) ou+ (CuI) pode ser usado como reagente inicial. Após a purificação (Figura 2),os MICs devem então ser testados como com o azide. Mesmo com cuidadosa consideração da escolha fluorofórfo e local de apego, é possível que a má atividade com antibióticos seja observada. Isso não significa, no entanto, que uma sonda inativa não é usada. Como mostrado com as sondas TMP, compostos com má atividade antibacteriana ainda podem se ligar ao mesmo alvo que a droga-mãe. Isso pode permitir estudos sobre o modo de ação e exame de fenômenos que levam à resistência, como a efflux.
Conforme descrito na seção de protocolos, é possível analisar a rotulagem bacteriana pelos antibióticos fluorescentes usando um simples ensaio de espectrofofotometria(Figura 3) ou citometria de fluxo(Figura 4). Ambos os métodos são capazes de quantificar o acúmulo de celular, e ao lising células e examinar a localização da fluorescência em lisato, é possível avaliar o acúmulo intracelular. Neste protocolo, o uso de lisozyme para lise celular é descrito, pois esta é uma técnica rápida e universal. Outras condições de lise, como o tratamento noturno com glicina-HCl7,também foram utilizadas com sucesso. Utilizando essa técnica, é possível estudar o impacto da efflux no acúmulo de antibióticos, que é um grande mecanismo de resistência. Se a efflux estiver realmente presente nas bactérias, será observada a falta de acúmulo intracelular, embora isso possa ser resgatado usando um inibidor de efflux como cccp.
A microscopia também pode ser realizada para inspecionar visualmente a localização de sondas em diferentes bactérias, obtendo informações sobre o modo de ação e potencialmente também resistência (ver Figura 5 para exemplos representativos). Para ver a localização dentro das bactérias, é necessário um microscópio confocal de alta resolução, equipado com recursos como SIM (microscopia de iluminação estruturada), SR-SIM (superresolução-SIM), Airyscan ou STED (esgotamento estimulado por emissões). Além disso, devem ser utilizados deslizamentos de cobertura de alto desempenho e análises pós-imagem realizadas em um software apropriado (por exemplo, FIJI, Zen ou Imaris). A localização das sondas é comparada a corantes que mancham arquiteturas específicas, como Hoechst-33342 (ácido azul, nucleico), Syto-9 (ácido verde, nucleico) e FM4-64FX (vermelho, membrana). A escolha dos corantes deve ser feita para combinar com o antibiótico fluorescente, de modo que cada cor usada tenha sobreposição espectral mínima. Para obter as melhores imagens possíveis, a otimização pode ser necessária. Por exemplo, se as bactérias estão muito lotadas no escorregador, tome apenas parte da pelota suspensa, em seguida, diluir com mais meio de montagem. Em contraste, se as bactérias são muito esparsas no slide, basta começar com mais bactérias. Neste protocolo, recomenda-se o uso de um gel termoreversível compatível com células vivas (por exemplo, Cygel) para imagens de células vivas, pois imobiliza bactérias (incluindo bactérias motile), mas outros meios de montagem ou agarose também foram usados com sucesso.
No geral, apesar dos desafios que podem ser enfrentados na preparação de um antibiótico fluorescente biologicamente ativo, a simplicidade de seu uso e sua versatilidade tornam essas sondas ferramentas atraentes para pesquisa na AMR. O trabalho futuro usando antibióticos fluorescentes tem o potencial de fornecer uma visão dos mecanismos de resistência a antibióticos, melhorar nossa compreensão de como os antibióticos atuais operam e ajudar no desenvolvimento de melhores medicamentos.
Divulgações
Os autores não têm nada a declarar.
Agradecimentos
A MRLS é apoiada por um Prêmio Australiano de Pós-Graduação (APA) e um Prêmio de Avanço em Pesquisa em Biociências Moleculares. Wanida Phetsang foi apoiada pela UQ International Scholarship (UQI) e iMB Postgraduate Award (IMBPA). Mac é pesquisador principal da NHMRC (APP1059354) e também possui uma consulta de pesquisador estrito na Universidade de Queensland, com seu tempo restante como CEO da Inflazome Ltd, uma empresa que desenvolve medicamentos para atender às necessidades clínicas não atendidas em doenças inflamatórias. O MATB é apoiado em parte pela Wellcome Trust Strategic Grant WT1104797/Z/14/Z e pelo SUBSÍDIO de Desenvolvimento NHMRC APP1113719. A microscopia foi realizada na Australian Cancer Research Foundation (ACRF)/Institute for Molecular Bioscience Cancer Biology Imaging Facility, que foi estabelecida com o apoio da ACRF.
Materiais
| Name | Company | Catalog Number | Comments |
| 3-(dimethylamino)phenol | Alfa-Aesar | B23067 | |
| 4-chloro-7-nitro-benzofuran | Sigma-Aldrich | 163260-5G | |
| Amicon Ultra-0.5 centrifugal filter unit with Ultracel- 10 membrane | Merck | UFC501096 | |
| Atlantis Prep T3 OBD (100 A, 5 uM, 10x250 mm) | Waters | 186008205 | |
| Atlantis T3 column (100 A, 5 uM, 2.1 × 50 mm) | Waters | 186003734 | |
| Bruker Avance 600 MHz spectrometer | Bruker | ||
| Buchi Reveleris C18 12g Cartridge | Buchi | BUC145152103 | |
| CCCP | Sigma-Aldrich | C2759 | |
| Celite 545 | Sigma-Aldrich | 22140-5KG-F | |
| Cygel | ABCAM | Ab109204 | |
| Elyra PS,1 SIM/STORM confocal microscope | Zeiss | ||
| FM4-64FX, fixable analog of FM™ 4-64 membrane stain | Life Technologies Australia Pt | F34653 | |
| Gallios flow cytometer | Beckman Coulter | ||
| Gamma 2-16 LSCplus lyophilise | CHRIST | ||
| Gilson HPLC 2020 | Gilson | ||
| Hanks' Balanced Salt solution, Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | H6648-500ML | |
| Hettich Zentrifugen Rotofix 32 | Hettich | ||
| High performance #1.5 cover slips (18 x 18 mm) | Schott/Zeiss | 474030-9000-000 | |
| Hoechst 33342, Trihydrochloride, Trihydrate - Fluo | Life Technologies Australia Pt | H21492 | |
| LB | AMRESCO | J106 | |
| Leica STED 3X Super Resolution Microscope with White Light Laser excitation | Leica | ||
| Lysozyme from chicken egg white lyophilized powder | Sigma-Aldrich | L6876 | |
| Mueller Hinton II Broth Cation adjusted | Becton Dickinson | 212322 | |
| Propargylamine | Sigma-Aldrich | P50900-5G | |
| Reveleris GRACE MPLC | Buchi | ||
| Shimadzu LCMS-2020 | Shimadzu | ||
| Sigma 1-15 Microcentrifuge | Sigma-Aldrich | ||
| Silica gel 60 (0.040-0.063 mm) for column chromatography (230-400 mesh ASTM) | Merck | 1093859025 | |
| SYTO 9 Green Fluorescent Nucleic Acid Stain | Life Technologies Australia Pt | S34854 | |
| TECAN Infinite M1000 PRO | TECAN |
Referências
- Cai, H., Rose, K., Liang, L. H., Dunham, S., Stover, C. Development of a liquid chromatography/mass spectrometry-based drug accumulation assay in Pseudomonas aeruginosa. Analytical Biochemistry. 385 (2), 321-325 (2009).
- Bhat, J., Narayan, A., Venkatraman, J., Chatterji, M. LC-MS based assay to measure intracellular compound levels in Mycobacterium smegmatis: Linking compound levels to cellular potency. Journal of Microbiological Methods. 94 (2), 152-158 (2013).
- Davis, T. D., Gerry, C. J., Tan, D. S. General Platform for Systematic Quantitative Evaluation of Small-Molecule Permeability in Bacteria. ACS Chemical Biology. 9 (11), 2535-2544 (2014).
- Richter, M. F., et al. Predictive compound accumulation rules yield a broad-spectrum antibiotic. Nature. 545, 299 (2017).
- Iyer, R., et al. Evaluating LC-MS/MS To Measure Accumulation of Compounds within Bacteria. ACS Infectious Diseases. 4 (9), 1336-1345 (2018).
- Prochnow, H., et al. Subcellular Quantification of Uptake in Gram-Negative Bacteria. Analytical Chemistry. 91 (3), 1863-1872 (2019).
- Dumont, E., et al. Antibiotics and efflux: combined spectrofluorimetry and mass spectrometry to evaluate the involvement of concentration and efflux activity in antibiotic intracellular accumulation. Journal of Antimicrobial Chemotherapy. 74 (1), 58-65 (2019).
- Stone, M. R. L., Butler, M. S., Phetsang, W., Cooper, M. A., Blaskovich, M. A. T. Fluorescent Antibiotics: New Research Tools to Fight Antibiotic Resistance. Trends in Biotechnology. 36 (5), 523-536 (2018).
- Piddock, L. J. V., Johnson, M. M. Accumulation of 10 fluoroquinolones by wild-type or efflux mutant Streptococcus pneumoniae. Antimicrobial Agents and Chemotherapy. 46 (3), 813-820 (2002).
- Mortimer, P. G. S., Piddock, L. J. V. A comparison of methods used for measuring the accumulation of quinolones by enterobacteriaceae, pseudomonas aeruginosa and staphylococcus aureus. Journal of Antimicrobial Chemotherapy. 28 (5), 639-653 (1991).
- Li, X. Z., Nikaido, H., Poole, K. Role of MexA-MexB-OprM in antibiotic efflux in Pseudomonas aeruginosa. Antimicrobial Agents and Chemotherapy. 39 (9), 1948-1953 (1995).
- Vince, R., Weiss, D., Pestka, S. Binding of N-substituted erythromycylamines to ribosomes. Antimicrobial Agents and Chemotherapy. 9 (1), 131-136 (1976).
- Vazquez, D. Antibiotics affecting chloramphenicol uptake by bacteria Their effect on amino acid incorporation in a cell-free system. Biochimica et Biophysica Acta (BBA) - Nucleic Acids and Protein Synthesis. 114 (2), 289-295 (1966).
- Phetsang, W., et al. An azido-oxazolidinone antibiotic for live bacterial cell imaging and generation of antibiotic variants. Bioorganic and Medicinal Chemistry. 22 (16), 4490-4498 (2014).
- Phetsang, W., et al. Fluorescent trimethoprim conjugate probes to assess drug accumulation in wild type and mutant Escherichia coli. ACS Infectious Diseases. 2 (10), 688-701 (2016).
- Stone, M. R. L., et al. Fluoroquinolone-derived fluorescent probes for studies of bacterial penetration and efflux. MedChemComm. 10 (6), 901-906 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados