Method Article
Visualisierung der bakteriellen Resistenz mit fluoreszierenden Antibiotikasonden
In diesem Artikel
Zusammenfassung
Fluoreszierend getaggte Antibiotika sind leistungsstarke Werkzeuge, die verwendet werden können, um mehrere Aspekte der antibiotika-resistenz zu untersuchen. Dieser Artikel beschreibt die Herstellung von fluoreszierend markierten Antibiotika und ihre Anwendung auf die Untersuchung von Antibiotikaresistenzen bei Bakterien. Sonden können verwendet werden, um Mechanismen der bakteriellen Resistenz (z. B. Efflux) durch Spektrophotometrie, Durchflusszytometrie und Mikroskopie zu untersuchen.
Zusammenfassung
Fluoreszierende Antibiotika sind Mehrzweck-Forschungswerkzeuge, die aufgrund ihres signifikanten Vorteils gegenüber anderen Methoden leicht für die Untersuchung antimikrobieller Resistenzen verwendet werden können. Zur Vorbereitung dieser Sonden werden Azidderivate von Antibiotika synthetisiert und dann mit Alkyn-Fluorophoren gekoppelt, die Azid-Alkyne-Dipolarzyklionaddition durch Klickchemie verwenden. Nach der Reinigung wird die antibiotische Aktivität des fluoreszierenden Antibiotikums durch minimale hemmende Konzentrationsbewertung getestet. Um die bakterielle Akkumulation zu untersuchen, kann entweder Spektrophotometrie oder Durchflusszytometrie verwendet werden, was eine viel einfachere Analyse als Methoden ermöglicht, die sich auf radioaktive Antibiotikaderivate stützen. Darüber hinaus kann die konfokale Mikroskopie verwendet werden, um die Lokalisation innerhalb der Bakterien zu untersuchen und wertvolle Informationen über die Wirkungsweise und Veränderungen bei resistenten Arten zu liefern. Der Einsatz von fluoreszierenden Antibiotika-Sonden bei der Untersuchung der antibiotika-resistenz ist eine leistungsfähige Methode mit viel Potenzial für zukünftige Expansion.
Einleitung
Antimikrobielle Resistenz (AMR) ist eine zunehmende Krise, die eine große Bedrohung für die menschliche Gesundheit auf der ganzen Welt darstellt. Resistenz gegen die meisten Antibiotika wurde berichtet, und Infektionen durch Bakterien, die gegen alle klinisch verfügbaren Medikamente resistent sind, entstehen. Um den Anstieg der Antibiotikaresistenz zu bekämpfen, müssen wir unser Verständnis dieses vielschichtigen Phänomens und der zugrunde liegenden Mechanismen und Wechselwirkungen zwischen Antibiotika und Bakterien erweitern. Ein Aspekt, der historisch wenig verstanden wurde, ist die Durchlässigung von Antibiotika in Bakterien, zusammen mit den Phänomenen der Akkumulation und des Efflux. Dieses Wissen ist entscheidend für die Entwicklung neuer Medikamente und das Verständnis von Mechanismen der Resistenz. Daher spielt dies eine entscheidende Rolle in der AMR-Forschung.
Es gibt zwei Hauptansätze, die ergriffen werden können, um die Antibiotikakonzentration zu messen: die Messung des Arzneimittels direkt oder die Kennzeichnung mit einem Moiety, das die Quantifizierung erleichtern soll. Obwohl die Kennzeichnung des Antibiotikums den Nachweis verbessert, kann dies die biologische Aktivität des Arzneimittels stören, wie antimikrobielle Aktivität und Durchlässigkeit. Dies ist kein Problem für nicht markierte Methoden; Die Erkennung kann jedoch eine Herausforderung darstellen. In den letzten Jahren haben technologische Fortschritte zu einem Boom in der Forschung geführt, die Massenspektrometrie (MS) verwendet, um die Antibiotikakonzentration in Bakterien direkt zu messen1,2,3,4,5,6,7. Diese Studien haben gezeigt, dass es möglich ist, intrazelluläre Akkumulation in einer Vielzahl von Bakterien zu studieren, mit gramnegativen Bakterien die am häufigsten untersucht. Die Quantifizierung der Moleküldurchlässigkeit wurde dann mit der Aktivität in Verbindung gebracht und zur Information über die Arzneimittelentwicklung2,3,4, obwohl Vorsicht geboten ist, wenn die Akkumulation und die Zielaktivität direkt vermischt werden5. Vor der MS-Entwicklung waren die einzigen Antibiotika, deren Konzentration direkt gemessen werden konnte, diejenigen, die eine intrinsische Fluoreszenz besaßen, wie Tetracyclin und die Chinolone8,9,10,11. Obwohl der Umfang offensichtlich begrenzt war, wurden Akkumulation und Efflux untersucht und quantifiziert, was die Nützlichkeit der fluoreszenzbasierten Quantifizierung veranschaulicht.
Tagged Antibiotika werden seit vielen Jahrzehnten verwendet, um Verteilungen, Wirkarten und Resistenzen zu untersuchen, wobei radioaktive und fluoreszierende Tags häufig sind. Radio-markierte Sonden haben den Vorteil, dass sie fast identisch mit der Übergeordneten Verbindung sind, daher ist es unwahrscheinlich, dass die biologische Aktivität signifikant unterschiedlich ist. Isotope wie 3H, 14C und 15N wurden häufig aufgrund der Prominenz dieser Elemente in Antibiotika verwendet, und eine Vielzahl von Antibiotikagerüsten wurden untersucht1,10,12,13. Während die Detektion von Funksonden einfach ist, gibt es eine Reihe von logistischen Bedenken (z. B. Sicherheit, Isotop-Halbwertszeit), die die Verwendung dieses Ansatzes eingeschränkt haben. Eine weitere Strategie sind fluoreszierend markierte Antibiotika. Diese Sonden können verwendet werden, um die Verteilung und die Wirkarten und die Widerstandsfähigkeit des Muttermedikaments zu untersuchen, mit einfacherer Technologie als MS und ohne die logistischen Probleme der Strahlung8. Der Hauptnachteil dieses Ansatzes ist, dass Antibiotika im Allgemeinen relativ kleine Moleküle sind, daher stellt die Einführung eines fluoreszierenden Moleküls eine signifikante chemische Veränderung dar. Diese Veränderung kann sich auf physiochemische Eigenschaften und antibakterielle Aktivität auswirken. Daher ist darauf zu achten, diese Faktoren zu bewerten, um Ergebnisse zu generieren, die für das Mutterantibiotikum repräsentativ sind.
In dieser Arbeit wird eine Methode zur Synthese, Bewertung und Verwendung fluoreszierender Antibiotika beschrieben, wie in unseren früheren Veröffentlichungen14,15,16. Durch frühere Arbeiten wurden eine Reihe von fluoreszierenden Antibiotika hergestellt und für eine Vielzahl von Zwecken verwendet (siehe Stone et al.8). Um die Wahrscheinlichkeit einer Auswirkungen auf die biologische Aktivität zu minimieren, werden bei dieser Arbeit sehr kleine Fluorophore verwendet: Nitrobenzoxadiazol(NBD, grün) und 7-(dimethylamino)-2-oxo-2 H-chromen-4-yl (DMACA, blau). Weiterhin wird die Beurteilung der antibakteriellen Aktivität mit dem Mikrobakenverdünnungs-Mindestinhibitionskonzentrationstest (MIC) beschrieben, so dass die Wirkung von Veränderungen auf die Aktivität gemessen werden kann. Diese fluoreszierend markierten Sonden können in spektrophotometrischen Assays, Durchflusszytometrie und Mikroskopie eingesetzt werden. Die Bandbreite der Einsatzmöglichkeiten liegt dort, wo der Vorteil fluoreszierender Antibiotika liegt. Die zelluläre Akkumulation kann quantifiziert, kategorisiert und visualisiert werden, was mit MS allein nicht möglich ist. Es ist zu hoffen, dass die durch den Einsatz von fluoreszierenden Antibiotika gewonnenen Erkenntnisse zu unserem Verständnis von Resistenzen und zur Bekämpfung von Antibiotika beidere werden.
Protokoll
1. Synthese von Alkyn-Fluorophoren
- Synthese von NBD-Alkyn (7-Nitro-N-(prop-2-yn-1-yl)benzo[c][1,2,5]oxadiazol-4-amin)
- 1.031 mg 4-Chlor-7-Nitro-Benzofuran (5,181 mmol) in 60 ml Tetrahydrofuran (THF) auflösen. Fügen Sie 1.857 mg CsCO3 (5.696 mmol), dann 0,39 ml Propargylamin (6,1 mmol). Erhitzen Sie die Reaktion auf 50 °C für 2 h, die von braun zu grün drehen, dann auf Raumtemperatur (RT) abkühlen.
- Filtern Sie die Reaktion mit einem Filterhilfsmittel (siehe Materialtabelle) und waschen Sie sie mit Ethylacetat (EA). Das Filtrat unter reduziertem Druck konzentrieren, dann den Rückstand in 150 ml EA auflösen und zu einem 500 ml Trenntrichter bewegen.
- Waschen Sie die EA-Lösung mit 100 ml mit Wasser bzw. Sole. Dann kombinieren Sie die wässrigen Phasen und waschen 2x mit 100 ml EA.
- Die kombinierten organischen Phasen über wasserfreies Magnesiumsulfat trocknen, dann filtern und unter reduziertem Druck konzentrieren.
- Reinigen Sie das Rohprodukt durch Blitzchromatographie auf Kieselgel (20–30% EA in Petrolether [PE]), Überprüfen der Reinheit durch Flüssigchromatographie Massenspektrometrie (LCMS, [M+H]+ = 219,1) und/oder Kernmagnetresonanz (NMR) Spektroskopie, chemische Verschiebungen wie folgt:
1 H NMR (CD3OD, 600 MHz) bei 8,54 (d, J = 8,7 Hz, 1H), 6,35 (d, J = 8,4 Hz, 1H), 4,31 (dd, J = 5,7 Hz, J = 2,5 Hz, 2H), 2,43 (t, J = 2,5 Hz, 1H); 13 C NMR (CD3OD, 150 MHz) n 144,3, 143,7, 142,2, 135,8, 125,7, 100,0, 76,5, 74,2, 33,4.
HINWEIS: Bei der Reinigung durch Kieselgelchromatographie bereiten Sie die Säule mit dem weniger polaren der aufgeführten Lösungsmittel vor. Rohe Verbindung kann entweder als konzentrierte Lösung geladen oder auf die Kieselsäure adsorbiert werden, wenn lösliche Ity es nicht zulässt. Nachdem die Verbindung an der Oberseite der Kieselsäure zugegeben wurde, laufen Sie durch 1–2 Säulenvolumen des gleichen Lösungsmittels, das für die Kieselsäurebenetzung verwendet wird. Beginnen Sie dann mit dem aufgeführten Lösungsmittelverhältnis, das durch mindestens 1 Spaltenvolumen jedes Lösungsmittels läuft, und stellen Sie sicher, dass sie keine großen Sprünge in der Lösungsmittelzusammensetzung machen. Sammeln Sie Fraktionen und überprüfen Sie Reinheit/Identität durch LCMS oder TLC (Dünnschichtchromatographie). Kombinieren Sie reine Fraktionen und konzentrieren Sie sich unter reduziertem Druck durch Rotationsverdampfung.
- Synthese von DMACA-Alkyn (2-(7-(dimethylamino)-2-oxo-2H-chromen-4-yl)-N-(prop-2-yn-1-yl)acetamide).
- 5,02 g 3-(Dimethylamino)phenol (36,6 mmol) in 30 ml Ethanol auflösen, dann 6,7 ml Diethyl 1,3-Acetondicarboxylat (36 mmol) hinzufügen. Fügen Sie 10,5 g ZnCl2 (77,2 mmol) hinzu, dann reflux die rote Lösung für 42 h. Fügen Sie weitere 9,20 g ZnCl2 (67,6 mmol), dann Reflux für 8 h.
- Kühlen Sie die Reaktion und konzentrieren Sie sich unter reduziertem Druck. Dispergieren Sie den resultierenden roten Feststoff in 200 ml EA, filtern, dann in einen 500 ml Trenntrichter übertragen.
- Waschen Sie den EA mit je 200 ml Wasser und Salzlake, dann über wasserfreies Magnesiumsulfat trocknen. Filtern Sie die getrocknete organische Phase und konzentraten Sie unter reduziertem Druck.
- Reinigen Sie den roten Feststoff (ethyl 2-(7-(dimethylamino)-2-oxo-2 H-chromen-4-yl)acetat) durch Blitzchromatographie auf Kieselgel (0–100% EA in PE), Überprüfung der Reinheit durch LCMS ([M+H]+ = 275.1) und/oder NMR, chemische Verschiebungen wie folgt:
1 H NMR (CDCl3, 600 MHz) bei 7,30 (d, J = 8,9 Hz, 1H), 6,52 (dd, J = 8,9 Hz, J = 2,6 Hz, 1H), 6,40 (d, J = 2,6 Hz, 1H), 5,87 (m, 1H), 2,96 (m, 8H), 2,25 (d, J = 1,2 Hz, 3H). - 488 mg Ethyl 2-(7-(dimethylamino)-2-oxo-2 H-Chromen-4-yl-acetat (1,18 mmol) in 10 ml THF auflösen, dann eine Lösung von 157 mg LiOH H2O (3,74 mmol) in 15 ml Wasser. Rühren Sie die Reaktion bei RT für 3 h, dann bewegen Sie sich zu einem trennenden Trichter und verdünnen Sie mit einem zusätzlichen 50 ml Wasser.
- Das Reaktionsgemisch 2x mit 50 ml Diethylether (Et2O) waschen und dann die kombinierte organische Phase 2x mit 25 ml Wasser waschen. Nehmen Sie jeden gelben Niederschlag mit der organischen Schicht. Konzentrieren Sie die organische Phase unter reduziertem Druck mit einem Rotationsverdampfer.
- Die wässrige Phase mit konzentriertem HCl auf pH = 2 säuern und über Nacht auf 4 °C abkühlen lassen. Filtern Sie die versauerte wässrige Phase und fügen Sie den gelben Feststoff in die konzentrierte organische Phase ein.
ANMERKUNG: Die 2-(7-(dimethylamino)-2-oxo-2 H-Chromen-4-yl)-Essigsäure kann ohne weitere Reinigung verwendet werden, kann aber durch LCMS ([M+H]+ = 247.1) und/oder NMR, chemische Verschiebungen wie folgt überprüft werden:
1 H NMR (CDCl3, 600 MHz) J = 9,0 Hz, 1H), 6,62 (dd, J = 9,2 Hz, J = 2,8 Hz, 1H), 6,52 (d, J = 2,8 Hz, 1H), 5,98 (d, J = 0,9 Hz, 1H), 3,05 (s, 6H), 2,35 (d, J = 0,9 Hz, 2H); 13 C NMR (CDCl3, 150 MHz) bei 162,2, 155,7, 152,9, 152,8, 125,3, 109,7, 109,3, 109,1, 108,8, 98,3, 40,2, 18,5. - 466 mg 2-(7-(dimethylamino)-2-oxo-2H-chromen-4-yl)essigsäure (1.89 mmol) in 7 ml trockenem N,N-Dimethylformamid (DMF) auflösen und unter stickstoffhaltiger Atmosphäre platzieren.
- 0,33 ml Propargylamin (5,1 mmol) in 7 ml trockenem DMF unter Stickstoff auflösen. 1,30 ml Di-Isopropylethylamin (DIPEA, 7,50 mmol) in die Farbstofflösung geben, dann 535 mg O-(1H-6-chlorobenzotriazol-1-yl)-1,1,3,3-tetramethyluronium hexafluorophosphat (HCTU, 1.29 mmol). Rühren Sie die aktivierte Farbstofflösung für 15 min bei RT, dann fügen Sie die Aminlösung tropfenweise, und lassen Sie über Nacht rühren.
- Am nächsten Tag die Reaktion mit 35 ml Wasser verdünnen und dann unter reduziertem Druck konzentrat.
- Teilen Sie den resultierenden orangen entoreinen Festkörper zwischen EA und Sole (jeweils 100 ml) in einem 250 ml Trenntrichter auf. Trennen Sie die Schichten (führen Sie die beiden Schichten in verschiedene Kolben), und waschen Sie die wässrige Phase mit 100 ml EA.
- Konzentrieren Sie die kombinierten organischen Phasen unter reduziertem Druck, und lösen Sie dann den Orangenfestin in 3 ml 1:1 Acetonitril (ACN)/Wasser (v/v) wieder auf. Reinigen Sie das Rohprodukt durch Injektion in ein Mitteldruck-Flüssigkeitschromatographiesystem (MPLC) der Umkehrphase, das mit einer C18-Patronensäule (Lösungsmittel A: Wasser, Lösungsmittel B: ACN) ausgestattet ist.
- Überprüfen Sie die Fraktionen auf Reinheit durch LCMS ([M+H]+ = 284.1, NMR-Chemische Verschiebungen unten angegeben), dann kombinieren und lyophilisieren entsprechende Fraktionen, um 2-(7-(dimethylamino)-2-oxo-2H-chromen-4-yl)-N-(prop-2-yn-1-yl)acetami, NMR chemische Verschiebungen wie folgt zu geben:
1 H NMR (600 MHz, DMSO-d6) bei 8,65 (t, J = 5,4 Hz, 1H), 7,52 (d, J = 9,0 Hz, 1H), 6,72 (dd, J = 9,1, 2,6 Hz, 1H), 6,55 (d, J = 2,6 Hz, 1H), 6,00 (s, 1H), 3,88–3,87 (m, 2H), 3,62 (s, 2H), 3,13 (t, J = 2,5 Hz, 1H), 3,01 (s, 6H); 13 C NMR (125 MHz, DMSO-d6) n 167,7, 160,7, 155,4, 152,9, 151,0, 126,0, 109,4, 109,1, 108,1, 97,5, 80,9, 73,3, 39,7, 38,4, 28,2.
2. Synthese fluoreszierender Antibiotika
- Bereiten Sie ein Azid-Derivat eines Antibiotikums wie zuvor beschrieben14,15,16.
HINWEIS: Das Verfahren ist spezifisch für jedes Antibiotikum und erfordert eine sorgfältige Untersuchung der Strukturaktivitätsbeziehung (SAR) des Übergeordneten Moleküls, um sicherzustellen, dass das funktionalisierte Antibiotikum eine Aktivität behält, die mit dem Elternteil vergleichbar ist. (z.B. Ciprofloxacin16, Linezolid14und Trimethoprim15). Siehe Abbildung 1 für Beispiele für veröffentlichte fluoreszierende Antibiotika und das allgemeine Syntheseschema. - Klicken Sie auf Reaktionsprozedur A
HINWEIS: Bei den meisten Antibiotika folgen Sie dem hier beschriebenen Verfahren für kupferkatalysiertes Huisgen [2+3] Cycloaddition von Azid (Schritt 2.1) und fluoreszierendem Alkyn (in Schritt 1).- Das Azid-Antibiotikum in einen runden Bodenkolben geben und tert-butanol (tBuOH) und Wasser (1:1 v/v, je 25 ml pro mmol-Azid) hinzufügen.
- Fügen Sie das in Schritt 1.1 (3 eq.) hergestellte Fluorophor-Alkyn hinzu und erhitzen Sie die Reaktion auf 50 °C. Dann Kupfersulfat (100 mM in Wasser, 0,6 eq.) zur Reaktion hinzufügen, gefolgt von Ascorbinsäure (500 mM in Wasser, 2,4 Eq.).
- Rühren Sie die Reaktion bei 50 °C für 1 h oder bis zur Analyse durch LCMS unter Angabe der Reaktionsvervollständigung (vollständiger Verbrauch von Beginnenazid).
- Kühlen Sie die Reaktion ab und reinigen Sie sie je nach Bedarf für das Antibiotikumgerüst und führen Sie die Reinigung entweder durch Schritt 2.3 oder 2.4 fort.
HINWEIS: Je nach Polarität und Stabilität des Gerüstes sind verschiedene Reinigungsmethoden möglich.
- Klicken Sie auf Reaktionsprozedur B
HINWEIS: Befolgen Sie dieses Verfahren für Peptid-basierte Antibiotika, um stärkere Reaktionsbedingungen zu bieten (unveröffentlichte Arbeit, Phetsang, 2019).- Das Peptid-Azid-Antibiotikum in einen runden Bodenkolben geben und genügend DMF (750 ml/mmol-Azid) hinzufügen, um sich aufzulösen.
- Fügen Sie das in Schritt 1 (5 eq.) hergestellte Fluorophor-Alkyn hinzu und erhitzen Sie die Reaktion auf 50 °C für 1 h.
- Kupfer (I) Iodid (20 eq.), dann DIPEA (120 eq.), dann Essigsäure (240 eq.).
- Rühren Sie die Reaktion bei 50 °C für 1 h, oder bis die Analyse durch LCMS die Reaktionsvervollständigung anzeigt (d. h. den vollständigen Verbrauch von Startazid). Kühlen Sie die Reaktion ab und gehen Sie zur Reinigung durch Methode 1 vor (siehe Schritt 2.3).
- Reinigungsverfahren 1 (verwendet für Ciprofloxacin, Trimethoprim und Linezolid)
- Injizieren Sie die gekühlte Klickreaktion direkt in eine MPLC C18-Patronensäule.
- Integrieren Sie eine lange Waschphase (ca. 10 min) zu Beginn des Laufs (100% Lösungsmittel A), dann führen Sie einen Gradienten bis zu 100% Lösungsmittel B, gefolgt von einer Rückkehr zu Lösungsmittel A.
HINWEIS: Lösungsmittel A kann aus Wasser, 0,05–0,1% Ameisensäure (FA) in Wasser, 0,05–0,1% Trifluoressigsäure (TFA) in Wasser gewählt werden, abhängig von Löslichkeit, Stabilität und der besten Auflösung von Spitzen. Lösungsmittel B kann aus Acetonitril (ACN), 0,05–0,1% FA in ACN, 0,05–0,1% TFA in ACN gewählt werden, um lösungsmittel A zu entsprechen. Wenn sich die Elution als schwierig erweist, kann Methanol anstelle von ACN verwendet werden. - Sammeln und kombinieren Sie geeignete Fraktionen, wie durch LCMS und Farbe angegeben (korrekte Masse gesehen, Singular Peak), dann Lyophilisieren, um das (halb)reine fluoreszierende Antibiotikum zu geben.
- Reinigen Sie das Produkt bei Bedarf weiter. Bewerten Sie die Reinheit durch NMR und/oder LCMS und Hochdruck-Flüssigkeitschromatographie (HPLC) unter Verwendung einer für das Gerüst geeigneten Säule und Methode.
- Reinigungsmethode 2
HINWEIS: Wenn die Löslichkeit dies zulässt, kann die Vorreinigung durch die wässrige Aufarbeitung durchgeführt werden (verwendet für Makroliden, unveröffentlichte Arbeit, Stein 2019).- Die gekühlte Klickreaktion mit Wasser und Et2O (1:1 v/v, ca. 10-fache Verdünnung aus dem anfänglichen Reaktionsvolumen) verdünnen und auf einen entsprechend großen Trenntrichter übertragen.
- Die Schichten trennen und die wässrige Phase zweimal mit Et2O waschen.
- Waschen Sie die kombinierten organischen Phasen 2x mit Wasser (gleiches Volumen mit organischer Phase), dann trocknen Sie über Na2SO4.
- Filtern Sie die getrocknete organische Phase und konzentraten Sie unter reduziertem Druck.
- Reinigen Sie das Rohprodukt mit MPLC und/oder HPLC, wie in Schritt 2.4.4 beschrieben.
HINWEIS: Siehe Abbildung 2 für Beispiele für unvollständige, vollständige und gereinigte Klickreaktion LCMS-Ablaufverfolgungen. Typische gereinigte Erträge für die Antibiotikum-Fluorophor-Klickreaktionen liegen zwischen 30 und 80%.
VORSICHT: Die meisten Chemikalien, die in diesen Synthesen verwendet werden, weisen spezifische Sicherheitsrisiken auf. Es ist jederzeit Vorsicht geboten, auch bei der Verwendung persönlicher Schutzausrüstung. Et2O, tBuOH, FA, Essigsäure, PE, EA, THF, ACN, DMF, EtOH, DIPEA, Propargylamin und HCTU sind alle entzündlich; Kontakt mit Wärme- oder Funkenquellen zu vermeiden. THF, Propargylamin, DIPEA, tBuOH, FA, DMF und PE sind alle toxisch; Exposition zu vermeiden. Propargylamin, CsCO3, ZnCl2, LiOH-H2O, DIPEA, CuI, FA, Essigsäure und HCl sind alle korrosiv; Kontakt vermeiden und sich des Oberflächenkontakts bewusst sein. ZnCl2, CuSO4, CuI und PE stellen Umweltgefahren dar; auf entsorgungsbedingungen achten. THF kann explosive Peroxide bilden; mit den Lagerbedingungen aufpassen. Organische Aziden sind explosiv; besonders bei der Großserienfertigung aufpassen.
3. Bewertung der antimikrobiellen Aktivität
HINWEIS: Alle Arbeiten mit Bakterien sollten unter sterilen Bedingungen durchgeführt werden, um eine Kontamination des Assays oder des Labors zu vermeiden. Alle Medien sollten vor dem Gebrauch autoklaviert werden, und Kunststoffe und Geräte wie Pipetten müssen steril gehalten werden. Es wird empfohlen, die Arbeit in einer Biocontainment-Haube (Typ 2) zu erledigen.
- Streifen GlycerinBestände von Bakterienstämmen geeignet für das Antibiotikum Gerüst auf LysogeneBrühe Agar (LB, nach Herstelleranweisungen zubereitet), und wachsen über Nacht bei 37 °C.
HINWEIS: Die Wahl der Bakterien, um antibakterielle Aktivität zu testen, muss auf der Grundlage des verwendeten Antibiotikumgerüsts getroffen werden. Aus den Arten, von denen bekannt ist, dass sie anfällig für das Antibiotikum sind, sollte ein repräsentativer Bereich von 5–10 Bakterien ausgewählt werden, wobei die logistischen Fähigkeiten des Labors berücksichtigt werden sollten. Wenn möglich, sollten auch resistente Bakterien getestet werden. Das unten angegebene Protokoll wird auf die meisten Bakterien funktionieren, aber überprüfen, ob besondere Bedingungen erforderlich sind (z.B. CO2, spezielle Medien) und änderungen bei Bedarf. Bakterien erfolgreich mit diesen Bedingungen astestiert gehören Staphylokokken, Streptococci, Bacilli, E. coli, Klebsiella pneumoniae, Pseudomonas aeruginosa, und Enterococcus faecium. - Wählen Sie eine einzelne Kolonie von der Platte, und Kultur über Nacht in 5 ml kationangepasstMueller-Hinton Broth (CAMHB, vorbereitet nach Herstelleranleitung) bei 37 °C.
- Verdünnen Sie die Nachtkulturen in CAMHB um das 40-fache und wachsen Sie bis zu einer Mittleren-Log-Phase, optische Dichte bei 600 nm (OD600) = 0,4–0,8, Volumen 5 ml).
- Bereiten Sie Lagerlösungen jedes fluoreszierenden Antibiotikums bei 1,28 mg/ml in sterilem Wasser und Pipette 10 l Antibiotikum auf die erste Säule einer 96-Well-Platte vor.
- Fügen Sie der ersten Spalte 90 L VON CAMHB und allen anderen Brunnen 50 L hinzu. Führen Sie dann eine serielle 2-fache Verdünnung über die Platte aus.
- Mischen Sie die Mid-Log-Phasenkulturen gründlich, dann auf 106 Koloniebildeinheiten (CFU)/ml und fügen Sie 50 l zu allen Brunnen hinzu, um eine Endkonzentration von 5 x 105 KBE/ml zu erreichen.
Kulturvolumen (mL) = (Medienvolumen in mL)/(OD600 x 1.000)
z.B. für eine OD600 = 0,5-Kultur bei einem gewünschten Medienvolumen von 12 ml (12/(0,5 x 1.000) = 0,024 ml Kultur auf 12 ml Medien - Die Platten mit Deckeln bedecken und bei 37 °C für 18 bis 24 H ohne Schütteln bebrüten.
- Überprüfen Sie die Platten visuell, wobei das MIC die niedrigste Konzentration gut und ohne sichtbares Wachstum ist.
HINWEIS: Siehe Tabelle 1 für einige Beispiele für aktive und inaktive fluoreszierende Antibiotika.
4. Analyse der Sondenakkumulation durch Spektrophotometrie und Durchflusszytometrie
HINWEIS: Diese Zentrifugationszeiten wurden für E. colioptimiert, so dass leichte Veränderungen für andere Arten erforderlich sein können. Repräsentative Daten für die Sondenakkumulation werden für die NBD-markierte Ciprofloxacinsonde gemeldet.
- Streifen Glycerin-Bestände der Bakterienstämme auf LB-Agar und wachsen über Nacht bei 37 °C.
- Wählen Sie eine einzelne Kolonie aus der Platte und Kultur über Nacht in LB bei 37 °C.
- Verdünnen Sie die Nachtkulturen in den Medien um das 50-fache und wachsen Sie bis zur mittleren Logphase (OD600 = 0,4–0,8).
- Zentrifugieren Sie die Kulturen bei 1.470 x g für 25 min und dekantieren Sie die Medien.
- Die Bakterien in 1 ml Phosphat-gepufferter Saline (PBS) aussetzen, dann 15 min zentrifugieren bei 1.470 x g.
- Dekantieren Sie die Medien und setzen Sie die gewaschenen Pellets in PBS auf eine endgültige OD600 = 2 aus.
- Auf Wunsch 10,1 l Carbonylcyanid 3-Chlorphenylhydrazone (CCCP, 10 mM in PBS) auf 1 ml Bakterien (Endkonzentration 100 m) geben und 10 min bei 37 °C inkubieren.
HINWEIS: CCCP ist ein Efflux-Pumpeninhibitor. Die Hinzufügung von CCCP wird die Untersuchung der Auswirkungen von Efflux ermöglichen. - Zentrifugieren Sie die Kulturen bei 18.000 x g für 4 min bei 20 °C und dekantieren Sie die Medien.
- 1 ml fluoreszierende Antibiotikalösung (10–100 M in PBS) in das Pellet geben und 30 min bei 37 °C inkubieren.
- Zentrifugieren Sie die Kulturen bei 18.000 x g für 7 min bei 4 °C und dekantieren Sie die Medien.
- Setzen Sie die Bakterien in 1 ml kaltem PBS aus, und wiederholen Sie Schritt 4.9.
- Wiederholen Sie Schritt 4.10 insgesamt 4x.
- Auf Wunsch Lysebakterien durch Zugabe von 180 l Lysepuffer (20 mM Tris-HCl, pH 8,0 und 2 mM Natrium EDTA) dann 70 l Lysozym (72 mg/ml in H2O).
- Bei 37 °C 30 min inkubieren, dann 3x einfrieren (ca. 78 °C für 5 min, dann 34 °C für 15 min).
- Beschallen Sie die Proben für 20 min, dann erhitzen Sie auf 65 °C für 30 min.
- Zentrifugieren Sie die lysierten Proben (18.000 x g, 8 min), dann filtern Sie durch eine 10 kDa Filtermembran.
- Waschen Sie den Filter 4x mit 100 l Wasser.
- Übertragen Sie das Lysat auf eine flache schwarze 96-Wellplatte und messen Sie die Fluoreszenzintensität auf einem Plattenleser mit anregungs- und Emissionswellenlängen, die für das Fluorophor geeignet sind (d. h. DMACA:ex = 400 nm,em = 490 nm; NBD:- ex = 475 nm, -em = 545 nm).
ANMERKUNG: Siehe Abbildung 3 für Beispiele für spektrophotometrische Analysen von Bakterien mit dem fluoreszierenden NBD-gekennzeichneten Ciprofloxacin-Antibiotikum. - Für die Analyse durch Durchflusszytometrie können die gleichen Wachstums- und Färbebedingungen verwendet werden (Schritte 4.1–4.17), wobei Änderungen ausschließlich in der endgültigen Vorbereitung vorgenommen werden.
- Bringen Sie das Gesamtvolumen auf 1 ml PBS.
- Lesen Sie Proben auf einem Durchflusszytometer mit einer Durchflussrate von ca. 60 l/min, mit logarithmischer Amplifikation für die Datenerfassung (F1-Anregung = 488 nm; Emission = 525/20 nm).
- Zeichnen Sie insgesamt 10.000 Ereignisse auf und analysieren Sie die Daten dann mit entsprechender Software.
- Zeichnen Sie die Fluoreszenzintensität von F1 gegen die Anzahl der Ereignisse und schätzen Sie die mittlere Fluoreszenzintensität von den Histogrammspitzen, nachdem die Bakterien gefärbt wurden.
HINWEIS: Siehe Abbildung 4 für Beispiele für Durchflusszytometrieanalysen von Bakterien mit dem NBD-gekennzeichneten Ciprofloxacin-Antibiotikum.
5. Vorbereitung für die mikroskopische Analyse
- Wachsen Sie Subkulturen zu OD600 = 0,4, wie bei der MIC-Bewertung, dann teilen Sie sich in 1 ml Aliquots und Zentrifuge bei 18.000 x g für 3-5 min.
- Dekantieren und entsorgen Sie Medien, und setzen Sie dann das bakterielle Pellet in 500 l HBSS wieder aus.
- Zentrifugieren Bei 18.000 x g für 3 min, dann Dekant und entsorgen Medien.
- Bereiten Sie Lösungen von Antibiotika-Sonden in HBSS in Konzentrationen von 1–100 M vor.
- Setzen Sie die gewaschenen Bakterien in 500 l der Sondenlösung wieder auf und brüten Sie 30 min bei 37 °C.
- Wiederholen Sie Schritt 5.3. Für ein Mehrfach-Etikettierungsexperiment das Pellet in 500 l eines orthogonal gefärbten Nukleinsäurefarbstoffs wieder aufsetzen. Verwenden Sie für Grün Syto9 (5 m in HBSS); für blau verwenden Sie Hoechst 33342 (20 g/ml in HBSS). Inkubieren bei RT für 15-30 min.
- Wiederholen Sie Schritt 5.3, dann in 500 l FM4-64FX (5 g/ml in HBSS) wieder aufsetzen und bei RT für 5 min inkubieren.
- Wiederholen Sie Schritt 5.3, setzen Sie dann in 500 l HBSS erneut ab, und wiederholen Sie Schritt 5.3 erneut.
- Wiederholen Sie Schritt 5.8, und setzen Sie schließlich die gewaschenen, gefärbten Bakterien in 15 l Montagemedium aus (siehe Tabelle der Materialien).
- Pipette Montagemedium auf einem Mikroskop-Schlitten und oben mit einem hochleistungsstarken Abdeckung supg, dann versiegeln Kanten mit klarem Nagellack.
ANMERKUNG: Siehe Abbildung 5 für Beispiele für konfokale Mikroskopiebilder, die mit NBD-gekennzeichneten Ciprofloxacin- und Trimethoprim-Antibiotika aufgenommen wurden, sowie Abbildung 6 für Dasazolidinon(Linezolid) mit DMACA-Kennzeichnung.
Ergebnisse
Abbildung 1 Veranschaulicht die Schlüsselklick-Chemiereaktion (A) für die Herstellung der fluoreszierenden Antibiotika und mit (B) Beispielen von Strukturen unserer veröffentlichten fluoreszierenden Antibiotika auf Basis von Ciprofloxacin (Cipro), Trimethoprim (TMP) und Linezolid. Diese Sonden wurden alle aus den entsprechenden Antibiotika über ein Azid-Zwischenprodukt synthetisiert. Sie wurden dann an die NBD- und DMACA-Fluorophore gekoppelt, die jeweils mit einem Alkyn funktionalisiert wurden.
Abbildung 2 zeigt Beispiel LCMS-Spuren aus einer Ciprofloxacin-N3- und NBD-Alkyn-Klickreaktion, bei der das Azid mit 3,2 min und das Produkt bei 3,8 min eluierte. Spectra 3 zeigt die Auswirkungen der Reinigung, wobei fehlerhafte Spitzen aus den MS- und UV-Spuren verschwinden. Sowohl Reinheit senz- als auch Reaktionsfortschritt könnten durch die Integration des Produktspitzen und etwaige Verunreinigungsspitzen quantifiziert werden.
Abbildung 3 zeigt typische Ergebnisse aus der Bewertung der intrazellulären Akkumulation durch Fluoreszenzspektroskopie in Gegenwart und Abwesenheit von Efflux. In diesem Experiment wurde E. coli mit TMP-NBD mit oder ohne Zugabe von CCCP behandelt, das die Protonen-Motivkraft (PMF) zusammenbricht. Die intrazelluläre Fluoreszenz der Bakterien war signifikant höher, wenn sie mit CCCP vorbehandelt wurde, was darauf hindeutet, dass Efflux die Akkumulation in diesen Bakterien reduzierte. Dieses Experiment wurde wiederholt mit Bakterien mit einem Mangel an tolC, zeigt die Kapazität dieses Assays, um die Auswirkungen der einzelnen Efflux-Pumpenkomponenten zu untersuchen. In diesem Fall, obwohl es eine Zunahme der intrazellulären Fluoreszenz im Vergleich zu den wildTyp-Bakterien gab, stieg die CCCP-Akkumulation noch an. Diese Ergebnisse deuten darauf hin, dass tolC an TMP efflux teilnimmt, aber nicht die einzige BETEILIGTe PMF-Antriebspumpe ist.
Abbildung 4 zeigt das Ergebnis desselben Experiments wie Abbildung 2, jedoch mit der Akkumulation, die durch Durchflusszytometrie anstelle der Spektroskopie gemessen wird. Die gleichen Datentrends wurden beobachtet, was zeigt, dass beide Techniken verwendet werden können, um das Phänomen der efflux vermittelten intrazellulären Akkumulation zu untersuchen.
Abbildung 5 zeigt repräsentative konfokale Mikroskopiebilder von grampositiven (S. aureus) und gramnegativen Bakterien (E. coli), die mit TMP-NBD (1) bzw. Cipro-NBD ( 2+ 3) fluoreszierenden Sonden beschriftet sind. In beiden Fällen wurde der rote Membranfarbstoff FM4-64FX hinzugefügt, um die Kolokalisierung zu vergleichen. Für TMP-NBD wurde auch der blaue Nukleinsäurefarbstoff Hoechst-33342 verwendet. Durch die Überlagerung dieser Bilder wurde die Lokalisation des Antibiotikums in den Bakterien visualisiert. Der Vergleich der Panels 2 und 3 zeigt, wie die Auswirkungen von Efflux untersucht wurden, wobei der Efflux-Inhibitor CCCP in 2verwendet wurde, was zu einer intrazellulären Akkumulation führte. In Panel 3wurde kein CCCP hinzugefügt. Daher ist Efflux aktiv und es wurde keine Sondenakkumulation beobachtet.
Abbildung 6 zeigt repräsentative konfokale Mikroskopiebilder von Gram-positiven (S. aureus) Bakterien, die mit DMACA-markierter Oxazolidinonsonde Lz-NBD gekennzeichnet sind. Der rote Membranfarbstoff FM4-64FX wurde hinzugefügt, um die Kolokalisierung zu vergleichen, und auch der grüne Nukleinsäurefarbstoff Hoechst-33342 wurde verwendet. Durch die Überlagerung dieser Bilder wurde die Lokalisation des Antibiotikums in den Bakterien visualisiert, die eine interne Lokalisation zeigt, die sich von der Membran und der Nukleinsäure unterscheidet.
Tabelle 1 zeigt MIC-Werte für drei Reihen von fluoreszierenden Antibiotika, Ciprofloxacin, Trimethoprim (TMP) und Linezolid (Lz), wobei Daten für das Mutterantibiotikum, NBD und DMACA-Derivate jeweils dargestellt werden. Für jedes Antibiotikum wurden repräsentative Arten ausgewählt, einschließlich grampositiv und gramnegativ. Für die Ciprofloxacin-Serie verloren beide fluoreszierenden Sonden im Vergleich zum Muttermedikament antibiotikaische Aktivität, behielten aber eine gewisse Aktivität gegen alle Arten bei. In ähnlicher Weise verloren die Linezolid-Sonden einige Aktivität, blieben aber ein mäßiges bis schwaches Antibiotikum. Die TMP-Sonden verloren fast alle Aktivitäten gegen Wildtypbakterien, waren aber gegen efflux-defizienten E. coliaktiv, was darauf hindeutet, dass der Verlust antibakterieller Aktivität auf mangelnde Akkumulation zurückzuführen war.

Abbildung 1: Synthese und Strukturen von antibiotikaabgeleiteten Sonden. (A) Das allgemeine Reaktionsschema für die Synthese von fluoreszierenden Antibiotikasonden aus Azid-Antibiotika und Alkyn-Fluorophoren. (B) Die Strukturen unserer veröffentlichten Sonden basieren auf Ciprofloxacin, Trimethoprim und Linezolid. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
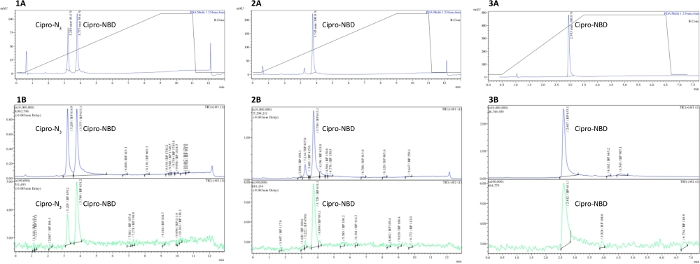
Abbildung 2: Messung der von Antibiotika abgeleiteten Sondenreinheit durch LCMS. Analytische LCMS-Spuren von (1) unvollständigen, (2) vollständigen und (3) HPLC gereinigten Ciprofloxacin-N3 + NBD-Alkyn-Klickreaktionen, die das Verschwinden des Ausgangsmaterials nach Abschluss der Reaktion und verschiedene Spitzen bei der Reinigung belegen. A = UV-Vis-Spur (Absorption bei 250 nm), B = MS-Ablauf (positiver und negativer Modus). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Plattenlesermessung der von Antibiotika abgeleiteten Sondenakkumulation. Fluoreszenzspektroskopische Messung der zellulären Akkumulation von TMP-NBD (50 M) in Wildart (1, ATCC 25922) und-tolC (2, ATCC 25922) E. coli inkubiert (A) mit und (B) ohne Zugabe von CCCP (100 m). Die statistische Signifikanz (**p - 0,01; ***p - 0,001) wird zwischen dem Fehlen oder Vorhandensein von CCCP und zwischen Wildtyp undTolCE. colidargestellt. Die gemeldeten Daten sind der Mittelwert für drei Experimente. Diese Zahl ist an unsere vorherige Publikation15angepasst und veranschaulicht den Einsatz der Spektroskopie, um die Rolle des Efflux bei der intrazellulären Akkumulation aufzuklären. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
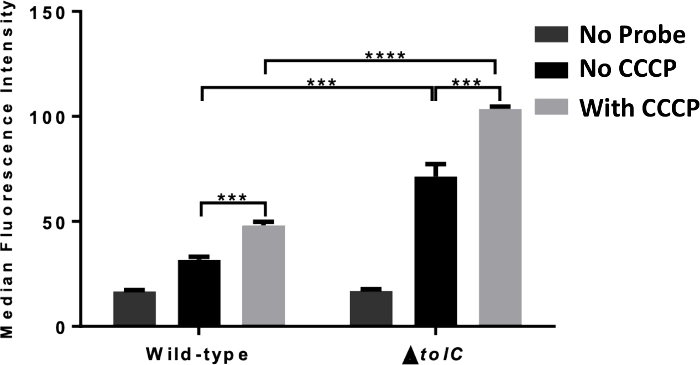
Abbildung 4: Durchflusszytometriemessung der von Antibiotika abgeleiteten Sondenakkumulation. Durchflusszytometriemessung der zellulären Akkumulation mit TMP-NBD in freier Wildbahn (1, ATCC 25922) und-tolC (2, ATCC 25922) E. coli mit und ohne Zusatz von CCCP (100 m). Die mediane Fluoreszenzaktivität wird aus 10.000 bakteriellen Ereignissen dargestellt, die statistische Signifikanz (***, p 0,001; ****, p -0001) wird zwischen dem Fehlen und Vorhandensein von CCCP und zwischen Wildtyp undTolCE. colidargestellt. Die gemeldeten Daten sind der Mittelwert für drei Experimente. Diese Abbildung ist an unsere vorherige Publikation15angepasst und veranschaulicht den Einsatz von Strömungszytometrie, um die Rolle des Efflux bei der intrazellulären Akkumulation aufzuklären. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Visualisierung der Konfokalen Mikroskopie der NBD-Sondenlokalisierung. Konfokale Mikroskopie Bilder von 1) live S. aureus mit Hoechst-33342 (blau, Nukleinsäure), TMP-NBD (grün), FM4-64FX (rot, Membran) und überlagert; 2) lebende E. coli mit CCCP (Efflux-Hemmer) mit Cipro-NBD (grün), FM4-64FX (rot, Membran) und überlagert behandelt; 3) lebendes E. coli mit Cipro-NBD (grün), FM4-64FX (rot, Membran) und überlagert. Diese Zahl ist an unsere früheren Veröffentlichungen15,16, angepasst und veranschaulicht den Einsatz von Mikroskopie zur Untersuchung der Sondenlokalisierung, einschließlich der Auswirkungen von efflux. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Visualisierung der Konfokalmikroskopie der DMACA-Sondenlokalisierung. Konfokale Mikroskopie bilder von live S. aureus beschriftet mit Oxazolidinone Sonde Lz-DMACA (blau), Sytox grün (grün, Nukleinsäure) und FM4-64FX (rot, Membran). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| MIC (g/ml) | |||||||||||
| Spezies | Belastung | Cipro | Cipro-NBD | Cipro-DMACA | Tmp | TMP-NBD | TMP-DMACA | Linezolid (Lz) | Lz-NBD | Lz-DMACA | |
| Staphylococcus aureus | ATCC 25923 | 0.125 - 0.5 | 32 - 64 € | 16 | 1 | 16 | >64 | ||||
| ATCC 43300 | 1 | 16 | >64 | ||||||||
| Streptococcus pneumoniae | ATCC 700677 | 1 | 4 | 64 | |||||||
| Enterococcus faecium | ATCC 35667 | 1 - 8 | 32 | 32 - 64 € | |||||||
| ATCC 51559 | 2 | 16 | 32 | ||||||||
| Klebsiella pneumoniae | ATCC 13883 | 0.015 - 0.06 | 8 - 16 | 8 - 32 | |||||||
| Pseudomonas aeruginosa | ATCC 27853 | 0.25 - 1 | 32 - 64 € | 32 - 64 € | |||||||
| Escherichia coli | ATCC 25922 | 0,004 € | 8 | 2 | 0.5 | >64 | >64 | ||||
| Mutant 'tolC | 0.125 | 0.25 | 2 | ||||||||
Tabelle 1. Antibiotika-Aktivitäten von fluoreszierenden Antibiotika-Sonden auf Basis von Ciprofloxacin, Trimethoprim und Linezolid gegen geeignete klinisch relevante Bakterienstämme, gemessen durch Brühe Mikroverdünnung MIC-Assays. In den meisten Fällen verloren die Sonden einige Aktivität im Vergleich zum Elternmedikament, behielten aber einige messbare Antibiotika-Potenz (ausreichend, um in weiteren Studien nützlich zu sein).
Diskussion
Die Schaffung einer erfolgreichen fluoreszierenden Antibiotikasonde muss mit einer sorgfältigen Planung und Prüfung der SAR des Muttermedikaments beginnen. Wenn die SAR nicht bekannt oder vollständig erforscht ist, müssen möglicherweise mehrere Optionen getestet werden, um eine Website zu finden, die selektiv geändert werden kann, ohne die biologische Aktivität abzuschaffen. Sobald ein Standort/die Standorte identifiziert wurden, ist die Installation eines Linker-Moietys oft unerlässlich, um einen sterischen Abstand zwischen dem biologischen Wirkungsort und dem inaktiven Fluorophor zu schaffen. Es ist darauf zu achten, dass die Reaktion, die verwendet wird, um den Linker an das Antibiotikum zu befestigen, eine biostabile funktionelle Gruppe hinterlässt, um beispielsweise Ester zu vermeiden, die durch Esterasen in vivo anfällig für Spaltung sind. Je nach pharmakodynamischem und pharmakokinetischem Profil des Antibiotikums kann ein einfacher Alkyllinker verwendet werden, oder es sollte eine weniger lipophile Option wie ein Linker aus Polyethylenglykol (PEG) in Betracht gezogen werden. Wenn der Linker angebracht ist, sollte die antibakterielle Aktivität bewertet werden, um sicherzustellen, dass die MICs gegen relevante Bakterien der Stammverbindung ähneln.
In dieser Arbeit empfehlen wir die Verwendung von Huigsen Azid-Alkyn [3+2] dipolarer Cycloaddition (Klickchemie, siehe Abbildung 1) zum Ligatenfluorophor zum Antibiotikum, aus einer Reihe von Gründen. Klickreaktionen sind sehr selektiv, was bedeutet, dass der Schutz von reaktiven Gruppen auf dem Antibiotikum nicht notwendig ist, und darüber hinaus hinterlässt die Reaktion eine stabile, biokompatible Triazol-Feuchtigkeit. Die Azidkomponente wird in den Antibiotikum-Anteil in unseren Verfahren eingeführt, da dies in der Regel leichter mit einer Vielzahl von Strukturtypen als die Einführung eines Alkyns erreicht werden kann. Die Synthesen zweier alkyn-derivatisierter Fluorophore werden hier beschrieben, andere könnten jedoch auf Wunsch erforscht werden. NBD und DMACA wurden aufgrund ihrer geringen Größe ausgewählt, wodurch die Möglichkeit einer Störung der Zelldurchdringung und der Zielinteraktion minimiert wurde. Die Klickreaktion selbst erfolgt mit Kupferkatalyse, wobei entweder Cu2+ (CuSO4, mit einem Ascorbinsäurereduktionsmittel) oder Cu+ (CuI) als Ausgangsreagenz verwendet werden kann. Nach der Reinigung (Abbildung 2) sollten die MICs dann wie beim Azid getestet werden. Selbst bei sorgfältiger Abwägung der Fluorophorwahl und der Anhaftungsstelle ist es möglich, dass eine schlechte Antibiotikaaktivität beobachtet wird. Dies bedeutet jedoch nicht, dass eine inaktive Sonde ohne Gebrauch ist. Wie bei den TMP-Sonden gezeigt, können Verbindungen mit schlechter antibakterieller Aktivität immer noch an das gleiche Ziel wie das Muttermedikament binden. Dies kann Studien über die Wirkweise und Untersuchung von Phänomenen ermöglichen, die zu Resistenzen führen, wie z. B. Efflux.
Wie im Protokollabschnitt beschrieben, ist es möglich, die bakterielle Kennzeichnung durch die fluoreszierenden Antibiotika entweder mit einem einfachen Spektrophotometrie-Assay (Abbildung 3) oder einer Durchflusszytometrie (Abbildung 4) zu analysieren. Beide Methoden sind in der Lage, die zelluläre Akkumulation zu quantifizieren, und durch Lysing von Zellen und die Untersuchung der Fluoreszenzlokalisierung in Lysat ist es möglich, die intrazelluläre Akkumulation zu bewerten. In diesem Protokoll wird die Verwendung von Lysozym für die Zelllyse beschrieben, da es sich um eine schnelle, universelle Technik handelt. Auch andere Lysebedingungen, wie die Nachtbehandlung mit Glycin-HCl7,wurden erfolgreich eingesetzt. Mit dieser Technik, Es ist möglich, die Auswirkungen von Efflux auf Antibiotika-Zellakkumulation zu studieren, Dies ist ein wichtiger Mechanismus der Resistenz. Wenn Efflux tatsächlich in den Bakterien vorhanden ist, wird ein Mangel an intrazellulärer Akkumulation beobachtet werden, obwohl dies mit einem Efflux-Hemmer wie CCCP gerettet werden kann.
Die Mikroskopie kann auch durchgeführt werden, um die Lokalisation von Sonden bei verschiedenen Bakterien visuell zu untersuchen, Informationen über die Wirkart und möglicherweise auch Resistenzen zu sammeln (repräsentative Beispiele siehe Abbildung 5). Um die Lokalisierung innerhalb von Bakterien zu sehen, ist ein hochauflösendes Konfokalmikroskop erforderlich, das mit Funktionen wie SIM (strukturierte Beleuchtungsmikroskopie), SR-SIM (Superresolution-SIM), Airyscan oder STED (stimulierte Emissionserschöpfung) ausgestattet ist. Darüber hinaus sollten hochleistungsstarke Abdeckungsscheine verwendet und nach-Imaging-Analysen mit einer geeigneten Software (z. B. FIJI, Zen oder Imaris) durchgeführt werden. Die Lokalisierung von Sonden wird mit Farbstoffen verglichen, die bestimmte Architekturen färben, wie Hoechst-33342 (blau, Nukleinsäure), Syto-9 (grün, Nukleinsäure) und FM4-64FX (rot, Membran). Die Wahl der Farbstoffe sollte so getroffen werden, dass sie dem fluoreszierenden Antibiotikum entspricht, so dass jede verwendete Farbe minimale spektrale Überlappung hat. Um die bestmöglichen Bilder zu erhalten, kann eine Optimierung erforderlich sein. Zum Beispiel, wenn Bakterien auf der Rutsche zu überfüllt sind, nehmen Sie nur einen Teil des aufgehängten Pellets, dann verdünnen Sie mit mehr Montagemedium. Im Gegensatz dazu, wenn Bakterien zu spärlich auf der Rutsche sind, beginnen Sie einfach mit mehr Bakterien. In diesem Protokoll wird die Verwendung eines thermoreversiblen Gels empfohlen, das mit lebenden Zellen (z. B. Cygel) kompatibel ist, da es Bakterien (einschließlich motiler Bakterien) immobilisiert, aber auch andere Montagemedien oder Agarose erfolgreich eingesetzt wurden.
Insgesamt machen diese Sonden trotz der Herausforderungen, denen bei der Herstellung eines biologisch aktiven fluoreszierenden Antibiotikaderivats begegnet sein kann, die Einfachheit ihrer Verwendung und ihre Vielseitigkeit zu attraktiven Werkzeugen für die Forschung in AMR. Zukünftige Arbeiten mit fluoreszierenden Antibiotika haben das Potenzial, Einblicke in Mechanismen der Antibiotikaresistenz zu geben, unser Verständnis der Funktionsweise aktueller Antibiotika zu verbessern und die Entwicklung besserer Medikamente zu unterstützen.
Offenlegungen
Die Autoren haben nichts zu erklären.
Danksagungen
MRLS wird durch einen Australian Postgraduate Award (APA) und einen Institute for Molecular Biosciences Research Advancement Award unterstützt. Wanida Phetsang wurde von UQ International Scholarship (UQI) und IMB Postgraduate Award (IMBPA) unterstützt. MAC ist ein NHMRC-Prinzip Forschungsstipendiat (APP1059354) und hält auch eine fraktionierte Professoren-Forschungsstipendiat in der University of Queensland, mit seiner verbleibenden Zeit als CEO von Inflazome Ltd, ein Unternehmen, das Medikamente entwickelt, um klinische unerfüllte Bedürfnisse bei entzündlichen Erkrankungen zu adressieren. MATB wird teilweise von Wellcome Trust Strategic Grant WT1104797/Z/14/Z und NHMRC Development Grant APP1113719 unterstützt. Die Mikroskopie wurde an der Australian Cancer Research Foundation (ACRF)/Institute for Molecular Bioscience Cancer Biology Imaging Facility durchgeführt, die mit Unterstützung des ACRF gegründet wurde.
Materialien
| Name | Company | Catalog Number | Comments |
| 3-(dimethylamino)phenol | Alfa-Aesar | B23067 | |
| 4-chloro-7-nitro-benzofuran | Sigma-Aldrich | 163260-5G | |
| Amicon Ultra-0.5 centrifugal filter unit with Ultracel- 10 membrane | Merck | UFC501096 | |
| Atlantis Prep T3 OBD (100 A, 5 uM, 10x250 mm) | Waters | 186008205 | |
| Atlantis T3 column (100 A, 5 uM, 2.1 × 50 mm) | Waters | 186003734 | |
| Bruker Avance 600 MHz spectrometer | Bruker | ||
| Buchi Reveleris C18 12g Cartridge | Buchi | BUC145152103 | |
| CCCP | Sigma-Aldrich | C2759 | |
| Celite 545 | Sigma-Aldrich | 22140-5KG-F | |
| Cygel | ABCAM | Ab109204 | |
| Elyra PS,1 SIM/STORM confocal microscope | Zeiss | ||
| FM4-64FX, fixable analog of FM™ 4-64 membrane stain | Life Technologies Australia Pt | F34653 | |
| Gallios flow cytometer | Beckman Coulter | ||
| Gamma 2-16 LSCplus lyophilise | CHRIST | ||
| Gilson HPLC 2020 | Gilson | ||
| Hanks' Balanced Salt solution, Modified, with sodium bicarbonate, without phenol red, calcium chloride and magnesium sulfate, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | H6648-500ML | |
| Hettich Zentrifugen Rotofix 32 | Hettich | ||
| High performance #1.5 cover slips (18 x 18 mm) | Schott/Zeiss | 474030-9000-000 | |
| Hoechst 33342, Trihydrochloride, Trihydrate - Fluo | Life Technologies Australia Pt | H21492 | |
| LB | AMRESCO | J106 | |
| Leica STED 3X Super Resolution Microscope with White Light Laser excitation | Leica | ||
| Lysozyme from chicken egg white lyophilized powder | Sigma-Aldrich | L6876 | |
| Mueller Hinton II Broth Cation adjusted | Becton Dickinson | 212322 | |
| Propargylamine | Sigma-Aldrich | P50900-5G | |
| Reveleris GRACE MPLC | Buchi | ||
| Shimadzu LCMS-2020 | Shimadzu | ||
| Sigma 1-15 Microcentrifuge | Sigma-Aldrich | ||
| Silica gel 60 (0.040-0.063 mm) for column chromatography (230-400 mesh ASTM) | Merck | 1093859025 | |
| SYTO 9 Green Fluorescent Nucleic Acid Stain | Life Technologies Australia Pt | S34854 | |
| TECAN Infinite M1000 PRO | TECAN |
Referenzen
- Cai, H., Rose, K., Liang, L. H., Dunham, S., Stover, C. Development of a liquid chromatography/mass spectrometry-based drug accumulation assay in Pseudomonas aeruginosa. Analytical Biochemistry. 385 (2), 321-325 (2009).
- Bhat, J., Narayan, A., Venkatraman, J., Chatterji, M. LC-MS based assay to measure intracellular compound levels in Mycobacterium smegmatis: Linking compound levels to cellular potency. Journal of Microbiological Methods. 94 (2), 152-158 (2013).
- Davis, T. D., Gerry, C. J., Tan, D. S. General Platform for Systematic Quantitative Evaluation of Small-Molecule Permeability in Bacteria. ACS Chemical Biology. 9 (11), 2535-2544 (2014).
- Richter, M. F., et al. Predictive compound accumulation rules yield a broad-spectrum antibiotic. Nature. 545, 299(2017).
- Iyer, R., et al. Evaluating LC-MS/MS To Measure Accumulation of Compounds within Bacteria. ACS Infectious Diseases. 4 (9), 1336-1345 (2018).
- Prochnow, H., et al. Subcellular Quantification of Uptake in Gram-Negative Bacteria. Analytical Chemistry. 91 (3), 1863-1872 (2019).
- Dumont, E., et al. Antibiotics and efflux: combined spectrofluorimetry and mass spectrometry to evaluate the involvement of concentration and efflux activity in antibiotic intracellular accumulation. Journal of Antimicrobial Chemotherapy. 74 (1), 58-65 (2019).
- Stone, M. R. L., Butler, M. S., Phetsang, W., Cooper, M. A., Blaskovich, M. A. T. Fluorescent Antibiotics: New Research Tools to Fight Antibiotic Resistance. Trends in Biotechnology. 36 (5), 523-536 (2018).
- Piddock, L. J. V., Johnson, M. M. Accumulation of 10 fluoroquinolones by wild-type or efflux mutant Streptococcus pneumoniae. Antimicrobial Agents and Chemotherapy. 46 (3), 813-820 (2002).
- Mortimer, P. G. S., Piddock, L. J. V. A comparison of methods used for measuring the accumulation of quinolones by enterobacteriaceae, pseudomonas aeruginosa and staphylococcus aureus. Journal of Antimicrobial Chemotherapy. 28 (5), 639-653 (1991).
- Li, X. Z., Nikaido, H., Poole, K. Role of MexA-MexB-OprM in antibiotic efflux in Pseudomonas aeruginosa. Antimicrobial Agents and Chemotherapy. 39 (9), 1948-1953 (1995).
- Vince, R., Weiss, D., Pestka, S. Binding of N-substituted erythromycylamines to ribosomes. Antimicrobial Agents and Chemotherapy. 9 (1), 131-136 (1976).
- Vazquez, D. Antibiotics affecting chloramphenicol uptake by bacteria Their effect on amino acid incorporation in a cell-free system. Biochimica et Biophysica Acta (BBA) - Nucleic Acids and Protein Synthesis. 114 (2), 289-295 (1966).
- Phetsang, W., et al. An azido-oxazolidinone antibiotic for live bacterial cell imaging and generation of antibiotic variants. Bioorganic and Medicinal Chemistry. 22 (16), 4490-4498 (2014).
- Phetsang, W., et al. Fluorescent trimethoprim conjugate probes to assess drug accumulation in wild type and mutant Escherichia coli. ACS Infectious Diseases. 2 (10), 688-701 (2016).
- Stone, M. R. L., et al. Fluoroquinolone-derived fluorescent probes for studies of bacterial penetration and efflux. MedChemComm. 10 (6), 901-906 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten