Method Article
الفحص الاستراتيجي وتوصيف مجمع إشارات البروتين البصرية GPCR-mini-G للتبلور الناجح
In This Article
Summary
يصف هذا التقرير فحص المنظفات المختلفة لإعداد GPCR البصرية، رودوبسين، ومجمعها مع مصغرة Go. يتم عرض الطرق الكيميائية الحيوية التي تميز نوعية المجمع في مراحل مختلفة أثناء التنقية. يمكن تعميم هذا البروتوكول على مجمعات بروتين غشاء أخرى لدراساتهم الهيكلية في المستقبل.
Abstract
المفتاح لتحديد الهياكل البلورية للمجمعات البروتينية الغشائية هو جودة العينة قبل التبلور. على وجه الخصوص ، فإن اختيار المنظفات أمر بالغ الأهمية ، لأنه يؤثر على استقرار المجمع وتشتته. لقد حددنا مؤخرًا الهيكل البلوري لحالة نشطة من الرودوبسين البقري إلى جانب بروتين G المهندس ، mini-Go، بدقة 3.1 Å. هنا، نحن بالتفصيل إجراءات لتحسين إعداد rhodopsin-mini-G-O مجمع.o تم إعداد رودوبسين الحالة الداكنة في المنظفات الكلاسيكية والنيوبينتيل جليكول (NPG) ، تليها تشكيل معقد مع Mini-Go تحت التعرض للضوء. تم تقييم استقرار رودوبسين من خلال التحليل الطيفي المرئي للأشعة فوق البنفسجية (UV-VIS) ، والذي يراقب إعادة التشكيل إلى رودوبسين في ليغاند الحساسللضوء ، 9-cisal. تم استخدام الكروماتوغرافيا التلقائية للاستبعاد من الحجم (SEC) لتوصيف التشتت الأحادي للرودوبسين ومركب رودوبسين-مينيجي. SDS-polyacrylamide electrophoresis (SDS-PAGE) أكد تشكيل المجمع من خلال تحديد نسبة 1:1 الأضراس بين رودوبسين وميني جيس بعد تلطيخ الجل مع الأزرق كوماسي. بعد التحقق من صحة جميع هذه البيانات التحليلية ، تخلصنا من المنظفات غير المناسبة واستمرنا مع أفضل المنظفات المرشحة لإعداد وتبلور على نطاق واسع. نشأت مشكلة إضافية من عدم تجانس N-glycosylation. لوحظ أن رودوبسين المعبر عنه بشكل مغاير على SDS-PAGE يحتوي على مجموعتين مختلفتين من N-glycosylated ، والتي ربما كانت ستعوق تولد البلورات. لذلك ، تم اختبار إنزيمات deglycosylation المختلفة ، وأنتجت endoglycosidase F1 (EndoF1) رودوبسين مع نوع واحد من N-glycosylation. مع هذا الخط الاستراتيجي لتوصيف جودة البروتين ، تم تحسين إعدادمركب rhodopsin-mini-G لتقديم الهيكل البلوري. كان هذا فقط الهيكل البلوري الثالث لمركب إشارات البروتين GPCR-G. ويمكن أيضا أن يكون هذا النهج معممة للبروتينات الغشائية الأخرى ومجمعاتها لتسهيل إعداد العينة وتحديد الهيكل.
Introduction
كان تحديد الهياكل البلورية للبروتينات الغشائية ومجمعاتها دائمًا تحديًا بسبب الصعوبات في الحصول على بلورات جيدة الانتشار. على النقيض من البروتينات القابلة للذوبان ، تتكون بروتينات الغشاء المتكاملة من نواة كارهة للماء تمتد عبر غشاء الخلية. لإزالة بروتينات الغشاء من غشاء الخلية إلى عازل مائي ، يجب استخدام المنظفات لتشكيل micelle المنظفات البروتينية ، وبالتالي استبدال الدهون حول جوهر الكاره للماء من بروتينات الغشاء. يعتمد استقرار ونشاط وسلامة بروتينات الغشاء بشكل مباشر على الخصائص الكيميائية والهيكلية للمنظفات1، كما تحدد خصائص المنظفات حجم الميكيل. قد المنظفات micelle كبيرة انسداد الأسطح المائية من بروتين غشاء صغير، وبالتالي منع تبلور بسبب عدم وجود اتصالات الكريستال عند استخدام طريقة نشر البخار. المنظفات الصغيرة micelle مفيد لعلم البلورات، ولكن المنظفات سلسلة قصيرة عادة ما تكون أقسى، وبالتالي تؤدي إلى زعزعة الاستقرار وتجميع البروتين الغشاء. لذلك ، قبل التبلور ، لا غنى عن إجراء فحص المنظفات الإضافي ، وعادة ما يستهدف المنظفات الأقصر التي لا تزال تحافظ على استقرار البروتين.
مستقبلات G المقترنة بالبروتين (GPCRs) هي بروتينات غشاء متكاملة تحتوي على سبعة من الهيليسات العابرة للأغشية. توجد GPCRs في ولايتين رئيسيتين ، إما حالة غير نشطة استقرت بواسطة ناهضات أو خصوم عكسية ، أو حالة نشطة مرتبطة بناهض واستقرت ببروتين G ، على الرغم من أنه من المرجح أن العديد من الدول الفرعية موجودة بين هذين النقيضين. وضع هيكل تحديد GPCRs في البداية على الدول غير النشطة ملزمة بناهضات عكسية وخصوم بسبب استقرارها أعلى من الدول النشطة2. عندما يتم تنشيط GPCRs على ربط ناهض، ومستقبلات ديناميكية للغاية، وأشكال مشقوق عابرة على الوجه السيتوبلازمي لمستقبلات لاقتران البروتين G. ويعتقد أن هذه الديناميكية هي السبب في أن GPCRs المنضمة إلى ناهض غالبا ما تكون أكثر اضطرابا من الدولة غير النشطة. لذلك ، يصبح من الضروري فحص المنظفات المناسبة للحالة التشكيلية للمستقبلات قيد الدراسة ، لأنه من المرجح أن تكون هناك حاجة إلى منظفات أكثر اعتدالًا لدراسة حالة نشطة مقارنة بحالة غير نشطة.
في هذا التقرير، ونحن نستخدم GPCR البصرية، الردوبسين البقري3،ومجمعها مع ميني Gس البروتين4،,5 لتجارب فحص المنظفات، تمثل الدولة غير النشطة والدولة النشطة، على التوالي. ركز فحص المنظفات على منظفات الألكيل الكلاسيكية والغلوكوسايد والمنظفات neopentyl glycol (NPG). في هذا السياق ، يتم بناء المنظفات الكلاسيكية من مجموعة رأس السكر وسلسلة ألكيل ، في حين أن المنظفات من نوع NPG تحتوي على منظفات كلاسيكية متطابقة تنصهر بواسطة كربون رباعي في الواجهة بين السكريات وسلاسل الألكيل6،7،8.
تم تصميم سير عمل تجريبي بدءًا من تنقية الرودوبسين في المنظفات المختلفة ، يليه تشكيل مركب رودوبسين - ميني جيوتنتهي بتوصيف المجمع باستخدام عدة طرق(الشكل 1). بالنسبة للحالة غير النشطة للرودوبسين ، تم رصد إعادة تشكيل ligand 9-cis الحساسة للضوء عن طريق التحليل الطيفي المرئي للأشعة فوق البنفسجية (UV-VIS). الطيف يكشف عن الحالة الفيزيائية الكيميائية للشبكية ويدل على بيئتها في جيب ربط الشبكية من رودوبسين. تم استخدام الكروماتوغرافيا استبعاد الحجم (SEC) لتقييم monodispersity من رودوبسين المنقى وكذلك تشكيلo rhodopsin-mini-G-o المركب. كما SEC يميز جزيئات البروتين حسب حجمها وشكلها، يمكن تحديد السكان البروتين المجمعة لأنها elute في حجم الفراغ. لتأكيد التكوين المعقد ، تم تقييم الكسور من SEC بواسطة الصوديوم dodecyl كبريتات البولي أكريلاميد هلام الكهربائي (SDS-PAGE) لتأكيد وجود كل من رودوبسين وميني جيس.
عامل آخر يحتاج إلى النظر هو التعديلات ما بعد الترجمة (PTM) على بروتينات الغشاء. PTM مثل N-glycosylation غالبا ما لوحظ على بروتينات غشاء eukaryotic المنتجة في الثدييات ونظم التعبير عن الخلايا الحشرية. تم تطوير سلالة محدودة N-glycosylation من الكلى الجنينية البشرية 293 (HEK293) الخلايا عن طريق حذف الجين ترميز N-acetylglucosamsaminyltransferase الأول (GnTI)، مما أدى إلى متجانسة N-glycosylation من قبل GlcNAc2مان5 في موقع الإجماع Asn-X-Ser/Thr. على الرغم من أنه يمكن منع N-glycosylation عن طريق تحور بقايا الأحماض الأمينية في موقع الإجماع، وهذا قد يغير أيضا وظيفة البروتين أو كفاءة للطي. في رودوبسين البقري، طفرة من بقايا N-غليكوزيل Asn15 يؤدي إلى طي غير صحيحة وانخفاض تنشيط البروتين G9،,10. وقد أعرب عن رودوبسين المستخدمة في هذا التقرير في HEK 293 GnTI نقص خط الخلية. ومع ذلك ، أظهرت SDS-PAGE وجود نوعين من رودوبسين. هذا التغايرية يمكن أن تمنع تكوين الكريستال، وبالتالي تم اختبار deglycosylation باستخدام الببتيد-N-glycosidase F (PNGase F) وendoglycosidase F1 (إندو F1). وقد تميز المنتج deglycosylated SDS-PAGE والطيف اللوني السائل (LC-MS) لتحديد مستوى الجليكوزيل وتجانسه.
Protocol
ملاحظة: هذا البروتوكول لفحص المنظفات مفصل ة ل30 غرام من HEK293 خلية بيليه كمادة البداية.
1- المواد والمواد الكيميائية والكواشف
ملاحظة: يتم إعداد جميع الحلول باستخدام الكواشف التحليلية والمياه فائقة النقاء ، والتي يتم تنقيتها من الماء المنزوع الأيونات للوصول إلى مقاومة 18.2 ميجاسم عند 25 درجة مئوية.
- حلول المخزون الاحتياطي
- إعداد 10x الفوسفات المالحة العازلة (10x PBS).
- إعداد العازلة HEPES: 1 M، مُخَنّم إلى درجة الحموضة 7.5 مع NaOH.
- إعداد 5 M NaCl.
- إعداد 2 M MgCl2.
ملاحظة: يتم تمرير جميع حلول المخزون من خلال مرشح 0.22 ميكرومتر للحفاظ على عقمها.
- حلول مخزون المنظفات
- إعداد dodecyl maltoside (DDM)، 10٪ (ث / v).
- إعداد ديسيل maltoside (DM)، 10٪ (ث / v).
- إعداد 6-سيكلوهيكسيل-هكسيل maltoside (Cymal-6)، 10٪ (ث /v).
- إعداد 5-سيكلوهيكسيل بينتيل المالتوسايد (Cymal-5)، 10٪ (ث / v).
- إعداد nonyl جلوكوسايد (C9G)، 10٪ (ث / v).
- إعداد لوريل مالتوز نيوبينيتيل جليكول (LMNG)، 5٪ (ث / v).
- إعداد decyl maltose neopentyl غليكول (DMNG)، 10٪ (ث / v).
- إعداد cymal-6 neopentyl غليكول (C6NG)، 10٪ (ث / v).
- إعداد cymal-5 neopentyl غليكول (C5NG)، 10٪ (ث / v).
- إعداد الأوكتيل الجلوكوز نيوبينيتيل جليكول (OGNG)، 10٪ (ث / v).
ملاحظة: للحصول على 10٪ محلول مخزون المنظفات، حل 1 غرام من مسحوق المنظفات في الماء فائق النقاء مع هزاز لطيف، ومن ثم ضبط حجم النهائي إلى 10 مل. يجب أن يبقى محلول مخزون المنظفات عند -20 درجة مئوية للتخزين على المدى الطويل وعلى الجليد أثناء العمل.
تنبيه: ينصح عادة المنظفات المعبأة في زجاجات لتخزين في -20 درجة مئوية الفريزر. يجب تسخين الزجاجات التي تحتوي على مسحوق المنظفات إلى درجة حرارة الغرفة قبل فتحها. مسحوق المنظفات هو hygroscopic، لذلك سوف توازن درجة الحرارة منع تشكيل التكثيف التي سوف الرطب المنظفات.
- المواد الكيميائية والكواشف الأخرى
- إعداد 1D4 المناعة agarose راتنج: 10 مل من الطين 50٪.
ملاحظة: أروز المنافية المناعية 1D4 هي حبات الأغروس المرتبطة بالأجسام المضادة Rho1D4 أحادية النسيلة، والتي تربط آخر 9 أحماض أمينية من الرودوبسين البقري TETSQVAPA كما epitope. يعمل أبروس المنافية المناعية 1D4 كمادة تنقية تقارب لالتقاط البروتينات التي تحتوي على تسلسل C-terminal 1D4. ويمكن إعداد هذه المواد تنقية9،,11 أو شراؤها. - إعداد 9-cis الشبكية الحل: 1 mM، حل في الإيثانول 100٪.
ملاحظة: منع التعرض للضوء للشبكية أثناء التحضير والتخزين. - إعداد الببتيد 1D4 (تسلسل TETSQVAPA): 800 ميكرومتر، مذاب في الماء.
- إعداد 1D4 المناعة agarose راتنج: 10 مل من الطين 50٪.
- المخازن المؤقته
ملاحظة: يتم خلط كافة المخازن المؤقتة من حلول المخزون إلى التركيز المطلوب. يتم تبريد جميع المخازن المؤقتة إلى 4 درجة مئوية قبل الاستخدام.- إعداد المخزن المؤقت A: PBS، 0.04% DDM.
- إعداد المخزن المؤقت B: 20 mM HEPES درجة الحموضة 7.5، 150 mM NaCl، 0.04% DDM.
- إعداد المخزن المؤقت C: 20 mM HEPES درجة الحموضة 7.5، 150 mM NaCl، والمنظفات في تركيز العمل المدرجة في الجدول 1.
- إعداد المخزن المؤقت D: 20 mM HEPES درجة الحموضة 7.5، 150 mM NaCl.
- إعداد العازلة Elution: 20 mM HEPES درجة الحموضة 7.5، 150 mM NaCl، 80 ميكرومتر 1D4 الببتيد، والمنظفات في تركيزعملهم.
- إعداد المخزن المؤقت SEC: 20 mM HEPES درجة الحموضة 7.5، 150 mM NaCl، 0.025% DDM; توزيعها من خلال مرشح 0.22 ميكرومتر.
- مذيب لـ LC-MS
- إعداد المذيبات A: الأسيتونتريل يحتوي على 0.1٪ حمض الفورميك.
- إعداد المذيبات B: المياه فائقة النقاء التي تحتوي على 0.1٪ حمض الفورميك.
- إعداد المذيبات C: ايزو بروبانول.
2. غشاء الخلية solubilization واستخراج البروتين
- ذوبان 30 غرام من HEK293 GnTI- خلية بيليه التعبير عن الروهوبسين البقري متحولة N2C/M257Y/D282C3،9 إلى درجة حرارة الغرفة، إضافة 120 مل من 1x PBS العازلة التي تحتوي على مزيج مثبطات البروتياز وتجانس باستخدام المتجانس Dounce أو المتجانس الكهربائي (13،000 دورة في الدقيقة لمدة 30 s). جمع تعليق الخلية المتجانسة في كوب وضبط مستوى الصوت إلى 150 مل.
ملاحظة: 30 غرام من بيليه الخلية يعادل 3 لتر من ثقافة الخلية في 2 × 106 خلية / mL الكثافة. - إضافة بلطف DDM 10٪ إلى الخلايا المتجانسة لإعطاء تركيز نهائي من 1.25٪. يُحرّك على الثلج لمدة ساعة واحدة.
- الطرد المركزي الخلية تصفر عند 4 درجات مئوية و 150،000 × ز لمدة 45 دقيقة لإزالة الحطام unsolubilized.
- نقل supernatant إلى زجاجة 500 مل وإضافة 10 مل من راتنج الآغا الخارقة المناعية 1D4 (50٪ الطين). مزيج بلطف خلية المنسوّر والراتنج لمدة 4 ساعات أو بين عشية وضحاها في 4 درجة مئوية.
- تحميل خليط ليسات / الراتنج إلى عمود مفتوح لجمع الراتنج.
- غسل الراتنج مع 10 مجلدات العمود (السيرة الذاتية) من غسل المخزن المؤقت A.
ملاحظة: حجم العمود هو حجم معبأة (100%) راتنج أغاروز المستخدمة. في هذه الحالة، 1 السيرة الذاتية هو 5 مل. - إعادة تعليق الراتنج مع السيرة الذاتية 2 من المخزن المؤقت A.
تنبيه: من الخطوة 2.8 فصاعداً، يتم وضع علامة على الخطوات التي يجب تنفيذها في ظل حالة الضوء الأحمر الخافتة مع "[الظلام]" في بداية الوصف. - [الظلام] أضف شبكية 9-cis إلى الراتنج المُعَلَّق إلى التركيز النهائي لـ 50 ميكرومتر. مزيج بلطف في 4 درجة مئوية لمدة 4-16 ساعة في الظلام.
ملاحظة: قد يؤدي وقت حضانة أقصر إلى إعادة تكوين الشبكية غير مكتملة. - [الظلام] إزالة التدفق من خلال من العمود. غسل الراتنج مع 20 السيرة الذاتية العازلة A، تليها 15 السيرة الذاتية المخزن المؤقت B.
- [الظلام] إعادة تعليق الراتنج في 2 CV المخزن المؤقت B، ومن ثم تقسيم تعليق الراتنج بالتساوي إلى 10 أعمدة التخلص 10-مل.
- [الظلام] إزالة التدفق من خلال من العمود، ومن ثم إعادة تعليق الراتنج في 1 مل المخزن المؤقت C. احتضان لمدة 1 ساعة في 4 درجة مئوية.
- [الظلام] كرر الخطوة 2.11.
- [الظلام] قم بإزالة التدفق من خلال العمود، ثم قم بإعادة تعليق الراتنج في 0.8 مل Elution المخزن المؤقت لكل عمود. مزيج بلطف لمدة 2 ساعة.
- [الظلام] جمع elution من العمود في أنبوب 2 مل.
- [الظلام] إعادة تعليق الراتنج في 0.7 مل من مخزن Elution المؤقت لكل عمود. مزيج بلطف لمدة 1 ساعة.
- [الظلام] جمع elution من العمود في نفس الأنبوب.
3. الأشعة فوق البنفسجية فيس الطيفية
- إعداد مقياس الطيف الضوئي لتغطية نطاق قياس 250-650 نانومتر. تسجيل خط الأساس باستخدام الماء أو مخزن Elution.
- [الظلام] تحميل البروتين eluted إلى كوفيت الكوارتز. قياس طيف عينة البروتين.
- [الظلام] تضيء البروتين مباشرة في الكوفيت لمدة 2 دقيقة مع ضوء مرت من خلال 495 نانومتر تمرير ة طويلة مرشح.
- قياس طيف العينة المضيئة.
- قم بإجراء نفس القياس لجميع عينات البروتين التي تم تنقيتها في المنظفات الـ 9 الأخرى ، سواء كانت حالات داكنة أو مضيئة.
- رسم المنحنيات (الامتصاص مقابل الطول الموجي) في مخطط مبعثر X-Y.
4. الكروماتوغرافيا التلقائية للحجم الاستبعاد من رودوبسين ورودوبسين-ميني جيس مجمع
- [الظلام] تركيز البروتين إلى 100 ميكرولتر عن طريق الطرد المركزي باستخدام مكثف دوران مع قطع الوزن الجزيئي (MWCO) من 30 كيلو دا عند 4 درجة مئوية. يمكن تخفيف العينات المفرطة التركيز باستخدام التدفق من خلال من المكثف أو المخزن المؤقت C. لتحديد تركيز عينة البروتين، قم بقياس الامتصاص عند 280 نانومتر باستخدام مقياس الطيف الضوئي.
ملاحظة: من الخطوة 4.2 فصاعداً، لا تتطلب التجربة بيئة مظلمة، وبالتالي يمكن إعداد العينات تحت الضوء العادي. - إعداد 100 ميكرولتر رودوبسين في 0.7 ملغ / مل لكل حالة المنظفات.
- إعداد 100 ميكرولتر من رودوبسين (0.7 ملغم/مل) وميني جيس4،,12 (0.2 ملغم/مل) خليط لكل حالة منظفات. ملحق الخليط مع 1 MM MgCl2. تضيء الخليط مع الضوء من 495 نانومتر تمرير مرشح طويل واحتضان لمدة 30 دقيقة.
- قم بتركيب عمود ترشيح هلامي 24 مل مع نطاق كسور من 10-600 كيلو طن من البروتين الكروي على جهاز تنقية الكروماتوغرافي السائل. توازن العمود مع المخزن المؤقت SEC.
ملاحظة: تم تجهيز جهاز تنقية الكروماتوغرافيا السائلة بأداة ضبط بالنفس، وكاشف طول موجي متعدد، وجامع كسور. - نقل العينات إلى قوارير العينات التلقائية ووضعها في علبة العينة. برنامج ملف أسلوب لأتمتة تشغيل SEC متتابعة لكل عينة، مع autosampler تحميل 77 ميكرولتر من العينة إلى العمود، وتنقية eluting 24 مل من المخزن المؤقت SEC بمعدل تدفق 0.5 مل/دقيقة لكل تشغيل. سجل الامتصاص في 280 نانومتر و 380 نانومتر.
- جمع كسور الذروة من رودوبسين ورودوبسين-ميني جيس مجمع في حجم الاحتفاظ حول 12.9 مل.
- تحليل عينات رودوبسين اليسار من الخطوة 4.2 وكسور الذروة من rhodopsin-mini-G-مجمع على 4-12٪ SDS-denaturing الجل التدرج مع تلطيخ Coomassie الأزرق.o
- رسم الكروماتوغرام elution (A280 أو380 مقابل حجم الاحتفاظ).
5. Deglycosylation وLC-MS الدراسة
- لدراسة LC-MS، استخدم عينة رودوبسين المنقاة فقط في منظفات LMNG.
- إعداد خليط 200 ميكرولتر من رودوبسين في 1 ملغ / مل وPNGase F13 في 0.01 ملغ / مل. مزيج جيد واحتضان في 4 درجة مئوية بين عشية وضحاها.
- إعداد خليط 200 ميكرولتر من رودوبسين في 1 ملغ /مل وإندو F113 في 0.01 ملغم/مل. مزيج جيد واحتضان في 4 درجة مئوية بين عشية وضحاها.
- تحليل نتيجة الهضم من قبل SDS-PAGE وCoomassie تلطيخ الأزرق.
- التركيز دون علاج وعينات رودوبسين Endo F1 المعالجة وتخضع لتنقية SEC في المخزن D.
ملاحظة: هذا هو لإعداد العينة مع الحد الأدنى من كمية المنظفات لدراسة LC-MS. العازلة D لا يحتوي على أي المنظفات، ولكن نظرا لبطء خارج معدل LMNG من بروتين غشاء14،سوف rhodopsin لا تجميع. - جمع الجزء الذروة في حجم الاحتفاظ حول 12.9 مل. التركيز على 1 ملغ / مل باستخدام مكثف تدور (MWCO 30 كيلو دا).
- حقن 10 ميكروغرام من البروتين في عمود Reprosil 200 C18-AQ وelute العمود باستخدام طريقة التدرج الخطي مع تكوين المذيبات والإعدادات المذكورة في الجدول 2. يتم تقسيم التدفق إلى 25٪ لمطياف الكتلة و 75٪ للكشف عن الأشعة فوق البنفسجية.
النتائج
يتم تلخيص سير العمل التجريبي لإعداد العينة وتحليلها في الشكل 1. باستخدام أعمدة مفتوحة لتنقية تقارب على نطاق صغير سمح لنا لإعداد العينات في العديد من ظروف المنظفات المختلفة بالتوازي(الشكل 1A). وقد أسفر هذا الإعداد للتنقية على نطاق صغير عن بروتين كاف لإجراء مزيد من التحليلات باستخدام التحليل الطيفي للأشعة فوق البنفسجية - فيس، وSEC وSDS-PAGE(الشكل 1B-C).
كشف التحليل الطيفي للأشعة فوق البنفسجية-VIS عن استقرار رودوبسين
تم تقييم استقرار رودوبسين المعاد تشكيله في الشبكية من خلال امتصاصه البصري(الشكل 2). في الحالة المظلمة ، يرتبط شبكية العين 9-cis بشكل التكافؤ بـ Lys296 كقاعدة شيف مبروتونة. بعد الإضاءة ، يتم ايزوميرة شبكية 9-cis إلى isoform جميع عبر والارتباط قاعدة شيف هو deprotonated. والشبكية 9-cis بروتونات يعطي ذروة امتصاص في 488 نانومتر، في حين أن شبكية جميع عبر deprotonated لديه ذروة في 380 نانومتر. وأظهرت أطياف الأشعة فوق البنفسجية في سدوبسين في DDM امتصاص نموذجي من 9-رابطة الدول المستقلة الشبكية ملزمة وضوء تنشيط رودبسين، حيث تحول أزرق من 108 نانومتر مع تقريبا نفس الكثافة البصرية لوحظ بوضوح(الشكل 2A، لوحة اليسار العلوي). عندما يتم زعزعة استقرار رودوبسين، ومن ثم جيب ملزمة لتغيرات الشبكية، مما يؤدي إلى إزالة البروتونات الشبكية وربما التفكك. إذا حدث هذا ، ومن ثم يظهر الطيف المساهمة من إزالة البروتونات وكذلك الشكل الحر للشبكية15. لذلك ، حددنا كفاءة إعادة تكوين الشبكية إلى رودوبسين بنسبة الامتصاص بين البروتين (280 نانومتر) والشبكية (488 نانومتر للبروتونات 9-cis retinal ، 380 nm لdeprotonated جميع عبر الشبكية)(الشكل 2B). عينات رودوبسين تنقية في المنظفات الكلاسيكية (DDM، DM، Cymal-6، Cymal-5، C9G) تظهر نفس الملف البصري. ومع ذلك، فإن العينات التي تم تنقيتها في منظفات NPG (LMNG، DMNG، Cymal-6NG، Cymal-5NG) تظهر ملامح بصرية تشير إلى بيئة ربط دون المستوى الأمثل للشبكية باستثناء عينة OGNG، والتي أعطت نفس الملف البصري لعينة DDM.
وأظهرت الكروماتوغرافيا الحجم الاستبعاد نقاء العينة وأحادية البروتين.
SEC هي أداة تحليلية فعالة وقوية لتقييم عينات البروتين أثناء التحضير والفحص. فإنه يتحقق من نقاء العينة من خطوة تنقية السابقة، فضلا عن monodispersity من جزيئات البروتين. بالنسبة لرودوبسينومجمعها الصغير G، تم تفسير جودة العينة من منحنيات الامتصاص عند 280 نانومتر و380 نانومتر(الشكل 3A). أظهرت آثار 280 نانومتر وجود البروتين ، وأظهر أثر 380 نانومتر وجود الشبكية. أي إشارات تظهر في حجم الفراغ (حوالي 8 مل عند استخدام هذا العمود) كانت تعزى إلى مجاميع البروتين. لذلك ، أظهرت النتائج أن العينات التي تم إعدادها في المنظفات الكلاسيكية كانت في حالة أحادية التشتت باستثناء C9G ، حيث ظهر جزء من المجموع. وعلى النقيض من ذلك، احتوت العينات التي أعدت باستخدام المنظفات من نوع NPG على مجاميع أكثر بكثير من عينة C9G؛ أدى LMNG و Cymal-6NG إلى التكوين الأكثر إجماليًا ، ولكن لوحظت مجاميع أقل في DMNG و Cymal-5NG. وكان الاستثناء OGNG، الذي أظهر ملف تعريف مماثل لDDM. البروتين المجاميع eluting في حجم الفراغ كان أيضا انخفاض شغل الشبكية، كما هو مبين في نسبة A280/A380 التي زادت بالمقارنة مع ذروة في حجم الاحتفاظ ~12.9 مل المقابلة ل135 كيلو دا. ميزة أخرى لاحظنا أن كلا من رودوبسين ورودوبسين-ميني جيس eluted حول نفس حجم الاحتفاظ(الشكل 3B). هذا ليس مفاجئا, لأن الوزن الجزيئي واضح من المنظفات ملزمة رودوبسين كان 120 كيلو دا وذلك من رودوبسين-مصغرةG-144 كيلو دا. لذلك لم نتمكن من التأكد من التكوين المعقد فقط من بيانات SEC ، لذلك تم استخدام SDS-PAGE لمزيد من تحليل عينة SEC المنقاة.
SDS-PAGE أكد تشكيل معقدة
SDS-PAGE هي طريقة قياسية لتحديد مكونات البروتين في العينة. تم تحليل رودوبسين مركزة (قبل تنقية SEC) من قبل SDS-PAGE لتأكيد نقائه ، وأظهرت فرقتين بالقرب من 37 كيلو دا وشريط ملطخ ة فوق 50 كيلو دا(الشكل 4A). تم تأكيد النطاقات السفلية في وقت لاحق أن يكون لها حالات N-glycosylation مختلفة. تم تفسير النطاق فوق 50 كيلو دا على أنه أوليغوسات رودوبسين المجمعة الناجمة عن المخزن المؤقت لعينة SDS-PAGE لأن هذه المجاميع لم تلاحظ في SEC أو أي طرق اكتشاف أخرى. وبما أن بيانات لجنة الأوراق المالية والبورصة لا يمكن أن تؤكد التكوين المعقد، فقد تم تحليل الكسور التي توصفها لجنة الأوراق المالية والبورصة من عينات رودوبسين-ميني-جيباستخدام SDS-PAGE. وأظهرت SDS-PAGE عصابات البروتين من كل من رودوبسين وميني جيس في جميع ظروف المنظفات، مما يشير إلى أن المجمع تم تشكيله بغض النظر عن اختيار المنظفات(الشكل 4B).
حدد قياس الطيف LC-MS نمط N-glycosylation في رودوبسين
وأظهرت عينات رودوبسين من كل من تنقية التقارب وSEC اثنين من عصابات البروتين التي هاجرت مع الوزن الجزيئي واضح من حوالي 37 كيلو دا على هلام SDS-PAGE، والتي لا يمكن فصلها من قبل لجنة الأوراق المالية والبورصة عند استخدام عمود 24 مل. أنماط مختلفة من N-glycosylation على رودوبسين أعرب عن هوي من HEK 293 GnTI- الخلايا كان التفسير الأكثر احتمالا. لذلك ، تم اختبار اثنين من الإنزيمات ، PNGase F و Endo F1 ، لقدرتها على الحصول على درجة الروديوبسين. من بيانات SDS-PAGE ، خفضت Endo F1 الوزن الجزيئي لكلا النطاقين البروتيني في منتج واحد ، في حين أن هضم PNGase F لا يزال يعطي مجموعتين(الشكل 5A). تم تحليل العينات غير المهضومة والعينات المعالجة من إندو F1 باستخدام قياس الطيف LC-MS لتحديد كتل الأنواع المختلفة. وأظهرت البيانات أن رودوبسين المنتجة في HEK 293 GnTI- الخلايا الواردة إما واحد أو اثنين من N-glycans، مع اختلاف في الكتلة من 1014 ± 1 Da. Endo F1 المعالجة رودبسين لم تحتوي على أي N-glycans وكان الفرق الشامل من 2027 ± 1 دا مقارنة مع رودوبسين تحتوي على اثنين من N-glycans. هذه النتائج تتسق مع عدم وجود إنزيم N-أسيتيل جلوكوزوسامينيل ترانسفيتاز I في خط الخلية المستخدمة للتعبير عن رودوبسين, مما يؤدي إلى جميع N-glycans وجود هيكل GlcNAc2رجل5, (كتلة 1014 Da).
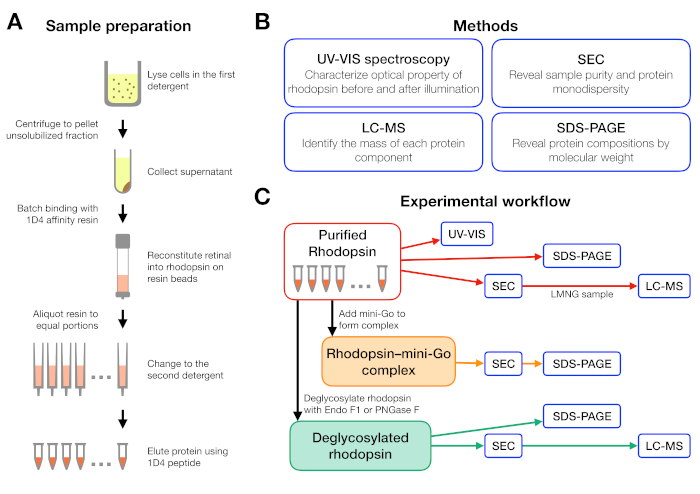
الشكل 1: إعداد العينات وتوصيفها لتجربة فحص المنظفات. (أ)إعداد عينات الرودوبسين في المنظفات المختلفة أثناء التنقية. (ب)الأساليب المستخدمة في البروتوكول: التحليل الطيفي للأشعة فوق البنفسجية-VIS، وكروماتوغرافيا استبعاد الحجم (SEC)، وSDS-PAGE، وقياس الطيف الكتلي السائل (LC-MS). (C)سير العمل التجريبي لتوصيف رودوبسين، رودوبسين-ميني-G-O، والمنتج deglycosylation من رودوبسين.o يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
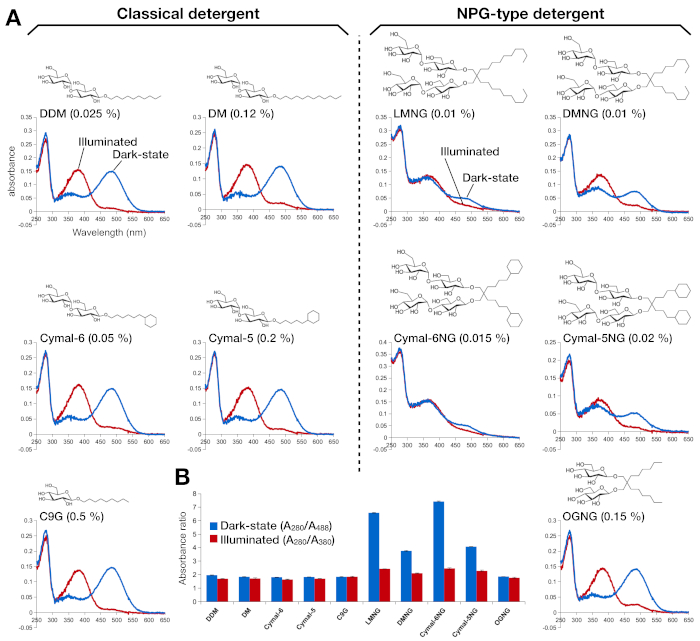
الشكل 2: التحليل الطيفي للأشعة فوق البنفسجية-VIS من رودوبسين. (أ)أطياف UV-VIS من رودوبسين. تظهر أطياف الحالة المظلمة، الرودوبسين المرتبطة بالشبكية 9-cis في المنحنيات الزرقاء. بعد الإضاءة ، يتم إزالة الشبكية 9-cis وisomerizes في الشبكية عبر جميع ، وتظهر أطياف رودوبسين مضيئة كمنحنيات حمراء. يظهر التركيب الكيميائي لكل منظف كمجموعة. (ب)نسبA 280/ A488 (شريط أزرق) و A280/ A380 (شريط أحمر) تصور استقرار رودوبسين في الحالة المظلمة والحالة الخفيفة ، على التوالي. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
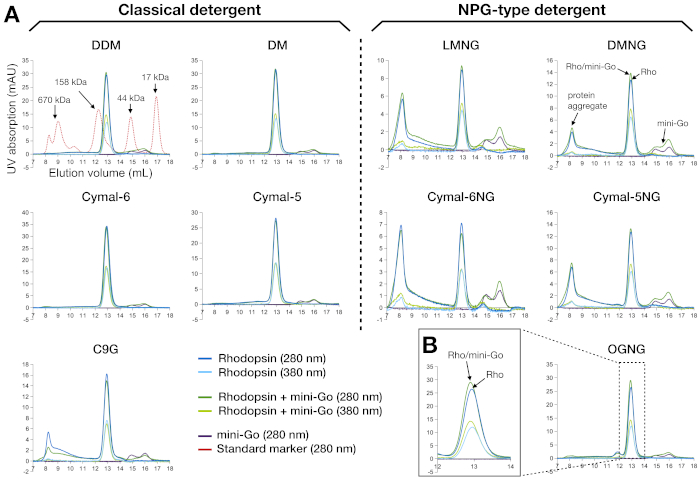
الشكل 3: ملامح الكروماتوغرافيا الحجم الاستبعاد من رودوبسين ورودوبسين–مصغرةGيا مجمع تنقية في 10 المنظفات المختلفة. (A) اللوحة اليسرى يظهر ملامح لجنة الأوراق المالية والبورصة من عينات تنقية في المنظفات الكلاسيكية. تمثل اللوحة اليمنى ملفات تعريف SEC للعينات التي يتم تنقيتها في منظفات نوع NPG. يظهر الملف الشخصي لبروتينات العلامة القياسية كتراكب مع عينة DDM. يظهر تفسير ملامح الذروة لDMNG ، مع السيناريو المثالي (لا المجاميع) ينظر لDDM ، DM ، Cymal - 6 ، Cymal - 5 وOGNG. (ب)الملف الشخصي المكبر لعينة OGNG في حجم الاحتفاظ 12-14 مل. تم تحليل جميع العينات باستخدام عمود Superdex200 زيادة 10/300 GL. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
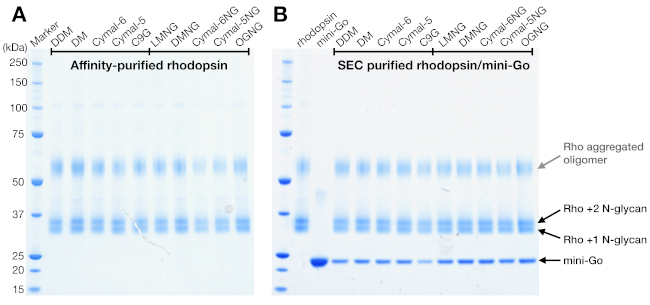
الشكل 4: تحليل SDS-PAGE من رودوبسين وrhodopsin / مصغرة الذهاب المعقدة. (أ)عينات رودوبسين تنقية في المنظفات. ويعزى الفرقة الملطخة فوق 50 كيلو دا إلى أوليغوسرس رودوبسين المجمعة الناجمة عن المخزن المؤقت عينة SDS-PAGE. (ب)عينات منتنقية SEC من rhodopsin / مصغرة الذهاب المعقدة. يتم تصوير رودوبسين مع 1 و 2 N-glycan وmini-Go. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
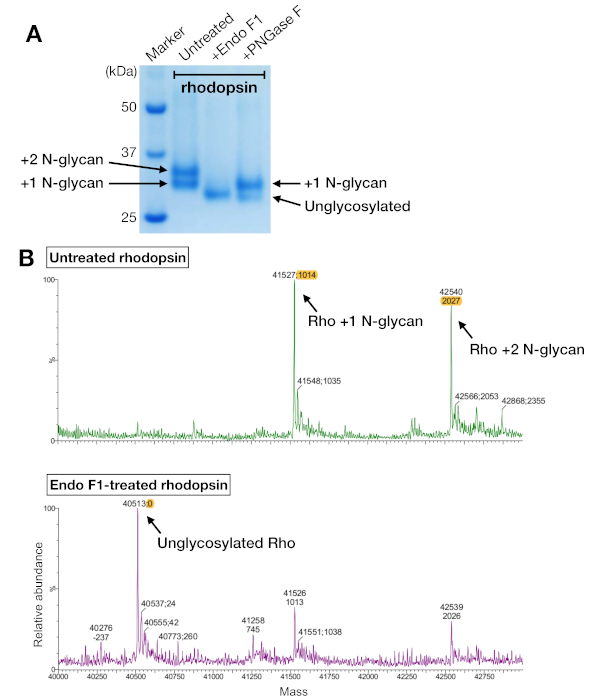
الشكل 5: تحديد الجليكوزيل في رودوبسين. (أ)تحليل SDS-PAGE من رودوبسين deglycosylated باستخدام PNGase F وEndo F1. (B)LC-MS أطياف رودوبسين دون (اللوحة العليا) ومع deglycosylation بواسطة Endo F1 (اللوحة السفلية). لإعداد rhodopsin-mini-G-oo مجمع للتبلور، اخترنا Endo F1 على PNGase F لأن إندو F1 سلمت نوع واحد متجانس من رودوبسين. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
| المنظفات | تركيز العمل (في المائة) | تركيز micelle الحرج (٪ ) |
| Ddm | 0.025 | 0.0087 |
| مارك الماني | 0.12 | 0.087 |
| سمال-6 | 0.05 | 0.028 |
| سمال-5 | 0.2 | 0.12 |
| C9G | 0.5 | 0.2 |
| LMNG | 0.01 | 0.001 |
| DMNG | 0.01 | 0.0034 |
| Cymal-6NG | 0.015 | غير متوفر؛ يجب أن يكون أقل من 0.056 |
| Cymal-5NG | 0.02 | 0.0056 |
| OGNG | 0.15 | 0.058 |
الجدول 1: تركيزات المنظفات العازلة C.
| الوقت (دقيقة) | المذيبات A (٪ ) | المذيبات B (٪ ) | المذيبات C (٪ ) | معدل التدفق (مل /دقيقة) |
| 0 | 0 | 95 | 5 | 0.5 |
| 1 | 0 | 95 | 5 | 0.5 |
| 5 | 20 | 75 | 5 | 0.6 |
| 25 | 85 | 10 | 5 | 0.6 |
| 26 | 90 | 5 | 5 | 0.6 |
| 30 | 90 | 5 | 5 | 0.6 |
الجدول 2: معلمات elution العمود.
Discussion
يعتمد النجاح في تبلور البروتين بقوة على عينة البروتين ، وخاصة البروتينات الغشائية ومجمعاتها بسبب المضاعفات التي تسببها المنظفات. يوضح هذا التقرير فحص المنظفات وتقييم جودة العينة لمجمعات إشارات البروتين GPCR-mini-G. وقد استخدمت على نطاق واسع مجموعة متنوعة من الأساليب لدراسة الخاصية الكيميائية الحيوية للبروتينات غشاء، على سبيل المثال، وتحليل الحرارة باستخدام الأصباغ الفلورية16،17، والمواد الملزمة للكشف عن تشكيل معقدة عن طريق قياس التغيير في إشارة الفلور سمرة التربتوفان18 أو نقل الطاقة بالرنين مع أجهزة الاستشعار الحيوية19. ومع ذلك ، فإن البيئات الكيميائية المستخدمة في هذه الأساليب تختلف تمامًا عن تلك الخاصة بإعداد عينة التبلور ، إما أن البروتينات تكون عند تركيز أقل ألف مرة للقياس القائم على الفلورسينس ، أو البروتينات مضمنة في طبقات الدهون أو في حالة منظفات ثابتة واحدة. في هذا البروتوكول ، يتم توحيد الأساليب المستخدمة أيضًا في إعداد العينة على نطاق واسع قبل التبلور. لذلك ، يمكن نقل المعلمات المحسنة بسهولة لإعداد مقياس التبلور دون مزيد من الفحص والتحسين الرئيسي.
الهدف من هذا البروتوكول هو تحسين إعداد مجمع بروتين GPCR-mini-G مستقر ومتجانس لتبلور انتشار البخار وتحديد الهيكل بواسطة علم البلورات بالأشعة السينية. يدمج البروتوكول مجموعة من الطرق لتقييم تأثير المنظفات وdeglycosylation نوعيًا أثناء إعدادمركب رودوبسين -mini-G.o. وقد تبلور تبلور رودبسين في حالة غير نشطة وحالة تنشيط الضوء ملزمة مع وبدون الببتيد محول عند تنقيتها في المنظفات أوتيل جلوكوسيد (C8G)20،21،22 و C9G23،24. كما rhodopsin -mini-G-o مجمع تنقية في C8G و C9G لم تسفر عن بلورات (البيانات غير مبين)، ثم استكشفنا مجموعة واسعة من المنظفات الأخرى باستخدام استراتيجية وصفها(الشكل 1).o من خلال الاستفادة من حساسية الضوء من رودوبسين، يمكننا أن نتابع بشكل جيد جدا إعادة تكوين الشبكية في أطوال موجية أخرى من 280 نانومتر. في كل من التحليل الطيفي للأشعة فوق البنفسجية فيس وSEC، اكتشفنا الشبكية إما في 380 نانومتر أو 488 نانومتر. ومع ذلك، فإن معظم البروتينات غشاء لم يكن لديك مثل الكروموفور مريحة لمتابعة وظيفة أثناء تنقية. الخيارات الأخرى هي جعل ليغاند يمكن الكشف عنها عن طريق إضافة كروموفور يمكن اكتشافه للضوء أو باستخدام الأشعة الملزمة والحرارية القابلة للتغير الحراري25.
رودوبسين لديه وزن جزيئي من 40 كيلو دا. نظرًا لكتلة المنظفات التي تربطها ، فإن وزنها الجزيئي الظاهر على SEC يبلغ حوالي 120 كيلو د. وبالتالي فإنه ليس من المستغرب أن الربط من مصغرة Gس (24 كيلو دا) لم يتم الكشف بسهولة على لجنة الأوراق المالية والبورصة، لأن هذا من شأنه أن يتطلب التمايز من البروتينات مع الجماهير الظاهرة من 120 كيلو دا و 144 كيلو دا. ولذلك استخدم تحليل كسور لجنة الأوراق المالية والبورصة من قبل SDS-PAGE لتأكيد نقاء العينة وتشكيل هامدة معقدة. حتى لو أظهرت ملفات تعريف SEC تحولًا واضحًا في التكوين المعقد ، فلا يزال من المستحسن إجراء تحليل SDS-PAGE لتأكيد التكوين المعقد مع شركاء الربط الصحيح بدلاً من الملوثات البروتينية الأخرى النقية.
تم تنقية كل من رودوبسين وميني جيس بكميات مليغرام ، مما سمح باستخدام الكشف عن الحساسية المنخفضة للمجمعات ، مثل امتصاص الأشعة فوق البنفسجية فيس أثناء SEC وCommassie Blue staining من المواد الهلامية SDS-PAGE. حيث تكون العينات محدودة ، يجب استخدام الكشف الأكثر حساسية ، مثل جهاز تنقية LC مجهز بكاشف فلوري لتتبع إشارات التربتوفان من البروتين (إثارة 280 نانومتر ، 350 نانومتر الانبعاثات) وتلطيخ الفضة للمواد الهلامية SDS-PAGE. وثمة نهج آخر يتمثل في دمج بروتين الفلورسنت، مثل بروتين الفلورسينس الأخضر (GFP) في البروتين ذي الأهمية، والذي من شأنه أن يسمح أيضا بالكشف حتى أثناء التعبير البروتيني26 ولكن ينبغي إزالته قبل التبلور.
من الضروري التأكد من أن البروتين المنقى خالي أيضًا من التغايرية الناشئة عن PTMs المتغير. في الحالة الموصوفة هنا ، تم وصف مجموعتين من رودوبسين لوحظ على المواد الهلامية SDS-PAGE بأنها إما واحدة أو اثنتين من N-glycans. تعديل متغير من البروتين من المحتمل أن تمنع تشكيل بلورات جيدا diffracting، لذلك نحن deglycosylated رودوبسين. وكان endoglycosidase إندو F1 تأثير اختبار وعلاج endoglycosidase أدى إلى نوع واحد من مستقبلات unglycosylated، في حين PNGase F إزالة جزئيا فقط جليكان على رودوبسين وأسفرت عن خليط من رودوبسين unglycosylated بالكامل أو مع واحد N-glycan بقيت. وقد تبلور تبلور بنجاح رودوبسين دون علاج deglycosylase3،27،28، وN - glycan على Rhodopsin Asn15 من المهم لتشكيل اتصال الكريستال في تلك الحالات. في حالة رودوبسين-ميني جيس،فمن الضروري إزالة N-glycans بواسطة إندو F1 للحصول على بلورات. لا توجد قاعدة موحدة لبروتينات deglycosylate ذات الأهمية قبل التبلور ، ولكن يجب النظر في إزالة PTMs غير متجانسة عندما تفشل البروتينات في التبلور بعد تجارب التبلور واسعة النطاق.
البيانات والمنهجية الموصوفة هنا ارشدتنا إلى اختيار OGNG باعتبارها المنظفات الأكثر تفضيلاo لبلورة rhodopsin-mini-G-O مجمع نظرا لصغر حجم micelle وقدرته على تحقيق الاستقرار في المجمع. كما استخدمنا إندو F1 لضمان أن يكون الرودوبسين المنقى من الأنواع المتجانسة. تم الحصول على بلورات في وقت لاحق وحددنا بنية الكريستال إلى ~ 3.1 Å4، الذي كان فقط الهيكل البلوري الثالث من بروتين GPCR-G يشير إلى مجمع14،29.
بالنسبة للبروتينات الغشائية المرتبطة ببروتين الشريك أو بدونه، يجب اعتبارها بروتينين مختلفين. البروتين في حالات وظيفية مختلفة لديه التشكيلات المختلفة وعلى مستوى الطاقة المختلفة. لذلك، فمن المستحسن لتحسين بروتوكول الإعداد لكل حالة وظيفية كما المعلمة لحالة غير نشطة قد لا تكون قابلة للتحويل بالكامل إلى الحالة المنشط. أيضا، ناهيك عن التغيير في خاصية البروتين معقدة عن طريق ربط بروتين شريك. يستخدم البروتوكول أساليب موحدة لإعداد عينة تبلور لإعداد بروتين الغشاء غير النشط في المنظفات المختلفة ، يليه تنشيط البروتين والتشكيل المعقد ، وتوصيف جودة البروتين. وبالتالي ، يمكن بسهولة تعميم هذا البروتوكول على بروتينات الأغشية الأخرى ومجمعاتها للدراسات الهيكلية مع تعديل طفيف.
Disclosures
CGT هو مستشار وعضو في المجلس الاستشاري العلمي لسوسي هيبتاسيس. جميع المؤلفين الآخرين ليس لديهم ما يكشفون عنه.
Acknowledgements
نشكر البروفيسور الدكتور غيبارد ف. س. شيرتلر على دعمه الطويل الأمد في هذا المشروع، الدكتور روجر ج. ب. داوسون وهوفمان لا روش على دعمهما في ثقافة الخلايا. وقد رعت هذا العمل المؤسسة الوطنية السويسرية للعلوم (المنح 210030_153145 310030B_173335 إلى GFXS)، والتمويل إلى CGT من مجلس البحوث الأوروبي (EMPSI، 339995) ومجلس البحوث الطبية (MRC U105197215). FP يعترف ETH Zürich من خلال المركز الوطني للكفاءة في البحوث الجزيئية فائقة السرعة العلوم والتكنولوجيا (NCCR MUST) وETH Femtosecond وAttosecond العلوم والتكنولوجيا (ETH FAST) . تعترف FP و JM و AB و CJT بالدعم المالي طويل الأجل من معهد بول شيرر.
Materials
| Name | Company | Catalog Number | Comments |
| 1D4 peptide | Peptide2.0 | Under request | |
| 9-cis retinal | Sigma-Aldrich | R5754 | |
| Autosampler A-900 | GE Healthcare | Discontinued | |
| C9G | Anatrace | N324 | |
| cOmplete, EDTA-free protease inhibitor coctail | Roche | 5056489001 | |
| Cymal-5 | Anatrace | C325 | |
| Cymal-5NG | Anatrace | NG325 | |
| Cymal-6 | Anatrace | C326 | |
| Cymal-6NG | Anatrace | NG326 | |
| DDM | Anatrace | D310 | |
| DM | Anatrace | D322 | |
| DMNG | Anatrace | NG322 | |
| Econo column | Bio-Rad | 7372512 | |
| Ettan LC | GE Healthcare | Discontinued | |
| FRAC-950 | GE Healthcare | Discontinued | |
| HPLC Water 2795 Separation Module | Waters AG | 720000358EN | |
| InstantBlue Protein Stain | Expedeon | ISB1L | |
| LCT Premier mass spectrometer (ESI-TOF) | Waters AG | - | |
| LMNG | Anatrace | NG310 | |
| Monitor UV-900 | GE Healthcare | 18110835 | |
| Nanodrop 1000 | Witec AG/ThermoFisher | Discontinued | |
| NuPAGE 4-12% Bis-Tris gel 1.0 mm, 15 well | ThermoFisher | NP0323BOX | |
| NuPAGE MES SDS buffer (20x) | ThermoFisher | NP0002 | |
| OGNG | Anatrace | NG311 | |
| PAGEr Minigel Chamber | Lonza | 59905 | |
| Reprosil 200 C18-AQ column | Morvay Analytik GmbH | #s1503 | |
| Superdex 200 Increase GL column | GE Healthcare | 28990944 | |
| Tabletop centrifuge 5424R | Eppendorf | 5404000413 | |
| Ultracentrifuge Optima XE-100 | Beckmann Coulter | A94516 | |
| ULTRA-TURRAX T25 | IKA WERKE | 0003725003 | |
| UV-VIS spectrophotometer | Shimadzu | UV-2401PC | |
| Waters 2487 Dual λ Absorbance Detector | Waters AG | - |
References
- Tate, C. G. Practical considerations of membrane protein instability during purification and crystallisation. Methods in Molecular Biology. 601, 187-203 (2010).
- Lebon, G., Bennett, K., Jazayeri, A., Tate, C. G. Thermostabilisation of an agonist-bound conformation of the human adenosine A(2A) receptor. Journal of Molecular Biology. 409 (3), 298-310 (2011).
- Deupi, X., et al. Stabilized G protein binding site in the structure of constitutively active metarhodopsin-II. Proceedings of the National Academy of Sciences. 109 (1), 119-124 (2012).
- Tsai, C. -. J., et al. Crystal structure of rhodopsin in complex with a mini-G o sheds light on the principles of G protein selectivity. Science Advances. 4 (9), (2018).
- Carpenter, B., Tate, C. G. Engineering a minimal G protein to facilitate crystallisation of G protein-coupled receptors in their active conformation. Protein Engineering Design and Selection. 29 (12), 583-594 (2016).
- Chae, P. S., et al. Maltose-neopentyl glycol (MNG) amphiphiles for solubilization, stabilization and crystallization of membrane proteins. Nature Methods. 7 (12), 1003-1008 (2010).
- Loll, P. J. Membrane proteins, detergents and crystals: what is the state of the art. Acta Crystallographica Section F Structural Biology Communications. 70 (12), 1576-1583 (2014).
- Chae, P. S., et al. Glucose-neopentyl glycol (GNG) amphiphiles for membrane protein study. Chemical communications. 49 (23), 2287-2289 (2013).
- Standfuss, J., Xie, G., Edwards, P. C., Burghammer, M., Oprian, D. D., Schertler, G. F. X. Crystal structure of a thermally stable rhodopsin mutant. Journal of Molecular Biology. 372 (5), 1179-1188 (2007).
- Kaushal, S., Ridge, K. D., Khorana, H. G. Structure and function in rhodopsin: the role of asparagine-linked glycosylation. Proceedings of the National Academy of Sciences of the United States of America. 91 (9), 4024-4028 (1994).
- Molday, L. L., Molday, R. S. 1D4: a versatile epitope tag for the purification and characterization of expressed membrane and soluble proteins. Methods in Molecular Biology. 1177 (604), 1-15 (2014).
- Carpenter, B., Tate, C. G. Expression and Purification of Mini G Proteins from Escherichia coli. Bio-Protocol. 7 (8), (2017).
- Grueninger-Leitch, F., D'Arcy, A., D'Arcy, B., Chène, C. Deglycosylation of proteins for crystallization using recombinant fusion protein glycosidases. Protein Science. 5 (12), 2617-2622 (1996).
- Rasmussen, S. G. F., et al. Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature. 477 (7366), 549-555 (2011).
- Loginova, M. Y., Rostovtseva, Y. V., Feldman, T. B., Ostrovsky, M. A. Light damaging action of all-trans-retinal and its derivatives on rhodopsin molecules in the photoreceptor membrane. Biochemistry (Moscow). 73 (2), 130-138 (2008).
- Alexandrov, A. I., Mileni, M., Chien, E. Y. T., Hanson, M. A., Stevens, R. C. Microscale Fluorescent Thermal Stability Assay for Membrane Proteins. Structure. 16 (3), 351-359 (2008).
- Sonoda, Y., et al. Benchmarking Membrane Protein Detergent Stability for Improving Throughput of High-Resolution X-ray Structures. Structure. 19 (1), 17-25 (2011).
- Maeda, S., et al. Crystallization scale preparation of a stable GPCR signaling complex between constitutively active rhodopsin and G-protein. PloS One. 9 (6), 98714 (2014).
- Boute, N., Jockers, R., Issad, T. The use of resonance energy transfer in high-throughput screening: BRET versus FRET. Trends in Pharmacological Sciences. 23 (8), 351-354 (2002).
- Singhal, A., Guo, Y., Matkovic, M., Schertler, G., Deupi, X., Yan, E. C. Y. Structural role of the T 94 I rhodopsin mutation in congenital stationary night blindness. EMBO Report. 17 (10), 1-10 (2016).
- Choe, H. -. W., et al. Crystal structure of metarhodopsin II. Nature. 471 (7340), 651-655 (2011).
- Mattle, D., et al. Ligand channel in pharmacologically stabilized rhodopsin. Proceedings of the National Academy of Sciences of the United States of America. 115 (14), 3640-3645 (2018).
- Okada, T., Fujiyoshi, Y., Silow, M., Navarro, J., Landau, E. M., Shichida, Y. Functional role of internal water molecules in rhodopsin revealed by X-ray crystallography. Proceedings of the National Academy of Sciences of the United States of America. 99 (9), 5982-5987 (2002).
- Blankenship, E., Vahedi-Faridi, A., Lodowski, D. T. The High-Resolution Structure of Activated Opsin Reveals a Conserved Solvent Network in the Transmembrane Region Essential for Activation. Structure. 23 (12), 2358-2364 (2015).
- Magnani, F., et al. A mutagenesis and screening strategy to generate optimally thermostabilized membrane proteins for structural studies. Nature Protocols. 11 (8), 1554-1571 (2016).
- Kawate, T., Gouaux, E. Fluorescence-detection size-exclusion chromatography for precrystallization screening of integral membrane proteins. Structure. 14 (4), 673-681 (2006).
- Standfuss, J., et al. The structural basis of agonist-induced activation in constitutively active rhodopsin. Nature. 471 (7340), 656-660 (2011).
- Singhal, A., et al. Insights into congenital stationary night blindness based on the structure of G90D rhodopsin. EMBO reports. 14 (6), 520-526 (2013).
- Carpenter, B., Nehmé, R., Warne, T., Leslie, A. G. W., Tate, C. G. Structure of the adenosine A(2A) receptor bound to an engineered G protein. Nature. 536 (7614), 104-107 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved