Method Article
Triagem Estratégica e Caracterização do Complexo de Sinalização de Proteínas Visuais GPCR-mini-G para cristalização bem sucedida
Neste Artigo
Resumo
Este relatório descreve a triagem de diferentes detergentes para a preparação do GPCR visual, a rodopsina e seu complexo com mini-Go. São demonstrados métodos bioquímicos caracterizando a qualidade do complexo em diferentes estágios durante a purificação. Este protocolo pode ser generalizado para outros complexos proteicos de membrana para seus futuros estudos estruturais.
Resumo
A chave para determinar estruturas cristalinas de complexos proteicos de membrana é a qualidade da amostra antes da cristalização. Em particular, a escolha do detergente é fundamental, pois afeta tanto a estabilidade quanto a monodispersão do complexo. Recentemente determinamos a estrutura cristalina de um estado ativo de rodopsina bovina acoplada a uma proteína G projetada, mini-Go,a 3.1 Å resolução. Aqui, detalhamos o procedimento para otimizar a preparação do complexo rhodopsin-mini-Go. A roddopsina de estado escuro foi preparada em detergentes clássicos e neopentyl glicol (NPG), seguido por formação complexa com mini-Go exposição à luz. A estabilidade da rodopsina foi avaliada pela espectroscopia ultravioleta visível (UV-VIS), que monitora a reconstituição em rodopsina do ligante sensível à luz, 9-cis retinal. A cromatografia automatizada de exclusão de tamanho (SEC) foi usada para caracterizar a monodispersidade da roddopsina e do complexo rhodopsin-mini-Go. A eletroforese SDS-poliacrilamida (SDS-PAGE) confirmou a formação do complexo identificando uma razão molar 1:1 entre a rodopsina e a mini-Go após a coloração do gel com azul Coomassie. Depois de cruzar todos esses dados analíticos, eliminamos detergentes inadequados e continuamos com o melhor detergente candidato para preparação e cristalização em larga escala. Um problema adicional surgiu da heterogeneidade da N-glicosilona. A roddopsina heterosamente expressa foi observada na SDS-PAGE para ter duas populações diferentes de N-glicosilada, o que provavelmente teria dificultado a cristalogênese. Portanto, diferentes enzimas de deglicosilação foram testadas, e a endoglicose F1 (EndoF1) produziu rodopsina com uma única espécie de N-glicosilação. Com este pipeline estratégico para caracterizar a qualidade da proteína, a preparação docomplexo rhodopsin-mini-G foi otimizada para entregar a estrutura cristalina. Esta foi apenas a terceira estrutura cristalina de um complexo de sinalização proteica GPCR-G. Essa abordagem também pode ser generalizada para outras proteínas de membrana e seus complexos para facilitar a preparação da amostra e a determinação da estrutura.
Introdução
Determinar estruturas cristalinas de proteínas de membrana e seus complexos sempre foi desafiador devido a dificuldades na obtenção de cristais bem difradores. Em contraste com as proteínas solúveis, as proteínas de membrana integral compreendem um núcleo hidrofóbico que abrange a membrana celular. Para remover proteínas de membrana da membrana celular em tampão aquoso, os detergentes devem ser usados para formar uma micela detergente-proteína, substituindo assim os lipídios ao redor do núcleo hidrofóbico das proteínas de membrana. Estabilidade, atividade e integridade das proteínas de membrana dependem diretamente das propriedades químicas e estruturais do detergente1, e as propriedades do detergente também determinam o tamanho da micela. Uma grande micela detergente pode ocluir as superfícies hidrofílicas de uma pequena proteína de membrana, impedindo assim a cristalização devido à falta de contatos de cristal ao usar o método de difusão de vapor. Uma pequena micela detergente é vantajosa para a cristalografia, mas detergentes de cadeia curta são geralmente mais resistentes e, portanto, levam à desestabilização e agregação da proteína da membrana. Portanto, antes da cristalização, um procedimento adicional de triagem de detergentes é indispensável, tipicamente visando detergentes mais curtos que ainda mantêm a estabilidade proteica.
Os receptores g acoplados à proteína (GPCRs) são proteínas de membrana integral contendo sete helicos transmembranas. Os GPCRs existem em dois estados principais, seja um estado inativo estabilizado por agonistas inversos ou antagonistas, ou um estado ativo ligado a um agonista e estabilizado por uma proteína G, embora seja provável que existam uma multidão de subestados entre esses dois extremos. A determinação estrutural dos GPCRs inicialmente se concentrou em estados inativos ligados a agonistas inversos e antagonistas devido à sua maior estabilidade do que os estados ativos2. Quando os GPCRs são ativados sobre a ligação agonista, os receptores são altamente dinâmicos, e uma fissura se forma transitoriamente na face citoplasmática do receptor para acoplamento de proteína G. Acredita-se que esse dinamismo é o motivo pelo qual os GPCRs agonistas são muitas vezes mais instáveis do que o estado inativo. Portanto, torna-se essencial a triagem de detergentes apropriados para o estado conformacional do receptor em estudo, pois é provável que detergentes mais leves sejam necessários para estudar um estado ativo em comparação com um estado inativo.
Neste relatório, utilizamos o GPCR visual, a rodopsina bovina3, e seu complexo com mini-Go proteína4,5 para os experimentos de triagem de detergentes, representando o estado inativo e o estado ativo, respectivamente. A triagem de detergentes concentrou-se nos detergentes clássicos alquil maltoside e glucoside e nos detergentes neopentyl glicol (NPG). Neste contexto, um detergente clássico é construído a partir de um grupo de cabeça de açúcar e uma cadeia alquil, enquanto os detergentes do tipo NPG contém dois detergentes clássicos idênticos que são fundidos por um carbono quaternário na interface entre os açúcares e as cadeias alquilas6,7,8.
Um fluxo de trabalho experimental foi projetado a partir da purificação da rodopsina em diferentes detergentes, seguido pela formação do complexo rhodopsin-mini-Go e terminando com a caracterização do complexo utilizando vários métodos (Figura 1). Para o estado inativo da rodopsina, a reconstituição do lige sensível à luz 9-cis foi monitorada por espectroscopia ultravioleta visível (UV-VIS). O espectro revela o estado físico-químico da retina e é indicativo de seu ambiente no bolsão de ligação da retina de rodopsina. A cromatografia de exclusão de tamanho (SEC) foi empregada para avaliar a monodispersidade da roddopsina purificada, bem como a formação do complexo rhodopsin-mini-Go. À medida que a SEC diferencia as moléculas de proteínas pelo seu tamanho e forma, a população de proteínas agregadas pode ser identificada à medida que elas eluiam no volume vazio. Para confirmar a formação complexa, as frações da SEC foram avaliadas por eletroforese de gel de sulfato de dodecil-poliacrilamida (SDS-PAGE) para confirmar a presença de rhodopsin e mini-Go.
Outro fator que precisa ser considerado são as modificações pós-translacionais (PTM) nas proteínas da membrana. PtM como n-glicosilação são freqüentemente observados em proteínas de membrana eucariótica produzidas em sistemas de expressão de células de mamíferos e insetos. Uma cepa limitada de N-glicosilação das células do rim embrionário humano 293 (HEK293) foi desenvolvida pela exclusão da codificação genética N-acetilglucosaminyltransferase I (GnTI), resultando em N-glicosilação homogênea por GlcNAc2Homem5 no local de consenso Asn-X-Ser/Thr. Embora a n-glicosilação possa ser prevenida pela mutação de um resíduo de aminoácidos no local de consenso, isso também pode alterar a função da proteína ou a eficiência da dobra. Na rodopsina bovina, a mutação do resíduo N-glicosilado Asn15 leva à dobra incorreta e à ativação reduzida da proteína G9,10. A rodopsina utilizada neste relatório foi expressa na linha celular hek 293 gnti-deficiente. No entanto, a SDS-PAGE mostrou a presença de duas espécies de rodopsina. Essa heterogeneidade poderia prevenir a formação de cristais e, portanto, a deglicosidação utilizando peptídeo-N-glicosidase F (PNGase F) e endoglicolicosidase F1 (Endo F1) foi testada. O produto deglicosilado foi caracterizado pela Espectrometria sds-PAGE e cromatografia líquida de massa (LC-MS) para identificar o nível de glicosia e sua homogeneidade.
Protocolo
NOTA: Este protocolo para triagem de detergente é detalhado para 30 g de pelota de célula hek293 como material de partida.
1. Materiais, produtos químicos e reagentes
NOTA: Todas as soluções são preparadas utilizando reagentes de grau analítico e água ultrapura, que é purificada da água deionizada para atingir uma resistividade de 18,2 MΩ⁄cm a 25 °C.
- Soluções de estoque de buffer
- Prepare 10x de solução salina tampocada de fosfato (10x PBS).
- Prepare o tampão HEPES: 1 M, titulado para pH 7.5 com NaOH.
- Prepare 5 M NaCl.
- Preparar 2 M MgCl2.
NOTA: Todas as soluções de estoque são passadas através de um filtro de 0,22 μm para manter sua esterilidade.
- Soluções de estoque de detergente
- Preparar dodecyl maltoside (DDM), 10% (c/v).
- Preparar decyl maltoside (DM), 10% (c/v).
- Preparar 6-ciclohexyl-hexyl maltoside (Cymal-6), 10% (c/v).
- Prepare o maltoside 5-ciclohexyl-pentil (Cymal-5), 10% (c/v).
- Preparar o glicoso nonyl (C9G), 10% (c/v).
- Prepare o glicol neopentyl lauryl maltose (LMNG), 5% (c/v).
- Preparar o glicol neopentyl decyl maltose (DMNG), 10% (c/v).
- Preparar o glicol de neopentyl cymal-6 (C6NG), 10% (c/v).
- Preparar o glicol de neopentyl cymal-5 (C5NG), 10% (c/v).
- Preparar octyl glicose neopentyl glicol (OGNG), 10% (c/v).
NOTA: Para uma solução de estoque de detergente de 10%, dissolva 1 g de pó de detergente em água ultrapura com balanço suave e ajuste o volume final para 10 mL. A solução de estoque de detergente deve ser mantida a -20 °C para armazenamento a longo prazo e no gelo durante o trabalho.
ATENÇÃO: Os detergentes engarrafados geralmente são recomendados para armazenar a -20 °C de congelador. As garrafas que contêm pó de detergente devem ser aquecidas à temperatura ambiente antes de abrir. O pó de detergente é higroscópico, por isso o equilíbrio da temperatura evitará a formação de condensação que vai mambeo o detergente.
- Outros produtos químicos e reagentes
- Prepare a resina de imunoafinidade 1D4: 10 mL do chorume de 50%.
NOTA: A agarose de imunoafinidade 1D4 são as contas de agarose ligadas ao anticorpo monoclonal Rho1D4, que liga os últimos 9 aminoácidos da rodopsina bovina TETSQVAPA como epítopo. A agarose de imunoafinidade 1D4 funciona como material de purificação de afinidade para capturar proteínas que contêm uma seqüência C-terminal 1D4. Este material de purificação pode ser preparado9,,11 ou comprado. - Preparar a solução de retina 9-cis: 1 mM, dissolvida em 100% etanol.
NOTA: Evite a exposição da luz à retina durante a preparação e o armazenamento. - Prepare o peptídeo 1D4 (seqüência TETSQVAPA): 800 μM, dissolvido em água.
- Prepare a resina de imunoafinidade 1D4: 10 mL do chorume de 50%.
- Buffers
NOTA: Todos os buffers são misturados das soluções de estoque à concentração desejada. Todos os tampões são refrigerados a 4 °C antes do uso.- Prepare o Buffer A: PBS, 0,04% DDM.
- Preparar Buffer B: 20 mM HEPES pH 7.5, 150 mM NaCl, 0.04% DDM.
- Preparar buffer C: 20 mM HEPES pH 7.5, 150 mM NaCl e detergente em sua concentração de trabalho listada na Tabela 1.
- Preparar Buffer D: 20 mM HEPES pH 7.5, 150 mM NaCl.
- Prepare o tampão de elução: 20 mM HEPES pH 7.5, 150 mM NaCl, 80 μM 1D4 peptídeo e detergente em sua concentração de trabalho.
- Prepare o buffer SEC: 20 mM HEPES pH 7.5, 150 mM NaCl, 0.025% DDM; filtrado através de um filtro de 0,22 μm.
- Solvente para LC-MS
- Prepare solvente A: acetonitrilo contendo 0,1% de ácido fórmico.
- Preparar solvente B: água ultrapura contendo 0,1% de ácido fórmico.
- Prepare o solvente C: iso-propanol.
2. Solubilização da membrana celular e extração de proteínas
- Descongelar 30 g de HEK293 GnTI- pelota celular expressando o mutante de rodopsina bovina N2C/M257Y/D282C3,9 à temperatura ambiente, adicionar 120 mL de tampão PBS 1x contendo coquetel inibidor de protease e homogeneizar usando um homogeneizador Dounce ou um homogeneizador elétrico (13.000 rpm para 30 s). Recolher a suspensão celular homogeneizada em um béquer e ajustar o volume para 150 mL.
NOTA: 30 g de pelota celular equivale a 3 L de cultura celular a 2 x 106 células/mL de densidade. - Adicione suavemente 10% de DDM às células homogeneizadas para dar uma concentração final de 1,25%. Mexa no gelo por 1 h.
- Centrifugar o lescolado celular a 4 °C e 150.000 x g por 45 min para remover os detritos não solubilizados.
- Transfira o sobrenadante para uma garrafa de 500 mL e adicione 10 mL da resina de imunoafinidade 1D4 (50% de chorume). Misture suavemente o lsato celular solubilizado e a resina por 4 h ou durante a noite a 4 °C.
- Carregue a mistura de lysate/resina em uma coluna aberta para coletar a resina.
- Lave a resina com 10 volumes de coluna (CV) da lavagem tampão A.
NOTA: O volume da coluna é o volume do embalado (100%) resina agarose usada. Neste caso, 1 CV é de 5 mL. - Ressuspensão da resina com 2 CV de Buffer A.
ATENÇÃO: A partir do passo 2.8 em diante, as etapas que precisam ser realizadas a condição de luz vermelha fraca são rotuladas com [Escuro] no início da descrição. - [Escuro] Adicione a retina de 9-cis à resina ressuspensa à concentração final de 50 μM. Misture suavemente a 4 °C por 4-16 horas no escuro.
NOTA: Um tempo de incubação mais curto pode levar à reconstituição incompleta da retina. - [Escuro] Remova o fluxo através da coluna. Lave a resina com buffer A de 20 CV, seguida pelo Buffer B de 15 CV.
- [Escuro] Ressuspensão da resina em 2 CV Buffer B e, em seguida, divida a suspensão de resina igualmente para 10 colunas de descarte de 10 mL.
- [Escuro] Remova o fluxo através da coluna e, em seguida, ressuspense a resina em 1 mL Buffer C. Incubar por 1 h a 4 °C.
- [Escuro] Repita o passo 2.11.
- [Escuro] Remova o fluxo através da coluna e, em seguida, ressuspensa a resina em um buffer de elução de 0,8 mL para cada coluna. Misture suavemente por 2 h.
- [Escuro] Coletar a elução da coluna em um tubo de 2 mL.
- [Escuro] Ressuspensão da resina em 0,7 mL de Elution Buffer para cada coluna. Misture suavemente por 1 h.
- [Escuro] Coletar a elução da coluna no mesmo tubo.
3. Espectroscopia UV-VIS
- Prepare o espectrofotômetro para cobrir a faixa de medição de 250-650 nm. Registre a linha de base usando água ou tampão de elução.
- [Escuro] Carregue a proteína eluida para a cuvette de quartzo. Meça o espectro da amostra de proteínas.
- [Escuro] Ilumine a proteína diretamente na cuvette por 2 min com luz passada através de um filtro de 495 nm de passagem longa.
- Meça o espectro da amostra iluminada.
- Realizar a mesma medição para todas as amostras de proteínas purificadas nos outros 9 detergentes, estados escuros e iluminados.
- Plote as curvas (absorvância versus comprimento de onda) no gráfico de dispersão X-Y.
4. Cromatografia automatizada de exclusão de tamanho de rhodopsin e rhodopsin-mini-Go complexo
- [Escuro] Concentre a proteína a 100 μL por centrifugação usando um concentrador de spin com um corte de peso molecular (MWCO) de 30 kDa a 4 °C. Amostras superconcentradas podem ser diluídas usando o fluxo através do concentrador ou do buffer C. Para determinar a concentração da amostra de proteína, meça a absorção a 280 nm usando um espectrofotômetro.
NOTA: A partir do passo 4.2 em diante, o experimento não requer um ambiente escuro e, portanto, as amostras podem ser preparadas luz normal. - Prepare 100 μL de rodopsina a 0,7 mg/mL para cada condição de detergente.
- Prepare 100 μL de rodopsina (0,7 mg/mL) e mini-Go4,12 (0,2 mg/mL) para cada condição de detergente. Suplemente a mistura com 1 mM MgCl2. Ilumine a mistura com luz de um filtro de 495 nm de passagem longa e incubapor por 30 min.
- Monte uma coluna de filtragem de gel de 24 mL com uma faixa de fracionamento de 10-600 kDa de uma proteína globular em um purificador de cromatografia líquida. Equilibrou a coluna com o buffer SEC.
NOTA: O purificador de cromatografia líquida está equipado com um autosampler, um detector de comprimento de onda múltiplo e um coletor de frações. - Transfira as amostras para os frascos do amostrador automático e coloque-as na bandeja da amostra. Programe um arquivo de método para automatizar as execução seqüenciais da SEC para cada amostra, com o autosampler carregando 77 μL da amostra para a coluna, e o purificador eluindo 24 mL de tampão SEC a uma taxa de fluxo de 0,5 mL/min por execução. Registre a absorvância em 280 nm e 380 nm.
- Coletar as frações de pico de rhodopsin e rhodopsin -mini-Go complexo no volume de retenção em torno de 12,9 mL.
- Analise as amostras de roddopsina esquerda do passo 4.2 e as frações de pico do complexo rhodopsin-mini-Go em géis gradientes de desnaturação de SDS de 4-12% com coloração azul Coomassie.
- Plote o cromatograma de elução (A280 ou A380 versus volume de retenção).
5. Estudo de deglicosibilização e LC-MS
- Para o estudo LC-MS, utilize apenas a amostra de rodopsina purificada no detergente LMNG.
- Prepare uma mistura de 200 μL de rodopsina a 1 mg/mL e PNGase F13 a 0,01 mg/mL. Misture bem e incubar a 4 °C durante a noite.
- Prepare uma mistura de 200 μL de rodopsina a 1 mg/mL e Endo F113 a 0,01 mg/mL. Misture bem e incubar a 4 °C durante a noite.
- Analise o resultado da digestão por sds-PAGE e coloração azul Coomassie.
- Concentre-se não tratada e endo amostras de rodopsina tratadas com F1 e sujeitas à purificação da SEC no Buffer D.
NOTA: Trata-se de preparar a amostra com quantidade mínima de detergente para o estudo lc-MS. O buffer D não contém detergente, mas devido à baixa taxa de lMNG de uma proteína de membrana14, a roddopsina não se agregará. - Coletar a fração de pico no volume de retenção em torno de 12,9 mL. Concentre-se em 1 mg/mL usando um concentrador de giro (MWCO 30 kDa).
- Injete 10 μg da proteína em uma coluna Reprosil 200 C18-AQ e eluia a coluna usando o método de gradiente linear com a composição do solvente e as configurações listadas na Tabela 2. O fluxo é dividido em 25% para espectrômetro de massa e 75% para detecção uv.
Resultados
O fluxo de trabalho experimental para preparação e análise da amostra é resumido na Figura 1. O uso de colunas abertas para purificação de afinidade em pequena escala permitiu preparar amostras em muitas condições diferentes de detergente em paralelo(Figura 1A). Tal configuração de purificação em pequena escala produziu proteína suficiente para análises posteriores usando espectroscopia UV-VIS, SEC e SDS-PAGE(Figura 1B-C).
Espectroscopia UV-VIS revelou estabilidade da rodopsina
A estabilidade da rodopsina reconstituída pela retina foi avaliada pela sua absorção óptica (Figura 2). No estado escuro, a retina 9-cis está covalentemente ligada a Lys296 como uma base protonada de Schiff. Após a iluminação, a retina 9-cis é isomerizada à isoformide trans e a ligação base de Schiff é deprotonada. A retina protonada de 9 cis dá um pico de absorção a 488 nm, enquanto a retina toda trans deprotonada tem um pico de 380 nm. O espectro UV-VIS de rodopsina em DDM mostrou a absorção típica de rhodopsin 9-cis retina lretina e ativada por luz, onde uma mudança azul de 108 nm com aproximadamente a mesma densidade óptica foi claramente observada(Figura 2A, painel superior esquerdo). Quando a rodopsina é desestabilizada, e então o bolso de ligação para alterações da retina, o que resulta em deprotonação da retina e possivelmente dissociação. Se isso acontecer, e então o espectro mostra a contribuição da deprotonação, bem como a forma livre de retina15. Assim, determinamos a eficiência da reconstituição da retina em rodopsina pela razão de absorvência entre a proteína (280 nm) e a retina (488 nm para a retina 9-cis protonada, 380 nm para deprotonado retinianato)(Figura 2B). As amostras de rodopsina purificadas nos detergentes clássicos (DDM, DM, Cymal-6, Cymal-5, C9G) apresentam o mesmo perfil óptico. No entanto, as amostras purificadas nos detergentes NPG (LMNG, DMNG, Cymal-6NG, Cymal-5NG) mostram perfis ópticos sugerindo um ambiente de ligação sub-ideal para a retina, exceto para a amostra OGNG, que deu o mesmo perfil óptico da amostra DDM.
A cromatografia de exclusão de tamanho mostrou pureza da amostra e monodispersidade proteica.
A SEC é uma ferramenta analítica eficiente e robusta para avaliar amostras de proteínas durante a preparação e triagem. Valida a pureza da amostra da etapa de purificação anterior, bem como a monodispersidade das moléculas proteicas. Para a rodopsina e seu complexo mini-Go, a qualidade da amostra foi interpretada a partir das curvas de absorção em 280 nm e 380 nm(Figura 3A). Os traços de 280 nm mostraram a presença de proteína, e o traço de 380 nm mostrou a presença de retina. Quaisquer sinais que apareciam no volume vazio (cerca de 8 mL ao usar esta coluna) foram atribuídos a agregados proteicos. Portanto, os resultados mostraram que as amostras preparadas nos detergentes clássicos estavam em estado monodisperso, exceto c9G, onde apareceu alguma porção de agregado. Em contraste, as amostras preparadas usando os detergentes do tipo NPG continham muito mais agregados do que a amostra C9G; LMNG e Cymal-6NG levaram à formação mais agregada, mas menos agregados foram observados em DMNG e Cymal-5NG. A exceção foi o OGNG, que mostrou um perfil semelhante ao DDM. Os agregados proteicos que eluiram no volume vazio também apresentaram menor ocupação da retina, como mostra a razão A280/A380 que havia aumentado em comparação com o pico no volume de retenção de ~12,9 mL correspondente a 135 kDa. Outra característica observada foi que tanto a roddopsina quanto a rhodopsin-mini-Go eluiram em torno do mesmo volume de retenção(Figura 3B). Isso não é surpreendente, porque o peso molecular aparente da rodopsina ligada ao detergente era de 120 kDa e o de rhodopsin-mini-Go 144 kDa. Portanto, não pudemos determinar a formação complexa apenas a partir dos dados da SEC, por isso o SDS-PAGE foi usado para analisar melhor a amostra purificada pela SEC.
SDS-PAGE confirmou formação complexa
SDS-PAGE é um método padrão para identificar os componentes proteicos em uma amostra. A rodopsina concentrada (antes da purificação da SEC) foi analisada pela SDS-PAGE para confirmar sua pureza, e mostrou duas bandas próximas a 37 kDa e uma banda manchada acima de 50 kDa(Figura 4A). As duas faixas inferiores foram mais tarde confirmadas para ter diferentes estados de N-glicosilação. A banda acima de 50 kDa foi interpretada como oliguladores de rodopsina agregada induzidos pelo buffer amostral SDS-PAGE porque esses agregados não foram observados na SEC ou em quaisquer outros métodos de detecção. Como os dados da SEC não puderam confirmar a formação complexa, a SEC eluiu frações de amostras de rhodopsin-mini-Go usando SDS-PAGE. A SDS-PAGE mostrou faixas proteicas de rodopsina e mini-Go em todas as condições de detergente, sugerindo que o complexo foi formado independentemente da escolha do detergente(Figura 4B).
A espectrometria de LC-MS identificou o padrão de N-glicosilação em rodopsina
Amostras de rhodopsin a partir de purificação de afinidade e SEC mostraram duas bandas de proteínas que migraram com um peso molecular aparente de cerca de 37 kDa em um gel SDS-PAGE, que não poderia ser separado pela SEC ao usar uma coluna de 24 mL. Diferentes padrões de N-glicosilação na rodopsina heterostitualmente expressa da HEK 293 GnTI- as células foram a explicação mais provável. Portanto, duas enzimas, PNGase F e Endo F1, foram testadas por sua capacidade de deglicosilar a rodopsina. A partir dos dados da SDS-PAGE, endo F1 reduziu o peso molecular de ambas as bandas proteicas em um único produto, enquanto a digestão PNGase F ainda deu duas populações (Figura 5A). As amostras não digeridas e tratadas com Endo F1 foram analisadas por meio da espectrometria LC-MS para identificar as massas de diferentes espécies. Os dados mostraram que a roddopsina produzida em HEK 293 GnTI- células continham um ou dois N-glicanos, com uma diferença na massa de 1014±1 Da. Endo F1-treated rhodopsin não continha nenhum N-glicano e tinha uma diferença de massa de 2027±1 Da em comparação com a rhodopsin contendo dois N-glicos. Estes resultados são consistentes com a ausência da enzima N-acetylglucosaminyltransferase I na linha celular usada para expressar rodopsina, o que resulta em todos os N-glicanos com a estrutura GlcNAc2Man5, (massa 1014 Da).
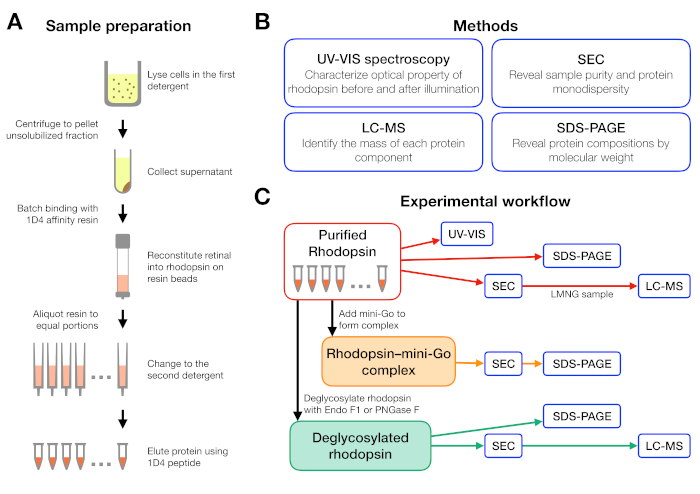
Figura 1: Preparação e caracterização da amostra para o experimento de triagem de detergente. (A) Preparação de amostras de rodopsina em diferentes detergentes durante a purificação. (B) Métodos utilizados no protocolo: espectroscopia UV-VIS, cromatografia de exclusão de tamanho (SEC), SDS-PAGE e espectrometria cromatografia-massa líquida (LC-MS). (C) Fluxo de trabalho experimental para caracterização de roddopsina, rhodopsin-mini-Go, e produto de deglicosibilização de rhodopsin. Clique aqui para ver uma versão maior desta figura.
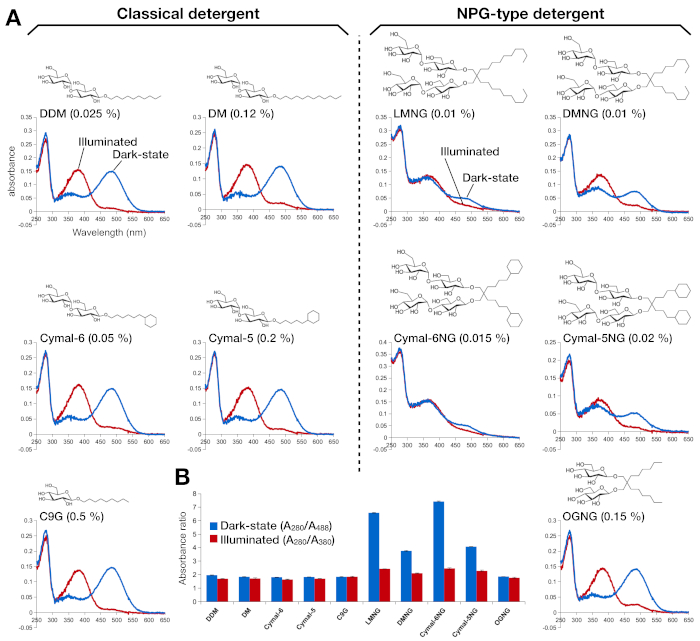
Figura 2: Espectroscopia UV-VIS de rodopsina. (A) espectro UV-VIS de rodopsina. Os espectros da rodopsina de 9 cis-bound da retina são mostrados em curvas azuis. Após a iluminação, a retina 9-cis é deprotonada e isomerizes em retiniana trans, e os espectros de roddopsina iluminada são mostrados como curvas vermelhas. A estrutura química de cada detergente é mostrada como uma insumo. (B) As proporções de A280/A488 (barra azul) e A280/A380 (barra vermelha) retratam a estabilidade da rodopsina no estado escuro e estado claro, respectivamente. Clique aqui para ver uma versão maior desta figura.
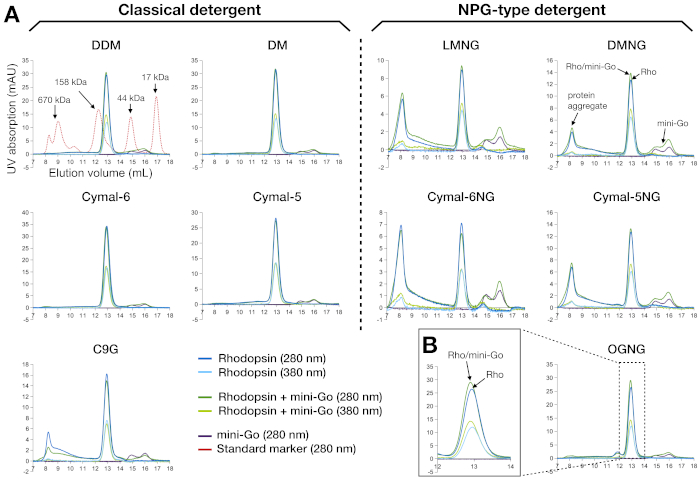
Figura 3: Perfis cromatógrafos de exclusão de tamanho de rhodopsin e rhodopsin–complexo mini-Go purificado em 10 detergentes diferentes. (A) O painel esquerdo mostra os perfis sec de amostras purificadas nos detergentes clássicos. O painel direito representa os perfis SEC de amostras purificadas nos detergentes do tipo NPG. O perfil das proteínas de marcadores padrão é mostrado como sobreposição juntamente com a amostra DDM. A interpretação dos perfis de pico é mostrada para DMNG, com o cenário ideal (sem agregados) visto para DDM, DM, Cymal-6, Cymal-5 e OGNG. (B) O perfil ampliado da amostra OGNG no volume de retenção de 12-14 mL. Todas as amostras foram analisadas utilizando-se uma coluna Superdex200 Increase 10/300 GL. Clique aqui para ver uma versão maior desta figura.
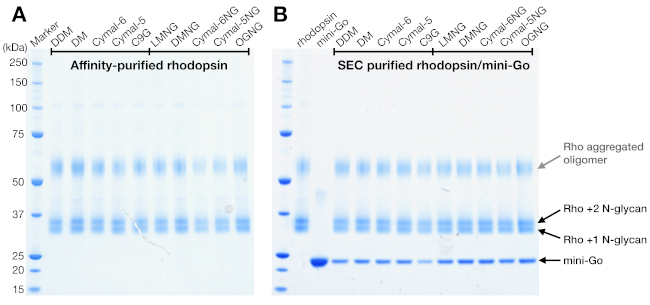
Figura 4: Análise SDS-PAGE do complexo de roddopsina e rhodopsin/mini-Go. (A)Amostras de rhodopsina purificadas em detergentes. A banda manchada acima de 50 kDa é atribuída aos oligômeros de rodopsina agregados induzidos pelo buffer de amostra SDS-PAGE. (B) Amostras purificadas pela SEC do complexo rhodopsin/mini-Go. Rhodopsin com 1 e 2 N-glicano e mini-Go são representados. Clique aqui para ver uma versão maior desta figura.
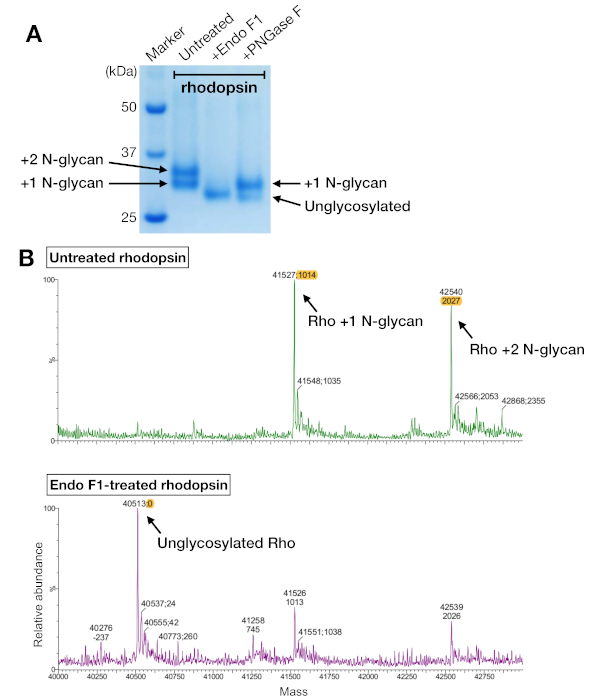
Figura 5: Identificação de glicosilação em rodopsina. (A) Análise SDS-PAGE de rhodopsin deglicosilado utilizando PNGase F e Endo F1. (B) Espectro lc-MS de rodopsina sem (painel superior) e com deglicosiloização por Endo F1 (painel inferior). Para preparar o complexo rhodopsin-mini-Go para cristalização, escolhemos Endo F1 em vez de PNGase F porque Endo F1 entregou uma única espécie homogênea de roddopsina. Clique aqui para ver uma versão maior desta figura.
| Detergente | Concentração de trabalho (%) | Concentração crítica de micelas (%) |
| DDM | 0.025 | 0.0087 |
| Dm | 0.12 | 0.087 |
| Cymal-6 | 0.05 | 0.028 |
| Cymal-5 | 0.2 | 0.12 |
| C9G | 0.5 | 0.2 |
| LMNG | 0.01 | 0.001 |
| DMNG | 0.01 | 0.0034 |
| Cymal-6NG | 0.015 | Não disponível; deve ser inferior a 0,056 |
| Cymal-5NG | 0.02 | 0.0056 |
| OGNG | 0.15 | 0.058 |
Tabela 1: Concentrações de detergente tampão C.
| Tempo (min) | Solvente A (%) | Solvente B (%) | Solvente C (%) | Vazão (ml/min) |
| 0 | 0 | 95 | 5 | 0.5 |
| 1 | 0 | 95 | 5 | 0.5 |
| 5 | 20 | 75 | 5 | 0.6 |
| 25 | 85 | 10 | 5 | 0.6 |
| 26 | 90 | 5 | 5 | 0.6 |
| 30 | 90 | 5 | 5 | 0.6 |
Tabela 2: Parâmetros de elução da coluna.
Discussão
O sucesso na cristalização proteica depende fortemente da amostra de proteínas, especialmente proteínas de membrana e seus complexos devido à complicação causada pelos detergentes. Este relatório demonstra a triagem de detergentes e a avaliação da qualidade da amostra para os complexos de sinalização proteica GPCR-mini-G. Uma variedade de métodos tem sido amplamente utilizada para estudar a propriedade bioquímica de proteínas de membrana, por exemplo, ensaio de termoestabilidade usando corantes fluorescentes16,17, ensaio de ligação para detectar formação complexa medindo a mudança no sinal de fluorescência triptofano18 ou a transferência de energia de ressonância com biosensores19. No entanto, os ambientes químicos utilizados nesses métodos são bastante diferentes daqueles para preparar uma amostra de cristalização, ou as proteínas estão em uma concentração mil vezes menor para medição baseada em fluorescência, ou proteínas são incorporadas em bicamadas lipídicas ou em uma condição de detergente fixo. Neste protocolo, os métodos utilizados também são padronizados na preparação da amostra em larga escala antes da cristalização. Portanto, os parâmetros otimizados podem ser facilmente transferidos para a preparação em escala de cristalização sem maior esceleção e otimização.
O objetivo deste protocolo é otimizar a preparação de um complexo proteico GPCR-mini-G estável e homogêneo para cristalização da difusão de vapor e determinação da estrutura por cristalografia de raios-X. O protocolo integra um conjunto de métodos para avaliar qualitativamente o impacto do detergente e da deglicosiladurante durante a preparação do complexo rhodopsin-mini-Go. A rodopsina em estado inativo e estado ativado pela luz ligado com e sem o peptídeo transducina foi cristalizada quando purificada nos detergentes octyl glucoside (C8G)20,21,22 e C9G23,24. Como o complexo rhodopsin-mini-Go purificado em C8G e C9G não produziu cristais (dados não mostrados), então exploramos uma gama mais ampla de outros detergentes usando a estratégia descrita (Figura 1). Aproveitando a sensibilidade à luz da rodopsina, poderíamos muito bem acompanhar a reconstituição da retina em comprimentos de onda diferentes de 280 nm. Tanto na espectroscopia UV-VIS quanto na SEC, detectamos a retina em 380 nm ou 488 nm. No entanto, a maioria das proteínas de membrana não tem um cromóforo tão conveniente para seguir a funcionalidade durante a purificação. Outras opções seriam tornar um liganddetectável adicionando um cromóforo detectável à luz ou usando ensaios de radioligação e mudança térmica25.
Rhodopsin tem um peso molecular de 40 kDa. Devido à massa de detergente que liga, seu peso molecular aparente na SEC é de cerca de 120 kDa. Não é surpresa, portanto, que a ligação de mini-Go (24 kDa) não tenha sido facilmente detectada na SEC, pois isso exigiria diferenciação de proteínas com massas aparentes de 120 kDa e 144 kDa. A análise das frações sec por SDS-PAGE foi, portanto, utilizada para confirmar a pureza da amostra e a formação complexa. Mesmo que os perfis da SEC mostrem uma clara mudança na formação complexa, ainda é recomendável realizar a análise sds-PAGE para confirmar a formação complexa com parceiros de ligação corretos em vez de outros contaminantes proteicos co-purificados.
Tanto a rodopsina quanto a mini-Go foram purificadas em quantidades de miligramas, o que permitiu o uso de detecção de baixa sensibilidade dos complexos, como a absorção uv-VIS durante a SEC e a coloração azul commassie de géis SDS-PAGE. Quando as amostras são limitadas, deve-se usar uma detecção mais sensível, como um purificador LC equipado com um detector de fluorescência para rastrear sinais de triptofano da proteína (emissão de 280 nm, emissão de 350 nm) e coloração de prata para géis SDS-PAGE. Outra abordagem seria fundir uma proteína fluorescente, como a proteína de fluorescência verde (GFP) à proteína de interesse, que também permitiria a detecção mesmo durante a expressão proteica26, mas deve ser removida antes da cristalização.
É essencial garantir que a proteína purificada também esteja livre da heterogeneidade decorrente de PTMs variáveis. No caso descrito aqui, as duas populações de rodopsina observadas em géis SDS-PAGE foram caracterizadas como tendo um ou dois N-glicanos. A modificação variável de uma proteína potencialmente impediria a formação de cristais bem difradores, por isso deglicoizamos a roddopsina. A endoglicemia Endo F1 foi o maior efeito testado e o tratamento levou a uma única espécie de receptor não aconchegante, enquanto PNGase F apenas removeu parcialmente os glicanos na rodopsina e resultou em uma mistura de rodopsina totalmente não aconchegante ou com um N-glicano permaneceu. A rhodopsina sem tratamento de deglicosilase foi cristalizada com sucesso3,27,28, e o N-glicano na rhodopsin Asn15 é importante para formar contato cristalino nesses casos. No caso da rhodopsina-mini-Go,é necessário remover n-glicanos por Endo F1 para obter cristais. Não há uma regra padronizada para deglicosilizar proteínas de interesse antes da cristalização, mas a remoção de PTMs heterogêneos deve ser considerada quando as proteínas não se cristalizam após extensos ensaios de cristalização.
Os dados e a metodologia descritos aqui nos guiaram a escolher o OGNG como o detergente preferido para a cristalização do complexo rhodopsin-mini-Go devido ao seu pequeno tamanho de micela e sua capacidade de estabilizar o complexo. Também usamos o Endo F1 para garantir que a rodopsina purificada fosse uma espécie homogênea. Os cristais foram posteriormente obtidos e determinamos a estrutura cristalina para ~3.1 Å4, que era apenas a terceira estrutura cristalina de um complexo de sinalização proteica GPCR-G14,29.
Para proteínas de membrana ligadas com e sem proteína parceira, elas devem ser consideradas como duas proteínas diferentes. Uma proteína em diferentes estados funcionais tem diferentes conformações e está em diferentes níveis de energia. Portanto, recomenda-se otimizar o protocolo de preparação para cada estado funcional, pois o parâmetro para o estado inativo pode não ser totalmente transferível para o estado ativado. Além disso, sem mencionar a mudança na propriedade proteica complicada pela vinculação de uma proteína parceira. O protocolo utiliza métodos padronizados para o preparo de uma amostra de cristalização para preparar proteína de membrana inativa em diferentes detergentes, seguido de ativação proteica e formação complexa, e para caracterizar a qualidade da proteína. Assim, este protocolo pode ser facilmente generalizado para outras proteínas de membrana e seus complexos para estudos estruturais com pequenas modificações.
Divulgações
A CGT é consultora e membro do Conselho Consultivo Científico da Sosei Heptares. Todos os outros autores não têm nada para revelar.
Agradecimentos
Agradecemos ao Prof. Dr. Gebhard F. X. Schertler por seu apoio de longo prazo neste projeto, Dr. Roger J.P. Dawson e Hoffmann La Roche pelo apoio na cultura celular. Este trabalho foi patrocinado pela Swiss National Science Foundation (bolsas 210030_153145 e 310030B_173335 ao GFXS), e financiamento para a CGT do Conselho Europeu de Pesquisa (EMPSI, 339995) e do Conselho de Pesquisa Médica (MRC U105197215). A FP reconhece o ETH Zürich através do Centro Nacional de Competência em Pesquisa Molecular Ultrarfast Ciência e Tecnologia (NCCR MUST) e dos programas ETH Femtosecond e Attosecond Science and Technology (ETH FAST). FP, JM, AB e CJT reconhecem o apoio financeiro de longo prazo do Instituto Paul Scherrer.
Materiais
| Name | Company | Catalog Number | Comments |
| 1D4 peptide | Peptide2.0 | Under request | |
| 9-cis retinal | Sigma-Aldrich | R5754 | |
| Autosampler A-900 | GE Healthcare | Discontinued | |
| C9G | Anatrace | N324 | |
| cOmplete, EDTA-free protease inhibitor coctail | Roche | 5056489001 | |
| Cymal-5 | Anatrace | C325 | |
| Cymal-5NG | Anatrace | NG325 | |
| Cymal-6 | Anatrace | C326 | |
| Cymal-6NG | Anatrace | NG326 | |
| DDM | Anatrace | D310 | |
| DM | Anatrace | D322 | |
| DMNG | Anatrace | NG322 | |
| Econo column | Bio-Rad | 7372512 | |
| Ettan LC | GE Healthcare | Discontinued | |
| FRAC-950 | GE Healthcare | Discontinued | |
| HPLC Water 2795 Separation Module | Waters AG | 720000358EN | |
| InstantBlue Protein Stain | Expedeon | ISB1L | |
| LCT Premier mass spectrometer (ESI-TOF) | Waters AG | - | |
| LMNG | Anatrace | NG310 | |
| Monitor UV-900 | GE Healthcare | 18110835 | |
| Nanodrop 1000 | Witec AG/ThermoFisher | Discontinued | |
| NuPAGE 4-12% Bis-Tris gel 1.0 mm, 15 well | ThermoFisher | NP0323BOX | |
| NuPAGE MES SDS buffer (20x) | ThermoFisher | NP0002 | |
| OGNG | Anatrace | NG311 | |
| PAGEr Minigel Chamber | Lonza | 59905 | |
| Reprosil 200 C18-AQ column | Morvay Analytik GmbH | #s1503 | |
| Superdex 200 Increase GL column | GE Healthcare | 28990944 | |
| Tabletop centrifuge 5424R | Eppendorf | 5404000413 | |
| Ultracentrifuge Optima XE-100 | Beckmann Coulter | A94516 | |
| ULTRA-TURRAX T25 | IKA WERKE | 0003725003 | |
| UV-VIS spectrophotometer | Shimadzu | UV-2401PC | |
| Waters 2487 Dual λ Absorbance Detector | Waters AG | - |
Referências
- Tate, C. G. Practical considerations of membrane protein instability during purification and crystallisation. Methods in Molecular Biology. 601, 187-203 (2010).
- Lebon, G., Bennett, K., Jazayeri, A., Tate, C. G. Thermostabilisation of an agonist-bound conformation of the human adenosine A(2A) receptor. Journal of Molecular Biology. 409 (3), 298-310 (2011).
- Deupi, X., et al. Stabilized G protein binding site in the structure of constitutively active metarhodopsin-II. Proceedings of the National Academy of Sciences. 109 (1), 119-124 (2012).
- Tsai, C. -. J., et al. Crystal structure of rhodopsin in complex with a mini-G o sheds light on the principles of G protein selectivity. Science Advances. 4 (9), (2018).
- Carpenter, B., Tate, C. G. Engineering a minimal G protein to facilitate crystallisation of G protein-coupled receptors in their active conformation. Protein Engineering Design and Selection. 29 (12), 583-594 (2016).
- Chae, P. S., et al. Maltose-neopentyl glycol (MNG) amphiphiles for solubilization, stabilization and crystallization of membrane proteins. Nature Methods. 7 (12), 1003-1008 (2010).
- Loll, P. J. Membrane proteins, detergents and crystals: what is the state of the art. Acta Crystallographica Section F Structural Biology Communications. 70 (12), 1576-1583 (2014).
- Chae, P. S., et al. Glucose-neopentyl glycol (GNG) amphiphiles for membrane protein study. Chemical communications. 49 (23), 2287-2289 (2013).
- Standfuss, J., Xie, G., Edwards, P. C., Burghammer, M., Oprian, D. D., Schertler, G. F. X. Crystal structure of a thermally stable rhodopsin mutant. Journal of Molecular Biology. 372 (5), 1179-1188 (2007).
- Kaushal, S., Ridge, K. D., Khorana, H. G. Structure and function in rhodopsin: the role of asparagine-linked glycosylation. Proceedings of the National Academy of Sciences of the United States of America. 91 (9), 4024-4028 (1994).
- Molday, L. L., Molday, R. S. 1D4: a versatile epitope tag for the purification and characterization of expressed membrane and soluble proteins. Methods in Molecular Biology. 1177 (604), 1-15 (2014).
- Carpenter, B., Tate, C. G. Expression and Purification of Mini G Proteins from Escherichia coli. Bio-Protocol. 7 (8), (2017).
- Grueninger-Leitch, F., D'Arcy, A., D'Arcy, B., Chène, C. Deglycosylation of proteins for crystallization using recombinant fusion protein glycosidases. Protein Science. 5 (12), 2617-2622 (1996).
- Rasmussen, S. G. F., et al. Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature. 477 (7366), 549-555 (2011).
- Loginova, M. Y., Rostovtseva, Y. V., Feldman, T. B., Ostrovsky, M. A. Light damaging action of all-trans-retinal and its derivatives on rhodopsin molecules in the photoreceptor membrane. Biochemistry (Moscow). 73 (2), 130-138 (2008).
- Alexandrov, A. I., Mileni, M., Chien, E. Y. T., Hanson, M. A., Stevens, R. C. Microscale Fluorescent Thermal Stability Assay for Membrane Proteins. Structure. 16 (3), 351-359 (2008).
- Sonoda, Y., et al. Benchmarking Membrane Protein Detergent Stability for Improving Throughput of High-Resolution X-ray Structures. Structure. 19 (1), 17-25 (2011).
- Maeda, S., et al. Crystallization scale preparation of a stable GPCR signaling complex between constitutively active rhodopsin and G-protein. PloS One. 9 (6), 98714 (2014).
- Boute, N., Jockers, R., Issad, T. The use of resonance energy transfer in high-throughput screening: BRET versus FRET. Trends in Pharmacological Sciences. 23 (8), 351-354 (2002).
- Singhal, A., Guo, Y., Matkovic, M., Schertler, G., Deupi, X., Yan, E. C. Y. Structural role of the T 94 I rhodopsin mutation in congenital stationary night blindness. EMBO Report. 17 (10), 1-10 (2016).
- Choe, H. -. W., et al. Crystal structure of metarhodopsin II. Nature. 471 (7340), 651-655 (2011).
- Mattle, D., et al. Ligand channel in pharmacologically stabilized rhodopsin. Proceedings of the National Academy of Sciences of the United States of America. 115 (14), 3640-3645 (2018).
- Okada, T., Fujiyoshi, Y., Silow, M., Navarro, J., Landau, E. M., Shichida, Y. Functional role of internal water molecules in rhodopsin revealed by X-ray crystallography. Proceedings of the National Academy of Sciences of the United States of America. 99 (9), 5982-5987 (2002).
- Blankenship, E., Vahedi-Faridi, A., Lodowski, D. T. The High-Resolution Structure of Activated Opsin Reveals a Conserved Solvent Network in the Transmembrane Region Essential for Activation. Structure. 23 (12), 2358-2364 (2015).
- Magnani, F., et al. A mutagenesis and screening strategy to generate optimally thermostabilized membrane proteins for structural studies. Nature Protocols. 11 (8), 1554-1571 (2016).
- Kawate, T., Gouaux, E. Fluorescence-detection size-exclusion chromatography for precrystallization screening of integral membrane proteins. Structure. 14 (4), 673-681 (2006).
- Standfuss, J., et al. The structural basis of agonist-induced activation in constitutively active rhodopsin. Nature. 471 (7340), 656-660 (2011).
- Singhal, A., et al. Insights into congenital stationary night blindness based on the structure of G90D rhodopsin. EMBO reports. 14 (6), 520-526 (2013).
- Carpenter, B., Nehmé, R., Warne, T., Leslie, A. G. W., Tate, C. G. Structure of the adenosine A(2A) receptor bound to an engineered G protein. Nature. 536 (7614), 104-107 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados