Method Article
إثراء التقارب المتزامن لتعديلات ما بعد الترجمة للقياس الكمي وتوطين الموقع
In This Article
Summary
يصف سير العمل هذا أداء الإثراء الفعال للوقت والتكلفة للتعديلات المتعددة للبروتين بعد الترجمة (PTMs) في وقت واحد للتحليل الكمي العالمي للبروتيوميات. يستخدم البروتوكول تخصيب PTM على مستوى الببتيد مع أجسام مضادة مترافقة متعددة ، يليه تحليل قياس الطيف الكتلي للاستحواذ المستقل عن البيانات للحصول على رؤى بيولوجية في الكلام المتبادل PTM.
Abstract
دراسة تعديلات متعددة بعد الترجمة (PTMs) من البروتينات هو خطوة حاسمة لفهم PTM الحديث المتبادل والحصول على رؤى أكثر شمولية في وظيفة البروتين. على الرغم من أهمية دراسات الإثراء متعددة PTM، إلا أن القليل من الدراسات تحقق في أكثر من عملية PTM واحدة في وقت واحد، ويرجع ذلك جزئيًا إلى النفقات والوقت وكميات البروتين الكبيرة المطلوبة لإجراء تحليل بروتيوميكي عالمي متعدد لـ PTMs. و "وعاء واحد" التخصيب تقارب مفصلة في هذا البروتوكول يتغلب على هذه الحواجز من خلال السماح في وقت واحد تحديد والقياس الكمي من الببتيدات مع بقايا الليسين التي تحتوي على أسيتيل وPTMs succinylation مع كميات منخفضة من العينة الادخال. البروتوكول ينطوي على إعداد البروتين lysate من أكباد الماوس من الفئران SIRT5 خروج المغلوب، وأداء الهضم التربسين، وإثراء لPTMs، وأداء تحليل الطيف الكتلي باستخدام عملية اقتناء مستقلة عن البيانات (DIA) سير العمل. لأن هذا سير العمل يسمح لإثراء اثنين من PTMs من نفس العينة في وقت واحد، فإنه يوفر أداة عملية لدراسة PTM الحديث المتبادل دون الحاجة إلى كميات كبيرة من العينات، ويقلل كثيرا من الوقت اللازم لإعداد العينة، والبيانات الاستحواذ والتحليل. يوفر مكون DIA لسير العمل معلومات شاملة خاصة بـ PTM. هذا مهم بشكل خاص عند دراسة تعريب موقع PTM ، حيث توفر DIA مجموعات شاملة من الأيونات المجزأة التي يمكن فك تشفيرها حسابيًا للتمييز بين أشكال تعريب PTM المختلفة.
Introduction
عدد لا يحصى من التعديلات ما بعد الترجمة تنظيم البروتينات ومسارات حيوي من خلال آثار على النشاط1، مما يشيرإلى 2، ودوران3،4. على سبيل المثال ، يتم تنشيط kinases البروتين أو تعطيلها عن طريق إضافة مجموعات الفوسفات5، وخل الهستون وغيرها من التعديلات توفر آلية لتغيير بنية الكروماتين وبمثابةآلياتتنظيمية النسخ6،7. في السنوات الأخيرة ، وقد شنت الأدلة على أن PTMs متعددة تعمل في تناغم أو تتنافس لتنظيم وظيفة البروتين أو النشاط8،9،10،11. ولذلك ، فهم PTM الحديث المتبادل هو حاجة ناشئة في البحوث PTM. ومع ذلك ، فإن معظم سير العمل البروتوميكية المتاحة لتحديد وتحديد مواقع PTM تركز على تعديلات مفردة ، بدلاً من التفاعل مع تعديلات متعددة. يرتبط سير العمل الموصوف بتعديل بروتين محدد "النقاط الساخنة" وبقايا الليسين التي يتم تعديلها بواسطة العديد من PTMs المختلفة.
وهناك حاجة متزايدة في الأوساط العلمية إلى أساليب مجدية لدراسة آليات منع البتات المتعددة في وقت واحد12. معظم الأساليب لتحديد وتحديد المواقع على الصعيد العالمي من أنواع متعددة من PTMs هي صعبة بسبب ارتفاع التكاليف وكمية الأنسجة المطلوبة12،13. لا تقتصر تجارب الإثراء متعدد PTM على استهلاك الوقت من حيث إعداد العينات والحصول على البيانات وتحليل البيانات ، ولكن هذه الدراسات تتطلب عادة كميات كبيرة وباهظة في كثير من الأحيان من البروتين11. وصف هنا هو بروتوكول للتخصيب في وقت واحد وتحليل PTMs متعددة، والذي يعالج أيضا العديد من هذه الحواجز وتمكن على نطاق واسع PTM التنميط وتقييم الكلام المتبادل بين مختلف PTMs14. هذا سير العمل وعاء واحد يحدد طريقة عملية للباحثين في الطب الحيوي لملفات PTMs متعددة على الصعيد العالمي ، وتحديد الببتيدات المعدلة ، ودراسة PTM crosstalk بطريقة فعالة وفعالة من حيث التكلفة14،15.
هنا ، يتم عرض هذه الطريقة من خلال فحص الميتوكوندريا بروتين acylation ، الذي درس لأول مرة منذ أكثر من 50 عاما16. وهو يركز على وجه التحديد على أسيتيل الليسين17 والسكسينيل18، بما في ذلك المشاركة في حدوث هذه التعديلات على البروتينات وحتى التعديل المشترك على مستوى الببتيد. وبما أن الدراسة تستخدم نموذج فأرة خروج المغلوب سيرتوين 5 (SIRT5)، فقد تم اختيارها للتركيز على إثراء مواقع الأسيتيل والسكشن. وقد اتخذ هذا القرار لأن مواقع السكسينيل هي أهداف لـ SIRT5 desuccinylase ومن المتوقع بالتالي أن تظهر زيادة كبيرة في فئران KO ، مما يجعلها أكثر PTMs ذات صلة في هذه الحالة. وكلا الأمرين وثيقا الصلة بيولوجياً على النحو الذي لخصه مؤخراً شركة كاريكو وآخرون19. بشكل عام ، يظهر الأسيتيل تأثيرات مهمة على التعبير الجيني والتمثيل الغذائي ، وقد تم الإبلاغ عن السكسينيل لتنظيم استقلاب القلب والوظيفة20.
يمكن تنفيذ البروتوكول الموصوف بكمية منخفضة من مواد مدخلات البروتين (على سبيل المثال، 1 ملغ من البروتين) ويقلل من المدة الإجمالية للتجربة عن طريق تقليل الوقت المستغرق في معالجة العينات، واكتساب التصلب المتعدد، وتحليل البيانات. يتم توفير مخطط سير العمل في الشكل 1. كما استخدمنا كميات أقل من المواد الأولية (وصولاً إلى 100 ميكروغرام من البروتين، مما يقلل من كميات الخرز المستخدمة وفقاً لذلك)، وهو ما يقلل، كما هو متوقع، من الغلة الإجمالية للببتيدات المنجلة المحددة؛ ومع ذلك، فإنه لا يزال يوفر نتائج قيمة للغاية والببتيدات القابلة للقياس الكمي.
في حين أن ما يسمى سير العمل من أعلى إلى أسفل أو من منتصف إلى أسفل عادة لا تستخدم نهج الهضم البروتيني (وبالتالي الحفاظ على اتصال PTMs متعددة داخل بروتين واحد)، وهذا البروتوكول يركز على نهج التخصيب تقارب الببتيد القائم على اكتساب عمق إضافي وحساسية لتحديد PTM والقياس الكمي(الشكل 1). بالإضافة إلى ذلك ، يستخدم سير العمل هذا الببتيد المتمحور حول أساليب قياس الطيف الكتلي الحديثة ، بما في ذلك 1) مزيج من الاستحواذ المعتمد على البيانات (DDA) لإنشاء مكتبات طيفية ، و 2) اكتساب مستقل عن البيانات (DIA) للقياس الكمي الدقيق لـ PTM في سير عمل خالٍ من التسمية.
تعمل مهام سير عمل DIA على التغلب على أخذ العينات من مخططات المسح الضوئي النموذجية DDA عن طريق تجزئة جميع إشارات الببتيد بشكل شامل داخل نطاق m/z العينات21. هذه الميزة مفيدة للغاية أيضًا من حيث تعريب الموقع ، لأنه من الأسهل الحصول على معلومات حول أي أي من الأجزاء المحددة يتم تعديلها داخل الببتيد. وبالإضافة إلى ذلك، تسمح سير عمل DIA بتحديد وقياس كمية أشكال ISOforms PTM-peptide البسيطة مع الأيونات السلائف متطابقة. يمكن لأساليب DIA أيضًا تحديد توطين موقع PTM محدد داخل الببتيد استنادًا إلى أيونات جزء محددة مناظرة يتم قياسها بشكل شامل في جميع الأوقات. ومع ذلك، غالباً ما تستخدم نهج DDA ميزات "الاستبعاد الديناميكي" التي تستبعد أخذ عينات متعددة من MS/MS لنفس الأيون السلائف، وبالتالي فهي تفتقد أشكال الـ PTM الثانوية.
إن استراتيجية الإثراء المتزامن الموصوفة هنا مناسبة بشكل مثالي للدراسات التي ستستفيد من التنميط العالمي والقياس الكمي لـ PTMs متعددة ، وفحص المحادثات المتقاطعة PTM ، وفهم التفاعلات الديناميكية للتعديلات ما بعد الانتقالية. وقد تم وصف تحديد PTMs المخصب متعددة في سير عمل واحد مجتمعة من قبل: الإثراء العالمي أو المسلسل أو الموازي PTM التي تحتوي على الببتيدات البروتينية، أو بدلا من ذلك عن طريق تحليل البروتينات سليمة. في مقارنة مباشرة مع الإثراء التسلسلي للأسيتيل والسكسينيل ، تم تحديد كفاءة منهجية وعاء واحد على أنها مشابهة للغاية14. وتتطلب هذه البروتوكولات البديلة كميات كبيرة من المواد والوقت الأوليين ويمكن أن تكون باهظة التكلفة. وعلى النقيض من ذلك، يوفر بروتوكول الوعاء الواحد طريقة غير مكلفة وفعالة لإثراء أكثر من آلية واحدة للإدارة المؤقتة مع التحليل والتحديد اللاحقين.
يتم الحصول على أنسجة كبد الماوس من الفئران SIRT5 خروج المغلوب وتستخدم هنا كمادة البداية. ويمكن أيضا أن يتم تنفيذ هذا البروتوكول لlysates البروتين من مختلف الأنسجة أو تجارب زراعة الخلايا. ويمكن تطبيق هذا البروتوكول على البروتين اتلاف التي تم الحصول عليها من الأنسجة أو خلايا الكريات الخلايا.
Protocol
تتبع جميع التجارب الموصوفة في البروتوكول المبادئ التوجيهية للجنة أبحاث الحيوانات المؤسسية لمعهد باك.
1. استخراج البروتين من الأنسجة المتجانسة والهضم مع البروتياز
- إعداد العازلة تحلل حديثا إلى تركيز نهائي من 8 M اليوريا, 50 m m triethylammonium بيكربونات (TEAB), 1 μM trichostatin A (TSA), 20 m nicotinamide, 75 mM كلوريد الصوديوم (NaCl), 1x بروتياز / فوسفاتاس كوكتيل مثبط (PIC) مع HPLC-الصف المياه.
- أضف حبة فولاذية معقمة واحدة إلى أنبوب 2 مل متوافق مع متجانس مطحنة حبة، ثم ضع قطعة الأنسجة (بحجم البازلاء) في الأنبوب. إضافة العازلة الانطول (500 ميكرولتر) والدوامة لفترة وجيزة لضمان العازلة يغطي قطعة الأنسجة (إضافة المزيد من العازلة الانطول، إذا لزم الأمر). ضع الأنابيب على مجموعات محولة مبردة مسبقًا، مما يضمن توازن الأنابيب بين محولي المتجانس.
- التجانس عينات 2x في 25 هرتز لمدة 3 دقيقة لكل منهما في 4 درجة مئوية. إذا لم يكن الأنسجة متجانسة بالكامل ، قم بتدوير الأنابيب لفترة وجيزة ونقل الليزات المتجانسة إلى أنبوب 1.5 مل المسمى حديثًا. ثم، إضافة إضافية العازلة الانخلاث إلى قطعة الأنسجة المتبقية، وكرر التجانس 2x في 25 هرتز لمدة 3 دقائق لكل منهما. جولتين من التجانس عادة ما تكون كافية لتفريق الأنسجة.
- إزالة من تبّه معدنيّة مع ملاقط. بين كل عينة، شطف ملاقط مع HPLC الصف المياه، HPLC الصف الميثانول، وHPLC-الصف المياه مرة أخرى.
- الجمع بين ليسات المتجانس إذا تم تطبيق جولتين من التجانس وعينات سونيكات مع الموجات فوق الصوتية لمدة 10 دورات في 30 ق على / 30 ق قبالة و 4 درجة مئوية على الطاقة العالية.
- الطرد المركزي المتجانس يليس في 14،000 ز لمدة 10 دقيقة في 4 درجة مئوية لمسح lysate. نقل supernatant (مسح lysate) إلى أنبوب جديد 1.5 مل الطرد المركزي الدقيق، وتجنب أي طبقة الدهون التي قد الجلوس على رأس supernatant وأي حطام في الجزء السفلي من الأنبوب.
- إجراء تحليل حمض البيسيندونينيك (BCA) لقياس تركيز البروتين من الليزات الخالية مع تخفيف السليم (على سبيل المثال، 1:20 و/ أو 1:200). وفقا لنتائج BCA، aliquot 1 ملغ من البروتين من كل عينة.
- تقليل البروتينات في 4.5 mM dithiothreitol (DTT) في 37 درجة مئوية لمدة 30 دقيقة مع الانفعالات في 1400 دورة في الدقيقة. في وقت لاحق، البروتينات الألكيلات في 10 m iodoacetamide (IAA) مع الحضانة في الظلام (مكان في درج أو مجلس الوزراء) في درجة حرارة الغرفة (RT) لمدة 30 دقيقة.
ملاحظة: يمكن استخدام الكواشف البديلة، مثل N-ethylmaleimide (NEM) بدلاً من IAA. - أضف 50 مم ّ من TEAB إلى العينات لتخفيف تركيز اليوريا إلى أقل من 2 م. بقعة 1 ميكرولتر من العينة على ورق درجة الحموضة لضمان درجة الحموضة في العينة المخففة بين 7.0-8.5. إضافة التربسين إلى كل عينة بنسبة 1:50 (التربسين إلى البروتين، wt/wt) وهضم البروتين مع الانفعالات في 37 درجة مئوية بين عشية وضحاها (حوالي 14-16 ساعة).
- إخماد الهاضم مع حمض الفورميك 10٪ للوصول إلى 1٪ حمض الفورميك في اليوم التالي. دوامة وتدور لفترة وجيزة. بقعة 1 μL من العينة على شرائط درجة الحموضة لضمان هضم هو درجة الحموضة = 2-3. عينات أجهزة الطرد المركزي في 1800 x ز لمدة 15 دقيقة في RT لبيليه أي مواد غير قابلة للذوبان.
2. إزالة الملح من الببتيدات البروتينية غير المخصب عن طريق استخراج المرحلة الصلبة على نطاق واسع
- الحصول على خراطيش تحتوي على راتنج C18 التي يمكن أن تربط ما يصل إلى 10 ملغ من البروتين. تناسب هذه الخراطيش في جهاز فراغ لاستخدام شفط فراغ التي يمكن سحب السائل من خلال خرطوشة خلال كل من الخطوات التالية. تعيين خرطوشة واحدة لكل عينة الببتيد.
- أضف 800 ميكرولتر من 80% أسيتونتريل (ACN) في حمض الفورميك 0.2% إلى خراطيش مع 19.8% من الماء واستخدم شفط الفراغ لسحب السائل من خلال. كرر هذه الخطوة 1x، وتجنب تجفيف الخراطيش تماما.
- خراطيش التوازن عن طريق إضافة 800 ميكرولتر من حمض الفورميك 0.2٪ في الماء مع شفط فراغ لسحب حجم كامل من خلال مرشح. كرر هذا 2x. تحميل الببتيدات على خراطيش مع شفط فراغ. غسل الببتيدات 2x مع 800 ميكرولتر من حمض الفورميك 0.2٪ في الماء تحت شفط فراغ.
- ترتيب 1.5 مل أنابيب الطرد المركزي الصغير تحت كل خرطوشة لجمع eluting الببتيد في الخطوة الأخيرة. تحت الببتيدات شفط فراغ من خراطيش، أولا مع 800 ميكرولتر من 80٪ ACN في 0.2٪ حمض الفورميك و 19.8٪ من الماء، ثم مع 400 ميكرولتر من نفس الحل. تجفيف عينات الببتيد الخالية من الملح تماما في مكثف فراغ (2-3 ساعة).
3. التخصيب المتزامن للببتيدات K-الأسيتيل وK-succinylated مع حبات المنافية المناعية
- إعادة تعليق الببتيدات المجففة في 1.4 مل من التبريد 1x المناعة تقارب تنقية (IAP) عازلة. دوامة لخلط وضمان درجة الحموضة من ~ 7. عينات أجهزة الطرد المركزي عند 10,000 × ز لمدة 10 دقيقة عند 4 درجات مئوية. قد تظهر بيليه صغير.
- وضع الببتيدات جانبا على الجليد أثناء إعداد الأجسام المضادة الخرز. إلى أنبوب من K-أسيتيل وأنبوب من K-succinyl الأجسام المضادة من الملاط (حجم: 100 ميكرولتر من الطين لكل أنبوب), إضافة 1 مل من الباردة 1x الفوسفات العازلة المالحة (PBS) ومزيج عن طريق الأنابيب. نقل الحل بأكمله إلى أنبوب جديد 1.5 مل وتدور في جهاز طرد مركزي مصغر لمدة 30 s في RT.
- يستنشق برنامج تلفزيوني، مع الحرص على تجنب aspiing قبالة أي حبات. كرر غسل 3x عن طريق الغسيل مرة أخرى مع 1 مل من 1x الباردة PBS، الطرد المركزي لمدة 30 ثانية في RT وaspirating قبالة برنامج تلفزيوني.
- إعادة تعليق الخرز في حوالي 440 ميكرولتر من برنامج تلفزيوني. ويستخدم ربع عدد الخرز في كل أنبوب PTM (100 ميكرولتر، الذي توفره الشركة المصنعة) للإثراء وعاء واحد (حوالي 62.5 ميكروغرام من كل جسم مضاد معلّق لكل من ك-أسيتيل وك-سوتشينيل حبات الأجسام المضادة). ماصة الخرز عدة مرات لخلط جيدا. إزالة 100 ميكرولتر من حبات الأجسام المضادة أسيتيل ليسين ونقلها إلى أنبوب واحد مع نصائح مسبقة 200 ميكرولتر، وضمان أن يبقى المزيج الرئيسي مختلطة بشكل جيد باستمرار.
- تفعل الشيء نفسه مع حبات الأجسام المضادة succinyl-lysine عن طريق إزالة 100 ميكرولتر من حبات الأجسام المضادة الستشينيل ليسين إلى الأنبوب للوصول إلى أجزاء متساوية من الأجسام المضادة أسيتيل ليسين والأجسام المضادة الستشينيلل يسين في كل أنبوب. تدور لأسفل لمدة 30 s في جهاز طرد مركزي مصغرة وتستنشق قبالة وسائل الإعلام مع تلميح محمل هلام (حبات سوف تتحول بيضاء).
ملاحظة: يجب أن يكون لكل أنبوب بيليه حبات مماثلة في الجزء السفلي. - ماسيت الببتيد إعادة تعليق مباشرة على الخرز غسلها. يجب الحرص على تجنب أي الكريات (إضافة بسرعة لتجنب تجفيف الخرز). احتضان الببتيدات مع الخرز في 4 درجة مئوية بين عشية وضحاها مع الانفعالات.
4. Elution من الببتيدات ملزمة حبات الأجسام المضادة
- قم بتدوير عينات الببتيد عند 2000 × ز لمدة 30 عامًا عند 4 درجات مئوية. إزالة supernatant تحتوي على الببتيدات غير المنضمة وحفظ للتجارب في المستقبل إذا رغبت في ذلك. إضافة 1 مل من العازلة 1x IAP الباردة إلى الخرز لغسل وخلط عن طريق عكس 5x. تدور في 2000 × ز لمدة 30 s في 4 °C. استعجّل حل IAP وكرر خطوة غسل IAP 1x لما مجموعه اثنين من الغسيل.
- أضف 1 مل من ماء HPLC البارد إلى الخرز واخلط عن طريق قلب 5x. تدور في 2000 × ز لمدة 30 s في 4 °C. استنشق الماء كرر خطوة غسل الماء مرتين لما مجموعه ثلاثة يغسل. قم بتدوير وقت إضافي عند 2000 × ز لمدة 30 عامًا عند درجة حرارة 4 درجات مئوية لجمع أي ماء متبقي في الجزء السفلي من الأنبوب. استشير أي ماء إضافي قد يكون جمع مع نصائح تحميل هلام ذات رؤوس مسطحة. كن حذرا لتجنب aspirating الخرز.
- إضافة 55 ميكرولتر من 0.15٪ حمض ثلاثي الفلوروacetic في الماء إلى الخرز. احتضان الخرز لمدة 10 دقيقة في RT في حين التنصت في بعض الأحيان الجزء السفلي من أنبوب لخلط. تدور الخرز في RT لمدة 30 s في جهاز طرد مركزي مصغر. قم بإزالة الببتيدات المنقوصة وتوضع جانباً باستخدام طرف تحميل هلامي ذو رؤوس مسطحة.
- إضافة 45 ميكرولتر من 0.15٪ حمض ثلاثي الفلوروacetic في الماء إلى الخرز. احتضان لمدة 10 دقيقة في RT أثناء النقر على الجزء السفلي من الأنبوب في بعض الأحيان لخلط. تدور الخرز في RT لمدة 30 s في جهاز طرد مركزي مصغر. إزالة elution الثاني باستخدام طرف جل تحميل ذات الرؤوس المسطحة والجمع مع elution الأولى.
- قم بتدوير الببتيدات المقترنة مجتمعة عند 12,000 × ز لمدة 5 سنوات في RT لبيليه أي حبات تحمل. نقل محلول عينة الببتيدات إلى أنبوب جديد 500 ميكرولتر.
ملاحظة: يمكن إيقاف البروتوكول مؤقتاً هنا.
5. إزالة الملح من الببتيدات المخصب
ملاحظة: يجب أن يكون درجة الحموضة من العينات أقل من 4 للربط الأمثل إلى الطرف الذي يحتوي على راتنج C18. استخدم طرف ماصة 10 ميكرولتر يحتوي على 0.6 ميكرولتر من راتنج C18 وماصة 10 ميكرولتر للتحكم في الطرف.
- قبل الرطب تلميح C18 عن طريق الأنابيب 10 ميكرولتر من الأسيتونتريل في الطرف. الاستغناء عن الأسيتونتريل في النفايات. كرر هذه الخطوة مرتين أخرى.
- اتوازن بين الطرف عن طريق غسل 3x مع 10 ميكرولتر من 0.2٪ حمض الفورميك في الماء. توزيع المحلول في النفايات بعد كل توازن.
- تحميل الببتيدات من العينة على الطرف عن طريق pipetting باستمرار والاستغناء عن عينة الببتيد المخصب مع تلميح. ماسيت صعودا وهبوطا مرارا وتكرارا على الأقل 20x والاستغناء عن الحل المتبقي من تلميح.
- غسل طرف يحتوي على الببتيد ملزمة مع 10 ميكرولتر من 0.2٪ حمض الفورميك في الماء. الاستغناء عن الحل في النفايات. كرر هذه الخطوة 9x.
- الببتيدات Elute في أنبوب جديد باستخدام 10 ميكرولتر من العازلة elution تحتوي على 0.2٪ حمض الفورميك، 50٪ أسيتونتريل، و 49.8٪ من الماء. الماصة مرارا وتكرارا والاستغناء عن 10 ميكرولتر من الحل داخل أنبوب جديد 15x. كرر هذه الخطوة مع 10 μL إضافية من العازلة elution، الأنابيب مرارا وتكرارا في نفس الأنبوب كما elution السابقة.
- الببتيدات الجافة تماما في تركيز فراغ (حوالي 20 دقيقة). إعادة تعليق الببتيدات المجففة في حجم مناسب من 0.2٪ حمض الفورميك في الماء.
ملاحظة: يمكن إيقاف البروتوكول مؤقتاً هنا.
6. الحصول على البيانات باستخدام DDA وDIA
ملاحظة: تحليل العينات باستخدام أساليب DDA وDIA LC-MS/MS، والتي يمكن تعديلها اعتمادًا على أداة قياس الطيف الكتلي المتوفرة. هنا، تم تحليل العينات باستخدام نظام HPLC نانو LC 2D إلى جانب مطياف كتلة عالية الدقة.
- استخدام نظام HPLC جنبا إلى جنب مع نظام HPLC منصة القائمة على رقاقة متصلة مباشرة إلى مطياف الكتلة (يمكن أيضا استخدام العديد من تكوينات وأنظمة LC-MS).
- تحليل العينات باستخدام المرحلة العكسية HPLC-ESI-MS/MS
- بعد الحقن، نقل مخاليط الببتيد على رقاقة C18 قبل العمود وإزالة الملح الببتيدات عن طريق الغسيل مع المرحلة المتنقلة A في 2 μL/min لمدة 10 دقيقة. ثم قم بنقل الببتيدات إلى عمود تحليلي وelute بمعدل تدفق 300 nL/min مع تدرج 2-3 ساعة باستخدام المرحلتين المتنقلة A و B. على وجه التحديد، استخدم تدرجًا خطيًا من 5٪ مرحلة متنقلة B إلى 35٪ المرحلة المتنقلة B على مدى 80 دقيقة.
- في وقت لاحق، منحدر المرحلة المتنقلة B إلى 80٪ على 5 دقائق، ثم عقد في 80٪ B لمدة 8 دقائق قبل العودة إلى 5٪ B لإعادة التوازن 25 دقيقة.
- بناء طريقة أداة MS لـ DDA وتحديد تجارب فحص الأدوات التالية
- التجربة 1: فحص السلائف الأيون MS1 من m/z 400-1500 (وقت التراكم 250 مللي ثانية). تعيين عتبة الكثافة لتشغيل MS / MS بمسح لالأيون اتون اتمن التهم 2-5 إلى 200 التهم. تعيين الاستبعاد الديناميكي للايونات السلائف إلى 60 s.
- التجربة 2: فحص الأيون للمنتجات MS/MS مع نطاق مسح MS2 من m/z 100-1,500 (وقت تراكم 100 مللي ثانية لكل فحص أيون 30 منتج لكل دورة). تعيين انتشار الطاقة الاصطدام إلى CES = 5، ثم حدد"وضع فحص أيون المنتج عالية الحساسية".
ملاحظة: ستكتسب طريقة DDA أطياف MS/MS لـ 30 من الأيونات السليفة الأكثر وفرة بعد كل مسح MS1 مسح لكل دورة، وسيكون إجمالي وقت الدورة ~ 3.3 s. سيتم استخدام عمليات الاستحواذ DDA لبناء المكتبات الطيفية كما هو موضح في القسم 7.
- بناء طريقة أداة MS لـ DIA وتحديد تجارب مسح الأداة التالية.
- التجربة 1: إجراء فحص السلائف الأيون MS1 من m/z 400-1,250 (وقت التراكم 250 مللي ثانية).
- التجربة 2: إجراء عمليات مسح لـ MS/MS للحصول على أيون من الـ 64 شريحة SWATH متغيرة مع نطاق مسح MS2 من m/z 100-1,500 (وقت تراكم 45 مللي ثانية لكل فحص أيون 64 منتج لكل دورة). تعيين انتشار الطاقة الاصطدام إلى CES = 10، ثم حدد"وضع فحص أيون المنتج عالية الحساسية".
- استخدم استراتيجية اقتناء DIA/SWATH للنافذة المتغيرة 64 كما وصفها شيلينغ وآخرون22 للحصول على تقدير كمي خالٍ من الملصقات مع إجمالي وقت الدورة البالغ 3.2 ث. باختصار ، في هذا الاستحواذ ، بدلاً من Q1 quadrupole نقل نطاق كتلة ضيقة من خلال خلية الاصطدام ، يتم تمرير نافذة أوسع من عرض النافذة المتغيرة (5-90 م / ض) في خطوات تدريجية على مدى الكتلة الكاملة (m/z 400 -1،250 مع 64 شرائح SWATH ، مع كل وقت تراكم 45 مللي ثانية ، مما أسفر عن وقت دورة من 3.2 ثانية ، والتي تشمل مسح MS1 واحد مع 250 مللي ثانية تراكم الوقت).
ملاحظة: يتم ضبط عرض النافذة المتغير ة وفقًا لتعقيد تيار الأيون MS1 النموذجي الذي تمت ملاحظته ضمن نطاق معين m/z باستخدام خوارزمية حاسبة نافذة متغيرة22 (يتم اختيار النوافذ الأكثر ضيقًا في نطاقات m/z "مشغولة"، ونوافذ واسعة في نطاقات m/z مع عدد قليل من الـتيونات السلائف). على منصات أدوات MS الأخرى، يمكن تنفيذ استراتيجيات نافذة DIA أخرى.
7 - تحليل البيانات
ملاحظة: يجب تغيير بعض إعدادات تحليل البيانات وتفصيلها حسب التجربة المحددة. على سبيل المثال ، تعتمد قاعدة بيانات البروتين (ملف FASTA) المختارة على الأنواع التي تم إعداد العينة منها (هنا ، Musculus). أدناه ، يتم وصف تحليل البيانات لعينات الماوس المخصب للببتيدات الأسيتيل وsuccinylated.
- استخدم محرك بحث قاعدة بيانات MS لتحليل عمليات الاستحواذ على DDA. إنشاء أسلوب محرك بحث قاعدة بيانات على النحو التالي:
- لمعلمات وصف العينة: حدد "تحديد" تحت نوع العينة، حدد "حمض Iodoacetic" تحت "الألكيلات السيستين"، حدد "التربسين"تحت "الهضم" (على افتراض C-الطرفية الانقسام في ليسين وأرجينين)، حدد "TripleTOF 6600" تحت الصك، تحت العوامل الخاصة، والتحقق من تأكيد الاختزال والإثراء Succinylation، وحدد العضلات والعضلات تحت الأنواع.
- لمعلمات معالجة محددة: حدد "التعديلات البيولوجية" تحت التركيز معرف، حدد"SwissProt" تحت قاعدة البيانات، والتحقق من"معرف شامل" تحت جهد البحث، حدد "0.05 (10٪)تحت "عتبة البروتين الكشف عنها"، والتحقق من"تشغيل تحليل معدل اكتشاف كاذبة" تحت "جودة النتائج". حفظ طريقة محرك البحث وتقديم الملفات الخام الطيفية الشامل للمعالجة من قبل محرك البحث قاعدة البيانات باستخدام الأسلوب الذي تم إنشاؤه.
ملاحظة: في عملية تكرارية، تتم إعادة معايرة كافة عمليات مسح MS و MS/MS تلقائيًا بواسطة محرك البحث استنادًا إلى التعليقات التوضيحية الأولية والنتائج.
- انقر على"ملخص الببتيد التصدير"عند الانتهاء من البحث وتصفية جميع نتائج تحديد الببتيد من قبل "عتبة الثقة" من 99 في برنامج جدول البيانات (على سبيل المثال، إكسل؛ معدل اكتشاف زائف [FDR] من 1٪.
- في"ملخص الببتيد"ملف جدول البيانات، تصفية لجميع الببتيدات التي تحتوي على تعليق PTM"acetylation"و "succinylation"في عمود التعديل لتوليد تقرير النتائج لتقديم حصرا الببتيدات المنجل والبروتينات المقابلة لها.
- لبناء مكتبات الطيفية MS / MS لمزيد من معالجة ملف DIA الخام والمزيد من التقدير الكمي النسبي ، افتح برنامج التحليل الكمي DIA. حدد"المكتبة"علامة التبويب ، ثم (في أسفل الصفحة) انقر فوق"إنشاء مكتبة الطيفية"من"محرك البحث قاعدة البيانات"وفتح تقرير محرك البحث في قاعدة البيانات (ملف FDR.xlsx * ) ، الذي تم إنشاؤه تلقائيًا كجزء من عملية البحث في قاعدة بيانات ملف DDA الخام. ثم انقر فوق "التالي" وحدد"مخطط LibrarySettings"و "التالي". حدد"Uniprot_mouse_proteome"كقاعدة بيانات، ثم انقر فوق"التالي"و"goa_mouse"كملف الشرح الجيني (علم الأنطولوجيا). وأخيرا، انقر فوق"إنهاء"،وسيتم إنشاء المكتبة الطيفية.
ملاحظة: سيتم تضمين معلومات حول الببتيدات الأسيتيلة وsuccinylated من ملفات البيانات الخام dDDA، ومسح السلائف أيون من MS1، ومسح الأيون جزء من MS2 في المكتبات الطيفية (وهذا يشمل وقت الاحتفاظ، MS / MS نمط التجزئة، الخ). - استخدام برامج تحليل البروتينات الكمية DIA لإجراء القياس الكمي النسبي لمستويات الأسيتيل والسكسيلينج وإنشاء جداول بيانات من الببتيدات المرشحة التي تحتوي على PTM التي يمكن استخدامها لمزيد من تحليل البيانات.
- لتحليل وقياس PTM التي تحتوي على PTM الببتيدات فتح برنامج التحليل الكمي DIA، استخدم مخطط تحليل القالب. يتوفر مخطط القالب في البرنامج عن طريق تحديد خيار"منظور الإعدادات"| "تحليلDIA"| "PTMs BGS"(إما كبيرة أو متناثرة، اعتمادا على التجربة).
ملاحظة: بدلاً من استخدام قالب تحليل PTM BGS في برنامج التحليل الكمي DIA، يمكن أيضًا إعداد كافة الإعدادات الخاصة بـ PTM يدويًا باتباع هذه الإرشادات: 1) تحت"تحديد"، حدد "تعريب PTM" (قطع الاحتمال = 0.75)؛ 2) في"القياس الكمي"، حدد"تجميع الببتيد طفيفة"| "تسلسل معدلة"; و 3) تحت"ما بعد التحليل"،حدد"تجمع وفرة التفاضلية"| "مجموعةثانوية"(إعدادات القياس الكمي). ستقوم هذه الإعدادات بتنشيط ميزة تعريب PTM بحيث يتم سرد الببتيدات المعدلة كإدخالات فردية ويتم إجراء التحليل التفاضلي على مستوى الببتيد. - لبدء تحليل القياس الكمي، حدد علامة التبويب"خط أنابيب"،ثم انقر فوق "إعداد تحليل DIA من الملف"،، افتح ملفات MS DIA الخام ذات الأهمية للقياس الكمي النسبي. حدد "تعيين المكتبة الطيفية" وحدد المكتبة التي تم بناؤها أعلاه ، انقر فوق"تحميل"| "التالي". حدد "BGS PTMs" مخطط التحليل وانقر فوق "المقبل". حدد قاعدة البيانات المناسبة ملف FASTA"Uniprot_mouse_proteome"| "التالي". تحديد إعداد الشرط ، الذي يعين الشروط المختلفة للعينات ، وانقر فوق"التالي". حدد"goa_mouse"كملف الشرح الجيني (علم الأنطولوجيا) وانقر فوق"التالي". مراجعة نظرة عامة على التحليل (ملخص إعداد التجربة) وتحديد"دليل الإخراج"| "إنهاء". وأخيراً، انقر فوق"تشغيل خط أنابيب"لإجراء التحليل الكمي الخالي من التسمية.
ملاحظة: وحدات إحصائية في برنامج التحليل الكمي DIA تلقائيا إجراء تحليل FDR، وتوليد خرائط الحرارة والأراضي البركانية مقارنة الظروف المختلفة، وتوليد قوائم الببتيدات والبروتينات المحددة والكمية، وتوفير Q-القيم جنبا إلى جنب مع التغييرات أضعاف النسبية مقارنة الظروف المختلفة.
- لتحليل وقياس PTM التي تحتوي على PTM الببتيدات فتح برنامج التحليل الكمي DIA، استخدم مخطط تحليل القالب. يتوفر مخطط القالب في البرنامج عن طريق تحديد خيار"منظور الإعدادات"| "تحليلDIA"| "PTMs BGS"(إما كبيرة أو متناثرة، اعتمادا على التجربة).
- وكبديل لذلك، استخدم برمجيات لإزالة التداخل من مجموعات بيانات DIA لمعالجة البيانات وإجراء التحليل الإحصائي بعد تصدير مناطق الذروة المستخرجة لمواقع الأسيتيل والسكشن.
8. تصور البيانات من الببتيدات المعدلة وتقييم توطين موقع PTM
- لفتح التحليل الكمي DIA التي تم إنشاؤها حدد"تحليل"علامة التبويب متبوعاً "تحميل تجربة برنامج التحليل الكمي" (من تجربة محفوظة فتح *. SNE الملف). انتقل إلى *. SNE النتائج الملف وحدد"فتح".
- في اللوحة اليسرى ، انقر على السهم إلى يسار ملف البيانات الخام الثالث *.wiff من الأعلى لتوسيع وتصور جميع شرائح SWATH 64. انقر على السهم إلى يسار الجزء [428.7-437.3] لتوسيع الجزء المحدد وعرض الببتيدات المعدلة المحددة لهذا النطاق الشامل. انقر على الببتيد المشحون ثلاث ثلاثية KQYGEAFEK [Acetyl] R.
ملاحظة: بشكل افتراضي، تعرض اللوحة العلوية اليمنى عادةً MS2 XIC، وتعرض اللوحة السفلية MS1 Isotope Envelope XIC- في اللوحة العليا، حدد"PTM تعريب المؤامرة". في اللوحة السفلى، حدد"PTM تعريب المؤامرة".
- في مؤامرة توطين PTM ، حدد تسلسل الببتيد العلوي "KQYGEAFEK [Acetyl] R"، مع مجموع نقاط توطين PTM 18.32. انقر على السهم إلى اليسار لتوسيع طريقة العرض وتصور الؤكد والدحض الأيون. انقر على السهم بجانب "تأكيد الأيون" ، ثم حدد أيون "y3 [+42]" لتسليط الضوء على أن أيون معين ، مما يؤكد أن موقع الأسيتيل يقع على K2 من تسلسل الببتيد.
- في PTM تعريب مؤامرة حدد تسلسل الببتيد الثاني "K [Acetyl] QYGEAFEKR" مع مجموع (منخفض جدا) PTM درجة التعريب من 1. انقر على السهم إلى اليسار لتوسيع طريقة العرض وتصور الؤكد والدحض الأيون. انقر على السهم بجانب "تأكيد الأيون" ، ثم على السهم المجاور لـ "تفنيد الأيون" ، ثم حدد بعض الأيونات المجزأة لتصور وتقييم الكروماتوجرام الأيون المستخرج وأطياف MS / MS(الشكل 5).
ملاحظة: تشير نقاط التعريب PTM المعينة والفحص البصري إلى أن ايزومير PTM الصحيح هو KQYGEAFEK [Acetyl] R، في حين لا يوجد أو يوجد دليل أدنى من أجل أي سومر PTM ممكن آخر K [Acetyl]QYGEAFEKR.
النتائج
ويبين الشكل 1 رسم تخطيطي عام لسير العمل، بما في ذلك حصاد الأنسجة من كبد الفأرة، واستخدام 1 ملغ من البروتين لهضم البروتين مع التربسين، واحتضان الببتيدات مع الخرز المتجانس للأجسام المضادة، والحصول على العينات على مرض التصلب العصبي المتعدد، وأخيرا ً إجراء تحليل DIA/SWATH للبيانات باستخدام مختلف حزم برامج البروتيوميات الكمية (الأكاديمية والتجارية).
ويبين الشكل 2ألف كيف أن الجدول الزمني لسير العمل وكميات العينة والبروتين المطلوبة، مقارنة بالأساليب البديلة المستخدمة حالياً في دراسات الإثراء المتعددة الآليات والآليات. يمكن تنفيذ طريقة وعاء واحد في نصف الوقت ومع نصف عدد العينات مثل هذه الطرق البديلة. بالمقارنة مع اثنين من طريقة إثراء PTM واحد، بروتوكول وعاء واحد يتطلب أيضا نصف كمية البروتين.
وقد تبين أن هذا البروتوكول بديل عملي وفعال من حيث التكلفة. ويبين الشكل 2باء أن معامل التباين المتوسط (CV) لمناطق الببتيد المعدلة كان أقل في طريقة الوعاء الواحد منه في عمليات التخصيب أحادية التكلفة وسلسلة PTM. ويبين الشكل 2جيم،دال أنه عند مقارنة أساليب التخصيب PTM ذات الوعاء الواحد ووحيدة التخصيب، لم تكن هناك اختلافات ملحوظة بين الارتباطات بين التحديدات الكمية على مستوى الموقع للتعديلات. وينطبق هذا أيضا على الارتباطات على مستوى الببتيد ومستوى الشظايا. ونفس الملاحظة التي أبديت بالنسبة لجميع الارتباطات الثلاثة عند مقارنة التخصيب أحادي الوعاء والمسلسل. تتوفر جميع البيانات الخام الأساسية لـ MS وصحائف نتائج Excel المعالجة المرتبطة بتقرير حديث من قبل Basisty et al.14 ويمكن تنزيلها من MassIVE (MSV00081906) وProteomeXchange (PXD008640).
بشكل عام ، في حين أن استراتيجيات تخصيب الأجسام المضادة قد تظهر بعض القيود ، مثل انسداد الإيتوب المحتمل أو التحديد المحدود ، فإن الأجسام المضادة المستخدمة في هذه الدراسة هي خليط من المستنسخين الذين تم إنشاؤهم بشكل مستقل وبالتالي توفير نطاقات أوسع من الخصائص.
توثق النتائج التجريبية إمكانية اكتشاف وتقييم الكلام المتبادل PTM. يعرض الشكل 3 بيانات من إثراء ناجح ويوضح مثالًا لببتيد يحتوي على تعديلات acyl متعددة ومختلفة تصور PTM crosstalk. الشكل 3A يظهر الببتيد الذي هو أسيتيل على بقايا الليسين واحد وsuccinylated على الآخر، والشكل 3B يظهر نفس الببتيد succinylated في كل من ليسين. وهذا يدل على أنه يمكن تعديل نفس بقايا الليسين مع كل من مجموعات acylation ، وهناك إمكانية للتحدث المتبادل التي تحدث في هذا الموقع. يعرض الشكل 4 عدد مخلفات الليسين التي تم تحديدها كما هو موضح في الأقسام 7.1-7.3 لتنفيذ كلا التعديلين، مشيراً أيضاً إلى احتمال التحدث المتبادل مع PTM.
كما يوضح الشكل 5 ، فإن معالجة مجموعات بيانات DIA PTM مع برنامج البروتيوميات الكمي يسمح لنا بتحديد أي بقايا الليسين محددة يتم تعديلها. هذا هو مفهوم يعرف باسم موقع التعريب ، وهو خطوة أساسية لأي تحليل لتحديد PTM ممكن. ويعرض الشكل 5 شكلين محتملين من أشكال الايزوما جنبا إلى جنب مع الإيونات المؤكدة والفندية لكل منها التي يمكن تصورها وتقييمها على النحو المبين في الفرعين 8-1-8-3 (الخطوتان 8-3-2 و8-3-3 على وجه التحديد). وبناء على هذه المعلومات، تمكنا من تحديد أي من الايزوالأشكال كان موجودا ً في العينة الأصلية بثقة. يوضح طيف MS/MS من KQYGEAFEKacR المؤكد أن الأيونات y (y2-y5)التي تحتوي على بقايا الأسيتيل ليسين ، والتي تحولت بمقدار 42 م / ز (كتلة الزيادة لمجموعة أسيتيل) ، أكدت بقايا الليسين المحددة في الببتيد الذي تم تعديله.
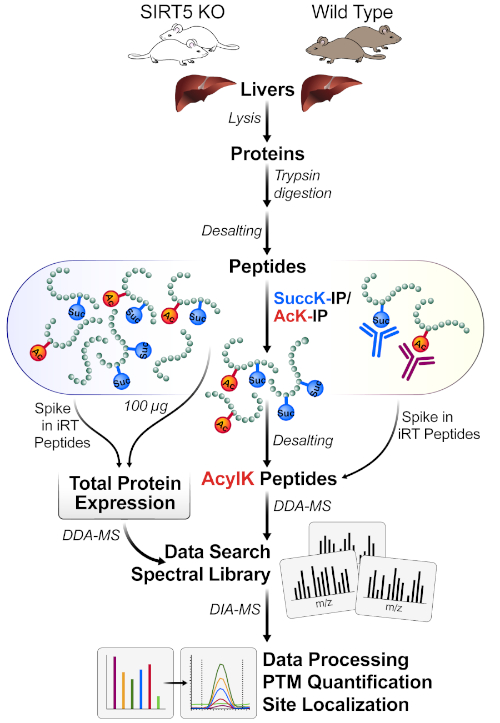
الشكل 1: سير العمل النموذجي لإثراء وعاء واحد من PTMs. يتم حصاد الأنسجة (هنا ، الكبد) من SIRT5 KO والفئران البرية من النوع (WT) ، ويتم تحليل البروتينات ، وهضم التربسين إلى الببتيدات ، وإزالة الملح. ثم يتم إثراء الببتيدات عن طريق التقارب المناعي مع مجموعات من حبات السوتشينيل والأسيتيل الأجسام المضادة. يقيس سير العمل المتوازي MS كلاً من 1) aliquots الصغيرة من التغيرات في التعبير البروتيني الكامل (لتطبيع البروتين) و2) الببتيدات المحتوية على الأسيل لتحديد موقع acylation (DDA-MS) وتوطين الموقع، تليها القياس الكمي (DIA-MS). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
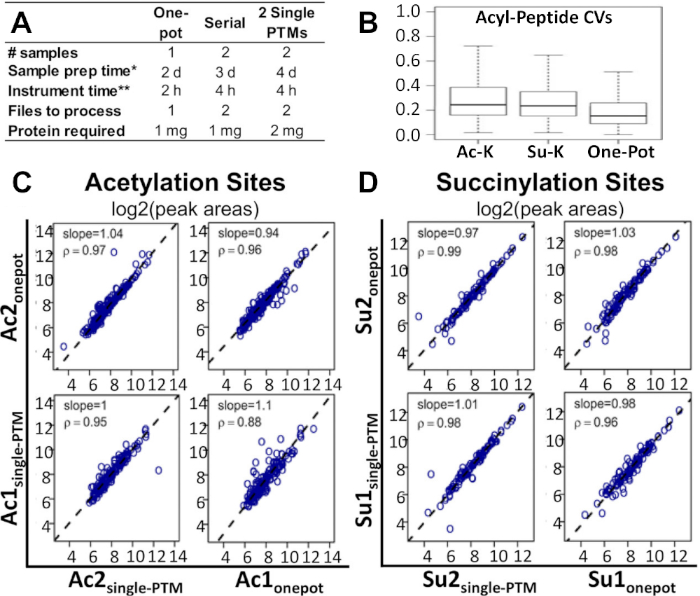
الشكل 2: مقارنة سير العمل ذو الوعاء الواحد مع الأساليب البديلة. (أ)مقارنة الوقت والتكاليف والمواد اللازمة لسير العمل ذي الوعاء الواحد، والإثراء التسلسلي لـ PTM، واثنين من عمليات التخصيب أحادية التكلفة. (ب)مقارنة السير الذاتية بين سير العمل واحد وعاء، واحد أسيتيل ليسين PTM الإثراء، وواحد succinyl-lysine PTM الإثراء. تحليل ارتباط سبيرمان مقارنة المناطق ذروة الببتيد acyl التي تم الحصول عليها من سير العمل وعاء واحد، وإثراء PTM واحد: المؤامرات المقابلة لنتائج منطقة الذروة log2 لمواقع(C)أسيتيل و(D)مواقع succinylation. ويشار إلى منحدرات الانحدار وعوامل الارتباط في الألواح الفردية14. وتمت معالجة اثنين من اليكررات البيولوجية المستقلة لكل من الشروط. وقد تم تعديل هذا الرقم من Basisty وآخرون14. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
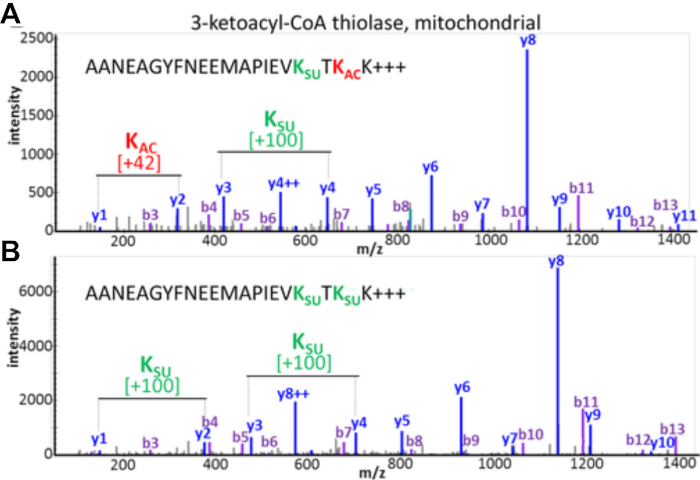
الشكل 3: التحادث المتبادل بين التعديلات الاسيتلاب والسكسينيل من بقايا الليسين. أطياف MS / MS من الببتيدات التربيك من الميتوكوندريا 3-ketoacyl-CoA thiolase التي تظهر نفس تسلسل الأحماض الأمينية ولكن تم تعديلها في اثنين من بقايا الليسين مع PTMs مختلفة. (A)MS / MS من الببتيد AANAGyfNEEMAPيفKsuccT KacK و (B)MS / MS من الببتيد AANAGYFNEEMAPIEVKsuccTKsuccK. وقد تم تعديل هذا الرقم من Basisty وآخرون14. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
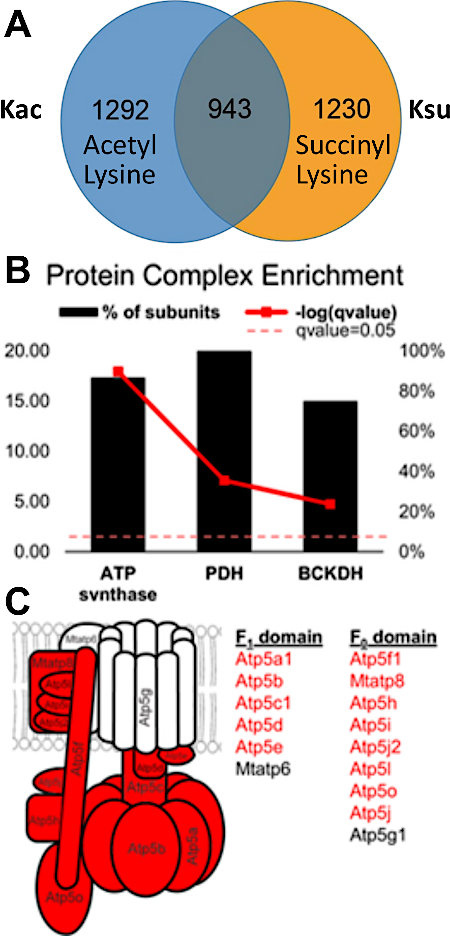
الشكل 4: التداخل والكلام المتبادل بين بقايا الليسين الأسيتيل وsuccinylated - أمثلة محددة في مجمعات البروتين. (A)مخطط فين عرض التداخل بين 2,235 أسيتيل و 2,173 مواقع succinylation. ومن بين هذه المواقع، كان هناك 943 موقعا ً مُسِلة ومُستشِفة على حد سواء. تم تحليل الكبد من SIRT5 (دي succinylase) الماوس بالضربة القاضية، وتم تحديد العديد من مواقع الستشينيليشن. في الواقع ، كانت أكثر وفرة مما لوحظ عادة في كبد الماوس (تمت تصفية الببتيدات المعدلة بقيمة Q قدرها < 0.05). (ب)مجمعات البروتين التي تبين النسبة المئوية لوحداتها الفرعية التي تحتوي على مواقع الأسيتيل والمستهين (الخط الأحمر الجريء يمثل الأهمية كما يحددها اختبار فيشر الدقيق). (C)رسم تخطيطي لمجمع ATP synthase: وحدات البروتين الفرعية باللون الأحمر تصور الوحدات الفرعية التي تحتوي على كل من المواقع الأسيتيلة والمستوفية. وقد تم تعديل هذا الرقم من Basisty وآخرون14. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
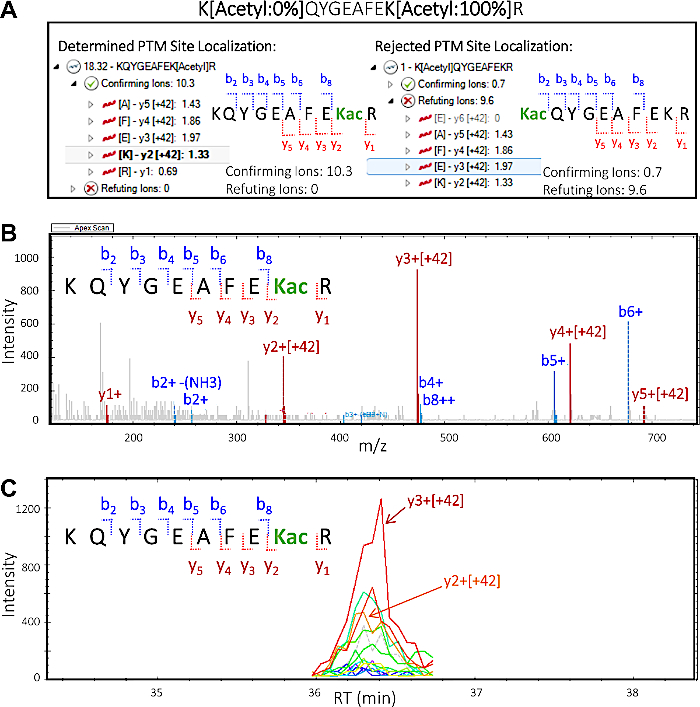
الشكل 5: برنامج البروتيوميات الكمي يفك شفرة توطين موقع الببتيد من PTMs. بناءعلى MS / MS تجزئة الببتيد، فمن الممكن لتوفير معلومات حول بقايا الليسين محددة مجموعة أسيتيل هو تعديل. هذا يعرض قدرة البرنامج على تقديم معلومات قيمة عن موقع توطين PTMs.(A)احتمالين لتعديل بقايا الليسين وتوطين موقع PTM: KQYGEAFEKacR (يسار) وKacQYGEAFEKR (يمين). يتم عرض "تأكيد" و "دحض" الأيونات جزء لكل من isoforms موقع التعريب المحتملة من الببتيد. وبناء على هذه المعلومات، يتم تعيين تأكيد الدرجات ودحض الدرجات، مما يؤكد وجود شهادة KQYGEAFEKacR في العينة. (ب)طيف MS/MS المطابق لمعيار الايزوفورم المؤكد KQYGEAFEKacR الذي يشير إلى أن جميع الأيونات y بما في ذلك بقايا الأسيتيل ليسين (y2 وأعلى) تحمل كتلة زيادة قدرها +42 م/ز، وهو ما يتوافق مع تعديل الأسيتيل. لا تحتوي الأيونات الملاحظة ب على التعديل. (C)استخراج الكروماتوغرام أيون (XIC) مع مناطق الذروة وفيرة الناتجة عن y2 و y3 الأيونات، وكلاهما تشكل موقع أسيتيل في وأكد isoform KQYGEAFEKacR. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يصف هذا البروتوكول تقنية جديدة لإثراء PTM متعددة في وقت واحد لفهم ptm عبر talk. الطرق البديلة للوصول إلى هذا الهدف تميل إلى أن تكون باهظة تستغرق وقتا طويلا ومكلفة، وأنها تتطلب كميات كبيرة من البروتين لتكون ناجحة11،13. يقدم هذا البروتوكول سير عمل تخصيب متعدد PTM يتضمن احتضان الخرز المترافق مع الأجسام المضادة لاثنتين من أجهزة منع الPTM في وقت واحد لتحسين الكفاءة الإجمالية للتجربة. تتضمن هذه الطريقة أيضًا استخدام DDA لتوليد المكتبة الطيفية ومقتنيات DIA MS للكشف عن الببتيدات الموجودة مع التداخل المخفض من الأيونات المجزأة22و23. وتستخدم برامج حاسوبية، مثل محركات البحث في قاعدة بيانات الماجستير لتحليل البيانات من عمليات الشراء DDA وقياسها، في حين أن برنامج البروتيوميات الكمي24 وبرنامج التحليل الكمي المحددة DIA25 ضروريان لتفسير الأطياف المعقدة التي تنتجها عمليات الاستحواذ على DIA.
هناك العديد من الخطوات الهامة في هذا البروتوكول التي ينبغي اتباعها بعناية. وبما أن الهدف الرئيسي للبروتوكول هو الإثراء لـ PTMs متعددة في وقت واحد ، فإن خطوة تخصيب الأجسام المضادة (القسم 2) أمر بالغ الأهمية لنجاح التجربة. عند أداء غسل على الخرز، فمن الضروري لضمان أي من الخرز يتم استنشاقها بطريق الخطأ. ضمان تركيز اليوريا قد تم تخفيفها إلى 1 M قبل الهضم مع التربسين (الخطوة 1.8) هو ضروري أيضا. على الرغم من أن مطلوب 8 M اليوريا في وقت سابق في البروتوكول لذوبان البروتين, تركيزات اليوريا فوق 1 M سوف تمنع النشاط الأنزيمي التربسين. بالإضافة إلى ذلك ، من المهم التحقق باستمرار من درجة الحموضة للعينة في جميع أنحاء البروتوكول. هذا مهم بشكل خاص قبل الهضم. إذا لم يتم تحييد درجة الحموضة للعينة ومحلول التربسين بشكل مناسب قبل الحضانة ، فقد يؤدي ذلك إلى عملية هضم غير فعالة حيث قد يتم تفويت العديد من مواقع الانقسام ، مما يؤدي إلى تحديد عدد أقل من الببتيد.
قد تكون بعض التعديلات على البروتوكول مفيدة عند إعداد العينات. للحصول على بروتين ليسات تم شراؤها من 1 ملغ من المواد الأولية ، يمكن استخدام ربع حبات الأجسام المضادة المتوفرة في كل أنبوب فحص PTM كبديل فعال من حيث التكلفة. يمكن استخدام كمية أكبر من مواد البدء للحصول على نتائج أفضل ، طالما يتم زيادة كمية حبات الأجسام المضادة المستخدمة بشكل متناسب. تعديل آخر يمكن أن تعزز سير العمل هو هضم عينات مع بروتياز آخر بالإضافة إلى التربسين. ومن شأن هذا التعديل أن يؤدي إلى مزيد من التباين في الببتيدات المتشبثة، مما يوفر تغطية متزايدة لمخلفات البروتين. على الرغم من أنه ليس من الضروري ، فمن المستحسن أن يكون التربسين أحد الإنزيمات المستخدمة لتحليل PTM بسبب خصوصيته العالية في الانقسام26.
ومن القيود المفروضة على هذا البروتوكول أن الآليات التي تجري دراستها تحتاج إلى كيمياء مماثلة لكي يتم إثراؤها في وقت واحد14. يجب أن تكون إجراءات الخرز المختلف للأجسام المضادة المترافقة متشابهة ، باستخدام مذيبات وحلول مماثلة ، بما في ذلك ظروف elution مماثلة ، ويفضل أن يكون من نفس البائع. لهذا السبب، تستخدم الطريقة الموضحة هنا باستمرار الأسيتيل والسكسينيل كمثال، وكلاهما يستخدم الخرز المتجانس بالأجسام المضادة (تكنولوجيا الإشارات الخلوية، وشركة). وعلى الرغم من أن هذه الطريقة يمكن تطبيقها نظرياً على أي عدد من آليات منع التجارة، فإن الأمر يحتاج إلى دراسات إضافية لتقييم القيد الدقيق للبروتوكول في هذا الصدد. وعلاوة على ذلك، وبما أن هذه طريقة تخصيب الأجسام المضادة، فإن هذه الطريقة لا يمكن أن توفر سوى تقدير كمي نسبي لمواقع الـ PTM.
وبالمقارنة مع أساليب الإثراء القائمة المتعددة الآليات، فإن سير العمل هذا هو بديل أكثر جدوى وفعالية من حيث التكلفة. من هذه التجربة، لوحظ أن فعالية هذه الطريقة تقارن بشكل جيد للغاية مع الأساليب البديلة، مثل الإثراء الفردي أو التسلسلي. ويبين الشكل 2باء أن السيرة الذاتية المتوسطة لمناطق ذروة الببتيد المعدلة قد انخفضت بالفعل في طريقة الوعاء الواحد بالمقارنة مع عمليات الإثراء أحادية الـ PTM والإثراءات المتسلسلة - PTM13. كما قمنا بتحليل النتائج التجريبية التي تقيّم التميّز الكمي على مستوى الموقع للتكيس أو السكّين. بالإضافة إلى ذلك، أظهر تحليل ارتباط سبيرمان(الشكل 2C,D)أن تخصيب PTM أحادي الوعاء كان يؤدي نفس الأداء لسير عمل الإثراء أحادي ة الـ PTM. وينطبق هذا أيضا على الارتباطات على مستوى الببتيد وشظية المستوى. ونفس الملاحظة التي أبديت بالنسبة لجميع الارتباطات الثلاثة عند مقارنة وعاء واحد مع الإثراء التسلسلي لـ PTM.
يسمح هذا البروتوكول للباحثين بإنشاء رؤى بيولوجية رائعة في الحديث المتبادل PTM بطريقة سريعة وفعالة من حيث التكلفة. يسمح عنصر DIA في سير العمل للباحثين بفهم المزيد عن PTMs ، لأنه يوفر معلومات حول توطين الموقع ويتغلب على التحديات مثل انخفاض إشغال موقع PTMs. تميل الإصدارات السلائف إلى الاستبعاد مع DDA ، وهو أمر مهم بشكل خاص عند دراسة PTMs ، حيث أن إشغال الموقع غالبًا ما يكون منخفضًا لدرجة أن هذه الببتيدات لا يتم اختيارها لـ MS / MS ولكنها لا تزال تحتوي على معلومات حاسمة. ويمكن إجراء تجارب متابعة لتقييم الحد الأعلى لعدد الآليات التي يمكن إثراؤها في وقت واحد باستخدام هذه الطريقة. وقد يشمل التحسين المستقبلي لسير العمل هذا تطوير منصات برمجية أكثر تقدماً لزيادة أتمتة تحليل تعريب الموقع وإشغال موقع PTM.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
نحن نعترف بالدعم المقدم من منحة الأجهزة المشتركة في المعاهد القومية للصحة لنظام TripleTOF في معهد باك (1S10 OD016281). كما تم دعم هذا العمل من قبل المعهد الوطني للحساسية والأمراض المعدية (R01 AI108255 إلى B.S.) والمعهد الوطني للسكري وأمراض الجهاز الهضمي والكلى (R24 DK085610 إلى إريك فردين. R01 DK090242 إلى اريك جوتزمان). تم دعم X.X. بمنحة من المعاهد الوطنية للصحة (منحة المعاهد القومية للصحة T32GM8806 ، إلى جوديث كامبيسي وليزا إليربي) ، تم دعم N.B. من خلال زمالة ما بعد الدكتوراه من مؤسسة جلين للأبحاث الطبية.
Materials
| Name | Company | Catalog Number | Comments |
| 1 M Triethylammonium biocarbonate buffer (TEAB) | Sigma Aldrich, St. Louis, MO, USA | T7408 | |
| Acetonitrile, Burdick and Jackson LC-MS grade | Burdick and Jackson, Muskegon, MI, USA | 36XL66 | |
| Bioruptor sonicator | Diagenode, Denville, NJ, USA | B01020001 | |
| C18 pre-column chip (200 µm x 6 mm ChromXP C18-CL chip, 3 um, 120 A) | SCIEX, Framingham, MA, USA | 5015841 | |
| C18-CL chip (75 µm x 15 cm ChromXP, 3 µm, 300 Å) | SCIEX, Framingham, MA, USA | 804-00001 | |
| Dithiothreitol (DTT) | Sigma Aldrich, St. Louis, MO, USA | D9779-5G | |
| Eppendorf Thermomixer Compact | Eppendorf AG, Hamburg, Germany | T1317-1EA | |
| Eppendorf Tube (2.0 mL Safelock) | Eppendorf AG, Hamburg, Germany | 22363352 | |
| Formic acid | Sigma Aldrich, St. Louis, MO, USA | F0507-500ML | |
| Indexed retention time (iRT) normalization peptide standard | Biognosys AG, Schlieren, Zurich, Switzerland | Ki-3002-2 | |
| Iodoacetamide (IAA) | Sigma Aldrich, St. Louis, MO, USA | I1149-25G | |
| mapDIA | web link | software for interference removal of DIA datasets | |
| Methanol, Burdick and Jackson LC-MS grade | Burdick and Jackson, Muskegon, MI, USA | BJLC230-4 | |
| PURELAB flex 1 ultrapure water dispenser | VWR International, Radnor, PA, USA | 89204-088 | |
| mProphet in Skyline | incorporated in Skyline | integrated statistical algorithms for FDR assessments | |
| Oasis HLB SPE cartridges | Waters Corp., Milford, MA, USA | WAT094225 | cartridges for desalting protein lysates, up to 50 mg material |
| Phosphate buffered saline solution | Life Technologies | 10010023 | |
| Pierce BCA Assay | Thermo Fisher Scientific, Waltham, MA, USA | 23225 | |
| ProteinPilot 5.0 - 'MS database search engine' | SCIEX, Framingham, MA, USA | software download SCIEX | MS database search engine |
| PTMScan Succinyl-Lysine Motif [Succ-K] Kit #13764 | Cell Signaling Technology | 13764 | antibody beads for affinity enrichment |
| PTMScan Acetyl-Lysine Motif [Ac-K] Kit #13416 | Cell Signaling Technology | 13416 | antibody beads for affinity enrichment |
| Sequencing-grade lyophilized trypsin | Life Technologies | 23225 | |
| Skyline - 'Quantitative Proteomics Software' | MacCoss lab (academic) | open source software | Quantitative Proteomics Software (academic) |
| Spectronaut - 'DIA Quantitative Analysis Software' | Biognosys AG, Schlieren, Zurich, Switzerland | Sw-3001 | DIA Quantitative Analysis Software / PTM site localization |
| Thermo Scientific Savant SPD131DDA Speedvac Concentrator | Thermo Fisher Scientific, Waltham, MA, USA | SPD131DDA-115 | instrument to concentrate liquid volume of samples |
| TissueLyser II | Qiagen, Hilden, Germany | 85300 | instrument for efficient lysis of tissue |
| Trifluoroacetic acid (TFA) | Sigma Aldrich, St. Louis, MO, USA | T6508-1L | |
| TripleTOF 6600: orthoganol quadrupole time-of-flight (QqTOF)mass spectrometer | SCIEX, Framingham, MA, USA | Per quote | high resolution mass spectrometer |
| Ultra Plus nano-LC 2D HPLC system | SCIEX, Eksigent Division, Framingham, MA, USA | Model #845 | chromatographic separation system |
| Urea | Thermo Fisher Scientific, Waltham, MA, USA | PI29700 | |
| Water, Burdick and Jackson LC-MS | Burdick and Jackson, Muskegon, MI, USA | 600-30-76 | |
| ZipTip C18 Pipette Tips, P10 | Merck Millipore Ltd, Tullagreen, Carrigtwohill, Co. Cork, IRL | ZTC18S096 | C-18 resin loaded tips for desalting of peptide mixtures |
References
- Christensen, D. G., et al. Post-translational Protein Acetylation: An Elegant Mechanism for Bacteria to Dynamically Regulate Metabolic Functions. Frontiers in Microbiology. 10, 1604 (2019).
- Deribe, Y. L., Pawson, T., Dikic, I. Post-translational modifications in signal integration. Nature Structural Molecular Biology. 17 (6), 666-672 (2010).
- Sadoul, K., Boyault, C., Pabion, M., Khochbin, S. Regulation of protein turnover by acetyltransferases and deacetylases. Biochimie. 90 (2), 306-312 (2008).
- Swaney, D. L., et al. Global analysis of phosphorylation and ubiquitylation cross-talk in protein degradation. Nature Methods. 10 (7), 676-682 (2013).
- Cohen, P. The regulation of protein function by multisite phosphorylation--a 25 year update. Trends in Biochemical Sciences. 25 (12), 596-601 (2000).
- Grunstein, M. Histone acetylation in chromatin structure and transcription. Nature. 389 (6649), 349-352 (1997).
- Struhl, K. Histone acetylation and transcriptional regulatory mechanisms. Genes and Development. 12 (5), 599-606 (1998).
- Mocciaro, A., Rape, M. Emerging regulatory mechanisms in ubiquitin-dependent cell cycle control. Journal of Cell Sciences. 125 (Pt 2), 255-263 (2012).
- Lopez-Otin, C., Hunter, T. The regulatory crosstalk between kinases and proteases in cancer. Nature Reviews in Cancer. 10 (4), 278-292 (2010).
- Du, Z., et al. DNMT1 stability is regulated by proteins coordinating deubiquitination and acetylation-driven ubiquitination. Science Signalling. 3 (146), (2010).
- McManus, F. P., Lamoliatte, F., Thibault, P. Identification of cross talk between SUMOylation and ubiquitylation using a sequential peptide immunopurification approach. Nature Protocols. 12 (11), 2342-2358 (2017).
- Venne, A. S., Kollipara, L., Zahedi, R. P. The next level of complexity: crosstalk of posttranslational modifications. Proteomics. 14 (4-5), 513-524 (2014).
- Mertins, P., et al. Integrated proteomic analysis of post-translational modifications by serial enrichment. Nature Methods. 10 (7), 634-637 (2013).
- Basisty, N., Meyer, J. G., Wei, L., Gibson, B. W., Schilling, B. Simultaneous Quantification of the Acetylome and Succinylome by 'One-Pot' Affinity Enrichment. Proteomics. 18 (17), e1800123 (2018).
- Wang, G., et al. Regulation of UCP1 and Mitochondrial Metabolism in Brown Adipose Tissue by Reversible Succinylation. Molecular Cell. 74 (4), 844-857 (2019).
- Verdin, E., Ott, M. 50 years of protein acetylation: from gene regulation to epigenetics, metabolism and beyond. Nature Reviews Molecular Cell Biology. 16 (4), 258-264 (2015).
- Rardin, M. J., et al. Label-free quantitative proteomics of the lysine acetylome in mitochondria identifies substrates of SIRT3 in metabolic pathways. Proceedings of the National Academy of Science U. S. A. 110 (16), 6601-6606 (2013).
- Rardin, M. J., et al. SIRT5 regulates the mitochondrial lysine succinylome and metabolic networks. Cell Metabolism. 18 (6), 920-933 (2013).
- Carrico, C., Meyer, J. G., He, W., Gibson, B. W., Verdin, E. The Mitochondrial Acylome Emerges: Proteomics, Regulation by Sirtuins, and Metabolic and Disease Implications. Cell Metabolism. 27 (3), 497-512 (2018).
- Sadhukhan, S., et al. Metabolomics-assisted proteomics identifies succinylation and SIRT5 as important regulators of cardiac function. Proceedings of the National Academy of Science U. S. A. 113 (16), 4320-4325 (2016).
- Collins, B. C., et al. Multi-laboratory assessment of reproducibility, qualitative and quantitative performance of SWATH-mass spectrometry. Nature Communications. 8 (1), 291 (2017).
- Schilling, B., Gibson, B. W., Hunter, C. L. Generation of High-Quality SWATH((R)) Acquisition Data for Label-free Quantitative Proteomics Studies Using TripleTOF((R)) Mass Spectrometers. Methods in Molecular Biology. 1550, 223-233 (2017).
- Meyer, J. G., Schilling, B. Clinical applications of quantitative proteomics using targeted and untargeted data-independent acquisition techniques. Expert Reviews in Proteomics. 14 (5), 419-429 (2017).
- MacLean, B., et al. Skyline: an open source document editor for creating and analyzing targeted proteomics experiments. Bioinformatics. 26 (7), 966-968 (2010).
- Sticker, A., Martens, L., Clement, L. Mass spectrometrists should search for all peptides, but assess only the ones they care about. Nature Methods. 14 (7), 643-644 (2017).
- Olsen, J. V., Ong, S. E., Mann, M. Trypsin cleaves exclusively C-terminal to arginine and lysine residues. Molecular Cell Proteomics. 3 (6), 608-614 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved