Method Article
정량화 및 사이트 현지화를 위한 두 가지 번역 후 수정의 동시 선호도 강화
요약
이 워크플로우에서는 정량적 글로벌 프로테오믹스 분석을 위해 동시에 여러 단백질 번역 후 변형(PTM)의 시간 및 비용 효율적인 농축 성능을 설명합니다. 이 프로토콜은 여러 개의 공액 항체를 사용한 펩타이드 수준 PTM 농축을 활용한 다음 데이터 독립적 수집 질량 분석 분석을 통해 PTM 누토크에 대한 생물학적 통찰력을 얻습니다.
초록
단백질의 여러 번역 후 수정 (PTM)을 공부하는 것은 PTM 누화를 이해하고 단백질 기능에 대한 보다 전체적인 통찰력을 얻는 중요한 단계입니다. 다중 PTM 농축 연구의 중요성에도 불구하고, PTM의 여러 글로벌 단백질 분석을 수행하는 데 필요한 비용, 시간 및 대량 단백질 수량으로 인해 한 번에 하나 이상의 PTM을 조사하는 연구는 거의 없습니다. 이 프로토콜에 자세히 설명된 "원 포트" 선호도 농축은 적은 양의 시료를 함유하는 리신 잔류물을 함유하는 펩티드의 동시 식별 및 정량화를 허용함으로써 이러한 장벽을 극복합니다. 입력. 이 프로토콜은 SIRT5 녹아웃 마우스의 마우스 간에서 단백질 용해물 의 준비, 트립신 소화의 성능, PTM에 대한 농축, 데이터 독립적 인 수집 (DIA) 워크플로우를 사용하여 질량 분광 분석의 성능을 포함한다. 이 워크플로우를 통해 동일한 샘플에서 두 개의 PTM을 동시에 보강할 수 있으므로 많은 양의 샘플없이 PTM 누화를 연구할 수 있는 실용적인 도구를 제공하며 샘플 준비, 데이터 처리에 필요한 시간을 크게 줄일 수 있습니다. 인수 및 분석. 워크플로의 DIA 구성 요소는 포괄적인 PTM 관련 정보를 제공합니다. DIA는 서로 다른 PTM 지역화 이소폼을 구별하기 위해 계산적으로 해독할 수 있는 포괄적인 조각 이온 세트를 제공하기 때문에 PTM 사이트 지역화를 연구할 때 특히 중요합니다.
서문
번역 후 변형의 무수한 동적으로 활성에 대한 효과를 통해 단백질과 경로를 조절1,신호2,회전율3,4. 예를 들어, 단백질 키나아제는 인산염기5의첨가에 의해 활성화 또는 비활성화되고, 히스톤 아세틸화 및 기타 변형은 염색질 구조를 변화시키고 전사 조절메커니즘으로작용하는 메커니즘을 제공한다6,7. 최근 몇 년 동안, 증거는 여러 PTM이 콘서트에서 작동하거나 단백질 기능 또는활성을조절하기 위해 경쟁8,9,10,11탑재하고있다. 따라서 PTM 크로스토크를 이해하는 것은 PTM 연구에서 새로운 필요성입니다. 그러나 PTM 사이트를 식별하고 정량화하는 대부분의 proteomic 워크플로는 여러 수정의 상호 작용이 아니라 단일 수정에 중점을 둡니다. 기재된 워크플로우는 다중 상이한 PTM에 의해 수정되는 특정 단백질 변형 "핫스팟" 및 라이신 잔류물의 상관관계를 나타냅니다.
여러 PTM을 동시에 연구하는 실행 가능한 방법에 대한 과학계의 필요성이 증가하고있습니다 12. 전 세계적으로 PTM의 여러 유형의 사이트를 식별하고 정량화하는 대부분의 방법은12,13에필요한 조직의 높은 비용과 양으로 인해 도전적이다. 다중 PTM 농축 실험은 시료 전처리, 데이터 수집 및 데이터 분석 측면에서 시간이 많이 소요될 뿐만 아니라, 이러한 연구는 전형적으로 크고 종종 금지되는 양의 단백질11을필요로 한다. 여기에 설명된 프로토콜은 여러 PTM의 동시 보강 및 분석을 위한 프로토콜로, 이러한 여러 장벽을 해결하고 다양한 PTM14간의 대규모 PTM 프로파일링 및 평가를 가능하게 합니다. 이 한 냄비 워크플로우는 생물 의학 연구원이 전 세계적으로 여러 PTM을 프로파일화하고, 공동 변형 된 펩티드를 식별하고, 효율적이고 비용 효율적인 방법으로 PTM 누토크를 연구할 수있는 실용적인 방법을설명합니다 14,15.
여기에서, 이 방법은 50 년 전에16년 이상 처음으로 공부된 미토콘드리아 단백질 acylation를 검토하여 전시됩니다. 특히 리신아세틸화(17) 및 간시닐레이션(18)에 집중하며, 단백질에 대한 이러한 변형의 공동 발생을 포함하고 펩티드 수준에서도 공동 변형한다. 이 연구는 sirtuin 5 (SIRT5) 녹아웃 마우스 모델을 사용하기 때문에, 아세틸화 및 침전 부위의 농축에 초점을 맞추기 위해 선택되었다. 이 결정은 succinylation 사이트가 SIRT5 desuccinylase의 표적이기 때문에 이렇게 KO 마우스에 있는 중요한 upregulation를 보여주기 위하여 예상되기 때문에, 그(것)들을 이 경우에 가장 관련성 이 PTM 만들기. 두 PTM은 최근 Carrico et al.19에의해 요약된 바와 같이 생물학적으로 관련이 있습니다. 일반적으로, 아세틸화는 유전자 발현 및 대사에 중요한 효과를 나타내며, 간결화는 심장 대사 및 기능20을조절하는 것으로 보고되었다.
기재된 프로토콜은 적은 양의 단백질 입력 물질(예를 들어, 1 mg의 단백질 용해)으로 수행될 수 있으며 샘플 처리, MS 수집 및 데이터 분석에 소요되는 시간을 감소시킴으로써 실험의 총 기간을 감소시킨다. 워크플로는 그림 1에제공됩니다. 우리는 또한 더 낮은 양의 시작 물질을 사용했습니다 (단백질 용해액의 100 μg까지, 그에 따라 사용되는 비드의 양을 축소), 이는 예상대로, 확인 된 아실화 펩티드의 전반적인 수율을 감소; 그러나, 그것은 여전히 매우 가치있는 결과와 정량화 된 수화물 펩티드를 제공합니다.
소위 하향식 또는 중간 하향 식 워크플로우는 일반적으로 단백질 분해 소화 접근법을 사용하지 않지만 (따라서 하나의 단백질 내에서 여러 PTM의 연결을 유지), 이 프로토콜은 PTM 식별 및 정량화를위한 추가 깊이와 감도를 얻기 위해 펩티드 기반 친화 강화 접근 방식에 초점을 맞추고 있습니다(그림 1). 또한, 이 펩타이드 중심 워크플로우는 1) 스펙트럼 라이브러리를 생성하기 위한 데이터 의존적 수집(DDA) 및 2) 데이터 독립적 수집(DIA)을 포함한 최신 질량 분석 방법을 활용하여 라벨 없는 워크플로우에서 정확한 PTM 정량화를 제공합니다.
DIA 워크플로우는 샘플링된 m/z 범위21내의 모든 펩티드 신호를 포괄적으로 단편화하여 일반적인 DDA 스캔 방식의 샘플링 스토시시티를 극복합니다. 이 기능은 또한 펩티드 내에서 변형되는 특정 단편 이온에 관한 정보를 얻는 것이 더 쉽기 때문에 사이트 국소화 측면에서 매우 유용합니다. 또한 DIA 워크플로우를 통해 동일한 전구체 이온을 가진 경미한 PTM-펩타이드 이소폼을 식별하고 정량화할 수 있습니다. DIA 방법은 또한 항상 포괄적으로 측정되는 특정 상응하는 단편 이온에 기초하여 펩티드 내의 특정 PTM 부위 국소화를 결정할 수 있다. 그러나 DDA 접근 방식은 종종 동일한 전구체 이온에 대해 MS/MS의 다중 샘플링을 제외하는 "동적 배제" 기능을 사용하므로 사소한 PTM 이소폼이 누락됩니다.
여기에 설명된 동시 보강 전략은 여러 PTM의 글로벌 프로파일링 및 정량화, PTM 누화 검사, 번역 후 수정의 동적 상호 작용 이해의 이점을 제공하는 연구에 이상적입니다. 하나의 결합된 워크플로우에서 다중 농축 PTM의 식별은 단백질화 펩타이드를 함유하는 PTM의 글로벌, 직렬 또는 병렬 농축, 또는 본래 단백질의 분석에 의해 대체로 설명되었습니다. 아세틸화 및 간화의 연속 농축과 직접 비교하여, 원팟 방법론의 효율은 매우 유사한 것으로 확립되었다14. 이러한 대체 프로토콜은 상당한 양의 시작 재료와 시간이 필요하며 엄청나게 비쌀 수 있습니다. 대조적으로, 원팟 프로토콜은 후속 분석 및 식별을 통해 하나 이상의 PTM을 농축하는 저렴하고 효율적인 방법을 제공한다.
마우스 간 조직은 SIRT5 녹아웃 마우스로부터 수득되고 여기에서 시작 물질로서 사용된다. 이 프로토콜은 또한 상이한 조직 또는 세포 배양 실험으로부터단백질 용해를 위해 수행될 수 있다. 이 프로토콜은 조직 또는 세포 배양 펠릿으로부터 수득된 단백질 리세이트에 적용될 수 있다.
프로토콜
프로토콜에 설명 된 모든 실험벅 연구소 기관 동물 연구위원회의 지침을 따릅니다.
1. 균질화 된 조직에서 단백질 추출 및 프로테아제소화
- 용해 완충액을 8M 우레아, 50 mM 트리에틸암모늄 중탄산염(TEAB), 1 μM 트리코스타틴 A(TSA), 20 mM 니코틴아미드, 75 mM 염화나트륨(NaCl), 1x 프로테아제/인산화 효소 억제제 칵테일(PIC)의 최종 농도로 신선하게 준비한다.
- 비드 밀 균질화와 호환되는 2 mL 튜브에 멸균 강철 비드 1개를 추가한 다음 티슈 조각(완두콩 크기)을 튜브에 넣습니다. 완충제 (500 μL)와 와류를 잠시 추가하여 버퍼가 조직 조각을 덮도록합니다 (필요한 경우 더 많은 lysis 버퍼를 추가하십시오). 미리 냉각된 어댑터 세트에 튜브를 놓아 균질화기의 두 어댑터 간에 튜브가 균형을 이루도록 합니다.
- 4 °C에서 각각 3 분 동안 25 Hz에서 2x 샘플을 균질화합니다. 조직이 완전히 균질화되지 않은 경우, 튜브를 짧게 회전시키고 균질화된 분해물들을 새로 표지된 1.5 mL 튜브로 옮김을 옮김을 옮김으로 옮김을 옮김을 옮김을 옮김을 옮김으로 옮김을 옮김을 옮김으로 옮기십시오. 이어서, 나머지 조직 조각에 용해 완충액을 추가하고, 각각 3분 동안 25Hz에서 균질화를 2x 반복한다. 균질화의 두 라운드는 전형적으로 조직을 분해하기에 충분하다.
- 핀처가 달린 금속 비드를 제거합니다. 각 샘플 사이에 트위저를 HPLC 등급의 물, HPLC 등급 메탄올 및 HPLC 등급의 물로 다시 헹구십시오.
- 균질화 된 용해액을 결합하여 두 번의 균질화가 적용된 경우 샘플을 초음파 처리하여 30 s on /30s off 및 4 °C에서 10 사이클 동안 초음파 처리하십시오.
- 원심분리기는 용해액을 제거하기 위해 4°C에서 10분 동안 14,000 x g에서 용해된다. 상층부(제거된 리세이트)를 새로운 1.5 mL 마이크로원심분리기 튜브로 옮기고, 상층부 와 튜브 바닥의 파편 위에 앉을 수 있는 지방층을 피하십시오.
- 비신코닌산(BCA) 분석법을 수행하여 적절한 희석으로 제거된 용해물의 단백질 농도를 측정합니다(예를 들어, 1:20 및/또는 1:200). BCA 결과에 따르면, 각 샘플에서 단백질 1 mg을 aliquot.
- 37°C에서 4.5 mM 디티오트레이톨(DTT)으로 단백질을 1,400rpm에서 교반하여 30분 동안 줄입니다. 이어서, 10 mM 의 알킬레이트 단백질을 30분 동안 실온(RT)에서 어둠 속에서 배양(서랍 또는 캐비닛에 배치)하여 배양하였다.
참고: IAA 대신 N-에틸말레미드(NEM)와 같은 대체 시약을 사용할 수 있다. - 50 mM TEAB를 샘플에 추가하여 샘플의 2 M. 스팟 1 μL 이하로 점액을 pH 종이에 희석하여 희석 된 샘플의 pH가 7.0-8.5 사이인지 확인하십시오. 각 샘플에 트립신을 1:50(트립신 대 단백질, wt/wt)의 비율로 추가하고 밤새 37°C(약 14-16시간)에서 교반하여 단백질을 소화합니다.
- 다음날 1% 포믹산에 도달하기 위해 10% 포르믹산으로 소화를 담금질합니다. 소용돌이와 짧게 회전. 다이제스트가 pH = 2-3인지 확인하기 위해 샘플의 1 μL을 pH 스트립 위에 두드리. RT에서 1,800 x g의 원심 분리기 샘플을 사용하여 불용성 물질을 펠렛합니다.
2. 대규모 고체 상 추출을 통한 비농축 단백질 용해 펩타이드의 탈염
- 최대 10 mg의 단백질을 결합할 수 있는 C18 수지가 들어 있는 카트리지를 구하십시오. 다음 각 단계에서 카트리지를 통해 액체를 당길 수 있는 진공 흡입을 사용하는 진공 장치에 카트리지를 장착합니다. 각 펩티드 샘플에 대해 하나의 카트리지를 지정합니다.
- 800 μL의 800 μL을 0.2% 포믹산에 19.8%의 물로 카트리지에 넣고 진공 흡입을 사용하여 액체를 빼냅니다. 카트리지가 완전히 마르지 않도록 이 단계를 1x반복합니다.
- 진공 흡입으로 물에 800 μL의 0.2% 포매산을 추가하여 필터를 통해 전체 부피를 끌어내는 평형 카트리지. 이 2x를 반복합니다. 진공 흡입으로 펩티드를 카트리지에 적재하십시오. 진공 흡입 하에 물에 0.2 % 포산의 800 μL로 펩타이드 2x를 씻으소서.
- 각 카트리지 아래에 1.5 mL 의 미세 원심분리튜브를 배치하여 최종 단계에서 펩타이드 용출을 수집합니다. 카트리지에서 진공 흡입 용홍색 펩티드를 사용하면 먼저 0.2 % 포매산및 19.8 % 물에 800 μL의 800 μL을, 동일한 용액의 400 μL로. 탈염 된 펩타이드 샘플을 진공 농축기 (2-3 h)에서 완전히 건조시다.
3. 면역상피성 구슬을 함유한 K-아세틸화 및 K-succinylated 펩타이드의 동시 농축
- 건조된 펩티드를 1.4 mL의 차가운 1x 면역 친화도 정제(IAP) 버퍼에 다시 중단한다. 와류는 ~ 7의 pH를 혼합하고 보장한다. 4 °C에서 10 분 동안 10,000 x g에서 원심 분리기 샘플. 작은 펠릿이 나타날 수 있습니다.
- 항체 비드를 준비하는 동안 얼음 위에 펩티드를 따로 놓습니다. K-succinyl 항체 비드 슬러리의 K-아세틸 및 튜브 튜브 (부피 : 튜브 당 슬러리 100 μL)에 1 mL의 차가운 인산완충식염수 (PBS)를 추가하고 파이펫팅으로 혼합하십시오. 전체 용액을 새로운 1.5mL 튜브로 옮기고 RT에서 30초 동안 소형 원심분리기로 회전합니다.
- PBS를 흡인, 어떤 구슬을 흡인 하지 않도록 주의. 차가운 1x PBS 1mL로 다시 세척하고 RT에서 30초 동안 원심분리하고 PBS를 흡인하여 3배 세탁을 반복합니다.
- PBS의 약 440 μL에서 구슬을 다시 중단한다. 각 PTM 튜브에서 비드의 수의 1/4(제조자가 제공한 100 μL)는 1포트 농축(K-아세틸 및 K-succinyl 항체 비드 모두에 대해 각 고정화 항체의 약 62.5 μg)에 사용된다. 비펫 을 여러 번 잘 섞어. 아세틸 리신 항체 구슬 100 μL을 제거하고 200 μL 프리컷 팁으로 하나의 튜브로 옮겨 마스터 믹스가 일관되게 잘 혼합되도록 합니다.
- 각 튜브에서 아세틸-리신 항체 및 수치닐-리신 항체의 동등한 부분에 도달하기 위해 튜브에 100 μL의 succinyl-lysine 항체 구슬을 제거함으로써 succinyl-lysine 항체 비드와 동일을 수행한다. 소형 원심분리기에서 30초 동안 스핀다운하고 젤 로더 팁으로 용지를 흡인합니다(비드는 흰색으로 바뀝니다).
참고 : 각 튜브는 하단에 유사한 비드 펠릿이 있어야합니다. - 세척된 구슬에 직접 다시 부유펩티드를 피펫. 어떤 펠릿을 피하기 위해주의 (구슬을 건조하지 않도록 신속하게 추가). 펩티드를 4°C에서 비드로 밤새 교반하여 배양한다.
4. 항체 구슬에 결합 된 펩티드의 용출
- 4 °C에서 30 s에 대 한 2,000 x g에서 펩 티 드 샘플을 회전. 언바운드 펩타이드를 함유한 상급물질을 제거하고 원할 경우 향후 실험을 위해 저장하십시오. 구슬에 차가운 1x IAP 버퍼 1mL를 추가하여 5x를 뒤집어 씻고 섞습니다. 4 °C에서 30s에 대해 2,000 x g에서 회전하십시오. IAP 용액을 흡기하고 IAP 세척 단계를 1x반복하여 총 2개의 세척을 합니다.
- 구슬에 차가운 HPLC 물 1 mL을 넣고 5x를 뒤집어 섞습니다. 4 °C에서 30s에 대해 2,000 x g에서 회전하십시오. 물에서 흡인. 총 3번의 세척을 위해 워터 워시 단계를 두 번 반복합니다. 4°C에서 30s에 대해 2,000 x g에서 추가 시간을 회전하여 튜브 바닥에 남은 물을 수집합니다. 평평한 팁 젤 로딩 팁으로 수집 했을 수 있는 여분의 물을 흡입 합니다. 구슬을 피하지 않도록 주의하십시오.
- 구슬에 물에 0.15 % 트리플루오로 아세트산 의 55 μL을 추가합니다. 때때로 혼합 튜브의 바닥을 두드리는 동안 RT에서 10 분 동안 구슬을 배양. 미니어처 원심분리기에서 RT에서 구슬을 30초 동안 회전시면 됩니다. 용출 된 펩티드를 제거하고 평평한 팁 젤 로딩 팁을 사용하여 따로 둡니다.
- 구슬에 물에 0.15 % 트리플루오로 아세트산 의 45 μL을 추가합니다. 가끔 섞기 위해 튜브의 바닥을 두드리면서 RT에서 10 분 동안 배양하십시오. 미니어처 원심분리기에서 RT에서 구슬을 30초 동안 회전시면 됩니다. 평평한 팁젤 로딩 팁을 사용하여 두 번째 용출을 제거하고 첫 번째 용출과 결합합니다.
- RT에서 12,000 x g에서 결합된 용출 펩티드를 5분 동안 회전하여 이월되는 모든 구슬을 펠렛합니다. 펩타이드 샘플 용액을 새로운 500 μL 튜브로 옮김.
참고: 프로토콜은 여기에서 일시 중지할 수 있습니다.
5. 농축 펩티드의 탈염
참고: 시료의 pH는 C18 수지 함유 팁에 최적 결합을 위해 4보다 낮아야 합니다. C18 수지 0.6 μL을 함유한 10 μL 파이펫 팁과 10 μL 파이펫을 사용하여 팁을 제어합니다.
- 아세토니트릴 10 μL을 팁에 파이펫팅하여 C18 팁을 미리 적시다. 아세토니트릴을 폐기물로 분배합니다. 이 단계를 두 번 더 반복합니다.
- 물에 0.2 % 포산의 10 μL로 3 x를 세척하여 팁을 평형화하십시오. 각 평형 후 폐기물에 용액을 분배하십시오.
- 팁으로 농축 된 펩타이드 샘플을 지속적으로 파이펫팅하고 분배하여 샘플에서 팁으로 펩티드를 로드합니다. 파이펫을 위아래로 20배 이상 반복하고 팁에서 남은 용액을 분배합니다.
- 결합 된 펩티드를 함유 한 팁을 물에 0.2 % 포매 산의 10 μL로 씻으하십시오. 용액을 폐기물로 분배합니다. 이 단계를 9x 반복합니다.
- 0.2% 포르믹산, 50% 아세토니트릴 및 49.8%의 물을 함유하는 용출 완충제의 10 μL을 사용하여 새로운 튜브로 펩티드를 용출한다. 반복적으로 파이펫을 하고 새로운 튜브 15x 내에서 용액의 10 μL을 분배합니다. 용출 버퍼의 추가 10 μL로 이 단계를 반복하여 이전 용출과 동일한 튜브로 반복적으로 피펫팅합니다.
- 진공 농축기에서 완전히 건조 된 펩티드 (약 20 분). 물에 0.2 % 포산의 적절한 부피에서 건조 된 펩티드를 다시 중단.
참고: 프로토콜은 여기에서 일시 중지할 수 있습니다.
6. DDA 및 DIA를 사용한 데이터 수집
참고: 사용 가능한 질량 분광 계측기에 따라 조정할 수 있는 DDA 및 DIA LC-MS/MS 방법으로 샘플을 분석합니다. 여기서, 샘플은 고분해능 질량 분석계에 결합된 나노 LC 2D HPLC 시스템을 사용하여 분석하였다.
- 질량 분석계에 직접 연결된 칩 기반 플랫폼 HPLC 시스템과 결합된 HPLC 시스템을 사용합니다(많은 LC-MS 구성 및 시스템도 사용할 수 있음).
- 역상 HPLC-ESI-MS/MS를 사용한 시료 분석
- 주입 후, 펩타이드 혼합물을 C18 프리컬럼 칩상에 옮기고 10분 동안 2 μL/min에서 이월 상 A로 세척하여 펩타이드를 탈염시다. 이어서, 펩티드를 분석 컬럼으로 옮기고 300 nL/min의 유량으로 2-3h 그라데이션으로 용해하여 이순상 A 및 B. 구체적으로, 80분 이상 5% 이순상 B 내지 35% 이순상 B로부터 선형 그라데이션을 사용한다.
- 그 후, 5분 동안 80%로 이동단계 B를 램프한 다음 80% B에서 8분 동안 유지한 다음 25분 재평형을 위해 5% B로 되돌아갑니다.
- DDA를 위한 MS 계측기 방법을 구축하고 다음 계측기 스캔 실험을 정의합니다.
- 실험 1: M/z 400-1,500에서 MS1 전구체 이온 스캔 (250 ms의 축적 시간). 전하 상태의 이온에 대한 MS/MS 스캔을 트리거하도록 강도 임계값을 설정하여 2-5~200카운트를 계산합니다. 전구체 이온의 동적 배제를 60s로 설정합니다.
- 실험 2: MS2 스캔범위가 m/z 100-1,500(주기당 30개 제품 이온 스캔당 100ms의 누적 시간)을 가진 MS/MS 제품 이온 스캔. 충돌 에너지 확산을 CES = 5로 설정한 다음"고감도 제품 이온 스캔 모드"를선택합니다.
참고: DDA 방법은 주기당 MS1 스캔을 각각 조사한 후 30개의 가장 풍부한 전구체 이온에 대한 MS/MS 스펙트럼을 획득하며, 총 사이클 시간은 ~3.3s. DDA 획득이 섹션 7에 설명된 대로 스펙트럼 라이브러리를 구축하는 데 사용됩니다.
- DIA를 위한 MS 계측기 방법을 구축하고 다음 계측기 스캔 실험을 정의합니다.
- 실험 1: m/z 400-1,250(250ms의 축적 시간)에서 MS1 전구체 이온 스캔을 수행합니다.
- 실험 2: MS2 스캔 범위가 m/z 100-1,500(주기당 64개 제품 이온 스캔당 45ms의 누적 시간)으로 64개의 가변 SWATH 세그먼트에 대해 MS/MS 제품 이온 스캔을 수행합니다. 충돌 에너지 확산을 CES = 10으로 설정한 다음"고감도 제품 이온 스캔 모드"를선택합니다.
- Schilling et al.22에 의해 설명된 대로 64 개의 가변 창 DIA/SWATH 획득 전략을 사용하여 총 주기 시간 ~3.2s로 라벨 없는 정량화를 얻습니다. 간략하게, 이 인수에서, 충돌 셀을 통해 좁은 질량 범위를 전송하는 Q1 사중대대대대신, 가변 윈도우 폭(5-90 m/z)의 더 넓은 창은 전체 질량 범위에 걸쳐 증분 단계로 전달된다(m/z 400 -1,250 과 64 SWATH 세그먼트, 각각 45 ms 누적 시간, 3.1의 사이클 시간을 산출하는 MS1의 사이클 시간 1, 1의 주기를 산출하는 MS1 250 ms 축적 시간).
참고: 가변 창 너비는 가변 창 계산기 알고리즘22를 사용하여 특정 m/z 범위 내에서 관찰되는 일반적인 MS1 이온 전류의 복잡성에 따라 조정됩니다(더 좁은 창은 "바쁜" m/z 범위에서 선택되며, 용출 전구체 이온이 거의 없는 m/z 범위의 넓은 창). 다른 MS 계측기 플랫폼에서는 다른 DIA 창 전략이 구현될 수 있습니다.
7. 데이터 분석
참고: 일부 데이터 분석 설정을 변경하고 특정 실험에 맞게 조정해야 합니다. 예를 들어, 선택된 단백질 데이터베이스(FASTA 파일)는 시료가 제조된 종에 따라 달라집니다(여기, 근골). 아래, 아세틸화 및 간결화된 펩티드에 대해 농축된 마우스 샘플에 대한 데이터 분석이 설명된다.
- MS 데이터베이스 검색 엔진을 사용하여 DDA 획득을 분석합니다. 다음과 같이 데이터베이스 검색 엔진 메서드를 만듭니다.
- 샘플 설명 매개 변수: 선택 "식별" 샘플 유형에서, 선택 " 키스테인 Alkylation"에서 "요오 아세트산" 선택, 선택 "트리프신 " "소화"(리신과 아르기닌에서 C 말단 절단 가정), 선택 " TripleTOF 6600" 악기에서, 특수 요인에서, 아세질화 강조 및 수치,수시, 무시, 무시, 선택.
- 특정 처리 매개 변수: ID 포커스에서"생물학적 수정""를 선택하고 데이터베이스에서"SwissProt""를 선택하고, 검색 노력에서"철저한 ID"를선택하고 "검출된 단백질 임계값"에서"0.05(10%)"를선택하고 "결과 품질"에서"잘못된 발견 비율 분석실행"을 선택합니다. 검색 엔진 방법을 저장하고 생성된 방법을 사용하여 데이터베이스 검색 엔진에서 처리하기 위해 질량 분광 원시 파일을 제출합니다.
참고: 반복 프로세스에서 모든 MS 및 MS/MS 스캔은 초기 주석 및 결과에 따라 검색 엔진에 의해 자동으로 다시 보정됩니다.
- "펩타이드 요약 내보내기"검색이 완료되면 스프레드시트 소프트웨어에서 99의 "신뢰 도면 기준"(예: Excel; 거짓 발견률 [FDR] 1%)에 의해 모든 펩티드 식별 결과를 필터링합니다.
- "펩티드 요약"스프레드시트 파일에서, PTM 부호를 포함하는 모든 펩티드에 대한 필터"아세틸화"및"succinylation"수정 컬럼에서 아실화된 펩티드 및 이들의 상응하는 단백질을 독점적으로 제시하는 결과 보고서를 생성한다.
- DIA 원시 파일을 추가로 처리하고 상대 정량화를 처리하기 위해 MS/MS 스펙트럼 라이브러리를 구축하려면 DIA 정량 분석 소프트웨어를 엽니다. "라이브러리"탭을 선택한 다음 (페이지 하단에서)"데이터베이스 검색 엔진"에서"스펙트럼 라이브러리 생성"을 클릭하고 DDA 원시 파일 데이터베이스 검색 프로세스의 일부로 자동으로 생성된 데이터베이스 검색 엔진 FDR 보고서(*FDR.xlsx 파일)를 엽니다. 그런 다음 "다음" 을 클릭하고"라이브러리설정 스키마"및 "다음 "을선택합니다. "Uniprot_mouse_proteome"를 데이터베이스로 선택한 다음 "다음" 및"goa_mouse"를 유전자 추가(ontology) 파일로 클릭합니다. 마지막으로"완료"를클릭하면 스펙트럼 라이브러리가 생성됩니다.
참고: TheDA 원시 데이터 파일, MS1의 전구체 이온 스캔 및 MS2의 조각 이온 스캔에서 아세틸화되고 간결한 펩티드에 대한 정보가 스펙트럼 라이브러리에 포함됩니다(보존 시간, MS/MS 조각화 패턴 등 포함). - DIA 정량적 프로테오믹스 분석 소프트웨어를 사용하여 아세틸화 및 간시화 수준의 상대적 정량화를 수행하고 추가 데이터 분석에 사용할 수 있는 후보 PTM 함유 펩티드의 스프레드시트를 생성합니다.
- DIA 정량 분석 소프트웨어를 여는 PTM 함유 펩티드를 분석하고 정량화하려면 템플릿 분석 스키마를 사용합니다. 템플릿 스키마는"설정 관점"옵션을 선택하여 소프트웨어에서 사용할 수 있습니다 . "DIA 분석" | "BGS PTM" (실험에 따라 유의하거나 희소한 것).
참고: DIA 정량 분석 소프트웨어에서 BGS PTM 분석 템플릿을 사용하는 대신 모든 PTM 별 설정은 다음 지침에 따라 수동으로 설정할 수 있습니다: 1)"식별","PTM 지역화"선택(확률 차단 = 0.75); 2)"정량화"에서"[ 작은 펩티드 그룹화"| "개량"; 3) 아래 "사후 분석", 선택 "차등 풍부한 그룹화" | "마이너 그룹" (정량화 설정). 이러한 설정은 PTM 국소화 기능을 활성화하여 변형된 펩티드가 개별 항목으로 나열되고 차동 분석이 펩티드 수준에서 수행되도록 합니다. - 정량화 분석을 시작하려면 "파이프라인" 탭을 선택한 다음파일에서 DIA 분석 설정"을 클릭하고 상대 정량화를 위해 관심 있는 MS DIA 원시 파일을 엽니다. "스펙트럼라이브러리 할당"을선택하고 위에 구축된 라이브러리를 선택하고 "로드" | "다음". "BGS PTM"분석 스키마를 선택하고"다음"을 클릭합니다. 적절한 데이터베이스 FASTA 파일 "Uniprot_mouse_proteome" | "다음". 샘플에 다른 조건을 할당하는 조건 설정을 정의하고다음"을 클릭합니다. 유전자 추가 (ontology) 파일로"goa_mouse"를 선택하고다음"을 클릭합니다. 분석 개요(실험 설정 요약)를 검토하고"출력 디렉토리"| "완료". 마지막으로"파이프라인 실행"을 클릭하여 레이블이 없는 정량 분석을 수행합니다.
참고: DIA 정량 분석 소프트웨어의 통계 모듈은 자동으로 FDR 분석을 수행하고, 다양한 조건을 비교하는 열 맵 및 화산 플롯을 생성하고, 식별및 정량화된 펩티드 및 단백질 목록을 생성하고, 서로 다른 조건을 비교하는 상대 접기 변화와 함께 Q 값.
- DIA 정량 분석 소프트웨어를 여는 PTM 함유 펩티드를 분석하고 정량화하려면 템플릿 분석 스키마를 사용합니다. 템플릿 스키마는"설정 관점"옵션을 선택하여 소프트웨어에서 사용할 수 있습니다 . "DIA 분석" | "BGS PTM" (실험에 따라 유의하거나 희소한 것).
- 대신 데이터를 처리하고 아세틸화 및 간시원화 사이트를 위해 추출된 피크 영역을 내보낸 후 통계 분석을 수행하기 위해 DIA 데이터 세트의 간섭 제거를 위해 소프트웨어를 사용합니다.
8. 수정된 펩타이드의 데이터 시각화 및 PTM 부위 현지화 평가
- 생성된 DIA 정량 분석을 열려면"분석"탭 다음에"정량 분석 소프트웨어 실험로드"(저장된 실험에서 *를 여는 것으로 선택합니다. SNE 파일)을 참조하십시오. *로 이동합니다. SNE 결과 파일을 선택하고"열기"를 선택합니다.
- 왼쪽 패널에서 세 번째 원시 데이터 *.wiff 파일의 왼쪽에 있는 화살표를 클릭하여 64개의 SWATH 세그먼트를 모두 확장하고 시각화합니다. 세그먼트 [428.7-437.3]의 왼쪽에 있는 화살표를 클릭하여 특정 세그먼트를 확장하고 이 질량 범위에 대해 확인된 변형된 펩티드를 표시합니다. 삼중 충전 펩티드 KQYGEAFEK [아세틸]R을 클릭합니다.
참고: 기본적으로 오른쪽 상단 패널은 일반적으로 MS2 XIC를 표시하고, 아래쪽 패널에는 MS1 동위 원소 봉투 XIC가 표시됩니다.- 위쪽 패널에서"PTM 지역화 플롯"을선택합니다. 아래쪽 패널에서"PTM 지역화 플롯"을선택합니다.
- PTM 국소화 플롯에서, 상부 펩티드 서열"KQYGEAFEK[아세틸]R"을선택하고, 총 PTM 국소화 점수는 18.32이다. 왼쪽의 화살표를 클릭하여 뷰를 확장하고 이온을 확인하고 반박하는 것을 시각화합니다. "이온 확인" 옆의화살표를 클릭한다음 이온"y3 [+42]" 를 선택하여 특정 이온을 강조하여, 이는 아세틸화 부위가 펩티드 서열의 K2상에 위치한다는 것을 확인한다.
- PTM 국소화 플롯에서 제2 펩티드 서열"K[아세틸]QYGEAFEKR"총(매우 낮은) PTM 국소화 점수가 1인 것을 선택한다. 왼쪽의 화살표를 클릭하여 뷰를 확장하고 이온을 확인하고 반박하는 것을 시각화합니다. "이온 확인" 옆의화살표를 클릭한다음 "이온 을 반박하는"다음 화살표 옆에 있는 화살표를 선택한 다음 추출된 이온 크로마토그램과 MS/MS 스펙트럼을 시각화하고 평가하기 위해 일부 조각 이온을 선택합니다(그림5).
참고: 할당된 PTM 현지화 점수 및 육안 검사는 올바른 PTM 이성미가 KQYGEAFEK[아세틸]R이며, 다른 가능한 PTM 이성모 K[아세틸]QYGEAFEKR에 대한 증거는 없거나 최소한의 증거가 없음을 나타냅니다.
결과
그림 1은 마우스 간에서 조직을 수확하고, 트립신으로 단백질 용해물을 소화하기 위해 1 mg의 단백질을 사용하고, 항체 컨쥬게이트 비드로 펩타이드를 배양하고, MS에서 샘플을 획득하고, 마지막으로 다양한 정량적 프로테오믹스 소프트웨어 패키지(학술 및 상업용)를 사용하여 데이터의 DIA/SWATH 분석을 수행하는 것을 포함한 워크플로우의 일반적인 다이어그램을 보여줍니다.
그림 2A는 현재 다중 PTM 농축 연구에 사용되는 대체 방법과 비교하여 워크플로우의 타임라인과 필요한 샘플 및 단백질의 양을 보여줍니다. 원 팟 방법은 이러한 대체 방법과 마찬가지로 샘플 수의 절반만큼 많은 시간과 절반으로 수행 할 수 있습니다. 2개의 단일 PTM 농축 방법에 비해, 1-pot 프로토콜은 또한 단백질의 절반 양을 필요로 한다.
이 프로토콜은 실현 가능하고 비용 효율적인 대안으로 나타났습니다. 도 2B는 변형된 펩티드 영역에 대한 변이(CV)의 중간 계수가 단일 PTM 및 직렬 PTM 농축물보다 원팟 방식에서 더 낮았다는 것을 나타낸다. 도 2C,D는 1포트 PTM 및 단일 PTM 농축 방법을 비교하는 동안 두 수정에 대한 사이트 수준 정량화의 상관 관계 간에 주목할 만한 차이가 없음을 보여줍니다. 이것은 또한 펩티드 수준 및 단편 수준 상관관계에 대해서도 마찬가지였다. 한 냄비 와 직렬 PTM 농축물을 비교할 때 세 상관 관계 모두에 대해 동일한 관찰이 유지되었습니다. 모든 기본 MS 원시 데이터 및 처리 된 엑셀 결과 시트는 Basisty 등14에 의해 최근 보고서와 관련된 사용할 수 있으며 MassIVE (MSV00081906) 및 ProteomeXchange (PXD008640)에서 다운로드 할 수 있습니다.
일반적으로 항체 농축 전략은 잠재적 인 에피토프 폐색 또는 제한된 특이성과 같은 특정 한계를 나타낼 수 있지만,이 연구에서 사용되는 항체는 독립적으로 생성 된 클론의 혼합물이므로 더 넓은 범위를 제공합니다. 특이성.
실험 결과는 PTM 누토크를 감지하고 평가할 수 있는 가능성을 문서화합니다. 도 3은 성공적인 농축으로부터의 데이터를 표시하고 PTM 누토크를 시각화하는 다중 및 상이한 아실 변형을 포함하는 펩티드에 대한 예를 도시한다. 도3A는 하나의 리신 잔기 상에서 아세틸화되고 다른 쪽에서 간결화된 펩티드를 나타내고, 도 3B는 두 라이신모두에서 동일한 펩티드를 증액된 동일한 펩티드를 나타낸다. 이것은 동일한 리신 잔류물이 두 아실레이션 그룹으로 수정될 수 있음을 보여 주며, 해당 사이트에서 발생하는 누화의 가능성이 있다. 도 4는 7.1-7.3 절에 기재된 바와 같이 확인된 라이신 잔기의 수를 표시하여 두 가지 수정을 모두 수행하고, 또한 가능한 PTM 크로스토크를 가리킨다.
그림 5에서 알 수 있듯이, 정량적 프로테오믹스 소프트웨어로 DIA PTM 데이터 세트를 처리하면 어떤 특정 라이신 잔류물이 수정되는지 정확히 파악할 수 있습니다. 이는 가능한 PTM 크로스토크를 측정하기 위한 모든 분석을 위한 필수적인 단계인 사이트 지역화라는 개념입니다. 그림 5는 8.1-8.3 절(구체적으로 단계 8.3.2 및 8.3.3)에 설명된 대로 시각화및 평가될 수 있는 각각에 대한 확인 및 반박 이온과 함께 두 개의 잠재적 인 이소폼을 표시합니다. 이 정보를 바탕으로 원래 샘플에 있는 두 개의 등소폼 중 어느 것이 존재할지 자신 있게 식별할 수 있었습니다. 확인된 이소폼 KQYGEAFEKacR의 MS/MS 스펙트럼은 42 m/z(아세틸 기의 증분 질량)에 의해 이동된 아세틸화된 리신 잔류물을 함유하는 y 이온(y2-y5)이개질된 펩티드에서 특이적 리신 잔류물을 확인했음을 명확하게 입증한다.
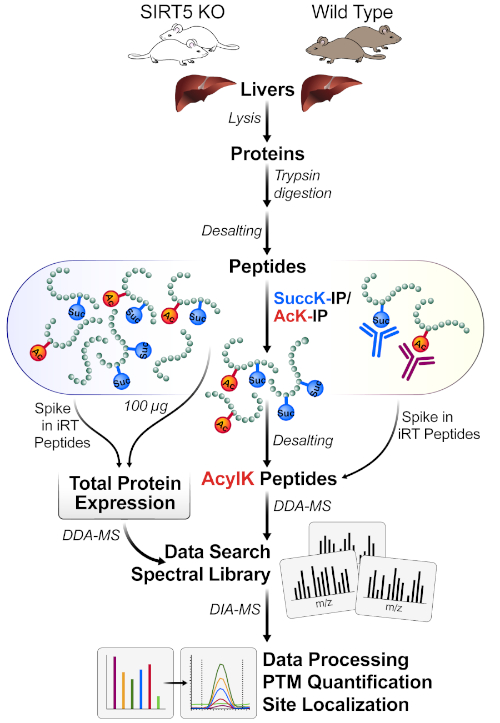
그림 1: PTM의 원포트 보강을 위한 일반적인 워크플로우입니다. 조직(여기, 간)은 SIRT5 KO 및 야생형(WT) 마우스로부터 수확되고, 단백질은 용해되고, 펩티드로 트립신 소화되고, 탈염된다. 펩티드는 그런 다음 succinyl- 및 아세틸 항체 구슬의 조합으로 면역 affinity에 의해 농축됩니다. 병렬 MS 워크플로우는 1) 전체 용해 단백질 발현 변화(단백질 정규화를 위한) 및 2) 아실 함유 펩티드를 아실 함유 펩티드(DDA-MS) 및 부위 국소화를 모두 측정한 다음 정량화(DIA-MS)를 측정합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
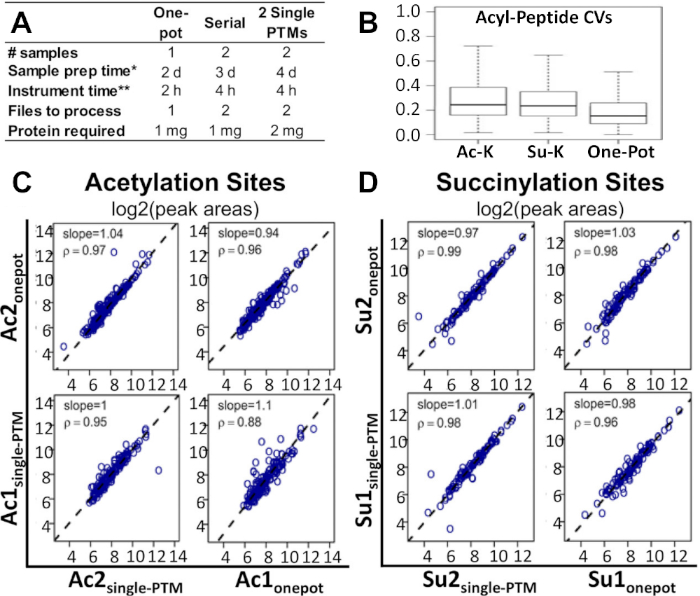
그림 2: 한 포트 워크플로우와 다른 방법을 비교합니다. (A)원팟 워크플로우, 직렬 PTM 농축 및 2개의 단일 PTM 농축에 필요한 시간, 비용 및 재료 비교. (B)원팟 워크플로우, 단일 아세틸-리신 PTM 농축, 단일 수시닐-리신 PTM 농축 간의 CV 비교. 스피어맨 상관 분석은 단일 포트 워크플로우및 단일 PTM 농축물로부터 수득된 아실 펩티드 피크 영역을 비교한 결과,(C)아세틸화 부위 및(D)간약성 부위에 대한 log2 피크 영역 결과의 해당 플롯. 회귀 경사 및 상관 계수는 개별 패널14에표시되어 있습니다. 2개의 독립적인 생물학적 복제본은 각각의 조건에 대해 처리되었다. 이 수치는 Basisty 외14에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
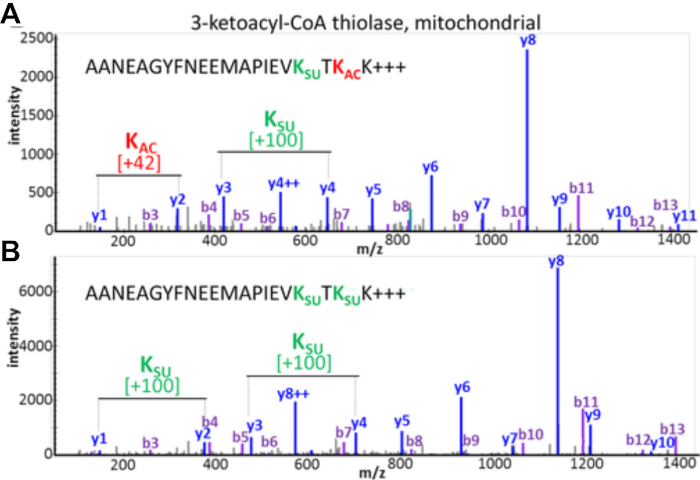
그림 3: 아세틸화와 리신 잔기의 간질 수정 사이의 크로스토크. 동일한 아미노산 서열을 보여주지만 다른 PTM을 가진 2개의 리신 잔기에서 변형된 미토콘드리아 3-케토아실-코아 티올라제의 트립틱 펩티드의 MS/MS 스펙트럼.(A)펩타이드 AANEAGYFNEEMAPIEVKsuccTKacK 및(B)MS/MS/MS 의 펩타이드 AANEAGYFNEEMAPIEVKsuccTKsuccK. 이 수치는 Basisty 외14에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
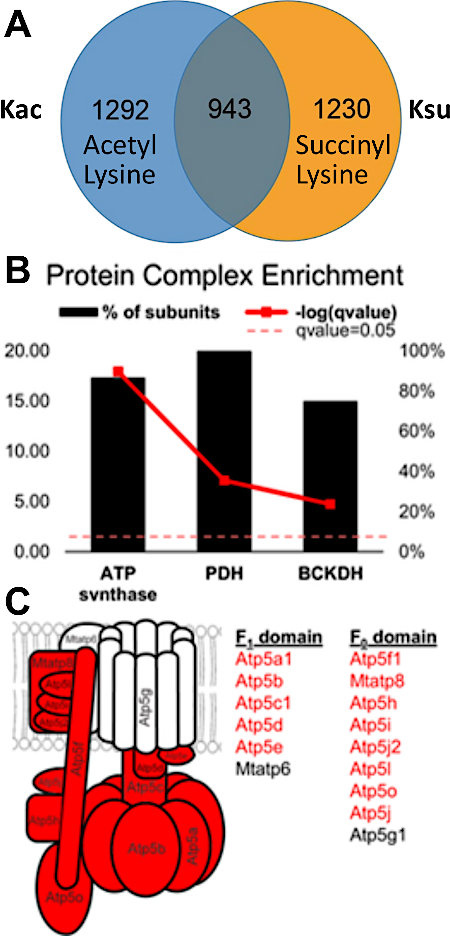
도 4: 단백질 복합체에서 아세틸화 및 간첩성 리신 잔기 사이의 중첩 및 크로스토크. (A)2,235 아세틸화와 2,173 개의 간결한 사이트 사이에 중첩을 표시하는 벤 다이어그램. 이 중 943개 사이트는 아세틸화되고 간결했다. SIRT5 (de-succinylase) 녹아웃 마우스로부터의 간을 분석하고, 많은 간질 부위를 확인하였다. 사실, 그들은 일반적으로 마우스 간에서 관찰 보다 더 풍부 했다 (수정 된 펩 티 드의 Q 값에서 여과 되었다 <0.05). (B)아세틸화 및 간결한 부위를 모두 포함하는 소단위의 백분율을 나타내는 단백질 복합체(굵은 빨간색 선은 피셔의 정확한 시험에 의해 결정된 중요성을 나타낸다). (C)ATP 신타제 복합체의 다이어그램: 적색의 단백질 소단위는 아세틸화 및 간결화된 부위를 모두 포함하는 소단위를 묘사한다. 이 수치는 Basisty 외14에서수정되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
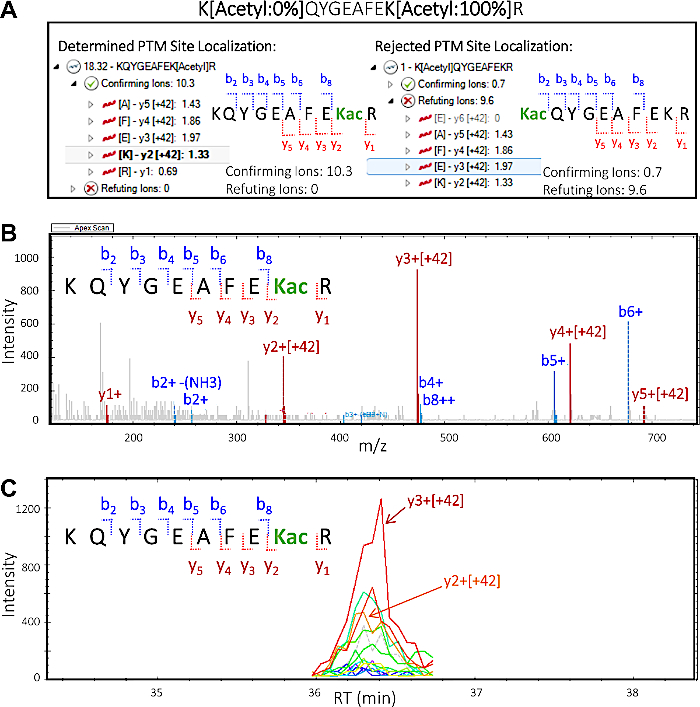
도 5: 정량적 프로테오믹스 소프트웨어는 PTM의 펩티드 부위 국소화를 해독한다. 펩티드의 MS/MS 단편화에 기초하여, 아세틸 기가 수정되는 특정 라이신 잔류물에 대한 정보를 제공할 수 있다. 이는 소프트웨어가 PTM의 현장 현지화에 대한 귀중한 정보를제공하는 능력을 보여줍니다. 펩티드의 잠재적 부위 국소화 이소폼에 대해 "확인" 및 "반박" 단편 이온이 도시된다. 이 정보를 바탕으로, 점수를 확인하고 점수를 반박하는 것이 할당되고, 샘플에서 Isoform KQYGEAFEKacR의 존재를 확인한다. (B)확인된 이소폼 KQYGEAFEKacR에 대응하는 MS/MS 스펙트럼은 아세틸화된 리신 잔류물(y2 이상)을 포함한 모든 y 이온이 아세틸 변형에 상응하는 +42 m/z의 증분 질량을 수반한다는 것을 나타낸다. 관찰된 b 이온은 변형을 포함하지 않는다. (C)추출 된 이온 크로마토그램 (XIC)y2 및 y3 이온에서 발생하는 풍부한 피크 영역을 가진, 둘 다 확인 된 이소폼 KQYGEAFEKacR. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜은 PTM 누토크를 보다 효과적으로 이해하기 위해 동시에 다중 PTM 농축을 위한 새로운 기술을 설명합니다. 이 목표에 도달하는 대안적인 방법은 엄청나게 시간이 많이 걸리고 비용이 많이 드는 경향이 있으며,11,13을성공시키기 위해서는 다량의 단백질이 필요합니다. 이 프로토콜은 실험의 전반적인 효율성을 향상시키기 위해 한 번에 두 개의 PTM에 대한 항체 컨쥬게이션 비드의 인큐베이션을 포함하는 다중 PTM 농축 워크플로우를 제시한다. 이 방법은 또한 스펙트럼 라이브러리 생성 및 DIA MS 획득을 위한 DDA의 사용을 수반하여 단편 이온22,23으로부터의감소된 간섭으로 존재하는 펩티드를 검출하고 정량화한다. MS 데이터베이스 검색 엔진과 같은 소프트웨어 프로그램은 DDA 획득에서 데이터를 분석하고 정량화하는 데 사용되는 반면, 정량적 프로테오믹스소프트웨어(24)와 특정 DIA 정량 분석소프트웨어(25)는 DIA 획득에 의해 생성된 복잡한 스펙트럼을 해석하는 데 필요합니다.
이 프로토콜에는 신중하게 따라야 하는 몇 가지 중요한 단계가 있습니다. 프로토콜의 주요 목표는 여러 PTM을 동시에 풍부하게 하는 것이므로, 항체-친화성 농축 단계(섹션 2)는 실험의 성공에 매우 중요하다. 구슬에 세서를 수행 할 때, 구슬중 어느 것도 실수로 흡인되지 않도록할 필요가있다. 트립신(step 1.8)으로 소화되기 전에 우레아 농도를 1M로 희석하는 것도 필요하다. 단백질 용해화를 위한 프로토콜의 초기에 8M 우레아가 요구되더라도, 1 M 이상의 우레아 농도는 트립신의 효소 활성을 억제한다. 또한 프로토콜 전반에 걸쳐 샘플의 pH를 일관되게 확인하는 것이 중요합니다. 이것은 소화하기 전에 특히 중요합니다. 시료 및 트립신 용액의 pH가 인큐베이션 전에 적절히 중화되지 않으면, 많은 절단 부위가 누락될 수 있는 비효율적인 소화를 초래할 수 있으며, 이로 인해 펩티드 식별이 감소할 수 있다.
샘플을 준비할 때 프로토콜을 약간 수정하면 도움이 될 수 있습니다. 1 mg의 시작 물질로부터 조달된 단백질 용해물의 경우, 각 PTM 스캔 튜브에 제공된 항체 비드의 분기가 비용 효율적인 대안으로 사용될 수 있다. 사용되는 항체 비드의 양이 비례적으로 증가하는 한 더 많은 양의 시작 물질을 더 나은 결과를 위해 사용될 수 있습니다. 워크플로우를 향상시킬 수 있는 또 다른 수정사항은 트립신 이외에 다른 프로테아제로 샘플을 소화하는 것입니다. 이 수정은 단백질 잔기의 증가한 엄호를 제공하는 펩티드 에 있는 더 많은 가변성 귀착될 것입니다. 필요는 없지만, 트립신은 높은 절단 특이성26으로인해 PTM 분석에 사용되는 효소 중 하나가 되는 것이 좋습니다.
이 프로토콜의 한계는 연구 중인 PTM이 동시에14를농축하기 위해 유사한 화학을 가질 필요가 있다는 것입니다. 상이한 항체-컨쥬게이션 비드에 대한 절차는 유사한 용출 조건을 포함하는 유사한 용매 및 용액을 활용하며, 바람직하게는 동일한 공급업체로부터 유사해야 한다. 이러한 이유로, 여기서 설명된 방법은 일관되게 아세틸화 및 간결화를 예로 사용하며, 둘 다 항체 접합비(Cell Signaling Technology, Inc.)를 사용한다. 이 방법은 이론적으로 모든 수의 PTM에 적용될 수 있지만, 이 점에서 프로토콜의 정확한 한계를 평가하기 위해서는 추가적인 연구가 필요할 것이다. 더욱이, 이것은 항체 기반 농축 방법이므로, 상기 방법은 PTM 부위의 상대적 정량화만을 제공할 수 있다.
기존 다중 PTM 보강 방법과 비교하여 이 워크플로는 보다 실현 가능하고 비용 효율적인 대안입니다. 이 실험에서, 이 방법의 효능은 개별 또는 직렬 농축과 같은 대체 방법과 매우 잘 비교된다는 것이 관찰되었다. 도 2B는 변형된 펩티드 피크 영역에 대한 중앙값 CV가 단일 PTM 농축물 및 직렬 PTM 농축물(13)에 비해 단일 포트 방식에서 실제로 감소되었다는 것을 보여준다. 우리는 또한 아세틸화 또는 간결화에 대한 사이트 수준의 정량화를 평가하는 실험 결과를 분석했습니다. 또한, 스피어맨 상관분석(그림 2C,D)은단일 PTM 농축 워크플로우와 유사하게 원팟 PTM 농축이 수행된다는 것을 입증하였다. 이것은 또한 펩티드- 및 단편 수준 상관관계에 대해서도 마찬가지였다. 한 포트와 직렬 PTM 농축을 비교할 때 세 가지 상관 관계에 대해 동일한 관찰이 유지되었습니다.
이 프로토콜을 통해 연구자들은 PTM 누토크에 대한 생물학적 통찰력을 빠르고 비용 효율적인 방식으로 만들 수 있습니다. 워크플로의 DIA 구성 요소는 현장 현지화에 대한 정보를 제공하고 PTM의 낮은 사이트 점유와 같은 문제를 극복하기 때문에 연구원이 PTM에 대해 더 많이 이해할 수 있게 해줍니다. 후속 실험은 이 방법을 사용하여 동시에 보강될 수 있는 PTM 수의 상한을 평가하기 위해 수행될 수 있습니다. 이 워크플로의 향후 개선에는 사이트 지역화 및 PTM 사이트 점유 분석을 더욱 자동화하기 위한 고급 소프트웨어 플랫폼 개발이 포함될 수 있습니다.
공개
저자는 공개 할 것이 없다.
감사의 말
우리는 벅 연구소 (1S10 OD016281)에서 트리플 TOF 시스템에 대한 NIH 공유 계측 보조금의 지원을 인정합니다. 이 작품은 또한 국립 알레르기 및 전염병 연구소 (R01 AI108255 b.S.) 및 당뇨병과 소화 및 신장 질환의 국립 연구소 (에릭 베르딘에 R24 DK085610;; R01 DK090242에서 에릭 괴츠만까지). X.X.는 국립 보건원 (NIH 교부금 T32GM8806, 주디스 캄피시 및 리사 엘러비)의 보조금으로 지원되었으며, N.B.는 글렌 의학 연구 재단의 박사 후 펠로우십에 의해 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1 M Triethylammonium biocarbonate buffer (TEAB) | Sigma Aldrich, St. Louis, MO, USA | T7408 | |
| Acetonitrile, Burdick and Jackson LC-MS grade | Burdick and Jackson, Muskegon, MI, USA | 36XL66 | |
| Bioruptor sonicator | Diagenode, Denville, NJ, USA | B01020001 | |
| C18 pre-column chip (200 µm x 6 mm ChromXP C18-CL chip, 3 um, 120 A) | SCIEX, Framingham, MA, USA | 5015841 | |
| C18-CL chip (75 µm x 15 cm ChromXP, 3 µm, 300 Å) | SCIEX, Framingham, MA, USA | 804-00001 | |
| Dithiothreitol (DTT) | Sigma Aldrich, St. Louis, MO, USA | D9779-5G | |
| Eppendorf Thermomixer Compact | Eppendorf AG, Hamburg, Germany | T1317-1EA | |
| Eppendorf Tube (2.0 mL Safelock) | Eppendorf AG, Hamburg, Germany | 22363352 | |
| Formic acid | Sigma Aldrich, St. Louis, MO, USA | F0507-500ML | |
| Indexed retention time (iRT) normalization peptide standard | Biognosys AG, Schlieren, Zurich, Switzerland | Ki-3002-2 | |
| Iodoacetamide (IAA) | Sigma Aldrich, St. Louis, MO, USA | I1149-25G | |
| mapDIA | web link | software for interference removal of DIA datasets | |
| Methanol, Burdick and Jackson LC-MS grade | Burdick and Jackson, Muskegon, MI, USA | BJLC230-4 | |
| PURELAB flex 1 ultrapure water dispenser | VWR International, Radnor, PA, USA | 89204-088 | |
| mProphet in Skyline | incorporated in Skyline | integrated statistical algorithms for FDR assessments | |
| Oasis HLB SPE cartridges | Waters Corp., Milford, MA, USA | WAT094225 | cartridges for desalting protein lysates, up to 50 mg material |
| Phosphate buffered saline solution | Life Technologies | 10010023 | |
| Pierce BCA Assay | Thermo Fisher Scientific, Waltham, MA, USA | 23225 | |
| ProteinPilot 5.0 - 'MS database search engine' | SCIEX, Framingham, MA, USA | software download SCIEX | MS database search engine |
| PTMScan Succinyl-Lysine Motif [Succ-K] Kit #13764 | Cell Signaling Technology | 13764 | antibody beads for affinity enrichment |
| PTMScan Acetyl-Lysine Motif [Ac-K] Kit #13416 | Cell Signaling Technology | 13416 | antibody beads for affinity enrichment |
| Sequencing-grade lyophilized trypsin | Life Technologies | 23225 | |
| Skyline - 'Quantitative Proteomics Software' | MacCoss lab (academic) | open source software | Quantitative Proteomics Software (academic) |
| Spectronaut - 'DIA Quantitative Analysis Software' | Biognosys AG, Schlieren, Zurich, Switzerland | Sw-3001 | DIA Quantitative Analysis Software / PTM site localization |
| Thermo Scientific Savant SPD131DDA Speedvac Concentrator | Thermo Fisher Scientific, Waltham, MA, USA | SPD131DDA-115 | instrument to concentrate liquid volume of samples |
| TissueLyser II | Qiagen, Hilden, Germany | 85300 | instrument for efficient lysis of tissue |
| Trifluoroacetic acid (TFA) | Sigma Aldrich, St. Louis, MO, USA | T6508-1L | |
| TripleTOF 6600: orthoganol quadrupole time-of-flight (QqTOF)mass spectrometer | SCIEX, Framingham, MA, USA | Per quote | high resolution mass spectrometer |
| Ultra Plus nano-LC 2D HPLC system | SCIEX, Eksigent Division, Framingham, MA, USA | Model #845 | chromatographic separation system |
| Urea | Thermo Fisher Scientific, Waltham, MA, USA | PI29700 | |
| Water, Burdick and Jackson LC-MS | Burdick and Jackson, Muskegon, MI, USA | 600-30-76 | |
| ZipTip C18 Pipette Tips, P10 | Merck Millipore Ltd, Tullagreen, Carrigtwohill, Co. Cork, IRL | ZTC18S096 | C-18 resin loaded tips for desalting of peptide mixtures |
참고문헌
- Christensen, D. G., et al. Post-translational Protein Acetylation: An Elegant Mechanism for Bacteria to Dynamically Regulate Metabolic Functions. Frontiers in Microbiology. 10, 1604 (2019).
- Deribe, Y. L., Pawson, T., Dikic, I. Post-translational modifications in signal integration. Nature Structural Molecular Biology. 17 (6), 666-672 (2010).
- Sadoul, K., Boyault, C., Pabion, M., Khochbin, S. Regulation of protein turnover by acetyltransferases and deacetylases. Biochimie. 90 (2), 306-312 (2008).
- Swaney, D. L., et al. Global analysis of phosphorylation and ubiquitylation cross-talk in protein degradation. Nature Methods. 10 (7), 676-682 (2013).
- Cohen, P. The regulation of protein function by multisite phosphorylation--a 25 year update. Trends in Biochemical Sciences. 25 (12), 596-601 (2000).
- Grunstein, M. Histone acetylation in chromatin structure and transcription. Nature. 389 (6649), 349-352 (1997).
- Struhl, K. Histone acetylation and transcriptional regulatory mechanisms. Genes and Development. 12 (5), 599-606 (1998).
- Mocciaro, A., Rape, M. Emerging regulatory mechanisms in ubiquitin-dependent cell cycle control. Journal of Cell Sciences. 125 (Pt 2), 255-263 (2012).
- Lopez-Otin, C., Hunter, T. The regulatory crosstalk between kinases and proteases in cancer. Nature Reviews in Cancer. 10 (4), 278-292 (2010).
- Du, Z., et al. DNMT1 stability is regulated by proteins coordinating deubiquitination and acetylation-driven ubiquitination. Science Signalling. 3 (146), (2010).
- McManus, F. P., Lamoliatte, F., Thibault, P. Identification of cross talk between SUMOylation and ubiquitylation using a sequential peptide immunopurification approach. Nature Protocols. 12 (11), 2342-2358 (2017).
- Venne, A. S., Kollipara, L., Zahedi, R. P. The next level of complexity: crosstalk of posttranslational modifications. Proteomics. 14 (4-5), 513-524 (2014).
- Mertins, P., et al. Integrated proteomic analysis of post-translational modifications by serial enrichment. Nature Methods. 10 (7), 634-637 (2013).
- Basisty, N., Meyer, J. G., Wei, L., Gibson, B. W., Schilling, B. Simultaneous Quantification of the Acetylome and Succinylome by 'One-Pot' Affinity Enrichment. Proteomics. 18 (17), e1800123 (2018).
- Wang, G., et al. Regulation of UCP1 and Mitochondrial Metabolism in Brown Adipose Tissue by Reversible Succinylation. Molecular Cell. 74 (4), 844-857 (2019).
- Verdin, E., Ott, M. 50 years of protein acetylation: from gene regulation to epigenetics, metabolism and beyond. Nature Reviews Molecular Cell Biology. 16 (4), 258-264 (2015).
- Rardin, M. J., et al. Label-free quantitative proteomics of the lysine acetylome in mitochondria identifies substrates of SIRT3 in metabolic pathways. Proceedings of the National Academy of Science U. S. A. 110 (16), 6601-6606 (2013).
- Rardin, M. J., et al. SIRT5 regulates the mitochondrial lysine succinylome and metabolic networks. Cell Metabolism. 18 (6), 920-933 (2013).
- Carrico, C., Meyer, J. G., He, W., Gibson, B. W., Verdin, E. The Mitochondrial Acylome Emerges: Proteomics, Regulation by Sirtuins, and Metabolic and Disease Implications. Cell Metabolism. 27 (3), 497-512 (2018).
- Sadhukhan, S., et al. Metabolomics-assisted proteomics identifies succinylation and SIRT5 as important regulators of cardiac function. Proceedings of the National Academy of Science U. S. A. 113 (16), 4320-4325 (2016).
- Collins, B. C., et al. Multi-laboratory assessment of reproducibility, qualitative and quantitative performance of SWATH-mass spectrometry. Nature Communications. 8 (1), 291 (2017).
- Schilling, B., Gibson, B. W., Hunter, C. L. Generation of High-Quality SWATH((R)) Acquisition Data for Label-free Quantitative Proteomics Studies Using TripleTOF((R)) Mass Spectrometers. Methods in Molecular Biology. 1550, 223-233 (2017).
- Meyer, J. G., Schilling, B. Clinical applications of quantitative proteomics using targeted and untargeted data-independent acquisition techniques. Expert Reviews in Proteomics. 14 (5), 419-429 (2017).
- MacLean, B., et al. Skyline: an open source document editor for creating and analyzing targeted proteomics experiments. Bioinformatics. 26 (7), 966-968 (2010).
- Sticker, A., Martens, L., Clement, L. Mass spectrometrists should search for all peptides, but assess only the ones they care about. Nature Methods. 14 (7), 643-644 (2017).
- Olsen, J. V., Ong, S. E., Mann, M. Trypsin cleaves exclusively C-terminal to arginine and lysine residues. Molecular Cell Proteomics. 3 (6), 608-614 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유