Method Article
Niceleme ve Site Yerelleştirmesi Için İki Çeviri Sonrası Modifikasyonun Eşzamanlı Affinity Zenginleştirmesi
Bu Makalede
Özet
Bu iş akışı, nicel küresel proteomik analiz için aynı anda birden fazla protein çeviri sonrası modifikasyonun (PtM) zaman ve maliyet-etkin zenginleşmesinin performansını açıklar. Protokol, ptm çapraz konuşmasına biyolojik kavrayışlar kazandırmak için birden fazla konjuge antikorla peptid düzeyinde PTM zenginleştirme, ardından da veri bağımsız iktisap kütle spektrometresi analizini kullanmaktadır.
Özet
Proteinlerin birden fazla çeviri sonrası modifikasyonları (PtM) eğitimi PTM crosstalk anlamak ve protein fonksiyonu içine daha bütünsel anlayışlar kazanmak için önemli bir adımdır. Çok PTM zenginleştirme çalışmalarının önemine rağmen, ptm'lerin birden fazla küresel proteomik analizini gerçekleştirmek için gereken harcamalar, zaman ve büyük protein miktarları nedeniyle, aynı anda birden fazla PTM araştırmak birkaç çalışma. Bu protokolde ayrıntılı olarak yer alan "tek pot" yakınlık zenginleştirme, peptidlerin eşzamanlı olarak tanımlanmasına ve ölçülmesiile, düşük miktarda numune içeren lizin kalıntıları ve süksinyon PTM'leri ile bu engelleri aşarak aşar. Giriş. Protokol, SIRT5 nakavt farelerin fare karaciğerlerinden protein lisatının hazırlanmasını, tripsin sindiriminin ifasını, PtM'ler için zenginleştirmeyi ve veribağımsız bir kazanım (DIA) iş akışı kullanarak kütle spektrometrik analizinin gerçekleştirilmesini içerir. Bu iş akışı aynı örnekten aynı anda iki PTM zenginleştirme sağlar, bu örnek büyük miktarlarda gerek kalmadan PTM crosstalk çalışma için pratik bir araç sağlar ve büyük ölçüde örnek hazırlanması için gerekli süreyi azaltır, veri edinimi ve analizi. İş akışının DIA bileşeni kapsamlı PTM'ye özgü bilgiler sağlar. DIA, farklı PTM yerelleştirme izoformlarını ayırt etmek için hesaplama lı olarak deşifre edilebilen kapsamlı parça iyonları setleri sağladığından, PTM site yerelleştirmesini incelerken bu özellikle önemlidir.
Giriş
Çok sayıda çeviri sonrası modifikasyon, proteinleri ve yolları aktivite1,sinyalizasyon2ve ciro3,4üzerindeki etkilerle dinamik olarak düzenler. Örneğin, protein kinazları fosfat grupları5ilavesi ile aktive edilir veya devre dışı bırakılır ve histon asetilasyon ve diğer modifikasyonlar kromatin yapısını değiştirmek için bir mekanizma sağlar ve transkripsiyonel düzenleyici mekanizmalar olarak hizmet vermektedir6,7. Son yıllarda, kanıt birden fazla PTM konser de çalışmak ya da protein fonksiyonu veya aktivitesi8,9,10,11düzenlemek için rekabet monte edilmiştir. Bu nedenle, PTM crosstalk anlamak PTM araştırma ortaya çıkan bir ihtiyaçtır. Ancak, PTM sitelerini tanımlamak ve ölçmek için mevcut proteomik iş akışlarının çoğu, birden çok değişikliğin etkileşimi yerine tek değişikliklere odaklanır. Açıklanan iş akışı, birden fazla farklı PtM tarafından modifiye edilen spesifik protein modifikasyonu "sıcak noktalar" ve lizin artıklarını ilişkilendirir.
Aynı anda birden fazla PTM'leri incelemek için uygulanabilir yöntemler için bilim camiasında artan bir ihtiyaç vardır12. Küresel olarak belirlemek ve PTM birden fazla türde siteleri ölçmek için en yöntemleri yüksek maliyet ve doku miktarı nedeniyle12,13gerekli zor . Sadece çok PTM zenginleştirme deneyleri örnek hazırlama, veri toplama ve veri analizi açısından zaman alıcı, ancak bu çalışmalar genellikle protein büyük ve genellikle engelleyici miktarda gerektirir11. Burada açıklanan aynı anda zenginleştirme ve birden fazla PTM analizi için bir protokol, aynı zamanda bu engellerin birkaç adresleri ve büyük ölçekli PTM profilleme sağlar ve çeşitli PTM'ler arasında çapraz konuşma değerlendirme14. Bu bir-pot iş akışı biyomedikal araştırmacılar için pratik bir yol özetliyor küresel birden fazla PTMs profil, co-modifiye peptidler tanımlamak, ve verimli ve maliyet-etkin bir şekilde PTM crosstalk çalışma14,15.
Burada, bu yöntem ilk 50 yıl önce16üzerinde çalışıldı mitokondriyal protein aylasyonu inceleyerek sergilenir. Özellikle lizin asetilasyon17 ve süksinilasyon18üzerinde yoğunlaşmıştır , proteinler ve hatta peptid düzeyinde co-modifikasyon bu değişikliklerin birlikte oluşumu da dahil olmak üzere. Çalışma da sirtuin 5 (SIRT5) nakavt fare modeli kullandığından, asetilasyon ve süksinilasyon alanlarının zenginleşmesine odaklanmak için seçilmiştir. Bu karar, kısas ilasyon alanlarının SIRT5 desuccinylase'nin hedefi olması ve bu nedenle KO farelerde önemli bir düzenleme göstermesi nin beklendiği için alınmıştır. Her iki PTMs biyolojik olarak son zamanlarda Carrico ve ark.19tarafından özetlenen ilgilidir. Genel olarak, asetilasyon gen ekspresyonu ve metabolizması üzerinde önemli etkileri gösterir, ve succinylation kalp metabolizması ve fonksiyon düzenlemek için bildirilmiştir20.
Açıklanan protokol, düşük miktarda protein girdi materyali (örn. 1 mg protein lisat) ile gerçekleştirilebilir ve numune işleme, MS alımı ve veri analizi için harcanan süreyi azaltarak deneyin toplam süresini kısaltabilir. Şekil 1'debir iş akışı şeması verilmiştir. Ayrıca daha da düşük miktarlarda başlangıç materyali (100 μg'a kadar protein lisat, buna göre kullanılan boncuk miktarlarını azaltarak) kullandık ve bu da beklendiği gibi tanımlanmış acylated peptidlerin toplam verimini azaltıyor; ancak, hala son derece değerli sonuçlar ve ölçülebilir acylated peptidler sağlar.
Yukarıdan aşağıya veya orta aşağı iş akışları genellikle proteolitik sindirim yaklaşımları kullanmazken (ve böylece tek bir protein içinde birden fazla PtM'nin bağlantısını korurken), bu protokol PTM tanımlama ve nicelleştirme için ekstra derinlik ve duyarlılık kazanmak için peptid bazlı afinite zenginleştirme yaklaşımına odaklanır (Şekil 1). Buna ek olarak, bu peptit merkezli iş akışı, 1) spektral kitaplıklar oluşturmak için veriye bağımlı kazanım (DDA) kombinasyonu ve etiketsiz bir iş akışında doğru PTM niceliği için 2) veri bağımsız kazanım (DIA) dahil olmak üzere modern kütle spektrometresi yöntemlerikullanır.
DIA iş akışları, örneklenmiş m/z aralığı21'dekitüm peptit sinyallerini kapsamlı bir şekilde parçalayarak tipik DDA taramalar›n› n› örnekleme stochasticity'nin üstesinden gelecektir. Bu özellik, hangi belirli parça iyonlarının peptid içinde değiştirildiğine ilişkin bilgi edinmek daha kolay olduğundan, site lokalizasyonu açısından da son derece yararlıdır. Buna ek olarak, DIA iş akışları özdeş öncül iyonları ile küçük PTM-peptid isoformların tanımlanması ve nicelleştirilmesine olanak sağlar. DIA yöntemleri de kapsamlı her zaman ölçülen belirli karşılık gelen parça iyonları dayalı bir peptid içinde belirli bir PTM site lokalizasyonu belirleyebilirsiniz. Ancak, DDA yaklaşımları genellikle aynı öncül iyon için MS/MS örneklemesini dışlayan ve böylece küçük PTM isoformlarını kaçıran "dinamik dışlama" özelliklerini kullanır.
Burada açıklanan eşzamanlı zenginleştirme stratejisi, birden fazla PTM'nin küresel profilleme ve sayısallaştırılmasından, PTM çapraz konuşmasının incelenmesinden ve çeviri sonrası modifikasyonların dinamik etkileşimlerinin anlaşılmasından yararlanacak çalışmalar için idealdir. Tek bir kombine iş akışında birden fazla zenginleştirilmiş PTM'nin tanımlanması şu şekilde tanımlanmıştır: proteolitik peptidler içeren PTM'nin küresel, seri veya paralel zenginleştirilmesi veya alternatif olarak bozulmamış proteinlerin analizi. Asetiles ve süksinir seri zenginleştirme ile doğrudan karşılaştırıldığında, tek pot metodolojisinin verimliliği çok benzer14olarak kurulmuştur. Bu alternatif protokoller önemli miktarda başlangıç malzemesi ve zaman gerektirir ve son derece pahalı olabilir. Buna karşılık, tek pot protokolü sonraki analiz ve tanımlama ile birden fazla PTM zenginleştirme için ucuz ve verimli bir yöntem sağlar.
Fare karaciğer dokuları SIRT5 nakavt farelerden elde edilir ve burada başlangıç malzemesi olarak kullanılır. Bu protokol aynı zamanda farklı dokulardan veya hücre kültürü deneylerinden protein lisatları için de yapılabilir. Bu protokol dokulardan veya hücre kültürü peletlerinden elde edilen protein lisatlarına uygulanabilir.
Protokol
Protokolde açıklanan tüm deneyler Buck Enstitüsü Kurumsal Hayvan Araştırma Komitesi yönergelerine uyar.
1. Homojendokudan protein çıkarılması ve proteaz ile sindirim
- HPLC sınıfı su ile 8 M üre, 50 mM triethylamonnium bikarbonat (TEAB), 1 μM trihostatin A (TSA), 20 mM nikotinamid, 75 mM sodyum klorür (NaCl), 1x proteaz/fosfataz inhibitörü kokteyli (PIC) son konsantrasyonuna taze olarak lysis tamponunu hazırlayın.
- Bir boncuk değirmeni homogenizer ile uyumlu 2 mL tüp bir steril çelik boncuk ekleyin, sonra tüp içine doku parçası (bezelye büyüklüğünde) yerleştirin. Tamponun doku parçasını kapsadığından emin olmak için kısa bir süre lysis tamponu (500 μL) ve girdap ekleyin (gerekirse daha fazla lysis tampon ekleyin). Tüpleri önceden soğutulmuş adaptör setlerine yerleştirin ve tüplerin homogenizer'in iki adaptörü arasında dengede olmasını sağlar.
- Homojenize örnekleri 2x 25 Hz için 3 dk her 4 °C'de. Doku tamamen homojenize değilse, tüpleri kısa bir süre döndürün ve homojenize lysate'yi yeni etiketlenmiş 1,5 mL'lik bir tüpe aktarın. Daha sonra kalan doku parçasına ilave lisis tamponu ekleyin ve homojenizasyon 2x'i 25 Hz'de 3 dk boyunca tekrarlayın. Homojenizasyon iki tur genellikle doku kırmak için yeterlidir.
- Bir cızırtıcı ile metal boncuk çıkarın. Her numune arasında, cızırdayan hplc sınıfı su, HPLC sınıfı metanol ve HPLC sınıfı su ile tekrar durulayın.
- Homojenleştirilmiş lysates iki tur homojenizasyon uygulandı ve sonicate örnekleri 30 s on/30 s kapalı ve 4 ° C yüksek güç 10 döngüleri için bir ultrasonicator ile birleştirin.
- 14.000 x g'de 4 °C'de 10 dk'da homojenize lysates'i santrifüj edin ve lysate'yi temizleyin. Supernatant 'ı (temizlenmiş lysate) yeni bir 1,5 mL mikrosantrifüj tüpe aktarın, supernatant'ın üstüne oturabilecek yağ tabakasından ve tüpün altındaki enkazdan kaçının.
- Uygun bir seyreltme ile temizlenmiş lysate protein konsantrasyonu ölçmek için bir bicinchoninic asit (BCA) tayini gerçekleştirin (örneğin, 1:20 ve/veya 1:200). BCA sonuçlarına göre, her örnekten 1 mg protein aliquot.
- 4,5 mM dithiothreitol (DTT) 37 °C'de 30 dk boyunca 1400 rpm'de ajitasyon ile proteinleri azaltın. Daha sonra, 10 mM iodoacetamide alkilat proteinleri (IAA) karanlıkta kuluçka ile (çekmece veya dolap yer) oda sıcaklığında (RT) için 30 dakika.
NOT: Alternatif reaktifler Kullanılabilir, Gibi N-etilmaleimid (NEM) Yerine IAA. - Seyreltilmiş numunenin pH'ının 7,0-8,5 arasında olduğundan emin olmak için numunenin 2 M. Spot 1 μL'nin altına seyreltmek için numunelere 50 mM TEAB ekleyin. Her numuneye 1:50 oranında tripsin ekleyin (tripsin-to-protein, wt/wt) ve proteini bir gecede 37 °C'de ajitasyonla sindirin (yaklaşık 14-16 saat).
- Ertesi gün %1 formik aside ulaşmak için %10 formik asit ile sindirin. Girdap ve kısa bir süre spin. Sindirimin pH = 2-3 olduğundan emin olmak için numunenin 1 μL'sini pH şeritlerine ayırın. Çözünmez herhangi bir malzemeyi peletlemek için RT'de 15 dakika boyunca 1.800 x g'lık santrifüj numuneleri.
2. Zenginleşmemiş proteolitik peptidlerin büyük ölçekli katı faz ekstraksiyonu ile tuzdan arındırma
- 10 mg proteini bağlayabilen C18 rekarn içeren kartuşları elde edin. Aşağıdaki adımların her birinde sıvıyı kartuştan çekebilen vakum emmesi kullanmak için bu kartuşları bir vakum cihazına titretin. Her peptit numunesi için bir kartuş belirleyin.
- %19,8 su ile kartuşlara %0,2 formik asitte %800 asetonitril (ACN) ekleyin ve sıvıyı çekmek için vakum emme kullanın. Kartuşların tamamen kurumasını önleyerek bu adımı 1x tekrarlayın.
- Vakum emme ile suya 800 μL %0,2 formik asit ekleyerek kartuşları dengeleyin ve tüm hacmi filtreden geçirin. Bu 2x tekrarlayın. Vakum emme ile kartuşlar üzerine peptidler yükleyin. Vakum emme altında suda % 0,2 formik asit 800 μL ile 2x yıkayın.
- Son adımda peptit eluting toplamak için her kartuşun altında 1,5 mL mikrosantrifüj tüpleri düzenleyin. Vakum emme altında kartuşlarından gelen peptidler, önce %80 ACN%80 ACN ile %0,2 formik asit ve %19,8 su, ardından aynı çözeltinin 400 μL'si ile. Tuzsuz peptid örneklerini vakumlu konsantratörü (2-3 saat) tamamen kurutun.
3. K-asetillated ve K-succinylated peptidlerin immünafinitboncuklarla eş zamanlı zenginleşmesi
- Kurutulmuş peptidleri 1,4 mL soğuk 1x immünafer-afinite (IAP) tamponunda yeniden askıya alın. Girdap karıştırmak ve ~ 7 bir pH sağlamak. 4 °C'de 10 dk için 10.000 x g santrifüj örnekleri. Küçük bir pelet görünebilir.
- Antikor boncukhazırlarken buz üzerinde bir kenara peptidler ayarlayın. K-asetil tüpü ve K-succinyl antikor boncuk bulamacı tüpüne (hacim: tüp başına 100 μL bulamaç), 1 mL soğuk 1x fosfat tamponlu salin (PBS) ekleyin ve pipetleme ile karıştırın. Tüm çözümü yeni bir 1,5 mL tüpe aktarın ve RT'de 30 s için minyatür bir santrifüjde döndürün.
- PBS aspire, herhangi bir boncuk kapalı aspirating önlemek için özen. 1 mL soğuk 1x PBS ile tekrar yıkayarak, RT'de 30 s'lik santrifüj ve PBS'yi havalandırarak 3x yıkayın.
- PBS yaklaşık 440 μL boncuk yeniden askıya. Her PTM tüpündeki boncuk sayısının dörtte biri (üretici tarafından sağlanan 100°L) tek pot zenginleştirme için kullanılır (hem K-asetil hem de K-succinyl antikor boncukları için her immobilize antikordan yaklaşık 62,5 g). Pipet boncuklar birkaç kez iyi karıştırmak için. 100 μL asetil-lizin antikor boncukları çıkarın ve ana karışımın sürekli olarak iyi karışık kalmasını sağlayarak 200 μL önceden kesme uçlarıyla bir tüpe aktarın.
- Her tüpte asetil-lizin antikor ve süksin-lizin antikor eşit parçalara ulaşmak için tüp için süksinil-lizin antikor boncuk100 μL succinyl-lizin antikor boncuklar ile aynı şeyi yapın. Minyatür bir santrifüj içinde 30 s aşağı spin ve jel yükleyici ucu ile medya aspire (boncuklar beyaz dönecek).
NOT: Her tüpün alt kısmında benzer bir boncuk pelet olmalıdır. - Pipet, yeniden askıda olan peptiddoğrudan yıkanmış boncukların üzerine. Peletlerden kaçınmaya dikkat edin (boncukların kurumasını önlemek için hızlıca ekleyin). Peptidleri bir gecede 4 °C'de ajitasyonla boncuklarla kuluçkaya yatırın.
4. Antikor boncuklara bağlı peptidlerin elüsasyonu
- Peptit örneklerini 2.000 x g'de 30 s'de 4 °C'de döndürün. Bağlı olmayan peptidler içeren supernatant çıkarın ve istenirse gelecekteki deneyler için kaydedin. Boncuklara 1 mL soğuk 1x IAP tampon ekleyin ve 5x ters çevirerek karıştırın. 4 °C'de 30 s için 2.000 x g'de spin. IAP çözeltisini aspire edin ve toplam iki yıkama için IAP yıkama adımını 1x tekrarlayın.
- Boncuklara 1 mL soğuk HPLC suyu ekleyin ve 5x ters çevirerek karıştırın. 4 °C'de 30 s için 2.000 x g'de spin. Sudan aspire edin. Toplam üç yıkama için su yıkama adımını iki kez tekrarlayın. Tüpün altında kalan suyu toplamak için 4 °C'de 30 s için 2.000 x g'de ek bir süre döndürün. Düz uçlu jel yükleme ipuçları ile toplanmış olabilir herhangi bir ekstra su aspire. Boncuklar aspirating önlemek için dikkatli olun.
- Boncuklara suya %0,15 trifloroasetik asit ekleyin. Bazen karıştırmak için tüpün altına dokunarak RT 10 dakika boyunca boncuk kuluçka. Minyatür bir santrifüj içinde 30 s için RT de boncuk spin. Eluted peptidler çıkarın ve düz uçlu jel yükleme ucu kullanarak bir kenara koyun.
- Boncuklara suya %0,15 trifloroasetik asit 45 μL ekleyin. Bazen karıştırmak için tüpün altına dokunarak RT 10 dakika kuluçka. Minyatür bir santrifüj içinde 30 s için RT de boncuk spin. Düz uçlu jel yükleme ucunu kullanarak ikinci elüasyonu çıkarın ve ilk elüsasyonla birleştirin.
- Üzerinde taşıma herhangi bir boncuk pelet rt 5 dakika için 12.000 x g kombine eluted peptidler spin. Peptidler örnek çözeltisini yeni bir 500 μL tüpe aktarın.
NOT: Protokol burada duraklatılabilir.
5. Zenginleştirilmiş peptidlerin tuzdan arındırılanması
NOT: C18 resin içeren ucuna en uygun şekilde bağlanmak için numunelerin pH'ı 4'ten az olmalıdır. Ucu kontrol etmek için 0,6 l C18 resin içeren 10 μL pipet ucu ve 10 μL pipet kullanın.
- C18 ucunu 10 μL asetonitile ucuna borulayarak önceden ıslatın. Atık içine asetonitril dağıtın. Bu adımı iki kez daha tekrarlayın.
- Sudaki %0,2 formik asitten 10°L ile 3x yıkayarak ucu dengeleyin. Her dengeden sonra çözeltiyi atık haline getirin.
- Numuneden gelen peptitleri sürekli pipetleme ve ucu ile zenginleştirilmiş peptid numunesi dağıtarak ucun üzerine yükleyin. Pipet yukarı ve aşağı tekrar tekrar en az 20x ve ucundan kalan çözelti dağıtmak.
- Bağlı peptid içeren ucu suda %0,2 formik asit le yıkayın. Çözeltiyi atıklara dağıtın. Bu adımı 9x tekrarlayın.
- %0.2 formik asit, %50 asetonitril ve %49.8 su içeren bir elüsyon tamponunun 10 μL'sini kullanarak yeni bir tüpe elute peptidler. Tekrar tekrar pipet ve yeni tüp 15x içinde çözelti 10 μL dağıtmak. Bu adımı, bir önceki elüsyonla aynı tüpe tekrar tekrar boru ile 10 μL'lik ek bir tahliye tamponu ile tekrarlayın.
- Kuru peptidler tamamen vakum konsantratör (yaklaşık 20 dk). Kurutulmuş peptidleri suda uygun hacimde %0,2 formik asit le resuspend.
NOT: Protokol burada duraklatılabilir.
6. DDA ve DIA kullanarak veri toplama
NOT: Mevcut kütle spektrometrik alete bağlı olarak ayarlanabilen örnekleri DDA ve DIA LC-MS/MS yöntemleri ile analiz edin. Burada, örnekler yüksek çözünürlüklü kütle spektrometresi ile birleşen nano-LC 2D HPLC sistemi kullanılarak analiz edildi.
- Bir hplc sistemi doğrudan bir kütle spektrometre (birçok LC-MS yapılandırmaları ve sistemleri de kullanılabilir) bağlı bir çip tabanlı platform HPLC sistemi ile birlikte kullanın.
- Ters faz HPLC-ESI-MS/MS kullanılarak numunelerin analizi
- Enjeksiyondan sonra peptid karışımlarını C18 ön kolon çipine aktarın ve 10 dakika boyunca 2 μL/dk'da A fazı ile yıkayarak peptidleri tuzdan arındırın. Daha sonra, peptidleri analitik bir kolona aktarın ve 300 nL/dk akış hızında 2-3 saat degrade ile mobil fazA ve B'yi kullanın.
- Daha sonra, 5 dakika üzerinde% 80 mobil faz B rampa, daha sonra 25 dakika geri dengeleme için% 5 B dönmeden önce 8 dakika için% 80 B tutun.
- DDA için bir MS enstrüman yöntemi oluşturun ve aşağıdaki enstrüman tarar deneylerini tanımlayın
- Deney 1: MS1 öncül iyon tonu m/z 400-1.500 (250 ms'lik birikim süresi). Şarj durumları 2-5 ila 200 sayısı iyonları için MS/MS taramalarını tetiklemek için yoğunluk eşiğini ayarlayın. Öncül iyonların dinamik dışlanmasını 60 s olarak ayarlayın.
- Deney 2: MS2 tarak aralığı m/z 100-1.500 arasında dır (döngü başına her 30 ürün iyon tonu başına 100 ms'lik birikim süresi). Çarpışma enerjisini CES = 5'e göre ayarlayın, ardından "yüksek duyarlılıklı ürün iyon tonu modunu" seçin.
NOT: DDA yöntemi, her anket MS1 döngüsü taramasından sonra 30 en bol öncül iyon için MS/MS spektrumları elde edecek ve toplam çevrim süresi ~3.3 s. DDA kazanımları bölüm 7'de açıklandığı gibi spektral kütüphaneler oluşturmak için kullanılacaktır.
- DIA için bir MS enstrüman yöntemi oluşturma ve aşağıdaki alet tarar deneylerini tanımlama.
- Deney 1: ms1 öncül iyon tayini m/z 400-1.250 (250 ms'lik birikim süresi) yapın.
- Deney 2: ms2 taraması m/z 100-1.500 arasında değişen 64 değişken SWATH segmenti için MS/MS ürün iyon taramaları gerçekleştirin (döngü başına her 64 ürün iyon taraması başına 45 ms'lik birikim süresi). Çarpışma enerjisini CES = 10'a göre ayarlayın, ardından "yüksek duyarlılıklı ürün iyon tonu modunu" seçin.
- Schilling ve ark.22 tarafından açıklanan 64 değişken pencere DIA/SWATH satın alma stratejisini kullanarak toplam çevrim süresi ~3,2 s olan etiketsiz nicelik elde edin. Kısaca, bu kazanımda, çarpışma hücresine dar bir kütle aralığı ileten Q1 dörtkutup yerine, değişken pencere genişliği (5 -90 m/z) daha geniş bir pencere, tam kütle aralığı (m/z 400 -1.250 64 SWATH segmentleri ile, her biri 45 ms birikme süresi ile, bir MS1 scan scan içeren bir döngü verim artımlı adımlarla geçirilir 250 ms birikim süresi ile).
NOT: Değişken pencere genişliği, değişken pencere hesap algoritması22 kullanılarak belirli bir m/z aralığında gözlenen tipik MS1 iyon akımının karmaşıklığına göre ayarlanır (daha dar pencereler "meşgul" m/z aralıklarında, az sayıda eluting öncül iyoniçeren m/z aralıklarında geniş pencereler seçilir). Diğer MS enstrüman platformlarında diğer DIA pencere stratejileri uygulanabilir.
7. Veri analizi
NOT: Bazı veri analizi ayarları değiştirilmeli ve belirli denemeye uygun olarak uyarlanmalıdır. Örneğin, seçilen protein veritabanı (FASTA dosyası) numunenin hazırlandığı türe bağlıdır (burada, Mus musculus). Aşağıda, asetillated ve özlü peptidler için zenginleştirilmiş fare örnekleri için veri analizi açıklanmıştır.
- DDA kazanımlarını çözümlemek için bir MS veritabanı arama motoru kullanın. Aşağıdaki gibi bir veritabanı arama motoru yöntemi oluşturun:
- Örnek Açıklama parametreleri için: Örnek Tip altında "Tanımlama" seçin, "Sistein Alkylation" altında "İyodoasetik Asit"seçin, "Sindirim" altında "Trypsin"seçin (Lizin ve arginin'de C-terminal dekoltesi varsayarsak), Özel Faktörler altında "TripleTOF 6600" seçin, Asetilesi makaratasyon vurgusu ve Süksinyas zenginleştirmesini kontrol edin, ve Türler altında Musmusku'yu seçin.
- Belirli İşlem parametreleri için: ID Focus altında "Biyolojik modifikasyonlar" seçin, Veritabanı altında "SwissProt" seçin, Arama Çabası altında "Thorough ID" seçeneğini işaretleyin, "Algılanan Protein Eşiği" altında "0,05 (%10)" seçeneğini belirleyin ve "Sonuçlar Kalitesi" altında "Yanlış Keşif Oranı Analizini Çalıştır"ıkontrol edin. Arama motoru yöntemini kaydedin ve oluşturulan yöntemi kullanarak veritabanı arama motoru tarafından işlenmek üzere kütle spektrometrik ham dosyalarını gönderin.
NOT: Yinelemeli bir işlemde, tüm MS ve MS/MS taramaları ilk ek açıklamalara ve sonuçlara göre arama motoru tarafından otomatik olarak yeniden kalibre edilir.
- Arama tamamlandıktan sonra "İhracat Peptid Özeti" üzerine tıklayın ve bir elektronik tablo yazılımında tüm peptid tanımlama sonuçlarını 99 "güven eşiği" ile filtreleyin (örneğin, Excel; yanlış bulma oranı [FDR] %1).
- "Peptit Özeti" elektronik tablo dosyasında, modifikasyon sütununda PTM ek açıklama "asetilasyonu" ve "süksinilasyon" içeren tüm peptidler için filtre uygulayarak yalnızca asilatif peptidleri ve bunların karşılık gelen proteinlerini sunmak için bir sonuç raporu hazırlayın.
- DIA ham dosyasını daha fazla işlemek ve daha fazla göreli niceleme için MS/MS spektral kitaplıklar oluşturmak için DIA Kantitatif Analiz Yazılımını açın. "Library" sekmesini seçin, ardından (sayfanın alt kısmında) " Veritabanı Arama Motoru "dan "Spektral Kütüphane Oluştur" seçeneğini tıklayın ve DDA ham dosya veritabanı arama sürecinin bir parçası olarak otomatik olarak oluşturulan bir Veritabanı AramaMotoru FDR raporu (*FDR.xlsx dosyası) açın. Ardından "Next" seçeneğini tıklatın ve "LibrarySettings Schema" ve "sonraki" seçeneğini belirleyin. Veritabanı olarak "Uniprot_mouse_proteome" seçeneğini belirleyin, ardından gen ek gösterimi (ontoloji) dosyası olarak "next" ve "goa_mouse" dosyasını tıklatın. Son olarak , "bitiş"'e tıklayın ve spektral kitaplık oluşturulacaktır.
NOT: TheDDA ham veri dosyalarından elde edilen asetilve özlü peptidler, MS1'den öncül iyon taramaları ve MS2'den parça iyon taramaları spektral kütüphanelere eklenecektir (bu, bekletme süresi, MS/MS parçalanma deseni vb.) - Asetilasyon ve süksinyon düzeylerinin göreceli olarak ölçülmesi için DIA kantitatif proteomik analiz yazılımını kullanın ve daha fazla veri analizi için kullanılabilecek aday PTM içeren peptidlerin elektronik tablolarını oluşturun.
- PTM içeren peptidleri analiz etmek ve ölçmek için DIA Kantitatif Analiz Yazılımı'nı açın, şablon analizi şemasını kullanın. Şablon şeması yazılımda "Ayarlar Perspektifi" seçeneğini seçerek kullanılabilir | "DIA Analizi" | "BGS PTMs" (deneye bağlı olarak önemli veya seyrek).
NOT: DIA Kantitatif Analiz Yazılımı'nda BGS PTM analiz şablonunu kullanmak yerine, PTM'ye özel tüm ayarlar bu talimatlara göre el ile ayarlanabilir: 1) "tanımlama" altında , "PTM yerelleştirme" (olasılık kesme = 0,75); 2) içinde "niceleme", seçin "minör peptid gruplama" | "değiştirilmiş sıra"; ve 3) altında "post-analysis", seçin "diferansiyel bolluk gruplandırma" | "minör grup" (niceleme ayarları). Bu ayarlar PTM lokalizasyon özelliğini etkinleştirecek, böylece modifiye peptidler tek tek girişler olarak listelenir ve diferansiyel analizler peptit düzeyinde gerçekleştirilir. - Niceleme Analizini başlatmak için "Pipeline" sekmesini seçin ve "Dosyadan BIR DIA Çözümlemesi Ayarlayın" seçeneğini tıklayın, göreli nicelik için ms dia ham dosyalarını açın. "Spektral Kitaplığı Ata" seçeneğini seçin ve yukarıda oluşturulmuş olan kitaplığı seçin, "load" | "sonraki". "BGS PTMs" analiz şeasını seçin vesonraki" seçeneğini tıklayın. Uygun veritabanı FASTA dosyasını seçin "Uniprot_mouse_proteome" | "sonraki". Örneklere farklı koşullar atayan koşul kurulumunu tanımlayın vesonraki" düğmesini tıklatın. Gen ek açıklama (ontoloji) dosyası olarak "goa_mouse" dosyasını seçin vesonraki" düğmesine tıklayın. Analize genel bakışı gözden geçirin (deneme kurulumunun özeti) ve "çıktı dizini" | "bitirmek". Son olarak, etiketsiz nicel analiz yapmak için "Boru Hattını Çalıştır" seçeneğini tıklayın.
NOT: DIA Kantitatif Analiz Yazılımındaki istatistiksel modüller otomatik olarak FDR analizi yapar, farklı koşulları karşılaştıran ısı haritaları ve yanardağ çizimleri oluşturur, tanımlanmış ve sayısallaştırılmış peptid ve proteinlerin listelerini oluşturur ve Q değerleri ve farklı koşulları karşılaştıran göreli kıvrım değişiklikleri.
- PTM içeren peptidleri analiz etmek ve ölçmek için DIA Kantitatif Analiz Yazılımı'nı açın, şablon analizi şemasını kullanın. Şablon şeması yazılımda "Ayarlar Perspektifi" seçeneğini seçerek kullanılabilir | "DIA Analizi" | "BGS PTMs" (deneye bağlı olarak önemli veya seyrek).
- Alternatif olarak, asetilasyon ve succinylation siteleri için çıkarılan tepe alanları dışa aktardıktan sonra verileri işlemek ve istatistiksel analiz yapmak için DIA veri kümelerinin girişimden kaldırılması için yazılım kullanın.
8. Modifiye peptidlerin veri görselleştirilmesi ve PTM site lokalizasyonunun değerlendirilmesi
- Oluşturulan DIA Kantitatif Analizini açmak için "Analysis" sekmesini ve ardından "load the quantitative Analysis Software Experiment" (kaydedilmiş bir deneme nin açılış ını * seçin. SNE dosyası). *'ye gidin. SNE sonuçları dosyası ve seçin "aç".
- Sol panelde, 64 SWATH kesiminin tümünün genişletilmesi ve görselleştirilmesi için üstten üçüncü ham veri *.wiff dosyasının solundaki oka tıklayın. Segmentin solundaki oka tıklayın [428.7-437.3] belirli kesimi genişletmek ve bu kitle aralığı için tanımlanan değiştirilmiş peptidleri görüntülemek için. Triply yüklü peptid KQYGEAFEK[Asetil]R tıklayın.
NOT: Varsayılan olarak, sağ üst panel genellikle MS2 XIC görüntüler ve alt panel MS1 Izotop Zarf XIC görüntüler- Üst panelde "PTM Yerelleştirme Çizimi" seçeneğini belirleyin. Alt panelde "PTM Yerelleştirme Çizimi" seçeneğini belirleyin.
- PTM Yerelleştirme Çiziminde, toplam PTM lokalizasyon puanı 18,32 olan en üst peptid sırasını "KQYGEAFEK[Asetil]R" seçin. Görünümü genişletmek ve doğrulayan ve çürüten iyonları görselleştirmek için soldaki oka tıklayın. Asetilasyon sitesinin peptit dizisinin K2'de bulunduğunu doğrulayan bu iyona dikkat etmek için "Doğrulama İyonları" yanındaki oka tıklayın, ardından iyon "y3 [+42]" seçeneğini belirleyin.
- PTM Yerelleştirme Çiziminde toplam (çok düşük) PTM lokalizasyon skoru 1 olan ikinci peptit dizisini "K[Asetil]QYGEAFEKR" seçin. Görünümü genişletmek ve doğrulayan ve çürüten iyonları görselleştirmek için soldaki oka tıklayın. "Doğrulama İyonları" nın yanındaki oka tıklayın, ardından "Refuting Ions" yanındaki okta, sonra çıkarılan iyon kromatogramını ve MS/MS spektrumlarını görselleştirmek ve değerlendirmek için bazı parça iyonlarını seçin (Şekil 5).
NOT: Atanan PTM Lokalizasyon Skoru ve görsel inceleme doğru PTM izomerinin KQYGEAFEK[Asetil]R olduğunu gösterirken, diğer olası PTM izomeri K[Asetil]QYGEAFEKR için hiçbir veya minimal kanıt bulunmamaktadır.
Sonuçlar
Şekil 1, fare karaciğerlerinden doku hasat, tripsin ile protein lisats isindirimi için 1 mg protein kullanarak, antikor konjuge boncuklar ile peptidler kuluçka, MS örnekleri edinme ve son olarak çeşitli kantitatif proteomik yazılım paketleri (akademik ve ticari) kullanarak verilerin DIA / SWATH analizi gerçekleştirmek de dahil olmak üzere iş akışının genel bir diyagramgösterir.
Şekil 2A, çoklu PTM zenginleştirme çalışmaları için şu anda kullanılmakta olan alternatif yöntemlerle karşılaştırıldığında, iş akışının zaman çizelgesini ve gerekli numune ve protein miktarlarını gösterir. Tek pot yöntemi bu alternatif yöntemlerin yarısı kadar ve yarım örnek sayısı ile yapılabilir. İki tek PTM zenginleştirme yöntemi ile karşılaştırıldığında, tek pot protokolü de protein miktarının yarısını gerektirir.
Bu protokolün uygulanabilir ve uygun maliyetli bir alternatif olduğu gösterilmiştir. Şekil 2B, modifiye peptid alanlar için ortanca varyasyon katsayısının (CV) tek pot yönteminde tek ptm ve seri PTM zenginleştirmelerine göre daha düşük olduğunu göstermektedir. Şekil 2C,D, tek potlu PTM ve tek PTM zenginleştirme yöntemlerini karşılaştırırken, iki modifikasyon için site düzeyindeki niceliklerin korelasyonları arasında kayda değer bir fark olmadığını göstermektedir. Bu durum peptid düzeyi ve parça düzeyi korelasyonları için de geçerlidir. Tek pot ve seri PTM zenginleştirmeleri karşılaştırırken her üç korelasyon için de aynı gözlem yapıldı. Basisty ve ark.14 tarafından hazırlanan yeni bir raporla ilişkili tüm temel MS ham verileri ve işlenmiş Excel sonuç sayfaları mevcuttur ve MassIVE (MSV00081906) ve ProteomeXchange 'den (PXD008640) indirilebilir.
Genel olarak, antikor zenginleştirme stratejileri, potansiyel epitop tıkanıklığı veya sınırlı özgüllük gibi bazı sınırlamalar gösterse de, bu çalışmada kullanılan antikorlar bağımsız olarak oluşturulan klonların karışımlarıdır ve böylece daha geniş aralıklar özellikleri.
Deneysel sonuçlar PTM çapraz konuşmasını tespit etme ve değerlendirme olasılığını belgelemektedir. Şekil 3, başarılı bir zenginleştirmeden elde edilen verileri görüntüler ve PTM çapraz konuşmasını görselleştiren birden fazla ve farklı asil modifikasyoniçeren bir peptid örneği gösterir. Şekil 3A bir lizin kalıntısı üzerinde asetiled ve diğer insuccinylated bir peptit gösterir, ve Şekil 3B her iki lizinde süksinat aynı peptid gösterir. Bu aynı lizin kalıntısı her iki aylation grupları ile değiştirilebilir olduğunu göstermektedir, ve bu sitede meydana gelen çapraz konuşma olasılığı vardır. Şekil 4, her iki değişikliği de taşımak için 7.1-7.3 bölümlerinde tanımlandığı şekilde tanımlanan lizin artıklarının sayısını göstererek olası PTM çapraz konuşmasına işaret etmektedir.
Şekil 5'in gösterdiği gibi, DIA PTM veri kümelerinin nicel proteomik yazılımla işlenmesi, hangi lizin kalıntılarının değiştirildiğini belirlememizi sağlar. Bu olası PTM crosstalk belirlenmesi için herhangi bir analiz için önemli bir adımdır site yerelleştirme olarak bilinen bir kavramdır. Şekil 5, 8.1-8.3 bölümlerinde (özellikle 8.3.2 ve 8.3. adımlarında) açıklandığı gibi görselleştirilebilen ve değerlendirilebilen her biri için doğrulayıcı ve çürütülen iyonlarla birlikte iki potansiyel izoform görüntüler. Bu bilgilere dayanarak, orijinal örnekte iki izoformdan hangisinin bulunduğunu güvenle tespit edebildik. Doğrulanmış izoform KQYGEAFEKacR'ın MS/MS spektrumu, 42 m/z (asetil grubunun artış kütlesi) ile kaymış olan asetil lisin kalıntısını içeren y iyonlarının (y2-y5)modifiye edilen peptiddeki spesifik lizin kalıntısını doğruladığını açıkça göstermektedir.
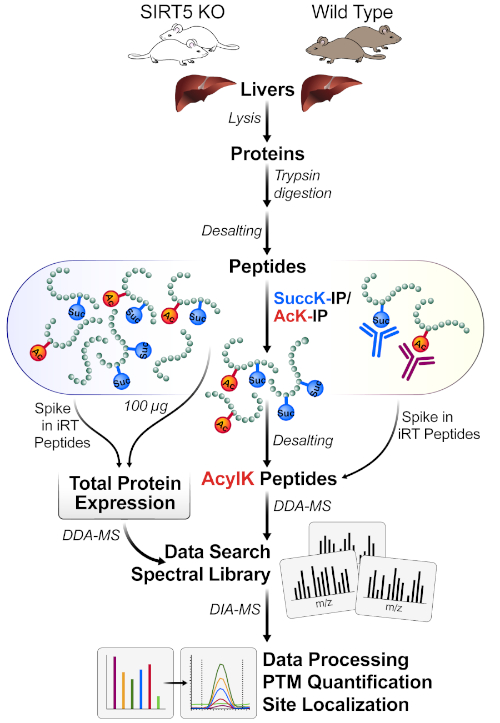
Şekil 1: PTM'lerin tek potlu zenginleşmesi için tipik iş akışı. Doku (burada, karaciğerler) SIRT5 KO ve yabani tip (WT) farelerden hasat edilir ve proteinler lysed, peptidler içine tripsin-sindirilir ve desalted. Peptidler daha sonra süksinil ve asetil antikor boncuk kombinasyonları ile immünafinite ile zenginleştirilmiştir. Paralel MS iş akışları, aylaksasyon alanı tanımlaması (DDA-MS) ve site lokalizasyonu için zenginleştirilmiş asil içeren peptidlerin (protein normalizasyonu için) ve 2) hem 1) küçük lysate protein ekspresyonu değişikliklerini (protein normalizasyonu için) hem de küçük aliquotları ölçer ve ardından nicelleştirme (DIA-MS). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
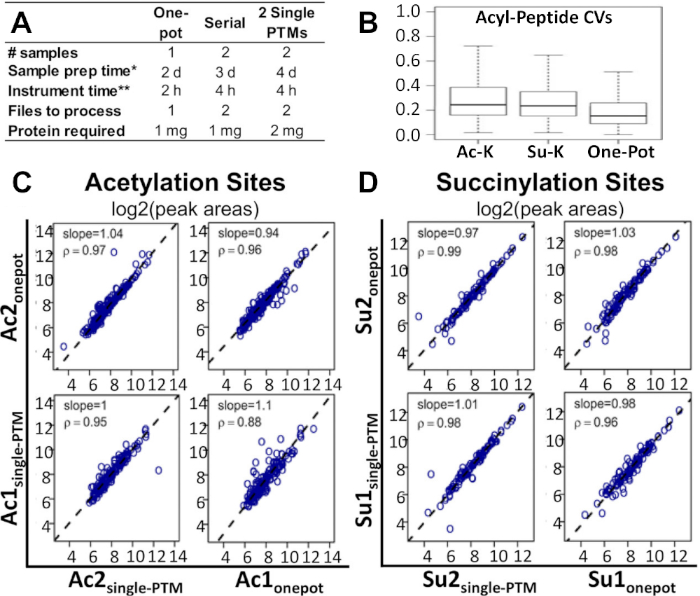
Şekil 2: Tek potiş iş akışının alternatif yöntemlerle karşılaştırılması. (A)Tek potlu iş akışı, seri PTM zenginleştirme ve iki tek PTM zenginleştirme için gereken zaman, maliyet ve malzemelerin karşılaştırılması. (B) Tek pot iş akışı, tek asetil-lizin PTM zenginleştirme ve tek süksin-lizin PTM zenginleştirme arasında CV'ler karşılaştırması. Tek pot iş akışından elde edilen asil peptid pik alanlarını ve tek PTM zenginleştirmelerini karşılaştıran spearman korelasyon analizi:(C) asetilasyon bölgeleri ve (D) süksinilasyon alanları için log2 tepe alanı sonuçlarının karşılık gelen arazileri. Regresyon eğimleri ve korelasyon faktörleri tek tek panellerde gösterilir14. Her bir koşul için iki bağımsız biyolojik kopya işlendi. Bu rakam Basisty ve ark.14'tendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
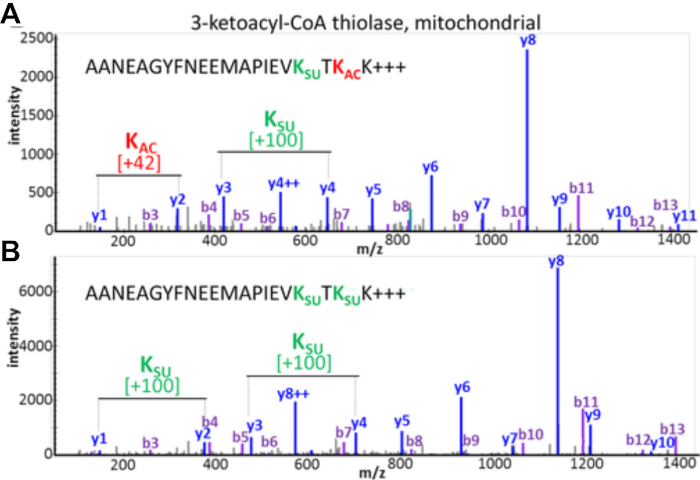
Şekil 3: Lizin kalıntılarının asetilasyon ve süksinilasyon modifikasyonları arasında çapraz konuşma. Aynı amino asit dizisini gösteren ancak farklı PTM'ler ile iki lizin kalıntısı modifiye edilmiş mitokondriyal 3-ketoasil-CoA thiolase gelen triptik peptidlerin MS/MS spektrumları. (A) Peptid AANEAGYFNEEMAPIEVKsuccTKacK ve (B) MS/MS of peptid AANEAGYFNEEMAPIEVKsuccTKsuccK. Bu rakam Basisty ve ark.14'tendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
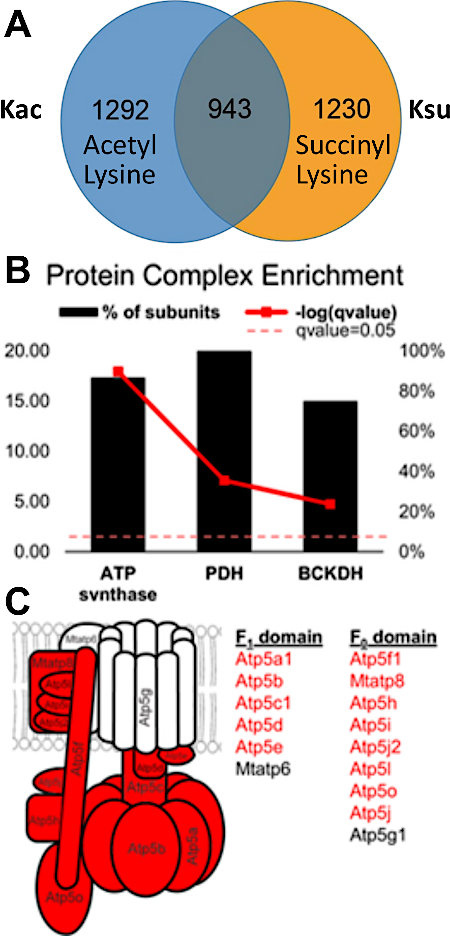
Şekil 4: Protein komplekslerinde asetilve süksinli lizin artıkları arasında örtüşme ve çapraz konuşma. (A) Venn diyagramı 2.235 asetilasyon ve 2.173 süksinyon siteleri arasında çakışma gösteren. Bunlardan 943'ü hem asetilhem de süksildi. SIRT5 (de-succinylase) nakavt faresinden alınan karaciğer analiz edildi ve birçok süksinyalasyon alanı tespit edildi. Aslında, fare karaciğerinde normal olarak gözlenenden daha boldular (modifiye peptidler <0.05 Q değerinde filtrelendi). (B) Hem asetilhem de süksinyonlu siteleri içeren alt birimlerinin yüzdesini gösteren protein kompleksleri (koyu kırmızı çizgi Fisher'ın tam testinde belirlenen önemi temsil eder). (C) ATP synthase kompleksinin diyagramı: kırmızı protein alt birimleri hem asetillated hem de süksinlated siteleri içeren alt birimleri göstermektedir. Bu rakam Basisty ve ark.14'tendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
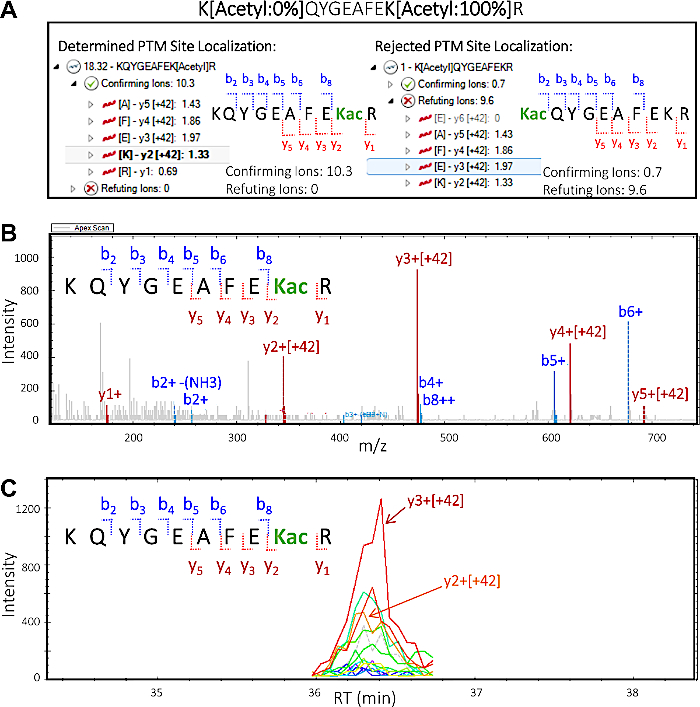
Şekil 5: Kantitatif proteomik yazılım PtM'lerin peptid site lokalizasyonunu deşifre eder. Peptidin MS/MS parçalanmasına bağlı olarak asetil grubunun modifiye olduğu spesifik lizin kalıntısı hakkında bilgi vermek mümkündür. Bu, yazılımın PTM'lerin site lokalizasyonu hakkında değerli bilgiler sunabilme yeteneğini sergiler. (A) Lizin kalıntısı modifikasyonu ve PTM site lokalizasyonu için iki olasılık: KQYGEAFEKacR (solda) ve KacQYGEAFEKR (sağda). Peptidin potansiyel site lokalizasyon izoformlarının her biri için "doğrulama" ve "çürütme" parça iyonları gösterilir. Bu bilgilere dayanarak, puanların doğrulanmaları ve çürütme puanları atanarak örnekte izoform KQYGEAFEKacR'nin varlığını doğrular. (B) Doğrulanmış izoform KQYGEAFEKacR'a karşılık gelen MS/MS spektrumu, asetil lisin kalıntısı (y2 ve üzeri) dahil olmak üzere tüm y iyonlarının +42 m/z artış kütlesi taşıdığını ve bu iyonların asetil modifikasyonuna karşılık geldiğini belirtir. Gözlenen b iyonları modifikasyon içermez. (C) Çıkarılan iyon kromatogram (XIC) y2 ve y3 iyonları kaynaklanan bol tepe alanları ile, her ikisi de teyit izoform KQYGEAFEKacR asetilasyon site makyaj bu rakamın daha büyük bir sürümünü görmek için buraya tıklayın.
Tartışmalar
Bu protokol, PTM çapraz konuşmasını daha etkili bir şekilde anlamak için eşzamanlı çoklu PTM zenginleştirme için yeni bir tekniği açıklar. Bu amaca ulaşmanın alternatif yöntemleri engelleyici zaman alıcı ve pahalı olma eğilimindedir, ve başarılı olmak için protein büyük miktarda gerektirir11,13. Bu protokol, deneyin genel verimliliğini artırmak için aynı anda iki PTM için antikor konjuge boncuklarda kuluçka içeren çok PTM zenginleştirme iş akışı sunar. Bu yöntem aynı zamanda spektral kütüphane üretimi ve DIA MS kazanımları için DDA kullanımını tespit etmek ve parça iyonları22,23azaltılmış girişim ile mevcut peptidler ölçmek içerir. MS veritabanı arama motorları gibi yazılım programları DDA satın almalarından elde edilen verileri analiz etmek ve ölçmek için kullanılırken, Kantitatif Proteomik Yazılım24 ve dia satın almaları tarafından üretilen karmaşık spektrumları yorumlamak için özel DIA Kantitatif Analiz Yazılımı25 gereklidir.
Bu protokol içinde dikkatle izlenmesi gereken birkaç kritik adım vardır. Protokolün ana amacı aynı anda birden fazla PtM için zenginleştirmek olduğundan, antikor-yakınlık zenginleştirme adımı (bölüm 2) deneyin başarısı için önemlidir. Boncuklar üzerinde yıkıntı yaparken, boncukların hiçbirinin kazara aspire edilmemesini sağlamak gerekir. Üre konsantrasyonunun sindirimden önce 1 M'ye kadar seyreltilmesini sağlamak tripsin (adım 1.8) ile de gereklidir. Protein çözünürasyonu için protokolde daha önce 8 M üre gerekmesine rağmen, 1 M'nin üzerindeki üre konsantrasyonları tripsinin enzimatik aktivitesini inhibe edecektir. Buna ek olarak, protokol boyunca numunenin pH'ını sürekli olarak kontrol etmek önemlidir. Bu özellikle sindirim öncesinde önemlidir. Numunenin pH'ı ve tripsin çözeltisi kuluçkadan önce uygun şekilde nötralize edilmezse, birçok dekolte bölgesinde gözden kaçırılabileceği ve daha az peptid tanımlaması ile sonuçlanabileceği verimsiz bir sindirime neden olabilir.
Örnekler hazırlanırken protokolde yapılan birkaç değişiklik yararlı olabilir. 1 mg başlangıç materyalinden elde edilen bir protein lisat için, her PTM tarar tüpünde sağlanan antikor boncuklarının dörtte biri uygun maliyetli bir alternatif olarak kullanılabilir. Kullanılan antikor boncuk miktarı orantılı olarak arttığı sürece, daha iyi sonuçlar için daha fazla sayıda başlangıç malzemesi kullanılabilir. İş akışını geliştirebilecek bir diğer değişiklik de, örnekleri tripsinin ek olarak başka bir proteaz ile sindirmektir. Bu modifikasyon, protein kalıntılarının daha fazla kapsama alanı sağlayarak, kümeslerde daha fazla değişkenliğe neden olur. Gerekli olmamakla birlikte, yüksek dekolte özgüllüğü nedeniyle PTM analizinde kullanılan enzimlerden biri olan tripsinin olması tavsiye edilir26.
Bu protokolün bir sınırlama sıyrık, çalışılan PtM'lerin aynı anda zenginleşebilmesi için benzer kimyalara sahip olması gerektiğidir14. Farklı antikor konjuge boncuklar için prosedürler benzer olmalıdır, benzer elüsasyon koşulları da dahil olmak üzere benzer çözücüler ve çözümler kullanarak, ve tercihen aynı satıcıdan. Bu nedenle, burada özetlenen yöntem sürekli bir örnek olarak asetilasyon ve süksinyas kullanır, her ikisi de antikor konjuge boncuklar kullanın (Hücre Sinyal Teknolojisi, Inc). Bu yöntem teorik olarak herhangi bir sayıda PtM'ye uygulanabilmesine rağmen, protokolün bu konudaki tam sınırlamasını değerlendirmek için ek çalışmalara ihtiyaç olacaktır. Ayrıca, bu bir antikor tabanlı zenginleştirme yöntemi olduğu gibi, yöntem sadece PTM sitelerinin göreceli bir nicel sağlayabilir.
Mevcut çoklu PTM zenginleştirme yöntemleriile karşılaştırıldığında, bu iş akışı daha uygun ve uygun maliyetli bir alternatiftir. Bu deneyden, bu yöntemin etkinliğinin bireysel veya seri zenginleştirmeler gibi alternatif yöntemlerle son derece iyi karşılaştırıldığında olduğu gözlenmiştir. Şekil 2B, modifiye peptid pik alanları için ortanca CV aslında tek PTM zenginleştirmeler ve seri-PTM zenginleştirmeler13göre tek pot yöntemi azalmıştır gösterir. Ayrıca asetilasyon veya süksinilasyon için site düzeyinde ki nicelikleri değerlendiren deneysel sonuçları analiz ettik. Ayrıca, Spearman korelasyon analizi(Şekil 2C,D)tek potluk PTM zenginleştirme tek PTM zenginleştirme iş akışları benzer performans gösterdi. Bu aynı zamanda peptid ve parça düzeyinde korelasyonlar için de geçerliydi. Seri-PTM zenginleştirme ile bir-pot karşılaştırırken her üç korelasyon için yapılan aynı gözlem.
Bu protokol, araştırmacıların PTM crosstalk'a hızlı ve uygun maliyetli bir şekilde büyüleyici biyolojik bilgiler edinmelerini sağlar. İş akışının DIA bileşeni araştırmacıların PTM'ler hakkında daha fazla bilgi sağlamasına olanak sağlar, çünkü site lokalizasyonu hakkında bilgi sağlar ve PTM'lerin düşük site doluluk oranı gibi zorlukların üstesinden gelmektedir. Bu yöntem kullanılarak aynı anda kaç PtM'nin zenginleştirilebildiğini değerlendirmek için takip deneyleri yapılabilir. Bu iş akışının gelecekteki bir iyileştirme daha fazla site yerelleştirme ve PTM site doluluk analizini otomatikleştirmek için daha gelişmiş yazılım platformları geliştirilmesi içerebilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Buck Enstitüsü'ndeki (1S10 OD016281) TripleTOF sistemi için NIH ortak enstrümantasyon hibesinin desteğini kabul ediyoruz. Bu çalışma ayrıca Ulusal Alerji ve Bulaşıcı Hastalıklar Enstitüsü (R01 AI108255-B.S.) ve Ulusal Diyabet ve Sindirim ve Böbrek Hastalıkları Enstitüsü (R24 DK085610, Eric Verdin; R01 DK090242 Eric Goetzman için). X.X. Ulusal Sağlık Enstitüleri (NIH hibe T32GM8806, Judith Campisi ve Lisa Ellerby için) bir hibe tarafından desteklenen, NB Glenn Vakfı Tıbbi Araştırma için doktora sonrası burs tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 M Triethylammonium biocarbonate buffer (TEAB) | Sigma Aldrich, St. Louis, MO, USA | T7408 | |
| Acetonitrile, Burdick and Jackson LC-MS grade | Burdick and Jackson, Muskegon, MI, USA | 36XL66 | |
| Bioruptor sonicator | Diagenode, Denville, NJ, USA | B01020001 | |
| C18 pre-column chip (200 µm x 6 mm ChromXP C18-CL chip, 3 um, 120 A) | SCIEX, Framingham, MA, USA | 5015841 | |
| C18-CL chip (75 µm x 15 cm ChromXP, 3 µm, 300 Å) | SCIEX, Framingham, MA, USA | 804-00001 | |
| Dithiothreitol (DTT) | Sigma Aldrich, St. Louis, MO, USA | D9779-5G | |
| Eppendorf Thermomixer Compact | Eppendorf AG, Hamburg, Germany | T1317-1EA | |
| Eppendorf Tube (2.0 mL Safelock) | Eppendorf AG, Hamburg, Germany | 22363352 | |
| Formic acid | Sigma Aldrich, St. Louis, MO, USA | F0507-500ML | |
| Indexed retention time (iRT) normalization peptide standard | Biognosys AG, Schlieren, Zurich, Switzerland | Ki-3002-2 | |
| Iodoacetamide (IAA) | Sigma Aldrich, St. Louis, MO, USA | I1149-25G | |
| mapDIA | web link | software for interference removal of DIA datasets | |
| Methanol, Burdick and Jackson LC-MS grade | Burdick and Jackson, Muskegon, MI, USA | BJLC230-4 | |
| PURELAB flex 1 ultrapure water dispenser | VWR International, Radnor, PA, USA | 89204-088 | |
| mProphet in Skyline | incorporated in Skyline | integrated statistical algorithms for FDR assessments | |
| Oasis HLB SPE cartridges | Waters Corp., Milford, MA, USA | WAT094225 | cartridges for desalting protein lysates, up to 50 mg material |
| Phosphate buffered saline solution | Life Technologies | 10010023 | |
| Pierce BCA Assay | Thermo Fisher Scientific, Waltham, MA, USA | 23225 | |
| ProteinPilot 5.0 - 'MS database search engine' | SCIEX, Framingham, MA, USA | software download SCIEX | MS database search engine |
| PTMScan Succinyl-Lysine Motif [Succ-K] Kit #13764 | Cell Signaling Technology | 13764 | antibody beads for affinity enrichment |
| PTMScan Acetyl-Lysine Motif [Ac-K] Kit #13416 | Cell Signaling Technology | 13416 | antibody beads for affinity enrichment |
| Sequencing-grade lyophilized trypsin | Life Technologies | 23225 | |
| Skyline - 'Quantitative Proteomics Software' | MacCoss lab (academic) | open source software | Quantitative Proteomics Software (academic) |
| Spectronaut - 'DIA Quantitative Analysis Software' | Biognosys AG, Schlieren, Zurich, Switzerland | Sw-3001 | DIA Quantitative Analysis Software / PTM site localization |
| Thermo Scientific Savant SPD131DDA Speedvac Concentrator | Thermo Fisher Scientific, Waltham, MA, USA | SPD131DDA-115 | instrument to concentrate liquid volume of samples |
| TissueLyser II | Qiagen, Hilden, Germany | 85300 | instrument for efficient lysis of tissue |
| Trifluoroacetic acid (TFA) | Sigma Aldrich, St. Louis, MO, USA | T6508-1L | |
| TripleTOF 6600: orthoganol quadrupole time-of-flight (QqTOF)mass spectrometer | SCIEX, Framingham, MA, USA | Per quote | high resolution mass spectrometer |
| Ultra Plus nano-LC 2D HPLC system | SCIEX, Eksigent Division, Framingham, MA, USA | Model #845 | chromatographic separation system |
| Urea | Thermo Fisher Scientific, Waltham, MA, USA | PI29700 | |
| Water, Burdick and Jackson LC-MS | Burdick and Jackson, Muskegon, MI, USA | 600-30-76 | |
| ZipTip C18 Pipette Tips, P10 | Merck Millipore Ltd, Tullagreen, Carrigtwohill, Co. Cork, IRL | ZTC18S096 | C-18 resin loaded tips for desalting of peptide mixtures |
Referanslar
- Christensen, D. G., et al. Post-translational Protein Acetylation: An Elegant Mechanism for Bacteria to Dynamically Regulate Metabolic Functions. Frontiers in Microbiology. 10, 1604 (2019).
- Deribe, Y. L., Pawson, T., Dikic, I. Post-translational modifications in signal integration. Nature Structural Molecular Biology. 17 (6), 666-672 (2010).
- Sadoul, K., Boyault, C., Pabion, M., Khochbin, S. Regulation of protein turnover by acetyltransferases and deacetylases. Biochimie. 90 (2), 306-312 (2008).
- Swaney, D. L., et al. Global analysis of phosphorylation and ubiquitylation cross-talk in protein degradation. Nature Methods. 10 (7), 676-682 (2013).
- Cohen, P. The regulation of protein function by multisite phosphorylation--a 25 year update. Trends in Biochemical Sciences. 25 (12), 596-601 (2000).
- Grunstein, M. Histone acetylation in chromatin structure and transcription. Nature. 389 (6649), 349-352 (1997).
- Struhl, K. Histone acetylation and transcriptional regulatory mechanisms. Genes and Development. 12 (5), 599-606 (1998).
- Mocciaro, A., Rape, M. Emerging regulatory mechanisms in ubiquitin-dependent cell cycle control. Journal of Cell Sciences. 125 (Pt 2), 255-263 (2012).
- Lopez-Otin, C., Hunter, T. The regulatory crosstalk between kinases and proteases in cancer. Nature Reviews in Cancer. 10 (4), 278-292 (2010).
- Du, Z., et al. DNMT1 stability is regulated by proteins coordinating deubiquitination and acetylation-driven ubiquitination. Science Signalling. 3 (146), (2010).
- McManus, F. P., Lamoliatte, F., Thibault, P. Identification of cross talk between SUMOylation and ubiquitylation using a sequential peptide immunopurification approach. Nature Protocols. 12 (11), 2342-2358 (2017).
- Venne, A. S., Kollipara, L., Zahedi, R. P. The next level of complexity: crosstalk of posttranslational modifications. Proteomics. 14 (4-5), 513-524 (2014).
- Mertins, P., et al. Integrated proteomic analysis of post-translational modifications by serial enrichment. Nature Methods. 10 (7), 634-637 (2013).
- Basisty, N., Meyer, J. G., Wei, L., Gibson, B. W., Schilling, B. Simultaneous Quantification of the Acetylome and Succinylome by 'One-Pot' Affinity Enrichment. Proteomics. 18 (17), e1800123 (2018).
- Wang, G., et al. Regulation of UCP1 and Mitochondrial Metabolism in Brown Adipose Tissue by Reversible Succinylation. Molecular Cell. 74 (4), 844-857 (2019).
- Verdin, E., Ott, M. 50 years of protein acetylation: from gene regulation to epigenetics, metabolism and beyond. Nature Reviews Molecular Cell Biology. 16 (4), 258-264 (2015).
- Rardin, M. J., et al. Label-free quantitative proteomics of the lysine acetylome in mitochondria identifies substrates of SIRT3 in metabolic pathways. Proceedings of the National Academy of Science U. S. A. 110 (16), 6601-6606 (2013).
- Rardin, M. J., et al. SIRT5 regulates the mitochondrial lysine succinylome and metabolic networks. Cell Metabolism. 18 (6), 920-933 (2013).
- Carrico, C., Meyer, J. G., He, W., Gibson, B. W., Verdin, E. The Mitochondrial Acylome Emerges: Proteomics, Regulation by Sirtuins, and Metabolic and Disease Implications. Cell Metabolism. 27 (3), 497-512 (2018).
- Sadhukhan, S., et al. Metabolomics-assisted proteomics identifies succinylation and SIRT5 as important regulators of cardiac function. Proceedings of the National Academy of Science U. S. A. 113 (16), 4320-4325 (2016).
- Collins, B. C., et al. Multi-laboratory assessment of reproducibility, qualitative and quantitative performance of SWATH-mass spectrometry. Nature Communications. 8 (1), 291 (2017).
- Schilling, B., Gibson, B. W., Hunter, C. L. Generation of High-Quality SWATH((R)) Acquisition Data for Label-free Quantitative Proteomics Studies Using TripleTOF((R)) Mass Spectrometers. Methods in Molecular Biology. 1550, 223-233 (2017).
- Meyer, J. G., Schilling, B. Clinical applications of quantitative proteomics using targeted and untargeted data-independent acquisition techniques. Expert Reviews in Proteomics. 14 (5), 419-429 (2017).
- MacLean, B., et al. Skyline: an open source document editor for creating and analyzing targeted proteomics experiments. Bioinformatics. 26 (7), 966-968 (2010).
- Sticker, A., Martens, L., Clement, L. Mass spectrometrists should search for all peptides, but assess only the ones they care about. Nature Methods. 14 (7), 643-644 (2017).
- Olsen, J. V., Ong, S. E., Mann, M. Trypsin cleaves exclusively C-terminal to arginine and lysine residues. Molecular Cell Proteomics. 3 (6), 608-614 (2004).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır