Method Article
העשרת אהדה בו של שני שינויים שלאחר ההעברה לקוונפיקציה ולוקליזציה לאתר
In This Article
Summary
זרימת עבודה זו מתארת את ביצועי הזמן והעשרת העלויות היעילות של שינויים מרובים בחלבון שלאחר ההעברה (לפטין) בו זמנית עבור ניתוח פרוטמית גלובלי כמותי. הפרוטוקול מנצל את העשרה ברמת הפפטיד PTM עם נוגדנים מרובה מצוחים, ואחריו נתונים עצמאיים רכישה המסה ניתוח ספקטרומטר מאסה כדי לקבל תובנות ביולוגיות לתוך הוצלב PTM.
Abstract
לימוד שינויים מרובים שלאחר ההעברה (לפטין) של חלבונים הוא צעד מכריע כדי להבין הצלבות PTM ולקבל תובנות הוליסטי יותר לתפקוד חלבון. למרות החשיבות של מחקרים העשרה מרובי PTM, מחקרים מעטים לחקור יותר PTM אחד בכל פעם, בשל חלקית על ההוצאות, זמן, וכמויות חלבון גדול נדרש לבצע ניתוח פרוטמית גלובלי מרובים של לפטין. "אחד הסיר" הקרבה המפורטת בפרוטוקול זה גוברת על המחסומים הללו על ידי המתיר זיהוי סימולטני וקוונפיקציה של פפטידים עם שאריות ליזין המכילים מרחרחון וסורחון בכמות נמוכה של דגימה קלט. הפרוטוקול כולל הכנת מחלת חלבון מתוך כבדי העכבר של SIRT5 הסתרה, הביצועים של טריפסין העיכול, העשרה לפטין, וביצועים של ניתוח ספקטרומטרי מסה באמצעות הרכישה עצמאית נתונים (DIA) זרימת עבודה. מאחר שזרימת עבודה זו מאפשרת העשרה של שתי מילישניות ממדגם זהה בו זמנית, היא מספקת כלי מעשי לחקר הוצלב PTM מבלי לדרוש כמויות גדולות של דגימות, וזה מפחית מאוד את הזמן הנדרש עבור הכנה לדוגמה, נתונים רכישה וניתוח. רכיב ה-DIA של זרימת העבודה מספק מידע מקיף הספציפי ל-PTM. זה חשוב במיוחד כאשר לימוד לוקליזציה של האתר PTM, כמו DIA מספק סטים של יוני קטעים שיכולים להיות מפוענח מבחינה חישובית כדי להבדיל בין לוקליזציה שונים PTM isoforms.
Introduction
מספר עצום של שינויים שלאחר המעבר באופן דינאמי להסדיר חלבונים ומסלולים באמצעות אפקטים על הפעילות1, איתות2, ומחזור3,4. לדוגמה, מופעלות החלבונים מופעלים או מנוטרלים על-ידי הוספת קבוצות פוספט5, ומרחרחון ושינויים אחרים מספקים מנגנון לשינוי מבנה כרומטין ומשמשים כמנגנוני הרגולציה הטרנססוניים6,7. בשנים האחרונות, הראיות נטען כי עבודה מרובים לפטין בקונצרט או להתחרות כדי להסדיר את תפקוד החלבון או פעילות8,9,10,11. לכן, הבנת הצלבות PTM היא הצורך המתעוררים במחקר PTM. עם זאת, מרבית זרימות העבודה הזמינות לזיהוי ולכמת אתרי PTM להתמקד בשינויים בודדים, ולא הגומלין של שינויים מרובים. זרימת העבודה המתוארת מתאמת שינוי מסוים בחלבון "נקודות חמות" ושאריות ליזין שהשתנו על-ידי מספר מרובה של מיליפטין.
יש צורך הולך וגובר בקהילה המדעית בשביל שיטות שונות ללמוד במקביל בו12. רוב השיטות כדי לזהות ולכמת באופן כללי את האתרים של סוגים מרובים של לפטין הם מאתגרים בשל העלויות הגבוהות וכמות הרקמות הנדרשות12,13. לא רק הם ניסויים העשרה multi-PTM הזמן צורכת מבחינת ההכנה לדוגמה, רכישת נתונים, ניתוח נתונים, אבל מחקרים אלה דורשים בדרך כלל גדול ולעתים קרובות כמויות של חלבון11. המתואר כאן הוא פרוטוקול להעשרה וניתוח בו של מספר מיני מדינות, אשר גם מטפל בכמה מחסומים אלה ומאפשר יצירת פרופיל PTM בקנה מידה גדול והערכת הצלבות בין שונות לפטין14. זו זרימת העבודה של סיר אחד מתווה דרך מעשית עבור חוקרים ביורפואיים לפרופיל גלובלי מרובים לפטין, לזהות פפטידים שונו, וללמוד ptm הוצלב בדרך יעילה וחסכונית14,15.
כאן, שיטה זו היא לראווה על ידי בחינת אכלציה חלבון מיטוכונדריאלי, אשר נחקרו לראשונה לפני 50 שנים16. זה מתמקד במיוחד על ליזין מרחלציה17 ו סורחון18, כולל המופע המשותף של שינויים אלה על חלבונים ואפילו שיתוף השינוי ברמת פפטיד. מאז המחקר משתמש sirtuin 5 (SIRT5) הסתרה מודל העכבר, זה נבחר להתמקד על העשרה של מרחלציה ואתרי סורחון. החלטה זו נעשתה מכיוון שאתרי הסולציה הם מטרות של SIRT5 דסוינילאז, ולכן הם צפויים להראות upregulation משמעותיים בעכברים קו, מה שהופך אותם לחלק הרלוונטי ביותר במקרה זה. שתי מילישניות הן רלוונטיות ביולוגית כפי שמסוכם לאחרונה על ידי קאריקו ואח '19. באופן כללי, מרחלציה מראה השפעות חשובות על ביטוי גנים ומטבוליזם, וסורחון דווח לווסת את חילוף החומרים של הלב ותפקוד20.
הפרוטוקול המתואר ניתן לבצע עם כמות נמוכה של חומר קלט חלבון (g., 1 מ ג של חלבון ליפוסט) ומפחית את המשך הכולל של הניסוי על ידי הפחתת הזמן שהושקע עבור עיבוד דגימת, MS הרכישה, וניתוח נתונים. תרשים שרטוט של זרימת עבודה מסופק באיור 1. השתמשנו גם כמויות נמוכות יותר של חומר התחלתי (עד 100 μg של חלבון ליפוסט, להקטין את כמויות החרוזים בשימוש בהתאם), אשר כצפוי, מפחית את התשואה הכוללת של פפטידים acylated מזוהה; עם זאת, הוא עדיין מספק תוצאות בעלות ערך רב ופפטידים acylated הניתנות לכימות.
בעוד זרימות עבודה מלמעלה-למטה או הביניים למטה בדרך כלל לא להשתמש בגישות לעיכול פרוטחרדה (ובכך לשמור על הקישוריות של מספר לפטין בתוך חלבון אחד), פרוטוקול זה מתמקד בגישה מבוססת פפטיד העשרה כדי לצבור עומק נוסף רגישות עבור זיהוי PTM וכימות (איור 1). בנוסף, זו זרימת העבודה פפטיד-ממוקד מנצל שיטות מודרניות ספקטרומטר המסה, כולל 1) שילוב של רכישה תלוי נתונים (דה) כדי ליצור ספריות ספקטרליות, ו 2) לרכוש עצמאית נתונים (DIA) עבור כימות PTM מדויק בתהליך עבודה ללא תווית.
זרימות עבודה של DIA להתגבר על מערכת הדגימה של מערכות הסריקה האופייניות של דה-לוד באמצעות מקטעים מגוונים באופן מקיף את כל האותות הפפטיד בטווח של21שנדגמו. תכונה זו גם מועילה מאוד מבחינת הלוקליזציה של האתר, כי קל יותר לקבל מידע לגבי אילו יוני קטעים ספציפיים משתנים בתוך הפפטיד. בנוסף, זרימות עבודה של DIA מאפשרות זיהוי וכימות של מקטין PTM-פפטיד איזוטפסים עם יונים מקודמן זהה. שיטות DIA יכולות גם לקבוע לוקליזציה מסוימת של אתר PTM בתוך פפטיד המבוססת על יוני קטעים מתאימים ספציפיים הנמדדים בכל עת. עם זאת, גישה לעתים קרובות לנצל "הדרה דינמית" תכונות שאינן כוללות דגימה מרובים של MS/MS עבור אותו יון מקודמן, ובכך חסר PTM מינורי.
אסטרטגיית ההעשרה הזמנית המתוארת כאן מתאימה באופן אידיאלי למחקרים שיפיקו תועלת מפרופיל עולמי וככמת של מספר רב של מדים לפטין, בחינת מוצלב PTM, והבנת האינטראקציות הדינמיות של שינויים שלאחר ההעברה. זיהוי של מספר לפטין מועשר בזרימת עבודה אחת משולבת תוארה על ידי: גלובל, סדרתי או מקביל העשרה של PTM המכיל פפטידים בחרדה, או לחילופין על ידי ניתוח של חלבונים שלמים. בהשוואה ישירה עם העשרה סדרתיים של מרחלציה וסורחון, היעילות של מתודולוגיית הסיר החד הוקמה כדומה מאוד ל-14. פרוטוקולים חלופיים אלה דורשים כמויות משמעותיות של חומר התחלתי וזמן יכול להיות יקר באופן גמיש. לעומת זאת, פרוטוקול חד-סיר מספק שיטה זולה ויעילה להעשרה של יותר מ-PTM אחד עם הניתוח והזיהוי הבאים.
רקמות הכבד של העכבר מתקבלים מ SIRT5 הסתרה עכברים ומשמשים כאן כחומר מתחיל. פרוטוקול זה יכול גם להתבצע לקבל חלבון lysates מרקמות שונות או ניסויים בתרבות התא. פרוטוקול זה יכול להיות מוחל על lysates חלבונים המתקבלים מרקמות או כדורי תרבות התא.
Protocol
כל הניסויים המתוארים בפרוטוקול מנחים את ההנחיות לוועדת המחקר של בעלי חיים מוסדיים במכון באק.
1. הפקת חלבון מרקמת הומוגניים ומעיכול עם פרוטאז
- טרי להכין את מאגר הליזה לריכוז הסופי של 8 M שתנן, 50 mM triethylammonium ביקרבונט (TEAB), 1 μM trichoסטטין A, 20 מ"מ ניטינאמיד, 75 mM נתרן כלוריד (הנאל), 1x פרוטאז/פוספאטואז מעכבי קוקטייל (PIC) עם בחינת כיתה מים.
- הוסף אחד מחרוז פלדה סטרילית ל 2 מ"ל צינור תואם עם הומוגניצר חרוז חרוזים, ואז למקם את פיסת הרקמה (אפונה בגודל) לתוך הצינור. הוסף מאגר הליזה (500 μL) ומערבולת לזמן קצר כדי להבטיח את המאגר מכסה את פיסת הרקמה (להוסיף מאגר לפירוק יותר, במידת הצורך). מניחים צינורות על ערכות מתאם מראש מקורר, ומבטיחים כי הצינורות מאוזנים בין שני המתאמים של הומוגניצר.
- הומוגון מדגימות 2x ב -25 הרץ עבור 3 דקות כל אחת ב -4 ° c. אם הרקמה אינה הומוגניים במלואה, סובב את החצוצרות לזמן קצר והעבר את המהגון המתכלה לתוך צינור שפופרת טרי 1.5 mL. לאחר מכן, הוסיפו מאגר פירוק נוסף לחלק השני של הרקמה, וחזרו על ההמגון 2x ב -25 הרץ עבור 3 דקות לכל אחד. שני סיבובים של הומוגון מספיקים בדרך כלל כדי לשבור את הרקמה.
- להסיר את החרוז מתכת עם טוויצר. בין כל דוגמא, שטפו את הטוויצר בעזרת מים מבוססי-כיתה, מתנול, ומים כיתה.
- לשלב את lysates הומוגניים אם שני סיבובים של הומומטר הוחלו וsonicate דגימות עם ultrasonicator עבור 10 מחזורים ב 30 ב/30 ביטול ו-4 ° c על כוח גבוה.
- צנטריפוגה את הגון ליסביטים ב 14,000 x g עבור 10 דקות ב 4 ° צ' כדי לנקות את הליפוסט. העבר את סופרנטנט (נקי ליפוסט) לצינור מיקרוצנטריפוגה חדש 1.5 mL, הימנעות כל שכבת שומן שעשוי לשבת על גבי supernatant וכל פסולת בתחתית הצינור.
- ביצוע חומצה ביוניתית (BCA) בעלת מדידה של ריכוז החלבון של הליפוסט הנקי בדילול מתאים (לדוגמה, 1:20 ו/או 1:200). לדברי bca תוצאות, סדרת מחלקים 1 מ ג של חלבון מכל מדגם.
- הפחת חלבונים ב 4.5 מ"מ dithiothol (DTT) ב 37 ° c עבור 30 דקות עם עצבנות ב 1,400 rpm. לאחר מכן, החלבון האלקין בשנת 10 מ"מ ביותר (הרשות העתיקות) עם דגירה בחושך (מקום במגירה או הקבינט) בטמפרטורת החדר (RT) עבור 30 דקות.
הערה: ניתן להשתמש בריאגנטים אלטרנטיבי, כגון N-אתילמלאימיד (NEM) במקום רשות העתיקות. - להוסיף 50 mM TEAB לדגימות כדי לדלל את הריכוז אוריאה למטה 2 M. ספוט 1 μL של המדגם על נייר pH כדי להבטיח את ה-pH של המדגם מדולל הוא בין 7.0-8.5. להוסיף טריפסין לכל מדגם ביחס של 1:50 (טריפסין לחלבון, wt/wt) ולעכל את החלבון בעצבנות ב-37 ° c ללילה (כ-14-16 h).
- להרוות את מעכל עם 10% החומצה פורמית להגיע 1% חומצה פורמית למחרת. . ומערבולת וסיבוב קצר ספוט 1 μL של המדגם אל רצועות pH כדי להבטיח את התקציר הוא pH = 2-3. צנטריפוגה דגימות ב 1,800 x g עבור 15 דקות ב-RT כדי לגלולה כל חומר לא מסיסים.
2. התפלה של פפטידים מועשר נגד חרדה באמצעות הוצאת בקנה מידה גדול בשלב מוצק
- להשיג מחסניות המכילות סי18 שרף שיכול לאגד עד 10 מ ג של חלבון. להתאים את מחסניות אלה לתוך מכשיר ואקום להשתמש שאיבה ואקום שיכול למשוך את הנוזל דרך המחסנית במהלך כל אחד השלבים הבאים. הגדר מחסנית אחת עבור כל דגימת פפטיד.
- להוסיף 800 μl של 80% acetonitrile (acn) ב 0.2% החומצה פורמית כדי מחסניות עם 19.8% מים להשתמש שאיבה ואקום כדי למשוך את הנוזל דרך. חזור על שלב זה 1x, הימנעות ייבוש של מחסניות לחלוטין.
- מחסניות השפה על ידי הוספת 800 μl של 0.2% החומצה פורמית במים עם שאיבה ואקום כדי למשוך את כל אמצעי האחסון באמצעות המסנן. חזור על 2x זה. לטעון פפטידים על מחסניות עם שאיבה ואקום. כביסה פפטידים 2x עם 800 μl של 0.2% החומצה פורמית במים תחת שאיבה ואקום.
- סדר 1.5 mL מיקרוצנטריפוגה צינורות מתחת לכל מחסנית כדי לאסוף משחררי פפטיד בשלב הסופי. תחת שאיבה ואקום elute פפטידים ממחסניות, הראשון עם 800 μl של 80% acn ב 0.2% פורמית חומצה ו 19.8% מים, אז עם 400 μl של אותו פתרון. נגב את דגימות הפפטיד התפלה לחלוטין בתוך מרכז ואקום (2-3 h).
3. העשרת בו של מacetylated ו-K-סוסועם עם חרוזים של זיקה חיסונית
- השהה מחדש את הפפטידים היבשים ב-1.4 mL של מאגר הזיקה לטיהור האהדה של 1x הקרה (IAP). מערבולת לערבב ולהבטיח pH של ~ 7. דגימות צנטריפוגה ב 10,000 x g עבור 10 דקות ב 4 ° c. גלולה קטנה עשויה להופיע.
- הניחו פפטידים בצד הקרח תוך הכנת מחרוזות נוגדנים. לצינור של K-מרחקסיל ושפופרת של הנוגדן K-סוקסיל חרוז (כרך: 100 μL של שפופרת לצינור), להוסיף 1 מ ל קר מלוחים 1x פוספט באגירה (PBS) ו לערבב על ידי ליטוף. העבר את הפתרון כולו לצינור 1.5 mL חדש ספין בצנטריפוגה מיניאטורי עבור 30 s ב RT.
- מוציא את הערוץ, מטפל. במניעת כיבוי חרוזים לחזור על כביסה 3x על ידי שטיפת שוב עם 1 מ ל של הקרים 1x PBS, תפרידו עבור 30 s ב RT ו להוריד את ה-PBS.
- השהה מחדש את החרוזים בערך 440 μL של PBS. אחד ברבעון של מספר חרוזים בכל צינור PTM (100 μL, שסופקו על ידי היצרן) משמש עבור העשרה סיר אחד (סביב 62.5 μg של כל נוגדן משתמש עבור שני מצנני ו-K-סוקסיל מחרוזת נוגדנים). פיפטה את החרוזים מספר פעמים כדי לערבב היטב. הסר 100 μl של מחרוזת נוגדנים ליזין, להעביר לתוך צינור אחד עם 200 μl טיפים חתוכים, להבטיח כי תמהיל מאסטר נשאר בעקביות היטב מעורב.
- לעשות את אותו הדבר עם חרוזי הנוגדן ליזין הסוקסיל על-ידי הסרת 100 μL של חרוזי נוגדן מסוקסיל-ליזין לצינור כדי להגיע לחלקים שווים של נוגדן מרחלי-ליזין וליזין הנוגדן האלחוטי בכל צינור. ספין למטה עבור 30 s צנטריפוגה מיניאטורי ומלא מדיה עם טיפ מטעין ג'ל (חרוזים יהפוך לבן).
הערה: לתחתית כל צינורית צריכה להיות גלולה מדומה. - מצנפת את הפפטיד מחדש. ישירות על החרוזים הנשטפים להיזהר להימנע כל כדורי (להוסיף במהירות כדי למנוע ייבוש את החרוזים). מודיית את הפפטידים עם חרוזים ב 4 ° c לילה עם עצבנות.
4. הימנעות פפטידים מאוגד לחרוזי נוגדן
- לסובב את דגימות פפטיד ב 2,000 x g עבור 30 s ב 4 ° c. הסר את supernatant המכיל פפטידים לא מאוגדים ולשמור לניסויים עתידיים אם תרצה. הוסף 1 מ ל של מאגר IAP קר 1x לחרוזים כדי לשטוף ולערבב על ידי היפוך 5x. ספין ב 2,000 x g עבור 30 s ב 4 ° c. מטפי את הפתרון IAP ולחזור על IAP לשטוף שלב 1x עבור סכום כולל של שתי שטיפת.
- הוסיפו 1 מ ל של המים הקרים באמצעות החרוזים וערבבו על ידי היפוך 5x. ספין ב 2,000 x g עבור 30 s ב 4 ° c. . מוריד את המים מהמים חזור על שטיפת המים צעד פעמיים על סך של שלוש שטיפות. ספין זמן נוסף ב 2,000 x g עבור 30 s ב 4 ° צ' כדי לאסוף את כל המים הנותרים בתחתית הצינור. כאשר מעלים את כל המים המיותרים שייתכן שנאספו עם שטוח ג'ל טעינה טיפים. להיזהר להימנע מלשים את החרוזים.
- הוסף 55 μL של 0.15% trifluoroacetic חומצה במים על החרוזים. מודטה את החרוזים עבור 10 דקות ב RT תוך כדי לחיצה מדי פעם על החלק התחתון של הצינור לערבב. לסובב את החרוזים על RT עבור 30 s בצנטריפוגה מיניאטורי. הסירו את הפפטידים האלה והניחו בצד באמצעות טיפ שטוח לטעינת ג'ל.
- הוסף 45 μL של 0.15% trifluoroacetic חומצה במים על החרוזים. דגירה עבור 10 דקות ב RT בעת הקשה על החלק התחתון של הצינור מדי פעם כדי לערבב. לסובב את החרוזים על RT עבור 30 s בצנטריפוגה מיניאטורי. הסר את הימנעות השנייה באמצעות טיפ שטוח ג'ל טעינה ולשלב עם הימנעות הראשון.
- ספין את הפפטידים משולבים ב 12,000 x g עבור 5 דקות ב RT כדי לקחת את כל החרוזים כי לשאת. להעביר את הפתרון לדוגמה פפטידים לתוך צינור חדש 500 μL.
הערה: ניתן להשהות את הפרוטוקול כאן.
5. התפלה של פפטידים מועשרים
הערה: ה-pH של דגימות צריך להיות פחות מ 4 עבור איגוד אופטימלי לקצה המכיל סי18 שרף. השתמש בטיפ 10 μL המכיל 0.6 μL של שרף סי18 ו-10 μL צינורות כדי לשלוט על הקצה.
- מראש להרטיב את הטיפ סי18 על ידי ליטוף 10 μL של בייגל לתוך הקצה. . מוותר. חזור על שלב זה פעמיים נוספות.
- באמצעות שטיפת הקצה על ידי כביסה 3x עם 10 μl של 0.2% חומצה פורמית במים. לוותר על הפתרון לפסולת לאחר כל שיווי משקל.
- לטעון פפטידים מן המדגם על הקצה על ידי ליטוף ברציפות מדגם פפטיד מועשר עם הקצה. פיפטה למעלה ולמטה שוב ושוב לפחות 20x ומוותר על הפתרון הנותר מהקצה.
- שטוף את הטיפ המכיל פפטיד מאוגד עם 10 μl של 0.2% חומצה פורמית במים. הפתרון מוותר לפסולת. חזור על שלב זה 9x.
- פפטידים של אליוט לתוך צינור חדש באמצעות 10 μl של מאגר המכיל 0.2% החומצה פורמית, 50% acetonitrile, ו 49.8% מים. פיפטה שוב ושוב מוותר על 10 μL של הפתרון בתוך הצינור החדש 15x. חזור על שלב זה עם תוספת 10 μL של מאגר הימנעות, מלטף שוב ושוב לתוך הצינור באותה מידה של הימנעות הקודמת.
- פפטידים יבשים לחלוטין בתוך מרכז ואקום (כ 20 דקות). להשעות את הפפטידים היבשים בנפח המתאים של 0.2% החומצה פורמית במים.
הערה: ניתן להשהות את הפרוטוקול כאן.
6. רכישת נתונים באמצעות דה ודיה
הערה: לנתח את הדגימות עם השיטות של דה ו-DIA LC-MS/MS, אשר ניתן לכוונן בהתאם לכלי הייצור המסה הזמין. כאן, הדגימות נותחו באמצעות מערכת בדיקות ננו-LC 2D בשילוב עם ספקטרומטר מסה ברזולוציה גבוהה.
- השתמש במערכת מערכות הקשר בשילוב עם מערכת מבוססת שבבים המחוברת ישירות לספקטרומטר מסה (ניתן להשתמש בתצורות ובמערכות רבות של LC-MS).
- ניתוח דגימות באמצעות בדיקות משלב הפוך-ESI-MS/MS
- לאחר הזרקה, להעביר את תערובות פפטיד אל שבב pre-סי18-טור ו desalt הפפטידים על ידי שטיפת עם השלב הנייד A ב 2 μL/min עבור 10 דקות. לאחר מכן, להעביר את הפפטידים לטור אנליטי ו-elute בקצב הזרימה של 300 nL/min עם הדרגתי 2-3 h באמצעות שלבים ניידים A ו-B. באופן ספציפי, השתמש במעבר ליניארי מ 5% בשלב הנייד B כדי 35% השלב הנייד B מעל 80 min.
- לאחר מכן, הכבש את השלב הנייד ב-80% למעלה מ-5 דקות, ולאחר מכן החזק את האחוז ב-80% B למשך 8 דקות לפני שחזור ל-5% B עבור 25 דקות מחדש לשפה.
- בניית שיטת מכשיר MS ל-לוד והגדרת הניסויים הבאים לסריקת כלי נגינה
- ניסוי 1: MS1 לסרוק יון מקודמי מ m/z 400-1500 (זמן הצטברות של 250 אלפיות הראשונה). הגדר את סף העוצמה כדי להפעיל סריקות MS/MS עבור יונים של מדינות חיוב 2-5 ל 200 ספירות. הגדר את החרגה הדינמית של יונים מקודמן ל-60 s.
- הניסוי 2: המוצר MS/MS לסרוק את מוצר עם טווח סריקה MS2 מ m/z 100-1500 (זמן הצטברות של 100 MS לכל כל 30-מוצר לסרוק לכל מחזור). להגדיר את התפשטות האנרגיה התנגשות ל-CES = 5, ולאחר מכן לבחור "מצב רגישות גבוהה מוצר לסרוק את המוצר".
הערה: שיטת ה-א לרכוש את MS/MS ספקטרום עבור 30 היונים המקודשים הנפוצים ביותר אחרי כל סקר MS1 לסרוק לכל מחזור, ואת הזמן המחזור הכולל יהיה ~ 3.3 s. רכישות אדה ישמשו לבניית ספריות ספקטרליות כמתואר בסעיף 7.
- בניית שיטת כלי MS עבור DIA והגדרת הניסויים הבאים לסרוק את המכשיר.
- ניסוי 1: לבצע סריקה MS1 מקודמן מ-m/z 400-1250 (זמן הצטברות של 250 ms).
- הניסוי 2: ביצוע סריקות יון MS/MS מוצר עבור 64 משתנה מקטעי הרצועה עם טווח סריקה MS2 מ m/z 100-1500 (זמן הצטברות של 45 MS לכל 64-מוצר לסרוק את המוצר לכל מחזור). להגדיר את התפשטות האנרגיה התנגשות ל-CES = 10, ולאחר מכן לבחור "מצב רגישות גבוהה מוצר לסרוק את המוצר".
- השתמש ב-64 משתנה באסטרטגיית הרכישה הכוללת של שילינג ואח '22 כדי לקבל כימות ללא תווית עם זמן מחזור כולל של ~ 3.2 s. בקצרה, ברכישה זו, במקום הקוטב Q1 ארבעה משדר טווח מסה צר דרך התא התנגשות, חלון רחב יותר של רוחב חלון משתנה (5 -90 m/z) מועבר בשלבים מצטברים על פני טווח מסה מלא (m/z 400-1,250 עם 64 מקטעי הרצועה, כל אחד עם זמן הצטברות של מספר האלפיות השנייה, מניב זמן מחזור של 45 עם זמן הצטברות של 250 אלפיות הראשונה).
הערה: רוחב חלון המשתנה מותאם בהתאם למורכבות של MS1 ion אופייני הנוכחי נצפתה בתוך טווח m/z מסוימים באמצעות אלגוריתם מחשבון חלון משתנה22 (חלונות צרים יותר נבחרים בטווחים "לא פנויים" m/z, חלונות רחבים בטווחי m/z עם כמה יונים מקודעי מבשר). על פלטפורמות מכשירים אחרים של MS, אסטרטגיות אחרות של חלון DIA יכול להיות מיושם.
7. ניתוח נתונים
הערה: יש לשנות הגדרות ניתוח נתונים מסוימות ולהתאים אותן לניסוי הספציפי. לדוגמה, מסד הנתונים של החלבון (קובץ FASTA) נבחר תלוי במינים שמהם הכין את המדגם (כאן, Mus musculus). להלן, ניתוח הנתונים עבור דגימות העכבר מועשר לacetylated ופפטידים מתופחת מתוארים.
- השתמש במנוע חיפוש במאגר המידע של MS כדי לנתח רכישות לוד. צור שיטה של מנוע חיפוש במסד הנתונים באופן הבא:
- לפרמטרים של תיאור המדגם: בחר "זיהוי" תחת סוג לדוגמה, בחר ב-"חומצה יודואצטט" תחת "ציסטאין אלקיללציה", בחר "טריפסין" תחת "עיכול" (בהנחה ש-C-terminal מפצילות ליזין וארגינין), בחר באפשרות " טריפלתוף 6600" תחת מכשיר, תחת גורמים מיוחדים, בדוק את ההדגשה והעשרה הסורחוןובחר ב
- לקבלת פרמטרי עיבוד ספציפיים: בחר באפשרות "שינויים ביולוגיים" תחת מזהה מיקוד, בחר "סוויספלרוט" תחת מסד נתונים, בדוק "מזהה יסודי" תחת מאמץ חיפוש, בחר "0.05 (10%)" תחת "סף החלבון זוהה", ובדוק "הפעל ניתוח שיעור גילוי שווא" תחת "איכות התוצאות". שמור את השיטה מנוע החיפוש ולהגיש את הנפח ההמוני הגדול הספקטרומטרי לעיבוד על-ידי מנוע החיפוש של מסד הנתונים באמצעות השיטה שנוצרה.
הערה: בתהליך איטראטיבי, כל הסריקות של MS ו-ms/MS מייחסות אוטומטית על-ידי מנוע החיפוש המבוסס על ביאורים ראשוניים ותוצאות.
- לחץ על "לייצא סיכום פפטיד" עם השלמת החיפוש ולסנן את כל התוצאות הזיהוי פפטיד על ידי "סף ביטחון" של 99 בתוכנת גיליון אלקטרוני (למשל, Excel; שיעור גילוי שווא [רוזוולט] של 1%).
- ב "תקציר פפטיד" קובץ גיליון אלקטרוני, מסנן עבור כל הפפטידים המכילים את הביאור ptm "מרחרחון" ו "סורחון" בעמודת השינוי כדי ליצור דוח תוצאות להציג באופן בלעדי את הפפטידים acylated ואת החלבונים המתאימים שלהם.
- כדי לבנות ספריות ספקטרליות MS/MS לעיבוד נוסף של הקובץ הגולמי DIA וכימות יחסית, פתח את התוכנה לניתוח כמותי של DIA. בחר את הכרטיסייה "ספרייה", אז (בתחתית העמוד) לחץ "ליצור ספרייה ספקטרלית" מ "מנוע חיפוש במסד הנתונים" ולפתוח דוח מנוע חיפוש מסדי נתונים רוזוולט (* הקובץ רוזוולט. xlsx), אשר נוצר באופן אוטומטי במסגרת תהליך החיפוש של מסד הנתונים של הקובץ הגולמי. לאחר מכן, לחץ על "הבא" ובחר את "סכימת הגדרות הספריה" ו-"next". בחר "Uniprot_mouse_proteome" כמסד הנתונים, ולאחר מכן לחץ על "הבא" ו-"goa_mouse" כקובץ הביאור גנים (אונטולוגיה). לבסוף, לחץ על "סיום", והספריה ספקטרלית תיווצר.
הערה: מידע על הפפטידים הacetylated והסוחיים מתוך קבצי הנתונים הגולמיים של אדה, סריקות מקודשי מMS1, וסריקות יונים מMS2 ייכללו בספריות הספקטרליות (כולל זמן שמירה, תבנית פיצול MS/MS, וכו '). - השתמש בתוכנה כמותית פרוטאומניקס ניתוח לבצע כימות יחסית של מרחרחון ורמות סורחון וליצור גיליונות אלקטרוניים של המועמד PTM המכילים פפטידים שניתן להשתמש בהם עבור ניתוח נתונים נוסף.
- כדי לנתח ולכמת PTM המכילים פפטידים לפתוח את התוכנה לניתוח כמותי DIA, השתמש בסכימת ניתוח התבנית. סכימת התבנית זמינה בתוכנה על-ידי בחירה באפשרות "הגדרות פרספקטיבה" | מחקר "דיה" | "Bgs לפטין" (או משמעותי או דליל, בהתאם לניסוי).
הערה: במקום להשתמש בתבנית ניתוח BGS PTM בתוכנת הניתוח הכמותי של DIA, כל ההגדרות הספציפיות ל-PTM יכולות להיות גם להגדיר באופן ידני את ההוראות הבאות: 1) תחת "זיהוי", בחר באפשרות "לוקליזציה ptm" (סף הסתברות = 0.75); 2)ב"קוונפיקציה", בחר "קיבוץ פפטיד מינורי" | "רצף משתנה"; ו -3) תחת "לאחר ניתוח", בחר "קיבוץ שפע משלים" | "קבוצה משנית" (הגדרות קוונפיקציה). הגדרות אלה יפעיל את תכונת הלוקליזציה PTM כך הפפטידים ששונו מפורטים כערכים בודדים וניתוח דיפרנציאלי מתבצעים ברמת פפטיד. - כדי להפעיל את ניתוח הכמת, בחר את הכרטיסייה "צינור", ולאחר מכן לחץ על "הגדר ניתוח DIA מתוך קובץ", פתח את הקבצים הגולמיים MS DIA של עניין עבור כימות יחסית. בחר באפשרות "הקצאת ספריה ספקטרלית" ובחר את הספריה שנבנתה לעיל, לחץ על "טען" | "הבא". בחר בסכימת הניתוח "Bgs פטין" ולחץ על "הבא". בחר את קובץ ה-FASTA של מסד הנתונים המתאים "Uniprot_mouse_proteome" | "הבא". הגדר את הגדרת התנאי, המקצה את התנאים השונים לדגימות ולחץ על "הבא". בחר "goa_mouse" כביאור הגן (אונטולוגיה) קובץ ולחץ על "הבא". סקור את סקירת הניתוח (סיכום הגדרת הניסוי) ובחר "ספריית פלט" | "סיום". לבסוף, לחץ על "הפעל צינור" כדי לבצע ניתוח כמותי ללא תווית.
הערה: מודולים סטטיסטיים בתוכנת הניתוח הכמותי של DIA לבצע באופן אוטומטי ניתוח של רוזוולט, ליצור מפות חום ומגרשים הר געש השוואת התנאים השונים, ליצור רשימות של פפטידים מזוהים וחלבונים, ולספק Q-ערכים יחד עם שינויים בקיפול יחסי השוואת תנאים שונים.
- כדי לנתח ולכמת PTM המכילים פפטידים לפתוח את התוכנה לניתוח כמותי DIA, השתמש בסכימת ניתוח התבנית. סכימת התבנית זמינה בתוכנה על-ידי בחירה באפשרות "הגדרות פרספקטיבה" | מחקר "דיה" | "Bgs לפטין" (או משמעותי או דליל, בהתאם לניסוי).
- כחלופה, השתמש בתוכנה להסרת הפרעות של ערכות מידע DIA לעיבוד נתונים וביצוע ניתוח סטטיסטי לאחר ייצוא אזורי השיא המחולצים לאתרי מרחלציה וסורחון.
8. הדמיית נתונים של פפטידים שהשתנו והערכה של לוקליזציה של אתר PTM
- כדי לפתוח ניתוח כמותי של DIA לבחור את הכרטיסייה "ניתוח" ואחריו "טען את הניסוי הכמותי בתוכנה ניתוח" (מתוך ניסוי שמור פתיחת *. קובץ SNE). נווט אל *. SNE תוצאות הקובץ ובחר "פתח".
- בחלונית השמאלית, לחץ על החץ שמשמאל לקובץ הנתונים הגולמיים השלישי *. wiff מלמעלה כדי להרחיב ולהמחיש את כל 64 מקטעי הרצועה. לחץ על החץ משמאל למקטע [428.7-437.3] כדי להרחיב את הקטע המסוים ולהציג את הפפטידים שהשתנו שזוהו עבור טווח מסה זה. לחץ על הפפטיד הטעונה באופן שאינו מופעל.
הערה: כברירת מחדל, החלונית העליונה הימנית מציגה בדרך כלל את ה-MS2 XIC, והחלונית התחתונה מציגה MS1 מעטפת איזוטופ XIC- בלוח העליון, בחר "התאמה לוקליזציה Ptm". בחלונית התחתונה, בחר "מגרש לוקליזציה Ptm".
- במגרש הלוקליזציה של PTM, בחר את רצף הפפטיד העליון "Kqygeafek" R, עם ציון לוקליזציה ptm בסך של 18.32. לחץ על החץ שמאלה כדי להרחיב את התצוגה ולהמחיש את יוני המאשר והתדלוק. לחץ על החץ ליד "מאשרת יוני", ולאחר מכן בחר את יון "3 יו ' [+ 42]" כדי להדגיש את יון מסוים, אשר מאשרת כי האתר מרחרחון ממוקם על K2 של רצף פפטיד.
- במגרש הלוקליזציה PTM לבחור את רצף פפטיד השני "K [מאצטק] QYGEAFEKR" עם סך (נמוך מאוד) ציון לוקליזציה ptm של 1. לחץ על החץ שמאלה כדי להרחיב את התצוגה ולהמחיש את יוני המאשר והתדלוק. לחץ על החץ ליד "מאשרת יונים", ולאחר מכן על החץ ליד "יוני התדלוק", לאחר מכן בחר יוני קטעים מסוימים כדי להמחיש ולהעריך את כרומטוגרם יון מחולץ ו ms/ms ספקטרום (איור 5).
הערה: ציון PTM המוקצה לוקליזציה ובדיקה חזותית מצביעים על כך התיקון הנכון PTM איזוer הוא KQYGEAFEK [מרחריל] R, בעוד ראיות לא או מינימליות קיים עבור PTM האפשרי השני של האחרים K [אצטקסיל] QYGEAFEKR.
תוצאות
איור 1 מציג דיאגרמה כללית של זרימת העבודה, כולל קצירת הרקמה מתוך כבדי העכבר, באמצעות 1 מ ג של חלבון לעכל את החלבון ליפוסט עם טריפסין, פפטידים דגירה עם נוגדן מעלה חרוזים, רכישת דגימות על MS, ולבסוף ביצוע הניתוח DIA/הרצועה של הנתונים באמצעות חבילות תוכנה שונים פרוטאומניקס כ
איור 2A מציג כיצד ציר הזמן של זרימת העבודה וכמויות המדגם והחלבון נדרשים, בהשוואה לשיטות חלופיות המשמשות כיום ללימודי העשרה מרובי-ממדי. ניתן לבצע את שיטת הסיר החד בחצי מהזמן ובמחצית ממספר הדגימות כשיטות חלופיות אלה. בהשוואה לשתי שיטות העשרת היחידות, פרוטוקול חד-סיר דורש גם חצי מכמות החלבון.
פרוטוקול זה הוכח כחלופה אפשרית וחסכונית. איור 2B מראה כי המקדם החציוני של וריאציה (קורות חיים) עבור אזורים פפטיד שונה היה נמוך יותר בשיטה אחת מאשר ב-ptm יחיד ו-serial-ptm enrichments. איור 2ג, D מראה כי, בזמן השוואת ptm בסיר אחד ושיטות העשרה חד-שנתיים, אין הבדלים ראויים לציון בין יחסי הגומלין של ברמת האתר לבין שני השינויים. הדבר נכון גם לגבי יחסי הגומלין ברמת הפפטיד וברמת הרסיס. אותה התבוננות שנערכה עבור כל שלושת הקשרים בעת השוואת הסיר אחד ו-serial PTM enrichments. כל הנתונים הבסיסיים MS raw ועיבוד גליונות תוצאות Excel המשויכים הדו ח האחרונות על ידי בסיסה et al.14 זמינים וניתן להוריד מ מסיבית (MSV00081906) ו-פרוטאוצ'יינג (PXD008640).
באופן כללי, בעוד אסטרטגיות העשרה הנוגדן עשוי להראות מגבלות מסוימות, כגון כאפיפי פוטנציאל הסגר או ספציפיות, הנוגדנים המשמשים במחקר זה הם תערובות של שיבוטים שנוצר באופן עצמאי ובכך לספק טווחים רחבים יותר של . מיוחד למדי
תוצאות נסיוניות מתעד את האפשרות של זיהוי והערכה של הוצלב PTM. איור 3 מציג נתונים מתוך העשרה מוצלחת וממחיש דוגמה עבור פפטיד המכיל שינויים מרובים acyl שונים והמחשה הצלבות ptm. איור 3מראה פפטיד הacetylated על שארית ליזין אחת ומסופחת מצד שני, ואיור 3ב' מראה את הפפטיד המקביל בשני הסינוסים. הדבר ממחיש כי אותו שארית ליזין ניתן לשנות עם שתי קבוצות האקלציה, ויש אפשרות של הוצלב המתרחשים באתר זה. איור 4 מציג את מספר שאריות ליזין שזוהו כמתואר בסעיפים 7.1-7.3 כדי לבצע את שני השינויים, גם הצבעה לקראת הוצלב אפשרי ptm.
כמו איור 5 מדגים, עיבוד הנתונים DIA ptm עם תוכנת פרוטקומניקס כמותית מאפשר לנו להצביע על שאריות מסוימים ליזין משתנים. זהו קונספט הידוע כלוקליזציה של האתר, שהוא צעד חיוני עבור כל ניתוח לקביעת הצלבות של PTM אפשרי. איור 5 מציג 2 איזוטפסים פוטנציאליים יחד עם היונים המאשרים והתדלוק עבור כל אחד שיכול להיות מדומה ומוערך כמתואר בסעיפים 8.1-8.3 (במיוחד צעדים 8.3.2 ו-8.3.3). בהתבסס על מידע זה, הצלחנו לזהות בביטחון מי מבין שני איזוטפסים היה נוכח במדגם המקורי. הספקטרום MS/MS של isoform המאושר Kqygeafe, מדגים בבירור כי y יונים (y2-y5) המכיל את שאריות acetylated ליזין, אשר הוזז על ידי 42 m/z (המסה הקבועה של קבוצת מרחקסיל), אישר את שאריות ליזין ספציפיים ב פפטיד שהשתנה.
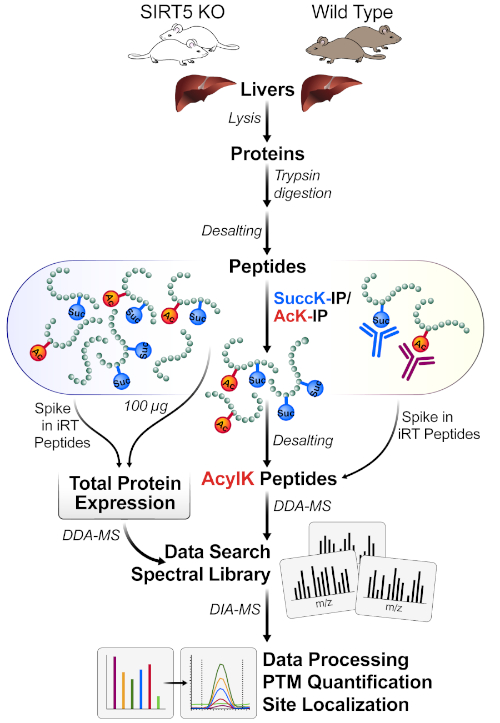
איור 1: זרימת עבודה אופיינית עבור העשרת הסיר של פטין. הרקמה (כאן, כבדים) נקצרו מ SIRT5 KO ו פראי סוג (WT) עכברים, וחלבונים הם הפכו, טריפסין-מתעכל לתוך פפטידים, ו התפלה. פפטידים הם מועשרים לאחר מכן על ידי זיקה חיסונית עם שילובים של חרוזים סוקסיל ומרחפי-נוגדן. מקבילים MS זרימות עבודה למדוד את שניהם 1) קטן של ביטוי חלבון מלאה הביטוי שינויים (עבור נרמול חלבון) ו 2) פפטידים מועשר המכילים מכיל המכיל מזהה acyl האתר (דה-MS) ולוקליזציה של האתר, ואחריו ככמת (DIA-MS). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
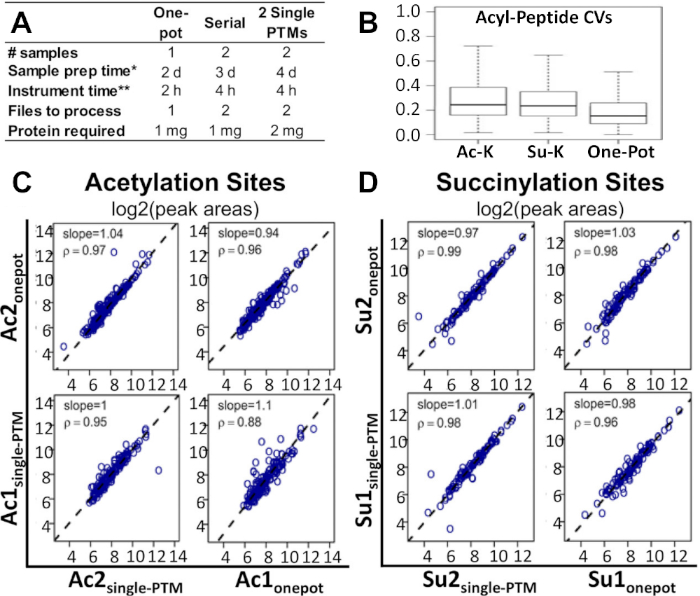
איור 2: השוואת זרימת עבודה של סיר אחד עם שיטות חלופיות. (א) השוואה של זמן, עלויות, וחומרים הנדרשים עבור זרימת העבודה של סיר אחד, העשרה טורית ptm, ושני ptm יחיד enrichments. (ב) השוואת קורות חיים בין זרימת העבודה החד, העשרה בודדת ליזין ptm, והעשרה בודדת ליזין ptm. ניתוח מתאם ספיטמן השוואת אזורי הפסגה של האקקסיל המתקבלים מזרימת העבודה של סיר אחד, ו-PTM יחיד enrichments: מגרשים המקביל של תוצאות אזור שיא log2 עבור (C) מרחלציה אתרים ו-(ד) סורחון אתרים. מדרונות הרגרסיה וגורמי המתאם מצוינים בלוחות הבודדים14. שני משכפל ביולוגי עצמאי עובדו עבור כל אחד מהתנאים. דמות זו השתנתה מתוך בסיליסטי ואח '14. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
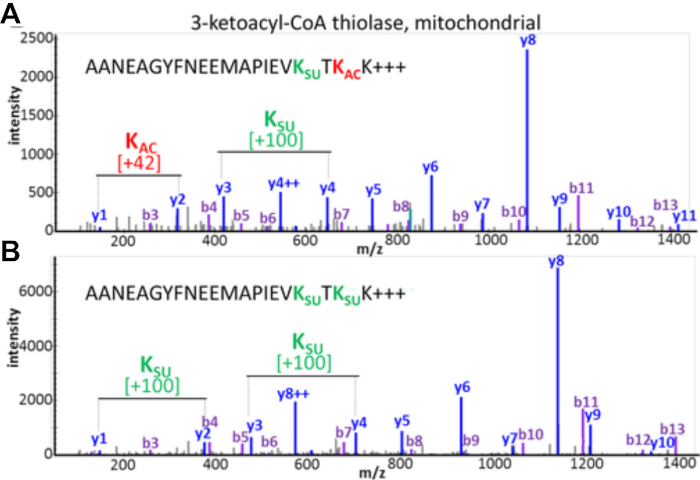
איור 3: הוצלב בין מרחלציה וסורחון שינויים של שאריות ליזין. MS/MS ספקטרום של פפטידים טריפטיים מ מיטוכונדריאלי 3-באקקסיל-CoA thiolase כי להראות את אותו רצף חומצות אמינו, אבל שונו על שני שאריות ליזין עם שונה לפטין. (א) MS/ms של פפטיד (ב) טרשת נפוצה (ב) ms/ms של פפטיד לאחר מפיייב כפיר k 'הג המאביק. דמות זו השתנתה מתוך בסיליסטי ואח '14. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
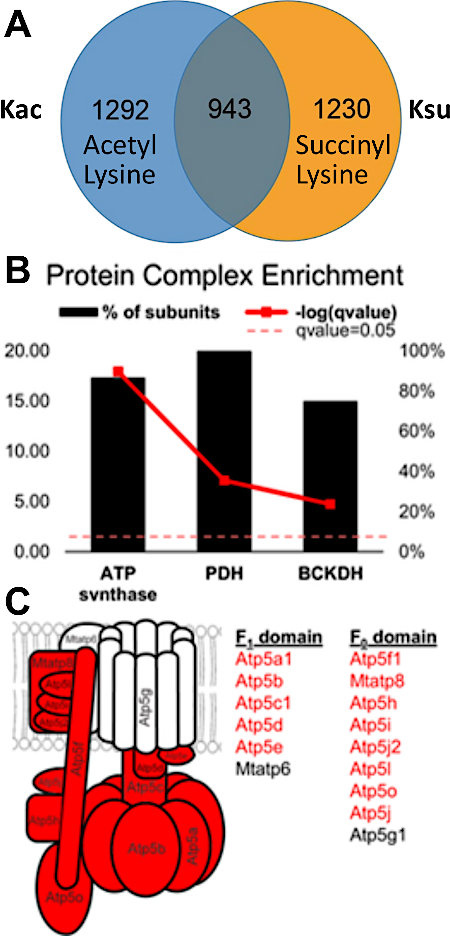
איור 4: חפיפה והצלבות בין שאריות ליזין הacetylated והתמציתית-דוגמאות ספציפיות למערכות חלבונים. (א) דיאגרמת חיתוך-קבוצותהמציגהחפיפה בין 2,235 מרחלציה ו-2,173 אתרי סורחון. מתוך אלה, 943 האתרים היו acetylated ומסובטים. הכבד מתוך SIRT5 (דה סוסוקלז) העכבר היה מנותח, ואתרי סורחון רבים זוהו. למעשה, הם היו יותר בשפע מאשר בדרך כלל נצפתה בכבד העכבר (פפטידים שונו היו מסוננים בערך Q של < 0.05). (ב) מתחמי חלבונים המראים את אחוז היחידות המשנה שלהם, המכילים גם acetylated ואתרים מסווניים (קו אדום מודגש מייצג את המשמעות כפי שנקבע במבחן המדויק של פישר). (ג) דיאגרמת מורכבות של ATP: יחידות המשנה של החלבון באדום מתארות את יחידות המשנה המכילות הן acetylated והן אתרים מסורזים. דמות זו השתנתה מתוך בסיליסטי ואח '14. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
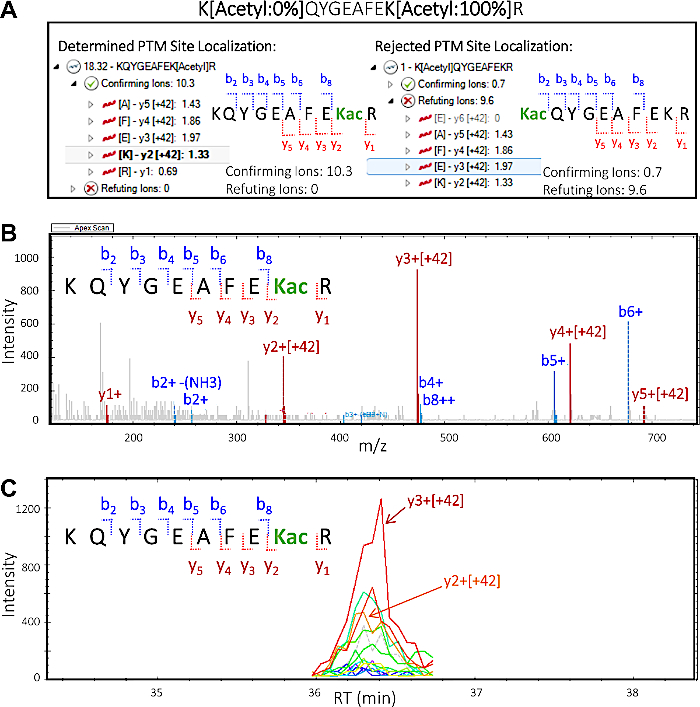
איור 5: תוכנת פרוטקומניקס כמותית הוא את הלוקליזציה של אתר פפטיד. בהתבסס על פיצול MS/MS של פפטיד, ניתן לספק מידע על השאריות ליזין ספציפי הקבוצה מרחלקסיל משנה. זה מציג את היכולת של התוכנה להציע מידע רב ערך על הלוקליזציה של האתר של לפטין (א) שתי אפשרויות של שינוי ליזין שאריות ו PTM האתר לוקליזציה: KQYGEAFEkacR (משמאל) ו kacqygeafekr (מימין). "מאשרת" ו-"התדלוק" יונים קטעים מוצגים עבור כל אחד מאתרי הלוקליזציה של האתר הפוטנציאלי של הפפטיד. בהתבסס על מידע זה, מאשרים ציונים ותוצאות התדלוק מוקצים, המאשר את הנוכחות של איזוטופס KQYGEAFEKacבמדגם. (ב) MS/ms הספקטרום המתאים האיזוטופס מאושר KQYGEAFEkacR המציין כי כל יוני y כולל שאריות acetylated ליזין (y2 ומעלה) לשאת מסה תוספת של + 42 m/z, אשר מתאים לשינוי מרחקסיל. יונים שנצפו b אינם מכילים את השינוי. (ג) מחולץ יון כרומאטוגרמה (XIC) עם אזורים שיא שופע הנובע y2 ו-y3 יונים, שניהם מהווים את האתר מרחרחון ב ISOFORM המאושר KqygeafekacR. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
פרוטוקול זה מתאר טכניקה מקורית של העשרה PTM בו מרובים כדי להבין בצורה יעילה יותר את הוצלב PTM. שיטות חלופיות להגיע למטרה זו נוטות להיות מצרך ארוך ויקר בזמן, והם דורשים כמויות גדולות של חלבון כדי להצליח11,13. פרוטוקול זה מציג את זרימת העבודה העשרה PTM המערבת הדגירה של הנוגדן חרוזים מצודים עבור שני לפטין בו כדי לשפר את היעילות הכוללת של הניסוי. שיטה זו כרוכה גם השימוש דה עבור הדור הספריה ספקטרלית ורכישות DIA MS כדי לזהות ולכמת את פפטידים נוכח הפרעה מופחתת מיוני קטע22,23. תוכנות, כגון מנועי החיפוש של MS מסד נתונים משמשים לניתוח ומכמת נתונים מרכישות לוד, בעוד תוכנת פרוטאומניקס כמותית24 ו ניתוח מסוים כמותי התוכנה25 יש צורך לפרש את ספקטרום מורכב המיוצר על ידי הרכישות דיה.
ישנם מספר שלבים קריטיים בפרוטוקול זה שיש לעקוב אחריהם בזהירות. ככל שהמטרה העיקרית של הפרוטוקול היא להעשיר עבור מספר רב של מונים בו, השלב ההעשרה של הנוגדן (סעיף 2) הוא קריטי להצלחת הניסוי. בעת ביצוע שוטף על החרוזים, זה הכרחי כדי להבטיח שאף אחד החרוזים לא מנושב בטעות. הבטחת ריכוז אוריאה כבר מדולל ל 1 M לפני העיכול עם טריפסין (שלב 1.8) הוא גם הכרחי. למרות 8 M אוריאה נדרש קודם לכן בפרוטוקול עבור מסיסות חלבון, ריכוזי אוריאה מעל 1 M לעכב את פעילות אנזימטית של טריפסין. בנוסף, חשוב לבדוק בעקביות את ה-pH של המדגם לאורך כל הפרוטוקול. זה חשוב במיוחד לפני העיכול. אם ה-pH של המדגם ואת התמיסה טריפסין אינם מנוטרלים כראוי לפני הדגירה, זה יכול לגרום לעיכול לא יעיל שבו אתרי מחשוף רבים עלולים להיות מחמיץ, וכתוצאה מכך פחות שמות פפטיד.
כמה שינויים בפרוטוקול עשויים להועיל בעת הכנת דגימות. עבור חלבון ליפוסט מתוך 1 מ"ג של חומר התחלתי, רבע של חרוזי נוגדנים המסופקים בכל צינור סריקה PTM ניתן להשתמש כחלופה חסכונית. כמות גדולה יותר של חומר התחלתי ניתן להשתמש לתוצאות טובות יותר, כל עוד כמות של חרוזי נוגדן המשמשים מוגברת באופן פרופורציונלי. שינוי נוסף שיכול לשפר את זרימת העבודה הוא לעכל דגימות עם פרוטאז אחר בנוסף לטריפסין. שינוי זה יגרום להשתנות יותר הפפטידים ביקבו, מתן כיסוי מוגבר של שאריות חלבון. למרות שאין צורך בכך, מומלץ להשתמש בטריפסין כאחד מהאנזימים המשמשים לניתוח PTM בשל המחשוף הגבוהשלה.
הגבלה של פרוטוקול זה היא כי לומדים לחקור את הצורך בchemistries דומים כדי להיות מועשר בו זמנית14. ההליכים עבור מחרוזת נוגדנים שונים החרוזים חייב להיות דומה, ניצול ממיסים ופתרונות דומים, כולל תנאי הימנעות דומים, ורצוי מאותו ספק. מסיבה זו, השיטה המתוארים כאן משתמשת באופן עקבי באצטלציה ובסורחון כדוגמה, שניהם משתמשים בכלי השימוש בנוגדנים בחרוזים (תא איתות טכנולוגיה, Inc). למרות ששיטה זו יכולה תיאורטית להיות מוחלת על כל מספר של פטין, מחקרים נוספים יהיו נחוצים כדי להעריך את המגבלה המדויקת של הפרוטוקול בהקשר זה. יתרה מזו, מאחר שזוהי שיטת העשרה המבוססת על נוגדן, השיטה יכולה לספק רק קוונפיקציה יחסית של אתרי PTM.
בהשוואה לשיטות העשרה הקיימות של מולטי-PTM, זרימת עבודה זו היא חלופה אפשרית וחסכונית יותר. מתוך ניסוי זה, נצפתה כי היעילות של שיטה זו משווה בצורה מאוד טובה עם שיטות חלופיות, כגון enrichments בודדות או טוריות. איור 2B מראה כי קורות חיים חציון עבור שונה אזורי השיא פפטיד הצטמצמה למעשה בשיטה אחת-סיר בהשוואה ל יחיד ptm enrichments ו-serial-ptm enrichments13. ניתחנו עוד את התוצאות הנסיוניות הערכת כימות ברמת האתר לאצטלציה או לסורחון. בנוסף, ניתוח מתאם ספיטמן (איור 2ג, ד) הראה כי העשרת הסיר ptm האחד הופיע באופן דומה לזרימות העבודה העשרה בודדות. הדבר נכון גם לגבי יחסי המין הפפטיד-וברמת הרסיס. אותה התבוננות שנערכה עבור כל שלושת הקשרים בעת השוואת סיר אחד עם העשרה טורית PTM.
פרוטוקול זה מאפשר לחוקרים להפוך תובנות ביולוגיות מרתקות לתוך הוצלב PTM באופן מהיר וחסכוני. רכיב ה-DIA של זרימת העבודה מאפשר לחוקרים להבין יותר אודות האזור, כפי שהוא מספק מידע על הלוקליזציה של האתר ומתגבר על אתגרים כגון תפוסת האתר הנמוכה של לפטין. יוני מקודמן נוטים להיות כלולים עם דה, אשר חשוב במיוחד כאשר לימוד האתר הפרטי, כאשר תפוסת אתרים היא לעתים ניתן לבצע ניסויים מעקב כדי להעריך את הגבול העליון של כמה מילישניות ניתן להעשיר בו זמנית באמצעות שיטה זו. שיפור עתידי של זרימת עבודה זו עשוי לכלול פיתוח של פלטפורמות תוכנה מתקדמות יותר כדי להפוך עוד יותר את הניתוח של לוקליזציה באתר ותפוסת האתר PTM.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
אנו מכירים בתמיכה מתוך מענק מכשור משותף NIH עבור מערכת הטריפלתוף במכון באק (1S10 OD016281). עבודה זו הייתה נתמכת גם על ידי המכון הלאומי לאלרגיה ומחלות זיהומיות (R01 AI108255 to בולשיט) והמכון הלאומי לסוכרת ומחלות עיכול וכליות (R24 DK085610 לאריק Verdin; R01 DK090242 לאריק גועצממן). X.X. היה נתמך על ידי מענק של המכון הלאומי לבריאות (NIH גרנט T32GM8806, לג Campisi ו ליסה Ellerby), N.B. היה נתמך על ידי מלגת דוקטורט מקרן גלן למחקר רפואי.
Materials
| Name | Company | Catalog Number | Comments |
| 1 M Triethylammonium biocarbonate buffer (TEAB) | Sigma Aldrich, St. Louis, MO, USA | T7408 | |
| Acetonitrile, Burdick and Jackson LC-MS grade | Burdick and Jackson, Muskegon, MI, USA | 36XL66 | |
| Bioruptor sonicator | Diagenode, Denville, NJ, USA | B01020001 | |
| C18 pre-column chip (200 µm x 6 mm ChromXP C18-CL chip, 3 um, 120 A) | SCIEX, Framingham, MA, USA | 5015841 | |
| C18-CL chip (75 µm x 15 cm ChromXP, 3 µm, 300 Å) | SCIEX, Framingham, MA, USA | 804-00001 | |
| Dithiothreitol (DTT) | Sigma Aldrich, St. Louis, MO, USA | D9779-5G | |
| Eppendorf Thermomixer Compact | Eppendorf AG, Hamburg, Germany | T1317-1EA | |
| Eppendorf Tube (2.0 mL Safelock) | Eppendorf AG, Hamburg, Germany | 22363352 | |
| Formic acid | Sigma Aldrich, St. Louis, MO, USA | F0507-500ML | |
| Indexed retention time (iRT) normalization peptide standard | Biognosys AG, Schlieren, Zurich, Switzerland | Ki-3002-2 | |
| Iodoacetamide (IAA) | Sigma Aldrich, St. Louis, MO, USA | I1149-25G | |
| mapDIA | web link | software for interference removal of DIA datasets | |
| Methanol, Burdick and Jackson LC-MS grade | Burdick and Jackson, Muskegon, MI, USA | BJLC230-4 | |
| PURELAB flex 1 ultrapure water dispenser | VWR International, Radnor, PA, USA | 89204-088 | |
| mProphet in Skyline | incorporated in Skyline | integrated statistical algorithms for FDR assessments | |
| Oasis HLB SPE cartridges | Waters Corp., Milford, MA, USA | WAT094225 | cartridges for desalting protein lysates, up to 50 mg material |
| Phosphate buffered saline solution | Life Technologies | 10010023 | |
| Pierce BCA Assay | Thermo Fisher Scientific, Waltham, MA, USA | 23225 | |
| ProteinPilot 5.0 - 'MS database search engine' | SCIEX, Framingham, MA, USA | software download SCIEX | MS database search engine |
| PTMScan Succinyl-Lysine Motif [Succ-K] Kit #13764 | Cell Signaling Technology | 13764 | antibody beads for affinity enrichment |
| PTMScan Acetyl-Lysine Motif [Ac-K] Kit #13416 | Cell Signaling Technology | 13416 | antibody beads for affinity enrichment |
| Sequencing-grade lyophilized trypsin | Life Technologies | 23225 | |
| Skyline - 'Quantitative Proteomics Software' | MacCoss lab (academic) | open source software | Quantitative Proteomics Software (academic) |
| Spectronaut - 'DIA Quantitative Analysis Software' | Biognosys AG, Schlieren, Zurich, Switzerland | Sw-3001 | DIA Quantitative Analysis Software / PTM site localization |
| Thermo Scientific Savant SPD131DDA Speedvac Concentrator | Thermo Fisher Scientific, Waltham, MA, USA | SPD131DDA-115 | instrument to concentrate liquid volume of samples |
| TissueLyser II | Qiagen, Hilden, Germany | 85300 | instrument for efficient lysis of tissue |
| Trifluoroacetic acid (TFA) | Sigma Aldrich, St. Louis, MO, USA | T6508-1L | |
| TripleTOF 6600: orthoganol quadrupole time-of-flight (QqTOF)mass spectrometer | SCIEX, Framingham, MA, USA | Per quote | high resolution mass spectrometer |
| Ultra Plus nano-LC 2D HPLC system | SCIEX, Eksigent Division, Framingham, MA, USA | Model #845 | chromatographic separation system |
| Urea | Thermo Fisher Scientific, Waltham, MA, USA | PI29700 | |
| Water, Burdick and Jackson LC-MS | Burdick and Jackson, Muskegon, MI, USA | 600-30-76 | |
| ZipTip C18 Pipette Tips, P10 | Merck Millipore Ltd, Tullagreen, Carrigtwohill, Co. Cork, IRL | ZTC18S096 | C-18 resin loaded tips for desalting of peptide mixtures |
References
- Christensen, D. G., et al. Post-translational Protein Acetylation: An Elegant Mechanism for Bacteria to Dynamically Regulate Metabolic Functions. Frontiers in Microbiology. 10, 1604 (2019).
- Deribe, Y. L., Pawson, T., Dikic, I. Post-translational modifications in signal integration. Nature Structural Molecular Biology. 17 (6), 666-672 (2010).
- Sadoul, K., Boyault, C., Pabion, M., Khochbin, S. Regulation of protein turnover by acetyltransferases and deacetylases. Biochimie. 90 (2), 306-312 (2008).
- Swaney, D. L., et al. Global analysis of phosphorylation and ubiquitylation cross-talk in protein degradation. Nature Methods. 10 (7), 676-682 (2013).
- Cohen, P. The regulation of protein function by multisite phosphorylation--a 25 year update. Trends in Biochemical Sciences. 25 (12), 596-601 (2000).
- Grunstein, M. Histone acetylation in chromatin structure and transcription. Nature. 389 (6649), 349-352 (1997).
- Struhl, K. Histone acetylation and transcriptional regulatory mechanisms. Genes and Development. 12 (5), 599-606 (1998).
- Mocciaro, A., Rape, M. Emerging regulatory mechanisms in ubiquitin-dependent cell cycle control. Journal of Cell Sciences. 125 (Pt 2), 255-263 (2012).
- Lopez-Otin, C., Hunter, T. The regulatory crosstalk between kinases and proteases in cancer. Nature Reviews in Cancer. 10 (4), 278-292 (2010).
- Du, Z., et al. DNMT1 stability is regulated by proteins coordinating deubiquitination and acetylation-driven ubiquitination. Science Signalling. 3 (146), (2010).
- McManus, F. P., Lamoliatte, F., Thibault, P. Identification of cross talk between SUMOylation and ubiquitylation using a sequential peptide immunopurification approach. Nature Protocols. 12 (11), 2342-2358 (2017).
- Venne, A. S., Kollipara, L., Zahedi, R. P. The next level of complexity: crosstalk of posttranslational modifications. Proteomics. 14 (4-5), 513-524 (2014).
- Mertins, P., et al. Integrated proteomic analysis of post-translational modifications by serial enrichment. Nature Methods. 10 (7), 634-637 (2013).
- Basisty, N., Meyer, J. G., Wei, L., Gibson, B. W., Schilling, B. Simultaneous Quantification of the Acetylome and Succinylome by 'One-Pot' Affinity Enrichment. Proteomics. 18 (17), e1800123 (2018).
- Wang, G., et al. Regulation of UCP1 and Mitochondrial Metabolism in Brown Adipose Tissue by Reversible Succinylation. Molecular Cell. 74 (4), 844-857 (2019).
- Verdin, E., Ott, M. 50 years of protein acetylation: from gene regulation to epigenetics, metabolism and beyond. Nature Reviews Molecular Cell Biology. 16 (4), 258-264 (2015).
- Rardin, M. J., et al. Label-free quantitative proteomics of the lysine acetylome in mitochondria identifies substrates of SIRT3 in metabolic pathways. Proceedings of the National Academy of Science U. S. A. 110 (16), 6601-6606 (2013).
- Rardin, M. J., et al. SIRT5 regulates the mitochondrial lysine succinylome and metabolic networks. Cell Metabolism. 18 (6), 920-933 (2013).
- Carrico, C., Meyer, J. G., He, W., Gibson, B. W., Verdin, E. The Mitochondrial Acylome Emerges: Proteomics, Regulation by Sirtuins, and Metabolic and Disease Implications. Cell Metabolism. 27 (3), 497-512 (2018).
- Sadhukhan, S., et al. Metabolomics-assisted proteomics identifies succinylation and SIRT5 as important regulators of cardiac function. Proceedings of the National Academy of Science U. S. A. 113 (16), 4320-4325 (2016).
- Collins, B. C., et al. Multi-laboratory assessment of reproducibility, qualitative and quantitative performance of SWATH-mass spectrometry. Nature Communications. 8 (1), 291 (2017).
- Schilling, B., Gibson, B. W., Hunter, C. L. Generation of High-Quality SWATH((R)) Acquisition Data for Label-free Quantitative Proteomics Studies Using TripleTOF((R)) Mass Spectrometers. Methods in Molecular Biology. 1550, 223-233 (2017).
- Meyer, J. G., Schilling, B. Clinical applications of quantitative proteomics using targeted and untargeted data-independent acquisition techniques. Expert Reviews in Proteomics. 14 (5), 419-429 (2017).
- MacLean, B., et al. Skyline: an open source document editor for creating and analyzing targeted proteomics experiments. Bioinformatics. 26 (7), 966-968 (2010).
- Sticker, A., Martens, L., Clement, L. Mass spectrometrists should search for all peptides, but assess only the ones they care about. Nature Methods. 14 (7), 643-644 (2017).
- Olsen, J. V., Ong, S. E., Mann, M. Trypsin cleaves exclusively C-terminal to arginine and lysine residues. Molecular Cell Proteomics. 3 (6), 608-614 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved