Method Article
تبسيط أخذ العينات وزراعة اليرقات العالمية الأوقيانوسية، أوكوبيورا دييكا
In This Article
Summary
Oikopleura dioica هو كائن حي نموذجي في مختلف مجالات البيولوجيا. نحن نصف أساليب أخذ العينات، وتحديد الأنواع، وإعداد زراعة، وبروتوكولات زراعة للحيوانات وعلف الطحالب. ونسلط الضوء على العوامل الرئيسية التي ساعدت على تعزيز النظام الثقافي ومناقشة المشاكل والقرارات المحتملة.
Abstract
Oikopleura dioica هو chordate planktonic مع قدرة استثنائية للتغذية الفلتر ، وقت التوليد السريع ، والتنمية المبكرة المحفوظة ، وميينوم مدمج. ولهذه الأسباب، يعتبر كائناً نموذجياً مفيداً للدراسات الإيكولوجية البحرية، والبيولوجيا التطورية، وعلم الجينوم. وبما أن البحوث تتطلب في كثير من الأحيان إمدادات ثابتة من الموارد الحيوانية، فمن المفيد إنشاء نظام ثقافة موثوق به ومنخفض الصيانة. هنا نحن وصف طريقة خطوة بخطوة لإنشاء ثقافة O. دييكا. ونصف كيفية اختيار مواقع المعاينة المحتملة، وطرق جمعها، وتحديد هوية الحيوانات المستهدفة، وإعداد نظام الاستزراع. نحن نقدم المشورة في استكشاف الأخطاء وإصلاحها بناءً على تجاربنا الخاصة. كما نسلط الضوء على العوامل الحاسمة التي تساعد على الحفاظ على نظام ثقافة قوي. على الرغم من أن بروتوكول الثقافة المقدمة هنا هو الأمثل ل O. dioica، ونأمل لدينا تقنية أخذ العينات والإعداد الثقافة سوف تلهم أفكارا جديدة للحفاظ على اللافقاريات البحرية الهشة الأخرى.
Introduction
وقد كانت الكائنات الحية النموذجية مفيدة في معالجة العديد من المسائل البيولوجية بما في ذلك تلك المتعلقة بالتنمية، وعلم الوراثة، وعلم وظائف الأعضاء. وعلاوة على ذلك، فإن الكائنات العضوية النموذجية الإضافية تسهل اكتشافات جديدة، وبالتالي فهي حاسمة لتحقيق فهم أكبر للطبيعة1،2. العوالق الحيوانية البحرية هي مجموعات متنوعة من الكائنات الحية التي تلعب دورا هاما في النظم الإيكولوجية للمحيطات3،4،5،6. على الرغم من وفرة وأهميتها الإيكولوجية، والكائنات الجيلاتية مثل tunicates planktonic غالبا ما تكون ممثلة تمثيلا ناقصا في دراسات التنوع البيولوجي العوالق لأن شفافيتها وهشاشتها جعل جمع الحقل وتحديد التحدي7،8. تقنيات أخذ العينات وتكييفها و الزراعة المختبرية تسمح لمراقبة أوثق من الحيوانات في المختبر، والتي زادت المعرفة في بيولوجيا planktonic tunicates9،10،11،12.
اليرقات (Appendicularians) هي فئة من التونيكات البحرية السباحة الحرة التي تضم حوالي 70 نوعا وصفت في جميع أنحاء العالم8،13. كما أنها واحدة من المجموعات الأكثر وفرة داخل المجتمعات العوالق الحيوانية14,15,16,17, تمثل اليرقات مصدر الغذاء الأساسي للكائنات الكبيرة العوالق مثل يرقات الأسماك18,19. على عكس ascidians-الريسيل tunicates-larvaceans الاحتفاظ مورفولوجيا مثل الشرغوف وتبقى planktonic طوال حياتهم20. يعيش كل داخل بنية تغذية مرشحية معقدة مبنية ذاتياً تعرف باسم المنزل. يتراكمون الجسيمات في بيوتهم عن طريق خلق تيارات المياه من خلال حركة متموجة من ذيولها21. يتم التخلص من المنازل المسدودة على مدار اليوم ، وبعضها يشكل مجاميع الكربون والمصارف في نهاية المطاف إلى قاع البحر22؛ وهكذا، تلعب اليرقات دوراً رئيسياً في تدفق الكربون العالمي23. وتفيد التقارير بأن معظم الأنواع تعيش في المنطقة البحرية الواقعة في حدود 100 متر من عمود الماء13؛ ومع ذلك، من المعروف أن اليرقات العملاقة Bathochordaeus أن يسكن أعماق 300 م24. وكشفت دراسة أجريت على باثوتشورديوس في خليج مونتيري، كاليفورنيا أن الحيوانات هي أيضا بمثابة ناقل بيولوجي للبلاستيك الدقيق، مما يشير إلى أهمية محتملة في فهم دور الزوائد في النقل الرأسي وتوزيع البلاستيك الدقيق في المحيطات25.
Oikopleura دييكا، وهو نوع من اليرقات ، وقد اجتذب الانتباه في السنوات الأخيرة ككائن حي نموذجي بسبب العديد من الخصائص الرائعة. ويشيع الإبلاغ عنه في جميع أنحاء محيطات العالم. هو خصوصا وافرة في المياه الساحلية26، والذي يسمح أخذ العينات سهلة من الشاطئ. على المدى الطويل، و الاستزراع مستقرة هو ممكن مع كل من مياه البحر الطبيعية والاصطناعية27،28،29. أوقات توليد درجة الحرارة تعتمد قصيرة مثل 4-9 أيام في ظروف المختبر. لديها براز عالية مع كل أنثى قادرة على إنتاج > 300 بيضة على مدار السنة. كما سترة، فإنه يحتل موضعاً مهمًا فيلوجينتيك لفهم تطور chordate30،31. في 70 ميغابايت، O. دييكا لديه أصغر الجينوم المحدد بين جميع chordates32. بين اليرقات، O. دييكا هو الأنواع غير الموصوفة فقط غير هيرامبورديتيك حتى الآن33.
أول نجاح O. dioica الثقافة مع المختبر نمت الطحالب الدقيقة وذكرت Paffenhöfer34. تم تطوير بروتوكول الثقافة الأصلي باستخدام المحركات والمجاذيف المتزامنة من قبل فينو وغورسكي35 واعتمدته في وقت لاحق من قبل مختبرات متعددة. وفي الآونة الأخيرة، أبلغ "فوجيوآخرون" (Fujii et al. 36) عن زراعة أو ديوكا في مياه البحر الاصطناعية، ونظام ثقافة قوي ومجموعة ميدانية وصفها بوكيه وآخرون27، وأبلغ مارتي-سولانس وآخرون29عن بروتوكول أمثل لنظام مبسط ومعقول التكلفة. وبصرف النظر عن النظام الثقافي التقليدي Oikopleura، تصميم ذكرت حديثا مع خزان تربية أنبوب مزدوج لديه أيضا القدرة على ثقافة Oikopleura sp. 37-
نقدم بروتوكول مفصل لبدء O. dioica أحادية الثقافة على أساس مجموعة من البروتوكولات التي وضعتها مجموعات البحوث الرئيسية Oikopleura في المركز الدولي للسارس للبيولوجيا الجزيئية البحرية27، جامعة برشلونة29، جامعة أوساكا28، وملاحظاتنا الخاصة. في بروتوكولات الثقافة المنشورة سابقا، تم وصف المعلومات التفصيلية المتعلقة بتكوين وسائل الإعلام الطحالب، وتقنيات أخذ العينات الشاطئية، وتحديد أوكبلورا تقريبا فقط، مما ترك الكثير من الغموض. هنا، مع مساعدة المعلومات المرئية في بروتوكول الفيديو، قمنا بتجميع جميع المعلومات الهامة اللازمة لإنشاء ثقافة أو دييكا من الألف إلى إلى المدى الأعلى بطريقة مباشرة، خطوة بخطوة. نحن وصف كيفية التمييز O. دييكا من الأنواع الأخرى التي يشيع ذكرها, O. longicauda, التي هي واحدة من الخطوات الأكثر تحديا. على الرغم من أن النظم الثقافية الحالية قابلة للتطبيق لزراعة O. dioica في جميع أنحاء العالم، فإننا نسلط الضوء على أهمية تعديل البروتوكول على أساس الظروف البيئية المحلية. وتجمع المعلومات المقدمة بين البيانات المنشورة على نطاق واسع، فضلا عن المعارف المكتسبة من خلال الخبرة. البروتوكول الحالي مناسب بشكل مثالي للباحثين المهتمين بتأسيس ثقافة من الصفر.
Protocol
1- مرفق ثقافي دييكا
- نظام تصفية المياه (الشكل 1)
- جمع مياه البحر الطبيعية من ميناء على عمق 2-3 متر. تمرير مياه البحر من خلال مرشح الرمل (المسام حجم 1.4 مم) ونقلها إلى خزان مشترك في المختبر. استخدم فلتر عبوة لتوزيع المياه من أجل الحفاظ على جودة المياه في خزان الخزان المشترك.
- في غرفة الثقافة، قم بإعداد نظام تصفية متعدد الخطوات يتكون من خزان 100 لتر مع مضخة محرك مغناطيسي، 5 ميكرومتر و1 ميكرومتر فلاتر خرطوشة جرح البولي بروبلين، ومعقم للأشعة فوق البنفسجية (100 فولت)(الشكل 1).
- نقل مياه البحر من خزان الخزان المشترك إلى خزان غرفة الثقافة. تمرير مياه البحر من خلال وحدة مرشح 25 ميكرومتر(الشكل 1A, B) قبل دخول خزان خزان غرفة الثقافة. تعميم مياه البحر من خلال مرشحات 5 و 1 ميكرومتر بين عشية وضحاها لإزالة الجسيمات التي يمكن أن تعوق نمو الحيوانات.
ملاحظة: يفيد عامل تصفية إضافي بحجم شبكة أكبر (25-50 ميكرومتر) لمنع الجسيمات الأكبر من انسداد مرشحات الخراطيش ذات أحجام شبكة أصغر. مياه البحر المصفاة (fSW) جاهزة للاستخدام في صباح اليوم التالي.
-
Oikopleura وحدة زراعة (الشكل 2)
- الحفاظ على الحيوانات في 5 أو 10 لتر جولة، واكواق بلاستيكية شفافة.
- ضع الأكواب على رفوف ثابتة من مستويين من الفولاذ المقاوم للصدأ (L x W x H = 150 سم × 45 سم × 90 سم) مع لوحة سطح ية اكريليك شفافة بسمك 5 مم.
- ضع أضواء الفلورسنت البيضاء تحت سطح الأكريليك لإلقاء الضوء على الحيوانات من قاع الأكواب.
- ضع ورقة بلاستيكية سوداء خلف القارور. الورقة السوداء يخلق التباين ويعزز التصور من الحيوانات شفافة.
- توصيل المحركات الكهربائية المتزامنة إلى المجاذيف الاكريليك (L x H = 8 سم × 27 سم) (ملف إضافي 2). تعليق المجاذيف في القارير الثقافة من القضبان المتوازية على طول طول وحدة رفوف (الشكل 2A).
- قم بتشغيل المحركات لتوليد حركة دائرية لطيفة في القارير عند 15 دورة في الدقيقة.
ملاحظة: الحيوانات في منازلهم السليلوز هي مزدهرة بشكل محايد. ومع ذلك، يساعد تداول المياه على إبقاء البيض واليرقات والطعام الطحالب معلقة وتوزيعها بالتساوي في الكوابك الثقافية.
- مضخة الزباء التلقائي (اختياري)
ملاحظة: تقلل وحدة التغذية التلقائية من متطلبات التوظيف، خاصة خلال عطلات نهاية الأسبوع.- معايرة حجم السائل الاستغناء عن مضخة التعبئة التلقائية وفقا لتعليمات الشركة المصنعة.
- استخدام 50 مل أنابيب كخزانات الطحالب.
- حفر اثنين من ثقوب 5 ملم على قبعات من أنابيب 50 مل لتمرير من خلال أنابيب الطيران. توصيل أنبوب واحد إلى مضخة الهواء الحوض القياسية لإدخال فقاعات الهواء، وأنبوب آخر إلى ميناء مدخل مضخة الزاويه(الشكل 2B).
ملاحظة: إدخال تيار رقيق من فقاعات الهواء يساعد على منع الطحالب من الاستقرار على الجزء السفلي من الأنابيب. - برمج وقت وحجم تغذية الطحالب التي سيتم الاستغناء عنها في يوم معين.
- محطة الطحالب
- استخدم وحدة رفوف (L x W x H = 90 سم × 46 سم × 115 سم) لوضع أربع قارورة قاعية مستديرة 1 لتر تحتوي على ثقافات عمل الطحالب (انظر الخطوة 2.1).
- عودة تضيء ثقافات العمل عن طريق وضع أضواء الفلورسنت وراء القارورة.
- قارورة الختم مع سدادات مطاطية من ثقبين.
- تمرير ماصة 1 مل المتاح من خلال سدادة المطاط. استخدام أنابيب الطيران لتوصيل ماصة لضخة الهواء الحوض. إدخال تيار من فقاعات الهواء في القارورة.
2- الأغذية الصغيرة الغال
- بدء ثقافات الطحالب
ملاحظة: الحفاظ على ثلاث مجموعات من الثقافات (الأسهم، الفرعية، وثقافات العمل) لثلاثة أنواع صغيرة، Chaetoceros calcitrans، Isochrysis sp.، Rhinomonas reticulata،وجنس واحد من البكتيريا الزرقاء، Synechococcus sp.. وتستخدم الأرصدة والثقافات الفرعية كمخزونات احتياطية. وتستخدم ثقافة العمل للتغذية اليومية.- تحضير الكواشف اللازمة لزراعة الطحالب الدقيقة والالبكتيريا الزرقاء(الجدول 1).
- لبدء ثقافة الأسهم، الأوتوكلاف (121 درجة مئوية، 25 دقيقة) 60 - 80 مل من fSW في قارورة 100 مل Erlenmeyer. تطعيم Asoculate محددة كمية تعديل كونواي المتوسطة27 والطحالب الدقيقة(الجدول 2). على سبيل المثال، لتطعيم ثقافة مخزون C. calcitrans، الأوتوكلاف 60 مل من مياه البحر، تطعيم 30 ميكرولتر اإلإلإلكل من فيتامين والحل A، 15 ميكرولتر من سيليكات الصوديوم، 60 ميكرولتر من الستريبتوميسين، و 30 ميكرولتر من C. calcitran من ثقافة الأسهم السابقة.
ملاحظة: R. reticulata يتحول من أحمر الوردي إلى البني orangish عندما يتعرض إلى الكثير من الضوء. نقلهم بعيدا عن الضوء بمجرد أن بدأت تتحول من واضحة إلى الوردي الفاتح. - الحفاظ على ثقافة الأسهم في حاضنة تعيين في 17 درجة مئوية مع الإضاءة المستمرة. بعد حوالي 10 أيام، والثقافة يتغير لون للإشارة إلى نمو الطحالب(الشكل 3). بمجرد ظهور الألوان، نقلها إلى 4 درجة مئوية لتخزين طويل الأجل لمدة تصل إلى 1 شهر.
- على مقعد نظيفة، تطعيم asoculate sub-culture من ثقافة الأسهم(الجدول 2). احتضان في 17 درجة مئوية مع الإضاءة المستمرة. بعد ظهور ألوان الطحالب، استمر في تخزينها في الحاضنة لمدة تصل إلى أسبوعين.
- 1- تلقيح ثقافة العمل من الثقافة الفرعية(الجدول 2). ختم قارورة مع غطاء مطاطي وإدراج ماصة 1 مل المتاح. نقل القارورة إلى محطة الطحالب والحفاظ على درجة حرارة الغرفة مع 8 ساعة photoperiod. العرض مع تهيّم مستمرّة. تجديد ثقافة العمل كل 4 أيام.
- اثارة الأسهم والثقافات الفرعية مرتين في اليوم عن طريق دوامة.
ملاحظة: التخزين طويل الأجل للثقافة الطحالب على وسائل الإعلام الصلبة والكوندبريس من الممكن ما يصل إلى 3 أشهر و 1 سنة، على التوالي29.
- إنشاء منحنيات نمو الطحالب (اختياري)
ملاحظة: التقييم الدقيق لكمية التغذية مهم للحفاظ على ثقافة مستقرة من O. dioica. أنشأنا منحنيات النمو لنوعين من المواد الغذائية الطحالب الأولية، Chaetoceros calcitrans وSsochrysis sp.- تحضير C. calcitrans و Isochrysis sp. ثقافات العمل (الجدول 2).
- لكل نوع من أنواع الاستزراع العامل، عيّن ثلاث مرات منفصلة وقياس الامتصاصات عند 660 نانومتر باستخدام مقياس طيفي. خذ متوسط قياسات ثلاثية من كل ثقافة العمل.
- بعد تعليمات الشركة المصنعة لعداد خلية الآلي، وإعداد عينات الطحالب للعد. عد كل عينة ثلاث مرات. خذ متوسط ثلاثة أعداد لتحديد العدد الإجمالي للخلايا الموجودة في كل عينة.
- استمر في العد اليومي حتى يتم تسجيل حوالي 50 متوسط قياس.
- إنشاء منحنيات النمو لكلا النوعين الطحالب(الشكل 4).
3. جمع الميدان من البرية Oikopleura Spp.
- صافي ألواح تعديل (الشكل 5)
ملاحظة: المفتاح إلى أخذ عينات ناجحة من Oikopleura Spp. هو السحب البطيء من صافي العوالق مع مرجح، غير تصفية القد نهاية. ويبين الشكل 5 رسم تخطيطي لصافي ألواح معدلة.- استبدال سمك القد نهاية شبكة من العوالق المحمولة باليد مع تعديل 500 مل برغي أعلى زجاجة الغسيل.
- حفر حفرة قطرها 3 سم في قطر 4 سم المسمار الأعلى من زجاجة الغسيل للسماح للماء والحيوانات لدخول نهاية سمك القد.
- تناسب غطاء زجاجة في نهاية شبكة بلانكتون. لفها بإحكام مع الشريط الكهربائي. تأمين الغطاء كذلك مع المشبك خرطوم الفولاذ المقاوم للصدأ.
- نعلق وزن 70 غرام إلى خارج القد تعديل نهاية مع ربطات عنق الرمز.
- إرفاق المقود السلامة لمزيد من تأمين سمك القد نهاية.
- اختيار مواقع التجميع (الشكل 6)
ملاحظة: تمت الموافقة على كافة مجموعات العينات من قبل لجنة أمان العمل الميداني OIST. قد يكون هناك اختلاف موسمي في وجود أوكوبليورا SPP. اعتمادا على الموقع (الشكل 6). تجنب أخذ العينات مباشرة بعد الظواهر الجوية المتطرفة مثل العواصف المطيرة الشديدة.- استخدم طريقة عرض القمر الصناعي على موقع الخريطة لتحديد مواقع أخذ العينات المحتملة. ركزنا على الموانئ وأرصفة الصيد التي يمكن الوصول إليها بسهولة بالسيارة وتقع داخل الخلجان أو بالقرب من ألواح المحيطات حيث تميل العوالق إلى التراكم: ميناء إيشيكاوا في خليج كين، أوكيناوا، اليابان (GPS: 26°25'39.3"N 127°49'56.6"E).
- زيارة مواقع أخذ العينات المحتملة لتقييم إمكانية الوصول إلى الشاطئ وسلامة كل موقع. الحصول على تصريح تحصيل من السلطات المحلية حسب الحاجة.
- إجراء أخذ العينات
- يلقي صافي العوالق في البحر والسماح لحوض القد بالوعة 1-2 متر تحت سطح الماء.
- سحب صافي أفقيا باليد في 50-100 سمs -1. استمر في السحب عن طريق المشي ذهاباً وإياباً لمدة 2-5 دقائق. ضبط وقت القطر وفقا لوفرة العوالق النباتية في الميناء، مع أقصر سحب عندما يكون هناك المزيد من العوالق النباتية.
ملاحظة: اليرقات هي هشة. يمكن أن يؤدي السحب السريع أو الصب المتكرر للشبكة إلى تلف الحيوانات المحاصرة في نهاية سمك القد. - رفع بلطف الشبكة. نقل محتويات نهاية سمك القد ببطء إلى زجاجة زجاجية مستديرة 500 مل. ملء زجاجة عينة تماما مع مياه البحر لتجنب فقاعات الهواء.
ملاحظة: يمكن تأكيد وجود Oikopleura SPP. عن طريق عرض زجاجات عينة على خلفية سوداء. معظم الحيوانات تتخلى عن منازلها أثناء جمعها. ولذلك، هناك حاجة إلى المراقبة المجهرية لتحديد مستوى الأنواع. - تكرار أخذ العينات حتى يتم جمع ثلاث زجاجات 500 مل.
- قياس الملوحة ودرجة الحرارة والكلورو باستخدام محلل CTD لتسجيل مجموعة من المعلمات الفيزيائية حيث الحيوانات موجودة بشكل طبيعي.
- جمع 10-15 لتر من مياه البحر السطحية في دلو لتأقلم الحيوانات في الإعداد المختبر.
4. الحيوان عزل وتحديد (الشكل 7، الشكل 8)
-
Oikopleura Spp. تحديد الهوية
ملاحظة: الكائنات الحية الأخرى التي قد تشبه أوكوبيورا Spp. للوهلة الأولى تشمل chaetognaths، Fritillaria spp.، الديدان الخيطية، يرقات الأسماك مع صفار الكيسات، وسيونا spp. اليرقات.- لتأقلم الحيوانات مع ظروف المختبرات، قم بنقل كل عينة 500 مل إلى 10 لتر من الكوبر تحتوي على نسبة 1:1 من مياه البحر السطحية من موقع أخذ العينات ومياه البحر المصفاة (fSW) التي تمت صيانتها في المختبر (الشكل 7A, B). ضبط حجم من الكوابر إلى 5-10 L اعتمادا على تركيز عينة من العوالق.
ملاحظة: إذا احتوى نموذج الألواح على حطام غير مرغوب فيه، قم بتشغيله عبر فلتر خشن (حجم شبكة 600 ميكرومتر تقريبًا) قبل نقله إلى كوب 10 لتر. - استخدم مجدافًا متصلًا بمحرك كهربائي متزامن (15 دورة في الدقيقة) وبقًا على اللوح في حالة تعليق بين عشية وضحاها (الخطوة 1.2.5).
- تحديد Oikopleura Spp. من خلال البحث عن 1-2 ملم طويلة، والحيوانات على شكل الشرغوف متموجة ذيولها داخل منزل كروية، شفافة. قد تكون بعض الحيوانات سباحة حرة مؤقتًا بدون المنازل. نقل بلطف ~ 5 الحيوانات إلى طبق بيتري فارغة باستخدام ماصة حادة نهاية.
- لتحديد جنس، طرد الحيوانات من منازلهم عن طريق بدس بلطف المنزل مع ماصة نقل.
- مراقبة الحيوانات بلا منزل تحت 20-40x مجهر حقل الظلام وتأكيد Oikopleura Spp (الشكل 8).
- لتأقلم الحيوانات مع ظروف المختبرات، قم بنقل كل عينة 500 مل إلى 10 لتر من الكوبر تحتوي على نسبة 1:1 من مياه البحر السطحية من موقع أخذ العينات ومياه البحر المصفاة (fSW) التي تمت صيانتها في المختبر (الشكل 7A, B). ضبط حجم من الكوابر إلى 5-10 L اعتمادا على تركيز عينة من العوالق.
-
O. دييكا الهوية
ملاحظة: O. ديوتشيا يمكن تحديدها بصريا من خلال وجود ناضجة تماما من الذكور والإناث أو اثنين من الخلايا الفرعية الكبيرة الموجودة على نصف من ذيولها.. قد تختلف المسافة بين خليتين دون كل من الأفراد.- بعد ذلك، تحقق مما إذا كان هناك أوكبلورا نضجت تماما مع الشناء مليئة البويضات (الشكل 8A) أو الحيوانات المنوية (الشكل 8B). إذا كان الحيوان يمتلك فقط البيض أو الحيوانات المنوية، انتقل إلى الخطوة 4.2.3 كما هو O. دييكا،الأنواع الوحيدة غير الموصوفة غير hermaphroditic.
- إذا كان الحيوان غير ناضج (الشكل 8C) ، ابحث عن خليتين دون كل منهما في نهاية ذيله (الشكل 8D).
- بمجرد تأكيد الأنواع ، قم بنقلها إلى طبق بيتري جديد. كرر الخطوات 4.1.3-4.2.2 حتى يتم تأكيد 10-20 فرد على مستوى الأنواع.
ملاحظة: للحصول على تعريف أسهل، تخدير الحيوانات في طبق بيتري الذي يحتوي على 0.015٪ ثلاثية التريكايين غاز الميثان (MS222) في fSW. - إذا لم يتم العثور على O. دييكا، والحفاظ على القارور معلقة ليوم أو يومين إضافيين. قد يكون هناك غير ناضجة O. دييكا التي سوف تستمر في النمو وتصبح أسهل ليتم الكشف عنها. إذا لم يظهر أي منها بعد أسبوع، فتجاهل العينة وحاول أخذ العينات مرة أخرى.
5. بروتوكول زراعة ل O. دييكا
- بدء O. dioica أحادية الثقافة من حقل جمع عينة (الشكل 7)
ملاحظة: يتم إعداد الطعام الطحالب يوميا من الثقافات العاملة ويتم تغذية كل من القارق أحادية الثقافة ثلاث مرات في اليوم في 9 صباحا و 12:00 و 5 مساء على التوالي (انظر الخطوة 5.2). يتم الحفاظ على الحيوانات في 23 درجة مئوية. في ظل هذه الظروف ، أوكيناوا O. دورة حياة دييكا هو 4 أيام (الشكل 7C).- لبدء زراعة أحادية من O. دييكا، عزل 120 الحيوانات ونقلها إلى منقار جديد يحتوي على 5 لتر من fSW الطازجة (الشكل 7B, C).
- في صباح اليوم التالي، ابحث عن الذكور الناضجين تماماً مع الرناد الأصفر والإناث مع البيض الذي يظهر كـ المجالات الذهبية(الشكل 8A, B).
- جعل منقار التفريخ عن طريق نقل بلطف 15 الذكور و 30 الإناث إلى beaker جديدة تحتوي على 2.5 لتر من fSW الطازجة مع ماصة 5 مل حادة نهاية.
ملاحظة: إذا لم يكن هناك ما يكفي من الذكور والإناث، نقل أكبر عدد ممكن من البالغين إلى منقار يحتوي على 1 لتر من fSW والسماح لهم تفرخ بشكل طبيعي. لتقليل الضغط البدني للحيوانات أثناء النقل اليدوي ، يجب أن يتم سحبها ببطء وإطلاقها تحت سطح الماء. - دع الحيوانات تفرخ بشكل طبيعي لبدء الجيل القادم. يجب أن تظهر اليرقات التيل حوالي 3 ساعات بعد الإخصاب.
ملاحظة: يتم تنفيذ التفريخ من قبل الحيوانات الناضجة تماما التخلي عن منازلهم، والسباحة نحو المياه السطحية، وإطلاق الأمشاج. ويمكن تأكيد نجاح الإخصاب عن طريق استخراج 5-10 مل من مياه البحر من الجزء السفلي من من beaker التفريخ وتحديد البيض مع الانقسامات تحت المجهر. - في الصباح الأول بعد التفريخ (اليوم 1)، يجب أن يظهر جيل جديد من الحيوانات ذات المنازل المتضخمة في القارس. استخدام 500 مل من القارس باليد لنقل بلطف محتويات من beaker التفريخ في منقار جديد يحتوي على 7.5 لتر من fSW الطازجة (مما يجعل ما مجموعه 10 لتر). صب في زاوية لتجنب حركة الرش.
- في الصباح الثاني (اليوم الثاني) ، نقل يدويا 150 الحيوانات إلى beaker جديد يحتوي على 5 لتر من fSW الطازجة.
- في صباح اليوم الثالث (اليوم الثالث) ، نقل يدويا 120 الحيوانات إلى الكوبر الجديد مع 5 لتر من fSW الطازجة.
ملاحظة: من أجل مزامنة تطور الحيوانات، من المهم اختيار الأفراد ذوي الأحجام المماثلة أثناء النقل اليدوي في اليومين 2 و3. يمكن أن يتم سحب 10 كحد أقصى في عملية نقل واحدة. - في الصباح الرابع (اليوم الرابع)، يجب أن تظهر الحيوانات الناضجة بالكامل. كرر الخطوة 5.1.3 لإغلاق دورة الحياة.
ملاحظة: يمكن تعيين مضخة تغذية آلية لإطعام الحيوانات في الساعة 5 مساء في عطلة نهاية الأسبوع دون وجود الموظفين زراعة.
- إعداد يومي للغذاء الطحالب من ثقافة العمل
- قياس امتصاص ثقافة العمل في 660 نانومتر.
- استنادا إلى مخطط التغذية اليومية، ومعرفة عدد الخلايا الطحالب تحتاج إلى تغذية للحيوانات ذات حجم معين(الجدول 3).
- باستخدام منحنيات النمو الطحالب (الشكل 4) ، حل المعادلات أدناه لحساب حجم الطعام الطحالب (مل) المطلوبة في يوم معين.
- لحساب حجم الطحالب معينة اللازمة ليوم معين وتغذية الوقت، استخدم المعادلة التالية:
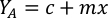
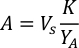
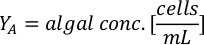
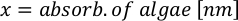
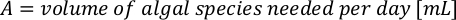
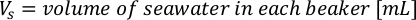
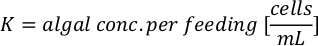
حيث YA هو تركيز الطحالب في يوم معين و A هو حجم الطحالب اللازمة لكل تغذية. وعلاوة على ذلك، تظهر العلاقة الخطية بين YA إلى x، وقيم التقاطع (c) والممنح(m)في الشكل 4. راجع الجدول 3 لقيم K. - على سبيل المثال، لحساب حجم الـ Isochrysis sp. المطلوبة في 9 AM تغذية من الحيوانات يوم 3 التي حافظت على في ثقافة 5 L وامتصاص الطحالب من 0.234 (قياس في 660 نانومتر)، تم حساب ما يلي:
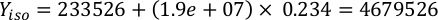
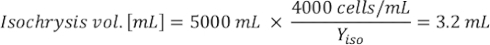
ملاحظة: تخزين هذه المعادلات في جدول بيانات بحيث يتم حساب كمية التغذية اليومية تلقائيا على أساس قياسات الامتصاص، وحجم الحيوانات، وحجم مياه البحر الثقافة(ملف تكميلي 1).
- لحساب حجم الطحالب معينة اللازمة ليوم معين وتغذية الوقت، استخدم المعادلة التالية:
- نقل حجم الطحالب المحسوبة إلى 50 مل أنابيب، والطرد المركزي في 5000 × ز لمدة 5 دقائق في 20 درجة مئوية.
- إزالة المناط. ملء الأنابيب مرة أخرى إلى حجم الأصلي مع fSW الطازجة، لتحل محل وسائل الإعلام الطحالب القديمة.
- تخزين الطعام المعد في الثلاجة حتى جاهزة للاستخدام في الأعلاف المقبلة. تخلص من طعام الطحالب القديم بعد إعداد الطعام الجديد في صباح اليوم التالي.
- الفحم المنشط (اختياري)
ملاحظة: يضاف 10 غرام من الفحم المنشط إلى كل من القارص الثقافية للحفاظ على جودة المياه. يمكن إعادة استخدام الفحم حتى أربع مرات. فتح كيس الفحم ببطء لتجنب غبار الفحم من دخول القارق الثقافة.- نقل ~ 700 غرام من الفحم المنشط في وعاء. نقع في المياه العذبة (FW) لمدة 48 ساعة والسماح لهم لتسوية في الجزء السفلي.
- شطف مع FW لإزالة غبار الفحم المتبقية.
- يغلي الفحم في FW لمدة 15-20 دقيقة. إزالة من الحرارة والسماح لتبرد.
- شطف حتى تتم إزالة معظم الغبار الفحم، ويصبح الماء واضحا.
- تخزين الفحم النظيف في 2 L منقار يحتوي على fSW. تغطية القارب لمنع الغبار من الدخول.
- إضافة الفحم إلى كل منقار جديد قبل نقل الحيوانات.
النتائج
Oikopleura يمكن جمعها من قارب أو من ميناء من قبل بطيئة، لطيف القطر من 100 μm شبكة العوالق الصافية مع القد نهاية غير مرشح(الشكل 5). نظراً للطبيعة الهشة للحيوانات، من المهم تجنب أي حركة يمكن أن تسبب الإجهاد البدني، مثل التعامل الخشن مع الشبكة أو الرش بسبب جيب الهواء المحاصرين في جرة العينة.
من المهم فهم النمط الموسمي لسكان أويكولوبورا المحليين وكذلك التقلبات المصاحبة في الخصائص المادية للماء في موقع أخذ العينات. كشفت عملية أخذ العينات بين عامي 2015 و2019 عن وجود تباين موسمي ثابت في وجود O. dioica في ميناءي إيشيكاوا وكين في أوكيناوا (الشكل 6). ويبدو أن درجة حرارة مياه البحر السطحية تشكل عاملا رئيسيا. O. كان الدييكا الأنواع المهيمنة عندما وصلت مياه البحر السطحية إلى ≥28 درجة مئوية ، وتعايشت O. longicauda مع O. dioica في درجات حرارة تتراوح بين 24 درجة مئوية و 27 درجة مئوية؛ ومع ذلك، سيطر O. longicauda تحت 23 درجة مئوية(الشكل 6A). ولم يرتبط التغير التدريجي في الملوحة بعد عدة أيام متتالية من الأمطار الغزيرة بوفرة أو دييكا (الشكل 6B).
باستخدام إجراءات أخذ العينات المذكورة أعلاه، معظم O. الديوكسيا التي استردناها كانت بين اليومين 2 و 3 من دورة حياتهم 4 أيام(الشكل 7C). تم التعرف على الذكور الناضجين من خلال تلوين الرناد الأصفر في حين أن الرناد الأنثوية تلألأ الذهب من البيض الذي كان 70-80 ميكرومتر في القطر(الشكل 8A, B). تم تأكيد غير ناضجة O. ديوتشيكا من قبل اثنين من الخلايا دون الطلب على ذيولها (الشكل 8D). وهناك نوع آخر مهيمن في المياه المحلية، هو O. longicauda، كانت متشابهة في الحجم والمورفولوجيا. استخدمنا المعايير التالية للتمييز O. longicauda من O. dioica38,39,40: عدم وجود خلايا تحت الحمراء في الذيل, وجود velum في الجذع, ووجود الخندق hermaphrodite ( الشكل8E, F). ومورفولولوجيا ذيل مختلفة هي أيضا مفيدة لتمييز O. longicauda من O. dioica. عندما كان عارية سليمة دون المنزل موجهة بشكل ثناء، ذيل O. longicauda كان أكثر استقامة مع انحناء أقل، ويعطيها مظهر أكثر صلابة مقارنة مع ذلك من O. dioica.
وأهم ثلاثة عوامل لإنشاء نظام لثقافة أويكوبلوبورا مستقرة هي : '1' الحفاظ على جودة المياه العالية، '2' تحديد نظام التغذية الأمثل، و '3' إنشاء منبر للتفريخ مع أعداد كافية من الذكور والإناث. أدى إدخال نظام تصفية متعدد الخطوات(الشكل 1)إلى تحسين جودة المياه واستقرار الثقافة. نظام الترشيح ليس ضروريا لمياه البحر الاصطناعية; ومع ذلك، فإن تكلفة وتوافر وراحة مياه البحر الطبيعية يجعلها خيارا أفضل للمختبرات الواقعة بالقرب من الساحل. لإنشاء نظام التغذية، نوصي بقياس منحنيات نمو الطحالب التي تنطبق على إعدادات المختبر الفردية، حيث تختلف ظروف الحرارة والضوء بشكل كبير. قمنا بدمج منحنيات النمو مع جداول التغذية المنشورة سابقًا لتحسين تركيزات الأعلاف الطحالبية والتراكيب27 (الشكل 4). ونحن نتبع أيضا جدولا الصارمة التطعيم الطحالب للحفاظ على إمدادات جديدة من المواد الغذائية الطحالب(الجدول 2). نظام التغذية الآلي يسمح لنا للحفاظ على جدول التغذية اليومية متسقة دون وجود الموظفين زراعة (الشكل 2B).
بمجرد أن يتم تحقيق أفضل مياه البحر والتغذية الظروف، من المهم أن تبدأ أجيال جديدة عن طريق إنشاء منقار تفريخ مع 15 من الذكور و 30 الإناث في 2.5 لتر من fSW. وهذا يضمن تركيز جيد للحيوانات في اليوم 1 في صباح اليوم التالي، وهو ما يكفي لعزل 150 حيوانا في اليوم 2، 120 في اليوم 3 و 45 البالغين ناضجة في اليوم 4 لتفريخ. إذا لم يكن هناك ما يكفي من الذكور والإناث في اليوم 4 ، وجمع ونقل أكبر عدد ممكن من الأفراد الناضجين إلى 1 لتر من fSW والسماح لهم تفرخ بشكل طبيعي على أمل أن يكون هناك ما يكفي من اليرقات لحمل على الجيل القادم. بعد البروتوكول المقدمة، دورة حياة O. دييكا هو 4 أيام في 23 درجة مئوية(الشكل 7C). لقد أنشأنا موثوق ستة مجموعات سكان البرية مستقلة من O. دييكا، وكلها استمرت أكثر من 20 جيلا.
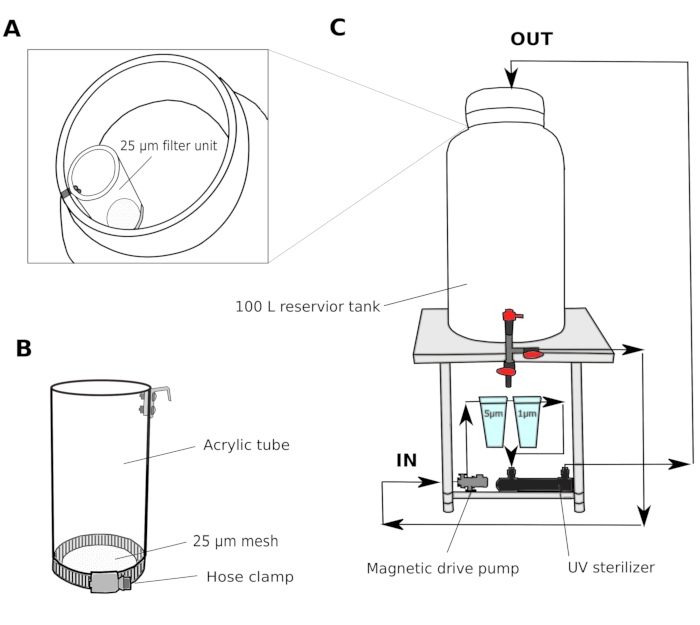
الشكل 1: التخطيطي لنظام تصفية مياه البحر.
(ألف وباء) يتم تصفية مياه البحر في البداية من خلال وحدة فلتر 25 ميكرومتر قبل دخول خزان الخزان (C) يتم استخدام مضخة محرك مغناطيسي لسحب مياه البحر من خزان الخزان. ثم يتم دفع مياه البحر من خلال اثنين من مرشحات البولي بروبلين ومعقم الأشعة فوق البنفسجية قبل العودة إلى خزان الخزان. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
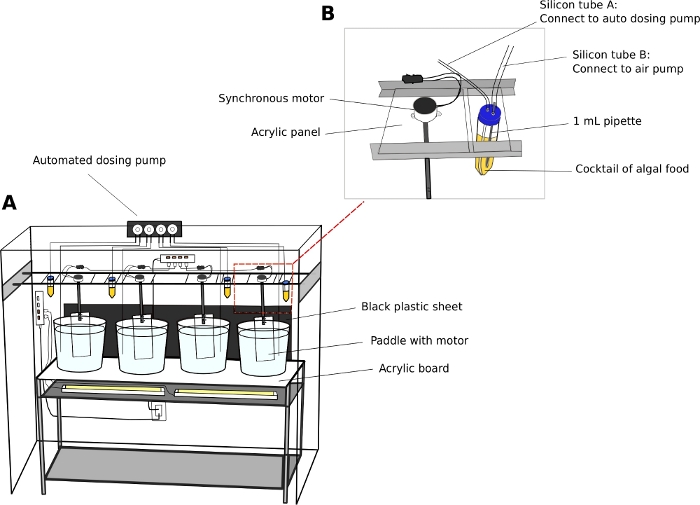
الشكل 2: النظام الثقافي لـ O. dioica.
(A)نظرة عامة على نظام الثقافة (B) عرض عن قرب للمحرك المتزامن وخزان الطحالب لمضخة الزهو الآلي. الأقطار الداخلية من أنبوب السيليكون A و B هي 2 مم و 4 ملم، على التوالي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: الأرصدة السمكية للـ O. dioica.
من اليسار- C. calcitrans، Isochrysis sp.، Synechococcus sp.، وR. reticulata بعد أن نمت في 17 درجة مئوية تحت الضوء المستمر لمدة ~ 10 أيام. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
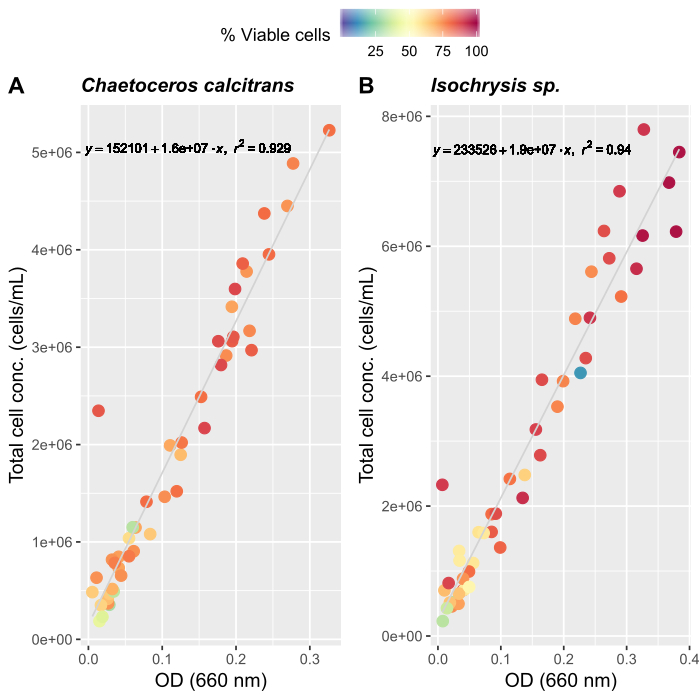
الشكل 4: منحنى نمو الطحالب لاثنين من أنواع الأغذية الرئيسية، C. calcitrans و Isochrysis sp..
تناثر المؤامرات من الكثافة البصرية (OD) في 660 نانومتر وتركيزات الخلايا الكلية لـ (A) C. calcitrans و (B) Isochrysis sp.. وتمثل كل نقطة متوسط ثلاثة قياسات. تم استخدام عداد الخلية لتحديد النسبة المئوية للخلايا القابلة للحياة وتركيزات الخلايا الكلية (الخلايا/mL). وقد سُجلت القياسات لمدة 20 يوماً (ن = 47). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
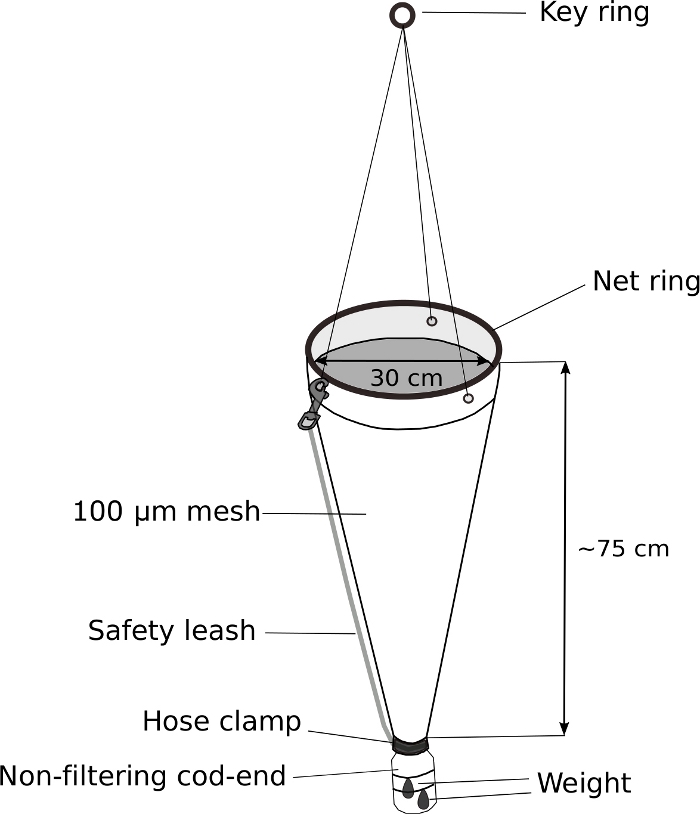
الشكل 5: صافي العوالق المعدلة لأخذ العينات Oikopleura.
يتم استبدال سمك القد نهاية من شبكة من الألواح المحمولة باليد (100 μm شبكة) مع 500 مل غسل زجاجة. يتم إرفاق وزن 70 غرام إلى نهاية سمك القد. يتم إرفاق حوالي 5 م من الحبل إلى حلقة المفتاح. يتم إرفاق مقود السلامة لمزيد من تأمين سمك القد نهاية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
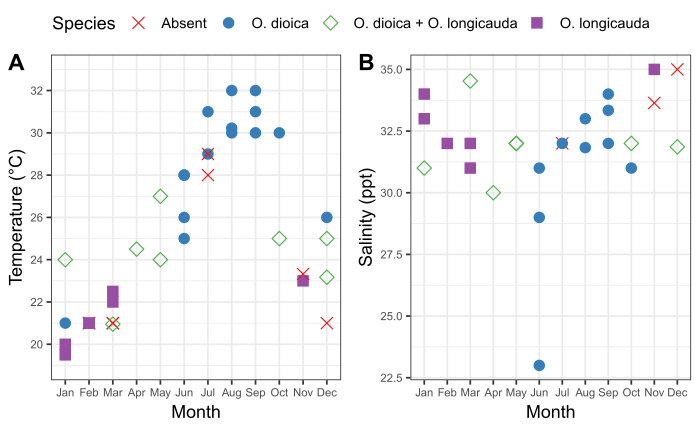
الشكل 6: موسمية أو دييكا في أوكيناوا.
وجود وغياب أو دييكا و أو. longicauda بالنسبة للتغيرات الموسمية في (أ) درجة الحرارة و (B) الملوحة في الموانئ في إيشيكاوا (26°25'39.3"N 127°49'56 .6"E) وكين (26°26'40.2"N 127°55'00.3"E) بين 2015-2019. تم تسجيل كل نوع على أنه موجود إذا تم إحصاء أكثر من 50 حيوانًا يدويًا. وسجلت قياسات درجة الحرارة والملوحة للمياه السطحية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
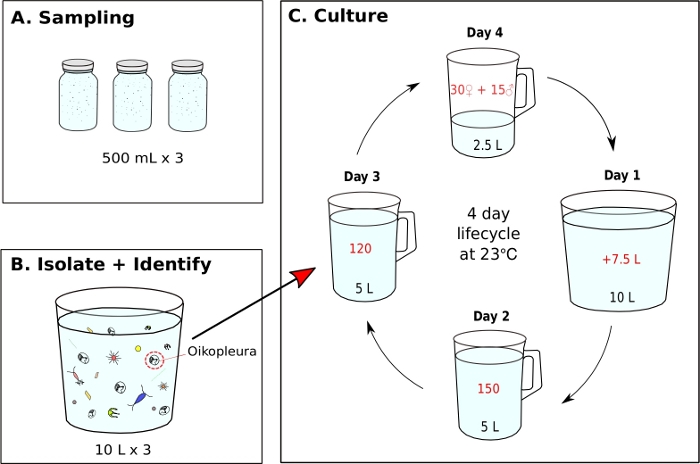
الشكل 7: مخطط تدفق لبدء O. dioica أحادية الثقافة.
A) يتم جمع عينات من العوالق 500 مل من موقع أخذ العينات (B) يتم تخفيف كل جرة عينة ويتم عزل O. ديويكا عن بقية العوالق (C) يتم البدء في زراعة أحادية من O. ديويكا عن طريق نقل يدويا 120 يوم 3 الحيوانات إلى beaker جديد يحتوي على 5 لتر من مياه البحر الطازجة (fSW). قم بإعداد منقار تفريخ يحتوي على 30 أنثى و15 ذكراً و2.5 لتر من fSW الطازجة. في الصباح الأول بعد التفريخ (Day1) ، إفراغ بعناية منقار التفريخ مع الجيل الجديد من الحيوانات في منقار يحتوي على 7.5 لتر من fSW الطازجة. في اليوم الثاني بعد التفريخ (اليوم 2)، نقل 150 حيوانا إلى منقار يحتوي على 5 لتر FSW الطازجة. في اليوم الثالث بعد التفريخ (اليوم 3)، نقل 120 حيوانا إلى منقار يحتوي على 5 لتر FSW الطازجة. في اليوم الأخير (اليوم 4) ، قم بإعداد منقار جديد للتفريخ يحتوي على 30 أنثى و 15 ذكرا و 2.5 لتر FSW جديدة في التحضير للجيل القادم. الحيوانات لديها دورة حياة لمدة 4 أيام في 23 درجة مئوية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
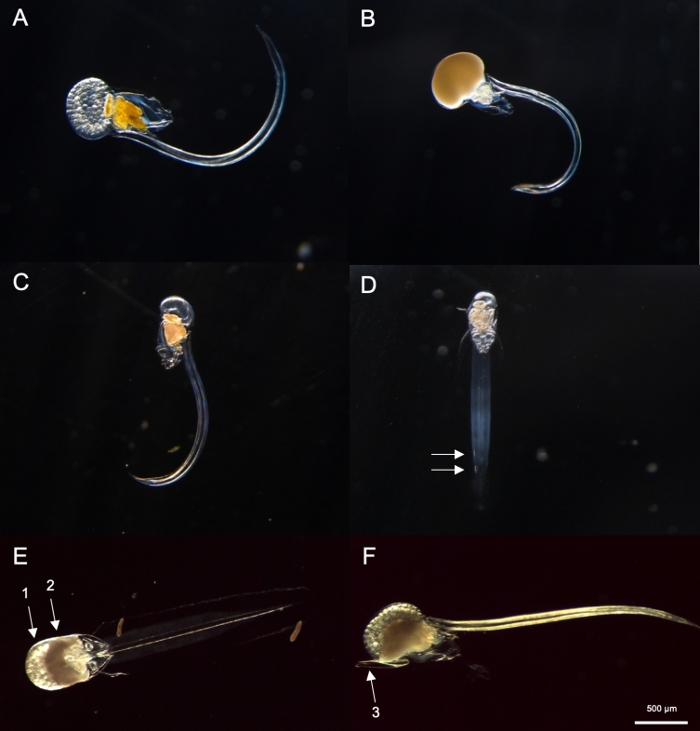
الشكل 8: تحديد أوكوبلوبورا Spp. (A-D: O. dioica,E و F: O. longicauda).
(أ)أنثى أو. ديوتشيكا مع البيض (B) ذكر O. دييكا مع الحيوانات المنوية (C) منظر جانبي من غير ناضج O. dioica (D) منظر فيترالي من غير ناضج O. ديوتشيكا مع اثنين من الخلايا دون التشدئة المشار إليها بسهام بيضاء (E) عرض فيترالي ناضج O. longica تحمل البيض (السهم 1) والحيوانات المنوية (السهم 2) (F) عرض جانبي لـ O. longicauda velum (السهم 3). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الكواشف | المنتجات الكيميائية | المبلغ | المجلد النهائي (مل) | التعقيم | الأسهم / فتح |
| الحل A | Na2EDTA | 45 غرام | 1000 | 1- التشابك التلقائي | -20 درجة مئوية / 4 درجة مئوية |
| NaNO3 | 100 غرام | ||||
| H3BO3 | 33.6 غ | ||||
| NaH2PO4 | 20 غ | ||||
| MnCl2·4H2O | 0.36 غ | ||||
| FeCl3·6H2O | 1.3 غرام | ||||
| الحل باء | 1.0 مل | ||||
| الحل باء | ZnCl2 | 2.1 غرام | 1000 | 1- التشابك التلقائي | 4 درجة مئوية / 4 درجة مئوية |
| CoCl2·6H2O | 2.0 غرام | ||||
| (NH4)6Mo7O24· 4H2O | 0.9 غرام | ||||
| CuSO4·5H2O | 2.0 غرام | ||||
| * HCl | -- مل | ||||
| فيتامين | الثيامين (ب1) · Hcl | 200 ملغ | 1000 | 1- التشابك التلقائي | -20 درجة مئوية / 4 درجة مئوية |
| البيوتين | 1 ملغ | ||||
| كوبالامين (ب12) | 1 ملغ | ||||
| سيليكات الصوديوم | Na2SiO3 | 5% | 1000 | مرشح 0.22 ميكرومتر | 4 درجة مئوية / 4 درجة مئوية |
| ستريبتوميسين | C21H39N7O12 | 25 ملغ / مل | 50 | مرشح 0.22 ميكرومتر | -20 درجة مئوية / -20 درجة مئوية |
الجدول 1: وصفة من الكواشف اللازمة لصيانة الأغذية الطحالب. بعد حل جميع المواد الكيميائية المدرجة في الحل B، يضاف HCl حتى يصبح الحل واضحا مع عدم وجود عكر. يتم تعقيم جميع الكواشف إما عن طريق autoclaving (120 درجة مئوية ، 25 دقيقة) أو عن طريق استخدام مرشح 0.22 م. يتم تعقيم جميع الكواشف باستثناء مخزون الفيتامينات بعد إضافة مادة كيميائية محددة. بالنسبة لمخزونات الفيتامينات، قم بتكفير الماء أولاً، ثم قم بحل المادة الكيميائية المدرجة. يتم سرد درجات حرارة التخزين للمخزون والكواشف المفتوحة.
| نوع الثقافة | الغال spp. | ASW (مل) | فيتامين | الحل A | سيليكات الصوديوم | ستريبتوميسين | الطحالب (مل) / نوع الثقافة | احتضان / متجر | التردد |
| ثقافة الأسهم | تشايتو | 60 | 1/2000 | 1/2000 | 1/4000 (Chaeto فقط) | 1/1000 (الكل باستثناء Syn) | 0.03 / الأسهم | 17 درجة مئوية / 4 درجة مئوية | نصف شهريه |
| Iso | 60 | 0.03 / الأسهم | |||||||
| الكركدن | 80 | 0.06 / الأسهم | |||||||
| Syn | 60 | 0.03 / الأسهم | |||||||
| الثقافة الفرعية | تشايتو | 500 | 1/2000 | 1/2000 | 1/4000 (Chaeto فقط) | 1/1000 (الكل باستثناء Syn) | 10 / الأسهم | 17 درجة مئوية / 17 درجة مئوية | التنزيلات |
| Iso | 500 | 10 / الأسهم | |||||||
| الكركدن | 500 | 20 / الأسهم | |||||||
| Syn | 500 | 10 / الأسهم | |||||||
| ثقافة العمل | تشايتو | 400 | 1/2000 | 1/2000 | 1/4000 (Chaeto فقط) | 1/1000 (الكل باستثناء Syn) | 100 / فرعي | جمهورية مقدونيا / جمهورية مقدونيا | كل 4 أيام |
| Iso | 400 | 100 / فرعي | |||||||
| الكركدن | 400 | 150 / فرعي | |||||||
| Syn | 400 | 100 / فرعي |
الجدول 2: تعليمات للحفاظ على ثلاثة أنواع من ثقافة الطحالب. إضافة كمية محددة من المكملات الغذائية إلى قارورة تحتوي على مياه البحر التي تم رفدها. تلقيح كل قارورة مع كمية محددة من ثقافة الطحالب. احتضان وتخزين الطحالب في درجات حرارة محددة. تلقيح ثقافة الأسهم الجديدة والثقافة الفرعية من ثقافة الأسهم السابقة، وثقافة العمل الجديدة من الثقافة الفرعية السابقة. تلقيح ثقافة الأسهم الجديدة والثقافة الفرعية وثقافة العمل كل أسبوعين وأسبوع واحد وأربعة أيام على التوالي. يوفر هذا الجدول ما يكفي من الغذاء لحوالي 10 اقواد من ثقافة O. دييكا. الحفاظ على 2 - 3 مجموعات من كل نوع ثقافة الطحالب كما احتياطية. RM – درجة حرارة الغرفة.
| اليوم | الغال spp. | 9 صباحاً و 5 مساءً | 12 مساءً |
| 1 | تشايتو | — | — |
| Iso | 1000 | 2000 | |
| Syn | 20,000 | 40,000 | |
| 2 | تشايتو | 1000 | 2000 |
| Iso | 2000 | 2000 | |
| الكركدن | 1000 | 1000 | |
| 3 | تشايتو | 3000 | 4000 |
| Iso | 3000 | 4000 | |
| الكركدن | 1500 | 1500 | |
| 4 | تشايتو | 1000 | 2000 |
| Iso | 1000 | 2000 | |
| الكركدن | 1000 | 1000 |
الجدول 3: تركيز الطحالب لكل تغذية معدلة من بوكيه وآخرون27. تركيزات الطحالب (الخلايا mL-1) وأنواع الطحالب المستخدمة للتغذية اليومية خلال دورة حياة 4 أيام من أوكيناوا O. دييكا.
ملف تكميلي 1: مخطط التغذية اليومية. يتم حساب كميات التغذية اليومية لكل من القارص الزرعية تلقائيا بعد إدخال قياسات امتصاص الطحالب اليومية (OD) ، وحجم الحيوانات (يوم) ، وحجم مياه البحر (SW vol.) في كل من القارص الثقافية. تم تكييف منحنيات النمو من R. reticulata و Synechococcus sp. من باقة وآخرون27. الرجاء النقر هنا لتحميل هذا الملف.
ملف تكميلي 2: كيفية ربط المحرك متزامن إلى مجداف الاكريليك. المسمار بإحكام على مجداف إلى المحرك باستخدام وجع سداسية. الرجاء النقر هنا لتحميل هذا الملف.
Discussion
لتسهيل المرونة في تأسيس ثقافة O. دييكا، من المهم فهم الموائل الطبيعية للحيوانات. توفر البيانات الموسمية معلومات حول نطاقات المعلمات الفيزيائية، والتي يمكن استخدامها لتوجيه ظروف الزراعة المختبرية. كما أنه يساعد في فهم التقلبات الموسمية في وفرة الحيوانات. في أوكيناوا، تم العثور على أكثر موثوقية من يونيو إلى أكتوبر. ومع ذلك ، في خليج طوكيو ، يبلغ عدد السكان ذروته في فبراير و41أكتوبر . على الرغم من أن زراعة O. dioica غالبا ما يقال في 20 درجة مئوية أو أقل27,28,29, أوكيناوا O. dioica يظهر أفضل البقاء على قيد الحياة في درجات حرارة فوق 20 °C;. ويمكن تفسير ذلك من حقيقة أن درجة حرارة مياه البحر السطحية الدنيا في أوكيناوا هي 20 درجة مئوية(الشكل 6). قد تتأثر وفرة O. ديويكا أيضا من قبل تزهر العوالق النباتية42 و وفرة المفترس43,44. بغض النظر عن المكان الذي يتم فيه جمع O. dioica ، فإن فهم موسمية السكان المحليين يزيد من فرصة أخذ العينات ونجاح الاستزراع.
ونظرا للموسم المناسب والموقع، صافي أخذ العينات هو وسيلة فعالة لجمع أعداد كبيرة من Oikopleura مع الحد الأدنى من الجهد. ويمكن أيضا استخدام الشباك ذات الألواح ذات حجم الشبكة الأصغر (60-70 ميكرومتر) لجمع جميع مراحل الحيوانات. ونادرا ما توجد الحيوانات الناضجة تماما في الشبكة، وربما بسبب هشاشتها في نهاية دورة الحياة. ولذلك، يتم تحقيق تحديد الأنواع تليها أخذ العينات عن طريق المراقبة المجهرية للخلايا دون الحمراء. عادة ما يظهر الأفراد الناضجون بعد يوم أو يومين من أخذ العينات مع استمرار نمو الحيوانات في المختبر. وعلى الرغم من أن أخذ العينات الصافية يتسم بالكفاءة، فقد يكون من الضروري اتباع أساليب بديلة لأخذ العينات في ظروف مختلفة. على سبيل المثال، يمكن أخذ العينات الصافية بالقرب من المناطق الحضرية جمع أعداد كبيرة من العوالق النباتية، مما يجعل من الصعب عزل أوكوبلو مورا. في مثل هذه الحالات، يوصى بأخذ عينات بسيطة من الجرافة لجمع مياه البحر السطحية أو أخذ عينات من القوارب من مناطق خارج الميناء. وأظهرت النتائج أن التغير التدريجي في الملوحة بسبب أيام المطر المتتالية لم يؤثر على وفرة أو دييكا. ومع ذلك، ينبغي تجنب أخذ عينات الشاطئ مباشرة بعد الظواهر الجوية المتطرفة مثل الأعاصير المدارية. هذه الأحداث تسبب تغييرات كيميائية حيوية مفاجئة وجذرية في الجسم المحمي من الماء45,46. قد تحمل جريان مياه الأمطار الملوثات والرواسب والمواد المغذية الزائدة، والتي تزيد من العكر وانخفاض نوعية المياه47. قد تكون العوالق المغذية للتصفية، مثل Oikopleura،عرضة بشكل خاص لهذه التغييرات بسبب طريقة التغذية ومحدودية الحركة. في مثل هذه الظروف، نوصي بتأجيل أخذ العينات لبضعة أيام حتى تعود الظروف المحلية إلى طبيعتها.
إدخال نظام تصفية متعدد الخطوات أمر ضروري للحفاظ على الكائنات الصغيرة، والكائنات المغذية للتصفية مثل O. dioica. وباستخدام مياه البحر التي تمت تصفيتها بشكل سيئ (على سبيل المثال، شبكة 25 ميكرومتر في نظام الثقافة السابق)، كانت الثقافة غير مستقرة في كثير من الأحيان خاصة خلال فصل الصيف، مما قد يرجع إلى ارتفاع وفرة العوالق النباتية. على الرغم من أن بعض العوالق النباتية مفيدة لنمو O. ديويكا، والبعض الآخر إنتاج السموم البيومين التي يمكن أن تسبب تطورا غير طبيعي من أجنة O. ديويكا 48. وبالإضافة إلى ذلك، تركيز عالية من الدياتوم مثل Chaetoceros SPP. يحتمل أن تكون ضارة لنمو O. dioica لأنها يمكن أن تمتلك setae طويلة التي يمكن أن تسد المنزل ومنع التغذية الفعالة49. لاحظنا في كثير من الأحيان منازل الحيوانات الصغيرة التي انسداد من قبل C. calcitrans setae; لذلك، نحن الآن تغذية C. calcitrans فقط للحيوانات في اليوم 2 وما فوق(الجدول 3).
على الرغم من أنها لم تكن مشكلة هنا, على نطاق صغير على المدى الطويل زراعة O. دييكا يمكن أن تشهد انخفاض مفاجئ في حجم السكان بسبب اختناق وراثي; في مثل هذه الحالات، يوصي Martí-Solans وآخرون29 بإضافة أفراد جدد من البرية إلى الثقافة كل 20 جيلًا.
نظام ثقافة Oikopleura مرن. ويمكن تأسيس ثقافة مستقرة في غضون أسبوع. من الممكن زراعة أو دييكا على المدى الطويل على ميزانية متواضعة مع معدات غير متخصصة. الجهد اليومي اللازم للحفاظ على 5-10 قارور من أوكوبلوبورا هو عادة أقل من 2 ساعة مع 2 الناس. O. يمكن الحفاظ على ديويكا أيضا في مياه البحر الاصطناعية، وهو أمر مفيد لأولئك الذين لا يستطيعون الوصول إلى مياه البحر الطبيعية28. التخزين طويل الأجل من المواد الغذائية الطحالب ممكن باستخدام ثقافة صلبة و التبريد29. وعلاوة على ذلك، يمكن أن يكون o. الحيوانات المنوية دييكا cryopreserved، وتبقى قابلة للحياة لأكثر من عام50. وكل هذه العوامل تعني أنه يمكن إعادة الثقافات بسهولة. وأخيرا ، تجربة الماضي مع زراعة عرضي من Pleurobrachia sp. قد تشير إلى أن نظام زراعة التي وضعت لأوكبلورا يمكن أن تمتد إلى مجتمع أوسع من الكائنات العضوية البحرية الهشة.
O. دييكا تواصل تقديم رؤى قوية في مختلف المجالات البيولوجية. إن فهم الموسمية المحلية، ونظام الثقافة الدقيق، وعدد قليل من الأفراد المتفانين يسمح بنشأة ثقافة فعالة مع القليل من الجهد. يوفر نظام أوكوببورا للثقافة الموارد الأساسية لدراسة مجموعة واسعة من المجالات البيولوجية المتعلقة بالبيئة والتنمية وعلم الجينوم وتطور هذه الوترات البحرية الفريدة.
Disclosures
ليس لدى صاحب البلاغ ما يعلنه.
Acknowledgements
ونحن ممتنون لغارث إلسلي لدعمه في إنشاء النظام الثقافي. ونحن نعترف مساهمات ريتسوكو سوياما وسيلفان غيلوت في جهود أخذ العينات المبكرة وتحديد الأنواع. ومن المقرر شكر خاص لهيروكي نيشيدا، اكيشي أوناما، وتاتسويا أوموتزاكو لدعمهم وتوجيههم السخي في جميع أنحاء، بما في ذلك إنشاء أولي لنظام الاستزراع المحلي وتقاسم الحيوانات والثقافة الصغيرة. كما نشكر دانيال شوروت، وجان ماري بوكيه، وآن أسيوورد، وكريستيان كانيسترو، وألفونسو فيرناديز - رولدان لتقاسم خبراتهم في أخذ العينات والاستزراع. قدم جاي دينتون وتشارلز بلازي وجيفري جولي تعليقات لا تقدر بثمن على المخطوطة. وضعت شارلوت ويست معادلة معممة لحساب الطحالب. وأخيراً، نشكر OIST على التمويل، وماري كولينز ولجنة سلامة العمل الميداني التابعة لمنظمة "أوست" للحصول على المشورة بشأن إجراءات أخذ العينات الآمنة، وموظفي متجر آلات OIST لبناء معدات الزراعة وأخذ العينات، وكويتشي تودا لتسليم مياه البحر.
Materials
| Name | Company | Catalog Number | Comments |
| Activated charcoal | Sigma | C2764-2.5KG | |
| Alluminum pulley | Rainbow Products | 10604-10607 | |
| Biotin | Sigma | B4501-100MG | |
| Boric acid | Wako | 021-02195 | |
| Cobalamin (B12) | Sigma | V2876-100MG | |
| Cobalt(II) chloride hexahydrate | Wako | 036-03682 | |
| Copper(II) sulfate pentahydrate | Wako | 039-04412 | |
| Disodium edetate hydrate | Wako | 044-29525 | |
| Hexaammonium heptamolybdate tetrahydrate | Wako | 019-03212 | |
| Hexagon wrench | Anex | No.6600 | |
| Hydrochloric acid | Wako | 080-01066 | |
| Iron(III) chloride hexahydrate | Wako | 091-00872 | |
| Jebao programmable auto dosing pump | Jebao | DP-4 | |
| Magnet pump | REI-SEA | RMD-201 | |
| Manganese(II) chloride tetrahydrate | Wako | 134-15302 | |
| Polypropylene wound cartridge filter | Advantec | TCW-10N-PPS | |
| TCW-5N-PPS | |||
| TCW-1N-PPS | |||
| Screwless terminal block | SATO PARTS | SL4500 | |
| Simple plankton net | RIGO, Japan | 5512-C | |
| Sodium metasilicate | Sigma | 307815-1KG | |
| Sodium nitrate | Wako | 195-02545 | |
| Sodium phosphate monobasic anhydrous | MP Biomedicals | 194740 | |
| Streptomycin sulfate salt | Sigma | S6501-25G | |
| Synchronous electric motor | Servo | D5N6Z15M | |
| Thiamin hydrochloride | Wako | 201-00852 | |
| UV sterilizer | Iwaki | UVF-1000 | |
| Zinc chloride | MP Biomedicals | 194858 |
References
- Travis, J. Is It What We Know or Who We Know? Choice of Organism and Robustness of Inference in Ecology and Evolutionary Biology (American Society of Naturalists Presidential Address). The American Naturalist. 167 (3), 303-314 (2006).
- Jenner, R. A., Wills, M. A. The choice of model organisms in evo-devo. Nature Reviews Genetics. 8 (4), 311-314 (2007).
- Irigoien, X., Huisman, J., Harris, R. P. Global biodiversity patterns of marine phytoplankton and zooplankton. Nature. 429 (6994), 863-867 (2004).
- Wilson, S., Ruhl, H., Smith, J. Zooplankton fecal pellet flux in the abyssal northeast Pacific: A 15 year time-series study. Limnology and Oceanography. 58 (3), 881-892 (2013).
- Steinberg, D. K., Lomas, M. W., Cope, J. S. Long-term increase in mesozooplankton biomass in the Sargasso Sea: Linkage to climate and implications for food web dynamics and biogeochemical cycling. Global Biogeochemical Cycles. 26 (1), 1004 (2012).
- Lombard, F., Kiørboe, T. Marine snow originating from appendicularian houses: Age-dependent settling characteristics. Deep Sea Research Part I: Oceanographic Research Papers. 57 (10), 1304-1313 (2010).
- Fenaux, R., Bone, Q. . The Biology of Pelagic Tunicates. , 251-264 (1998).
- Hopcroft, R. R., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 45-57 (2005).
- Walters, T. L., Gibson, D. M., Frischer, M. E. Cultivation of the Marine Pelagic Tunicate Dolioletta gegenbauri (Uljanin 1884) for Experimental Studies. Journal of Visualized Experiments. (150), e59832 (2019).
- Deibel, D. Feeding mechanism and house of the appendicularian Oikopleura vanhoeffeni. Marine Biology. 93 (3), 429-436 (1986).
- Spada, F., et al. Molecular patterning of the oikoplastic epithelium of the larvacean tunicate Oikopleura dioica. Journal of Biological Chemistry. 276 (23), 20624-20632 (2001).
- Flood, P. R., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 59-85 (2005).
- Tokioka, T. Studies on the distribution of appendicularians and some thaliaceans of the North Pacific, with some morphological notes. Publication of the Seto Marine Biological Laboratory. (8), 351-443 (1960).
- Alldredge, A. L. Discarded appendicularian houses as sources of food, surface habitats, and particulate organic matter in planktonic environments. Limnology and Oceanography. 21 (1), 14-24 (1976).
- Clarke, C., Roff, J. C. Abundance and biomass of herbivorous zooplankton off Kingston, Jamaica, with estimates of their annual production. Estuarine, Coastal and Shelf Science. 31 (4), 423-437 (1990).
- Hopcroft, R. R., Roff, J. C. Zooplankton growth rates: extraordinary production by the larvacean Oikopleura dioica in tropical waters. Journal of Plankton Research. 17 (2), 205-220 (1995).
- Hopcroft, R. R., Roff, J. C. Production of tropical larvaceans in Kingston Harbour, Jamaica: are we ignoring an important secondary producer. Journal of Plankton Research. 20 (3), 557-569 (1998).
- Mochioka, N., Iwamizu, M. Diet of anguilloid larvae: leptocephali feed selectively on larvacean houses and fecal pellets. Marine Biology. 125 (3), 447-452 (1996).
- Sakaguchi, S. O., et al. Morphological identity of a taxonomically unassigned cytochrome c oxidase subunit i sequence from stomach contents of juvenile chum salmon determined using polymerase chain reaction. Fisheries Science. 83 (5), 757-765 (2017).
- Fenaux, R., Bone, Q. . The Biology of Pelagic Tunicates. , 25-34 (1998).
- Sato, R., Tanaka, Y., Ishimaru, T. House production by Oikopleura dioica (Tunicata, Appendicularia) under laboratory conditions. Journal of Plankton Research. 23 (4), 415-423 (2001).
- Flood, R., Deibel, D., Bone, Q. . The Biology of Pelagic Tunicates. , 105-124 (1998).
- Alldredge, A., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 309-326 (2005).
- Katija, K., Sherlock, R. E., Sherman, A. D., Robison, B. H. New technology reveals the role of giant larvaceans in oceanic carbon cycling. Science Advances. 3 (5), 1602374 (2017).
- Katija, K., Choy, C. A., Sherlock, R. E., Sherman, A. D., Robison, B. H. From the surface to the seafloor: How giant larvaceans transport microplastics into the deep sea. Science Advances. 3 (8), 1700715 (2017).
- Hidaka, K. Species composition and horizontal distribution of the appendicularian community in waters adjacent to the Kuroshio in winter-early spring. Plankton and Benthos Research. 3 (3), 152-164 (2008).
- Bouquet, J. M., et al. Culture optimization for the emergent zooplanktonic model organism Oikopleura dioica. Journal of Plankton Research. 31 (4), 359-370 (2009).
- Nishida, H. Development of the appendicularian Oikopleura dioica: culture, genome, and cell lineages. Development, Growth & Differentiation. 50, 239-256 (2008).
- Martí-Solans, J., et al. Oikopleura dioica culturing made easy: A Low-Cost facility for an emerging animal model in Evo Devo. Genesis. 53 (1), 183-193 (2015).
- Holland, L. Z. Tunicates. Current Biology. 26 (4), 146-152 (2016).
- Delsuc, F., Brinkmann, H., Chourrout, D., Philippe, H. Tunicates and not cephalochordates are the closest living relatives of vertebrates. Nature. 439 (7079), 965-968 (2006).
- Seo, H. C., et al. Miniature genome in the marine chordate Oikopleura dioica. Science. 294 (5551), 2506 (2001).
- Fredriksson, G., Olsson, R. The subchordal cells of Oikopleura dioica and O. albicans (Appendicularia, Chordata). Acta Zoologica. 72 (4), 251-256 (1991).
- Paffenhöfer, G. A. The cultivation of an appendicularian through numerous generations. Marine Biology. 22 (2), 183-185 (1973).
- Fenaux, R., Gorsky, G. Nouvelle technique d'élevage des appendiculaires. Rapports et Procés-Verbaux des Réunions-Commission Internationale pour l'Exploration Scientifique de la Mer Méditerranée. 29, 291-292 (1985).
- Fujii, S., Nishio, T., Nishida, H. Cleavage pattern, gastrulation, and neurulation in the appendicularian, Oikopleura dioica. Development Genes and Evolution. 218 (2), 69-79 (2008).
- Patry, W. L., Bubel, M., Hansen, C., Knowles, T. Diffusion tubes: a method for the mass culture of ctenophores and other pelagic marine invertebrates. PeerJ. 8, 8938 (2020).
- Fenaux, R. The classification of Appendicularia (Tunicata): history and current state. Memoires de I'Institut oceanographique. , (1993).
- Shiga, N., Chihara, M., Murano, M. . Illustrated Guide to Marine Plankton in Japan. , 1393-1414 (1997).
- Gorsky, G., Castellani, C., Castellani, C., Edwards, M. . Marine Plankton: A practical guide to ecology, methodology, and taxonomy. , 599-606 (2017).
- Sato, R., Ishibashi, Y., Tanaka, Y., Ishimaru, T., Dagg, M. J. Productivity and grazing impact of Oikopleura dioica (Tunicata, Appendicularia) in Tokyo Bay. Journal of Plankton Research. 30 (3), 299-309 (2008).
- Nakamura, Y., Suzuki, K., Suzuki, S. Y., Hiromi, J. Production of Oikopleura dioica (Appendicularia) following a picoplankton 'bloom'in a eutrophic coastal area. Journal of Plankton Research. 19 (1), 113-124 (1997).
- Nakamura, Y. Blooms of tunicates Oikopleura spp. and Dolioletta gegenbauri in the Seto Inland Sea, Japan, during summer. Hydrobiologia. 385 (1-3), 183-192 (1998).
- Uye, S. I., Ichino, S. Seasonal variations in abundance, size composition, biomass and production rate of Oikopleura dioica (Fol)(Tunicata: Appendicularia) in a temperate eutrophic inlet. Journal of Experimental Marine Biology and Ecology. 189 (1-2), 1-11 (1995).
- Tsuchiya, K., et al. Phytoplankton community response and succession in relation to typhoon passages in the coastal waters of Japan. Journal of Plankton Research. 36 (2), 424-438 (2014).
- Lopez-Lopez, L., et al. Effects of typhoons on gelatinous carnivore zooplankton off Northern Taiwan. Cahiers de Biologie Marine. 53, 349-355 (2012).
- Ares, &. #. 1. 9. 3. ;., et al. Extreme storm-induced run-off causes rapid, context-dependent shifts in nearshore subtropical bacterial communities. bioRxiv. , (2019).
- Torres-Águila, N. P., et al. Diatom bloom-derived biotoxins cause aberrant development and gene expression in the appendicularian chordate Oikopleura dioica. Communications Biology. 1 (1), 1-11 (2018).
- Troedsson, C., Frischer, M. E., Nejstgaard, J. C., Thompson, E. M. Molecular quantification of differential ingestion and particle trapping rates by the appendicularian Oikopleura dioica as a function of prey size and shape. Limnology and Oceanography. 52 (1), 416-427 (2007).
- Ouchi, K., Nishino, A., Nishida, H. Simple procedure for sperm cryopreservation in the larvacean tunicate Oikopleura dioica. Zoological Science. 28 (1), 8-11 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved