Method Article
Muestreo y cultivo simplificados del larvato y cordorágico cosmopolitan, Oikopleura dioica
En este artículo
Resumen
Oikopleura dioica es un organismo modelo de tunicado en diversos campos de la biología. Describimos métodos de muestreo, identificación de especies, configuración de cultivo y protocolos de cultivo para los animales y piensos de algas. Destacamos los factores clave que ayudaron a fortalecer el sistema de cultura y discutir los posibles problemas y resoluciones.
Resumen
Oikopleura dioica es un acordeado planctónico con una capacidad excepcional de alimentación del filtro, tiempo de generación rápida, desarrollo temprano conservado y un genoma compacto. Por estas razones, se considera un organismo modelo útil para estudios ecológicos marinos, biología del desarrollo evolutivo y genómica. Como la investigación a menudo requiere un suministro constante de recursos animales, es útil establecer un sistema de cultivo confiable y de bajo mantenimiento. Aquí describimos un método paso a paso para establecer una cultura O. dioica. Describimos cómo seleccionar posibles sitios de muestreo, métodos de recolección, identificación de animales objetivo y la configuración del sistema de cultivo. Proporcionamos consejos de solución de problemas basados en nuestras propias experiencias. También destacamos los factores críticos que ayudan a sostener un sistema de cultivo sólido. Aunque el protocolo de cultivo proporcionado aquí está optimizado para O. dioica,esperamos que nuestra técnica de muestreo y configuración de cultivo inspire nuevas ideas para mantener otros invertebrados pelágicos frágiles.
Introducción
Los organismos modelo han sido fundamentales para abordar muchas cuestiones biológicas, incluidas las relacionadas con el desarrollo, la genética y la fisiología. Además, los organismos modelo adicionales facilitan nuevos descubrimientos y, por lo tanto, son cruciales para lograr una mayor comprensión de la naturaleza1,2. El zooplancton marino son diversos grupos de organismos que desempeñan un papel importante en los ecosistemas oceánicos3,,4,,5,,6. A pesar de su abundancia e importancia ecológica, organismos gelatinosos como los tunicados planctónicos a menudo están subrepresentados en los estudios de biodiversidad de plancton porque su transparencia y fragilidad hacen que la recolección e identificación de campo desafien7,,8. Las técnicas de muestreo adaptadas y el cultivo de laboratorio permiten una observación más estrecha de los animales in vitro, lo que ha favorecido el conocimiento en la biología de los tunicados planctónicos9,,10,,11,,12.
Los larvanos (Apéndices) son una clase de tunicados marinos de natación libre que comprenden alrededor de 70 especies descritas en todo el mundo8,13. Como son uno de los grupos más abundantes dentro de las comunidades de zooplancton14,15,16,17, larvasans representan una fuente de alimento primaria para organismos planctónicos más grandes como larvas de peces18,,19. A diferencia de los ascidios, los tunicados sésiles-larvaceanos conservan una morfología similar al renacuajo y permanecen planctónicos a lo largo de sus vidas20. Cada animal vive dentro de una estructura autoconstruta e intrincada de alimentación de filtros conocida como casa. Acumulan partículas en sus casas creando corrientes de agua a través del movimiento ondulado de sus colas21. Las casas obstruidas se desechan durante todo el día, algunas de las cuales forman agregados de carbono y finalmente se hunden en el fondo marino22; por lo tanto, los larvas desempeñan un papel importante en el flujo de carbono global23. Se informa que la mayoría de las especies viven en la zona pelágica dentro de los 100 m superiores de la columna de agua13; sin embargo, el bathochordaeus larvado gigante es conocido por habitar las profundidades de 300 m24. Un estudio sobre Bathochordaeus en Monterey Bay, California reveló que los animales también sirven como vector biológico de microplásticos, lo que sugiere una importancia potencial en la comprensión del papel de los apéndices en el transporte vertical y la distribución de microplásticos en los océanos25.
Oikopleura dioica,una especie de larvaceano, ha atraído la atención en los últimos años como organismo modelo debido a varias características notables. Se reporta comúnmente en todos los océanos del mundo. Es especialmente abundante en aguas costeras26,lo que permite un fácil muestreo desde la orilla. El cultivo estable a largo plazo es posible con agua de mar natural y artificial27,,28,,29. Los tiempos de generación dependientes de la temperatura son tan cortos como 4-9 días en condiciones de laboratorio. Tiene una alta fecundidad con cada hembra capaz de producir >300 huevos durante todo el año. Como tunicado, ocupa una importante posición filogenética para entender la evolución de los acordes30,,31. A 70 Mb, O. dioica tiene el genoma identificado más pequeño entre todos los acordes32. Entre los larvanos, O. dioica es la única especie no hermafrodita descrita hasta ahora33.
El primer cultivo exitoso de O. dioica con microalgas cultivadas en laboratorio fue reportado por Paffenh-fer34. El protocolo de cultivo original utilizando motores y paletas síncronos fue desarrollado por Fenaux y Gorsky35 y más tarde adoptado por múltiples laboratorios. Más recientemente, Fujii et al.36 informaron que O. dioica cultivaba el cultivo en agua de mar artificial, un sistema de cultivo robusto y la recolección de campo fueron descritos por Bouquet et al.27 y Marti-Solans et al.29informó de un protocolo optimizado para un sistema simplificado y asequible. Aparte del sistema de cultivo tradicional de Oikopleura, un diseño recién reportado con un tanque de cría de doble tubo también tiene el potencial de cultivar Oikopleura sp. 37.
Presentamos un protocolo detallado para iniciar un monocultivo O. dioica basado en una combinación de protocolos desarrollados por los principales grupos de investigación de Oikopleura en el Centro Internacional Sars de Biología Molecular Marina27,la Universidad de Barcelona29,la Universidad de Osaka28y nuestras propias observaciones. En los protocolos de cultivo publicados anteriormente, la información detallada sobre la composición de los medios de algas, las técnicas de muestreo en tierra y la identificación de Oikopleura sólo se describieron aproximadamente, dejando una gran cantidad de ambiguedad. Aquí, con la ayuda de la información visual en el protocolo de vídeo, hemos reunido toda la información crítica necesaria para establecer una cultura O. dioica desde cero de una manera sencilla y paso a paso. Describimos cómo distinguir O. dioica de otra especie comúnmente reportada, O. longicauda, que es uno de los pasos más desafiantes. Aunque los sistemas de cultivo existentes son aplicables para el cultivo de O. dioica en todo el mundo, destacamos la importancia del ajuste del protocolo basado en las condiciones ambientales locales. La información presentada combina datos ampliamente publicados, así como conocimientos adquiridos a través de la experiencia. El protocolo actual es ideal para investigadores interesados en establecer una cultura desde cero.
Protocolo
1. Facilidad de cultivo de O. dioica
- Sistema de filtro de agua (Figura 1)
- Recoger el agua de mar natural de un puerto a 2-3 m de profundidad. Pasar el agua de mar a través de un filtro de arena (tamaño de poro 1,4 mm) y transportar a un tanque de depósito compartido en el laboratorio. Utilice un filtro de recipiente para hacer circular el agua con el fin de mantener la calidad del agua en el tanque del depósito compartido.
- En una sala de cultivo, configure un sistema de filtro de varios pasos que consista en un tanque de depósito de 100 L con una bomba de accionamiento magnético, filtros de cartucho de polipropileno de 5 y 1 m, y un esterilizador UV (100 V)(Figura 1).
- Transfiera el agua de mar desde el tanque del depósito compartido al tanque del depósito de la sala de cultivo. Pase el agua de mar a través de una unidad de filtro de 25 m(Figura 1A,B) antes de entrar en el tanque del depósito de la sala de cultivo. Circule el agua de mar a través de filtros de 5 y 1 m durante la noche para eliminar a fondo las partículas que podrían dificultar el desarrollo de los animales.
NOTA: Un filtro adicional con un tamaño de malla más grande (25-50 m) es útil para evitar que partículas más grandes obstruyan los filtros de cartucho con tamaños de malla más pequeños. El agua de mar filtrada (fSW) está lista para su uso a la mañana siguiente.
-
Unidad de cultivo de Oikopleura (Figura 2)
- Mantenga a los animales en vasos de plástico transparentes redondos de 5 o 10 L.
- Coloque vasos de cultivo en una unidad de estanterías de acero inoxidable estable de dos niveles (L x W x H x 150 cm x 45 cm x 90 cm) con una placa de superficie acrílica transparente de 5 mm de espesor.
- Coloque las luces fluorescentes blancas debajo de la superficie acrílica para iluminar a los animales desde la parte inferior de los vasos.
- Coloque una lámina de plástico negro detrás de los vasos. La hoja negra crea contraste y mejora la visualización de los animales transparentes.
- Conectar motores eléctricos síncronos a paletas de acrílico (L x H a 8 cm x 27 cm) (Archivo Suplementario 2). Suspenda las paletas en los vasos de cultivo de los rieles paralelos que recorren a lo largo de la unidad de estanterías (Figura 2A).
- Encienda los motores para generar un movimiento circular suave en los vasos de pico a 15 RPM.
NOTA: Los animales en sus casas de celulosa son neutralmente boyantes; sin embargo, la circulación del agua ayuda a mantener los huevos, larvas y alimentos de algas para ser suspendidos y distribuidos uniformemente en los vasos de cultivo.
- Bomba dosificadora automática (opcional)
NOTA: Una unidad de alimentación automática reduce los requisitos de personal, especialmente durante los fines de semana.- Calibre el volumen de líquido dispensador de una bomba dosificadora automática de acuerdo con las instrucciones del fabricante.
- Utilice tubos de 50 ml como reservorios de algas.
- Taladre dos orificios de 5 mm en las tapas de tubos de 50 ml para pasar a través de tubos de línea aérea. Conecte un tubo a una bomba de aire de acuario estándar para introducir burbujas de aire, y el otro tubo al puerto de entrada de la bomba dosificadora (Figura 2B).
NOTA: La introducción de una fina corriente de burbujas de aire ayuda a evitar que las algas se asienten en la parte inferior de los tubos. - Programe la hora y el volumen de alimento de algas que se dispensarán en un día determinado.
- Estación de algas
- Utilice una unidad de estanterías (L x An x H a 90 cm x 46 cm x 115 cm) para colocar cuatro matraces de fondo redondo de 1 L que contengan cultivos de trabajo de algas (véase el paso 2.1).
- Ilumina de nuevo los cultivos de trabajo colocando luces fluorescentes detrás de los matraces.
- Sellar matraces con tapones de goma de dos orificios.
- Pase una pipeta desechable de 1 ml a través del tapón de goma. Utilice tubos de aerolíneas para conectar la pipeta a una bomba de aire de acuario. Introducir una corriente de burbujas de aire en el matraz.
2. Alimentos con microalgas
- Iniciando culturas de algas
NOTA: Mantener tres conjuntos de cultivos (cultivos de stock, sub y de trabajo) para tres especies de microalgas, Chaetoceros calcitrans, Isochrysis sp., Rhinomonas reticulata, y una especie de cianobacterias, Synechococcus sp.. Las referencias y subculturas se utilizan como copias de seguridad. El cultivo de trabajo se utiliza para la alimentación diaria.- Preparar los reactivos necesarios para el cultivo de microalgas y cianobacterias (Tabla 1).
- Para iniciar el cultivo de stock, autoclave (121oC, 25 min) 60 – 80 mL de fSW en un matraz Erlenmeyer de 100 ml. Inópticamente inocular la cantidad especificada de medio Conway modificado27 y microalgas (Tabla 2). Por ejemplo, para inocular un cultivo de C. calcitrans, autoclave 60 mL de agua de mar, inoculación asépticamente 30 l cada una de la vitamina y solución A, 15 l de silicato de sodio, 60 l de estreptomicina y 30 l de C. calcitran del cultivo de stock anterior.
NOTA: R. reticulata pasa de rosa rojizo a marrón orangish cuando se expone a demasiada luz. Aléjalos de la luz una vez que hayan comenzado a pasar de rosa claro a rosa claro. - Mantener el cultivo de stock en una incubadora situada a 17oC con iluminación continua. Después de unos 10 días, la cultura cambia de color para indicar el crecimiento de algas (Figura 3). Una vez que aparezcan los colores, muévalos a 4 oC para almacenamiento a largo plazo durante un máximo de 1 mes.
- En un banco limpio, inocular asépticamente una subcultura de la cultura de valores (Tabla 2). Incubar a 17oC con iluminación continua. Después de que aparezcan los colores de algas, continúe guardándolos en la incubadora hasta 2 semanas.
- Inocular la cultura de trabajo de la subcultura (Tabla 2). Selle el matraz con una tapa de goma e inserte una pipeta desechable de 1 ml. Mueva el matraz a la estación de algas y mantenga a temperatura ambiente con un fotoperiodo de 8 h. Suministro con aireación constante. Renovar la cultura de trabajo cada 4 días.
- Revuelva las existencias y las subculturas dos veces al día arremolinando.
NOTA: El almacenamiento a largo plazo de la cultura de algas en medios sólidos y la criopreservación son posibles hasta 3 meses y 1 año, respectivamente29.
- Creación de curvas de crecimiento de algas (opcional)
NOTA: La evaluación precisa de la cantidad de alimentación es importante para mantener un cultivo estable de O. dioica. Creamos curvas de crecimiento para dos especies primarias de algas, Chaetoceros calcitrans e Isochrysis sp.- Preparar cultivos de trabajo C. calcitrans e Isochrysis sp. (Tabla 2).
- Para cada especie de cultivo de trabajo, muestree tres veces separadas y mida las absorbancias a 660 nm utilizando un espectrofotómetro. Tome las medidas medias de los triplicados de cada cultivo de trabajo.
- Siguiendo las instrucciones del fabricante para un contador de células automatizado, prepare muestras de algas para el recuento. Cuente cada muestra tres veces. Tome el promedio de tres recuentos para determinar el número total de celdas presentes en cada muestra.
- Continúe contando diariamente hasta que se registren aproximadamente 50 mediciones promedio.
- Crear curvas de crecimiento para ambas especies de algas (Figura 4).
3. Colección de campo de Oikopleura spp salvaje.
- Red de plancton modificada (Figura 5)
NOTA: La clave para el muestreo exitoso de Oikopleura spp. es el remolque lento de una red de plancton con un extremo de bacalao ponderado y sin filtrado. La Figura 5 muestra un diagrama esquemático de una red de plancton modificada.- Sustituya el extremo de bacalao de una red de plancton de mano por una botella de lavado atornillada de 500 ml modificada.
- Taladre un orificio de 3 cm de diámetro en la tapa atornillada de 4 cm de diámetro de la botella de lavado para permitir que el agua y los animales entren en el extremo del bacalao.
- Coloque la tapa de la botella al final de la red de plancton. Envuélvelo firmemente con cinta eléctrica. Asegure aún más la tapa con una abrazadera de manguera de acero inoxidable.
- Fije un peso de 70 g al exterior del extremo de bacalao modificado con lazos de cremallera.
- Coloque la correa de seguridad para asegurar aún más el extremo del bacalao.
- Selección de sitios de recopilación (Figura 6)
NOTA: Todas las colecciones de muestras fueron aprobadas por el Comité de Seguridad del Trabajo de Campo de la OIST. Puede haber variación estacional en presencia de Oikopleura spp. dependiendo de la ubicación (Figura 6). Evite tomar muestras inmediatamente después de eventos climáticos extremos, como tormentas severas.- Utilice la vista por satélite en un sitio web de mapa para identificar posibles sitios de muestreo. Nos centramos en puertos y muelles de pesca que son fácilmente accesibles en coche y ubicados dentro de bahías o cerca de descensos oceánicos donde el plancton tiende a acumularse: el puerto de Ishikawa en Kin Bay, Okinawa, Japón (GPS: 26 x 25'39.3"N 127-49'56.6"E).
- Visite posibles lugares de muestreo para evaluar la accesibilidad y la seguridad en la costa de cada sitio. Obtenga permiso de recogida de las autoridades locales según sea necesario.
- Procedimiento de muestreo
- Arroje la red de plancton al mar y permita que el extremo del bacalao se hunda 1-2 m por debajo de la superficie del agua.
- Remolcar la red horizontalmente a mano a 50-100 cm s-1. Continúe remolcando caminando de ida y vuelta durante 2-5 minutos. Ajuste el tiempo de remolque de acuerdo con la abundancia de fitoplancton en el puerto, con remolque más corto cuando hay más fitoplancton.
NOTA: Los larvatos son animales frágiles. El remolque rápido o la fundición repetida de la red podrían dañar a los animales atrapados en el extremo del bacalao. - Levante suavemente la red. Transfiera lentamente el contenido del extremo del bacalao en una botella de vidrio redonda de 500 ml. Llene completamente la botella de muestra con agua de mar para evitar burbujas de aire.
NOTA: La presencia de Oikopleura spp. se puede confirmar viendo botellas de muestra sobre un fondo negro. La mayoría de los animales abandonan sus casas mientras son recogidos. Por lo tanto, la observación microscópica es necesaria para la identificación a nivel de especie. - Repita el muestreo hasta que se recojan tres botellas de 500 ml.
- Mida la salinidad, la temperatura y la clorofila utilizando un generador de perfiles CTD para registrar el rango de parámetros físicos donde los animales existen naturalmente.
- Recoger 10-15 L de agua de mar superficial en un cubo para aclimatar a los animales en el entorno de laboratorio.
4. Aislamiento e identificación de animales(Figura 7, Figura 8)
-
Identificación de Oikopleura spp.
NOTA: Otros organismos planctónicos que pueden parecerse a Oikopleura spp. a primera vista incluyen chaetognaths, Fritillaria spp., nematodos, larvas de peces con yema-sacs, y Ciona spp. larvas.- Para aclimatar a los animales a las condiciones de laboratorio, transfiera cada muestra de 500 ml a un vaso de precipitados de 10 L que contenga una relación de 1:1 de agua de mar superficial desde el lugar de muestreo y agua de mar filtrada (fSW) mantenida en el laboratorio (Figura 7A,B). Ajuste el volumen del vaso de precipitados a 5-10 L dependiendo de la concentración de la muestra de plancton.
NOTA: Si la muestra de plancton contiene residuos no deseados, pase a través de un filtro grueso (tamaño de malla de 600 m) antes de transferirlo a un vaso de precipitados de 10 L. - Utilice una paleta unida a un motor eléctrico síncrono (15 RPM) y mantenga el plancton en suspensión durante la noche (paso 1.2.5).
- Identifique Oikopleura spp. buscando animales de 1-2 mm de largo, en forma de renacuajo, ondulando sus colas dentro de una casa esférica y translúcida. Algunos animales pueden nadar temporalmente sin las casas. Transfiera suavemente 5 animales a un plato petri vacío usando una pipeta de extremo romo.
- Para la identificación del género, desalojar a los animales de sus casas pinchando suavemente la casa con una pipeta de transferencia.
- Observe animales sin casa bajo un microscopio de campo oscuro de 20-40x y confirme Oikopleura spp (Figura 8).
- Para aclimatar a los animales a las condiciones de laboratorio, transfiera cada muestra de 500 ml a un vaso de precipitados de 10 L que contenga una relación de 1:1 de agua de mar superficial desde el lugar de muestreo y agua de mar filtrada (fSW) mantenida en el laboratorio (Figura 7A,B). Ajuste el volumen del vaso de precipitados a 5-10 L dependiendo de la concentración de la muestra de plancton.
-
Identificación de O. dioica
NOTA: O. dioica se puede identificar visualmente por la presencia de machos y hembras completamente maduros o dos grandes células subcordal situadas en la mitad distal de suscolas. La distancia entre dos células subchordal puede variar entre individuos.- A continuación, compruebe si hay un Oikopleura completamente maduro con una gónada llena de óvulos (Figura 8A) o espermatozoides (Figura 8B). Si el animal sólo posee óvulos o espermatozoides, salte al paso 4.2.3 ya que es O. dioica,la única especie no hermafrodita descrita.
- Si el animal es inmaduro (Figura 8C), busque dos células subcordal al final de su cola (Figura 8D).
- Una vez confirmada la especie, transfiérala a un nuevo plato de Petri. Repita los pasos 4.1.3-4.2.2 hasta que se confirmen 10-20 individuos a nivel de especie.
NOTA: Para facilitar la identificación, anestesia a los animales en un plato de Petri que contenga 0.015% de metanesulfonato tricaine (MS222) en fSW. - Si no se encuentra O. dioica, mantenga los vasos suspendidos durante uno o dos días más. Puede haber inmaduro O. dioica que continuará creciendo y será más fácil de detectar. Si no aparece ninguno después de una semana, deseche la muestra e intente realizar el muestreo de nuevo.
5. Protocolo de cultivo para O. dioica
- Iniciar un monocultivo de O. dioica a partir de una muestra recogida en el campo (Figura 7)
NOTA: Los alimentos de algas se preparan diariamente a partir de cultivos de trabajo y cada vaso de monocultivo se alimenta tres veces al día a las 9 a. m., a las 12 p. m. y a las 5 p. m., respectivamente (ver paso 5.2). Los animales se mantienen a 23oC. En estas condiciones, el ciclo de vida de Okinawa O. dioica es de 4 días(Figura 7C).- Para iniciar un monocultivo de O. dioica,aislar 120 animales y transferir a un nuevo vaso de precipitados que contenga 5 L de fSW fresco (Figura 7B,C).
- A la mañana siguiente, busque machos completamente maduros con gónadas amarillas y hembras con huevos que aparezcan como esferas doradas(Figura 8A,B).
- Hacer un vaso de desove mediante la transferencia suave de 15 machos y 30 hembras a un nuevo vaso de precipitados que contiene 2,5 L de fSW fresco con una pipeta de extremo romo de 5 ml.
NOTA: Si no hay suficientes machos y hembras, transfiera tantos adultos como sea posible a un vaso de precipitados que contenga 1 L de fSW y déjelos desovar naturalmente. Para minimizar el estrés físico a los animales durante la transferencia manual, deben ser sifoneados lentamente y liberados bajo la superficie del agua. - Deja que los animales desoven naturalmente para iniciar la próxima generación. Las larvas de cola deben aparecer aproximadamente 3 horas después de la fertilización.
NOTA: El desove es realizado por animales completamente maduros que abandonan sus casas, nadan hacia las aguas superficiales y liberan sus gametos. La fertilización exitosa se puede confirmar extrayendo 5-10 ml de agua de mar del fondo del vaso de precipitados e identificando los huevos con escotes bajo un microscopio. - En la primera mañana después del desove (Día 1), una nueva generación de animales con casas infladas debe aparecer en el vaso de precipitados. Utilice un vaso de precipitados de 500 ml para transferir suavemente el contenido del vaso de precipitados de desove a un vaso de precipitados nuevo que contenga 7,5 L de fSW fresco (haciendo un total de 10 L). Vierta en un ángulo para evitar un movimiento de salpicaduras.
- En la segunda mañana (Día 2), transfiera manualmente 150 animales a un vaso de precipitados nuevo que contenga 5 L de fSW fresco.
- En la tercera mañana (Día 3), transfiera manualmente 120 animales a un nuevo vaso de precipitados con 5 L de fSW fresco.
NOTA: Para sincronizar el desarrollo de animales, es importante seleccionar individuos con tamaños similares durante la transferencia manual los días 2 y 3. Se puede utilizar un máximo de 10 animales en una sola transferencia. - En la cuarta mañana (Día 4), deben aparecer animales completamente maduros. Repita el paso 5.1.3 para cerrar el ciclo de vida.
NOTA: Se puede configurar una bomba de alimentación automatizada para alimentar a los animales a las 5 PM los fines de semana sin la presencia de personal de cultivo.
- Preparación diaria de alimentos de algas de la cultura de trabajo
- Mida la absorbancia del cultivo de trabajo a 660 nm.
- Sobre la base de la carta de alimentación diaria, averiguar cuántas células de algas necesitan ser alimentados para los animales de tamaño específico (Tabla 3).
- Usando las curvas de crecimiento de algas (Figura 4), resuelva las ecuaciones a continuación para calcular el volumen de alimentos de algas (ml) requeridos en un día determinado.
- Para calcular el volumen de una alga en particular necesaria para un día específico y el tiempo de alimentación, utilice la siguiente ecuación:
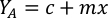
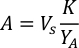
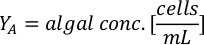
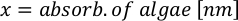
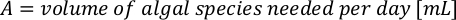
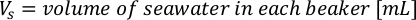
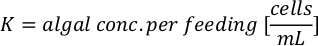
Donde YA es la concentración de algas en un día dado y A es el volumen de algas necesarias por alimentación. Además, la relación lineal entre YA y x, los valores de interceptación (c) y pendiente (m) se muestran en la Figura 4. Consulte la Tabla 3 para ver los valores K. - Por ejemplo, para calcular el volumen de Isochrysis sp. necesario en una alimentación de 9 AM de animales del día 3 mantenidos en un cultivo de 5 L y con la absorbancia de algas de 0,234 (medida a 660 nm), se calculó lo siguiente:
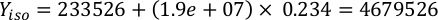
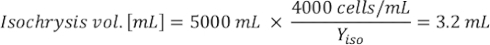
NOTA: Almacene estas ecuaciones en una hoja de cálculo para que la cantidad de alimentación diaria se calcule automáticamente en función de las mediciones de absorbancia, el tamaño de los animales y el volumen de agua de mar de cultivo (Archivo Suplementario 1).
- Para calcular el volumen de una alga en particular necesaria para un día específico y el tiempo de alimentación, utilice la siguiente ecuación:
- Transfiera el volumen calculado de algas a tubos de 50 ml, centrífuga a 5000 x g durante 5 min a 20oC.
- Retire el sobrenadante. Llene los tubos hasta el volumen original con fSW fresco, reemplazando los medios de algas viejos.
- Almacene los alimentos preparados en la nevera hasta que estén listos para ser utilizados para el próximo alimento. Deseche la comida de algas vieja después de que se preparen nuevos alimentos a la mañana siguiente.
- Carbón activado (Opcional)
NOTA: se añaden 10 g de carbón activado a cada vaso de cultivo para mantener la calidad del agua. El carbón se puede reutilizar hasta cuatro veces. Abra la bolsa de carbón lentamente para evitar que el polvo de carbón entre en los vasos de cultivo.- Transfiera 700 g de carbón activado en un recipiente. Remoje en agua dulce (FW) durante 48 horas y déjelos asentarse en el fondo.
- Enjuague con FW para eliminar el polvo de carbón residual.
- Hervir el carbón en FW durante 15-20 min. Retirar del fuego y dejar enfriar.
- Enjuague hasta que se retire la mayor parte del polvo de carbón y el agua se despeje.
- Almacene el carbón limpio en 2 L vaso que contenga fSW. Cubra el vaso de precipitados para evitar que entre polvo.
- Añadir carbón a cada vaso nuevo antes de transferir los animales.
Resultados
Oikopleura se puede recoger de un barco o de un puerto mediante un remolque lento y suave de una red de plancton de malla de 100 m con un extremo de bacalao sin filtrado(Figura 5). Debido a la naturaleza frágil de los animales, es importante evitar cualquier movimiento que pueda causar estrés físico, como el manejo brusco de la red o salpicaduras debido a un bolsillo de aire atrapado en el frasco de muestra.
Es importante entender el patrón estacional de las poblaciones locales de Oikopleura, así como las fluctuaciones que lo acompañan en las características físicas del agua en un sitio de muestreo. El muestreo entre 2015 y 2019 reveló una variación estacional constante en la presencia de O. dioica en los puertos de Ishikawa y Kin en Okinawa (Figura 6). La temperatura del agua de mar superficial parece ser un factor importante. O. dioica era la especie dominante cuando el agua de mar superficial alcanzó los 28 oC, y O. longicauda coexistió con O. dioica a temperaturas entre 24oC y 27oC; sin embargo, O. longicauda dominó por debajo de 23 oC(Figura 6A). El cambio gradual en la salinidad después de varios días consecutivos de lluvia intensa no se correlacionó con la abundancia de O. dioica (Figura 6B).
Utilizando los procedimientos de muestreo descritos anteriormente, la mayoría de O. dioica que recuperamos estaban entre el día 2 y el 3 de su ciclo de vida de 4 días (Figura 7C). Los machos maduros fueron reconocidos por la coloración amarilla de las gónadas, mientras que las gónadas hembras brillaban en oro de huevos de 70-80 m de diámetro(Figura 8A,B). Inmaduros O. dioica fueron confirmados por dos células subcordal en sus colas (Figura 8D). Otra especie dominante en las aguas locales, O. longicauda,eran similares en tamaño y morfología. Utilizamos los siguientes criterios para distinguir O. longicauda de O. dioica38,39,40: una falta de células subchordal en la cola, la presencia de velum en el tronco, y la presencia de una gónada hermafrodita ( Figura8E,F). Las diferentes morfologías de la cola también son útiles para distinguir O. longicauda de O. dioica. Cuando un animal desnudo intacto sin la casa se orientaba lateralmente, la cola de O. longicauda era más recta con menos curvatura, dándole un aspecto "más rígido" en comparación con el de O. dioica.
Los tres factores más importantes para establecer un sistema de cultivo estable de Oikopleura son (i) mantener una alta calidad del agua, (ii) identificar el régimen de alimentación óptimo, y (iii) establecer un vaso de desove con un número suficiente de machos y hembras. La introducción de un sistema de filtro de varios pasos (Figura 1) mejoró la calidad del agua y la estabilidad del cultivo. Un sistema de filtración no es necesario para el agua de mar artificial; sin embargo, el costo, la disponibilidad y la comodidad del agua de mar natural lo convierten en una mejor opción para laboratorios situados cerca de la costa. Para establecer el régimen de alimentación, recomendamos medir las curvas de crecimiento de algas que se aplican a entornos de laboratorio individuales, ya que las condiciones de temperatura y luz varían mucho. Combinamos las curvas de crecimiento con los calendarios de alimentación publicados anteriormente para optimizar las concentraciones y composiciones de piensos de algas27 (Figura 4). También seguimos un estricto programa de inoculación de algas para mantener un suministro fresco de alimentos de algas (Tabla 2). El sistema de alimentación automatizado nos permite mantener un horario de alimentación diario constante sin la presencia de personal de cultivo(Figura 2B).
Una vez que se logran condiciones óptimas de agua de mar y alimentación, es importante iniciar nuevas generaciones creando un vaso de precipitados con 15 machos y 30 hembras en 2,5 L de fSW. Esto garantiza una buena concentración de los animales del Día 1 a la mañana siguiente, que es suficiente para aislar 150 animales en el Día 2, 120 el Día 3 y 45 adultos maduros en el Día 4 para desove. Si no hay suficientes machos y hembras en el Día 4, recoja y transfiera tantos individuos maduros como sea posible a 1 L de fSW y déjelos desovar naturalmente con la esperanza de que haya suficientes larvas para llevar a la próxima generación. Siguiendo el protocolo proporcionado, el ciclo de vida de O. dioica es de 4 días a 23 oC(Figura 7C). Hemos establecido de forma fiable seis poblaciones silvestres independientes de O. dioica,todas las cuales duraron más de 20 generaciones.
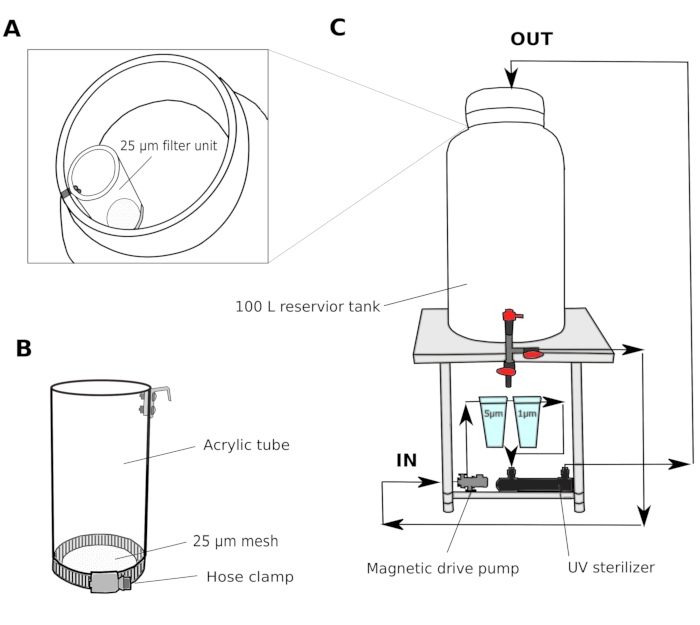
Figura 1: Esquema del sistema de filtro de agua de mar.
(A y B) El agua de mar se filtra inicialmente a través de una unidad de filtro de 25 m antes de entrar en el tanque del depósito (C) Se utiliza una bomba de accionamiento magnético para extraer agua de mar del tanque del depósito. El agua de mar se empuja a través de dos filtros de polipropileno y un esterilizador UV antes de regresar al tanque del depósito. Haga clic aquí para ver una versión más grande de esta figura.
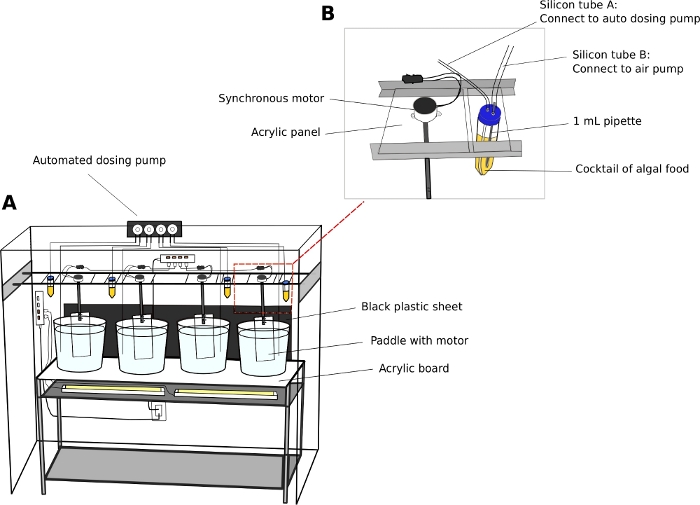
Figura 2: Sistema de cultivo para O. dioica.
(A) Visión general del sistema de cultivo (B) Vista de primer plano del motor síncrono y del depósito de algas para la bomba dosificadora automatizada. Los diámetros interiores de los tubos de silicio A y B son de 2 mm y 4 mm, respectivamente. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Cultivos de stock para O. dioica.
De izquierda a izquierda- C. calcitrans, Isochrysis sp., Synechococcus sp., y R. reticulata después de ser cultivada a 17 oC bajo luz continua durante 10 días. Haga clic aquí para ver una versión más grande de esta figura.
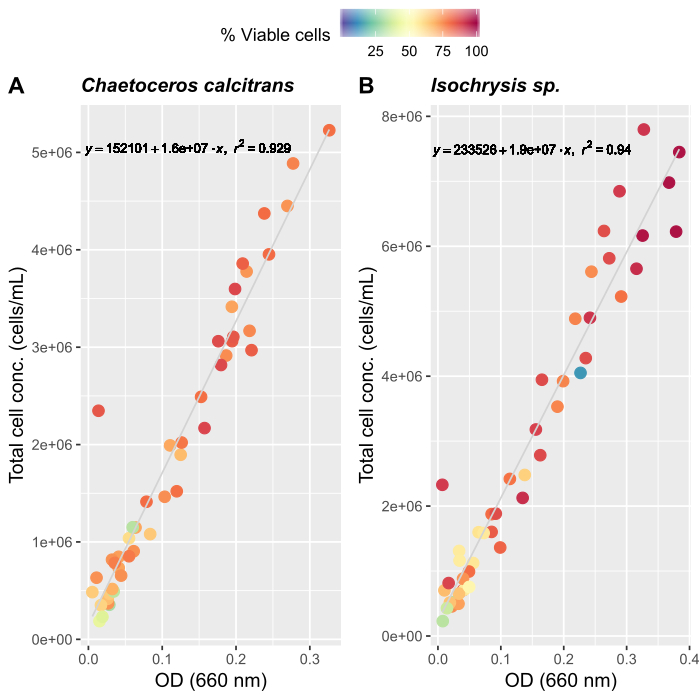
Figura 4: Curva de crecimiento de algas para dos de las principales especies de alimentos, C. calcitrans e Isochrysis sp..
Gráficas de dispersión de densidad óptica (OD) a 660 nm y concentraciones celulares totales para (A) C. calcitrans y (B) Isochrysis sp.. Cada punto representa el promedio de tres mediciones. Se utilizó un contador de células para determinar el porcentaje de células viables y las concentraciones celulares totales (células/ml). Las mediciones se registraron durante 20 días (n a 47). Haga clic aquí para ver una versión más grande de esta figura.
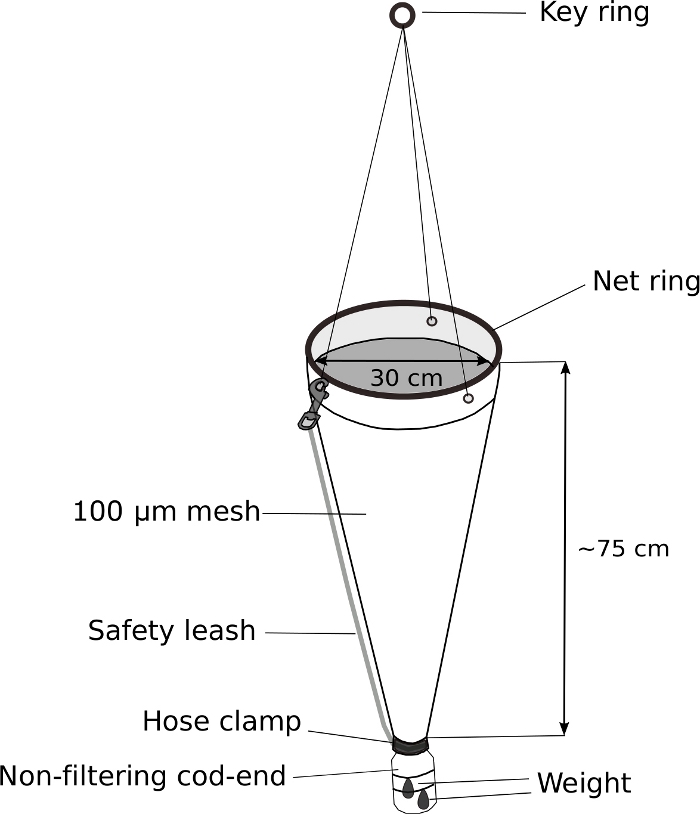
Figura 5: Red de plancton modificada para el muestreo de Oikopleura.
El extremo de bacalao de una red de plancton de mano (malla de 100 m) se sustituye por una botella de lavado de 500 ml. Se une un peso de 70 g al extremo del bacalao. Aproximadamente 5 m de cuerda está unida al llavero. Se fija una correa de seguridad para asegurar aún más el extremo del bacalao. Haga clic aquí para ver una versión más grande de esta figura.
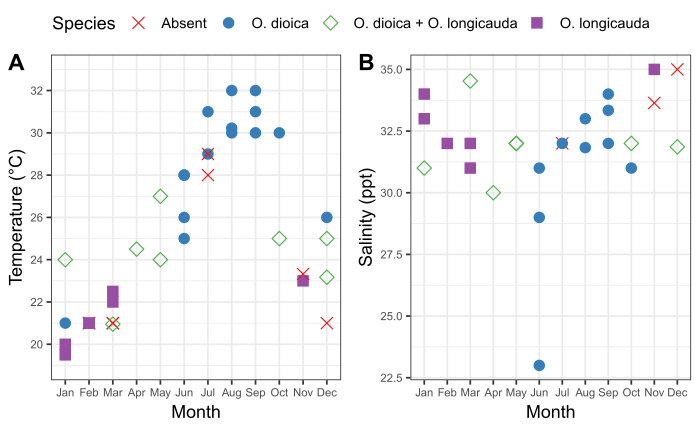
Figura 6: Estacionalidad de O. dioica en Okinawa.
Presencia y ausencia de O. dioica y O. longicauda en relación con los cambios estacionales en (A) temperatura y (B) salinidad en los puertos de Ishikawa (26-25'39.3"N 127-49'56.56.26 6"E) y Kin (26-26'40.2"N 127-55'00.3"E) entre 2015-2019. Cada especie se registró como presente si se contaran manualmente más de 50 animales. Se registraron mediciones de temperatura y salinidad de las aguas superficiales. Haga clic aquí para ver una versión más grande de esta figura.
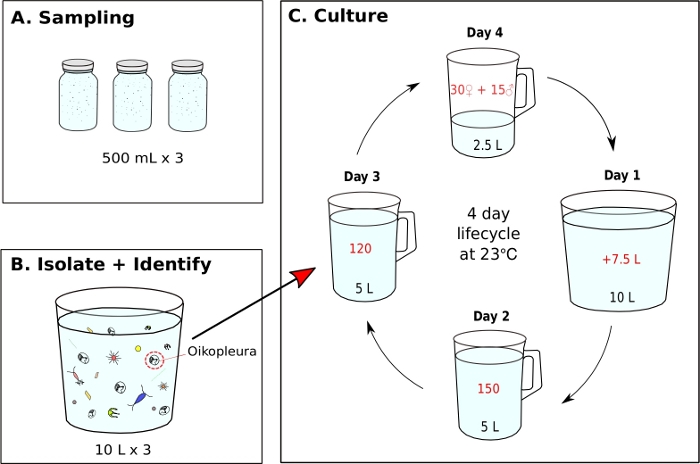
Figura 7: Diagrama de flujo para iniciar el monocultivo de O. dioica.
(A) Tres muestras de plancton de 500 ml se recogen de un sitio de muestreo (B) Cada tarro de muestra se diluye y O. dioica se aísla del resto del plancton (C) Un monocultivo de O. dioica se inicia mediante la transferencia manual de animales de 120 días 3 a un nuevo vaso de precipitados que contiene 5 L de agua de mar fresca filtrada (fSW). Establecer un vaso de precipitados que contiene 30 hembras, 15 machos y 2,5 L de fSW fresco. La primera mañana después del desove (Día1), vacíe cuidadosamente el vaso de desove con la nueva generación de animales en un vaso de precipitados que contiene 7,5 L de fSW fresco. En el segundo día después del desove (Día 2), transfiera 150 animales a un vaso de precipitados que contenga 5 L de fSW fresco. En el tercer día después del desove (Día 3), transfiera 120 animales a un vaso de precipitados que contenga 5 L de fSW fresco. En el último día (Día 4), establecer un nuevo vaso de desove que contiene 30 hembras, 15 machos y 2,5 L fresco fSW en preparación de la próxima generación. Los animales tienen un ciclo de vida de 4 días a 23 oC. Haga clic aquí para ver una versión más grande de esta figura.
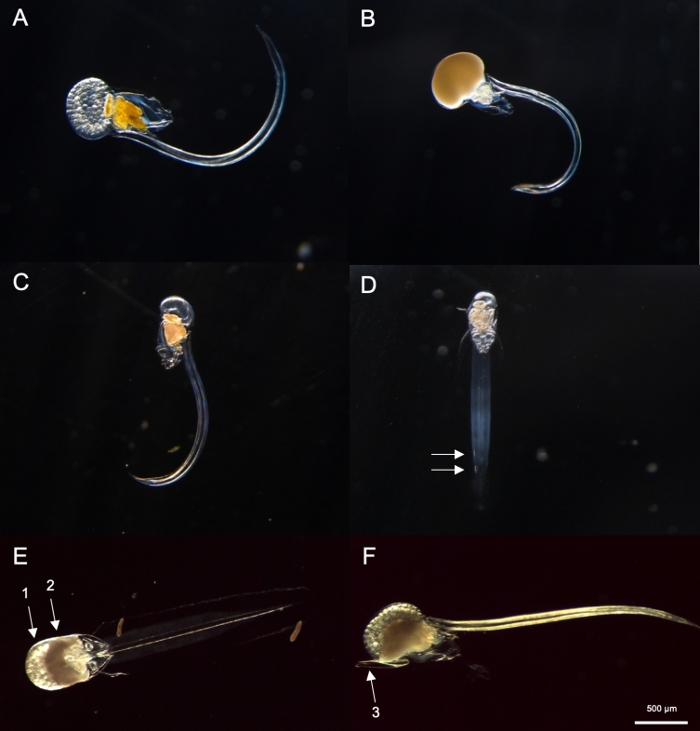
Figura 8: Identificación de Oikopleura spp. (A-D: O. dioica, E y F: O. longicauda).
(A) Hembra O. dioica con óvulos (B) Male O. dioica con esperma (C) Vista lateral de la inmaduro O. dioica (D) Vista ventral de inmaduro O. dioica con dos células subchordas indicadas con flechas blancas (E) Vista ventral de O. longicauda madura llevando huevos (flecha 1) y esperma (flecha 2) (F) Vista lateral de O. longicauda mostrando velum (flecha 3). Haga clic aquí para ver una versión más grande de esta figura.
| Reactivos | Productos químicos | Cantidad | Vol. final (mL) | Esterilización | Stock / Abierto |
| Solución A | Na2EDTA | 45 g | 1000 | Autoclave | -20 oC / 4 oC |
| NaNO3 | 100 g | ||||
| H3BO3 | 33,6 g | ||||
| NaH2PO4 | 20 g | ||||
| MnCl2x 4H2O | 0,36 g | ||||
| FeCl3x 6H2O | 1,3 g | ||||
| Solución B | 1.0 mL | ||||
| Solución B | ZnCl2 | 2.1 g | 1000 | Autoclave | 4oC / 4oC |
| CoCl2x 6H2O | 2,0 g | ||||
| (NH4)6Mo7O24x 4H2O | 0,9 g | ||||
| CuSO4x 5h2O | 2,0 g | ||||
| *HCl | -- mL | ||||
| Vitamina | Tiamina (B1) ? Hcl | 200 mg | 1000 | Autoclave | -20 oC / 4 oC |
| Biotina | 1 mg | ||||
| Cobalamina (B12) | 1 mg | ||||
| Silicato de sodio | Na2SiO3 | 5% | 1000 | Filtro de 0,22 m | 4oC / 4oC |
| Estreptomicina | C21H39N7O12 | 25 mg/ml | 50 | Filtro de 0,22 m | -20 oC / -20 oC |
Tabla 1: Receta de reactivos necesarios para el mantenimiento de alimentos de algas. Después de disolver todo el producto químico indicado para la solución B, se añade HCl hasta que la solución se aclare sin turbidez. Todos los reactivos se esterilizan mediante autoclaves (120 oC, 25 min) o mediante el uso de un filtro de 0,22 m. Todos los reactivos excepto las existencias de vitaminas se esterilizan después de la adición de la sustancia química especificada. Para las reservas de vitaminas, autoclave el agua primero, y luego disolver el producto químico listado. Se enumeran las temperaturas de almacenamiento para el stock y los reactivos abiertos.
| Tipo de referencia cultural | Algal spp. | ASW (mL) | Vitamina | Solución A | Silicato de sodio | Estreptomicina | Algas (ml) / Tipo de cultivo | Incubar / Almacenar | Frecuencia |
| Cultura de valores | Chaeto | 60 | 1/2000 | 1/2000 | 1/4000 (Sólo Chaeto) | 1/1000 (Todos excepto Syn) | 0.03 / stock | 17oC / 4oC | Quincenal |
| Iso | 60 | 0.03 / stock | |||||||
| rinoceronte | 80 | 0.06 / stock | |||||||
| Syn | 60 | 0.03 / stock | |||||||
| Subcultura | Chaeto | 500 | 1/2000 | 1/2000 | 1/4000 (Sólo Chaeto) | 1/1000 (Todos excepto Syn) | 10 / stock | 17oC / 17oC | Semanal |
| Iso | 500 | 10 / stock | |||||||
| rinoceronte | 500 | 20 / stock | |||||||
| Syn | 500 | 10 / stock | |||||||
| Cultura de trabajo | Chaeto | 400 | 1/2000 | 1/2000 | 1/4000 (Sólo Chaeto) | 1/1000 (Todos excepto Syn) | 100 / sub | RM / RM | Cada 4 días |
| Iso | 400 | 100 / sub | |||||||
| rinoceronte | 400 | 150 / sub | |||||||
| Syn | 400 | 100 / sub |
Tabla 2: Instrucción para el mantenimiento de tres tipos de cultivo de algas. Añadir la cantidad especificada de suplementos a los matraces que contienen agua de mar autoclabada. Inocular cada matraz con la cantidad especificada de cultivo de algas. Incubar y almacenar cultivos de algas a temperaturas específicas. Inocular nueva cultura de stock y subcultura de la cultura de valores anterior, y nueva cultura de trabajo de la subcultura anterior. Inocule nueva cultura bursátil, subcultura y cultura de trabajo cada dos semanas, una semana y cuatro días, respectivamente. Este horario proporciona suficiente comida para aproximadamente 10 vasos de cultivo de O. dioica. Mantenga 2 – 3 conjuntos de cada tipo de cultivo de algas como copias de seguridad. RM – temperatura ambiente.
| Día | Algal spp. | 9AM y 5PM | 12PM |
| 1 | Chaeto | — | — |
| Iso | 1000 | 2000 | |
| Syn | 20,000 | 40,000 | |
| 2 | Chaeto | 1000 | 2000 |
| Iso | 2000 | 2000 | |
| rinoceronte | 1000 | 1000 | |
| 3 | Chaeto | 3000 | 4000 |
| Iso | 3000 | 4000 | |
| rinoceronte | 1500 | 1500 | |
| 4 | Chaeto | 1000 | 2000 |
| Iso | 1000 | 2000 | |
| rinoceronte | 1000 | 1000 |
Tabla 3: Concentración de algas por alimentación modificada de Bouquet et al.27. Concentraciones de algas (células mL-1) y especies de algas utilizadas para la alimentación diaria durante el ciclo de vida de 4 días de Okinawa O. dioica.
Archivo Suplementario 1: Carta de alimentación diaria. Las cantidades diarias de alimentación para cada vaso de precipitados de cultivo se calculan automáticamente después de introducir mediciones diarias de absorción de algas (OD), el tamaño de los animales (Día) y el volumen de agua de mar (SW vol.) en cada vaso de cultivo. Las curvas de crecimiento de R. reticulata y Synechococcus sp. fueron adaptadas de Bouquet et al.27. Haga clic aquí para descargar este archivo.
Archivo Suplementario 2: Cómo conectar el motor síncrono a la paleta de acrílico. Atornille firmemente la paleta al motor con una llave hexagonal. Haga clic aquí para descargar este archivo.
Discusión
Para facilitar la flexibilidad en el establecimiento de la cultura O. dioica, es importante entender el hábitat natural de los animales. Los datos estacionales proporcionan información sobre los rangos de parámetros físicos, que se pueden utilizar para guiar las condiciones de cultivo de laboratorio. También ayuda a entender las fluctuaciones estacionales en la abundancia de animales. En Okinawa, O. dioica se encuentra de forma más fiable de junio a octubre. Sin embargo, en la bahía de Tokio, las poblaciones alcanzan su punto máximo en febrero y octubre41. Aunque el cultivo de O. dioica se reporta a menudo a20oC o menos 27,28,29, Okinawa O. dioica muestra una mejor supervivencia a temperaturas superiores a 20 oC; esto podría explicarse por el hecho de que la temperatura mínima del agua de mar superficial en Okinawa es de 20 oC(Figura 6). La abundancia de O. dioica también podría verse influenciada por las floraciones de fitoplancton42 y la abundancia de depredadores43,,44. Independientemente de dónde se recoja O. dioica, entender la estacionalidad de las poblaciones locales maximiza la posibilidad de probar y cultivar el éxito.
Dada la temporada y la ubicación apropiadas, el muestreo neto es una forma eficaz de recolectar un gran número de Oikopleura con el mínimo esfuerzo. Las redes de plancton con un tamaño de malla más pequeño (60-70 m) también se pueden utilizar para recoger todas las etapas de los animales. Los animales completamente maduros rara vez se encuentran en la red, tal vez debido a su fragilidad al final del ciclo de vida. Por lo tanto, la identificación de especies seguida de muestreo se logra mediante la observación microscópica de células subchordal. Los individuos maduros suelen aparecer uno o dos días después del muestreo a medida que los animales continúan creciendo en el laboratorio. Aunque el muestreo neto es eficaz, podrían ser necesarios métodos de muestreo alternativos en diferentes circunstancias. Por ejemplo, el muestreo neto cerca de áreas urbanas puede recoger un gran número de fitoplancton, lo que dificulta aislar Oikopleura. En tales casos, se recomienda un muestreo simple de cubos para recoger el agua de mar superficial o el muestreo de barcos de áreas más allá del puerto. Los resultados mostraron que el cambio gradual en la salinidad debido a días consecutivos de lluvia no afectó a la abundancia de O. dioica; sin embargo, se deben evitar el muestreo en tierra inmediatamente después de eventos climáticos extremos, como ciclones tropicales. Estos eventos causan cambios biogeoquímicos repentinos y drásticos en un cuerpo protegido de agua45,,46. La escorrentía de aguas pluviales puede transportar contaminantes, sedimentos y exceso de nutrientes, que aumentan la turbidez y la menor calidad del agua47. El plancton de alimentación de filtros, como Oikopleura,puede ser especialmente susceptible a estos cambios debido a su modo de alimentación y movilidad limitada. En tal circunstancia, recomendamos posponer el muestreo durante unos días hasta que las condiciones locales vuelvan a la normalidad.
La introducción de un sistema de filtro de varios pasos es esencial para mantener pequeños organismos de alimentación de filtros como O. dioica. Usando agua de mar mal filtrada (por ejemplo, una malla de 25 m en el sistema de cultivo anterior), el cultivo era a menudo inestable especialmente durante el verano, potencialmente debido a la mayor abundancia de fitoplancton. Aunque algunos fitoplancton son beneficiosos para el crecimiento de O. dioica, otros producen biotoxinas que pueden causar el desarrollo anormal de embriones O. dioica 48. Además, una alta concentración de diatomeas como Chaetoceros spp. son potencialmente perjudiciales para el crecimiento de O. dioica, ya que pueden poseer largas setas que pueden obstruir la casa y evitar la alimentación eficiente49. Con frecuencia observamos casas de animales pequeños obstruidos por C. calcitrans setae; por lo tanto, ahora alimentamos C. calcitrans sólo a los animales en el día 2 y mayores(Tabla 3).
Aunque no era un problema aquí, el cultivo a largo plazo a pequeña escala de O. dioica puede experimentar caídas repentinas en el tamaño de la población debido a un cuello de botella genético; en tales casos, Martí-Solans et al.29 recomiendan agregar nuevos individuos salvajes a la cultura cada 20 generaciones.
El sistema de cultivo Oikopleura es flexible. Una cultura estable se puede establecer dentro de una semana. El cultivo a largo plazo de O. dioica es posible con un presupuesto modesto con equipos no especializados. El esfuerzo diario requerido para el mantenimiento de 5-10 vasos de Oikopleura es generalmente menos de 2 horas con 2 personas. O. dioica también se puede mantener en agua de mar artificial, lo que es beneficioso para aquellos que no tienen acceso al agua de mar natural28. El almacenamiento a largo plazo de alimentos de algas es posible utilizando la criopreservación y la criopreservación29. Además, los espermatozoides O. dioica pueden ser crioconservados y permanecer viables durante más de un año50. Todos estos factores significan que las culturas pueden ser fácilmente restablecidas. Finalmente, experiencia pasada con el cultivo accidental de Pleurobrachia sp. puede sugerir que el sistema de cultivo desarrollado para Oikopleura podría extenderse potencialmente a una comunidad más amplia de organismos pelágicos frágiles.
O. dioica continúa proporcionando una poderosa visión de varios campos biológicos. Una comprensión de la estacionalidad local, un sistema de cultura meticuloso y algunos individuos dedicados permiten que la cultura efectiva se establezca con poco esfuerzo. El sistema de cultivo de Oikopleura proporciona los recursos básicos para investigar una amplia gama de campos biológicos relacionados con la ecología, el desarrollo, la genómica y la evolución de este acordeato marino único.
Divulgaciones
El autor no tiene nada que declarar.
Agradecimientos
Agradecemos a Garth Ilsley su apoyo en el establecimiento del sistema cultural. Reconocemos las contribuciones de Ritsuko Suyama y Sylvain Guillot a los esfuerzos de muestreo temprano e identificación de especies. Gracias especiales se deben a Hiroki Nishida, Takeshi Onuma y Tatsuya Omotezako por su generoso apoyo y orientación en todas partes, incluyendo el establecimiento inicial del sistema de cultivo local y compartir animales y la cultura microalgal. También agradecemos a Daniel Chourrout, Jean-Marie Bouquet, Anne Aasjord, Cristian Cañestro y Alfonso Ferrández-Roldán por compartir su experiencia en muestreo y cultivo. Jai Denton, Charles Plessy y Jeffrey Jolly proporcionaron comentarios invaluables sobre el manuscrito. Charlotte West formuló una ecuación generalizada para el cálculo de algas. Por último, agradecemos a la OIST por su financiación, Mary Collins y el Comité de Seguridad del Trabajo de Campo de la OIST por el asesoramiento sobre procedimientos de muestreo seguros, el personal de la tienda de máquinas OIST para la construcción de equipos de cultivo y muestreo, y Koichi Toda para la entrega de agua de mar.
Materiales
| Name | Company | Catalog Number | Comments |
| Activated charcoal | Sigma | C2764-2.5KG | |
| Alluminum pulley | Rainbow Products | 10604-10607 | |
| Biotin | Sigma | B4501-100MG | |
| Boric acid | Wako | 021-02195 | |
| Cobalamin (B12) | Sigma | V2876-100MG | |
| Cobalt(II) chloride hexahydrate | Wako | 036-03682 | |
| Copper(II) sulfate pentahydrate | Wako | 039-04412 | |
| Disodium edetate hydrate | Wako | 044-29525 | |
| Hexaammonium heptamolybdate tetrahydrate | Wako | 019-03212 | |
| Hexagon wrench | Anex | No.6600 | |
| Hydrochloric acid | Wako | 080-01066 | |
| Iron(III) chloride hexahydrate | Wako | 091-00872 | |
| Jebao programmable auto dosing pump | Jebao | DP-4 | |
| Magnet pump | REI-SEA | RMD-201 | |
| Manganese(II) chloride tetrahydrate | Wako | 134-15302 | |
| Polypropylene wound cartridge filter | Advantec | TCW-10N-PPS | |
| TCW-5N-PPS | |||
| TCW-1N-PPS | |||
| Screwless terminal block | SATO PARTS | SL4500 | |
| Simple plankton net | RIGO, Japan | 5512-C | |
| Sodium metasilicate | Sigma | 307815-1KG | |
| Sodium nitrate | Wako | 195-02545 | |
| Sodium phosphate monobasic anhydrous | MP Biomedicals | 194740 | |
| Streptomycin sulfate salt | Sigma | S6501-25G | |
| Synchronous electric motor | Servo | D5N6Z15M | |
| Thiamin hydrochloride | Wako | 201-00852 | |
| UV sterilizer | Iwaki | UVF-1000 | |
| Zinc chloride | MP Biomedicals | 194858 |
Referencias
- Travis, J. Is It What We Know or Who We Know? Choice of Organism and Robustness of Inference in Ecology and Evolutionary Biology (American Society of Naturalists Presidential Address). The American Naturalist. 167 (3), 303-314 (2006).
- Jenner, R. A., Wills, M. A. The choice of model organisms in evo-devo. Nature Reviews Genetics. 8 (4), 311-314 (2007).
- Irigoien, X., Huisman, J., Harris, R. P. Global biodiversity patterns of marine phytoplankton and zooplankton. Nature. 429 (6994), 863-867 (2004).
- Wilson, S., Ruhl, H., Smith, J. Zooplankton fecal pellet flux in the abyssal northeast Pacific: A 15 year time-series study. Limnology and Oceanography. 58 (3), 881-892 (2013).
- Steinberg, D. K., Lomas, M. W., Cope, J. S. Long-term increase in mesozooplankton biomass in the Sargasso Sea: Linkage to climate and implications for food web dynamics and biogeochemical cycling. Global Biogeochemical Cycles. 26 (1), 1004 (2012).
- Lombard, F., Kiørboe, T. Marine snow originating from appendicularian houses: Age-dependent settling characteristics. Deep Sea Research Part I: Oceanographic Research Papers. 57 (10), 1304-1313 (2010).
- Fenaux, R., Bone, Q. . The Biology of Pelagic Tunicates. , 251-264 (1998).
- Hopcroft, R. R., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 45-57 (2005).
- Walters, T. L., Gibson, D. M., Frischer, M. E. Cultivation of the Marine Pelagic Tunicate Dolioletta gegenbauri (Uljanin 1884) for Experimental Studies. Journal of Visualized Experiments. (150), e59832 (2019).
- Deibel, D. Feeding mechanism and house of the appendicularian Oikopleura vanhoeffeni. Marine Biology. 93 (3), 429-436 (1986).
- Spada, F., et al. Molecular patterning of the oikoplastic epithelium of the larvacean tunicate Oikopleura dioica. Journal of Biological Chemistry. 276 (23), 20624-20632 (2001).
- Flood, P. R., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 59-85 (2005).
- Tokioka, T. Studies on the distribution of appendicularians and some thaliaceans of the North Pacific, with some morphological notes. Publication of the Seto Marine Biological Laboratory. (8), 351-443 (1960).
- Alldredge, A. L. Discarded appendicularian houses as sources of food, surface habitats, and particulate organic matter in planktonic environments. Limnology and Oceanography. 21 (1), 14-24 (1976).
- Clarke, C., Roff, J. C. Abundance and biomass of herbivorous zooplankton off Kingston, Jamaica, with estimates of their annual production. Estuarine, Coastal and Shelf Science. 31 (4), 423-437 (1990).
- Hopcroft, R. R., Roff, J. C. Zooplankton growth rates: extraordinary production by the larvacean Oikopleura dioica in tropical waters. Journal of Plankton Research. 17 (2), 205-220 (1995).
- Hopcroft, R. R., Roff, J. C. Production of tropical larvaceans in Kingston Harbour, Jamaica: are we ignoring an important secondary producer. Journal of Plankton Research. 20 (3), 557-569 (1998).
- Mochioka, N., Iwamizu, M. Diet of anguilloid larvae: leptocephali feed selectively on larvacean houses and fecal pellets. Marine Biology. 125 (3), 447-452 (1996).
- Sakaguchi, S. O., et al. Morphological identity of a taxonomically unassigned cytochrome c oxidase subunit i sequence from stomach contents of juvenile chum salmon determined using polymerase chain reaction. Fisheries Science. 83 (5), 757-765 (2017).
- Fenaux, R., Bone, Q. . The Biology of Pelagic Tunicates. , 25-34 (1998).
- Sato, R., Tanaka, Y., Ishimaru, T. House production by Oikopleura dioica (Tunicata, Appendicularia) under laboratory conditions. Journal of Plankton Research. 23 (4), 415-423 (2001).
- Flood, R., Deibel, D., Bone, Q. . The Biology of Pelagic Tunicates. , 105-124 (1998).
- Alldredge, A., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 309-326 (2005).
- Katija, K., Sherlock, R. E., Sherman, A. D., Robison, B. H. New technology reveals the role of giant larvaceans in oceanic carbon cycling. Science Advances. 3 (5), 1602374 (2017).
- Katija, K., Choy, C. A., Sherlock, R. E., Sherman, A. D., Robison, B. H. From the surface to the seafloor: How giant larvaceans transport microplastics into the deep sea. Science Advances. 3 (8), 1700715 (2017).
- Hidaka, K. Species composition and horizontal distribution of the appendicularian community in waters adjacent to the Kuroshio in winter-early spring. Plankton and Benthos Research. 3 (3), 152-164 (2008).
- Bouquet, J. M., et al. Culture optimization for the emergent zooplanktonic model organism Oikopleura dioica. Journal of Plankton Research. 31 (4), 359-370 (2009).
- Nishida, H. Development of the appendicularian Oikopleura dioica: culture, genome, and cell lineages. Development, Growth & Differentiation. 50, 239-256 (2008).
- Martí-Solans, J., et al. Oikopleura dioica culturing made easy: A Low-Cost facility for an emerging animal model in Evo Devo. Genesis. 53 (1), 183-193 (2015).
- Holland, L. Z. Tunicates. Current Biology. 26 (4), 146-152 (2016).
- Delsuc, F., Brinkmann, H., Chourrout, D., Philippe, H. Tunicates and not cephalochordates are the closest living relatives of vertebrates. Nature. 439 (7079), 965-968 (2006).
- Seo, H. C., et al. Miniature genome in the marine chordate Oikopleura dioica. Science. 294 (5551), 2506 (2001).
- Fredriksson, G., Olsson, R. The subchordal cells of Oikopleura dioica and O. albicans (Appendicularia, Chordata). Acta Zoologica. 72 (4), 251-256 (1991).
- Paffenhöfer, G. A. The cultivation of an appendicularian through numerous generations. Marine Biology. 22 (2), 183-185 (1973).
- Fenaux, R., Gorsky, G. Nouvelle technique d'élevage des appendiculaires. Rapports et Procés-Verbaux des Réunions-Commission Internationale pour l'Exploration Scientifique de la Mer Méditerranée. 29, 291-292 (1985).
- Fujii, S., Nishio, T., Nishida, H. Cleavage pattern, gastrulation, and neurulation in the appendicularian, Oikopleura dioica. Development Genes and Evolution. 218 (2), 69-79 (2008).
- Patry, W. L., Bubel, M., Hansen, C., Knowles, T. Diffusion tubes: a method for the mass culture of ctenophores and other pelagic marine invertebrates. PeerJ. 8, 8938 (2020).
- Fenaux, R. The classification of Appendicularia (Tunicata): history and current state. Memoires de I'Institut oceanographique. , (1993).
- Shiga, N., Chihara, M., Murano, M. . Illustrated Guide to Marine Plankton in Japan. , 1393-1414 (1997).
- Gorsky, G., Castellani, C., Castellani, C., Edwards, M. . Marine Plankton: A practical guide to ecology, methodology, and taxonomy. , 599-606 (2017).
- Sato, R., Ishibashi, Y., Tanaka, Y., Ishimaru, T., Dagg, M. J. Productivity and grazing impact of Oikopleura dioica (Tunicata, Appendicularia) in Tokyo Bay. Journal of Plankton Research. 30 (3), 299-309 (2008).
- Nakamura, Y., Suzuki, K., Suzuki, S. Y., Hiromi, J. Production of Oikopleura dioica (Appendicularia) following a picoplankton 'bloom'in a eutrophic coastal area. Journal of Plankton Research. 19 (1), 113-124 (1997).
- Nakamura, Y. Blooms of tunicates Oikopleura spp. and Dolioletta gegenbauri in the Seto Inland Sea, Japan, during summer. Hydrobiologia. 385 (1-3), 183-192 (1998).
- Uye, S. I., Ichino, S. Seasonal variations in abundance, size composition, biomass and production rate of Oikopleura dioica (Fol)(Tunicata: Appendicularia) in a temperate eutrophic inlet. Journal of Experimental Marine Biology and Ecology. 189 (1-2), 1-11 (1995).
- Tsuchiya, K., et al. Phytoplankton community response and succession in relation to typhoon passages in the coastal waters of Japan. Journal of Plankton Research. 36 (2), 424-438 (2014).
- Lopez-Lopez, L., et al. Effects of typhoons on gelatinous carnivore zooplankton off Northern Taiwan. Cahiers de Biologie Marine. 53, 349-355 (2012).
- Ares, &. #. 1. 9. 3. ;., et al. Extreme storm-induced run-off causes rapid, context-dependent shifts in nearshore subtropical bacterial communities. bioRxiv. , (2019).
- Torres-Águila, N. P., et al. Diatom bloom-derived biotoxins cause aberrant development and gene expression in the appendicularian chordate Oikopleura dioica. Communications Biology. 1 (1), 1-11 (2018).
- Troedsson, C., Frischer, M. E., Nejstgaard, J. C., Thompson, E. M. Molecular quantification of differential ingestion and particle trapping rates by the appendicularian Oikopleura dioica as a function of prey size and shape. Limnology and Oceanography. 52 (1), 416-427 (2007).
- Ouchi, K., Nishino, A., Nishida, H. Simple procedure for sperm cryopreservation in the larvacean tunicate Oikopleura dioica. Zoological Science. 28 (1), 8-11 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados