Method Article
Échantillonnage simplifié et culture du Larvacean cosmopolite pélagique, Oikopleura dioica
Dans cet article
Résumé
Oikopleura dioica est un organisme modèle tunicier dans divers domaines de la biologie. Nous décrivons les méthodes d’échantillonnage, l’identification des espèces, la configuration de la culture et les protocoles de culture pour les animaux et les aliments pour algues. Nous soulignons les facteurs clés qui ont contribué à renforcer le système culturel et discutons des problèmes et des résolutions possibles.
Résumé
Oikopleura dioica est un chordat planctonique avec une capacité exceptionnelle d’alimentation par filtre, un temps de génération rapide, un développement précoce conservé et un génome compact. Pour ces raisons, il est considéré comme un organisme modèle utile pour les études écologiques marines, la biologie du développement évolutionnaire, et la génomique. Comme la recherche nécessite souvent un approvisionnement régulier en ressources animales, il est utile d’établir un système fiable de culture à faible entretien. Nous décrivons ici une méthode étape par étape pour établir une culture O. dioica. Nous décrivons comment sélectionner les sites d’échantillonnage potentiels, les méthodes de collecte, l’identification des animaux ciblés et la mise en place du système de culture. Nous fournissons des conseils de dépannage basés sur nos propres expériences. Nous soulignons également les facteurs critiques qui contribuent à maintenir un système culturel robuste. Bien que le protocole de culture fourni ici soit optimisé pour O. dioica,nous espérons que notre technique d’échantillonnage et notre configuration culturelle inspireront de nouvelles idées pour maintenir d’autres invertébrés pélagiques fragiles.
Introduction
Les organismes modèles ont joué un rôle déterminant dans la résolution de nombreuses questions biologiques, y compris celles relatives au développement, à la génétique et à la physiologie. En outre, d’autres organismes modèles facilitent les nouvelles découvertes et sont donc essentiels pour mieux comprendre la nature1,2. Le zooplancton marin sont divers groupes d’organismes qui jouent un rôle important dans les écosystèmes océaniques3,4,5,6. Malgré leur abondance et leur importance écologique, les organismes gélatineux tels que les tuniciers planctoniques sont souvent sous-représentés dans les études sur la biodiversité du plancton parce que leur transparence et leur fragilité rendent la collecte et l’identification sur le terrain difficiles7,,8. Les techniques d’échantillonnage adaptées et la culture en laboratoire permettent une observation plus étroite des animaux in vitro, ce qui a permis d’approfondir les connaissances en biologie des tuniciers planctoniques9,10,11,12.
Les larvacéens (appendices) sont une classe de tuniciers marins de natation libre comprenant environ 70 espèces décrites dans le mondeentier 8,13. Comme ils sont l’un des groupes les plus abondants au sein des communautés de zooplancton14,15,16,17, les larvaceans représentent une source de nourriture primaire pour les organismes planctoniques plus grands tels que les larves de poissons18,19. Contrairement aux ascidiens-les tuniciers sessile-larvaceans conservent une morphologie têtard-like et restent planctoniques tout au long de leur vie20. Chaque animal vit à l’intérieur d’une structure auto-construite et complexe d’alimentation par filtre connue sous le nom de maison. Ils accumulent des particules dans leurs maisons en créant des courants d’eau par le mouvement ondulant de leurs queues21. Les maisons obstruées sont jetées tout au long de la journée, dont certaines forment des agrégats de carbone et finissent par couler au fond des fonds marins22; ainsi, les larvacéens jouent un rôle majeur dans le flux mondial de carbone23. La plupart des espèces vivraient dans la zone pélagique dans les 100 m supérieurs de la colonned’eau 13; cependant, le bathochordaeus larvacean géant est connu pour habiter les profondeurs de 300 m24. Une étude sur Bathochordaeus dans la baie de Monterey, en Californie, a révélé que les animaux servent également de vecteur biologique de microplastiques, suggérant une importance potentielle dans la compréhension du rôle des appendices dans le transport vertical et la distribution des microplastiques dans les océans25.
Oikopleura dioica, une espèce de larvacean, a attiré l’attention ces dernières années en tant qu’organisme modèle en raison de plusieurs caractéristiques remarquables. Il est généralement rapporté dans les océans du monde. Il est particulièrement abondant dans les eaux côtières26, ce qui permet un échantillonnage facile de la rive. Une culture stable à long terme est possible avec l’eau de mer naturelle et artificielle27,28,29. Les temps de production dépendants de la température sont aussi courts que 4-9 jours dans des conditions de laboratoire. Il a une fécondité élevée avec chaque femelle capable de produire >300 œufs tout au long de l’année. En tant que tunicier, il occupe une position phylogénétique importante pour comprendre l’évolution de l’accord30,31. À 70 Mo, O. dioica a le plus petit génome identifié parmi tous les chordates32. Parmi les larvacéens, O. dioica est la seule espèce non hermaphroditique décrite jusqu’à présent33.
La première culture O. dioica réussie avec des microalgues cultivées en laboratoire a été rapportée par Paffenhöfer34. Le protocole de culture original utilisant des moteurs synchrones et des palettes a été développé par Fenaux et Gorsky35 et plus tard adopté par plusieurs laboratoires. Plus récemment, Fujii et coll.36 ont signalé que la culture d’O. dioica dans l’eau de mer artificielle, un système de culture robuste et une collecte sur le terrain ont été décrits par Bouquet et coll.27 et un protocole optimisé pour un système simplifié et abordable a été signalé par Marti-Solans et coll.29. Mis à part le système traditionnel de culture Oikopleura, une conception nouvellement signalée avec un réservoir d’élevage à double tube a également le potentiel de la culture Oikopleura sp. 37.
Nous présentons un protocole détaillé pour l’initiation d’une monoculture O. dioica basée sur une combinaison de protocoles développés par les principaux groupes de recherche Oikopleura au Sars International Centre for Marine Molecular Biology27, l’Université de Barcelone29, Osaka University28, et nos propres observations. Dans les protocoles culturels publiés précédemment, des informations détaillées sur la composition des milieux d’algues, les techniques d’échantillonnage à terre et l’identification d’Oikopleura n’ont été décrites qu’à peu près, laissant beaucoup d’ambiguïté. Ici, à l’aide de l’information visuelle dans le protocole vidéo, nous avons rassemblé toutes les informations essentielles nécessaires pour mettre en place une culture O. dioica à partir de zéro d’une manière simple, étape par étape. Nous décrivons comment distinguer O. dioica d’une autre espèce fréquemment signalée, O. longicauda, qui est l’une des étapes les plus difficiles. Bien que les systèmes de culture existants soient applicables à la culture d’O. dioica dans le monde entier, nous soulignons l’importance de l’ajustement du protocole basé sur les conditions environnementales locales. L’information présentée combine des données largement publiées ainsi que des connaissances acquises grâce à l’expérience. Le protocole actuel convient parfaitement aux chercheurs intéressés à établir une culture à partir de zéro.
Protocole
1. O. dioica culture facility
- Système de filtre à eau (Figure 1)
- Recueillir l’eau de mer naturelle d’un port à 2-3 m de profondeur. Passer l’eau de mer à travers un filtre à sable (taille des pores 1,4 mm) et le transporter jusqu’à un réservoir commun en laboratoire. Utilisez un filtre à bidon pour faire circuler l’eau afin de maintenir la qualité de l’eau dans le réservoir commun.
- Dans une salle de culture, mettre en place un système de filtre en plusieurs étapes composé d’un réservoir de réservoir de 100 L avec une pompe à entraînement magnétique, de filtres à cartouches de plaie en polypropylène de 5 μm et 1 μm et d’un stérilisateur UV (100 V) (figure 1).
- Transférer l’eau de mer du réservoir commun vers le réservoir du réservoir de la salle de culture. Passer l’eau de mer à travers une unité de filtre de 25 μm (figure 1A,B) avant d’entrer dans le réservoir de la salle de culture. Faire circuler l’eau de mer à travers des filtres de 5 et 1 μm pendant la nuit pour éliminer complètement les particules qui pourraient potentiellement entraver le développement des animaux.
REMARQUE : Un filtre supplémentaire avec une plus grande taille de maille (25-50 μm) est utile pour empêcher les particules plus grosses d’obstruer les filtres de cartouche avec de plus petites tailles de maille. L’eau de mer filtrée (fSW) est prête à être utilisée le lendemain matin.
-
Unité de culture Oikopleura (Figure 2)
- Entretenir les animaux dans des béchers en plastique ronds et transparents de 5 ou 10 L.
- Placez les béchers de culture sur une étagère en acier inoxydable stable à deux niveaux (L x W x H = 150 cm x 45 cm x 90 cm) avec une planche de surface acrylique transparente de 5 mm d’épaisseur.
- Placez les lumières fluorescentes blanches sous la surface acrylique pour éclairer les animaux du bas des béchers.
- Placez une feuille de plastique noire derrière les béchers. La feuille noire crée le contraste et améliore la visualisation des animaux transparents.
- Connecter les moteurs électriques synchrones aux palettes acryliques (L x H = 8 cm x 27 cm) (Fichier supplémentaire 2). Suspendre les pagaies dans les béchers de culture des rails parallèles qui longent la longueur de l’unité d’étagères (figure 2A).
- Allumez les moteurs pour générer un léger mouvement circulaire dans les béchers à 15 tr/min.
REMARQUE : Les animaux de leurs maisons de cellulose sont neutrement flottants; cependant, la circulation de l’eau aide à empêcher les œufs, les larves et les aliments d’algues d’être suspendus et répartis uniformément dans les béchers de culture.
- Pompe de dosage automatique (facultatif)
REMARQUE : Une unité d’alimentation automatique réduit les besoins en personnel, surtout le week-end.- Calibrer le volume de liquide de distribution à partir d’une pompe de dosage automatique selon les instructions du fabricant.
- Utilisez des tubes de 50 mL comme réservoirs d’algues.
- Percer deux trous de 5 mm sur les bouchons de tubes de 50 mL pour passer à travers les tubes des compagnies aériennes. Connectez un tube à une pompe à air d’aquarium standard pour introduire des bulles d’air, et l’autre tube au port d’entrée de la pompe de dosage (Figure 2B).
REMARQUE : L’introduction d’un mince flux de bulles d’air permet d’empêcher les algues de s’installer au fond des tubes. - Programmez le temps et le volume d’aliments pour algues à distribuer un jour donné.
- Station d’algues
- Utiliser une étagère (L x W x H = 90 cm x 46 cm x 115 cm) pour placer quatre flacons de fond ronds de 1 L contenant des cultures de travail d’algues (voir étape 2.1).
- Éclairer les cultures de travail en plaçant des lumières fluorescentes derrière les flacons.
- Sceller les flacons à l’aide d’bouchons en caoutchouc à deux trous.
- Passer une pipette jetable de 1 mL à travers le bouchon en caoutchouc. Utilisez des tubes de compagnie aérienne pour connecter la pipette à une pompe à air d’aquarium. Introduire un flux de bulles d’air dans la fiole.
2. Aliments microalgals
- Initiation des cultures d’algues
NOTE : Maintenir trois ensembles de cultures (cultures de stock, de sous-culture et de travail) pour trois espèces microalgales, Chaetoceros calcitrans, Isochrysis sp., Rhinomonas reticulata, et une espèce de cyanobactéries, Synechococcus sp.. Les stocks et les sous-cultures sont utilisés comme sauvegardes. La culture de travail est utilisée pour l’alimentation quotidienne.- Préparer les réactifs nécessaires à la culture des microalgues et des cyanobactéries (Tableau 1).
- Pour initier la culture des stocks, autoclave (121 °C, 25 min) 60 – 80 ml de fSW dans une fiole Erlenmeyer de 100 mL. Aseptique inoculer la quantité spécifiée de Conway moyenmodifié 27 et microalgues (Tableau 2). Par exemple, pour inoculer une culture de stock de C. calcitrans, autoclave 60 mL d’eau de mer, aseptique inoculer 30 μL chacun de la vitamine et de la solution A, 15 μL de silicate de sodium, 60 μL de streptomycine, et 30 μL de C. calciran de la culture stock précédente.
REMARQUE : R. reticulata passe du rose rougeâtre au brun orangâtre lorsqu’il est exposé à trop de lumière. Éloignez-les de la lumière une fois qu’ils ont commencé à passer du rose clair au rose clair. - Maintenir la culture du stock dans un incubateur fixé à 17 °C avec un éclairage continu. Après environ 10 jours, la culture change de couleur pour indiquer la croissance des algues (Figure 3). Une fois que les couleurs apparaissent, déplacez-les à 4 °C pour un stockage à long terme jusqu’à 1 mois.
- Sur un banc propre, inoculer aseptiquement une sous-culture de la culture des stocks (Tableau 2). Incuber à 17 °C avec éclairage continu. Après l’apparition des couleurs d’algues, continuez à les stocker dans l’incubateur jusqu’à 2 semaines.
- Inoculer la culture de travail de la sous-culture (Tableau 2). Sceller la fiole à l’aide d’un bouchon en caoutchouc et insérer une pipette jetable de 1 mL. Déplacez le flacon jusqu’à la station d’algues et maintenez-le à température ambiante avec une photopériode de 8 h. Approvisionnement avec aération constante. Renouveler la culture de travail tous les 4 jours.
- Remuer le stock et les sous-cultures deux fois par jour en tourbillonnant.
REMARQUE : Le stockage à long terme de la culture des algues sur les supports solides et la cryoconservation sont possibles jusqu’à 3 mois et 1 an, respectivement29.
- Création de courbes de croissance des algues (facultatif)
REMARQUE : Une évaluation précise de la quantité d’alimentation est importante pour maintenir une culture stable de O. dioica. Nous avons créé des courbes de croissance pour deux espèces alimentaires primaires d’algues, Chaetoceros calcitrans et Isochrysis sp.- Préparer les cultures de travail C. calcitrans et Isochrysis sp. (Tableau 2).
- Pour chaque espèce de culture de travail, échantillonnez trois fois et mesurez les absorptions à 660 nm à l’aide d’un spectrophotomètre. Prenez les mesures moyennes des triples de chaque culture de travail.
- Suivant les instructions du fabricant pour un compteur cellulaire automatisé, préparer des échantillons d’algues pour le comptage. Comptez chaque échantillon trois fois. Prenez la moyenne de trois dénombrements pour déterminer le nombre total de cellules présentes dans chaque échantillon.
- Continuer à compter quotidiennement jusqu’à ce qu’environ 50 mesures moyennes soient enregistrées.
- Créer des courbes de croissance pour les deux espèces d’algues (figure 4).
3. Collection de champ de sauvage Oikopleura spp.
- Filet de plancton modifié (Figure 5)
REMARQUE : La clé d’un échantillonnage réussi de l’approvisionnement en ostseura d’Oikopleura est le remorquage lent d’un filet de plancton avec une extrémité de morue pondérée et non filtrante. La figure 5 montre un diagramme schématique d’un filet de plancton modifié.- Remplacer l’extrémité de la morue d’un filet de plancton portatif par une bouteille de lavage à vis modifiée de 500 ml.
- Percer un trou de 3 cm de diamètre dans le haut à vis de 4 cm de diamètre de la bouteille de lavage pour permettre à l’eau et aux animaux d’entrer dans l’extrémité de la morue.
- Placez le bouchon de la bouteille à l’extrémité du filet de plancton. Enveloppez-le hermétiquement avec du ruban électrique. Fixez le bouchon plus loin à l’aide d’une pince à tuyaux en acier inoxydable.
- Attachez un poids de 70 g à l’extérieur de l’extrémité de la morue modifiée avec des attaches zippées.
- Attachez la laisse de sécurité pour fixer davantage l’extrémité de la morue.
- Sélection des sites de collecte (Figure 6)
REMARQUE : Toutes les collections d’échantillons ont été approuvées par le Comité de la sécurité des travaux de terrain de l’OIST. Il pourrait y avoir des variations saisonnières dans la présence d’Oikopleura spp. selon l’emplacement (Figure 6). Évitez l’échantillonnage immédiatement après des phénomènes météorologiques extrêmes tels que des tempêtes de pluie sévères.- Utilisez la vue satellite sur un site Web de carte pour identifier les sites d’échantillonnage potentiels. Nous nous sommes concentrés sur les ports et les jetées de pêche qui sont facilement accessibles en voiture et situés à l’intérieur des baies ou près des dépôts océaniques où le plancton ont tendance à s’accumuler: port d’Ishikawa à Kin Bay, Okinawa, Japon (GPS: 26°25'39.3"N 127°49'56.6"E).
- Visitez les emplacements d’échantillonnage potentiels pour évaluer l’accessibilité et la sécurité à terre de chaque site. Obtenir un permis de collecte auprès des autorités locales au besoin.
- Procédure d’échantillonnage
- Jeter le filet de plancton dans la mer et laisser l’extrémité de la morue couler de 1 à 2 m sous la surface de l’eau.
- Remorquer le filet horizontalement à la main à 50-100 cm s-1. Continuer le remorquage en faisant des allers-retours pendant 2-5 minutes. Ajuster le temps de remorquage en fonction de l’abondance du phytoplancton dans le port, avec un remorquage plus court lorsqu’il y a plus de phytoplancton.
REMARQUE : Les larvacéens sont des animaux fragiles. Le remorquage rapide ou le moulage répété du filet pourraient endommager les animaux emprisonnés dans l’extrémité de la morue. - Soulevez délicatement le filet. Transférer lentement le contenu de l’extrémité de la morue dans une bouteille en verre rond de 500 ml. Remplissez complètement la bouteille d’eau de mer pour éviter les bulles d’air.
NOTE: La présence de Oikopleura spp. peut être confirmée en regardant des bouteilles d’échantillon sur un fond noir. La plupart des animaux abandonnent leur maison en étant recueillis. Par conséquent, l’observation microscopique est nécessaire pour l’identification au niveau des espèces. - Répéter l’échantillonnage jusqu’à ce que trois bouteilles de 500 ml soient collectées.
- Mesurer la salinité, la température et la chlorophylle a à l’aide d’un profileur CTD pour enregistrer la gamme de paramètres physiques là où les animaux existent naturellement.
- Recueillir 10-15 L d’eau de mer de surface dans un seau pour acclimater les animaux en laboratoire.
4. Isolement et identification des animaux (figure 7, figure 8)
-
Oikopleura spp. identification
NOTE : D’autres organismes planctoniques qui peuvent ressembler à Oikopleura spp. à première vue incluent les chaetognaths, fritillaria spp., les nématodes, les larves de poissons avec des sacs de jaune, et les larves de Ciona spp.- Pour acclimater les animaux aux conditions de laboratoire, transférer chaque échantillon de 500 mL à un bécher de 10 L contenant un rapport de 1:1 d’eau de mer de surface à partir de l’emplacement d’échantillonnage et de l’eau de mer filtrée (FSW) maintenue en laboratoire (figure 7A,B). Ajuster le volume du bécher à 5-10 L en fonction de la concentration de l’échantillon de plancton.
REMARQUE : Si l’échantillon de plancton contient des débris indésirables, passez par un filtre grossier (taille de maille ~600 μm) avant de passer à un bécher de 10 L. - Utilisez une pagaie attachée à un moteur électrique synchrone (15 tr/min) et maintenez le plancton en suspension pendant la nuit (étape 1.2.5).
- Identifiez Oikopleura spp. en recherchant des animaux de 1 à 2 mm de long en forme de têtard ondulant leur queue à l’intérieur d’une maison sphérique et translucide. Certains animaux peuvent nager temporairement librement sans les maisons. Transférer doucement ~5 animaux dans une boîte de Pétri vide à l’aide d’une pipette à extrémité émoussée.
- Pour l’identification du genre, expulser les animaux de leurs maisons en fouillant doucement la maison avec une pipette de transfert.
- Observez les animaux sans maison sous un microscope 20-40x à champ foncé et confirmez Oikopleura spp (Figure 8).
- Pour acclimater les animaux aux conditions de laboratoire, transférer chaque échantillon de 500 mL à un bécher de 10 L contenant un rapport de 1:1 d’eau de mer de surface à partir de l’emplacement d’échantillonnage et de l’eau de mer filtrée (FSW) maintenue en laboratoire (figure 7A,B). Ajuster le volume du bécher à 5-10 L en fonction de la concentration de l’échantillon de plancton.
-
O. identification de dioica
NOTE : O. dioica peut être visuellement identifié par la présence de mâles et de femelles pleinement matures ou de deux grandes cellules subchordales situées sur la moitié distale de leurqueue. La distance entre deux cellules subchordales peut varier d’un individu à l’autre.- Ensuite, vérifiez s’il y a un Oikopleura entièrement mûri avec une gonade remplie d’ovules (figure 8A) ou de sperme (figure 8B). Si l’animal ne possède que des ovules ou du sperme, passez à l’étape 4.2.3 car il est O. dioica, la seule espèce non hermaphroditique décrite.
- Si l’animal est immature (figure 8C), recherchez deux cellules subchortales à l’extrémité de sa queue (figure 8D).
- Une fois l’espèce confirmée, transférez-la dans un nouveau plat Petri. Répétez les étapes 4.1.3-4.2.2 jusqu’à ce que 10 à 20 individus soient confirmés au niveau des espèces.
REMARQUE : Pour faciliter l’identification, anesthésiez les animaux dans une boîte de Pétri contenant 0,015 % de méthanesulfonate de tricaine (MS222) dans fSW. - Si aucun O. dioica n’est trouvé, gardez les béchers suspendus pour un jour ou deux supplémentaires. Il pourrait y avoir un O. dioica immature qui continuera de croître et de devenir plus facile à détecter. Si aucun n’apparaît après une semaine, jetez l’échantillon et réessayez l’échantillonnage.
5. Protocole de culture pour O. dioica
- Lancement d’une monoculture O. dioica à partir d’un échantillon prélevé sur le terrain (Figure 7)
REMARQUE : La nourriture d’algues est préparée quotidiennement à partir de cultures de travail et chaque bécher de monoculture est nourri trois fois par jour à 9 h, 12 h et 17 h, respectivement (voir l’étape 5.2). Les animaux sont maintenus à 23 °C. Dans ces conditions, le cycle de vie d’Okinawa O. dioica est de 4 jours (figure 7C).- Initier une monoculture d’O. dioica, isoler 120 animaux et transférer dans un nouveau bécher contenant 5 L de fSW frais (Figure 7B,C).
- Le lendemain matin, recherchez des mâles pleinement matures avec des gonades jaunes et des femelles avec des œufs qui apparaissent comme des sphères dorées (Figure 8A,B).
- Faire un bécher en transférant doucement 15 mâles et 30 femelles vers un nouveau bécher contenant 2,5 L de fSW frais avec une pipette émoussée de 5 mL.
REMARQUE : S’il n’y a pas assez de mâles et de femelles, transférer autant d’adultes que possible dans un bécher contenant 1 L de fSW et laissez-les frayer naturellement. Pour minimiser le stress physique pour les animaux lors du transfert manuel, ils doivent être lentement siphonnés et relâchés sous la surface de l’eau. - Laissez les animaux frayer naturellement pour initier la prochaine génération. Les larves à queue doivent apparaître environ 3 heures après la fécondation.
REMARQUE : Le frai est effectué par des animaux adultes qui abandonnent leur maison, nagent vers l’eau de surface et libèrent leurs gamètes. La fécondation réussie peut être confirmée en extrayant 5-10 mL d’eau de mer du fond du bécher reproducteur et en identifiant les oeufs avec des clivages sous un microscope. - Le premier matin après le frai (jour 1), une nouvelle génération d’animaux avec des maisons gonflées devrait apparaître dans le bécher. Utilisez un bécher portatif de 500 mL pour transférer doucement le contenu du bécher reproducteur dans un nouveau bécher contenant 7,5 L de fSW frais (soit un total de 10 L). Verser à un angle pour éviter un mouvement d’éclaboussure.
- Le deuxième matin (jour 2), transférer manuellement 150 animaux dans un nouveau bécher contenant 5 L de fSW frais.
- Le troisième matin (Jour 3), transférer manuellement 120 animaux dans un nouveau bécher avec 5 L de fSW frais.
REMARQUE : Afin de synchroniser le développement des animaux, il est important de sélectionner les personnes ayant des tailles similaires lors du transfert manuel les jours 2 et 3. Un maximum de 10 animaux peuvent être siphonnés en un seul transfert. - Le quatrième matin (jour 4), des animaux adultes devraient apparaître. Répétez l’étape 5.1.3 pour fermer le cycle de vie.
REMARQUE : Une pompe d’alimentation automatisée peut être mise en place pour nourrir les animaux à 17 h le week-end sans la présence de personnel de culture.
- Préparation quotidienne des aliments aux algues issus de la culture de travail
- Mesurer l’absorption de la culture de travail à 660 nm.
- D’après le tableau d’alimentation quotidien, découvrez combien de cellules algales doivent être nourries pour les animaux de taille spécifique (tableau 3).
- À l’aide des courbes de croissance des algues (figure 4),résoudre les équations ci-dessous pour calculer le volume d’aliments aux algues (mL) requis un jour donné.
- Pour calculer le volume d’une algue particulière nécessaire pour une journée et un temps d’alimentation spécifiques, utilisez l’équation suivante :
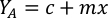
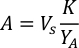
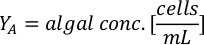
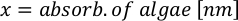
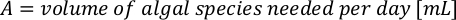
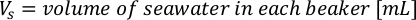
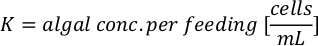
Où YA est la concentration d’algues un jour donné et A est le volume d’algues nécessaires par alimentation. En outre, la relation linéaire entre YA à x, les valeurs d’interception (c) et de pente (m) sont indiquées à la figure 4. Reportez-vous aux valeurs du tableau 3 pour K. - Par exemple, pour calculer le volume d’Isochrysis sp. nécessaire à une alimentation de 9 heures des animaux du jour 3 maintenus dans une culture de 5 L et avec l’absorption d’algues de 0,234 (mesurée à 660 nm), ce qui suit a été calculé:
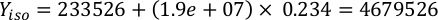
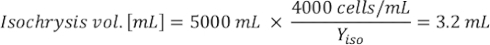
REMARQUE : Stockez ces équations dans une feuille de calcul afin que la quantité d’alimentation quotidienne soit automatiquement calculée en fonction des mesures d’absorption, de la taille des animaux et du volume d’eau de mer de culture (Fichier supplémentaire 1).
- Pour calculer le volume d’une algue particulière nécessaire pour une journée et un temps d’alimentation spécifiques, utilisez l’équation suivante :
- Transférer le volume calculé d’algues à 50 mL tubes, centrifugeuse à 5000 x g pendant 5 min à 20 °C.
- Retirer le supernatant. Remplissez les tubes jusqu’au volume d’origine avec fSW frais, en remplaçant les vieux supports d’algues.
- Conserver les aliments préparés au réfrigérateur jusqu’à ce qu’ils soient prêts à être utilisés pour le prochain aliment. Jetez les vieux aliments aux algues après la préparation de nouveaux aliments le lendemain matin.
- Charbon actif (facultatif)
REMARQUE : 10 g de charbon actif sont ajoutés à chaque bécher de culture pour maintenir la qualité de l’eau. Le charbon de bois peut être réutilisé jusqu’à quatre fois. Ouvrez lentement le sac de charbon de bois pour éviter que la poussière de charbon de bois n’entre dans les béchers de culture.- Transférer ~700 g de charbon actif dans un récipient. Tremper dans l’eau douce (FW) pendant 48 heures et laisser reposer sur le fond.
- Rincer à l’adresse FW pour éliminer les poussières résiduelles de charbon de bois.
- Faire bouillir le charbon de bois en FW pendant 15-20 min. Retirer du feu et laisser refroidir.
- Rincer jusqu’à ce que la plupart de la poussière de charbon de bois soit enlevée et que l’eau devienne claire.
- Conserver le charbon de bois propre dans un bécher de 2 L contenant de la fSW. Couvrir le bécher pour éviter que la poussière n’entre.
- Ajouter du charbon de bois à chaque nouveau bécher avant de transférer les animaux.
Résultats
Oikopleura peut être recueilli à partir d’un bateau ou d’un port par le remorquage lent et doux d’un filet de plancton en maille de 100 μm avec une extrémité de morue non filtrante (Figure 5). En raison de la nature fragile des animaux, il est important d’éviter tout mouvement qui pourrait causer un stress physique, comme la manipulation brutale du filet ou des éclaboussures dues à une poche d’air emprisonnée dans le pot d’échantillon.
Il est important de comprendre le modèle saisonnier des populations locales d’Oikopleura ainsi que les fluctuations qui l’accompagnent dans les caractéristiques physiques de l’eau à un site d’échantillonnage. L’échantillonnage entre 2015 et 2019 a révélé des variations saisonnières constantes dans la présence d’O. dioica dans les ports d’Ishikawa et kin à Okinawa (Figure 6). La température de l’eau de mer de surface semble être un facteur majeur. O. dioica était l’espèce dominante lorsque l’eau de mer de surface atteignait ≥28 °C, et O. longicauda coexistait avec O. dioica à des températures comprises entre 24 °C et 27 °C; cependant, O. longicauda a dominé en dessous de 23 °C (figure 6A). Le changement progressif de salinité après plusieurs jours consécutifs de fortes pluies n’était pas corrélé à l’abondance d’O. dioica (figure 6B).
À l’aide des procédures d’échantillonnage décrites ci-dessus, la plupart des O. dioica que nous avons récupérées se trouvaient entre le deuxième et le troisième jour de leur cycle de vie de 4 jours (figure 7C). Les mâles matures ont été reconnus par la coloration jaune des gonades tandis que les gonades femelles brillaient d’or à partir d’œufs de 70 à 80 μm de diamètre (figure 8A,B). Immature O. dioica ont été confirmés par deux cellules subchordales sur leur queue (Figure 8D). Une autre espèce dominante dans les eaux locales, O. longicauda, étaient semblables en taille et en morphologie. Nous avons utilisé les critères suivants pour distinguer O. longicauda de O. dioica38,39,40: un manque de cellules subchordales dans la queue, la présence de velum dans le tronc, et la présence d’une gonade hermaphrodite ( Figure8E,F). Les différentes morphologies de la queue sont également utiles pour distinguer O. longicauda de O. dioica. Quand un animal nu intact sans la maison a été orienté par la suite, la queue de O. longicauda était plus droite avec moins de courbure, lui donnant un aspect « plus rigide » par rapport à celle de O. dioica.
Les trois facteurs les plus importants pour établir un système stable de culture oikopleura sont (i) le maintien d’une haute qualité de l’eau, (ii) l’identification du régime d’alimentation optimal et (iii) la mise en place d’un bécher reproducteur avec un nombre suffisant de mâles et de femelles. L’introduction d’un système de filtre en plusieurs étapes (figure 1) a amélioré la qualité de l’eau et la stabilité de la culture. Un système de filtration n’est pas nécessaire pour l’eau de mer artificielle; cependant, le coût, la disponibilité et la commodité de l’eau de mer naturelle en font une meilleure option pour les laboratoires situés près de la côte. Pour établir le régime d’alimentation, nous recommandons de mesurer les courbes de croissance des algues qui s’appliquent aux différents milieux de laboratoire, puisque les conditions de température et de lumière varient considérablement. Nous avons combiné les courbes de croissance avec des calendriers d’alimentation publiés précédemment pour optimiser les concentrations et les compositions d’aliments des algues27 (figure 4). Nous suivons également un calendrier strict d’inoculation des algues pour maintenir un approvisionnement frais en aliments aux algues (Tableau 2). Le système d’alimentation automatisé nous permet de maintenir un horaire d’alimentation quotidien uniforme sans la présence du personnel de culture (figure 2B).
Une fois que l’eau de mer optimale et les conditions d’alimentation sont atteintes, il est important d’initier de nouvelles générations en créant un bécher de frai avec 15 mâles et 30 femelles dans 2,5 L de fSW. Cela assure une bonne concentration d’animaux du jour 1 le lendemain matin, ce qui est suffisant pour isoler 150 animaux le jour 2, 120 le jour 3 et 45 adultes matures le jour 4 pour le frai. S’il n’y a pas assez de mâles et de femelles le jour 4, recueillir et transférer autant d’individus matures que possible à 1 L de fSW et laissez-les frayer naturellement dans l’espoir qu’il y aura assez de larves pour porter sur la prochaine génération. Suivant le protocole fourni, le cycle de vie de O. dioica est de 4 jours à 23 °C (figure 7C). Nous avons établi de façon fiable six populations sauvages indépendantes d’O. dioica, qui ont toutes duré plus de 20 générations.
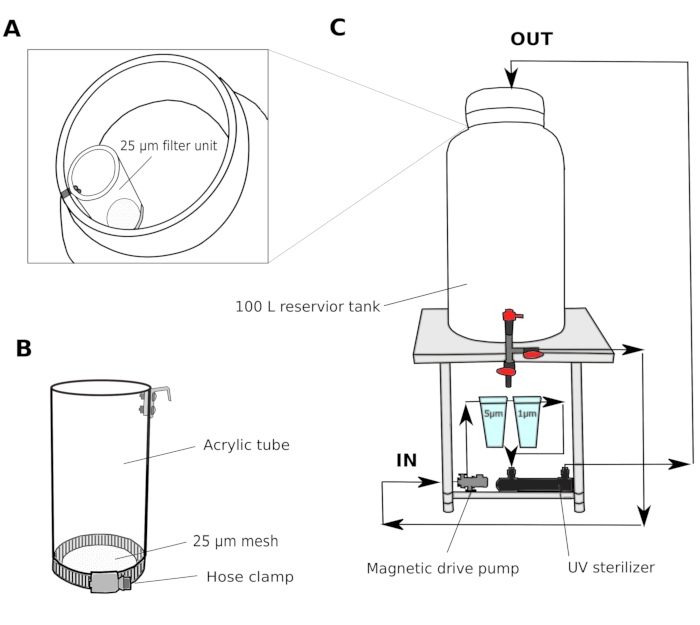
Figure 1 : Schéma du système de filtre d’eau de mer.
(A et B) L’eau de mer est d’abord filtrée à travers une unité de filtre de 25 μm avant d’entrer dans le réservoir du réservoir (C) Une pompe magnétique est utilisée pour extraire l’eau de mer du réservoir du réservoir. L’eau de mer est ensuite poussée à travers deux filtres en polypropylène et un stérilisateur UV avant de retourner dans le réservoir du réservoir. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
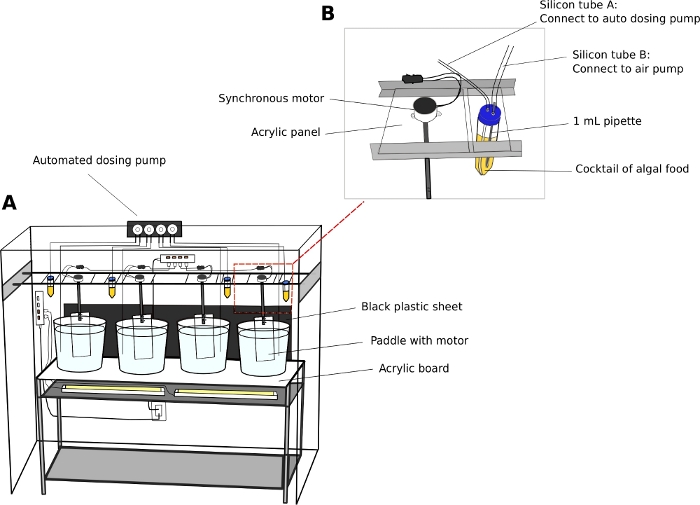
Figure 2 : Système de culture pour O. dioica.
(A) Vue d’ensemble du système de culture (B) Vue de plan rapproché du réservoir synchrone de moteur et d’algues pour la pompe de dosage automatisée. Les diamètres intérieurs des tubes de silicium A et B sont respectivement de 2 mm et 4 mm. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Cultures de stock pour O. dioica.
De gauche- C. calcitrans, Isochrysis sp., Synechococcus sp., et R. reticulata après avoir été cultivé à 17 °C sous la lumière continue pendant ~10 jours. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
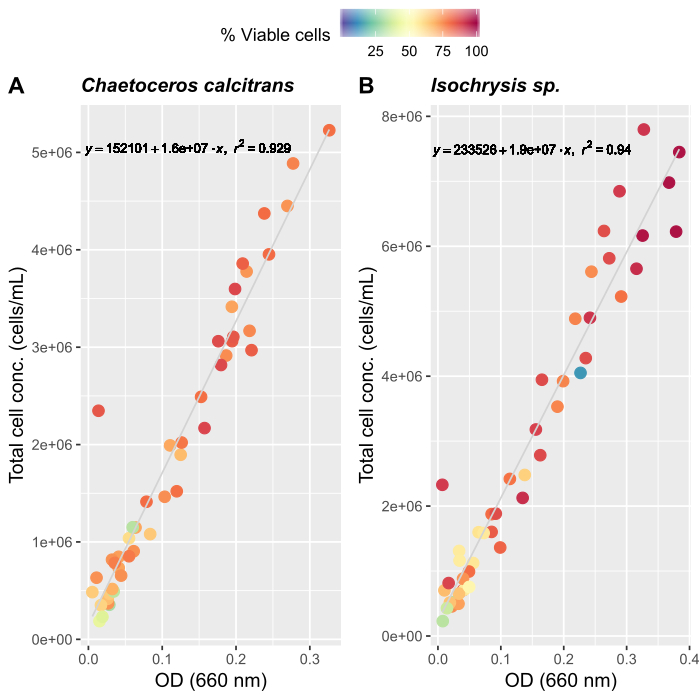
Figure 4 : Courbe de croissance des algues pour deux des principales espèces alimentaires, C. calcitrans et Isochrysis sp..
Parlpers des parcelles de densité optique (OD) à 660 nm et des concentrations totales de cellules pour (A) C. calcitrans et (B) Isochrysis sp.. Chaque point représente la moyenne de trois mesures. Un compteur cellulaire a été utilisé pour déterminer le pourcentage de cellules viables et les concentrations totales de cellules (cellules/mL). Les mesures ont été enregistrées pendant 20 jours (n = 47). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
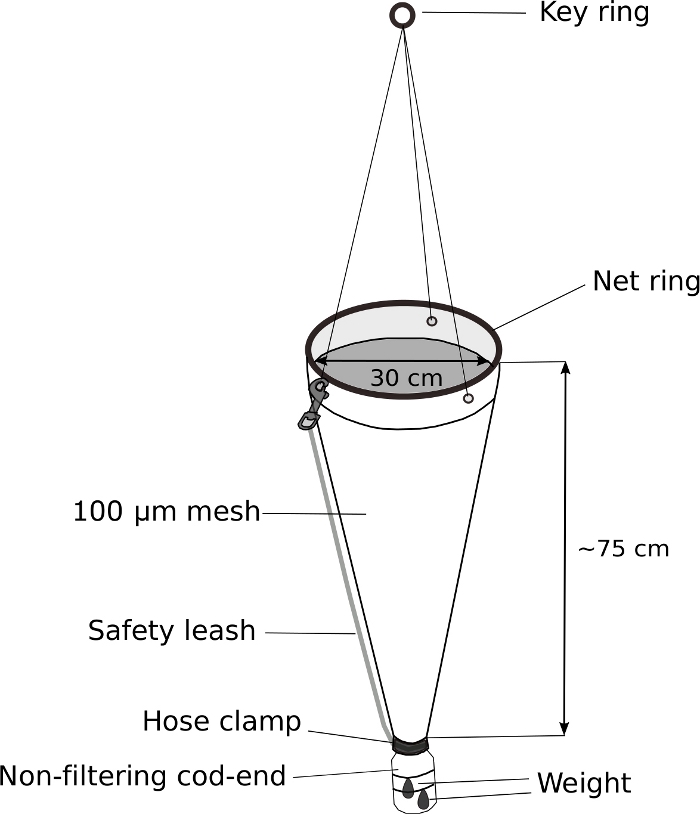
Figure 5 : Filet de plancton modifié pour l’échantillonnage d’Oikopleura.
L’extrémité de la morue d’un filet de plancton portatif (maille de 100 μm) est remplacée par une bouteille de lavage de 500 mL. Un poids de 70 g est fixé à l’extrémité de la morue. Environ 5 m de corde est fixé à l’anneau de clé. Une laisse de sécurité est attachée pour sécuriser davantage l’extrémité de la morue. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
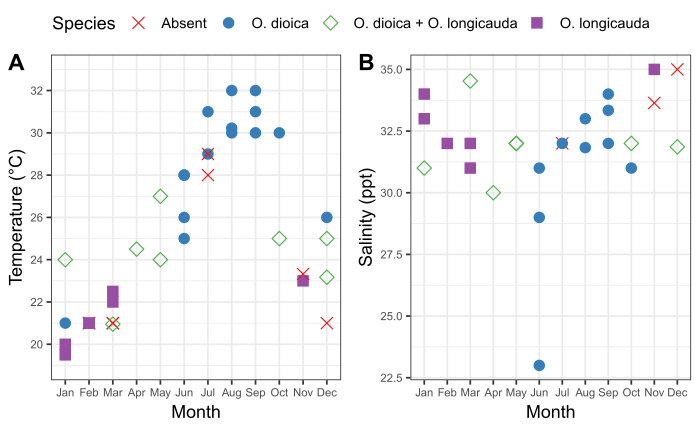
Figure 6 : Saisonnalité d’O. dioica à Okinawa.
Présence et absence d’O. dioica et O. longicauda par rapport aux variations saisonnières de la température (A)et (B) de la salinité dans les ports d’Ishikawa (26°25'39.3"N 127°49'56.56.56.56.3 6"E) et Kin (26°26'40.2"N 127°55'00.3"E) entre 2015 et 2019. Chaque espèce a été enregistrée comme présente si plus de 50 animaux ont été comptés manuellement. Des mesures de température et de salinité de l’eau de surface ont été enregistrées. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
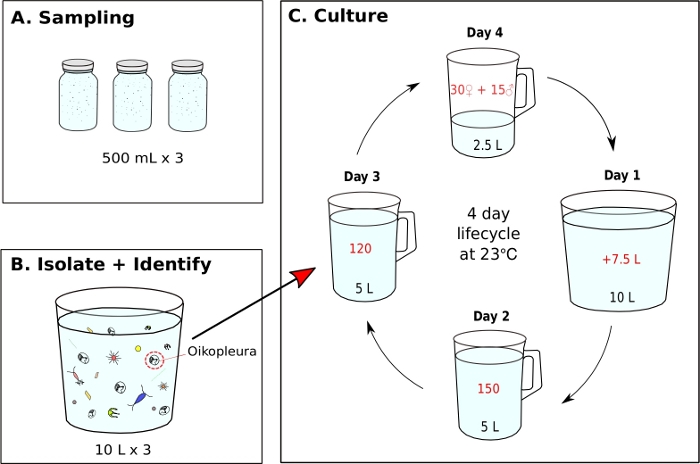
Figure 7 : Diagramme de flux pour l’initiation de la monoculture O. dioica.
(A) Trois, 500 mL d’échantillons de plancton sont prélevés à partir d’un site d’échantillonnage (B) Chaque pot d’échantillon est dilué et O. dioica est isolé du reste du plancton (C) Une monoculture de O. diocia est lancée en transférant manuellement 120 animaux de jour 3 à un nouveau bécher contenant 5 L d’eau de mer fraîche filtrée (FSW). Mettre en place un bécher de frai contenant 30 femelles, 15 mâles et 2,5 L de fSW frais. Le premier matin après le frai (Jour1), vider soigneusement le bécher de frai avec la nouvelle génération d’animaux dans un bécher contenant 7,5 L de fSW frais. Le deuxième jour après le frai (jour 2), transférer 150 animaux dans un bécher contenant 5 L fSW frais. Le troisième jour après le frai (jour 3), transférer 120 animaux dans un bécher contenant 5 L fSW frais. Le dernier jour (jour 4), mettre en place un nouveau bécher de frai contenant 30 femelles, 15 mâles et 2,5 L fSW frais en préparation de la prochaine génération. Les animaux ont un cycle de vie de 4 jours à 23 °C. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
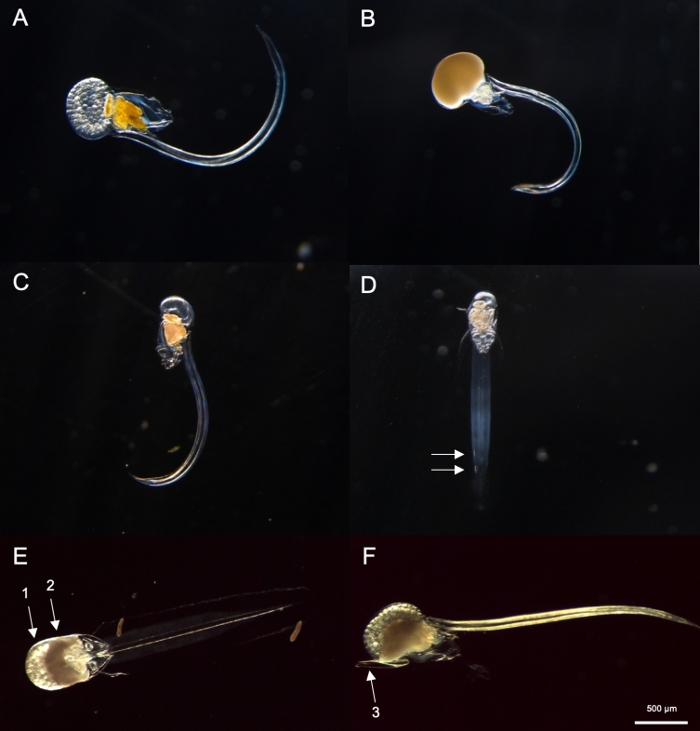
Figure 8 : Identification d’Oikopleura spp. (A-D: O. dioica, E et F : O. longicauda).
(A) Femelle O. dioica avec des oeufs (B) Mâle O. dioica avec sperme (C) Vue latérale de immature O. dioica (D) Vue ventrale de immature O. dioica avec deux cellules subchordales indiquées avec des flèches blanches (E) Vue ventrale de mature O. longicauda portant des oeufs (flèche 1) et sperme (flèche 2) (F) Vue latérale de O. longicauda montrant velum (flèche 3). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Réactifs | Produits chimiques | Montant | Vol final (mL) | Stérilisation | Stock / Ouvert |
| Solution A | Na2EDTA | 45 g | 1000 | Autoclave | -20 °C / 4 °C |
| NaNO3 | 100 g | ||||
| H3BO3 | 33,6 g | ||||
| NaH2PO4 | 20 g | ||||
| MnCl2·4H2O | 0,36 g | ||||
| FeCl3·6H2O | 1,3 g | ||||
| Solution B | 1,0 mL | ||||
| Solution B | ZnCl2 | 2,1 g | 1000 | Autoclave | 4 °C / 4 °C |
| CoCl2·6H2O | 2,0 g | ||||
| (NH4)6Mo7O24·4H2O | 0,9 g | ||||
| CuSO4·5H2O | 2,0 g | ||||
| *HCl | -- mL | ||||
| Vitamine | Thiamine (B1) · Hcl | 200 mg | 1000 | Autoclave | -20 °C / 4 °C |
| Biotine | 1 mg | ||||
| Cobalamine (B12) | 1 mg | ||||
| Silicate de sodium | Na2SiO3 | 5% | 1000 | Filtre de 0,22 μm | 4 °C / 4 °C |
| Streptomycine | C21H39N7O12 | 25 mg/mL | 50 | Filtre de 0,22 μm | -20 °C / -20 °C |
Tableau 1 : Recette des réactifs nécessaires à l’entretien des aliments aux algues. Après la dissolution de tous les produits chimiques énumérés pour la solution B, HCl est ajouté jusqu’à ce que la solution devienne claire sans turbidité. Tous les réactifs sont stérilisés soit par autoclaving (120 °C, 25 min) soit par l’utilisation d’un filtre de 0,22 m. Tous les réactifs, à l’exception des stocks de vitamines, sont stérilisés après l’ajout de produits chimiques spécifiés. Pour les stocks de vitamines, autoclavez d’abord l’eau, puis dissoudrez le produit chimique répertorié. Les températures de stockage des stocks et des réactifs ouverts sont répertoriées.
| Type de culture | Algue spp. | ASW (mL) | Vitamine | Solution A | Silicate de sodium | Streptomycine | Algues (mL) / Type de culture | Incuber / Magasin | Fréquence |
| Culture de stock | Chaeto | 60 | 1/2000 | 1/2000 | 1/4000 (Chaeto seulement) | 1/1000 (Tous sauf pour Syn) | 0,03 / stock | 17°C / 4°C | Biweekly |
| Iso | 60 | 0,03 / stock | |||||||
| Rhino | 80 | 0,06 / stock | |||||||
| Syn | 60 | 0,03 / stock | |||||||
| Sous-culture | Chaeto | 500 | 1/2000 | 1/2000 | 1/4000 (Chaeto seulement) | 1/1000 (Tous sauf pour Syn) | 10 / stock | 17°C / 17°C | Hebdomadaire |
| Iso | 500 | 10 / stock | |||||||
| Rhino | 500 | 20 / stock | |||||||
| Syn | 500 | 10 / stock | |||||||
| Culture de travail | Chaeto | 400 | 1/2000 | 1/2000 | 1/4000 (Chaeto seulement) | 1/1000 (Tous sauf pour Syn) | 100 / sous | RM / RM | Tous les 4 jours |
| Iso | 400 | 100 / sous | |||||||
| Rhino | 400 | 150 / sous | |||||||
| Syn | 400 | 100 / sous |
Tableau 2 : Instruction pour le maintien de trois types de culture d’algues. Ajouter la quantité spécifiée de suppléments aux flacons contenant de l’eau de mer autoclaved. Inoculer chaque flacon avec une quantité spécifiée de culture d’algues. Incuber et stocker les cultures d’algues à des températures déterminées. Inoculer une nouvelle culture de stock et la sous-culture de la culture stock précédente, et la nouvelle culture de travail de la sous-culture précédente. Inoculer une nouvelle culture de stock, la sous-culture et la culture de travail toutes les deux semaines, une semaine et quatre jours, respectivement. Ce calendrier fournit suffisamment de nourriture pour environ 10 béchers de la culture O. dioica. Maintenir 2 – 3 ensembles de chaque type de culture d’algues comme sauvegardes. RM – température ambiante.
| Jour | Algue spp. | 9h et 17h | 12h |
| 1 | Chaeto | — | — |
| Iso | 1000 | 2000 | |
| Syn | 20,000 | 40,000 | |
| 2 | Chaeto | 1000 | 2000 |
| Iso | 2000 | 2000 | |
| Rhino | 1000 | 1000 | |
| 3 | Chaeto | 3000 | 4000 |
| Iso | 3000 | 4000 | |
| Rhino | 1500 | 1500 | |
| 4 | Chaeto | 1000 | 2000 |
| Iso | 1000 | 2000 | |
| Rhino | 1000 | 1000 |
Tableau 3 : Concentration d’algues par alimentation modifiée par Bouquet et coll.27. Concentrations d’algues (cellules mL-1)et d’algues utilisées pour l’alimentation quotidienne pendant le cycle de vie de 4 jours d’Okinawa O. dioica.
Fichier supplémentaire 1 : Graphique d’alimentation quotidienne. Les quantités quotidiennes d’alimentation pour chaque bécher de culture sont automatiquement calculées après avoir entré des mesures quotidiennes d’absorption des algues (OD), la taille des animaux (Jour) et le volume d’eau de mer (SW vol.) dans chaque bécher de culture. Les courbes de croissance de R. reticulata et Synechococcus sp. ont été adaptées de Bouquet et al.27. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 2 : Comment connecter le moteur synchrone à la pagaie acrylique. Visser étroitement sur la pagaie jusqu’au moteur à l’aide d’une clé hexagonale. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Pour faciliter la flexibilité dans l’établissement de la culture O. dioica, il est important de comprendre l’habitat naturel des animaux. Les données saisonnières fournissent des informations sur les plages de paramètres physiques, qui peuvent être utilisées pour guider les conditions de culture en laboratoire. Il aide également à comprendre les fluctuations saisonnières de l’abondance des animaux. À Okinawa, O. dioica est le plus fiable de Juin à Octobre. Cependant, dans la baie de Tokyo, les populations atteignent un pic en février et octobre41. Bien que la culture d’O. dioica soit souvent signalée à 20 °C ou inférieure27,28,29, Okinawan O. dioica montre une meilleure survie à des températures supérieures à 20 °C; cela pourrait s’expliquer par le fait que la température minimale de l’eau de mer à okinawa est de ~20 °C (figure 6). L’abondance d’O. dioica pourrait également être influencée par les fleurs de phytoplancton42 et l’abondance des prédateurs43,44. Quel que soit l’endroit où O. dioica sont recueillis, la compréhension de la saisonnalité des populations locales maximise les chances d’échantillonnage et de succès de la culture.
Compte tenu de la saison et de l’emplacement appropriés, l’échantillonnage net est un moyen efficace de recueillir un grand nombre d’Oikopleura avec un minimum d’effort. Des filets de plancton de plus petite taille de maille (60-70 μm) peuvent également être utilisés pour recueillir toutes les étapes des animaux. Les animaux adultes sont rarement trouvés dans le filet, peut-être en raison de leur fragilité à la fin du cycle de vie. Par conséquent, l’identification des espèces suivie d’échantillonnage est obtenue par l’observation microscopique des cellules subchortales. Les individus matures apparaissent habituellement un ou deux jours après l’échantillonnage, car les animaux continuent de croître en laboratoire. Bien que l’échantillonnage net soit efficace, d’autres méthodes d’échantillonnage pourraient être nécessaires dans des circonstances différentes. Par exemple, l’échantillonnage net près des zones urbaines peut recueillir un grand nombre de phytoplancton, ce qui rend difficile l’isolement d’Oikopleura. Dans de tels cas, il est recommandé d’échantillonner simplement le seau pour recueillir l’échantillonnage de l’eau de mer de surface ou des bateaux dans des zones situées au-delà du port. Les résultats ont montré que le changement progressif de salinité dû à des jours consécutifs de pluie n’a pas affecté l’abondance de O. dioica; toutefois, il convient d’éviter l’échantillonnage à terre immédiatement après des phénomènes météorologiques extrêmes tels que les cyclones tropicaux. Ces événements provoquent des changements biogéochimiques soudains et drastiques dans un plan d’eau abrité45,46. Le ruissellement des eaux pluviales peut transporter des polluants, des sédiments et des éléments nutritifs excédentaires, ce qui augmente la turbidité et la qualité inférieure de l’eau47. Le plancton qui filtre, comme Oikopleura,peut être particulièrement sensible à ces changements en raison de leur mode d’alimentation et de leur mobilité limitée. Dans de telles circonstances, nous recommandons de reporter l’échantillonnage de quelques jours jusqu’à ce que les conditions locales reviennent à la normale.
L’introduction d’un système de filtre en plusieurs étapes est essentielle pour maintenir de petits organismes qui filtrent comme O. dioica. En utilisant de l’eau de mer mal filtrée (par exemple, un maillage de 25 μm dans le système de culture précédent), la culture était souvent instable surtout pendant l’été, potentiellement en raison de l’abondance plus élevée de phytoplancton. Bien que certains phytoplanctons soient bénéfiques pour la croissance d’O. diocia, d’autres produisent des biotoxines qui peuvent causer un développement anormal des embryons d’O. diocia 48. En outre, une forte concentration de diatomées telles que Chaetoceros spp. sont potentiellement nocifs pour la croissance O. dioica car ils peuvent posséder de longs setae qui peuvent obstruer la maison et empêcher l’alimentation efficace49. Nous avons fréquemment observé des maisons de petits animaux obstrués par C. calcitrans setae; par conséquent, nous ne donnons maintenant C. calcitrans qu’aux animaux du jour 2 et plus (tableau 3).
Bien que ce n’était pas un problème ici, la culture à grande échelle à long terme de O. dioica peut connaître des baisses soudaines de la taille de la population en raison d’un goulot d’étranglement génétique; dans de tels cas, Martí-Solans et coll.29 recommandent d’ajouter de nouveaux individus sauvages à la culture toutes les 20 générations.
Le système de culture Oikopleura est flexible. Une culture stable peut être établie en une semaine. La culture à long terme d’O. dioica est possible sur un budget modeste avec des équipements non spécialisés. L’effort quotidien requis pour l’entretien de 5-10 béchers d’Oikopleura est généralement inférieur à 2 heures avec 2 personnes. O. dioica peut également être maintenu dans l’eau de mer artificielle, ce qui est bénéfique pour ceux qui n’ont pas accès à l’eau de mer naturelle28. Le stockage à long terme des aliments aux algues est possible en utilisant la culture solide et la cryoconservation29. En outre, O. dioica sperme peut être cryoconservé, et rester viable pendant plus d’un an50. Tous ces facteurs signifient que les cultures peuvent être facilement rétablies. Enfin, l’expérience passée avec la culture accidentelle de Pleurobrachia sp. peut suggérer que le système de culture développé pour Oikopleura pourrait potentiellement être étendu à une communauté plus large d’organismes pélagiques fragiles.
O. dioica continue de fournir des informations puissantes sur divers domaines biologiques. Une compréhension de la saisonnalité locale, un système culturel méticuleux, et quelques individus dévoués permettent d’établir une culture efficace avec peu d’effort. Le système de culture Oikopleura fournit les ressources de base pour étudier un large éventail de domaines biologiques liés à l’écologie, au développement, à la génomique et à l’évolution de cet accord marin unique.
Déclarations de divulgation
L’auteur n’a rien à déclarer.
Remerciements
Nous sommes reconnaissants à Garth Ilsley pour son soutien à l’établissement du système culturel. Nous reconnaissons la contribution de Ritsuko Suyama et Sylvain Guillot aux premiers efforts d’échantillonnage et d’identification des espèces. Nous remercions tout particulièrement Hiroki Nishida, Takeshi Onuma et Tatsuya Omotezako pour leur généreux soutien et conseils tout au long de l’année, y compris la mise en place initiale du système local de culture et le partage des animaux et de la culture microalgale. Nous remercions également Daniel Chourrout, Jean-Marie Bouquet, Anne Aasjord, Cristian Cañestro et Alfonso Ferrández-Roldán d’avoir partagé leur expertise en matière d’échantillonnage et de culture. Jai Denton, Charles Plessy et Jeffrey Jolly ont fourni des commentaires précieux sur le manuscrit. Charlotte West a formulé une équation généralisée pour le calcul des algues. Enfin, nous remercions l’OIST pour le financement, Mary Collins et le Comité de sécurité du travail sur le terrain de l’OIST pour leurs conseils sur les procédures d’échantillonnage sécuritaires, le personnel de l’atelier d’usinage oist pour la construction d’équipements de culture et d’échantillonnage, et Koichi Toda pour la livraison d’eau de mer.
matériels
| Name | Company | Catalog Number | Comments |
| Activated charcoal | Sigma | C2764-2.5KG | |
| Alluminum pulley | Rainbow Products | 10604-10607 | |
| Biotin | Sigma | B4501-100MG | |
| Boric acid | Wako | 021-02195 | |
| Cobalamin (B12) | Sigma | V2876-100MG | |
| Cobalt(II) chloride hexahydrate | Wako | 036-03682 | |
| Copper(II) sulfate pentahydrate | Wako | 039-04412 | |
| Disodium edetate hydrate | Wako | 044-29525 | |
| Hexaammonium heptamolybdate tetrahydrate | Wako | 019-03212 | |
| Hexagon wrench | Anex | No.6600 | |
| Hydrochloric acid | Wako | 080-01066 | |
| Iron(III) chloride hexahydrate | Wako | 091-00872 | |
| Jebao programmable auto dosing pump | Jebao | DP-4 | |
| Magnet pump | REI-SEA | RMD-201 | |
| Manganese(II) chloride tetrahydrate | Wako | 134-15302 | |
| Polypropylene wound cartridge filter | Advantec | TCW-10N-PPS | |
| TCW-5N-PPS | |||
| TCW-1N-PPS | |||
| Screwless terminal block | SATO PARTS | SL4500 | |
| Simple plankton net | RIGO, Japan | 5512-C | |
| Sodium metasilicate | Sigma | 307815-1KG | |
| Sodium nitrate | Wako | 195-02545 | |
| Sodium phosphate monobasic anhydrous | MP Biomedicals | 194740 | |
| Streptomycin sulfate salt | Sigma | S6501-25G | |
| Synchronous electric motor | Servo | D5N6Z15M | |
| Thiamin hydrochloride | Wako | 201-00852 | |
| UV sterilizer | Iwaki | UVF-1000 | |
| Zinc chloride | MP Biomedicals | 194858 |
Références
- Travis, J. Is It What We Know or Who We Know? Choice of Organism and Robustness of Inference in Ecology and Evolutionary Biology (American Society of Naturalists Presidential Address). The American Naturalist. 167 (3), 303-314 (2006).
- Jenner, R. A., Wills, M. A. The choice of model organisms in evo-devo. Nature Reviews Genetics. 8 (4), 311-314 (2007).
- Irigoien, X., Huisman, J., Harris, R. P. Global biodiversity patterns of marine phytoplankton and zooplankton. Nature. 429 (6994), 863-867 (2004).
- Wilson, S., Ruhl, H., Smith, J. Zooplankton fecal pellet flux in the abyssal northeast Pacific: A 15 year time-series study. Limnology and Oceanography. 58 (3), 881-892 (2013).
- Steinberg, D. K., Lomas, M. W., Cope, J. S. Long-term increase in mesozooplankton biomass in the Sargasso Sea: Linkage to climate and implications for food web dynamics and biogeochemical cycling. Global Biogeochemical Cycles. 26 (1), 1004 (2012).
- Lombard, F., Kiørboe, T. Marine snow originating from appendicularian houses: Age-dependent settling characteristics. Deep Sea Research Part I: Oceanographic Research Papers. 57 (10), 1304-1313 (2010).
- Fenaux, R., Bone, Q. . The Biology of Pelagic Tunicates. , 251-264 (1998).
- Hopcroft, R. R., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 45-57 (2005).
- Walters, T. L., Gibson, D. M., Frischer, M. E. Cultivation of the Marine Pelagic Tunicate Dolioletta gegenbauri (Uljanin 1884) for Experimental Studies. Journal of Visualized Experiments. (150), e59832 (2019).
- Deibel, D. Feeding mechanism and house of the appendicularian Oikopleura vanhoeffeni. Marine Biology. 93 (3), 429-436 (1986).
- Spada, F., et al. Molecular patterning of the oikoplastic epithelium of the larvacean tunicate Oikopleura dioica. Journal of Biological Chemistry. 276 (23), 20624-20632 (2001).
- Flood, P. R., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 59-85 (2005).
- Tokioka, T. Studies on the distribution of appendicularians and some thaliaceans of the North Pacific, with some morphological notes. Publication of the Seto Marine Biological Laboratory. (8), 351-443 (1960).
- Alldredge, A. L. Discarded appendicularian houses as sources of food, surface habitats, and particulate organic matter in planktonic environments. Limnology and Oceanography. 21 (1), 14-24 (1976).
- Clarke, C., Roff, J. C. Abundance and biomass of herbivorous zooplankton off Kingston, Jamaica, with estimates of their annual production. Estuarine, Coastal and Shelf Science. 31 (4), 423-437 (1990).
- Hopcroft, R. R., Roff, J. C. Zooplankton growth rates: extraordinary production by the larvacean Oikopleura dioica in tropical waters. Journal of Plankton Research. 17 (2), 205-220 (1995).
- Hopcroft, R. R., Roff, J. C. Production of tropical larvaceans in Kingston Harbour, Jamaica: are we ignoring an important secondary producer. Journal of Plankton Research. 20 (3), 557-569 (1998).
- Mochioka, N., Iwamizu, M. Diet of anguilloid larvae: leptocephali feed selectively on larvacean houses and fecal pellets. Marine Biology. 125 (3), 447-452 (1996).
- Sakaguchi, S. O., et al. Morphological identity of a taxonomically unassigned cytochrome c oxidase subunit i sequence from stomach contents of juvenile chum salmon determined using polymerase chain reaction. Fisheries Science. 83 (5), 757-765 (2017).
- Fenaux, R., Bone, Q. . The Biology of Pelagic Tunicates. , 25-34 (1998).
- Sato, R., Tanaka, Y., Ishimaru, T. House production by Oikopleura dioica (Tunicata, Appendicularia) under laboratory conditions. Journal of Plankton Research. 23 (4), 415-423 (2001).
- Flood, R., Deibel, D., Bone, Q. . The Biology of Pelagic Tunicates. , 105-124 (1998).
- Alldredge, A., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 309-326 (2005).
- Katija, K., Sherlock, R. E., Sherman, A. D., Robison, B. H. New technology reveals the role of giant larvaceans in oceanic carbon cycling. Science Advances. 3 (5), 1602374 (2017).
- Katija, K., Choy, C. A., Sherlock, R. E., Sherman, A. D., Robison, B. H. From the surface to the seafloor: How giant larvaceans transport microplastics into the deep sea. Science Advances. 3 (8), 1700715 (2017).
- Hidaka, K. Species composition and horizontal distribution of the appendicularian community in waters adjacent to the Kuroshio in winter-early spring. Plankton and Benthos Research. 3 (3), 152-164 (2008).
- Bouquet, J. M., et al. Culture optimization for the emergent zooplanktonic model organism Oikopleura dioica. Journal of Plankton Research. 31 (4), 359-370 (2009).
- Nishida, H. Development of the appendicularian Oikopleura dioica: culture, genome, and cell lineages. Development, Growth & Differentiation. 50, 239-256 (2008).
- Martí-Solans, J., et al. Oikopleura dioica culturing made easy: A Low-Cost facility for an emerging animal model in Evo Devo. Genesis. 53 (1), 183-193 (2015).
- Holland, L. Z. Tunicates. Current Biology. 26 (4), 146-152 (2016).
- Delsuc, F., Brinkmann, H., Chourrout, D., Philippe, H. Tunicates and not cephalochordates are the closest living relatives of vertebrates. Nature. 439 (7079), 965-968 (2006).
- Seo, H. C., et al. Miniature genome in the marine chordate Oikopleura dioica. Science. 294 (5551), 2506 (2001).
- Fredriksson, G., Olsson, R. The subchordal cells of Oikopleura dioica and O. albicans (Appendicularia, Chordata). Acta Zoologica. 72 (4), 251-256 (1991).
- Paffenhöfer, G. A. The cultivation of an appendicularian through numerous generations. Marine Biology. 22 (2), 183-185 (1973).
- Fenaux, R., Gorsky, G. Nouvelle technique d'élevage des appendiculaires. Rapports et Procés-Verbaux des Réunions-Commission Internationale pour l'Exploration Scientifique de la Mer Méditerranée. 29, 291-292 (1985).
- Fujii, S., Nishio, T., Nishida, H. Cleavage pattern, gastrulation, and neurulation in the appendicularian, Oikopleura dioica. Development Genes and Evolution. 218 (2), 69-79 (2008).
- Patry, W. L., Bubel, M., Hansen, C., Knowles, T. Diffusion tubes: a method for the mass culture of ctenophores and other pelagic marine invertebrates. PeerJ. 8, 8938 (2020).
- Fenaux, R. The classification of Appendicularia (Tunicata): history and current state. Memoires de I'Institut oceanographique. , (1993).
- Shiga, N., Chihara, M., Murano, M. . Illustrated Guide to Marine Plankton in Japan. , 1393-1414 (1997).
- Gorsky, G., Castellani, C., Castellani, C., Edwards, M. . Marine Plankton: A practical guide to ecology, methodology, and taxonomy. , 599-606 (2017).
- Sato, R., Ishibashi, Y., Tanaka, Y., Ishimaru, T., Dagg, M. J. Productivity and grazing impact of Oikopleura dioica (Tunicata, Appendicularia) in Tokyo Bay. Journal of Plankton Research. 30 (3), 299-309 (2008).
- Nakamura, Y., Suzuki, K., Suzuki, S. Y., Hiromi, J. Production of Oikopleura dioica (Appendicularia) following a picoplankton 'bloom'in a eutrophic coastal area. Journal of Plankton Research. 19 (1), 113-124 (1997).
- Nakamura, Y. Blooms of tunicates Oikopleura spp. and Dolioletta gegenbauri in the Seto Inland Sea, Japan, during summer. Hydrobiologia. 385 (1-3), 183-192 (1998).
- Uye, S. I., Ichino, S. Seasonal variations in abundance, size composition, biomass and production rate of Oikopleura dioica (Fol)(Tunicata: Appendicularia) in a temperate eutrophic inlet. Journal of Experimental Marine Biology and Ecology. 189 (1-2), 1-11 (1995).
- Tsuchiya, K., et al. Phytoplankton community response and succession in relation to typhoon passages in the coastal waters of Japan. Journal of Plankton Research. 36 (2), 424-438 (2014).
- Lopez-Lopez, L., et al. Effects of typhoons on gelatinous carnivore zooplankton off Northern Taiwan. Cahiers de Biologie Marine. 53, 349-355 (2012).
- Ares, &. #. 1. 9. 3. ;., et al. Extreme storm-induced run-off causes rapid, context-dependent shifts in nearshore subtropical bacterial communities. bioRxiv. , (2019).
- Torres-Águila, N. P., et al. Diatom bloom-derived biotoxins cause aberrant development and gene expression in the appendicularian chordate Oikopleura dioica. Communications Biology. 1 (1), 1-11 (2018).
- Troedsson, C., Frischer, M. E., Nejstgaard, J. C., Thompson, E. M. Molecular quantification of differential ingestion and particle trapping rates by the appendicularian Oikopleura dioica as a function of prey size and shape. Limnology and Oceanography. 52 (1), 416-427 (2007).
- Ouchi, K., Nishino, A., Nishida, H. Simple procedure for sperm cryopreservation in the larvacean tunicate Oikopleura dioica. Zoological Science. 28 (1), 8-11 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon