Method Article
Campionamento semplificato e coltivazione del LarvaENo Cosmopolita Pelagico, Oikopleura dioica
In questo articolo
Riepilogo
L'oikopleura dioica è un organismo modello di tunicato in vari campi della biologia. Descriviamo i metodi di campionamento, l'identificazione delle specie, l'impostazione della coltura e i protocolli di coltura per gli animali e i mangimi algali. Mettiamo in evidenza i fattori chiave che hanno contribuito a rafforzare il sistema culturale e a discutere i possibili problemi e risoluzioni.
Abstract
Oikopleura dioica è un accordo planctonico con eccezionale capacità di filtraggio, tempo di generazione rapido, prestato sviluppo precoce, e un genoma compatto. Per questi motivi, è considerato un organismo modello utile per gli studi ecologici marini, la biologia evolutiva dello sviluppo e la genomica. Poiché la ricerca spesso richiede una fornitura costante di risorse animali, è utile stabilire un sistema di coltura affidabile e a bassa manutenzione. Qui descriviamo un metodo passo-passo per stabilire una cultura O. dioica. Descriviamo come selezionare potenziali siti di campionamento, metodi di raccolta, identificazione animale di destinazione e la configurazione del sistema di coltura. Forniamo consigli per la risoluzione dei problemi in base alle nostre esperienze. Mettiamo in evidenza anche i fattori critici che aiutano a sostenere un sistema di coltura robusto. Anche se il protocollo culturale fornito qui è ottimizzato per O. dioica, speriamo che la nostra tecnica di campionamento e la configurazione della cultura ispireranno nuove idee per mantenere altri fragili invertebrati pelagici.
Introduzione
Gli organismi modello sono stati fondamentali nell'affrontare molte questioni biologiche, tra cui quelle relative allo sviluppo, alla genetica e alla fisiologia. Inoltre, ulteriori organismi modello facilitano nuove scoperte e sono quindi cruciali per ottenere una maggiore comprensione della natura1,2. Lo zooplancton marino sono diversi gruppi di organismi che svolgono un ruolo importante negli ecosistemi oceanici3,4,5,6. Nonostante la loro abbondanza e l'importanza ecologica, gli organismi gelatinosi come i tunicati planctoni sono spesso sottorappresentati negli studi sulla biodiversità del plancton perché la loro trasparenza e fragilità rendono la raccolta e l'identificazione dei campi impegnativida 7,8. Tecniche di campionamento adattate e colture di laboratorio permettono una più stretta osservazione degli animali in vitro, che ha ulteriormente intensificato le conoscenze nella biologia dei tunicati planctonici9,10,11,12.
Larvacei (Appendicolari) sono una classe di tunicati marini che comprendono circa 70 specie descritte in tutto il mondo8,13. Poiché sono uno dei gruppi più abbondanti all'interno delle comunità di zooplancton14,15,16,17,larvacei rappresentano una fonte primaria di cibo per organismi planctonici più grandi come le larve di pesce18,19. A differenza degli ascidiani - i tunicati sessili-larvacei mantengono una morfologia girino-come e rimangono planctonici per tutta la vita20. Ogni animale vive all'interno di una struttura auto-costruita e intricata per l'alimentazione dei filtri conosciuta come casa. Accumulano particolato nelle loro case creando correnti d'acqua attraverso il movimento ondulato delle loro code21. Le case intasate vengono scartate per tutto il giorno, alcune delle quali formano aggregati di carbonio e alla fine affondano al fondo marino22; così, i larvacei svolgono un ruolo importante nel flusso globale del carbonio23. La maggior parte delle specie sono segnalate per vivere nella zona pelagica entro i 100 m superiori della colonna d'acqua13; tuttavia, la larva gigante Bathochordaeus è noto per abitare le profondità di 300 m24. Uno studio su Bathochordaeus nella baia di Monterey, California ha rivelato che gli animali fungono anche da vettore biologico di microplastiche, suggerendo una potenziale importanza nella comprensione del ruolo degli appendicolari nel trasporto verticale e nella distribuzione di microplastiche negli oceani25.
Oikopleura dioica, una specie di larvaceica, ha attirato l'attenzione negli ultimi anni come organismo modello a causa di diverse caratteristiche notevoli. È comunemente riportato in tutti gli oceani del mondo. E 'particolarmente abbondante nelle acque costiere26, che permette un facile campionamento dalla riva. La coltura stabile e a lungo termine è possibile con acqua di mare sia naturale che artificiale27,28,29. I tempi di generazione dipendenti dalla temperatura sono brevi fino a 4-9 giorni in condizioni di laboratorio. Ha un'alta fecondità con ogni femmina in grado di produrre >300 uova durante tutto l'anno. Come tunicato, occupa un'importante posizione filogenetica per comprendere l'evoluzione accordiate30,31. A 70 Mb, O. dioica ha il più piccolo genoma identificato tra tutti i chordates32. Tra i larvepati, O. dioica è l'unica specie non ermafrotica descritta finora33.
La prima coltura di O. dioica di successo con microalghe coltivate in laboratorio è stata riportata da Paffenh'fer34. Il protocollo originale della coltura con motori e pale sincroni è stato sviluppato da Fenaux e Gorsky35 e successivamente adottato da più laboratori. Più recentemente, Fujii et al.36 ha riferito o. dioica culturing in acqua di mare artificiale, un sistema di coltura robusto e la raccolta sul campo sono stati descritti da Bouquet et al.27 e un protocollo ottimizzato per un sistema semplificato e conveniente è stato segnalato da Marti-Solans et al.29. Oltre al tradizionale sistema di coltura Oikopleura, un design recentemente riportato con un serbatoio di allevamento a doppio tubo ha anche il potenziale per la coltura Oikopleura sp. 37.
Presentiamo un protocollo dettagliato per l'insorgere di una monocultura O. dioica basato su una combinazione di protocolli sviluppati dai principali gruppi di ricerca Oikopleura presso il Sars International Centre for Marine Molecular Biology27, l'Università di Barcellona29, l'Università di Osaka28,e le nostre osservazioni. Nei protocolli culturali pubblicati in precedenza, informazioni dettagliate sulla composizione dei media algali, sulle tecniche di campionamento a terra e sull'identificazione di Oikopleura sono state descritte solo approssimativamente, lasciando molte ambiguità. Qui, con l'aiuto delle informazioni visive nel protocollo video, abbiamo raccolto tutte le informazioni critiche necessarie per creare una cultura O. dioica da zero in modo semplice e graduale. Descriviamo come distinguere O. dioica da un'altra specie comunemente riportata, O. longicauda, che è uno dei passi più impegnativi. Anche se i sistemi di coltura esistenti sono applicabili per la coltivazione di O. dioica in tutto il mondo, sottolineiamo l'importanza dell'adattamento del protocollo in base alle condizioni ambientali locali. Le informazioni presentate combinano dati ampiamente pubblicati e conoscenze acquisite attraverso l'esperienza. L'attuale protocollo è ideale per i ricercatori interessati a stabilire una cultura da zero.
Protocollo
1. Struttura di coltura o. dioica
- Sistema di filtratità dell'acqua (Figura 1)
- Raccogliere acqua di mare naturale da un porto a 2-3 m di profondità. Passare l'acqua di mare attraverso un filtro di sabbia (dimensione pore 1,4 mm) e il trasporto in un serbatoio condiviso in laboratorio. Utilizzare un filtro contenitore per far circolare l'acqua al fine di mantenere la qualità dell'acqua nel serbatoio condiviso.
- In una sala coltura, impostare un sistema di filtraggio a più fasi costituito da un serbatoio da 100 L con una pompa magnetica, filtri per cartucce di polipropilene da 5 e 1 m e uno sterilizzatore UV (100 V) (Figura 1).
- Trasferire l'acqua di mare dal serbatoio condiviso al serbatoio serbatoio sala di coltura. Passare l'acqua di mare attraverso un'unità di filtro di 25 m (Figura 1A,B) prima di entrare nel serbatoio della sala di coltura. Circolare l'acqua di mare attraverso filtri da 5 e 1 m durante la notte per rimuovere accuratamente le particelle che potrebbero potenzialmente ostacolare lo sviluppo di animali.
NOTA: Un filtro aggiuntivo di dimensioni di rete di dimensioni maggiori (25-50 m) è utile per evitare che le particelle più grandi intatrino i filtri della cartuccia con dimensioni di mesh più piccole. L'acqua di mare filtrata (fSW) è pronta per l'uso la mattina seguente.
-
Unità di coltura Oikopleura (Figura 2)
- Mantenere gli animali in 5 o 10 L rotondi, bicchieri di plastica trasparenti.
- Posizionare i becher di coltura su un'unità di scaffalatura in acciaio inossidabile stabile (L x W x H - 150 cm x 45 cm x 90 cm) con una superficie acrilica trasparente spessa 5 mm.
- Posizionare luci fluorescenti bianche sotto la superficie acrilica per illuminare gli animali dal fondo dei becher.
- Posizionare un foglio di plastica nera dietro i becher. Il foglio nero crea contrasto e migliora la visualizzazione degli animali trasparenti.
- Collegare i motori elettrici sincroni alle pale acriliche (L x H x 8 cm x 27 cm) (File supplementare 2). Sospendere le pale nei becher di coltura da rotaie parallele che corrono lungo la lunghezza dell'unità discaffalatura( Figura 2A ).
- Accendere i motori per generare un movimento circolare delicato nei becher a 15 giri al secondo.
NOTA: Gli animali nelle loro case di cellulosa sono neutralmente galleggianti; tuttavia, la circolazione dell'acqua aiuta a mantenere le uova, le larve e il cibo delle alghe da sospendere e distribuire uniformemente nei becher di coltura.
- Pompa di dosso automatica (opzionale)
NOTA: un'unità di alimentazione automatica riduce i requisiti di personale, soprattutto durante i fine settimana.- Calibrare il volume del liquido di erogazione da una pompa di scarico automatica secondo le istruzioni del produttore.
- Utilizzare tubi da 50 mL come serbatoi di alghe.
- Forare due fori da 5 mm sui tappi dei tubi da 50 mL per passare attraverso i tubi della compagnia aerea. Collegare un tubo a una pompa d'aria acquario standard per introdurre bolle d'aria, e l'altro tubo al porto di insedio della pompa di dosso (Figura 2B).
NOTA: L'introduzione di un flusso sottile di bolle d'aria aiuta a prevenire che le alghe si stabiliscano sul fondo dei tubi. - Programmare il tempo e il volume dell'alimentazione algale da erogare in un dato giorno.
- Stazione di alghe
- Utilizzare un'unità di scaffalatura (L x W x H x 90 cm x 46 cm x 115 cm) per posizionare quattro flaconi inferiori rotondi da 1 L contenenti colture di lavoro algali (vedere il passaggio 2.1).
- Retroilluminare le culture di lavoro posizionando luci fluorescenti dietro i flaconi.
- Fiaschette di sigillo con tappi di gomma a due fori.
- Passare una pipetta usa e getta da 1 mL attraverso il tappo di gomma. Utilizzare tubi compagnia aerea per collegare la pipetta ad una pompa d'aria acquario. Introdurre un flusso di bolle d'aria nel pallone.
2. Cibo microalghe
- Influente le culture algali
NOTA: Mantenere tre serie di culture (stock, sub- e culture di lavoro) per tre specie di microalgali, Chaetoceros calcitrans, Isochrysis sp., Rhinomonas reticulata, e una specie di cianobatteri, Synechococcus sp.. Le scorte e le sottoculture vengono utilizzate come back-up. La cultura del lavoro viene utilizzata per l'alimentazione quotidiana.- Preparare i reagenti necessari per la coltivazione di microalghe e cianobatteri (Tabella 1).
- Per avviare la coltura dello stock, autoclave (121 gradi centigradi, 25 min) 60 – 80 mL di fSW in una fiaschetta Erlenmeyer da 100 ml. Inepeticamente inoculato quantità specificata di Modificato Conway medio27 e microalghe (Tabella 2). Ad esempio, per inoculare una coltura stock di C. calcitrans, autoclave 60 mL di acqua di mare, apposta inoculare 30 gradi ciascuna della vitamina e della soluzione A, 15 L di silicato di sodio, 60 l di streptomicina e 30 l di Calcitran dalla precedente coltura di stock.
NOTA: R. reticulata passa da rosa-rossastro a marrone orangiano quando esposto a troppa luce. Allontanateli dalla luce una volta che hanno iniziato a passare da chiaro a rosa chiaro. - Mantenere la coltura di riserva in un incubatore impostato a 17 gradi centigradi con illuminazione continua. Dopo circa 10 giorni, la cultura cambia colore per indicare la crescita delle alghe (Figura 3). Una volta visualizzati i colori, spostarli a 4 gradi centigradi per l'archiviazione a lungo termine per un massimo di 1 mese.
- Su un banco pulito, inoculare asetcically una sottocultura della cultura del titolo (Tabella 2). Incubare a 17 gradi centigradi con illuminazione continua. Dopo i colori delle algali appaiono, continuare a conservarli nell'incubatrice fino a 2 settimane.
- Inoculare la cultura del lavoro dalla sottocultura (Tabella 2). Sigillare il pallone con un cappuccio in gomma e inserire 1 mL di pipette usa e getta. Spostare il pallone alla stazione di alghe e mantenerlo a temperatura ambiente con un fotoperiodo di 8 ore. Alimentazione con costante aerazione. Rinnova la cultura del lavoro ogni 4 giorni.
- Mescolare magazzino e sottocolture due volte al giorno da vorticoso.
NOTA: L'archiviazione a lungo termine della cultura algale su supporti solidi e la crioconservazione è possibile fino a 3 mesi e 1 anno, rispettivamente29.
- Creazione di curve di crescita algale (opzionale)
NOTA: Una valutazione accurata della quantità di alimentazione è importante per mantenere una cultura stabile di O. dioica. Abbiamo creato curve di crescita per due specie alimentari primarie di alghe, Chaetoceros calcitrans e Isochrysis sp.- Preparare Le culture di lavoro di C. calcitrans e Isochrysis sp.(tabella 2).
- Per ogni specie di coltura di lavoro, campionare tre volte e misurare gli assorbimenti a 660 nm utilizzando uno spettrometro. Prendere le misure medie dei triplicati da ogni cultura di lavoro.
- Seguendo le istruzioni del produttore per un contatore cellulare automatizzato, preparare campioni di alghe per il conteggio. Contare ogni campione tre volte. Prendere la media di tre conteggi per determinare il numero totale di celle presenti in ogni campione.
- Continuare a contare ogni giorno fino a quando non vengono registrate circa 50 misurazioni medie.
- Creare curve di crescita per entrambe le specie algali (Figura 4).
3. Collezione di campo di Oikopleura spp selvatico.
- Rete di plancton modificata (Figura 5)
NOTA: La chiave per il campionamento riuscito di Oikopleura spp. è il lento traino di una rete di plancton con un merluzzo mozzo ponderato e non filtrante. Figura 5 Mostra un diagramma schematico di una rete plancton modificata.- Sostituire l'estremità del merluzzo di una rete a plancton portatile con una bottiglia di lavaggio a vite da 500 mL modificata.
- Forare un foro di 3 cm di diametro nella vite-top di 4 cm della bottiglia di lavaggio per consentire all'acqua e agli animali di entrare nell'estremità del merluzzo.
- Montare il tappo della bottiglia alla fine della rete di plancton. Avvolgere saldamente con nastro elettrico. Fissare ulteriormente il tappo con un morsetto in acciaio inossidabile.
- Fissare un peso di 70 g all'esterno dell'estremità del merluzzo modificato con le cravatte zip.
- Fissare il guinzaglio di sicurezza per fissare ulteriormente l'estremità del merluzzo.
- Selezione dei siti di raccolta (Figura 6)
NOTA: tutte le raccolte di campioni sono state approvate dal Comitato per la sicurezza sul campo OIST. Ci potrebbe essere variazione stagionale in presenza di Oikopleura spp. a seconda della posizione (Figura 6). Evitare il campionamento immediatamente dopo eventi meteorologici estremi come forti tempeste di pioggia.- Utilizzare la visualizzazione satellitare su un sito Web di mappe per identificare potenziali siti di campionamento. Ci siamo concentrati su porti e moli di pesca che sono facilmente accessibili in auto e situati all'interno di baie o vicino a i drop-off oceanici dove il plancton tende ad accumularsi: il porto di Ishikawa a Kin Bay, Okinawa, Giappone (GPS: 26'25'39.3"N 127'49'6"E).
- Visita le potenziali località di campionamento per valutare l'accessibilità e la sicurezza a terra di ogni sito. Ottenere il permesso di raccolta dalle autorità locali in base alle esigenze.
- Procedura di campionamento
- Gettare la rete di plancton in mare e lasciare che l'estremità del merluzzo affondere 1-2 m sotto la superficie dell'acqua.
- Trainare la rete orizzontalmente a mano a 50-100 cm s-1. Continuare a trainare camminando avanti e indietro per 2-5 minuti. Regolare il tempo di traino in base all'abbondanza di fitoplancton nel porto, con rimorchio più corto quando ci sono più fitoplancton.
NOTA: I larvacei sono animali fragili. Il traino rapido o la colata ripetuta della rete potrebbero danneggiare gli animali intrappolati nella fine del merluzzo. - Sollevare delicatamente la rete. Trasferire lentamente il contenuto dell'estremità del merluzzo in una bottiglia di vetro rotondo da 500 mL. Riempire completamente la bottiglia campione con acqua di mare per evitare bolle d'aria.
NOTA: La presenza di Oikopleura spp. può essere confermata visualizzando bottiglie campione su sfondo nero. La maggior parte degli animali abbandona le loro case durante la raccolta. Pertanto, l'osservazione microscopica è necessaria per l'identificazione a livello di specie. - Ripetere il campionamento fino a quando non vengono raccolte tre bottiglie da 500 mL.
- Misurare la salinità, la temperatura e la clorofilla utilizzando un profiler CTD per registrare la gamma di parametri fisici in cui gli animali esistono naturalmente.
- Raccogliere 10-15 L di acqua di mare di superficie in un secchio per acclimatarsi gli animali in laboratorio.
4. Isolamento e identificazione degli animali (Figura 7, Figura 8)
-
Identificazione oikopleura spp.
NOTA: Altri organismi planctoni cioctoniche che possono assomigliare a Oikopleura spp. a prima vista includono chaetognaths, Fritillaria spp., nematodi, larve di pesce con sacche di tuorlo e larve di Ciona spp.- Per acclimatare gli animali alle condizioni di laboratorio, trasferire ogni campione da 500 mL a un becher da 10 L contenente 1:1 rapporto tra l'acqua di superficie proveniente dal luogo di campionamento e l'acqua di mare filtrata (fSW) mantenuta in laboratorio(Figura 7A,B). Regolare il volume del becher a 5-10 L a seconda della concentrazione del campione di plancton.
NOTA: Se il campione di plancton contiene detriti indesiderati, passare attraverso un filtro grossolano (dimensione della maglia di 600 m) prima di passare a un becher da 10 L. - Utilizzare una pagaia attaccata a un motore elettrico sincrono (15 giri/min) e mantenere il plancton in sospensione durante la notte (passaggio 1.2.5).
- Identificare Oikopleura spp. cercando animali lunghi 1-2 mm a forma di girino che ondulano la coda all'interno di una casa sferica e traslucida. Alcuni animali possono essere temporaneamente liberi di nuoto senza le case. Trasferire delicatamente 5 animali in un piatto Petri vuoto utilizzando una pipetta smussata.
- Per l'identificazione del genere, sfrattare gli animali dalle loro case colme delicatamente la casa con una pipetta di trasferimento.
- Osservare gli animali senza casa al microscopio 20-40x e confermare Oikopleura spp (Figura 8).
- Per acclimatare gli animali alle condizioni di laboratorio, trasferire ogni campione da 500 mL a un becher da 10 L contenente 1:1 rapporto tra l'acqua di superficie proveniente dal luogo di campionamento e l'acqua di mare filtrata (fSW) mantenuta in laboratorio(Figura 7A,B). Regolare il volume del becher a 5-10 L a seconda della concentrazione del campione di plancton.
-
Identificazione di O. dioica
NOTA: O. dioica può essere identificata visivamente dalla presenza di maschi e femmine completamente maturi o due grandi cellule sottocordali situate sulla metà distale della loro coda. La distanza tra due cellule subchordali può variare tra gli individui.- Successivamente, verificare se c'è un Oikopleura completamente maturato con una gonad riempito con uova (Figura 8A) o sperma (Figura 8B). Se l'animale possiede solo uova o spermatozzo, andare al passaggio 4.2.3 in quanto O. dioica, l'unica specie non ermafrotica descritta.
- Se l'animale è immaturo (Figura 8C), cercare due cellule sottocordali alla fine della coda (Figura 8D).
- Una volta confermata la specie, trasferirla in un nuovo piatto Petri. Ripetere i passaggi 4.1.3-4.2.2 fino a quando 10-20 individui sono confermati a livello di specie.
NOTA: per facilitare l'identificazione, anestesizzare gli animali in un piatto Petri contenente lo 0,015% di metano tricainosulfonato (MS222) in fSW. - Se non viene trovato alcun O. dioica, tenere i becher sospesi per un giorno o due in più. Ci potrebbe essere immaturo O. dioica che continuerà a crescere e diventerà più facile da rilevare. Se dopo una settimana non viene visualizzato nessuno, eliminare il campione e riprovare a eseguire il campionamento.
5. Protocollo di coltivazione per O. dioica
- L'incaricamento di una monocoltura O. dioica da un campione raccolto sul campo (Figura 7)
NOTA: il cibo delle alghe viene preparato quotidianamente dalle culture che lavorano e ogni becher monocoltura viene nutrito tre volte al giorno rispettivamente alle 9:00, alle 12:00 e alle 17:00 (vedere il punto 5.2). Gli animali sono mantenuti a 23 gradi centigradi. In queste condizioni, il ciclo di vita di Okinawa O. dioica è di 4 giorni(Figura 7C).- Per avviare una monocoltura di O. dioica,isolare 120 animali e trasferirli su un nuovo becher contenente 5 L di fSW fresco (Figura 7B,C).
- La mattina seguente, cercare maschi completamente maturi con gonadi gialle e femmine con uova che appaiono come sfere d'oro (Figura 8A,B).
- Fai un becher di deposizione delle uova trasferendo delicatamente 15 maschi e 30 femmine su un nuovo becher contenente 2,5 L di fSW fresco con una pipetta da 5 mL.
NOTA: Se non ci sono abbastanza maschi e femmine, trasferire il maggior numero possibile di adulti a un becher contenente 1 L di fSW e lasciarli deporre le uova in modo naturale. Per ridurre al minimo lo stress fisico per gli animali durante il trasferimento manuale, devono essere lentamente sifonati e rilasciati sotto la superficie dell'acqua. - Lasciate che gli animali depongano le uova naturalmente per avviare la prossima generazione. Le larve alla coda dovrebbero comparire circa 3 ore dopo la fecondazione.
NOTA: La riproduzione viene eseguita da animali completamente maturati che abbandonano le loro case, nuotano verso l'acqua di superficie e rilasciano i loro gameti. Una fecondazione riuscita può essere confermata estraendo 5-10 mL di acqua di mare dal fondo del becher riproduttivo e identificando le uova con scissioni al microscopio. - Nella prima mattina dopo la deposizione delle uova (giorno 1), nel bicchiere dovrebbe comparire una nuova generazione di animali con case gonfiate. Utilizzare un becher portatile da 500 mL per trasferire delicatamente il contenuto del becher di deposizione delle uova in un nuovo becher contenente 7,5 L di fSW fresco (per un totale di 10 L). Versare ad angolo per evitare un movimento di spruzzi.
- La seconda mattinata (giorno 2), trasferire manualmente 150 animali a un nuovo becher contenente 5 L di fSW fresco.
- La terza mattina (giorno 3), trasferire manualmente 120 animali a un nuovo becher con 5 L di fSW fresco.
NOTA: Per sincronizzare lo sviluppo degli animali, è importante selezionare individui con dimensioni simili durante il trasferimento manuale il giorno 2 e 3. Un massimo di 10 animali possono essere siphonemati in un unico trasferimento. - La quarta mattina (giorno 4), dovrebbero comparire animali completamente maturati. Ripetere il passaggio 5.1.3 per chiudere il ciclo di vita.
NOTA: Una pompa di alimentazione automatica può essere impostata per nutrire gli animali alle 17:00 nei fine settimana senza la presenza di personale di coltura.
- Preparazione quotidiana del cibo algale dalla cultura del lavoro
- Misurare l'assorbimento della cultura del lavoro a 660 nm.
- Sulla base della carta di alimentazione giornaliera, scoprire quante cellule algali devono essere alimentate per gli animali di dimensioni specifiche (Tabella 3).
- Utilizzando le curve di crescita delle alghe (Figura 4), risolvere le equazioni riportate di seguito per calcolare il volume di alimenti algali (mL) necessari in un determinato giorno.
- Per calcolare il volume di una particolare alga necessaria per un giorno specifico e l'ora di alimentazione, utilizzare la seguente equazione:
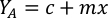
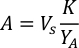
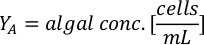
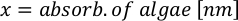
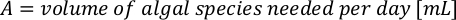
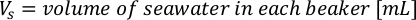
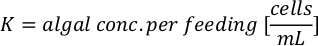
Dove YA è la concentrazione di alghe in un dato giorno e A è il volume di alghe necessarie per alimentazione. Inoltre, la relazione lineare tra YA e x, i valori per intercept (c) e slope (m) sono mostrate nella Figura 4. Fare riferimento alla tabella 3 per i valori K. - Ad esempio, per calcolare il volume di Isochrysis sp. necessario in un'alimentazione 9 AM degli animali del giorno 3 mantenuti in una coltura 5 L e con l'assorbimento algale di 0,234 (misurato a 660 nm), è stato calcolato quanto segue:
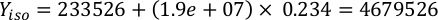
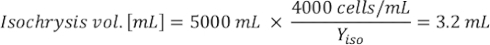
NOTA: memorizzare queste equazioni in un foglio di calcolo in modo che la quantità di alimentazione giornaliera venga calcolata automaticamente in base alle misurazioni dell'assorbimento, alle dimensioni degli animali e al volume dell'acqua di mare della coltura (File supplementare 1).
- Per calcolare il volume di una particolare alga necessaria per un giorno specifico e l'ora di alimentazione, utilizzare la seguente equazione:
- Trasferire il volume calcolato delle alghe a tubi da 50 mL, centrifugare a 5000 x g per 5 min a 20 gradi centigradi.
- Togliete il super-acletterante. Riempire i tubi fino al volume originale con fSW fresco, sostituendo i vecchi supporti algali.
- Conservare il cibo preparato in frigorifero fino a quando non è pronto per essere utilizzato per il mangime successivo. Scartare il vecchio cibo delle alghe dopo che il nuovo cibo è preparato la mattina successiva.
- Carbone attivo (opzionale)
NOTA: 10 g di carbone attivo vengono aggiunti a ogni bicchiere di coltura per mantenere la qualità dell'acqua. Il carbone può essere riutilizzato fino a quattro volte. Aprire lentamente il sacchetto di carbone per evitare che la polvere di carbone entri nei becher di coltura.- Trasferire 700 g di carbone attivo in un contenitore. Immergere in acqua dolce (FW) per 48 ore e lasciare che si stabiliscano sul fondo.
- Risciacquare con FW per rimuovere la polvere di carbone residuo.
- Far bollire il carbone in FW per 15-20 min. Rimuovere dal fuoco e lasciare raffreddare.
- Risciacquare fino a quando la maggior parte della polvere di carbone viene rimossa e l'acqua diventa limpida.
- Conservare il carbone pulito in becher da 2 L contenente fSW. Coprire il becher per evitare che la polvere entri.
- Aggiungere carbone ad ogni nuovo bicchiere prima di trasferire gli animali.
Risultati
L'oikopleura può essere raccolta da una barca o da un porto con un lento e delicato traino di una rete di plancton a rete da 100 m con un merluzzo non filtrante (Figura 5). A causa della natura fragile degli animali, è importante evitare qualsiasi movimento che possa causare stress fisico, come la manipolazione ruvida della rete o spruzzi a causa di una tasca d'aria intrappolata nel barattolo del campione.
È importante comprendere il modello stagionale delle popolazioni locali di Oikopleura, nonché le fluttuazioni che ne concedeno le caratteristiche fisiche dell'acqua in un sito di campionamento. Il campionamento tra il 2015 e il 2019 ha rivelato una costante variazione stagionale della presenza di O. dioica nei porti di Ishikawa e Kin nei porti di Okinawa(Figura 6). La temperatura delle acque marine di superficie sembra essere un fattore importante. O. dioica era la specie dominante quando l'acqua di mare ha raggiunto i 28 gradi centigradi, e O. longicauda ha coesistito con O. dioica a temperature comprese tra 24 e 27 gradi centigradi; tuttavia, O. longicauda ha dominato al di sotto dei 23 gradi centigradi(figura 6A). Il cambiamento graduale della salinità dopo diversi giorni consecutivi di forte pioggia non era correlato con l'abbondanza di O. dioica (Figura 6B).
Utilizzando le procedure di campionamento descritte in precedenza, la maggior parte di O. dioica che abbiamo recuperato erano tra il giorno 2 e il 3 del loro ciclo di vita di 4 giorni (Figura 7C). I maschi maturi sono stati riconosciuti dalla colorazione gialla delle gonadi, mentre le gonadi femminili luccicavano l'oro dalle uova di 70-80 m di diametro (Figura 8A,B). Immaturo O. dioica sono stati confermati da due cellule sottocordali sulla loro coda (Figura 8D). Un'altra specie dominante nelle acque locali, O. longicauda, erano simili per dimensioni e morfologia. Abbiamo usato i seguenti criteri per distinguere O. longicauda da O. dioica38,39,40: una mancanza di cellule subcordali nella coda, la presenza di velum nel tronco, e la presenza di una gonade ermafrodite ( Figura8E,F).39 Le diverse morfologie della coda sono utili anche per distinguere O. longicauda da O. dioica. Quando un animale nudo intatto senza la casa era orientato lateralmente, la coda di O. longicauda era più dritta con meno curvatura, dandogli un aspetto "rigido" rispetto a quello di O. dioica.
I tre fattori più importanti per stabilire un sistema stabile di coltura dell'Oikopleura sono (i) il mantenimento dell'alta qualità dell'acqua, (ii) l'identificazione del regime di alimentazione ottimale e (iii) la creazione di un becher riproduttivo con un numero sufficiente di maschi e femmine. L'introduzione di un sistema di filtro a più fasi (Figura 1) ha migliorato la qualità dell'acqua e la stabilità della coltura. Un sistema di filtrazione non è necessario per l'acqua di mare artificiale; tuttavia, il costo, la disponibilità e la comodità dell'acqua di mare naturale lo rendono un'opzione migliore per i laboratori situati vicino alla costa. Per stabilire il regime di alimentazione, si consiglia di misurare le curve di crescita delle alghe che si applicano alle singole impostazioni di laboratorio, poiché le condizioni di temperatura e luce variano notevolmente. Abbiamo combinato le curve di crescita con programmi di alimentazione pubblicati in precedenza per ottimizzare le concentrazioni di mangimi e le composizioni27 (Figura 4). Seguiamo anche un rigoroso programma di inoculazione delle alghe per mantenere una nuova scorta di alimenti algali (Tabella 2). Il sistema di alimentazione automatizzata ci permette di mantenere un programma di alimentazione giornaliero coerente senza la presenza di personale di coltura (Figura 2B).
Una volta raggiunte le condizioni ottimali di acqua di mare e di alimentazione, è importante iniziare nuove generazioni creando un becher di deposizione delle uova con 15 maschi e 30 femmine in 2,5 L di fSW. Questo assicura una buona concentrazione di animali del Giorno 1 la mattina seguente, che è sufficiente per isolare 150 animali il giorno 2, 120 il giorno 3 e 45 adulti maturi il giorno 4 per la deposizione delle uova. Se non ci sono abbastanza maschi e femmine il giorno 4, raccogliere e trasferire il maggior numero possibile di individui maturi a 1 L di fSW e lasciarli deporre le uova naturalmente nella speranza che ci saranno abbastanza larve per portare sulla prossima generazione. Seguendo il protocollo fornito, il ciclo di vita di O. dioica è di 4 giorni a 23 gradi (Figura 7C). Abbiamo stabilito in modo affidabile sei popolazioni selvatiche indipendenti di O. dioica,tutte durate più di 20 generazioni.
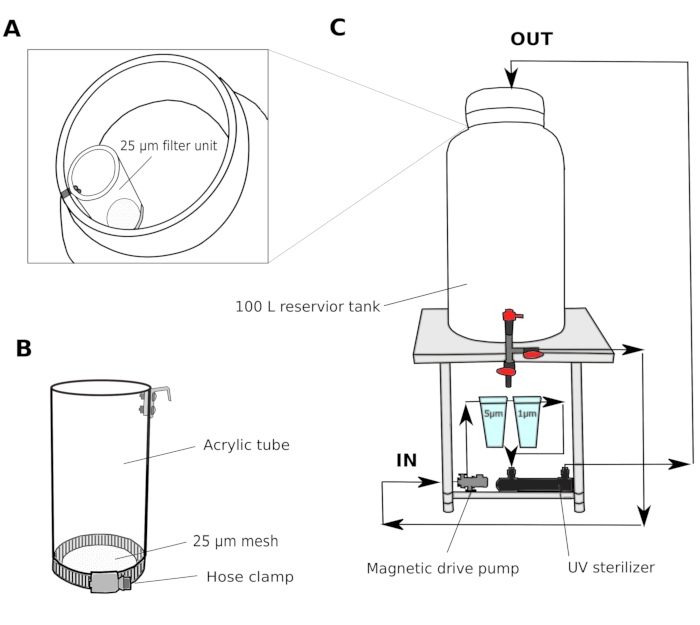
Figura 1: Schematico del sistema di filtro dell'acqua di mare.
(A e B) L'acqua di mare viene inizialmente filtrata attraverso un'unità di filtro di 25 m prima di entrare nel serbatoio del serbatoio (C) Viene utilizzata una pompa magnetica per estrarre l'acqua di mare dal serbatoio. L'acqua di mare viene quindi spinta attraverso due filtri di polipropilene e uno sterilizzatore UV prima di tornare al serbatoio. Fare clic qui per visualizzare una versione più grande di questa figura.
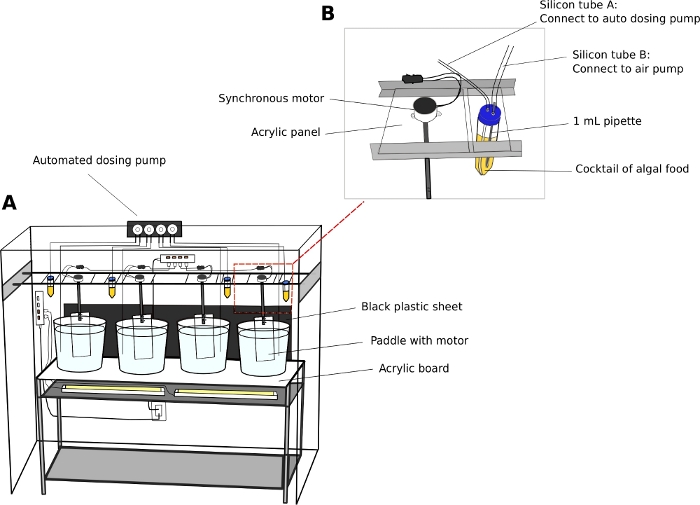
Figura 2: Sistema di coltura per O. dioica.
(A) Panoramica del sistema di coltura (B) Vista ravvicinata del serbatoio sincrono del motore e delle alghe per la pompa di dosso automatica. I diametri interni del tubo di silicio A e B sono rispettivamente 2 mm e 4 mm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Colture stock per O. dioica.
Da sinistra- C. calcitrans, Isochrysis sp., Synechococcus sp., e R. reticulata dopo essere cresciuto a 17 gradi centigradi sotto luce continua per 10 giorni. Fare clic qui per visualizzare una versione più grande di questa figura.
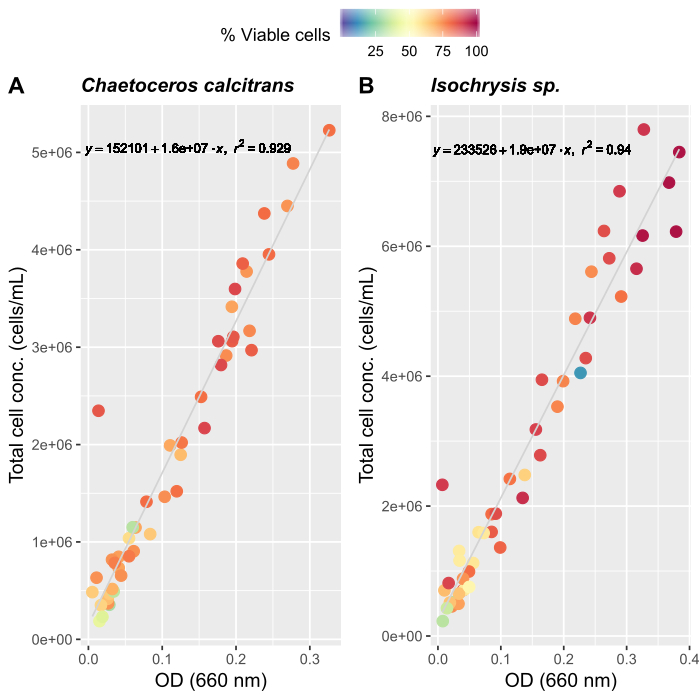
Figura 4: curva di crescita delle alghe per due delle principali specie alimentari, C. calcitrans e Isochrysis sp..
Grafici a dispersione a densità ottica (OD) a 660 nm e concentrazioni totali di cellule per (A) C. calcitrans e (B) Isochrysis sp.. Ogni punto rappresenta la media di tre misurazioni. Un contatore cellulare è stato utilizzato per determinare la percentuale di cellule vitali e le concentrazioni totali delle cellule (cellule/mL). Le misurazioni sono state registrate per 20 giorni (n . 47). Fare clic qui per visualizzare una versione più grande di questa figura.
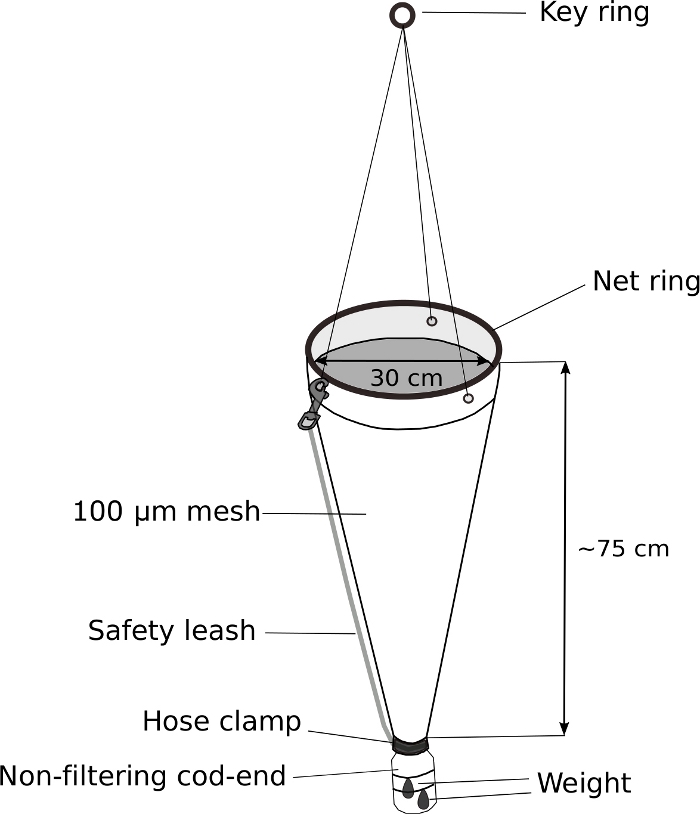
Figura 5: Rete di plancton modificata per il campionamento di Oikopleura.
L'estremità del merluzzo di una rete di plancton portatile (100 m mesh) viene sostituita con una bottiglia di lavaggio da 500 mL. All'estremità del merluzzo è fissato un peso di 70 g. Circa 5 m di corda sono attaccati all'anello chiave. Un guinzaglio di sicurezza è collegato per fissare ulteriormente il merluzzo. Fare clic qui per visualizzare una versione più grande di questa figura.
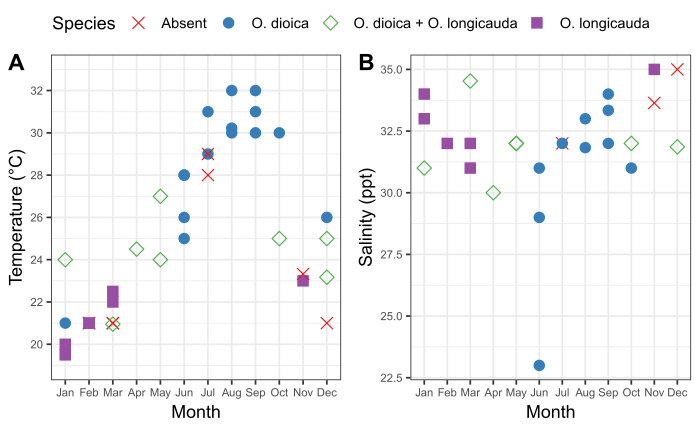
Figura 6: Stagionalità di O. dioica a Okinawa.
Presenza e assenza di O. dioica e O. longicauda in relazione ai cambiamenti stagionali della temperatura (A) e(B)la salinità nei porti di Ishikawa (26,25'39.3"N 127'49'56.6'E) e Kin (26'26'40.2"N'127'55'00.3'E) tra il 2015-2019. Ogni specie è stata registrata come presente se più di 50 animali sono stati conteggiati manualmente. Sono state registrate misurazioni di temperatura e salinità dell'acqua superficiale. Fare clic qui per visualizzare una versione più grande di questa figura.
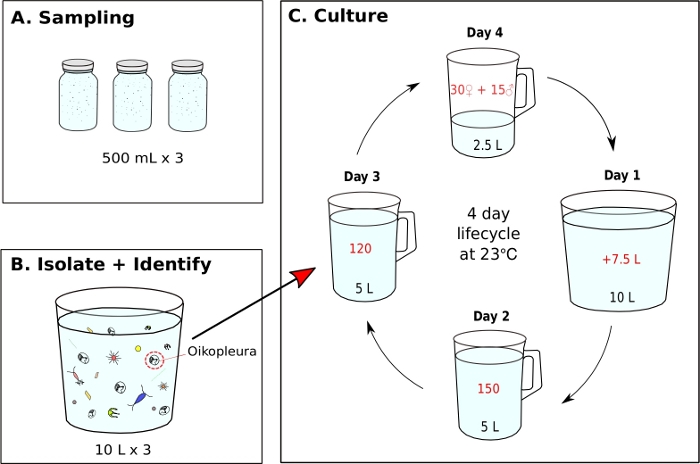
Figura 7: Diagramma di flusso per l'initazione della monocoltura di O. dioica.
(A) Tre campioni di plancton da 500 mL vengono raccolti da un sito di campionamento (B) Ogni vaso campione viene diluito e O. dioica è isolato dal resto del plancton (C) Una monocoltura di O. dioica viene avviata trasferendo manualmente 120 animali del giorno 3 a un nuovo becher contenente 5 L di acqua di mare fresco filtrata (fSW). Impostare un becher riproduttivo contenente 30 femmine, 15 maschi e 2,5 L di fSW fresco. Il primo post-spawning mattutino (Giorno1), svuotare con cura il becher di deposizione delle uova con la nuova generazione di animali in un becher contenente 7,5 L di fSW fresco. Il secondo giorno dopo la riproduzione (giorno 2), trasferisci 150 animali in un bicchiere contenente 5 L fSW fresco. Il terzo giorno dopo la riproduzione (giorno 3), trasferisci 120 animali in un bicchiere contenente 5 L fSW fresco. L'ultimo giorno (Giorno 4), allestito un nuovo becher di deposizione delle uova contenente 30 femmine, 15 maschi e fSW fresco da 2,5 L in preparazione della prossima generazione. Gli animali hanno un ciclo di vita di 4 giorni a 23 gradi centigradi. Fare clic qui per visualizzare una versione più grande di questa figura.
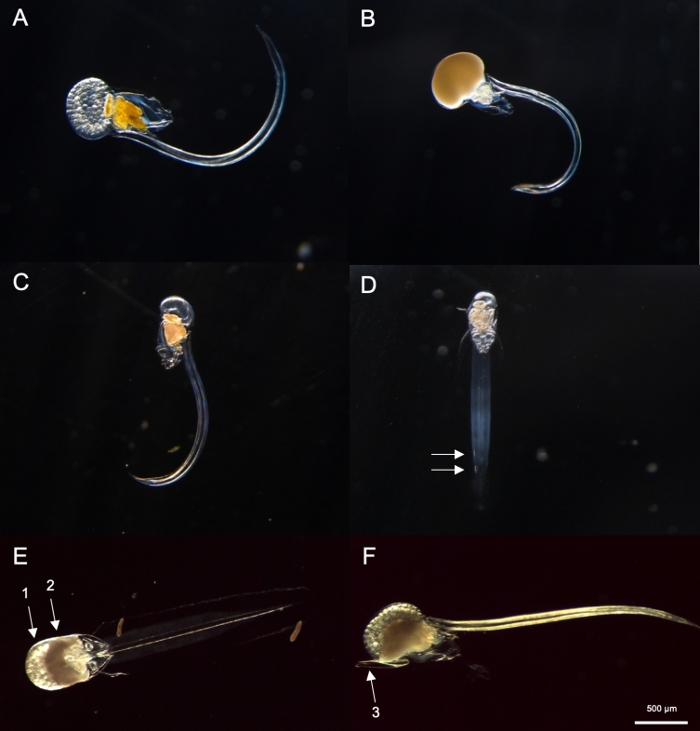
Figura 8: Identificazione di Oikopleura spp. (A-D: O. dioica, E e F: O. longicauda).
(A) O. dioica femminile con uova (B) Maschio O. dioica con sperma (C) Vista laterale dell'immatura O. dioica (D) Vista ventrale dell'immatura O. dioica con due cellule subcordali indicata con frecce bianche (E) Vista ventrale di O. longicauda matura che trasporta le uova (freccia 1) e sperma (freccia 2) (F) vista laterale di O. longicauda che mostra velum (freccia 3). Fare clic qui per visualizzare una versione più grande di questa figura.
| Reagenti | Prodotti chimici | Quantità | Vol. finale (mL) | Sterilizzazione | Magazzino / Aperto |
| Soluzione A | Na2EDTA | 45 g | 1000 | Autoclave | -20 gradi centigradi / 4 gradi centigradi |
| NaNO3 | 100g | ||||
| H3BO3 | 33,6 g | ||||
| NaH2PO4 | 20 g | ||||
| MnCl2s4H2O | 0,36 g | ||||
| FeCl3s6H2O | 1,3 g | ||||
| Soluzione B | 1,0 mL | ||||
| Soluzione B | NCl2 (NCl) | 2,1 g | 1000 | Autoclave | 4 gradi centigradi / 4 gradi centigradi |
| CoCl2ossutare2O | 2,0 g | ||||
| (NH4)6Mo7O224 | 0,9 g | ||||
| CuSO4x 5H2O | 2,0 g | ||||
| -HCl | -- mL | ||||
| Vitamina | Thiamin (B1) Hcl | 200 mg | 1000 | Autoclave | -20 gradi centigradi / 4 gradi centigradi |
| Biotina | 1 mg | ||||
| Cobalamin (B12) | 1 mg | ||||
| Silicato di sodio | Na2SiO3 | 5% | 1000 | filtro da 0,22 m | 4 gradi centigradi / 4 gradi centigradi |
| Streptomicina | C21H39N7O12 | 25 mg/mL | 50 | filtro da 0,22 m | -20 gradi centigradi / -20 gradi centigradi |
Tabella 1: Ricetta di reagenti necessaria per il mantenimento degli alimenti algali. Dopo aver sciolto tutte le sostanze chimiche elencate per la soluzione B, HCl viene aggiunto fino a quando la soluzione diventa chiara senza torbidità. Tutti i reagenti sono sterilizzati sia da autoclaving (120 gradi centigradi, 25 min) o mediante l'uso di un filtro di 0,22 m. Tutti i reagenti ad eccezione delle riserve vitaminiche vengono sterilizzati dopo l'aggiunta di prodotti chimici specificati. Per le riserve vitaminiche, autoclave l'acqua prima, e poi sciogliere la sostanza chimica elencata. Vengono elencate le temperature di stoccaggio per le scorte e i reagenti aperti.
| Tipo di lingua | Algal spp. | ASW (mL) | Vitamina | Soluzione A | Silicato di sodio | Streptomicina | Alghe (mL) / Tipo di coltura | Incubare / Negozio | Frequenza |
| Cultura dello stock | Chaeto | 60 | 1/2000 | 1/2000 | 1/4000 (Solo Chaeto) | 1/1000 (Tutti tranne Syn) | 0.03 / magazzino | 17oC / 4oC | Bisettimanale |
| Iso | 60 | 0.03 / magazzino | |||||||
| Rhino | 80 | 0.06 / magazzino | |||||||
| Syn | 60 | 0.03 / magazzino | |||||||
| Sottocultura | Chaeto | 500 | 1/2000 | 1/2000 | 1/4000 (Solo Chaeto) | 1/1000 (Tutti tranne Syn) | 10 / magazzino | 17 gradi centigradi / 17oC | Settimanale |
| Iso | 500 | 10 / magazzino | |||||||
| Rhino | 500 | 20 / magazzino | |||||||
| Syn | 500 | 10 / magazzino | |||||||
| Cultura del lavoro | Chaeto | 400 | 1/2000 | 1/2000 | 1/4000 (Solo Chaeto) | 1/1000 (Tutti tranne Syn) | 100 / sub | RM / RM | Ogni 4 giorni |
| Iso | 400 | 100 / sub | |||||||
| Rhino | 400 | 150 / sub | |||||||
| Syn | 400 | 100 / sub |
Tabella 2: Istruzioni per il mantenimento di tre tipi di coltura algale. Aggiungere la quantità specificata di integratori ai flaconi contenenti acqua di mare autoclaved. Inoculare ogni fiaschetta con quantità specificata di coltura algale. Incubare e conservare le colture algali a temperature specifiche. Inoculare la nuova cultura e la sottocultura del mondo e della nuova cultura del lavoro della precedente sottocultura. Inoculare nuova cultura stock, sottocultura e cultura del lavoro ogni due settimane, una settimana e quattro giorni, rispettivamente. Questo programma fornisce cibo sufficiente per circa 10 becher di cultura O. dioica. Mantenere 2 – 3 set di ogni tipo di coltura algale come back-up. RM – temperatura ambiente.
| Giorno | Algal spp. | 9:00 e 17:00 | Ore 12.00 |
| 1 | Chaeto | — | — |
| Iso | 1000 | 2000 | |
| Syn | 20,000 | 40,000 | |
| 2 | Chaeto | 1000 | 2000 |
| Iso | 2000 | 2000 | |
| Rhino | 1000 | 1000 | |
| 3 | Chaeto | 3000 | 4000 |
| Iso | 3000 | 4000 | |
| Rhino | 1500 | 1500 | |
| 4 | Chaeto | 1000 | 2000 |
| Iso | 1000 | 2000 | |
| Rhino | 1000 | 1000 |
Tabella 3: concentrazione di alghe per alimentazione- modificata da Bouquet et al.27. Concentrazioni di alghe (cellule mL-1)e specie di alghe utilizzate per l'alimentazione quotidiana durante il ciclo di vita di 4 giorni di Okinawa O. dioica.
File supplementare 1: tabella di alimentazione giornaliera. Le quantità giornaliere di alimentazione per ogni becher di coltura vengono calcolate automaticamente dopo aver inserito le misurazioni giornaliere dell'assorbimento delle alghe (OD), le dimensioni degli animali (Giorno) e il volume di acqua di mare (SW vol.) in ogni becher di coltura. Le curve di crescita di R. reticulata e Synechococcus sp. sono state adattate da Bouquet et al.27. Fare clic qui per scaricare questo file.
File supplementare 2: Come collegare il motore sincrono alla pagaia acrilica. Avvitare saldamente la pagaia al motore utilizzando una chiave esagonale. Fare clic qui per scaricare questo file.
Discussione
Per facilitare la flessibilità nella creazione della cultura O. dioica, è importante comprendere l'habitat naturale degli animali. I dati stagionali forniscono informazioni sulle gamme di parametri fisici, che possono essere utilizzate per guidare le condizioni di coltura di laboratorio. Aiuta anche a comprendere le fluttuazioni stagionali nell'abbondanza di animali. A Okinawa, O. dioica è più affidabile trovare da giugno a ottobre. Tuttavia, nella baia di Tokyo, le popolazioni picchiano in febbraio eottobre il 41. Anche se la coltura di O. dioica è spesso segnalata a 20 gradi centigradi o inferiore a27,28,29, Okinawan O. dioica mostra una migliore sopravvivenza a temperature superiori ai 20 gradi centigradi;29 questo potrebbe essere spiegato dal fatto che la temperatura minima delle acque di mare di superficie a Okinawa è di 20 gradi centigradi(Figura 6). L'abbondanza di O. dioica potrebbe anche essere influenzata dalle fioriture di fitoplancton42 e dall'abbondanza di predatori43,44. Indipendentemente da dove vengono raccolti O. dioica, comprendere la stagionalità delle popolazioni locali massimizza la possibilità di campionamento e di coltura del successo.
Data la stagione e la posizione appropriate, il campionamento netto è un modo efficace per raccogliere un gran numero di Oikopleura con il minimo sforzo. Le reti a cretolone con una dimensione di rete più piccola (60-70 m) possono anche essere utilizzate per raccogliere tutte le fasi degli animali. Gli animali completamente maturi si trovano raramente in rete, forse a causa della loro fragilità alla fine del ciclo di vita. Pertanto, l'identificazione delle specie seguite dal campionamento è ottenuta dall'osservazione microscopica delle cellule sottocordali. Gli individui maturi di solito appaiono uno o due giorni dopo il campionamento mentre gli animali continuano a crescere in laboratorio. Sebbene il campionamento netto sia efficiente, in circostanze diverse potrebbero essere necessari metodi di campionamento alternativi. Ad esempio, il campionamento netto vicino alle aree urbane può raccogliere un gran numero di fitoplancton, rendendo difficile isolare l'Oikopleura. In questi casi, si raccomanda un semplice campionamento di benne per raccogliere l'acqua di mare o il campionamento in barca da aree oltre il porto. I risultati hanno mostrato che il graduale cambiamento di salinità dovuto a giorni consecutivi di pioggia non ha influenzato l'abbondanza di O. dioica; tuttavia, il campionamento a terra subito dopo eventi meteorologici estremi come i cicloni tropicali dovrebbe essere evitato. Questi eventi causano improvvisi e drastici cambiamenti biogeochimici in un corpo riparato di acqua45,46. Il deflusso delle acque piovane può trasportare inquinanti, sedimenti e sostanze nutritive in eccesso, che aumentano la torbidità e la qualità dell'acquainferiore 47. Il plancton per l'alimentazione dei filtri, come l'Oikopleura,può essere particolarmente suscettibile a questi cambiamenti a causa della loro modalità di alimentazione e della mobilità limitata. In tali circostanze, si consiglia di posticipare il campionamento per alcuni giorni fino a quando le condizioni locali tornano alla normalità.
L'introduzione di un sistema di filtro multifase è essenziale per mantenere piccoli organismi che alimentano filtri come O. dioica. Utilizzando acqua di mare scarsamente filtrata (ad esempio, una maglie da 25 m nel sistema di coltura precedente), la coltura era spesso instabile soprattutto durante l'estate, potenzialmente a causa della maggiore abbondanza di fitoplancton. Anche se alcuni fitoplancton sono benefici per la crescita diOica, altri producono biotossine che possono causare lo sviluppo anomalo di embrioni O. dioica 48. Inoltre, un'alta concentrazione di diatomee come Chaetoceros spp. sono potenzialmente dannose per la crescita di O. dioica in quanto possono possedere lunghe setae che possono intasare la casa e prevenire un'alimentazione efficiente49. Spesso osservavamo case di piccoli animali intasati da C. calcitrans setae; quindi, ora diamo da mangiare C. calcitrans solo agli animali al giorno 2 e più anziani (Tabella 3).
Anche se non era un problema qui, la coltura a lungo termine su piccola scala di O. dioica può sperimentare improvvisi cali di dimensione della popolazione a causa di un collo di bottiglia genetico; in questi casi, Marta-Solans et al.29 consiglia di aggiungere nuovi individui selvatici alla cultura ogni 20 generazioni.
Il sistema di coltura Oikopleura è flessibile. Una cultura stabile può essere stabilita entro una settimana. La coltura a lungo termine di O. dioica è possibile con un budget modesto con attrezzature non specialistiche. Lo sforzo quotidiano richiesto per la manutenzione di 5-10 becher di Oikopleura è generalmente meno di 2 ore con 2 persone. O. dioica può essere mantenuta anche in acqua di mare artificiale, che è vantaggioso per coloro che non hanno accesso all'acqua di mare naturale28. Lo stoccaggio a lungo termine di alimenti algali è possibile utilizzando la cultura solida e la crioconservazione29. Inoltre, lo sperma O. dioica può essere crioconservato e rimanere vitale per più di un anno50. Tutti questi fattori significano che le culture possono essere facilmente ristabilite. Infine, esperienza passata con la coltura accidentale di Pleurobrachia sp. può suggerire che il sistema di coltura sviluppato per Oikopleura potrebbe potenzialmente essere esteso a una più ampia comunità di fragili organismi pelagici.
O. dioica continua a fornire potenti approfondimenti su vari campi biologici. La comprensione della stagionalità locale, un sistema culturale meticoloso e alcuni individui dedicati permettono di stabilire una cultura efficace con poco sforzo. Il sistema di coltura di Oikopleura fornisce le risorse di base per studiare una vasta gamma di campi biologici relativi all'ecologia, allo sviluppo, alla genomica e all'evoluzione di questo unico accordo marino.
Divulgazioni
L'autore non ha nulla da dichiarare.
Riconoscimenti
Siamo grati a Garth Ilsley per il suo sostegno nella creazione del sistema culturale. Riconosciamo il contributo di Ritsuko Suyama e Sylvain Guillot al campionamento precoce e agli sforzi di identificazione delle specie. Un ringraziamento speciale è grazie a Hiroki Nishida, Takeshi Onuma e Tatsuya Omotezako per il loro generoso sostegno e guida in tutto, tra cui l'istituzione iniziale del sistema di coltura locale e la condivisione di animali e cultura microalgal. Ringraziamo anche Daniel Chourrout, Jean-Marie Bouquet, Anne Aasjord, Cristian Caestro e Alfonso Ferràndez-Roldàn per aver condiviso le loro competenze nel campionare e coltivare. Jai Denton, Charles Plessy e Jeffrey Jolly fornirono un feedback prezioso sul manoscritto. Charlotte West ha formulato un'equazione generalizzata per il calcolo delle alghe. Infine, ringraziamo OIST per il finanziamento, Mary Collins e il Comitato per la sicurezza sul lavoro sul campo OIST per la consulenza sulle procedure di campionamento sicuro, il personale del negozio di macchine OIST per la costruzione di attrezzature di coltura e campionamento e Koichi Toda per la fornitura di acqua di mare.
Materiali
| Name | Company | Catalog Number | Comments |
| Activated charcoal | Sigma | C2764-2.5KG | |
| Alluminum pulley | Rainbow Products | 10604-10607 | |
| Biotin | Sigma | B4501-100MG | |
| Boric acid | Wako | 021-02195 | |
| Cobalamin (B12) | Sigma | V2876-100MG | |
| Cobalt(II) chloride hexahydrate | Wako | 036-03682 | |
| Copper(II) sulfate pentahydrate | Wako | 039-04412 | |
| Disodium edetate hydrate | Wako | 044-29525 | |
| Hexaammonium heptamolybdate tetrahydrate | Wako | 019-03212 | |
| Hexagon wrench | Anex | No.6600 | |
| Hydrochloric acid | Wako | 080-01066 | |
| Iron(III) chloride hexahydrate | Wako | 091-00872 | |
| Jebao programmable auto dosing pump | Jebao | DP-4 | |
| Magnet pump | REI-SEA | RMD-201 | |
| Manganese(II) chloride tetrahydrate | Wako | 134-15302 | |
| Polypropylene wound cartridge filter | Advantec | TCW-10N-PPS | |
| TCW-5N-PPS | |||
| TCW-1N-PPS | |||
| Screwless terminal block | SATO PARTS | SL4500 | |
| Simple plankton net | RIGO, Japan | 5512-C | |
| Sodium metasilicate | Sigma | 307815-1KG | |
| Sodium nitrate | Wako | 195-02545 | |
| Sodium phosphate monobasic anhydrous | MP Biomedicals | 194740 | |
| Streptomycin sulfate salt | Sigma | S6501-25G | |
| Synchronous electric motor | Servo | D5N6Z15M | |
| Thiamin hydrochloride | Wako | 201-00852 | |
| UV sterilizer | Iwaki | UVF-1000 | |
| Zinc chloride | MP Biomedicals | 194858 |
Riferimenti
- Travis, J. Is It What We Know or Who We Know? Choice of Organism and Robustness of Inference in Ecology and Evolutionary Biology (American Society of Naturalists Presidential Address). The American Naturalist. 167 (3), 303-314 (2006).
- Jenner, R. A., Wills, M. A. The choice of model organisms in evo-devo. Nature Reviews Genetics. 8 (4), 311-314 (2007).
- Irigoien, X., Huisman, J., Harris, R. P. Global biodiversity patterns of marine phytoplankton and zooplankton. Nature. 429 (6994), 863-867 (2004).
- Wilson, S., Ruhl, H., Smith, J. Zooplankton fecal pellet flux in the abyssal northeast Pacific: A 15 year time-series study. Limnology and Oceanography. 58 (3), 881-892 (2013).
- Steinberg, D. K., Lomas, M. W., Cope, J. S. Long-term increase in mesozooplankton biomass in the Sargasso Sea: Linkage to climate and implications for food web dynamics and biogeochemical cycling. Global Biogeochemical Cycles. 26 (1), 1004 (2012).
- Lombard, F., Kiørboe, T. Marine snow originating from appendicularian houses: Age-dependent settling characteristics. Deep Sea Research Part I: Oceanographic Research Papers. 57 (10), 1304-1313 (2010).
- Fenaux, R., Bone, Q. . The Biology of Pelagic Tunicates. , 251-264 (1998).
- Hopcroft, R. R., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 45-57 (2005).
- Walters, T. L., Gibson, D. M., Frischer, M. E. Cultivation of the Marine Pelagic Tunicate Dolioletta gegenbauri (Uljanin 1884) for Experimental Studies. Journal of Visualized Experiments. (150), e59832 (2019).
- Deibel, D. Feeding mechanism and house of the appendicularian Oikopleura vanhoeffeni. Marine Biology. 93 (3), 429-436 (1986).
- Spada, F., et al. Molecular patterning of the oikoplastic epithelium of the larvacean tunicate Oikopleura dioica. Journal of Biological Chemistry. 276 (23), 20624-20632 (2001).
- Flood, P. R., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 59-85 (2005).
- Tokioka, T. Studies on the distribution of appendicularians and some thaliaceans of the North Pacific, with some morphological notes. Publication of the Seto Marine Biological Laboratory. (8), 351-443 (1960).
- Alldredge, A. L. Discarded appendicularian houses as sources of food, surface habitats, and particulate organic matter in planktonic environments. Limnology and Oceanography. 21 (1), 14-24 (1976).
- Clarke, C., Roff, J. C. Abundance and biomass of herbivorous zooplankton off Kingston, Jamaica, with estimates of their annual production. Estuarine, Coastal and Shelf Science. 31 (4), 423-437 (1990).
- Hopcroft, R. R., Roff, J. C. Zooplankton growth rates: extraordinary production by the larvacean Oikopleura dioica in tropical waters. Journal of Plankton Research. 17 (2), 205-220 (1995).
- Hopcroft, R. R., Roff, J. C. Production of tropical larvaceans in Kingston Harbour, Jamaica: are we ignoring an important secondary producer. Journal of Plankton Research. 20 (3), 557-569 (1998).
- Mochioka, N., Iwamizu, M. Diet of anguilloid larvae: leptocephali feed selectively on larvacean houses and fecal pellets. Marine Biology. 125 (3), 447-452 (1996).
- Sakaguchi, S. O., et al. Morphological identity of a taxonomically unassigned cytochrome c oxidase subunit i sequence from stomach contents of juvenile chum salmon determined using polymerase chain reaction. Fisheries Science. 83 (5), 757-765 (2017).
- Fenaux, R., Bone, Q. . The Biology of Pelagic Tunicates. , 25-34 (1998).
- Sato, R., Tanaka, Y., Ishimaru, T. House production by Oikopleura dioica (Tunicata, Appendicularia) under laboratory conditions. Journal of Plankton Research. 23 (4), 415-423 (2001).
- Flood, R., Deibel, D., Bone, Q. . The Biology of Pelagic Tunicates. , 105-124 (1998).
- Alldredge, A., Gorsky, G., Youngbluth, M. J., Deibel, D. . Response of Marine Ecosystems to Global Change: Ecological Impact of Appendicularians. , 309-326 (2005).
- Katija, K., Sherlock, R. E., Sherman, A. D., Robison, B. H. New technology reveals the role of giant larvaceans in oceanic carbon cycling. Science Advances. 3 (5), 1602374 (2017).
- Katija, K., Choy, C. A., Sherlock, R. E., Sherman, A. D., Robison, B. H. From the surface to the seafloor: How giant larvaceans transport microplastics into the deep sea. Science Advances. 3 (8), 1700715 (2017).
- Hidaka, K. Species composition and horizontal distribution of the appendicularian community in waters adjacent to the Kuroshio in winter-early spring. Plankton and Benthos Research. 3 (3), 152-164 (2008).
- Bouquet, J. M., et al. Culture optimization for the emergent zooplanktonic model organism Oikopleura dioica. Journal of Plankton Research. 31 (4), 359-370 (2009).
- Nishida, H. Development of the appendicularian Oikopleura dioica: culture, genome, and cell lineages. Development, Growth & Differentiation. 50, 239-256 (2008).
- Martí-Solans, J., et al. Oikopleura dioica culturing made easy: A Low-Cost facility for an emerging animal model in Evo Devo. Genesis. 53 (1), 183-193 (2015).
- Holland, L. Z. Tunicates. Current Biology. 26 (4), 146-152 (2016).
- Delsuc, F., Brinkmann, H., Chourrout, D., Philippe, H. Tunicates and not cephalochordates are the closest living relatives of vertebrates. Nature. 439 (7079), 965-968 (2006).
- Seo, H. C., et al. Miniature genome in the marine chordate Oikopleura dioica. Science. 294 (5551), 2506 (2001).
- Fredriksson, G., Olsson, R. The subchordal cells of Oikopleura dioica and O. albicans (Appendicularia, Chordata). Acta Zoologica. 72 (4), 251-256 (1991).
- Paffenhöfer, G. A. The cultivation of an appendicularian through numerous generations. Marine Biology. 22 (2), 183-185 (1973).
- Fenaux, R., Gorsky, G. Nouvelle technique d'élevage des appendiculaires. Rapports et Procés-Verbaux des Réunions-Commission Internationale pour l'Exploration Scientifique de la Mer Méditerranée. 29, 291-292 (1985).
- Fujii, S., Nishio, T., Nishida, H. Cleavage pattern, gastrulation, and neurulation in the appendicularian, Oikopleura dioica. Development Genes and Evolution. 218 (2), 69-79 (2008).
- Patry, W. L., Bubel, M., Hansen, C., Knowles, T. Diffusion tubes: a method for the mass culture of ctenophores and other pelagic marine invertebrates. PeerJ. 8, 8938 (2020).
- Fenaux, R. The classification of Appendicularia (Tunicata): history and current state. Memoires de I'Institut oceanographique. , (1993).
- Shiga, N., Chihara, M., Murano, M. . Illustrated Guide to Marine Plankton in Japan. , 1393-1414 (1997).
- Gorsky, G., Castellani, C., Castellani, C., Edwards, M. . Marine Plankton: A practical guide to ecology, methodology, and taxonomy. , 599-606 (2017).
- Sato, R., Ishibashi, Y., Tanaka, Y., Ishimaru, T., Dagg, M. J. Productivity and grazing impact of Oikopleura dioica (Tunicata, Appendicularia) in Tokyo Bay. Journal of Plankton Research. 30 (3), 299-309 (2008).
- Nakamura, Y., Suzuki, K., Suzuki, S. Y., Hiromi, J. Production of Oikopleura dioica (Appendicularia) following a picoplankton 'bloom'in a eutrophic coastal area. Journal of Plankton Research. 19 (1), 113-124 (1997).
- Nakamura, Y. Blooms of tunicates Oikopleura spp. and Dolioletta gegenbauri in the Seto Inland Sea, Japan, during summer. Hydrobiologia. 385 (1-3), 183-192 (1998).
- Uye, S. I., Ichino, S. Seasonal variations in abundance, size composition, biomass and production rate of Oikopleura dioica (Fol)(Tunicata: Appendicularia) in a temperate eutrophic inlet. Journal of Experimental Marine Biology and Ecology. 189 (1-2), 1-11 (1995).
- Tsuchiya, K., et al. Phytoplankton community response and succession in relation to typhoon passages in the coastal waters of Japan. Journal of Plankton Research. 36 (2), 424-438 (2014).
- Lopez-Lopez, L., et al. Effects of typhoons on gelatinous carnivore zooplankton off Northern Taiwan. Cahiers de Biologie Marine. 53, 349-355 (2012).
- Ares, &. #. 1. 9. 3. ;., et al. Extreme storm-induced run-off causes rapid, context-dependent shifts in nearshore subtropical bacterial communities. bioRxiv. , (2019).
- Torres-Águila, N. P., et al. Diatom bloom-derived biotoxins cause aberrant development and gene expression in the appendicularian chordate Oikopleura dioica. Communications Biology. 1 (1), 1-11 (2018).
- Troedsson, C., Frischer, M. E., Nejstgaard, J. C., Thompson, E. M. Molecular quantification of differential ingestion and particle trapping rates by the appendicularian Oikopleura dioica as a function of prey size and shape. Limnology and Oceanography. 52 (1), 416-427 (2007).
- Ouchi, K., Nishino, A., Nishida, H. Simple procedure for sperm cryopreservation in the larvacean tunicate Oikopleura dioica. Zoological Science. 28 (1), 8-11 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon