A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
توليد الخلايا العصبية البشرية والخلايا قليلة التغصن من الخلايا الجذعية متعددة القدرات لنمذجة تفاعلات الخلايا العصبية قليلة التغصن
* These authors contributed equally
In This Article
Erratum Notice
Summary
التفاعلات العصبية الدبقية في التنكس العصبي ليست مفهومة جيدا بسبب عدم كفاية الأدوات والأساليب. هنا ، نصف البروتوكولات المثلى للحصول على الخلايا العصبية المستحثة ، وخلايا سلائف الخلايا قليلة التغصن ، والخلايا قليلة التغصن من الخلايا الجذعية البشرية متعددة القدرات ونقدم أمثلة على قيم هذه الطرق في فهم المساهمات الخاصة بنوع الخلية في مرض الزهايمر.
Abstract
في مرض الزهايمر (AD) والاضطرابات التنكسية العصبية الأخرى ، يعد الفشل الدبقي قليل التغصن سمة مرضية مبكرة شائعة ، ولكن كيف يساهم في تطور المرض وتطوره ، خاصة في المادة الرمادية للدماغ ، لا يزال غير معروف إلى حد كبير. يتميز الخلل الوظيفي لخلايا سلالة الخلايا قليلة التغصن بأوجه القصور في الميالين وضعف التجديد الذاتي لخلايا سلائف الخلايا قليلة التغصن (OPCs). يحدث هذان العيبان جزئيا على الأقل بسبب اضطراب التفاعلات بين الخلايا العصبية والخلايا قليلة التغصن على طول تراكم علم الأمراض. تؤدي OPCs إلى ظهور الخلايا قليلة التغصن الميالينية أثناء تطور الجهاز العصبي المركزي. في قشرة الدماغ الناضجة ، OPCs هي الخلايا التكاثرية الرئيسية (التي تضم ~ 5 ٪ من إجمالي خلايا الدماغ) وتتحكم في تكوين المايلين الجديد بطريقة تعتمد على النشاط العصبي. لم تتم دراسة مثل هذه الاتصالات من الخلايا العصبية إلى الخلايا العصبية قليلة التغصن بشكل كبير ، خاصة في سياق الحالات التنكسية العصبية مثل مرض الزهايمر ، بسبب نقص الأدوات المناسبة. في السنوات الأخيرة ، أحرزت مجموعتنا وغيرها تقدما كبيرا لتحسين البروتوكولات المتاحة حاليا لتوليد الخلايا العصبية الوظيفية والخلايا قليلة التغصن بشكل فردي من الخلايا الجذعية البشرية متعددة القدرات. في هذه المخطوطة ، نصف إجراءاتنا المحسنة ، بما في ذلك إنشاء نظام زراعة مشتركة لنمذجة اتصالات الخلايا العصبية قليلة التغصن. تشير نتائجنا التوضيحية إلى مساهمة غير متوقعة من OPCs / oligodendrocytes في الداء النشواني في الدماغ وسلامة المشبك العصبي وتسليط الضوء على فائدة هذه المنهجية لأبحاث مرض الزهايمر. هذا النهج الاختزالي هو أداة قوية لتشريح التفاعلات الخلوية غير المتجانسة المحددة من التعقيد المتأصل داخل الدماغ. من المتوقع أن تسهل البروتوكولات التي نصفها هنا الدراسات المستقبلية حول عيوب قلة التغصن في التسبب في التنكس العصبي.
Introduction
تشكل خلايا سلالة الخلايا قليلة التغصن - بما في ذلك خلايا سلائف الخلايا قليلة التغصن (OPCs) ، والخلايا قليلة التغصن الميالينية ، والأنواع الانتقالية بينهما - مجموعة رئيسية من خلايا الدماغ البشرية1 التي تشارك بنشاط في العديد من الوظائف الحيوية من أجل التشغيل السليم وصيانة نظامنا العصبي المركزي طوال التطور العصبي والشيخوخة2،3،4 . في حين أن oligodendrocytes معروفة جيدا بإنتاج المايلين لتسهيل انتقال النشاط العصبي ودعم الصحة المحورية في المادة البيضاء ، فإن OPCs وفيرة (~ 5٪) في المادة الرمادية حيث يكون الميالين نادرا وتؤدي وظائف إشارات تعتمد على النشاط للتحكم في سلوك التعلم وتكوين الذاكرة5،6،7،8 . كيف تعمل الخلايا الدبقية قليلة التغصن والخلل الوظيفي في التسبب في مرض الزهايمر (AD) وغيرها من الحالات التنكسية العصبية المرتبطة بالعمر لم تتم دراستها9. وتتمثل أوجه القصور في نظام نموذجي مناسب وأوجه القصور في المعارف العامة لتوجيه مسار تجريبي إلى الأمام في الأسباب الرئيسية لهذه الفجوة.
في ضوء أحدث الاختراقات في اشتقاق خلايا الدماغ البشري من الخلايا الجذعية متعددة القدرات بما في ذلك الخلايا الجذعية الجنينية (ES) والخلايا الجذعية المستحثة متعددة القدرات (iPS) ، ظهرت هذه النماذج الخلوية جنبا إلى جنب مع أدوات تحرير الجينات الحديثة كأدوات قوية للتعامل مع العلاقة المعقدة للتفاعلات الخلوية في الدماغ ، وهي قادرة على إظهار مظاهر المرض الخاصة بالإنسان10 ، 11. بالنظر إلى أن أنواع خلايا الدماغ الفردية يمكن أن تظهر تأثيرات مميزة وحتى متضاربة في مواجهة نفس الظروف المعززة لمرض الزهايمر12,13 ، فإن منهجية الخلايا الجذعية هذه تقدم بشكل فريد معلومات خاصة بنوع الخلية تم تفويتها سابقا باستخدام نماذج ثابتة في الجسم الحي أو في المختبر توفر فقط قراءات مجمعة من مجموعات من أنواع خلايا الدماغ. في العقد الماضي ، تم تطوير عدد كبير من البروتوكولات الموثوقة لتوليد الخلايا العصبية البشرية من التمايز العابر للخلايا الجذعية الجنينية / الجذعية المستحثة متعددة القدرات أو التحويل المباشر من أنواع الخلايا الأخرى المتمايزة نهائيا (مثل الخلايا الليفية)14,15. على وجه الخصوص ، يمكن أن يؤدي تطبيق عوامل النسخ العصبية الرئيسية (على سبيل المثال ، neurogenin 2 ، Ngn2)16 على الخلايا الجذعية البشرية متعددة القدرات إلى توليد مجموعة متجانسة من أنواع الخلايا العصبية المميزة جيدا للمزارع النقية دون الحاجة إلى التثاقف مع الخلايا الدبقية12،17،18. بالنسبة للخلايا قليلة التغصن البشرية المستحثة ، هناك عدد قليل من البروتوكولات المنشورة التي يمكن أن تولد خلايا وظيفية تشبه إلى حد كبير نظيراتها الأولية ، مع مجموعة واسعة من الكفاءة والطلب في الوقت والموارد19،20،21،22،23،24،25،26،27،28 . حتى الآن ، لم يتم تطبيق أي من هذه البروتوكولات للتحقيق في كيفية استجابة الخلايا قليلة التغصن وتأثيرها على التسبب في مرض الزهايمر.
هنا ، نصف بروتوكولاتنا المحسنة للثقافات الفردية والمختلطة للخلايا العصبية المستحثة البشرية (iNs) و OPCs / oligodendrocytes (iOPCs / iOLs). يعتمد بروتوكول iN الموصوف هنا على نهج Ngn216 المستخدم على نطاق واسع ، وله ميزة إضافية تتمثل في كونه خاليا من الدبقية. تكون iNs الناتجة متجانسة وتشبه إلى حد كبير الخلايا العصبية المثيرة للطبقة القشرية 2/3 ، مع مورفولوجيا هرمية مميزة ونمط التعبير الجيني وميزات فيزيولوجية كهربية17,18 (الشكل 1). للتغلب على بعض الحواجز الأساسية في التمايز الموجه للخلايا الجذعية متعددة القدرات ، قمنا بتطوير طريقة بسيطة وفعالة للمعالجة المسبقة لجرعة منخفضة من ثنائي ميثيل سلفوكسيد (DMSO)29،30 ، وأبلغنا عن ميل معزز لخلايا ES / iPS البشرية للانتقال إلى iOPCs و iOLs31 ، بناء على بروتوكول تم تكييفه على نطاق واسع بواسطة Douvaras و Fossati 32 . لقد قمنا بتبسيط البروتوكول بشكل أكبر ودمجنا مركبا قويا يعزز التمايز ، كليماستين7،33،34 ، لتسريع عملية النضج الدبقي قليل التغصن. نتيجة لذلك (الشكل 2) ، يمكن إنشاء iOPCs في أسبوعين (~ 95٪ إيجابي للعلامة O4) و iOLs في أربعة أسابيع (معبرا عن علامات ناضجة MBP و PLP1). ومن المثير للاهتمام ، وجدنا أن iOPCs وحدها تفرز كمية ملحوظة من β الأميلويد (Aβ) ، بما يتفق مع البيانات النسخية المستقلة التي تظهر التعبير الوفير لبروتين السلائف الأميلويد (APP) ومعالجة البروتياز β-secretase (BACE1) في خلايا سلالة الخلايا قليلة التغصن35,36. علاوة على ذلك ، يعزز نظام الاستزراع المشترك iN-iOPC الخاص بنا تغليف المحاور من خلال عمليات iOL الإيجابية MBP ويوفر دعما كبيرا لتشكيل المشبك العصبي (الشكل 3). وبالتالي ، فإن البروتوكولات التي قمنا بتفصيلها أدناه لها مزايا تقنية وبيولوجية على طرق الاستزراع المشترك للخلايا العصبية قليلة التغصن المفهرسة سابقا ، وتبشر بنمذجة أفضل للتنكس العصبي في مرض الزهايمر.
Protocol
1. تحريض الخلايا العصبية البشرية من الخلايا الجذعية البشرية متعددة القدرات
- تحضير فيروس العدس (~ 5 أيام ، بروتوكول مفصل كما هو موضح سابقا16)
- لوحة ~ 1 مليون خلية HEK293T كل قارورة T75 ، ليكون لها ~ 40 ٪ متقاربة عند إجراء transfection. قم بنقلها باستخدام البلازميدات التي تعبر عن Ngn2 المحرض بالتتراسيكلين والجين المقاوم للبوروميسين (PuroR ؛ تحت نفس سيطرة المروج TetO) ، rtTA والبلازميدات المساعدة الثلاثة pRSV-REV و pMDLg / pRRE و VSV-G (12 ميكروغرام من الحمض النووي للناقل الفيروسي العدسي و 6 ميكروغرام من كل من الحمض النووي البلازميد المساعد). تحضير ما لا يقل عن ثلاث قوارير لكل إعداد lentivirus. استخدم PEI للتحويل باتباع تعليمات الشركة المصنعة. قم بتغيير الوسائط بعد 16 ساعة وتجاهلها.
- أطلق الحصاد جزيئات فيروسية عن طريق جمع وسائط الاستزراع كل يوم واستبدالها بوسائط جديدة لمدة 3 أيام. تجمع الوسائط التي تم جمعها التي تحتوي على جزيئات فيروسية للتنقية. قم بتصفية الفيروس من خلال مرشح 0.22 ميكرومتر وأجهزة طرد مركزي بسرعة 49000 × جم لمدة 90 دقيقة. أعد تعليق الحبيبات بالحجم المناسب من جلوكوز PBS (~ 150 ميكرولتر).
- تحريض الخلايا العصبية (~ 5 أيام)
ملاحظة: هذا البروتوكول التعريفي (الشكل 1 أ ؛ مخطط التدفق) فعال للغاية لكل من خلايا iPS و ES من تعدد القدرات الذي تم التحقق من صحته (والذي يمكن فحصه عن طريق تلطيخ الكيمياء الهيستولوجية المناعية لعلامات تعدد القدرات المميزة جيدا ؛ الشكل 1 ب).- استخدم الخلايا الجذعية الجنينية البشرية H1 المتاحة تجاريا عند مرور 52 (انظر جدول المواد). قم بزراعة الخلايا على ألواح 6 آبار مغلفة بمحلول مصفوفة خارج الخلية (~ 0.5 مجم من محلول المصفوفة لكل لوحة ذات 6 آبار ؛ انظر جدول المواد) باستخدام وسيط صيانة الخلايا الجذعية الجنينية (انظر جدول المواد) واحتضان الألواح عند 37 درجة مئوية مع 5٪ CO2.
- في اليوم -2 ، افصل الخلايا الجذعية الجنينية (80٪ متقاربة) ب 1 مل من محلول انفصال الخلية (انظر جدول المواد) واحتضانها في درجة حرارة الغرفة لمدة 10 دقائق. نقل الخلايا إلى أنبوب ؛ اغسل البئر ب 2 مل من الوسائط وادمجها في نفس الأنبوب. جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق ، وأعد تعليق الحبيبات في الوسائط ، وقم بطلاء الخلايا على ألواح 6 آبار مغلفة بالمصفوفة بكثافة بذر 1 × 105 خلايا لكل بئر.
- في اليوم -1 ، أضف الفيروسات العدسية التي تعبر عن Ngn2 بالإضافة إلى PuroR و rtTA مع البوليبرين (8 ميكروغرام / مل) إلى الخلايا الجذعية الجنينية في وسط صيانة الخلايا الجذعية الجنينية الجديد (انظر جدول المواد). يجب تحديد الكمية الدقيقة للفيروسات بواسطة التتر الفعلي أو المعايرة. نضيف عادة 5 ميكرولتر لكل فيروس لكل بئر في لوحة من 6 آبار.
- في اليوم 0 ، أضف الدوكسيسيكلين (2 ميكروغرام / مل ، لتنشيط تعبير Ngn2) في وسط DMEM-F12 مع مكمل N2 بدون مورفوجينات.
- في اليوم الأول ، أضف Puromycin في وسط جديد من DMEM-F12 plus N2 والدوكسيسيكلين ، إلى التركيز النهائي لوسط 1 ميكروغرام / مل. حدد الخلايا المحولة في Puromycin لمدة 24 ساعة على الأقل. قد تكون هناك حاجة إلى تركيز أعلى من Puromycin (يصل إلى 5 ميكروغرام / مل) وفترة اختيار أطول (تصل إلى 48 ساعة) لإزالة الخلايا غير المحولة بشكل كاف إذا كان عيار الفيروس منخفضا.
- في اليوم 2 ، افصل الخلايا العصبية المتمايزة بمحلول انفصال الخلية (انظر جدول المواد) ، وأعد طلاءها على 24 لوحة بئر (بين 80000-200000 خلية / بئر) مطلية بمحلول مصفوفة (انظر جدول المواد) ، واحتفظ بها في وسط NBA / B27 بدون دوكسيسيكلين. كثافة البذر أمر بالغ الأهمية.
- في هذه المرحلة ، يمكن تجميد الخلايا العصبية المنفصلة في وسط تجميد تجاري متخصص (انظر جدول المواد) وتخزينها في النيتروجين السائل لمدة تصل إلى 3 أشهر. يمكن طلاء الخلايا العصبية النقية بحساب موت الخلايا النموذجي ~ 15٪ -20٪ بعد ذوبان الجليد ، أو زراعتها بمفردها أو استزراعها مع أنواع خلايا الدماغ الأخرى (انظر الخطوة 3.2.3. للزراعة المشتركة مع OPCs).
- زراعة iNs نقية على الألواح المطلية بحلول قائمة على المصفوفة خارج الخلية وفقا لتعليمات الشركة المصنعة (انظر جدول المواد). يجب أن يكون التشكل الهرمي المميز واضحا بحلول اليوم 4 (واليوم 6 ؛ الشكل 1 ج). يمكن اكتشاف تكوين المشبك في وقت مبكر من اليوم 14 إلى 16 وهو بارز في اليوم 24 عن طريق التلوين الكيميائي المناعي بعلامات قياسية قبل وبعد المشبكي. (الشكل 1D ؛ المسمى بعلامة ما قبل المشبكي Synapsin 1 والعلامة المتغصنة Map2).
2. تحريض الخلايا السليفة قليلة التغصن البشرية (OPCs) من الخلايا الجذعية متعددة القدرات ونضوج الخلايا قليلة التغصن
- توليد الخلايا السلفية العصبية (NPC): بروتوكول أحادي الطبقة (~ 7 أيام). انظر الشكل 2 أ للحصول على مخطط التدفق.
- زراعة الخلايا الجذعية الجنينية البشرية H1 كما هو موضح سابقا (انظر الخطوة 1.2.1.) وتحويلها إلى خلايا سلفية عصبية (NPCs) من خلال نهج راسخ يسمى SMADi المزدوج ، مع مثبطات جزيء صغيرة لمسارات إشارات متعددة. هنا نستخدم مجموعة تجارية مقبولة على نطاق واسع ونتبع بروتوكول أحادي الطبقة الذي توفره الشركة المصنعة (انظر جدول المواد).
- في اليوم -1 ، لوحة 0.5-1 × 106 خلايا لكل بئر في لوحة 6 آبار مغلفة بمحلول مصفوفة عامل نمو مختزل (انظر جدول المواد ؛ ~ 0.5 ملغ من محلول المصفوفة لكل لوحة 6 آبار) مع وسيط صيانة خلية ES (انظر جدول المواد). يستخدم محلول المصفوفة المختزل لعامل النمو هذا لطلاء جميع الألواح التي سيتم استخدامها في الخطوات التالية.
- في اليوم 0 ، عالج الخلايا لمدة 24 ساعة باستخدام وسيط صيانة الخلايا الجذعية الجنينية (انظر جدول المواد) مع 2٪ DMSO.
- في اليوم 1-6 ، قم بتغيير الوسائط الكاملة باستخدام وسط تحريض عصبي دافئ (37 درجة مئوية) يحتوي على مثبطات SMAD من المجموعة التجارية (انظر جدول المواد). إذا انقسمت الخلايا ووصلت إلى نقطة التقاء قبل اليوم السابع ، فقم بتمريرها إلى كثافة البذر من 0.5-1 × 106 ، كما هو موضح سابقا في الخطوة 2.1.2.
- في اليوم السابع ، تمر NPCs باستخدام محلول انفصال الخلية (انظر جدول المواد) ولوحة بكثافة بذر 1-2 × 105 خلايا / بئر من لوحة 24 بئر.
- فحص كفاءة التمايز عن طريق تلطيخ الكيمياء المناعية (IHC) لعدم وجود علامة متعددة القدرات ، OCT4 على سبيل المثال ، ووجود علامات NPC مثل PAX6 و Nestin و Sox1.
- في هذه المرحلة ، يمكن تجميد NPCs المنفصلة في وسائط تجميد NPC التجارية المتخصصة (انظر جدول المواد) وتخزينها في النيتروجين السائل لمدة تصل إلى 3 أشهر. بعد التجميد والذوبان لمرة واحدة ، لا تزال الشخصيات غير القابلة للعب تحتفظ بالقدرة المتعددة لتؤدي إلى ظهور الخلايا العصبية والخلايا النجمية و OPCs ذات البروتوكولات الموثوقة.
- جيل خلية السلائف قليلة التغصن (OPC) (~ 7 أيام). يرجى الاطلاع على الشكل 2 أ للحصول على مخطط التدفق.
- في اليوم السابع ، قم بمرور NPCs باستخدام محلول انفصال الخلية (انظر جدول المواد) وقم بطلائها بكثافة بذر 1-2 × 105 خلايا لكل بئر في صفيحة مكونة من 24 بئرا في وسط تحريض عصبي دافئ (37 درجة مئوية) بالإضافة إلى مثبطات SMAD من المجموعة التجارية (انظر جدول المواد).
- في اليوم 8 ، قم بإعداد محلول 1٪ DMSO في وسط تمايز OPC ومعالجة NPCs المطلية لمدة 24 ساعة. يتكون وسط التمايز OPC من: وسط DMEM / F12 ، ملحق N2 1٪ ، مكمل B27 1٪ ، bFGF عند 20 نانوغرام / مل ، SAG عند 1 ميكرومتر ، PDGF-AA عند 10 نانوغرام / مل (انظر جدول المواد).
- في اليوم 9 ، استبدل الوسائط بوسيط تمايز OPC جديد بدون DMSO. قم بإطعام الخلايا كل يوم حتى اليوم 15. إذا وصلت الخلايا إلى التقاء قبل اليوم 15 ، فقم بتمريرها إلى كثافة البذر من 1-2 × 105 خلايا لكل بئر كما هو موضح في الخطوة 2.2.1.
- في اليوم 14 ، لوحة OPCs في وسط تمايز OPC بكثافة 1-2 × 105 خلايا / بئر في لوحة 24 بئر.
- في هذه المرحلة (اليوم 15) ، خلايا الاختبار لوجود علامات خاصة ب OPC بواسطة تلطيخ IHC أو qPCR (على سبيل المثال ، O4 ، Olig1 / 2 ، CSPG4 / Ng2 ، NKX2.2 ، PDGFRa ؛ الشكل 2 ب) ولغياب علامات NPC (Pax6 أو Nestin ؛ الشكل 2 د). عادة ما نكتشف النشاط المناعي O4 في أكثر من 95٪ من الخلايا في اليوم 15. ذات صلة خاصة بمرض الزهايمر ، فإن التعبير عن APP (بروتين السلائف الأميلويد) ، BACE1 (بروتياز المعالجة β-secreatase 1) ، والببتيد أميلويد β (Aβ) وفير في OPCs (الشكل 2F).
- نضوج الخلايا قليلة التغصن (OL) (~ 7-20 يوما)
- في اليوم 15 ، استبدل الوسائط بوسط نضج OL: وسط Neurobasal-A ، ومكمل B27 2٪ ، و 1 ميكرومتر cAMP ، و 200 ng / mL T3 ثلاثي يودوثيرونين ، وكليماستين من 1 ميكرومتر (انظر جدول المواد). قم بتغيير الوسيط كل يوم أو كل يوم ، إذا لزم الأمر.
- عندما تصل الخلايا إلى 90٪ من التقاء ، تنقسم بنسبة 1: 3 حتى مقطعين أو حتى يتباطأ انقسام الخلايا بشكل كبير. إذا انقسمت OPCs بسرعة كبيرة ووصلت إلى نقطة التقاء في أقل من 3 أيام ، أضف Ara-C (انظر جدول المواد) بتركيز 2-5 ميكرومتر لمدة 1-3 أيام. يشير الانتشار النشط إلى انخفاض كفاءة النضج.
- افحص كفاءة النضج الدبقي قليل التغصن من خلال تقييم التعبير عن علامات OL ، على سبيل المثال ، CLDN11 أو PLP1 أو MBP بواسطة qPCR أو تلطيخ IHC أو النشاف المناعي. يجب اكتشاف التشكل المميز للهياكل شديدة التعقيد (الشكل 2C) والتعبير عن علامات OL (الشكل 2E) بسهولة بحلول اليوم 28.
3. الزراعة المشتركة للخلايا العصبية المستحثة البشرية (iNs) وخلايا سلائف الخلايا قليلة التغصن (iOPCs)
- طلاء iOPC (~ 3 أيام)
- لوحة iOPCs في اليوم 14 بكثافة 1 × 105 خلايا لكل بئر في لوحة 24 بئر (كما هو موضح أعلاه في الخطوة 2.2.4.) في وسط تمايز OPC (كما هو موضح في الخطوة 2.2.2.).
- إعداد الثقافة المشتركة iN-iOPC
- في اليوم 15 ، افصل الخلايا العصبية البشرية المستحثة في خطوة اليوم الثاني بعد اختيار Puromycin (كما هو موضح في الخطوة 1.2.6.) بمحلول انفصال الخلية (انظر جدول المواد).
- أضف الخلايا العصبية إلى OPCs المستزرعة ، وقم بالطلاء بكثافة البذر 2 × 105 خلايا لكل بئر في لوحة 24 بئرا مع OPCs المتنامية (من الخطوة 3.1.1). استخدم وسط الاستزراع المشترك الذي يحتوي على وسط Neurobasal-A ، ومكمل B27 2٪ ، و 100 نانوغرام / مل T3 ثلاثي يودوثيرونين. قم بتغيير الوسيط في اليوم التالي ثم كل يومين بعد ذلك. إذا تكاثرت OPCs بسرعة كبيرة ووصلت إلى نقطة التقاء في أقل من 3 أيام ، أضف Ara-C بتركيز 2-5 ميكرومتر. يوضح الشكل 3 أ صورة تمثيلية ل iNs و iOPCs المزروعة في الثقافة المشتركة بعد 7 أيام من الخلايا العصبية.
- استخدم الخلايا العصبية المجمدة المحضرة كما هو موضح أعلاه في الخطوة 1.2.7 للزراعة المشتركة مع OPCs. الخلايا العصبية تجميد وذوبان لوحة في كثافة أعلى من 3 × 105 خلايا لكل بئر.
- بعد اليوم 14-16 في الثقافات المشتركة ، يمكن ملاحظة تكوين المشبك في iNs عن طريق تلطيخ IHC لعلامات ما قبل وبعد المشبكي ، وبحلول اليوم 21 يجب أن تكون النقاط المشبكية وفيرة (الشكل 3C) ويمكن تسجيل الأنشطة العصبية بشكل موثوق.
- بدءا من اليوم 21 ، اختبر الخلايا بحثا عن علامات OL المحددة (على سبيل المثال ، MBP و PLP1). بحلول اليوم 28 ، نلاحظ عادة ظاهرة تغليف محاور iN بواسطة عمليات iOL ، والتي تم تسميتها بواسطة تلطيخ IHC لعلامات محددة (الشكل 3B ؛ NF للخيوط العصبية لمحاور iN و MBP لعمليات iOPC).
النتائج
التوليد المباشر للخلايا العصبية التي يسببها الإنسان من الخلايا الجذعية البشرية متعددة القدرات
من المهم جدا أن تظهر الخلايا الجذعية البشرية متعددة القدرات درجة عالية من تعدد القدرات للتوليد الناجح ل iNs أو iOPCs / iOLs. لذلك ، يجب تلطيخ الخلايا لعلامات محددة ، مثل Oct4 و SOX2 ، قبل البدء ف?...
Discussion
بالإضافة إلى الدعم الجسدي والأيضي لتحقيق الاستقرار في هياكل المشبك وتسهيل توصيل الإشارة الملحية عن طريق الميالين ، يمكن لخلايا سلالة oligodendrocyte تشكيل نمط النشاط العصبي عبر محادثات متقاطعة سريعة وديناميكية مع الخلايا العصبية5،6،7. بينما في...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من خلال المنح المقدمة من المعاهد الوطنية للصحة (R00 AG054616 إلى YAH و T32 GM136566 إلى KC) ، وكلية الطب بجامعة ستانفورد وزمالة Siebel (الممنوحة ل SC). Y.A.H. هو أستاذ متعدية في GFL من مركز علم الأعصاب الانتقالي في معهد براون للعلوم الانتقالية.
Materials
| Name | Company | Catalog Number | Comments |
| Accutase | STEMCELL Technologies | 7920 | |
| B27 supplement | ThermoFisher | 17504044 | |
| bFGF | ThermoFisher | PHG 0266 | |
| cAMP | MilliporeSigma | A9501 | |
| Clemastine | MilliporeSigma | SML0445 | |
| DMEM/F12 medium | STEMCELL Technologies | 36254 | |
| DMSO | ThermoFisher | D12345 | |
| Doxycycline | MilliporeSigma | D3072 | |
| Fetal Bovine Serum | ScienCell | 10 | |
| H1 human ES cells | WiCell | WA01 | |
| Matrigel | Corning | 354234 | |
| mTeSR plus | STEMCELL Technologies | 5825 | |
| N2 supplement | ThermoFisher | 17502001 | |
| Neurobasal A medium | ThermoFisher | 10888-022 | |
| Non Essential Amino Acids | ThermoFisher | 11140-050 | |
| PDGF-AA | R&D Systems | 221-AA-010 | |
| PEI | VWR | 71002-812 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polybrene | MilliporeSigma | TR-1003-G | |
| pRSV-REV | Addgene | 12253 | |
| Puromycin | ThermoFisher | A1113803 | |
| ROCK Inhibitor Y-27632 | STEMCELL Technologies | 72302 | |
| SAG | Tocris | 4366 | |
| STEMdiff Neural Progenitor Freezing Media | STEMCELL Technologies | 5838 | |
| STEMdiff SMADi Neural Induction Kit | STEMCELL Technologies | 8581 | |
| T3 triiodothyronine | MilliporeSigma | T6397 | |
| Tempo-iOlogo: Human iPSC-derived OPCs | Tempo BioScience | SKU102 | |
| TetO-Ng2-Puro | Addgene | 52047 | |
| VSV-G | Addgene | 12259 |
References
- Pelvig, D. P., Pakkenberg, H., Stark, A. K., Pakkenberg, B. Neocortical glial cell numbers in human brains. Neurobiology of Aging. 29 (11), 1754-1762 (2008).
- Barres, B. A. The mystery and magic of glia: a perspective on their roles in health and disease. Neuron. 60 (3), 430-440 (2008).
- De Strooper, B., Karran, E. The cellular phase of Alzheimer's disease. Cell. 164 (4), 603-615 (2016).
- Monje, M. Myelin plasticity and nervous system function. Annual Review of Neuroscience. 41, 61-76 (2018).
- Hughes, E. G., Orthmann-Murphy, J. L., Langseth, A. J., Bergles, D. E. Myelin remodeling through experience-dependent oligodendrogenesis in the adult somatosensory cortex. Nature Neuroscience. 21 (5), 696-706 (2018).
- Gibson, E. M., et al. Neuronal activity promotes oligodendrogenesis and adaptive myelination in the mammalian brain. Science. 344 (6183), 1252304 (2014).
- Pan, S., Mayoral, S. R., Choi, H. S., Chan, J. R., Kheirbek, M. A. Preservation of a remote fear memory requires new myelin formation. Nature Neuroscience. 23 (4), 487-499 (2020).
- Thornton, M. A., Hughes, E. G. Neuron-oligodendroglia interactions: Activity-dependent regulation of cellular signaling. Neuroscience Letters. 727, 134916 (2020).
- Ettle, B., Schlachetzki, J. C. M., Winkler, J. Oligodendroglia and myelin in neurodegenerative diseases: more than just bystanders. Molecular Neurobiology. 53 (5), 3046-3062 (2016).
- Essayan-Perez, S., Zhou, B., Nabet, A. M., Wernig, M., Huang, Y. A. Modeling Alzheimer's disease with human iPS cells: advancements, lessons, and applications. Neurobiology of Disease. 130, 104503 (2019).
- Li, L., et al. GFAP mutations in astrocytes impair oligodendrocyte progenitor proliferation and myelination in an hiPSC model of Alexander disease. Cell Stem Cell. 23 (2), 239-251 (2018).
- Lin, Y. T., et al. APOE4 causes widespread molecular and cellular alterations associated with Alzheimer's disease phenotypes in human iPSC-derived brain cell types. Neuron. 98 (6), 1294 (2018).
- TCW, J., et al. Cholesterol and matrisome pathways dysregulated in human APOE ε4 glia. bioRxiv. , (2019).
- Ang, C. E., Wernig, M. Induced neuronal reprogramming. Journal of Comparitive Neurology. 522 (12), 2877-2886 (2014).
- Penney, J., Ralvenius, W. T., Tsai, L. H. Modeling Alzheimer's disease with iPSC-derived brain cells. Molecular Psychiatry. 25 (1), 148-167 (2020).
- Zhang, Y., et al. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 78 (5), 785-798 (2013).
- Huang, Y. A., Zhou, B., Nabet, A. M., Wernig, M., Sudhof, T. C. Differential signaling mediated by ApoE2, ApoE3, and ApoE4 in human neurons parallels Alzheimer's Disease risk. Journal of Neuroscience. 39 (37), 7408-7427 (2019).
- Huang, Y. A., Zhou, B., Wernig, M., Sudhof, T. C. ApoE2, ApoE3, and ApoE4 Differentially Stimulate APP Transcription and Abeta Secretion. Cell. 168 (3), 427-441 (2017).
- Yang, N., et al. Generation of oligodendroglial cells by direct lineage conversion. Nature Biotechnology. 31 (5), 434-439 (2013).
- Douvaras, P., et al. Efficient generation of myelinating oligodendrocytes from primary progressive multiple sclerosis patients by induced pluripotent stem cells. Stem Cell Reports. 3 (2), 250-259 (2014).
- Lee, E. H., Park, C. H. Comparison of reprogramming methods for generation of induced-oligodendrocyte precursor cells. Biomolecules & Therapeutics (Seoul). 25 (4), 362-366 (2017).
- Ehrlich, M., et al. Rapid and efficient generation of oligodendrocytes from human induced pluripotent stem cells using transcription factors. Proceedings of the National Academy of Sciences of the United States of America. 114 (11), 2243-2252 (2017).
- Rodrigues, G. M. C., et al. Defined and scalable differentiation of human oligodendrocyte precursors from pluripotent stem cells in a 3D culture system. Stem Cell Reports. 8 (6), 1770-1783 (2017).
- Hu, B. Y., Du, Z. W., Li, X. J., Ayala, M., Zhang, S. C. Human oligodendrocytes from embryonic stem cells: conserved SHH signaling networks and divergent FGF effects. Development. 136 (9), 1443-1452 (2009).
- Izrael, M., et al. Human oligodendrocytes derived from embryonic stem cells: Effect of noggin on phenotypic differentiation in vitro and on myelination in vivo. Molecular and Cellular Neuroscience. 34 (3), 310-323 (2007).
- Yamashita, T., et al. Differentiation of oligodendrocyte progenitor cells from dissociated monolayer and feeder-free cultured pluripotent stem cells. PLoS One. 12 (2), 0171947 (2017).
- Wang, S., et al. Human iPSC-derived oligodendrocyte progenitor cells can myelinate and rescue a mouse model of congenital hypomyelination. Cell Stem Cell. 12 (2), 252-264 (2013).
- Chanoumidou, K., Mozafari, S., Baron-Van Evercooren, A., Kuhlmann, T. Stem cell derived oligodendrocytes to study myelin diseases. Glia. 68 (4), 705-720 (2020).
- Chetty, S., et al. A simple tool to improve pluripotent stem cell differentiation. Nature Methods. 10 (6), 553-556 (2013).
- Li, J., et al. A transient DMSO treatment increases the differentiation potential of human pluripotent stem cells through the Rb family. PLoS One. 13 (12), 0208110 (2018).
- Sambo, D., Li, J., Brickler, T., Chetty, S. Transient treatment of human pluripotent stem cells with DMSO to promote differentiation. Journal of Visualized Experiments: JoVE. (149), (2019).
- Douvaras, P., Fossati, V. Generation and isolation of oligodendrocyte progenitor cells from human pluripotent stem cells. Nature Protocols. 10 (8), 1143-1154 (2015).
- Mei, F., et al. Micropillar arrays as a high-throughput screening platform for therapeutics in multiple sclerosis. Nature Medicine. 20 (8), 954-960 (2014).
- Madhavan, M., et al. Induction of myelinating oligodendrocytes in human cortical spheroids. Nature Methods. 15 (9), 700-706 (2018).
- Zhang, Y., et al. Purification and characterization of progenitor and mature human astrocytes reveals transcriptional and functional differences with mouse. Neuron. 89 (1), 37-53 (2016).
- Grubman, A., et al. A single-cell atlas of entorhinal cortex from individuals with Alzheimer's disease reveals cell-type-specific gene expression regulation. Nature Neuroscience. 22 (12), 2087-2097 (2019).
- Goldman, S. A., Kuypers, N. J. How to make an oligodendrocyte. Development. 142 (23), 3983-3995 (2015).
- Behrendt, G., et al. Dynamic changes in myelin aberrations and oligodendrocyte generation in chronic amyloidosis in mice and men. Glia. 61 (2), 273-286 (2013).
- Patzke, C., et al. Neuromodulator signaling bidirectionally controls vesicle numbers in human synapses. Cell. 179 (2), 498-513 (2019).
- Piao, J., et al. Human embryonic stem cell-derived oligodendrocyte progenitors remyelinate the brain and rescue behavioral deficits following radiation. Cell Stem Cell. 16 (2), 198-210 (2015).
- Keirstead, H. S., et al. Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury. Journal of Neuroscience. 25 (19), 4694-4705 (2005).
- Kim, D. S., et al. Rapid generation of OPC-like cells from human pluripotent stem cells for treating spinal cord injury. Experimental & Molecular Medicine. 49 (7), 361 (2017).
Erratum
Formal Correction: Erratum: Generation of Human Neurons and Oligodendrocytes from Pluripotent Stem Cells for Modeling Neuron-Oligodendrocyte Interactions
Posted by JoVE Editors on 12/29/2020. Citeable Link.
An erratum was issued for: Generation of Human Neurons and Oligodendrocytes from Pluripotent Stem Cells for Modeling Neuron-Oligodendrocyte Interactions. The Representative Results section has been updated.
Figure 3 was updated from:
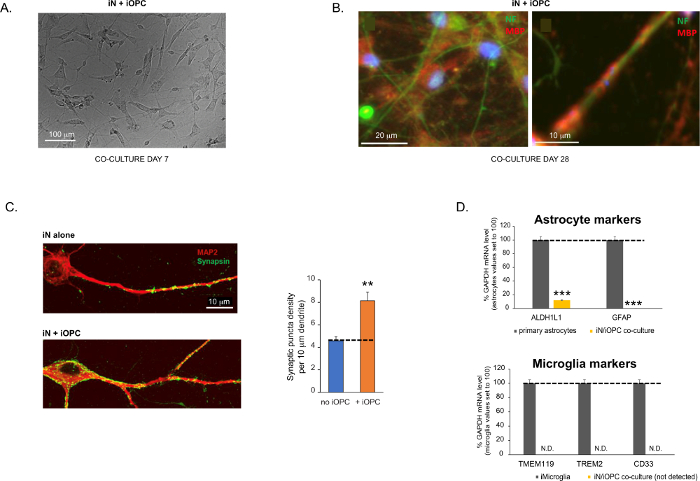
Figure 3: Co-culture of iNs and iOPCs. (A) Representative bright field image of co-cultured iNs and iOPCs at Day 7, showing a proper density for further maturation. (B) Representative immunofluorescence image of iNs and iOPCs co-cultured for 28 days. Axonal marker neurofilament NF is shown in green and oligodendrocytic marker MBP in red. Right, a segment of iN axon ensheathed by iOL process (MBP+). (C) Synapse formation assayed in 4-week-old co-cultures. Cells were stained for Synapsin 1 (Syn1, green) and MAP2 (red), and synaptic puncta were quantified by confocal analysis of density along the dendritic segments as described17,18. (D) In our co-cultures of iNs and iOPCs (7 days of co-culturing), the expression of astrocyte markers, ALDHL1 and GFAP, is minimal (top), and the expression of microglia markers, TMEM119, TREM2, and CD33, is not detected (N.D.) by qPCR. The contamination from these two glial cell types is thus excluded. Please click here to view a larger version of this figure.
to:
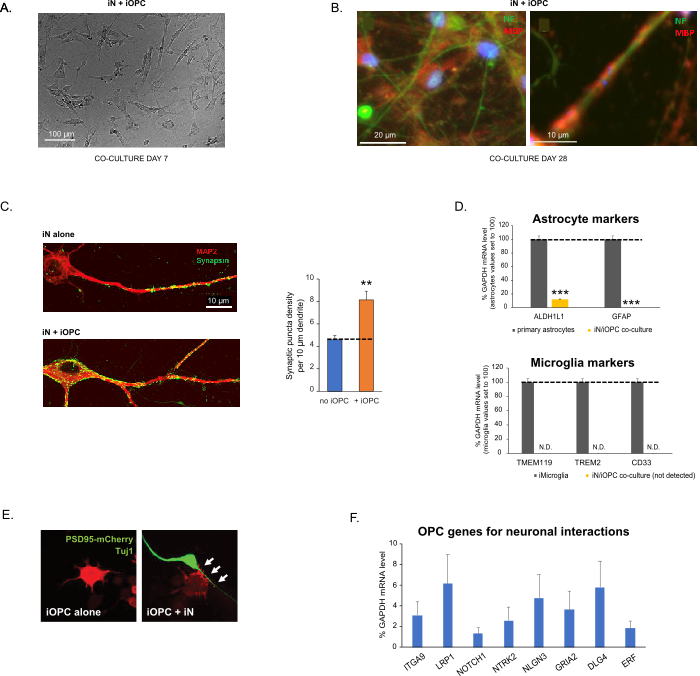
Figure 3: Co-culture of iNs and iOPCs. (A) Representative bright field image of co-cultured iNs and iOPCs at Day 7, showing a proper density for further maturation. (B) Representative immunofluorescence image of iNs and iOPCs co-cultured for 28 days. Axonal marker neurofilament NF is shown in green and oligodendrocytic marker MBP in red. Right, a segment of iN axon ensheathed by iOL process (MBP+). (C) Synapse formation assayed in 4-week-old co-cultures. Cells were stained for Synapsin 1 (Syn1, green) and MAP2 (red), and synaptic puncta were quantified by confocal analysis of density along the dendritic segments as described17,18. (D) In our co-cultures of iNs and iOPCs (7 days of co-culturing), the expression of astrocyte markers, ALDHL1 and GFAP, is minimal (top), and the expression of microglia markers, TMEM119, TREM2, and CD33, is not detected (N.D.) by qPCR. The contamination from these two glial cell types is thus excluded. (E) Coculturing iOPC with iN leads to the formation of neuron-OPC synapses. The fluorescence-tagged post-synaptic marker PSD95-mCherry is expressed only in OPCs, and display a diffuse pattern in single cultures (left) but aggregate to form puncta in cocultures (right, indicated by arrows; Tuj1, neuronal marker). (F) The expression of well-characterized oligodendroglial genes that can sense and respond to neuronal activities in the pure cultures of iOPCs at Day 14. Please click here to view a larger version of this figure.
The fourth paragraph was updated from:
Co-culturing of iNs and iOPCs
This protocol is optimized specifically for co-culturing iNs and iOPCs and allow our real-time monitoring of the inter-cellular communications between these two cell types along the course of neural development. The ideal plating densities for both cell types need to be decided with a series of cell number titration to achieve proper differentiation (Figure 3A). After 4 weeks in co-cultures, the iOPCs are expected to be adequately differentiated into OLs that are positive for specific markers such as MBP and extend processes to ensheath axons (Figure 3B). The co-culture system can robustly boost up the number of synapses, indicating that the iOPCs provide a neuronal support through physical contacts or release of trophic factors (Figure 3C). We can maintain the co-cultures in acceptable health condition for up to 6 weeks and observe that the synapse number and other neuronal attributes plateau around the fifth week. Of note, astrocytes and microglia are not present in our preparations and their absence can be documented by checking the expression of specific markers (Figure 3D).
to:
Co-culturing of iNs and iOPCs
This protocol is optimized specifically for co-culturing iNs and iOPCs and allow our real-time monitoring of the inter-cellular communications between these two cell types along the course of neural development. The ideal plating densities for both cell types need to be decided with a series of cell number titration to achieve proper differentiation (Figure 3A). After 4 weeks in co-cultures, the iOPCs are expected to be adequately differentiated into OLs that are positive for specific markers such as MBP and extend processes to ensheath axons (Figure 3B). The co-culture system can robustly boost up the number of synapses, indicating that the iOPCs provide a neuronal support through physical contacts or release of trophic factors (Figure 3C). We can maintain the co-cultures in acceptable health condition for up to 6 weeks and observe that the synapse number and other neuronal attributes plateau around the fifth week. Of note, astrocytes and microglia are not present in our preparations and their absence can be documented by checking the expression of specific markers (Figure 3D). The iOPCs express a good number of well-characterized genes that can potentially respond to and mediate the activity-dependent signals from neighboring neurons, in a paracrine (e.g. neurotrophins and metabolites) and/or a synaptic manner (Figure 3E and 3F).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved