JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
뉴런-희소돌기아교세포 상호작용 모델링을 위한 만능줄기세포로부터 인간 뉴런 및 희소돌기아교세포 생성
* 이 저자들은 동등하게 기여했습니다
Erratum Notice
요약
신경 퇴행의 뉴런-아교 세포 상호 작용은 부적절한 도구와 방법으로 인해 잘 이해되지 않습니다. 여기에서는 인간 만능 줄기 세포에서 유도 뉴런, 희소돌기아교세포 전구세포 및 희소돌기아교세포를 얻기 위한 최적화된 프로토콜을 설명하고 알츠하이머병에서 세포 유형 특이적 기여를 이해하는 데 있어 이러한 방법의 가치에 대한 예를 제공합니다.
초록
알츠하이머 병 (AD) 및 기타 신경 퇴행성 질환에서 희소 돌기 부전은 일반적인 초기 병리학 적 특징이지만 특히 뇌의 회백질에서 질병 발달 및 진행에 어떻게 기여하는지는 거의 알려지지 않았습니다. 희소돌기아교세포 계통 세포의 기능 장애는 희소돌기아교세포 전구체 세포(OPC)의 수초화 결핍 및 자가 재생 장애로 특징지어집니다. 이 두 가지 결함은 병리학의 축적을 따라 뉴런과 희소돌기아교세포 사이의 상호 작용이 중단되어 적어도 부분적으로 발생합니다. OPC는 CNS 발달 동안 수초 희소돌기아교세포를 생성합니다. 성숙한 뇌 피질에서 OPC는 주요 증식 세포 (전체 뇌 세포의 ~ 5 %를 구성)이며 신경 활동 의존적 방식으로 새로운 미엘린 형성을 제어합니다. 이러한 뉴런-희소돌기아교세포 통신은 적절한 도구의 부족으로 인해 특히 AD와 같은 신경퇴행성 상태의 맥락에서 상당히 과소 연구되고 있습니다. 최근 몇 년 동안 우리 그룹과 다른 사람들은 인간 만능 줄기 세포에서 개별적으로 기능성 뉴런과 희소돌기아교세포를 생성하기 위해 현재 사용 가능한 프로토콜을 개선하기 위해 상당한 진전을 이루었습니다. 이 원고에서는 뉴런-희소돌기아교세포 연결을 모델링하기 위한 공동 배양 시스템의 구축을 포함하여 최적화된 절차에 대해 설명합니다. 우리의 예시적인 결과는 뇌 아밀로이드증 및 시냅스 무결성에 대한 OPC/희소돌기아교세포의 예상치 못한 기여를 시사하고 AD 연구를 위한 이 방법론의 유용성을 강조합니다. 이 환원 주의적 접근법은 뇌 내부의 고유 한 복잡성에서 특정 이종 세포 상호 작용을 해부하는 강력한 도구입니다. 여기에서 설명하는 프로토콜은 신경 퇴행의 발병 기전에서 희소돌기전 결함에 대한 향후 연구를 용이하게 할 것으로 예상됩니다.
서문
희소돌기아교세포 전구세포(OPC), 수초 희소돌기아교세포 및 그 사이의 전이 유형을 포함한 희소돌기아교세포 계통 세포는 신경 발달 및 노화 전반에 걸쳐 중추신경계의 적절한 작동 및 유지를 위한 많은 중요한 기능에 적극적으로 참여하는 인간 뇌 세포1의 주요 그룹을 구성합니다.2,3,4 . 희소돌기아교세포는 백질에서 신경 활동 전달을 촉진하고 축삭 건강을 지원하기 위해 미엘린을 생성하는 것으로 잘 알려져 있지만, OPC는 수초화가 부족한 회백질에 풍부하고(~5%) 학습 행동 및 기억 형성을 제어하는 활동 의존적 신호 기능을 수행합니다. 5,6,7,8 . 알츠하이머병(AD) 및 기타 연령 관련 신경퇴행성 질환의 발병기전에서 희소돌기아세포 기능 및 기능 장애가 어떻게 연구되었는지는 연구되지 않았습니다9. 적절한 모델 시스템의 부적절 함과 실험 경로를 안내하는 일반 지식의 부족이 이러한 격차의 주요 원인입니다.
배아 줄기 (ES) 및 유도 만능 줄기 (iPS) 세포를 포함한 만능 줄기 세포로부터 인간 뇌 세포를 유도하는 최근의 돌파구에 비추어 볼 때, 현대 유전자 편집 도구와 결합 된 이러한 세포 모델은 뇌에서 세포 상호 작용의 복잡한 연결을 처리하는 강력한 도구로 등장했으며 인간 특이 적 질병 증상을 입증 할 수 있습니다10, 11. 개별 뇌 세포 유형이 동일한 AD 촉진 조건12,13에 직면하여 뚜렷하고 심지어 상충되는 효과를 나타낼 수 있다는 점을 고려할 때,이 줄기 세포 방법론은 뇌 세포 유형 모음에서 집계 판독 값만을 제공하는 확립 된 생체 내 또는 시험관 내 모델을 사용하여 이전에 놓친 세포 유형 별 정보를 고유하게 제공합니다. 지난 10년 동안 ES/iPS 세포의 트랜스분화 또는 다른 말기 분화 세포 유형(예: 섬유아세포)에서 직접 전환하여 인간 뉴런을 생성하기 위해 신뢰할 수 있는 프로토콜이 많이 개발되었습니다.14,15. 특히, 주요 신경인성 전사 인자(예를 들어, 뉴로게닌 2, Ngn2)16를 인간 만능 줄기 세포에 적용하면 신경교 세포와 공배양할 필요 없이 순수 배양을 위한 잘 특성화된 뉴런 세포 유형의 균질한 집단을 생성할 수 있다12,17,18. 유도 된 인간 희소 돌기 아교 세포의 경우, 시간과 자원에서 광범위한 효율성과 수요를 가진 1 차 대응 물과 매우 유사한 기능성 세포를 생성 할 수있는 몇 가지 발표 된 프로토콜이 있습니다 19,20,21,22,23,24,25,26,27,28 . 현재까지 이러한 프로토콜 중 어느 것도 희소돌기아교 세포가 AD 발병 기전에 어떻게 반응하고 영향을 미치는지 조사하는 데 적용되지 않았습니다.
여기에서는 인간 유도 뉴런(iN) 및 OPC/희소돌기아교세포(iOPC/iOL)의 단일 및 혼합 배양에 대한 개선된 프로토콜을 설명합니다. 여기에 설명된 iN 프로토콜은 널리 사용되는 Ngn2 접근법(16)에 기초하며, glia-free라는 추가적인 특징을 갖는다. 결과 iN은 균질하고 특징적인 피라미드 형태, 유전자 발현 패턴 및 전기 생리 학적 특징17,18을 갖는 피질 층 2/3 흥분성 뉴런과 매우 유사합니다 (그림 1). 만능 줄기 세포의 직접 분화의 근본적인 장벽 중 일부를 극복하기 위해 우리는 저용량 디메틸 설폭 사이드 (DMSO) 전처리29,30의 간단하고 효과적인 방법을 개발했으며 Douvaras 및 Fossati 32의 널리 채택 된 프로토콜을 기반으로 인간 ES / iPS 세포가 iOPC 및 iOL로 트랜스 분화하는 성향이 향상되었다고보고했습니다32 . 우리는 프로토콜을 더욱 단순화하고 강력한 분화 촉진 화합물인 클레마스틴 7,33,34를 통합하여 희소돌기아교 성숙 과정을 가속화했습니다. 그 결과(그림 2), iOPC는 2주 내에 생성될 수 있고(마커 O4에 대해 ~95% 양성) 4주 내에 iOL이 생성될 수 있습니다(성숙한 마커 MBP 및 PLP1 발현). 흥미롭게도, 우리는 iOPCs만이 놀라운 양의 아밀로이드 β (Aβ)를 분비한다는 것을 발견했으며, 이는 희소 돌기 아교 세포35,36에서 아밀로이드 전구체 단백질 (APP)의 풍부한 발현과 처리 프로테아제 β- 세크레타제 (BACE1)의 풍부한 발현을 보여주는 독립적 인 전사체 데이터와 일치합니다. 또한, 당사의 iN-iOPC 공동 배양 시스템은 MBP 양성 iOL 과정에 의한 축삭 외피를 촉진하고 시냅스 형성에 대한 상당한 지원을 제공합니다(그림 3). 따라서 아래에 자세히 설명된 프로토콜은 이전에 카탈로그화된 뉴런-희소돌기아교세포 공동 배양 방법에 비해 기술적 및 생물학적 이점을 가지고 있으며 AD의 신경퇴행을 더 잘 모델링할 수 있는 가능성을 가지고 있습니다.
프로토콜
1. 인간 만능줄기세포로부터 인간 뉴런 유도
- 렌티바이러스 준비(~5일, 앞서 설명한 세부 프로토콜16)
- 각 T75 플라스크에 ~100만 개의 HEK293T 세포를 플레이트하여 형질감염을 수행할 때 ~40% 합류하도록 합니다. 테트라사이클린 유도성 Ngn2 및 퓨로마이신 내성 유전자(PuroR, 동일한 TetO 프로모터 대조군 하에서), rtTA 및 3개의 헬퍼 플라스미드 pRSV-REV, pMDLg/pRRE 및 VSV-G(렌티바이러스 벡터 DNA 12μg 및 각 헬퍼 플라스미드 DNA 6μg)를 발현하는 플라스미드로 형질감염시킵니다. 렌티 바이러스 준비 당 최소 3 개의 플라스크를 준비하십시오. 제조업체의 지시에 따라 형질주입을 위해 PEI를 사용하십시오. 16시간 후에 미디어를 교체하고 폐기하십시오.
- Harvest는 매일 배양 배지를 수집하여 바이러스 입자를 방출하고 3 일 동안 신선한 배지로 교체했습니다. 정제를 위해 바이러스 입자가 포함된 수집된 배지를 풀링합니다. 0.22μm 필터를 통해 바이러스를 여과하고 49,000 x g 에서 90분 동안 원심분리합니다. 적절한 양의 PBS- 포도당 (~ 150 μL)에 펠릿을 재현 탁하십시오.
- 뉴런 유도 (~ 5 일)
참고: 이 유도 프로토콜(그림 1A, 흐름도)은 검증된 만능성의 iPS 및 ES 세포 모두에 매우 효과적입니다(이는 잘 특성화된 만능성 마커의 면역조직화학 염색으로 분석할 수 있음; 그림 1B).- 52의 계대에서 시판되는 H1 인간 ES 세포를 사용한다(재료 표 참조). ES 세포 유지 배지 (재료 표 참조)를 사용하여 6-웰 플레이트로 코팅된 세포외 매트릭스 용액(6-웰 플레이트당 ~0.5mg의 매트릭스 용액; 재료 표 참조) 상에서 세포를 배양하고, 플레이트를 5%CO2로 37°C에서 배양한다.
- -2일째에 1mL의 세포 분리 용액( 재료 표 참조)으로 ES 세포(80% 합류)를 분리하고 실온에서 10분 동안 배양합니다. 세포를 튜브로 옮깁니다. 2mL의 배지로 웰을 씻고 동일한 튜브에서 결합합니다. 300 x g 에서 5분 동안 원심분리하고, 펠릿을 배지에 재현탁시키고, 웰당 1 x 105 셀의 파종 밀도로 매트릭스 코팅된 6웰 플레이트에 세포를 플레이트화합니다.
- -1일째에 폴리브렌(8μg/ml)과 함께 Ngn2와 PuroR 및 rtTA를 발현하는 렌티바이러스를 새로운 ES 세포 유지 배지의 ES 세포에 추가합니다( 재료 표 참조). 바이러스의 정확한 양은 실제 역가 또는 적정에 의해 결정되어야 합니다. 일반적으로 6웰 플레이트에 웰당 각 바이러스 5μL를 추가합니다.
- 0일째에 모르포겐이 없는 N2 보충제와 함께 DMEM-F12 배지에 독시사이클린(2μg/mL, Ngn2 발현 활성화)을 추가합니다.
- 1일째에 퓨로마이신을 DMEM-F12와 N2 및 독시사이클린의 새로운 배지에 첨가하여 최종 농도 1μg/mL 배지에 첨가합니다. Puromycin에서 최소 24시간 동안 형질도입된 세포를 선택합니다. 바이러스 역가가 낮은 경우 형질도입이 부족한 세포를 적절하게 제거하기 위해 더 높은 Puromycin 농도(최대 5μg/mL)와 더 긴 선택 기간(최대 48시간)이 필요할 수 있습니다.
- 2일차에 세포 분리 용액( 재료 표 참조)으로 분화 뉴런을 분리하고 매트릭스 용액( 재료 표 참조)으로 코팅된 24웰 플레이트(80,000–200,000 세포/웰 사이)에 다시 플레이팅하고 독시사이클린이 없는 NBA/B27 배지에 유지합니다. 파종 밀도가 중요합니다.
- 이 단계에서 분리 된 뉴런은 특수 상업용 동결 매체 ( 재료 표 참조)에서 동결되어 최대 3 개월 동안 액체 질소에 저장 될 수 있습니다. 순수한 뉴런은 해동 후 전형적인 ~ 15 % -20 % 세포 사멸을 고려하여 도금되거나, 단독으로 배양되거나, 다른 뇌 세포 유형과 공동 배양 될 수 있습니다 (OPC와의 공동 배양은 3.2.3 단계 참조).
- 제조자의 지시에 따라 세포 외 기질 기반 용액으로 코팅 된 플레이트에서 순수한 iN을 배양합니다 ( 재료 표 참조). 특징적인 피라미드 형태는 4 일 (및 6 일째; 그림 1C). 시냅스 형성은 빠르면 14일에서 16일에 검출할 수 있으며 표준 시냅스 전후 마커를 사용한 면역조직화학 염색에 의해 24일째에 두드러집니다. (그림 1D; 시냅스 전 마커 Synapsin 1 및 수지상 마커 Map2로 표지됨).
2. 만능줄기세포로부터 인간 희소돌기아교세포 전구세포(OPCs) 유도 및 희소돌기아교세포 성숙
- 신경 전구 세포(NPC) 생성: 단층 프로토콜(~7일). 흐름도는 그림 2A 를 참조하십시오.
- 앞서 설명한 대로 H1 인간 ES 세포를 배양하고(1.2.1단계 참조) 여러 신호 경로에 대한 소분자 억제제를 사용하여 이중 SMADi라는 확립된 접근 방식을 통해 신경 전구 세포(NPC)로 트랜스분화합니다. 여기에서는 널리 사용되는 상용 키트를 사용하고 제조업체에서 제공하는 단층 프로토콜을 따릅니다( 재료 표 참조).
- -1일째에 ES 세포 유지 배지(재료 표 참조)를 사용하여 성장 인자 감소 매트릭스 용액(재료 표 참조, 6웰 플레이트당 ~0.5mg의 매트릭스 용액)으로 코팅된 6웰 플레이트에 웰당 0.5–1 x 106개의 세포를 플레이트합니다(재료 표 참조). 이 성장 인자 감소 매트릭스 용액은 다음 단계에서 사용될 모든 플레이트를 코팅하는 데 사용됩니다.
- 0일째에 2% DMSO가 보충된 ES 세포 유지 배지( 재료 표 참조)로 24시간 동안 세포를 처리합니다.
- 1-6일째에 상용 키트의 SMAD 억제제가 포함된 따뜻한(37°C) 신경 유도 배지로 전체 배지를 교체합니다( 재료 표 참조). 세포가 분열하여 7일 전에 합류점에 도달하면 2.1.2단계 앞에서 설명한 대로 0.5–1 x 106의 파종 밀도로 계대합니다.
- 7일차에 NPC를 세포 분리 용액( 재료 표 참조)을 사용하여 24웰 플레이트의 파종 밀도가 1–2 x 105 셀/웰로 플레이트합니다.
- 다능성 마커, 예를 들어 OCT4의 부재 및 NPC 마커, 예컨대 PAX6, Nestin 및 Sox1의 존재에 대한 면역조직화학(IHC) 염색에 의한 분화 효율을 분석한다.
- 이 단계에서 분리된 NPC는 특수 상업용 NPC 냉동 매체( 재료 표 참조)에서 동결하고 최대 3개월 동안 액체 질소에 보관할 수 있습니다. 한 번 동결 및 해동 후에도 NPC는 여전히 신뢰할 수 있는 프로토콜을 가진 뉴런, 성상세포 및 OPC를 생성하는 다능성을 유지합니다.
- 희소돌기아교세포 전구세포(OPC) 생성(~7일). 흐름도는 그림 2A 를 참조하십시오.
- 7일째에 NPC를 세포 분리 용액(재료 표 참조)을 사용하여 통과시키고 따뜻한 (37°C) 신경 유도 배지의 24웰 플레이트에 웰당 1–2 x 105 세포의 파종 밀도로 플레이팅하고 상용 키트의 SMAD 억제제를 추가합니다(재료 표 참조).
- 8일째에 OPC 분화 배지에서 1% DMSO 용액을 준비하고 도금된 NPC를 24시간 동안 처리한다. OPC 분화 배지는 DMEM / F12 배지, 1 % N2 보충제, 1 % B27 보충제, 20 ng / mL에서 bFGF, 1 μM에서 SAG, 10 ng / mL에서 PDGF-AA로 구성됩니다 ( 재료 표 참조).
- 9일째에 배지를 DMSO가 없는 새로운 OPC 분화 배지로 교체합니다. 15 일까지 격일로 세포를 먹이십시오. 세포가 15일 전에 합류점에 도달하면 2.2.1단계에 설명된 대로 웰당 1–2 x 105 개의 세포로 계대합니다.
- 14일째에, OPC를 24-웰 플레이트에서 1-2 x 105 세포/웰의 밀도로 OPC 분화 배지 중의 플레이트화시켰다.
- 이 단계 (제15일)에, IHC 염색 또는 qPCR에 의한 OPC 특이적 마커의 존재에 대한 시험 세포 (예를 들어, O4, Olig1/2, CSPG4/Ng2, NKX2.2, PDGFRa; 그림 2B) NPC 마커가없는 경우 (Pax6 또는 Nestin; 그림 2D). 우리는 일반적으로 15 일째에 세포의 95 % 이상에서 O4 면역 반응성을 검출합니다. 알츠하이머병과 특히 관련하여, APP (아밀로이드 전구체 단백질), BACE1 (프로테아제 β-세크레아제 1 처리) 및 펩티드 아밀로이드-β(Aβ)의 발현은 OPCs에 풍부하다(도 2F).
- 희소돌기아교세포(OL) 성숙(~7–20일)
- 15일째에 배지를 OL 성숙 배지로 교체하십시오: 신경기저-A 배지, 2% B27 보충제, 1μM cAMP, 200ng/mL T3 트리요오드티로닌 및 1μM의 클레마스틴( 재료 표 참조). 필요한 경우 격일로 또는 매일 매체를 교체하십시오.
- 세포가 90% 합류에 도달하면 최대 2계대까지 1:3 비율로 또는 세포 분열이 상당히 느려질 때까지 분할합니다. OPC가 너무 빨리 분열하고 3일 이내에 컨플루언스에 도달하면 1-3일 동안 2-5μM 농도로 Ara-C( 재료 표 참조)를 추가합니다. 활성 증식은 성숙 효율이 낮아졌음을 나타냅니다.
- OL 마커, 예를 들어 CLDN11, PLP1, MBP의 발현을 qPCR, IHC 염색 또는 면역블로팅으로 평가함으로써 희소돌기아교세포 성숙의 효율을 조사한다. 매우 복잡한 구조의 특징적인 형태 (그림 2C)와 OL 마커의 발현 (그림 2E)은 28 일까지 쉽게 감지되어야합니다.
3. 인간 유도 뉴런(iN)과 희소돌기아교세포 전구세포(iOPC)의 공동 배양
- iOPC 도금 (~ 3 일)
- 플레이트 iOPC를 14일째에 24-웰 플레이트에서 웰당 1 x 105 개의 세포 밀도로 (단계 2.2.4에서 상기 기술된 바와 같이) OPC 분화 배지 (단계 2.2.2.에 기재된 바와 같음).
- iN-iOPC 공동 문화 설정
- 15일째에, Puromycin 선택 후 (단계 1.2.6에 기재된 바와 같이) 후 2일째의 단계에서 유도된 인간 뉴런을 세포 분리 용액으로 분리한다( 재료 표 참조).
- 배양된 OPC 상에 뉴런을 추가하고, 성장하는 OPC를 갖는 24-웰 플레이트에서 웰당 2 x 105 세포의 파종 밀도로 도금한다(단계 3.1.1에서). Neurobasal-A 배지, 2% B27 보충제 및 100ng/mL T3 트리요오드티로닌이 포함된 공동 배양 배지를 사용하십시오. 다음 날 매체를 교체하고 그 이후에는 격일로 배지를 교체하십시오. OPC가 너무 빨리 증식하고 3일 이내에 컨플루언스에 도달하면 2-5μM 농도로 Ara-C를 추가합니다. 7일 후 뉴런 공동 배양에서 성장한 iNs 및 iOPCs의 대표 이미지가 도 3A에 도시되어 있다.
- OPCs와의 공동 배양을 위해 단계 1.2.7에서 전술한 바와 같이 제조된 동결 뉴런을 사용한다. 플레이트 동결 및 해동 뉴런을 웰당 3 x 105 세포의 더 높은 밀도로 만듭니다.
- 공동 배양에서 14-16 일 후, iNs의 시냅스 형성은 시냅스 전후 마커의 IHC 염색에 의해 관찰 될 수 있으며, 21 일째에는 시냅스 반점이 풍부해야하며 (그림 3C) 신경 세포 활동을 안정적으로 기록 할 수 있습니다.
- 21일째부터 세포에서 OL 특이적 마커(예를 들어, MBP 및 PLP1)에 대해 시험한다. 28일째까지, 우리는 일반적으로 특정 마커에 대한 IHC 염색으로 표지된 iOL 과정에 의한 iN 축삭의 피복 현상을 관찰합니다(그림 3B; iN 축삭의 경우 신경섬유 NF, iOPC 과정의 경우 MBP).
결과
인간 만능 줄기 세포에서 인간 유도 뉴런의 직접 생성
시작하는 인간 다 능성 줄기 세포가 iN 또는 iOPC / iOL의 성공적인 생성을 위해 높은 수준의 다 능성을 나타내는 것이 매우 중요합니다. 따라서, 세포는 본 원고에 기재된 유도 프로토콜 중 하나를 시작하기 전에 Oct4 및 SOX2와 같은 특정 마커에 대해 염색되어야 한다(도 1A). 인간 H1 세포는 Zhang et al.에 의해 이?...
토론
시냅스 구조를 안정화시키고 수초화에 의한 염분 신호 전도를 촉진하는 물리적 및 대사적 지원 외에도 희소돌기아교세포 계통 세포는 뉴런 5,6,7과의 빠르고 역동적인 혼선을 통해 뉴런 활동 패턴을 형성할 수 있습니다. AD 병리학에서 희소돌기아교세포 반응은 처음에는 염증 및 산화 스트레스에 이차적인 것으로 간주되었지만...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작업은 국립 보건원 (R00 AG054616에서 YAH, T32 GM136566에서 KC), 스탠포드 의과 대학 및 Siebel Fellowship (SC에 수여)의 보조금으로 지원되었습니다. YAH는 브라운 중개 과학 연구소의 중개 신경 과학 센터의 GFL 번역 교수입니다.
자료
| Name | Company | Catalog Number | Comments |
| Accutase | STEMCELL Technologies | 7920 | |
| B27 supplement | ThermoFisher | 17504044 | |
| bFGF | ThermoFisher | PHG 0266 | |
| cAMP | MilliporeSigma | A9501 | |
| Clemastine | MilliporeSigma | SML0445 | |
| DMEM/F12 medium | STEMCELL Technologies | 36254 | |
| DMSO | ThermoFisher | D12345 | |
| Doxycycline | MilliporeSigma | D3072 | |
| Fetal Bovine Serum | ScienCell | 10 | |
| H1 human ES cells | WiCell | WA01 | |
| Matrigel | Corning | 354234 | |
| mTeSR plus | STEMCELL Technologies | 5825 | |
| N2 supplement | ThermoFisher | 17502001 | |
| Neurobasal A medium | ThermoFisher | 10888-022 | |
| Non Essential Amino Acids | ThermoFisher | 11140-050 | |
| PDGF-AA | R&D Systems | 221-AA-010 | |
| PEI | VWR | 71002-812 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polybrene | MilliporeSigma | TR-1003-G | |
| pRSV-REV | Addgene | 12253 | |
| Puromycin | ThermoFisher | A1113803 | |
| ROCK Inhibitor Y-27632 | STEMCELL Technologies | 72302 | |
| SAG | Tocris | 4366 | |
| STEMdiff Neural Progenitor Freezing Media | STEMCELL Technologies | 5838 | |
| STEMdiff SMADi Neural Induction Kit | STEMCELL Technologies | 8581 | |
| T3 triiodothyronine | MilliporeSigma | T6397 | |
| Tempo-iOlogo: Human iPSC-derived OPCs | Tempo BioScience | SKU102 | |
| TetO-Ng2-Puro | Addgene | 52047 | |
| VSV-G | Addgene | 12259 |
참고문헌
- Pelvig, D. P., Pakkenberg, H., Stark, A. K., Pakkenberg, B. Neocortical glial cell numbers in human brains. Neurobiology of Aging. 29 (11), 1754-1762 (2008).
- Barres, B. A. The mystery and magic of glia: a perspective on their roles in health and disease. Neuron. 60 (3), 430-440 (2008).
- De Strooper, B., Karran, E. The cellular phase of Alzheimer's disease. Cell. 164 (4), 603-615 (2016).
- Monje, M. Myelin plasticity and nervous system function. Annual Review of Neuroscience. 41, 61-76 (2018).
- Hughes, E. G., Orthmann-Murphy, J. L., Langseth, A. J., Bergles, D. E. Myelin remodeling through experience-dependent oligodendrogenesis in the adult somatosensory cortex. Nature Neuroscience. 21 (5), 696-706 (2018).
- Gibson, E. M., et al. Neuronal activity promotes oligodendrogenesis and adaptive myelination in the mammalian brain. Science. 344 (6183), 1252304 (2014).
- Pan, S., Mayoral, S. R., Choi, H. S., Chan, J. R., Kheirbek, M. A. Preservation of a remote fear memory requires new myelin formation. Nature Neuroscience. 23 (4), 487-499 (2020).
- Thornton, M. A., Hughes, E. G. Neuron-oligodendroglia interactions: Activity-dependent regulation of cellular signaling. Neuroscience Letters. 727, 134916 (2020).
- Ettle, B., Schlachetzki, J. C. M., Winkler, J. Oligodendroglia and myelin in neurodegenerative diseases: more than just bystanders. Molecular Neurobiology. 53 (5), 3046-3062 (2016).
- Essayan-Perez, S., Zhou, B., Nabet, A. M., Wernig, M., Huang, Y. A. Modeling Alzheimer's disease with human iPS cells: advancements, lessons, and applications. Neurobiology of Disease. 130, 104503 (2019).
- Li, L., et al. GFAP mutations in astrocytes impair oligodendrocyte progenitor proliferation and myelination in an hiPSC model of Alexander disease. Cell Stem Cell. 23 (2), 239-251 (2018).
- Lin, Y. T., et al. APOE4 causes widespread molecular and cellular alterations associated with Alzheimer's disease phenotypes in human iPSC-derived brain cell types. Neuron. 98 (6), 1294 (2018).
- TCW, J., et al. Cholesterol and matrisome pathways dysregulated in human APOE ε4 glia. bioRxiv. , (2019).
- Ang, C. E., Wernig, M. Induced neuronal reprogramming. Journal of Comparitive Neurology. 522 (12), 2877-2886 (2014).
- Penney, J., Ralvenius, W. T., Tsai, L. H. Modeling Alzheimer's disease with iPSC-derived brain cells. Molecular Psychiatry. 25 (1), 148-167 (2020).
- Zhang, Y., et al. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 78 (5), 785-798 (2013).
- Huang, Y. A., Zhou, B., Nabet, A. M., Wernig, M., Sudhof, T. C. Differential signaling mediated by ApoE2, ApoE3, and ApoE4 in human neurons parallels Alzheimer's Disease risk. Journal of Neuroscience. 39 (37), 7408-7427 (2019).
- Huang, Y. A., Zhou, B., Wernig, M., Sudhof, T. C. ApoE2, ApoE3, and ApoE4 Differentially Stimulate APP Transcription and Abeta Secretion. Cell. 168 (3), 427-441 (2017).
- Yang, N., et al. Generation of oligodendroglial cells by direct lineage conversion. Nature Biotechnology. 31 (5), 434-439 (2013).
- Douvaras, P., et al. Efficient generation of myelinating oligodendrocytes from primary progressive multiple sclerosis patients by induced pluripotent stem cells. Stem Cell Reports. 3 (2), 250-259 (2014).
- Lee, E. H., Park, C. H. Comparison of reprogramming methods for generation of induced-oligodendrocyte precursor cells. Biomolecules & Therapeutics (Seoul). 25 (4), 362-366 (2017).
- Ehrlich, M., et al. Rapid and efficient generation of oligodendrocytes from human induced pluripotent stem cells using transcription factors. Proceedings of the National Academy of Sciences of the United States of America. 114 (11), 2243-2252 (2017).
- Rodrigues, G. M. C., et al. Defined and scalable differentiation of human oligodendrocyte precursors from pluripotent stem cells in a 3D culture system. Stem Cell Reports. 8 (6), 1770-1783 (2017).
- Hu, B. Y., Du, Z. W., Li, X. J., Ayala, M., Zhang, S. C. Human oligodendrocytes from embryonic stem cells: conserved SHH signaling networks and divergent FGF effects. Development. 136 (9), 1443-1452 (2009).
- Izrael, M., et al. Human oligodendrocytes derived from embryonic stem cells: Effect of noggin on phenotypic differentiation in vitro and on myelination in vivo. Molecular and Cellular Neuroscience. 34 (3), 310-323 (2007).
- Yamashita, T., et al. Differentiation of oligodendrocyte progenitor cells from dissociated monolayer and feeder-free cultured pluripotent stem cells. PLoS One. 12 (2), 0171947 (2017).
- Wang, S., et al. Human iPSC-derived oligodendrocyte progenitor cells can myelinate and rescue a mouse model of congenital hypomyelination. Cell Stem Cell. 12 (2), 252-264 (2013).
- Chanoumidou, K., Mozafari, S., Baron-Van Evercooren, A., Kuhlmann, T. Stem cell derived oligodendrocytes to study myelin diseases. Glia. 68 (4), 705-720 (2020).
- Chetty, S., et al. A simple tool to improve pluripotent stem cell differentiation. Nature Methods. 10 (6), 553-556 (2013).
- Li, J., et al. A transient DMSO treatment increases the differentiation potential of human pluripotent stem cells through the Rb family. PLoS One. 13 (12), 0208110 (2018).
- Sambo, D., Li, J., Brickler, T., Chetty, S. Transient treatment of human pluripotent stem cells with DMSO to promote differentiation. Journal of Visualized Experiments: JoVE. (149), (2019).
- Douvaras, P., Fossati, V. Generation and isolation of oligodendrocyte progenitor cells from human pluripotent stem cells. Nature Protocols. 10 (8), 1143-1154 (2015).
- Mei, F., et al. Micropillar arrays as a high-throughput screening platform for therapeutics in multiple sclerosis. Nature Medicine. 20 (8), 954-960 (2014).
- Madhavan, M., et al. Induction of myelinating oligodendrocytes in human cortical spheroids. Nature Methods. 15 (9), 700-706 (2018).
- Zhang, Y., et al. Purification and characterization of progenitor and mature human astrocytes reveals transcriptional and functional differences with mouse. Neuron. 89 (1), 37-53 (2016).
- Grubman, A., et al. A single-cell atlas of entorhinal cortex from individuals with Alzheimer's disease reveals cell-type-specific gene expression regulation. Nature Neuroscience. 22 (12), 2087-2097 (2019).
- Goldman, S. A., Kuypers, N. J. How to make an oligodendrocyte. Development. 142 (23), 3983-3995 (2015).
- Behrendt, G., et al. Dynamic changes in myelin aberrations and oligodendrocyte generation in chronic amyloidosis in mice and men. Glia. 61 (2), 273-286 (2013).
- Patzke, C., et al. Neuromodulator signaling bidirectionally controls vesicle numbers in human synapses. Cell. 179 (2), 498-513 (2019).
- Piao, J., et al. Human embryonic stem cell-derived oligodendrocyte progenitors remyelinate the brain and rescue behavioral deficits following radiation. Cell Stem Cell. 16 (2), 198-210 (2015).
- Keirstead, H. S., et al. Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury. Journal of Neuroscience. 25 (19), 4694-4705 (2005).
- Kim, D. S., et al. Rapid generation of OPC-like cells from human pluripotent stem cells for treating spinal cord injury. Experimental & Molecular Medicine. 49 (7), 361 (2017).
Erratum
Formal Correction: Erratum: Generation of Human Neurons and Oligodendrocytes from Pluripotent Stem Cells for Modeling Neuron-Oligodendrocyte Interactions
Posted by JoVE Editors on 12/29/2020. Citeable Link.
An erratum was issued for: Generation of Human Neurons and Oligodendrocytes from Pluripotent Stem Cells for Modeling Neuron-Oligodendrocyte Interactions. The Representative Results section has been updated.
Figure 3 was updated from:
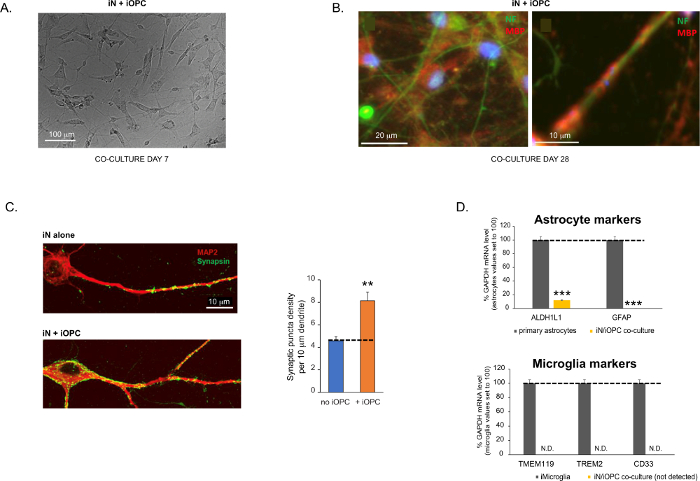
Figure 3: Co-culture of iNs and iOPCs. (A) Representative bright field image of co-cultured iNs and iOPCs at Day 7, showing a proper density for further maturation. (B) Representative immunofluorescence image of iNs and iOPCs co-cultured for 28 days. Axonal marker neurofilament NF is shown in green and oligodendrocytic marker MBP in red. Right, a segment of iN axon ensheathed by iOL process (MBP+). (C) Synapse formation assayed in 4-week-old co-cultures. Cells were stained for Synapsin 1 (Syn1, green) and MAP2 (red), and synaptic puncta were quantified by confocal analysis of density along the dendritic segments as described17,18. (D) In our co-cultures of iNs and iOPCs (7 days of co-culturing), the expression of astrocyte markers, ALDHL1 and GFAP, is minimal (top), and the expression of microglia markers, TMEM119, TREM2, and CD33, is not detected (N.D.) by qPCR. The contamination from these two glial cell types is thus excluded. Please click here to view a larger version of this figure.
to:
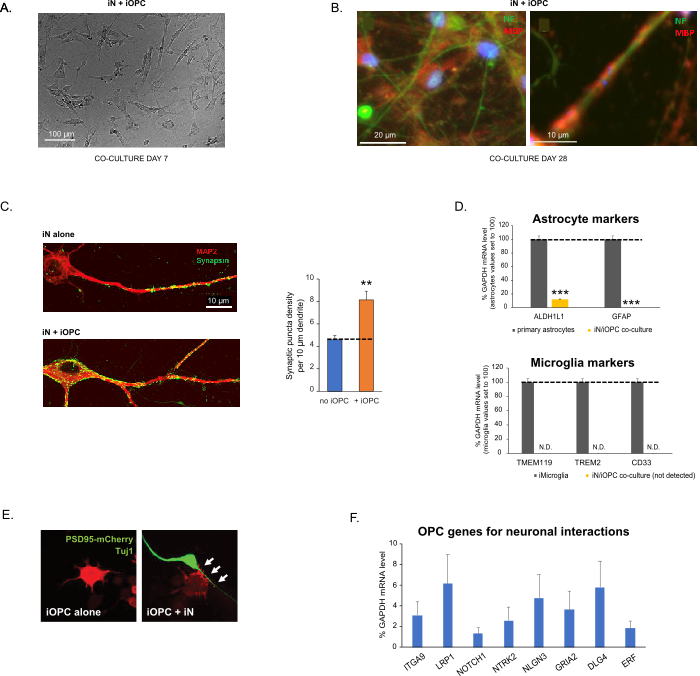
Figure 3: Co-culture of iNs and iOPCs. (A) Representative bright field image of co-cultured iNs and iOPCs at Day 7, showing a proper density for further maturation. (B) Representative immunofluorescence image of iNs and iOPCs co-cultured for 28 days. Axonal marker neurofilament NF is shown in green and oligodendrocytic marker MBP in red. Right, a segment of iN axon ensheathed by iOL process (MBP+). (C) Synapse formation assayed in 4-week-old co-cultures. Cells were stained for Synapsin 1 (Syn1, green) and MAP2 (red), and synaptic puncta were quantified by confocal analysis of density along the dendritic segments as described17,18. (D) In our co-cultures of iNs and iOPCs (7 days of co-culturing), the expression of astrocyte markers, ALDHL1 and GFAP, is minimal (top), and the expression of microglia markers, TMEM119, TREM2, and CD33, is not detected (N.D.) by qPCR. The contamination from these two glial cell types is thus excluded. (E) Coculturing iOPC with iN leads to the formation of neuron-OPC synapses. The fluorescence-tagged post-synaptic marker PSD95-mCherry is expressed only in OPCs, and display a diffuse pattern in single cultures (left) but aggregate to form puncta in cocultures (right, indicated by arrows; Tuj1, neuronal marker). (F) The expression of well-characterized oligodendroglial genes that can sense and respond to neuronal activities in the pure cultures of iOPCs at Day 14. Please click here to view a larger version of this figure.
The fourth paragraph was updated from:
Co-culturing of iNs and iOPCs
This protocol is optimized specifically for co-culturing iNs and iOPCs and allow our real-time monitoring of the inter-cellular communications between these two cell types along the course of neural development. The ideal plating densities for both cell types need to be decided with a series of cell number titration to achieve proper differentiation (Figure 3A). After 4 weeks in co-cultures, the iOPCs are expected to be adequately differentiated into OLs that are positive for specific markers such as MBP and extend processes to ensheath axons (Figure 3B). The co-culture system can robustly boost up the number of synapses, indicating that the iOPCs provide a neuronal support through physical contacts or release of trophic factors (Figure 3C). We can maintain the co-cultures in acceptable health condition for up to 6 weeks and observe that the synapse number and other neuronal attributes plateau around the fifth week. Of note, astrocytes and microglia are not present in our preparations and their absence can be documented by checking the expression of specific markers (Figure 3D).
to:
Co-culturing of iNs and iOPCs
This protocol is optimized specifically for co-culturing iNs and iOPCs and allow our real-time monitoring of the inter-cellular communications between these two cell types along the course of neural development. The ideal plating densities for both cell types need to be decided with a series of cell number titration to achieve proper differentiation (Figure 3A). After 4 weeks in co-cultures, the iOPCs are expected to be adequately differentiated into OLs that are positive for specific markers such as MBP and extend processes to ensheath axons (Figure 3B). The co-culture system can robustly boost up the number of synapses, indicating that the iOPCs provide a neuronal support through physical contacts or release of trophic factors (Figure 3C). We can maintain the co-cultures in acceptable health condition for up to 6 weeks and observe that the synapse number and other neuronal attributes plateau around the fifth week. Of note, astrocytes and microglia are not present in our preparations and their absence can be documented by checking the expression of specific markers (Figure 3D). The iOPCs express a good number of well-characterized genes that can potentially respond to and mediate the activity-dependent signals from neighboring neurons, in a paracrine (e.g. neurotrophins and metabolites) and/or a synaptic manner (Figure 3E and 3F).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유