A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
יצירת נוירונים אנושיים ואוליגודנדרוציטים מתאי גזע פלוריפוטנטיים למידול אינטראקציות נוירון-אוליגודנדרוציטים
* These authors contributed equally
In This Article
Erratum Notice
Summary
האינטראקציות הנוירוניות-גליאליות בניוון עצבי אינן מובנות היטב בשל כלים ושיטות לא מספקים. במאמר זה אנו מתארים פרוטוקולים ממוטבים להשגת תאי עצב מושרים, תאים מבשרי אוליגודנדרוציטים ואוליגודנדרוציטים מתאי גזע פלוריפוטנטיים אנושיים ומספקים דוגמאות לערכים של שיטות אלה בהבנת תרומות ספציפיות לסוג התא במחלת אלצהיימר.
Abstract
במחלת אלצהיימר (AD) ובהפרעות נוירודגנרטיביות אחרות, כשל אוליגודנדרוגליאלי הוא תכונה פתולוגית מוקדמת נפוצה, אך האופן שבו הוא תורם להתפתחות המחלה ולהתקדמותה, במיוחד בחומר האפור של המוח, נותר ברובו לא ידוע. תפקוד לקוי של תאי שושלת אוליגודנדרוציטים מסומן על ידי ליקויים במיאלינציה והתחדשות עצמית לקויה של תאים מבשרי אוליגודנדרוציטים (OPCs). שני פגמים אלה נגרמים לפחות בחלקם על ידי הפרעה של אינטראקציות בין נוירון ו oligodendrocytes לאורך הצטברות של פתולוגיה. OPCs מעוררים אוליגודנדרוציטים מיאלינים במהלך התפתחות מערכת העצבים המרכזית. בקליפת המוח הבוגרת, OPCs הם התאים המתרבים העיקריים (המהווים ~5% מכלל תאי המוח) ושולטים בהיווצרות מיאלין חדשה באופן תלוי-פעילות עצבית. תקשורת נוירון לאוליגודנדרוציטים כאלה נחקרים באופן משמעותי, במיוחד בהקשר של תנאים נוירודגנרטיביים כגון AD, בשל היעדר כלים מתאימים. בשנים האחרונות, הקבוצה שלנו ואחרים התקדמו משמעותית כדי לשפר את הפרוטוקולים הזמינים כיום כדי ליצור נוירונים פונקציונליים ואוליגודנדרוציטים בנפרד מתאי גזע פלוריפוטנטיים אנושיים. בכתב יד זה, אנו מתארים את ההליכים האופטימליים שלנו, כולל הקמת מערכת תרבית משותפת כדי לדגום את הקשרים נוירון-אוליגודנדרוציטים. תוצאות ההמחשה שלנו מצביעות על תרומה בלתי צפויה של OPCs/אוליגודנדרוציטים לעמילואידוזיס במוח ולשלמות הסינפסה, ומדגישות את התועלת של מתודולוגיה זו לחקר אלצהיימר. גישה רדוקציוניסטית זו היא כלי רב עוצמה לנתח את האינטראקציות ההטרו-תאיות הספציפיות מתוך המורכבות האינהרנטית בתוך המוח. הפרוטוקולים שאנו מתארים כאן צפויים להקל על מחקרים עתידיים על פגמים אוליגודנדרוגליאליים בפתוגנזה של ניוון עצבי.
Introduction
תאי שושלת אוליגודנדרוציטים – כולל תאים מבשרי אוליגודנדרוציטים (OPCs), אוליגודנדרוציטים מיאלינים וסוגי מעבר בין לבין – מהווים קבוצה מרכזית של תאי מוח אנושיים1 המשתתפים באופן פעיל בתפקודים קריטיים רבים לתפעול ותחזוקה תקינים של מערכת העצבים המרכזית שלנו במהלך ההתפתחות העצבית וההזדקנות 2,3,4 . בעוד שאוליגודנדרוציטים ידועים בייצור מיאלין כדי להקל על העברת הפעילות העצבית ולתמוך בבריאות האקסונאלית בחומר הלבן, OPCs נמצאים בשפע (~5%) בחומר אפור שבו המיאלינציה נדירה ומבצעים פונקציות איתות תלויות פעילות כדי לשלוט בהתנהגות הלמידה וביצירת הזיכרון 5,6,7,8 . כיצד תאים אוליגודנדרוגליאליים מתפקדים ותפקוד לקוי בפתוגנזה של מחלת אלצהיימר (AD) ומצבים נוירודגנרטיביים אחרים הקשורים לגיל הובנו9. הליקויים של מערכת מודל מתאימה וליקויים בידע הכללי כדי להנחות נתיב ניסויי קדימה הם הסיבות העיקריות לפער זה.
לאור פריצות הדרך האחרונות בגזירת תאי מוח אנושיים מתאי גזע פלוריפוטנטיים הכוללים תאי גזע עובריים (ES) ותאי גזע פלוריפוטנטיים מושרים (iPS), מודלים תאיים כאלה בשילוב עם כלי עריכת גנים מודרניים התפתחו ככלים חזקים לטיפול בקשר המורכב של אינטראקציות תאיות במוח, והם מסוגלים להדגים ביטויי מחלה ספציפיים לאדם10, 11. בהתחשב בכך שסוגי תאי מוח בודדים יכולים להציג השפעות שונות ואף סותרות לנוכח אותם תנאים מקדמי AD12,13, מתודולוגיית תאי גזע זו מציעה באופן ייחודי מידע ספציפי לסוג התא שהוחמץ בעבר באמצעות מודלים מבוססים in vivo או in vitro המספקים רק קריאות מצטברות מאוספים של סוגי תאי מוח. בעשור האחרון פותחו מספר לא מבוטל של פרוטוקולים אמינים ליצירת תאי עצב אנושיים כתוצאה מהתמיינות טרנס-דיפרנציאציה של תאי ES/iPS או מהמרה ישירה מסוגי תאים אחרים שעברו התמיינות סופנית (למשל, פיברובלסטים)14,15. בפרט, היישום של גורמי שעתוק נוירוגניים מרכזיים (למשל, נוירוגנין 2, Ngn2)16 לתאי גזע פלוריפוטנטיים אנושיים יכול ליצור אוכלוסייה הומוגנית של סוגי תאים עצביים מאופיינים היטב עבור תרביות טהורות ללא צורך בקוקולטורה עם תאי גליה12,17,18. עבור אוליגודנדרוציטים אנושיים מושרים, ישנם כמה פרוטוקולים שפורסמו שיכולים ליצור תאים פונקציונליים הדומים מאוד לעמיתיהם הראשוניים, עם מגוון רחב של יעילות וביקוש בזמן ובמשאבים 19,20,21,22,23,24,25,26,27,28 . עד כה, אף אחד מהפרוטוקולים הללו לא יושם כדי לחקור כיצד תאים אוליגודנדרוגליאליים מגיבים לפתוגנזה של אלצהיימר ומשפיעים עליה.
כאן אנו מתארים את הפרוטוקולים המשופרים שלנו עבור תרביות בודדות ומעורבות של תאי עצב המושרים על ידי בני אדם (iNs) ו-OPC/אוליגודנדרוציטים (iOPCs/iOLs). פרוטוקול iN המתואר כאן מבוסס על גישת Ngn216 הנמצאת בשימוש נרחב, ויש לו את התכונה הנוספת של היותו נטול גליה. ה-iNs המתקבלים הם הומוגניים ודומים מאוד לשכבת קליפת המוח 2/3 נוירונים מעוררים, עם מורפולוגיה פירמידלית אופיינית, דפוס ביטוי גנים ותכונות אלקטרופיזיולוגיות17,18 (איור 1). כדי להתגבר על כמה מהמחסומים הבסיסיים בהתמיינות מכוונת של תאי גזע פלוריפוטנטיים, פיתחנו שיטה פשוטה ויעילה של דימתיל סולפוקסיד במינון נמוך (DMSO) לפני טיפול29,30, ודיווחנו על נטייה משופרת של תאי ES/iPS אנושיים לבצע טרנס-דיפרנציאציה ל-iOPCs ו-iOLs31, בהתבסס על פרוטוקול מותאם באופן נרחב על ידי Douvaras ו-Fossati 32 . פישטנו עוד יותר את הפרוטוקול ושילבנו תרכובת חזקה המקדמת בידול,clemastine 7,33,34, כדי להאיץ את תהליך ההבשלה האוליגודנדרוגליאלית. כתוצאה מכך (איור 2), ניתן ליצור את ה-iOPCs תוך שבועיים (~95% חיוביים עבור הסמן O4) ו-iOLs תוך ארבעה שבועות (המבטאים סמנים בוגרים MBP ו-PLP1). באופן מעניין, מצאנו ש-iOPCs לבדם מפרישים כמות יוצאת דופן של עמילואיד-β (Aβ), בהתאם לנתוני התעתיק הבלתי תלויים המראים את הביטוי השופע של חלבון מבשר העמילואיד (APP) והפרוטאז המעבד β-secretase (BACE1) בתאי שושלת אוליגודנדרוציטים35,36. יתר על כן, מערכת התרביות המשותפות iN-iOPC שלנו מקדמת את המעטפת של אקסונים על ידי תהליכי iOL חיוביים ל-MBP ומספקת תמיכה משמעותית להיווצרות סינפסות (איור 3). לפיכך, לפרוטוקולים שנפרט להלן יש יתרונות טכניים וביולוגיים על פני שיטות שיתוף פעולה של נוירונים-אוליגודנדרוגליה שקוטלגו בעבר, והם טומנים בחובם הבטחה במידול טוב יותר של הניוון העצבי באלצהיימר.
Protocol
1. אינדוקציה של נוירונים אנושיים מתאי גזע פלוריפוטנטיים אנושיים
- הכנת Lentivirus (~ 5 ימים, פרוטוקול מפורט כפי שתואר קודםלכן 16)
- צלחת ~ 1 מיליון תאי HEK293T כל בקבוק T75, כדי שהם ~ 40% מפגש בעת ביצוע טרנספקציה. העבירו אותם עם פלסמידים המבטאים Ngn2 הניתן להסרה של טטרציקלין וגן עמיד לפורומיצין (PuroR; תחת אותה בקרת מקדם TetO), rtTA ושלושת הפלסמידים המסייעים pRSV-REV, pMDLg/pRRE ו-VSV-G (12 מיקרוגרם של דנ"א וקטורי לנטי-ויראלי ו-6 מיקרוגרם של כל אחד מהדנ"א הפלסמיד המסייע). הכינו לפחות שלוש צלוחיות לכל הכנת לנטיוירוס. השתמש ב- PEI לצורך העברה בהתאם להוראות היצרן. שנה את המדיה לאחר 16 שעות והשלך.
- קציר שחרר חלקיקים ויראליים על ידי איסוף מדיה תרבותית כל יום ולהחליף עם מדיה טרייה במשך 3 ימים. מאגר את המדיה שנאספה המכילה חלקיקים ויראליים לטיהור. סנן את הווירוס דרך מסנן 0.22 מיקרומטר וצנטריפוגה בגודל 49,000 x g למשך 90 דקות. להשעות את הכדור בנפח המתאים של PBS-גלוקוז (~ 150 μL).
- אינדוקציה של נוירונים (~5 ימים)
הערה: פרוטוקול אינדוקציה זה (איור 1A; דיאגרמת זרימה) יעיל מאוד הן עבור תאי iPS והן עבור תאי ES בעלי פלוריפוטנטיות מאומתת (אשר ניתנת לבדיקה על-ידי צביעה אימונוהיסטוכימית של סמני פלוריפוטנטיות מאופיינים היטב; איור 1B).- השתמש בתאי ES אנושיים H1 הזמינים מסחרית במעבר של 52 (ראה טבלת חומרים). תרבית התאים על תמיסת מטריצה חוץ-תאית מצופה לוחות 6-באר (~0.5 מ"ג של תמיסת מטריצה לכל צלחת 6-well; ראו טבלת חומרים) באמצעות מדיום תחזוקת תאי ES (ראו טבלת חומרים) ודגירה של הלוחות בטמפרטורה של 37 מעלות צלזיוס עם 5% CO2.
- ביום -2, נתקו תאי ES (80% מפגש) עם 1 מ"ל של תמיסת ניתוק תאים (ראו טבלת חומרים) ודגירה בטמפרטורת החדר למשך 10 דקות. להעביר את התאים לצינור; לשטוף את הבאר עם 2 מ"ל של מדיה ולשלב באותו צינור. צנטריפוגה ב 300 x גרם במשך 5 דקות, לתלות את הכדור במדיה, ואת צלחת התאים על מטריצה מצופה 6-באר צלחות בצפיפות זריעה של 1 x 105 תאים לכל באר.
- ביום -1, הוסיפו לנטי-וירוסים המבטאים Ngn2 בתוספת PuroR ו-rtTA יחד עם פוליברן (8 מיקרוגרם/מ"ל) לתאי ה-ES במדיום לתחזוקת תאי ES טריים (ראו טבלת חומרים). הכמות המדויקת של וירוסים צריכה להיקבע על ידי titers בפועל או טיטרציה. בדרך כלל אנו מוסיפים 5 μL כל וירוס לכל באר בצלחת של 6 בארות.
- ביום 0, יש להוסיף דוקסיציקלין (2 מיקרוגרם/מ"ל, כדי להפעיל ביטוי Ngn2) במדיום DMEM-F12 עם תוסף N2 ללא מורפוזן.
- ביום הראשון, יש להוסיף פורומיצין במדיום טרי של DMEM-F12 בתוספת N2 ודוקסיציקלין, לריכוז הסופי של מדיום 1 מיקרוגרם/מ"ל. בחר את התאים המתמרים ב- Puromycin למשך 24 שעות לפחות. ייתכן שיהיה צורך בריכוז פורומיצין גבוה יותר (עד 5 מיקרוגרם/מ"ל) ותקופת בחירה ארוכה יותר (עד 48 שעות) כדי להסיר כראוי את התאים התת-מתמרים אם טיטר הנגיף נמוך.
- ביום השני, נתקו תאי עצב מתמיינים עם תמיסת ניתוק תאים (ראו טבלת חומרים), וצלחו אותם מחדש על לוחות של 24 בארות (בין 80,000 ל-200,000 תאים/באר) המצופים בתמיסת מטריצה (ראו טבלת חומרים), ושמרו אותם במדיום NBA/B27 ללא דוקסיציקלין. צפיפות הזריעה היא קריטית.
- בשלב זה, נוירונים מנותקים יכולים להיות מוקפאים במדיום הקפאה מסחרי מיוחד (ראו טבלת חומרים) ומאוחסנים בחנקן נוזלי למשך עד 3 חודשים. ניתן לצפות נוירונים טהורים תוך התחשבות במוות תאי טיפוסי של ~15%-20% לאחר ההפשרה, בתרבית בלבד או בתרבית משותפת עם סוגי תאי מוח אחרים (ראו שלב 3.2.3. להתרבות משותפת עם OPCs).
- תרבית iN טהורה על הלוחות המצופים בפתרונות מבוססי מטריצה חוץ-תאית בהתאם להוראות היצרן (ראה טבלת חומרים). המורפולוגיה הפירמידלית האופיינית צריכה להיות ניכרת עד יום 4 (ויום 6; איור 1C). ניתן לזהות את היווצרות הסינפסה כבר ביום 14 עד 16 והיא בולטת ביום 24 על ידי צביעה אימונוהיסטוכימית עם סמנים סטנדרטיים לפני ואחרי סינפטיים. (איור 1D; מסומן עם הסמן הקדם-סינפטי Synapsin 1 והסמן הדנדריטי Map2).
2. אינדוקציה של תאים מבשרי אוליגודנדרוציטים אנושיים (OPCs) מתאי גזע פלוריפוטנטיים והבשלת אוליגודנדרוציטים
- יצירת תאי אב עצביים (NPC): פרוטוקול חד-שכבתי (~7 ימים). ראה איור 2A עבור דיאגרמת הזרימה.
- תרבית H1 תאי ES אנושיים כפי שתואר קודם לכן (ראה שלב 1.2.1.) וטרנס-דיפרנציאציה שלהם לתאי אב עצביים (NPCs) על ידי גישה מבוססת הנקראת SMADi כפול, עם מעכבי מולקולות קטנות עבור מסלולי איתות מרובים. כאן אנו משתמשים בערכה מסחרית מקובלת ועוקבים אחר פרוטוקול monolayer המסופק על ידי היצרן (ראה טבלת חומרים).
- ביום -1, צלחת 0.5-1 x 10 6 תאים לכל באר בצלחת6 בארות המצופה על ידי תמיסת מטריצה מופחתת גורם גדילה (ראה טבלת חומרים; ~ 0.5 מ"ג של תמיסת מטריצה לכל צלחת 6 בארות) עם מדיום תחזוקת תאי ES (ראה טבלת חומרים). תמיסת מטריצה מופחתת גורם גדילה זו משמשת לציפוי כל הלוחות שישמשו בשלבים הבאים.
- ביום 0, טפלו בתאים במשך 24 שעות עם מדיום תחזוקת תאי ES (ראו טבלת חומרים) בתוספת 2% DMSO.
- ביום 1-6, החליפו את המדיה המלאה במדיום אינדוקציה עצבי חם (37 מעלות צלזיוס) המכיל את מעכבי ה-SMAD מהערכה המסחרית (ראו טבלת חומרים). אם התאים מתחלקים ומגיעים למפגש לפני יום 7, העבירו אותם לצפיפות הזריעה של 0.5-1 x 106, כפי שתואר קודם לכן בשלב 2.1.2.
- ביום 7, מעבר NPCs באמצעות תמיסת ניתוק תאים (ראה טבלת חומרים) וצלחת בצפיפות זריעה של 1-2 x 105 תאים / באר של צלחת 24 באר.
- בדוק את יעילות ההבחנה על ידי צביעה אימונוהיסטוכימית (IHC) בהיעדר סמן פלוריפוטנטיות, OCT4 למשל, ונוכחות של סמני NPC כגון PAX6, Nestin ו- Sox1.
- בשלב זה, ניתן להקפיא NPCs מנותקים במדיית ההקפאה המסחרית המיוחדת של NPC (ראו טבלת חומרים) ולאחסן אותם בחנקן נוזלי למשך עד 3 חודשים. לאחר הקפאה והפשרה פעם אחת, NPCs עדיין שומרים על הרב-פוטנטיות כדי ליצור נוירונים, אסטרוציטים ו-OPCs עם פרוטוקולים אמינים.
- דור תאים מבשרי אוליגודנדרוציטים (OPC) (~7 ימים). ראה איור 2A עבור דיאגרמת הזרימה.
- ביום 7, מעבירים NPCs באמצעות תמיסת ניתוק תאים (ראו טבלת חומרים) ולוחים אותם בצפיפות זריעה של 1-2 x 105 תאים לכל באר בצלחת של 24 בארות במדיום אינדוקציה עצבית חמה (37 מעלות צלזיוס) בתוספת מעכבי SMAD מהערכה המסחרית (ראו טבלת חומרים).
- ביום 8, הכינו תמיסה של 1% DMSO במדיום ההתמיינות OPC וטפלו ב-NPCs המצופים במשך 24 שעות. מדיום הבידול OPC מורכב מ: מדיום DMEM/F12, תוסף N2 1%, תוסף B27 1%, bFGF ב-20 ננוגרם/מ"ל, SAG ב-1 מיקרומטר, PDGF-AA ב-10 ננוגרם/מ"ל (ראו טבלת חומרים).
- ביום ה-9, החלף את המדיה באמצעי בידול OPC טרי ללא DMSO. האכילו את התאים אחת ליומיים עד יום 15. אם התאים מגיעים למפגש לפני יום 15, העבירו אותם לצפיפות זריעה של 1-2 x 105 תאים לכל באר כמתואר בשלב 2.2.1.
- ביום 14, לוחות OPC במדיום התמיינות OPC בצפיפות של 1-2 x 105 תאים / באר בצלחת 24 באר.
- בשלב זה (יום 15), בדוק תאים לנוכחות סמנים ספציפיים ל- OPC על ידי צביעת IHC או qPCR (למשל, O4, Olig1/2, CSPG4 / Ng2, NKX2.2, PDGFRa; איור 2B) ועל היעדר סמני NPC (Pax6 או Nestin; איור 2D). בדרך כלל אנו מזהים את הפעילות החיסונית של O4 ביותר מ-95% מהתאים ביום 15. רלוונטי במיוחד למחלת אלצהיימר, הביטוי של APP (חלבון מבשר עמילואיד), BACE1 (פרוטאז העיבוד β-secreatase 1) ופפטיד עמילואיד-β (Aβ) נמצא בשפע ב-OPCs (איור 2F).
- הבשלת אוליגודנדרוציטים (OL) (~7-20 יום)
- ביום ה-15, החליפו את המדיה במדיום הבשלה OL: מדיום Neurobasal-A, תוסף B27 של 2%, 1 μM cAMP, טריודותירונין T3 של 200 ננוגרם/מ"ל, וקלמסטין של 1 μM (ראו טבלת חומרים). שנה את המדיום כל יומיים או כל יום, במידת הצורך.
- כאשר התאים מגיעים למפגש של 90%, הם מתפצלים ביחס של 1:3 עד ל-2 מעברים או עד שחלוקת התאים מאטה באופן משמעותי. אם OPCs מתחלקים מהר מדי ומגיעים למפגש תוך פחות מ-3 ימים, הוסיפו Ara-C ( ראו טבלת חומרים) בריכוז של 2-5 מיקרומטר למשך 1-3 ימים. התפשטות פעילה מצביעה על יעילות התבגרות נמוכה יותר.
- בחן את היעילות של הבשלה אוליגודנדרוגליאלית על ידי הערכת הביטוי של סמני OL, למשל, CLDN11, PLP1, MBP על ידי qPCR, צביעת IHC או אימונובלוטציה. המורפולוגיה האופיינית של מבנים מורכבים מאוד (איור 2C) והביטוי של סמני OL (איור 2E) אמורים להיות מזוהים בקלות עד יום 28.
3. התרבות משותפת של נוירונים המושרים על ידי בני אדם (iNs) ותאים מבשרי אוליגודנדרוציטים (iOPCs)
- ציפוי iOPC (~3 ימים)
- לוחות iOPCs ביום 14 בצפיפות של 1 x 105 תאים לכל באר בצלחת 24 באר (כפי שתואר לעיל בשלב 2.2.4.) במדיום התמיינות OPC (כמתואר בשלב 2.2.2.).
- הקמת תרבות משותפת של iN-iOPC
- ביום 15, נתק את הנוירונים האנושיים המושרים בשלב של יום 2 לאחר בחירת Puromycin (כמתואר בשלב 1.2.6.) עם תמיסת ניתוק תאים (ראה טבלת חומרים).
- הוסיפו תאי עצב לתאי ה-OPC בתרבית, וציפוי בצפיפות זריעה של 2 x 105 תאים לבאר בצלחת 24 בארות עם OPCs גדלים (משלב 3.1.1). השתמשו במדיום הקו-תרבית המכיל מדיום Neurobasal-A, תוסף 2% B27 ו-100 ng/mL T3 triiodothyronine. שנה את המדיום למחרת ולאחר מכן כל יומיים לאחר מכן. אם OPCs מתרבים מהר מדי ומגיעים למפגש תוך פחות מ-3 ימים, הוסיפו את Ara-C בריכוז של 2-5 מיקרומטר. תמונה מייצגת של תאי ה-iN וה-iOPCs שגדלו בתרבית משותפת לאחר 7 ימים תאי עצב מוצגת באיור 3A.
- השתמש בנוירונים קפואים שהוכנו כמתואר לעיל בשלב 1.2.7 לצורך שיתוף פעולה עם OPCs. צלחת להקפיא ולהפשיר נוירונים בצפיפות גבוהה יותר של 3 x 105 תאים לכל באר.
- לאחר יום 14-16 בתרביות משותפות, ניתן לראות את היווצרות הסינפסה ב-iNs על-ידי צביעת IHC של סמנים טרום-סינפטיים ופוסט-סינפטיים, ועד יום 21 הפונקטה הסינפטית צריכה להיות בשפע (איור 3C) וניתן לתעד פעילויות עצביות באופן מהימן.
- החל מיום 21, בדוק תאים עבור סמנים ספציפיים ל- OL (לדוגמה, MBP ו- PLP1). עד היום ה-28, אנו בדרך כלל צופים בתופעה של אקסוני iN על-ידי תהליכי iOL, המסומנים על-ידי צביעת IHC עבור סמנים ספציפיים (איור 3B; נוירופילמנט NF עבור אקסונים של iN ו-MBP עבור תהליכי iOPC).
תוצאות
ייצור ישיר של נוירונים המושרים על ידי בני אדם מתאי גזע פלוריפוטנטיים אנושיים
חשוב מאוד שתאי הגזע הפלוריפוטנטיים האנושיים המתחילים יציגו רמה גבוהה של פלוריפוטנטיות לדור מוצלח של iNs או iOPCs/iOLs. לכן, יש להכתים תאים עבור סמנים ספציפיים, כגון Oct4 ו-SOX2, לפני תחילת אחד מפרוטוקולי האינדוק?...
Discussion
בנוסף לתמיכה הפיזית והמטבולית לייצוב מבני הסינפסה ולהקלה על הולכת האות המלוח על ידי מיאלינציה, תאי שושלת אוליגודנדרוציטים יכולים לעצב את דפוס הפעילות העצבית באמצעות שיחות צולבות מהירות ודינמיות עם נוירונים 5,6,7. בעוד שבפתולוגיה של AD התג?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מהמכונים הלאומיים לבריאות (R00 AG054616 ל- Y.A.H. ו- T32 GM136566 ל- K.C.), בית הספר לרפואה של אוניברסיטת סטנפורד ומלגת Siebel (המוענקת ל- S.C.). י.א.ה. הוא פרופסור תרגומי GFL מהמרכז למדעי המוח התרגומיים במכון בראון למדעים תרגומיים.
Materials
| Name | Company | Catalog Number | Comments |
| Accutase | STEMCELL Technologies | 7920 | |
| B27 supplement | ThermoFisher | 17504044 | |
| bFGF | ThermoFisher | PHG 0266 | |
| cAMP | MilliporeSigma | A9501 | |
| Clemastine | MilliporeSigma | SML0445 | |
| DMEM/F12 medium | STEMCELL Technologies | 36254 | |
| DMSO | ThermoFisher | D12345 | |
| Doxycycline | MilliporeSigma | D3072 | |
| Fetal Bovine Serum | ScienCell | 10 | |
| H1 human ES cells | WiCell | WA01 | |
| Matrigel | Corning | 354234 | |
| mTeSR plus | STEMCELL Technologies | 5825 | |
| N2 supplement | ThermoFisher | 17502001 | |
| Neurobasal A medium | ThermoFisher | 10888-022 | |
| Non Essential Amino Acids | ThermoFisher | 11140-050 | |
| PDGF-AA | R&D Systems | 221-AA-010 | |
| PEI | VWR | 71002-812 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polybrene | MilliporeSigma | TR-1003-G | |
| pRSV-REV | Addgene | 12253 | |
| Puromycin | ThermoFisher | A1113803 | |
| ROCK Inhibitor Y-27632 | STEMCELL Technologies | 72302 | |
| SAG | Tocris | 4366 | |
| STEMdiff Neural Progenitor Freezing Media | STEMCELL Technologies | 5838 | |
| STEMdiff SMADi Neural Induction Kit | STEMCELL Technologies | 8581 | |
| T3 triiodothyronine | MilliporeSigma | T6397 | |
| Tempo-iOlogo: Human iPSC-derived OPCs | Tempo BioScience | SKU102 | |
| TetO-Ng2-Puro | Addgene | 52047 | |
| VSV-G | Addgene | 12259 |
References
- Pelvig, D. P., Pakkenberg, H., Stark, A. K., Pakkenberg, B. Neocortical glial cell numbers in human brains. Neurobiology of Aging. 29 (11), 1754-1762 (2008).
- Barres, B. A. The mystery and magic of glia: a perspective on their roles in health and disease. Neuron. 60 (3), 430-440 (2008).
- De Strooper, B., Karran, E. The cellular phase of Alzheimer's disease. Cell. 164 (4), 603-615 (2016).
- Monje, M. Myelin plasticity and nervous system function. Annual Review of Neuroscience. 41, 61-76 (2018).
- Hughes, E. G., Orthmann-Murphy, J. L., Langseth, A. J., Bergles, D. E. Myelin remodeling through experience-dependent oligodendrogenesis in the adult somatosensory cortex. Nature Neuroscience. 21 (5), 696-706 (2018).
- Gibson, E. M., et al. Neuronal activity promotes oligodendrogenesis and adaptive myelination in the mammalian brain. Science. 344 (6183), 1252304 (2014).
- Pan, S., Mayoral, S. R., Choi, H. S., Chan, J. R., Kheirbek, M. A. Preservation of a remote fear memory requires new myelin formation. Nature Neuroscience. 23 (4), 487-499 (2020).
- Thornton, M. A., Hughes, E. G. Neuron-oligodendroglia interactions: Activity-dependent regulation of cellular signaling. Neuroscience Letters. 727, 134916 (2020).
- Ettle, B., Schlachetzki, J. C. M., Winkler, J. Oligodendroglia and myelin in neurodegenerative diseases: more than just bystanders. Molecular Neurobiology. 53 (5), 3046-3062 (2016).
- Essayan-Perez, S., Zhou, B., Nabet, A. M., Wernig, M., Huang, Y. A. Modeling Alzheimer's disease with human iPS cells: advancements, lessons, and applications. Neurobiology of Disease. 130, 104503 (2019).
- Li, L., et al. GFAP mutations in astrocytes impair oligodendrocyte progenitor proliferation and myelination in an hiPSC model of Alexander disease. Cell Stem Cell. 23 (2), 239-251 (2018).
- Lin, Y. T., et al. APOE4 causes widespread molecular and cellular alterations associated with Alzheimer's disease phenotypes in human iPSC-derived brain cell types. Neuron. 98 (6), 1294 (2018).
- TCW, J., et al. Cholesterol and matrisome pathways dysregulated in human APOE ε4 glia. bioRxiv. , (2019).
- Ang, C. E., Wernig, M. Induced neuronal reprogramming. Journal of Comparitive Neurology. 522 (12), 2877-2886 (2014).
- Penney, J., Ralvenius, W. T., Tsai, L. H. Modeling Alzheimer's disease with iPSC-derived brain cells. Molecular Psychiatry. 25 (1), 148-167 (2020).
- Zhang, Y., et al. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 78 (5), 785-798 (2013).
- Huang, Y. A., Zhou, B., Nabet, A. M., Wernig, M., Sudhof, T. C. Differential signaling mediated by ApoE2, ApoE3, and ApoE4 in human neurons parallels Alzheimer's Disease risk. Journal of Neuroscience. 39 (37), 7408-7427 (2019).
- Huang, Y. A., Zhou, B., Wernig, M., Sudhof, T. C. ApoE2, ApoE3, and ApoE4 Differentially Stimulate APP Transcription and Abeta Secretion. Cell. 168 (3), 427-441 (2017).
- Yang, N., et al. Generation of oligodendroglial cells by direct lineage conversion. Nature Biotechnology. 31 (5), 434-439 (2013).
- Douvaras, P., et al. Efficient generation of myelinating oligodendrocytes from primary progressive multiple sclerosis patients by induced pluripotent stem cells. Stem Cell Reports. 3 (2), 250-259 (2014).
- Lee, E. H., Park, C. H. Comparison of reprogramming methods for generation of induced-oligodendrocyte precursor cells. Biomolecules & Therapeutics (Seoul). 25 (4), 362-366 (2017).
- Ehrlich, M., et al. Rapid and efficient generation of oligodendrocytes from human induced pluripotent stem cells using transcription factors. Proceedings of the National Academy of Sciences of the United States of America. 114 (11), 2243-2252 (2017).
- Rodrigues, G. M. C., et al. Defined and scalable differentiation of human oligodendrocyte precursors from pluripotent stem cells in a 3D culture system. Stem Cell Reports. 8 (6), 1770-1783 (2017).
- Hu, B. Y., Du, Z. W., Li, X. J., Ayala, M., Zhang, S. C. Human oligodendrocytes from embryonic stem cells: conserved SHH signaling networks and divergent FGF effects. Development. 136 (9), 1443-1452 (2009).
- Izrael, M., et al. Human oligodendrocytes derived from embryonic stem cells: Effect of noggin on phenotypic differentiation in vitro and on myelination in vivo. Molecular and Cellular Neuroscience. 34 (3), 310-323 (2007).
- Yamashita, T., et al. Differentiation of oligodendrocyte progenitor cells from dissociated monolayer and feeder-free cultured pluripotent stem cells. PLoS One. 12 (2), 0171947 (2017).
- Wang, S., et al. Human iPSC-derived oligodendrocyte progenitor cells can myelinate and rescue a mouse model of congenital hypomyelination. Cell Stem Cell. 12 (2), 252-264 (2013).
- Chanoumidou, K., Mozafari, S., Baron-Van Evercooren, A., Kuhlmann, T. Stem cell derived oligodendrocytes to study myelin diseases. Glia. 68 (4), 705-720 (2020).
- Chetty, S., et al. A simple tool to improve pluripotent stem cell differentiation. Nature Methods. 10 (6), 553-556 (2013).
- Li, J., et al. A transient DMSO treatment increases the differentiation potential of human pluripotent stem cells through the Rb family. PLoS One. 13 (12), 0208110 (2018).
- Sambo, D., Li, J., Brickler, T., Chetty, S. Transient treatment of human pluripotent stem cells with DMSO to promote differentiation. Journal of Visualized Experiments: JoVE. (149), (2019).
- Douvaras, P., Fossati, V. Generation and isolation of oligodendrocyte progenitor cells from human pluripotent stem cells. Nature Protocols. 10 (8), 1143-1154 (2015).
- Mei, F., et al. Micropillar arrays as a high-throughput screening platform for therapeutics in multiple sclerosis. Nature Medicine. 20 (8), 954-960 (2014).
- Madhavan, M., et al. Induction of myelinating oligodendrocytes in human cortical spheroids. Nature Methods. 15 (9), 700-706 (2018).
- Zhang, Y., et al. Purification and characterization of progenitor and mature human astrocytes reveals transcriptional and functional differences with mouse. Neuron. 89 (1), 37-53 (2016).
- Grubman, A., et al. A single-cell atlas of entorhinal cortex from individuals with Alzheimer's disease reveals cell-type-specific gene expression regulation. Nature Neuroscience. 22 (12), 2087-2097 (2019).
- Goldman, S. A., Kuypers, N. J. How to make an oligodendrocyte. Development. 142 (23), 3983-3995 (2015).
- Behrendt, G., et al. Dynamic changes in myelin aberrations and oligodendrocyte generation in chronic amyloidosis in mice and men. Glia. 61 (2), 273-286 (2013).
- Patzke, C., et al. Neuromodulator signaling bidirectionally controls vesicle numbers in human synapses. Cell. 179 (2), 498-513 (2019).
- Piao, J., et al. Human embryonic stem cell-derived oligodendrocyte progenitors remyelinate the brain and rescue behavioral deficits following radiation. Cell Stem Cell. 16 (2), 198-210 (2015).
- Keirstead, H. S., et al. Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury. Journal of Neuroscience. 25 (19), 4694-4705 (2005).
- Kim, D. S., et al. Rapid generation of OPC-like cells from human pluripotent stem cells for treating spinal cord injury. Experimental & Molecular Medicine. 49 (7), 361 (2017).
Erratum
Formal Correction: Erratum: Generation of Human Neurons and Oligodendrocytes from Pluripotent Stem Cells for Modeling Neuron-Oligodendrocyte Interactions
Posted by JoVE Editors on 12/29/2020. Citeable Link.
An erratum was issued for: Generation of Human Neurons and Oligodendrocytes from Pluripotent Stem Cells for Modeling Neuron-Oligodendrocyte Interactions. The Representative Results section has been updated.
Figure 3 was updated from:
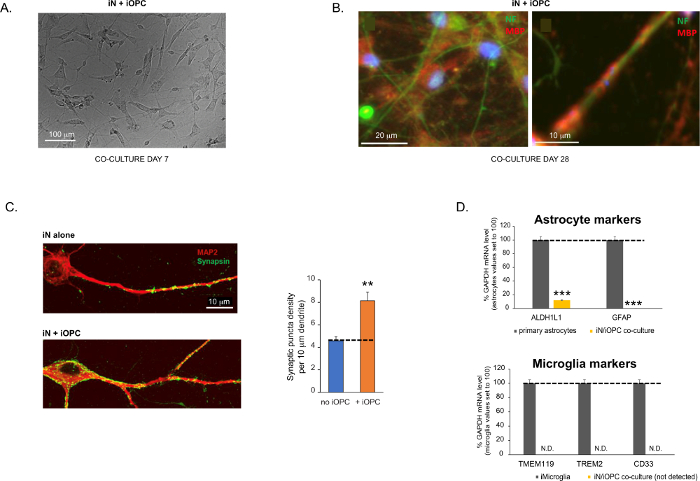
Figure 3: Co-culture of iNs and iOPCs. (A) Representative bright field image of co-cultured iNs and iOPCs at Day 7, showing a proper density for further maturation. (B) Representative immunofluorescence image of iNs and iOPCs co-cultured for 28 days. Axonal marker neurofilament NF is shown in green and oligodendrocytic marker MBP in red. Right, a segment of iN axon ensheathed by iOL process (MBP+). (C) Synapse formation assayed in 4-week-old co-cultures. Cells were stained for Synapsin 1 (Syn1, green) and MAP2 (red), and synaptic puncta were quantified by confocal analysis of density along the dendritic segments as described17,18. (D) In our co-cultures of iNs and iOPCs (7 days of co-culturing), the expression of astrocyte markers, ALDHL1 and GFAP, is minimal (top), and the expression of microglia markers, TMEM119, TREM2, and CD33, is not detected (N.D.) by qPCR. The contamination from these two glial cell types is thus excluded. Please click here to view a larger version of this figure.
to:
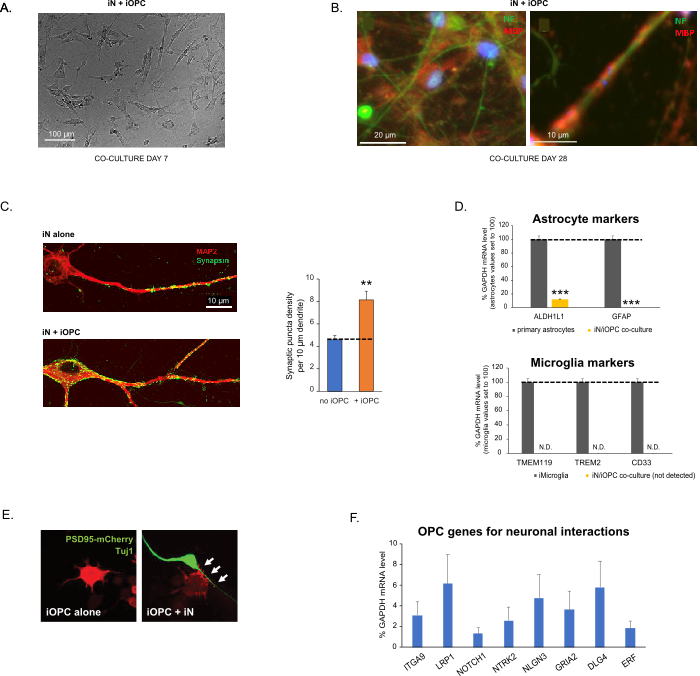
Figure 3: Co-culture of iNs and iOPCs. (A) Representative bright field image of co-cultured iNs and iOPCs at Day 7, showing a proper density for further maturation. (B) Representative immunofluorescence image of iNs and iOPCs co-cultured for 28 days. Axonal marker neurofilament NF is shown in green and oligodendrocytic marker MBP in red. Right, a segment of iN axon ensheathed by iOL process (MBP+). (C) Synapse formation assayed in 4-week-old co-cultures. Cells were stained for Synapsin 1 (Syn1, green) and MAP2 (red), and synaptic puncta were quantified by confocal analysis of density along the dendritic segments as described17,18. (D) In our co-cultures of iNs and iOPCs (7 days of co-culturing), the expression of astrocyte markers, ALDHL1 and GFAP, is minimal (top), and the expression of microglia markers, TMEM119, TREM2, and CD33, is not detected (N.D.) by qPCR. The contamination from these two glial cell types is thus excluded. (E) Coculturing iOPC with iN leads to the formation of neuron-OPC synapses. The fluorescence-tagged post-synaptic marker PSD95-mCherry is expressed only in OPCs, and display a diffuse pattern in single cultures (left) but aggregate to form puncta in cocultures (right, indicated by arrows; Tuj1, neuronal marker). (F) The expression of well-characterized oligodendroglial genes that can sense and respond to neuronal activities in the pure cultures of iOPCs at Day 14. Please click here to view a larger version of this figure.
The fourth paragraph was updated from:
Co-culturing of iNs and iOPCs
This protocol is optimized specifically for co-culturing iNs and iOPCs and allow our real-time monitoring of the inter-cellular communications between these two cell types along the course of neural development. The ideal plating densities for both cell types need to be decided with a series of cell number titration to achieve proper differentiation (Figure 3A). After 4 weeks in co-cultures, the iOPCs are expected to be adequately differentiated into OLs that are positive for specific markers such as MBP and extend processes to ensheath axons (Figure 3B). The co-culture system can robustly boost up the number of synapses, indicating that the iOPCs provide a neuronal support through physical contacts or release of trophic factors (Figure 3C). We can maintain the co-cultures in acceptable health condition for up to 6 weeks and observe that the synapse number and other neuronal attributes plateau around the fifth week. Of note, astrocytes and microglia are not present in our preparations and their absence can be documented by checking the expression of specific markers (Figure 3D).
to:
Co-culturing of iNs and iOPCs
This protocol is optimized specifically for co-culturing iNs and iOPCs and allow our real-time monitoring of the inter-cellular communications between these two cell types along the course of neural development. The ideal plating densities for both cell types need to be decided with a series of cell number titration to achieve proper differentiation (Figure 3A). After 4 weeks in co-cultures, the iOPCs are expected to be adequately differentiated into OLs that are positive for specific markers such as MBP and extend processes to ensheath axons (Figure 3B). The co-culture system can robustly boost up the number of synapses, indicating that the iOPCs provide a neuronal support through physical contacts or release of trophic factors (Figure 3C). We can maintain the co-cultures in acceptable health condition for up to 6 weeks and observe that the synapse number and other neuronal attributes plateau around the fifth week. Of note, astrocytes and microglia are not present in our preparations and their absence can be documented by checking the expression of specific markers (Figure 3D). The iOPCs express a good number of well-characterized genes that can potentially respond to and mediate the activity-dependent signals from neighboring neurons, in a paracrine (e.g. neurotrophins and metabolites) and/or a synaptic manner (Figure 3E and 3F).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved