このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
多能性幹細胞からのヒト神経細胞および希突起膠細胞の作製によるニューロン-希突起膠細胞相互作用のモデル化
* これらの著者は同等に貢献しました
Erratum Notice
要約
神経変性におけるニューロンとグリアの相互作用は、ツールや方法が不十分なため、よく理解されていません。ここでは、ヒト多能性幹細胞から誘導されたニューロン、希突起膠細胞前駆細胞、および希突起膠細胞を取得するための最適化されたプロトコルについて説明し、アルツハイマー病における細胞種特異的な寄与を理解する上でのこれらの方法の価値の例を提供します。
要約
アルツハイマー病(AD)やその他の神経変性疾患では、希突起膠障害は一般的な初期の病理学的特徴ですが、特に脳の灰白質において、それが疾患の発症と進行にどのように寄与するかはほとんど不明のままです。希突起膠細胞系譜細胞の機能不全は、髄鞘形成の欠損および希突起膠細胞前駆細胞(OPC)の自己複製障害によって特徴付けられる。これらの2つの欠陥は、病理学の蓄積に沿ったニューロンと希突起膠細胞の間の相互作用の混乱によって少なくとも部分的に引き起こされます。OPCは、CNSの発生中に有髄性希突起膠細胞を生じさせる。成熟した脳皮質では、OPCは主要な増殖細胞(全脳細胞の~5%を占める)であり、神経活動依存的に新しいミエリン形成を制御します。このようなニューロンから希突起膠細胞へのコミュニケーションは、適切なツールがないため、特にADなどの神経変性状態の状況では、かなり研究されていません。近年、私たちのグループなどは、ヒト多能性幹細胞から機能的なニューロンと希突起膠細胞を個別に生成するために、現在利用可能なプロトコルを改善するための大きな進歩を遂げました。本稿では、ニューロン-希突起膠細胞結合をモデル化するための共培養システムの確立など、最適化された手順について説明します。私たちの実例となる結果は、OPC /希突起膠細胞が脳アミロイドーシスとシナプスの完全性に予想外の寄与をしていることを示唆しており、AD研究におけるこの方法論の有用性を強調しています。この還元主義的アプローチは、脳内の固有の複雑さから特定のヘテロ細胞相互作用を分析するための強力なツールです。ここで説明するプロトコルは、神経変性の病因における希突起膠原欠陥に関する将来の研究を促進することが期待されます。
概要
希突起膠細胞前駆細胞(OPC)、有髄性希突起膠細胞、およびその間の移行型を含む希突起膠細胞系譜細胞は、ヒト脳細胞の主要なグループを構成しています1神経発達と老化を通して中枢神経系の適切な操作と維持のための多くの重要な機能に積極的に関与しています2,3,4.希突起膠細胞は、白質のニューロン活動伝達を促進し、軸索の健康をサポートするミエリンを産生することでよく知られていますが、OPCは髄鞘形成がほとんどない灰白質に豊富(~5%)存在し、学習行動と記憶形成を制御する活動依存性シグナル伝達機能を実行します5,6,7,8 .アルツハイマー病(AD)やその他の加齢に伴う神経変性状態の病因における希突起膠細胞がどのように機能し、機能不全になるかは十分に研究されていません9。適切なモデルシステムの不十分さと、実験の道を前進させるための一般的な知識の不足が、このギャップの主な理由です。
胚性幹(ES)および人工多能性幹(iPS)細胞を含む多能性幹細胞からヒト脳細胞を誘導する最新のブレークスルーに照らして、そのような細胞モデルは、最新の遺伝子編集ツールと組み合わせて、脳内の細胞相互作用の複雑なネクサスを処理するための堅牢なツールとして浮上しており、ヒト特異的な疾患症状を実証することができます10。11.個々の脳細胞タイプは、同じAD促進条件に直面しても明確で相反する効果を示す可能性があることを考慮すると12,13、この幹細胞方法論は、脳細胞タイプのコレクションからの集計読み取りのみを提供する確立されたin vivoまたはin vitroモデルを使用して以前に見逃されていた細胞タイプ固有の情報を独自に提供します。過去10年間で、ES/iPS細胞の分化形質転換または他の最終分化細胞タイプ(線維芽細胞など)からの直接変換からヒトニューロンを生成するために、多くの信頼性の高いプロトコルが開発されてきました14,15。特に、重要な神経原性転写因子(例えば、ニューロゲニン2、Ngn2)16をヒト多能性幹細胞に適用することで、グリア細胞との共培養を必要とせずに、純粋培養用の十分に特徴付けられた神経細胞タイプの均質な集団を生成することができます12、17、18。誘導されたヒト希突起膠細胞については、主要な対応物に非常に類似した機能細胞を生成できるいくつかの公開されたプロトコルがあり、時間とリソースにおいて幅広い効率と需要があります19,20,21,22,23,24,25,26,27,28 .今日まで、これらのプロトコルのいずれも、希突起膠細胞がどのように応答し、AD病因に影響を与えるかを調査するために適用されていません。
ここでは、ヒト誘導ニューロン(iN)およびOPC/希突起膠細胞(iOPC / iOL)の単一および混合培養のための改善されたプロトコルについて説明します。ここで説明するiNプロトコルは、広く使用されているNgn2アプローチ16に基づいており、グリアフリーであるという追加的な特徴を有する。得られたiNは均質で、皮質層の2/3興奮性ニューロンに非常に似ており、特徴的な錐体形態、遺伝子発現パターン、および電気生理学的特徴を備えています17,18(図1)。多能性幹細胞の指向性分化における基本的な障壁のいくつかを克服するために、我々は、低用量ジメチルスルホキシド(DMSO)前処理の簡単で効果的な方法を開発し29,30、そしてDouvarasとFossati 32によって広く適応されたプロトコルに基づいて、ヒトES/iPS細胞がiOPCとiOLに分化形質転換する傾向が高まったことを報告しました31。.プロトコルをさらに簡素化し、強力な分化促進化合物であるクレマスチン7,33,34を組み込んで、希突起膠の成熟プロセスを加速しました。その結果(図2)、iOPCは2週間で生成され(マーカーO4に対して~95%陽性)、iOLは4週間で生成されます(成熟マーカーMBPおよびPLP1を発現)。興味深いことに、iOPC単独では顕著な量のアミロイドβ(Aβ)を分泌し、希突起膠細胞系統細胞におけるアミロイド前駆体タンパク質(APP)およびプロセシングプロテアーゼβセクレターゼ(BACE1)の豊富な発現を示す独立したトランスクリプトームデータと一致しています35,36。さらに、当社のiN-iOPC共培養システムは、MBP陽性iOLプロセスによる軸索の被覆を促進し、シナプス形成を大いにサポートします(図3)。したがって、以下に詳述するプロトコルは、以前にカタログ化されたニューロン-オリゴデンドログリア共培養法に比べて技術的および生物学的利点があり、ADにおける神経変性をより適切にモデル化する上で有望です。
プロトコル
1. ヒト多能性幹細胞からのヒトニューロン誘導
- レンチウイルス調製(~5日、前述の詳細なプロトコル16)
- 各T75フラスコに~100万個のHEK293T細胞をプレートし、トランスフェクションを行う際にそれらを~40%コンフルエントにさせる。テトラサイクリン誘導性Ngn2およびピューロマイシン耐性遺伝子(PuroR;同じTetOプロモーター制御下)、rtTA、および3つのヘルパープラスミドpRSV-REV、pMDLg/pRRE、およびVSV-G(レンチウイルスベクターDNA12 μgおよびヘルパープラスミドDNAのそれぞれ6 μg)を発現するプラスミドをトランスフェクトします。レンチウイルス調製物ごとに少なくとも3つのフラスコを準備します。トランスフェクションには、製造元の指示に従ってPEIを使用してください。16時間後にメディアを交換し、廃棄します。
- 毎日培地を採取して放出されたウイルス粒子を収穫し、3日間新鮮な培地と交換します。精製のためにウイルス粒子を含む収集された培地をプールします。ウイルスを0.22 μmのフィルターでろ過し、49,000 x g で90分間遠心分離します。ペレットを適切な容量のPBSグルコース(~150 μL)に再懸濁します。
- ニューロン誘導(~5日)
注:この導入プロトコル(図1A;フロー図)は、検証済みの多能性(十分に特徴付けられた多能性マーカーの免疫組織化学染色によってアッセイできる)のiPS細胞とES細胞の両方に非常に効果的です。 図1B)。- 52の継代で市販のH1ヒトES細胞を使用する(材料の表を参照)。ES細胞維持培地(材料の表を参照)を使用して、細胞外マトリックス溶液コーティングされた6ウェルプレート(6ウェルプレートあたり~0.5 mgのマトリックス溶液;材料の表を参照)で細胞を培養し、プレートを5%CO2で37°Cでインキュベートします。
- -2日目に、ES細胞(80%コンフルエント)を1 mLの細胞剥離溶液( 材料の表を参照)で分離し、室温で10分間インキュベートします。細胞をチューブに移します。ウェルを2 mLの培地で洗浄し、同じチューブ内で混ぜ合わせます。300 x g で5分間遠心分離し、ペレットを培地に再懸濁し、細胞をマトリックスコーティングされた6ウェルプレートに1ウェルあたり1 x 105 細胞の播種密度でプレートします。
- 1日目に、Ngn2とPuroRおよびrtTAを発現するレンチウイルスをポリブレン(8 μg/ ml)とともに、新鮮なES細胞維持培地のES細胞に追加します( 材料の表を参照)。ウイルスの正確な量は、実際の力価または滴定によって決定する必要があります。通常、6ウェルプレートにウェルあたり5 μLの各ウイルスを追加します。
- 0日目に、モルフォゲンを含まないN2サプリメントを含むDMEM-F12培地にドキシサイクリン(2 μg / mL、Ngn2発現を活性化)を追加します。.
- 1日目に、DMEM-F12とN2およびドキシサイクリンを加えた新鮮な培地にピューロマイシンを最終濃度1μg/mL培地まで加えます。ウイルス力価が低い場合、形質導入不足の細胞を適切に除去するには、より高いピューロマイシン濃度(最大5 μg / mL)とより長い選択期間(最大48時間)が必要になる場合があります。
- 2日目に、分化ニューロンを細胞剥離溶液(材料の表を参照)で剥離し、マトリックス溶液でコーティングされた24ウェルプレート(80,000〜200,000細胞/ウェル)に再プレートし(材料の表を参照)、ドキシサイクリンを含まないNBA / B27培地に維持します。播種密度は重要です。
- この段階で、剥離したニューロンは、特殊な市販の凍結媒体( 材料の表を参照)で凍結し、液体窒素中で最大3ヶ月間保存することができます。純粋なニューロンは、融解後の典型的な~15%~20%の細胞死を占めるプレーティング、単独で培養するか、他の脳細胞タイプと共培養することができます(OPCとの共培養については、ステップ3.2.3を参照してください)。
- メーカーの指示に従って、細胞外マトリックスベースの溶液でコーティングされたプレート上で純粋なiNを培養します( 材料の表を参照)。特徴的な錐体形態は、4日目(および6日目; 図1C)。シナプス形成は早くも14日目から16日目に検出でき、標準的なシナプス前およびシナプス後マーカーによる免疫組織化学的染色によって24日目に顕著になります。(図1D;シナプス前マーカーSynapsin 1および樹状突起マーカーMap2で標識)。
2. 多能性幹細胞からのヒト希突起膠細胞前駆細胞(OPC)の誘導と希突起膠細胞の成熟
- 神経前駆細胞(NPC)の生成:単層プロトコル(~7日)。フロー図については 、図 2A を参照してください。
- 前述のようにH1ヒトES細胞を培養し(ステップ1.2.1を参照)、複数のシグナル伝達経路に対する低分子阻害剤を用いて、デュアルSMADiと呼ばれる確立されたアプローチによって神経前駆細胞(NPC)に分化形質転換します。ここでは、広く受け入れられている商用キットを使用し、メーカーが提供する単層プロトコルに従います(材料表を参照)。
- -1日目に、ES細胞維持培地(材料表を参照;6ウェルプレートあたり~0.5 mgのマトリックス溶液)でコーティングした6ウェルプレートに、ウェルあたり0.5–1 x 106細胞をプレートします(材料の表を参照)。この成長因子低減マトリックス溶液は、次のステップで使用されるすべてのプレートをコーティングするために使用されます。
- 0日目に、2%DMSOを添加したES細胞維持培地( 材料の表を参照)で細胞を24時間処理します。
- 1〜6日目に、市販のキットのSMAD阻害剤を含む温かい(37°C)神経誘導培地でフル培地を交換します( 材料の表を参照)。細胞が分裂して7日目までにコンフルエントに達した場合は、ステップ2.1.2で前述したように、播種密度0.5–1 x 106に細胞を継代します。
- 7日目に、細胞剥離溶液( 材料の表を参照)を使用してNPCを継代し、24ウェルプレートの1〜2 x 105 細胞/ウェルの播種密度でプレートします。
- 多能性マーカー、例えばOCT4の非存在下、およびPAX6、Nestin、およびSox1などのNPCマーカーの存在について、免疫組織化学(IHC)染色による分化効率をアッセイする。
- この段階で、分離されたNPCは、特殊な商用NPC凍結媒体( 材料表を参照)で凍結し、液体窒素で最大3か月間保存できます。一度凍結融解した後も、NPCは多能性を保持し、信頼性の高いプロトコルでニューロン、星状細胞、およびOPCを生み出します。
- 希突起膠細胞前駆細胞(OPC)の生成(~7日)。フロー図については 、図2A を参照してください。
- 7日目に、細胞剥離溶液(材料の表を参照)を使用してNPCを継代し、市販のキット(材料の表を参照)の温かい(37°C)神経誘導培地とSMAD阻害剤の24ウェルプレートに1ウェルあたり1〜2 x10 5細胞の播種密度でプレートします。
- 8日目に、OPC分化培地中の1%DMSOの溶液を調製し、播種したNPCを24時間処理します。OPC分化培地は、DMEM/F12培地、1%N2サプリメント、1%B27サプリメント、20 ng/mLのbFGF、1 μMのSAG、10 ng/mLのPDGF-AAで構成されています( 材料の表を参照)。
- 9日目に、培地をDMSOを含まない新鮮なOPC分化培地と交換します。15日目まで一日おきに細胞に餌をやる。細胞が15日目より前にコンフルエントに達した場合は、ステップ2.2.1で説明されているように、ウェルあたり1〜2 x 105 細胞の播種密度まで継代します。
- 14日目に、OPC分化培地中のOPCを1〜2 x 105 細胞/ウェルの密度で24ウェルプレートにプレートします。
- この段階(15日目)で、IHC染色またはqPCRによるOPC特異的マーカーの存在について細胞を試験します(例:.、O4、Olig1 / 2、CSPG4 / Ng2、NKX2.2、PDGFRa; 図2B)NPCマーカーがない場合(Pax6またはネスチン; 図2D)。通常、15日目に95%以上の細胞でO4免疫反応性を検出します。アルツハイマー病に特に関連するのは、 APP (アミロイド前駆体タンパク質)、 BACE1 (プロセシングプロテアーゼβ-secreatase 1)、およびペプチドアミロイドβ(Aβ)の発現がOPCに豊富にあることです(図2F)。
- 希突起膠細胞(OL)の成熟(~7-20日)
- 15日目に、培地をOL成熟培地(ニューロバサルA培地、2%B27サプリメント、1 μM cAMP、200 ng/mL T3トリヨードチロニン、および1 μMのクレマスチン)と交換します( 材料の表を参照)。必要に応じて、隔日または毎日培地を交換してください。
- 細胞が90%のコンフルエントに達したら、1:3の比率で最大2継代まで、または細胞分裂が大幅に遅くなるまで分割します。OPCの分裂が速すぎて3日以内にコンフルエントに達する場合は、Ara-C( 材料の表を参照)を2〜5 μMの濃度で1〜3日間添加します。活発な増殖は成熟効率の低下を示す。
- OLマーカー(例えば、CLDN11、PLP1、MBP)の発現をqPCR、IHC染色またはイムノブロッティングによって評価することにより、希突起膠の成熟の効率を調べます。非常に複雑な構造の特徴的な形態(図2C)とOLマーカーの発現(図2E)は、28日目までに容易に検出できるはずです。
3. ヒト誘導神経細胞(iN)と希突起膠細胞前駆細胞(iOPC)の共培養
- iOPCメッキ(~3日)
- 14日目にiOPCを1ウェルあたり1 x 105 細胞の密度で、OPC分化培地中の24ウェルプレート(ステップ2.2.4で説明したように)でプレートします。
- iN-iOPCコカルチャーのセットアップ
- 15日目に、ピューロマイシン選択後の2日目のステップ(ステップ1.2.6に記載)で誘導されたヒトニューロンを細胞剥離溶液で分離する( 材料の表を参照)。
- 培養OPCにニューロンを追加し、増殖するOPCを含む24ウェルプレートにウェルあたり2 x 105 細胞の播種密度でプレーティングします(ステップ3.1.1から)。ニューロバサルA培地、2%B27サプリメント、および100 ng/mL T3トリヨードチロニンを含む共培養培地を使用してください。翌日に培地を交換し、その後は隔日に培地を交換してください。OPCの増殖が速すぎて3日以内にコンフルエントに達する場合は、Ara-Cを2〜5 μMの濃度で添加します。共培養7日後のニューロンで増殖したiNsとiOPCsの代表的な画像を 図3Aに示す。
- OPCとの共培養のために、ステップ1.2.7で上記のように調製した凍結ニューロンを使用します。凍結融解ニューロンを、ウェルあたり3 x 105 細胞の高密度でプレートします。
- 共培養の14〜16日目以降は、シナプス前およびシナプス後のマーカーのIHC染色によってiNのシナプス形成を観察することができ、21日目までにシナプス点状突起が豊富になり(図3C)、ニューロン活動を確実に記録できます。
- 21日目から、OL特異的マーカー(MBPやPLP1など)について細胞をテストします。28日目までに、通常、iOLプロセスによるiN軸索の被覆現象を観察し、特定のマーカーについてIHC染色によって標識します(図3B;iN軸索の場合はニューロフィラメントNF、iOPCプロセスの場合はMBP)。
結果
ヒト多能性幹細胞からのヒト誘導神経細胞の直接生成
出発ヒト多能性幹細胞がiNまたはiOPC / iOLの生成を成功させるために高度な多能性を示すことは非常に重要です。したがって、本稿に記載されている誘導プロトコルのいずれかを開始する前に、Oct4やSOX2などの特定のマーカーについて細胞を染色する必要があります(図1A)。ヒトH1細胞を用いて、Zhangらに...
ディスカッション
希突起膠細胞系譜細胞は、シナプス構造を安定化させ、髄鞘形成による塩状シグナル伝導を促進するための物理的および代謝的サポートに加えて、ニューロンとの迅速かつ動的なクロストークを介してニューロン活動パターンを形成することができます5,6,7。AD病理学では、オリゴデンドログリア応答は当初、炎症と酸化?...
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、国立衛生研究所(R00 AG054616からYAHおよびT32 GM136566からK.C.)、スタンフォード大学医学部、およびシーベルフェローシップ(SCに授与)からの助成金によってサポートされました。Y.A.H.は、ブラウントランスレーショナルサイエンス研究所のトランスレーショナルニューロサイエンスセンターのGFLトランスレーショナル教授です。
資料
| Name | Company | Catalog Number | Comments |
| Accutase | STEMCELL Technologies | 7920 | |
| B27 supplement | ThermoFisher | 17504044 | |
| bFGF | ThermoFisher | PHG 0266 | |
| cAMP | MilliporeSigma | A9501 | |
| Clemastine | MilliporeSigma | SML0445 | |
| DMEM/F12 medium | STEMCELL Technologies | 36254 | |
| DMSO | ThermoFisher | D12345 | |
| Doxycycline | MilliporeSigma | D3072 | |
| Fetal Bovine Serum | ScienCell | 10 | |
| H1 human ES cells | WiCell | WA01 | |
| Matrigel | Corning | 354234 | |
| mTeSR plus | STEMCELL Technologies | 5825 | |
| N2 supplement | ThermoFisher | 17502001 | |
| Neurobasal A medium | ThermoFisher | 10888-022 | |
| Non Essential Amino Acids | ThermoFisher | 11140-050 | |
| PDGF-AA | R&D Systems | 221-AA-010 | |
| PEI | VWR | 71002-812 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polybrene | MilliporeSigma | TR-1003-G | |
| pRSV-REV | Addgene | 12253 | |
| Puromycin | ThermoFisher | A1113803 | |
| ROCK Inhibitor Y-27632 | STEMCELL Technologies | 72302 | |
| SAG | Tocris | 4366 | |
| STEMdiff Neural Progenitor Freezing Media | STEMCELL Technologies | 5838 | |
| STEMdiff SMADi Neural Induction Kit | STEMCELL Technologies | 8581 | |
| T3 triiodothyronine | MilliporeSigma | T6397 | |
| Tempo-iOlogo: Human iPSC-derived OPCs | Tempo BioScience | SKU102 | |
| TetO-Ng2-Puro | Addgene | 52047 | |
| VSV-G | Addgene | 12259 |
参考文献
- Pelvig, D. P., Pakkenberg, H., Stark, A. K., Pakkenberg, B. Neocortical glial cell numbers in human brains. Neurobiology of Aging. 29 (11), 1754-1762 (2008).
- Barres, B. A. The mystery and magic of glia: a perspective on their roles in health and disease. Neuron. 60 (3), 430-440 (2008).
- De Strooper, B., Karran, E. The cellular phase of Alzheimer's disease. Cell. 164 (4), 603-615 (2016).
- Monje, M. Myelin plasticity and nervous system function. Annual Review of Neuroscience. 41, 61-76 (2018).
- Hughes, E. G., Orthmann-Murphy, J. L., Langseth, A. J., Bergles, D. E. Myelin remodeling through experience-dependent oligodendrogenesis in the adult somatosensory cortex. Nature Neuroscience. 21 (5), 696-706 (2018).
- Gibson, E. M., et al. Neuronal activity promotes oligodendrogenesis and adaptive myelination in the mammalian brain. Science. 344 (6183), 1252304 (2014).
- Pan, S., Mayoral, S. R., Choi, H. S., Chan, J. R., Kheirbek, M. A. Preservation of a remote fear memory requires new myelin formation. Nature Neuroscience. 23 (4), 487-499 (2020).
- Thornton, M. A., Hughes, E. G. Neuron-oligodendroglia interactions: Activity-dependent regulation of cellular signaling. Neuroscience Letters. 727, 134916 (2020).
- Ettle, B., Schlachetzki, J. C. M., Winkler, J. Oligodendroglia and myelin in neurodegenerative diseases: more than just bystanders. Molecular Neurobiology. 53 (5), 3046-3062 (2016).
- Essayan-Perez, S., Zhou, B., Nabet, A. M., Wernig, M., Huang, Y. A. Modeling Alzheimer's disease with human iPS cells: advancements, lessons, and applications. Neurobiology of Disease. 130, 104503 (2019).
- Li, L., et al. GFAP mutations in astrocytes impair oligodendrocyte progenitor proliferation and myelination in an hiPSC model of Alexander disease. Cell Stem Cell. 23 (2), 239-251 (2018).
- Lin, Y. T., et al. APOE4 causes widespread molecular and cellular alterations associated with Alzheimer's disease phenotypes in human iPSC-derived brain cell types. Neuron. 98 (6), 1294 (2018).
- TCW, J., et al. Cholesterol and matrisome pathways dysregulated in human APOE ε4 glia. bioRxiv. , (2019).
- Ang, C. E., Wernig, M. Induced neuronal reprogramming. Journal of Comparitive Neurology. 522 (12), 2877-2886 (2014).
- Penney, J., Ralvenius, W. T., Tsai, L. H. Modeling Alzheimer's disease with iPSC-derived brain cells. Molecular Psychiatry. 25 (1), 148-167 (2020).
- Zhang, Y., et al. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 78 (5), 785-798 (2013).
- Huang, Y. A., Zhou, B., Nabet, A. M., Wernig, M., Sudhof, T. C. Differential signaling mediated by ApoE2, ApoE3, and ApoE4 in human neurons parallels Alzheimer's Disease risk. Journal of Neuroscience. 39 (37), 7408-7427 (2019).
- Huang, Y. A., Zhou, B., Wernig, M., Sudhof, T. C. ApoE2, ApoE3, and ApoE4 Differentially Stimulate APP Transcription and Abeta Secretion. Cell. 168 (3), 427-441 (2017).
- Yang, N., et al. Generation of oligodendroglial cells by direct lineage conversion. Nature Biotechnology. 31 (5), 434-439 (2013).
- Douvaras, P., et al. Efficient generation of myelinating oligodendrocytes from primary progressive multiple sclerosis patients by induced pluripotent stem cells. Stem Cell Reports. 3 (2), 250-259 (2014).
- Lee, E. H., Park, C. H. Comparison of reprogramming methods for generation of induced-oligodendrocyte precursor cells. Biomolecules & Therapeutics (Seoul). 25 (4), 362-366 (2017).
- Ehrlich, M., et al. Rapid and efficient generation of oligodendrocytes from human induced pluripotent stem cells using transcription factors. Proceedings of the National Academy of Sciences of the United States of America. 114 (11), 2243-2252 (2017).
- Rodrigues, G. M. C., et al. Defined and scalable differentiation of human oligodendrocyte precursors from pluripotent stem cells in a 3D culture system. Stem Cell Reports. 8 (6), 1770-1783 (2017).
- Hu, B. Y., Du, Z. W., Li, X. J., Ayala, M., Zhang, S. C. Human oligodendrocytes from embryonic stem cells: conserved SHH signaling networks and divergent FGF effects. Development. 136 (9), 1443-1452 (2009).
- Izrael, M., et al. Human oligodendrocytes derived from embryonic stem cells: Effect of noggin on phenotypic differentiation in vitro and on myelination in vivo. Molecular and Cellular Neuroscience. 34 (3), 310-323 (2007).
- Yamashita, T., et al. Differentiation of oligodendrocyte progenitor cells from dissociated monolayer and feeder-free cultured pluripotent stem cells. PLoS One. 12 (2), 0171947 (2017).
- Wang, S., et al. Human iPSC-derived oligodendrocyte progenitor cells can myelinate and rescue a mouse model of congenital hypomyelination. Cell Stem Cell. 12 (2), 252-264 (2013).
- Chanoumidou, K., Mozafari, S., Baron-Van Evercooren, A., Kuhlmann, T. Stem cell derived oligodendrocytes to study myelin diseases. Glia. 68 (4), 705-720 (2020).
- Chetty, S., et al. A simple tool to improve pluripotent stem cell differentiation. Nature Methods. 10 (6), 553-556 (2013).
- Li, J., et al. A transient DMSO treatment increases the differentiation potential of human pluripotent stem cells through the Rb family. PLoS One. 13 (12), 0208110 (2018).
- Sambo, D., Li, J., Brickler, T., Chetty, S. Transient treatment of human pluripotent stem cells with DMSO to promote differentiation. Journal of Visualized Experiments: JoVE. (149), (2019).
- Douvaras, P., Fossati, V. Generation and isolation of oligodendrocyte progenitor cells from human pluripotent stem cells. Nature Protocols. 10 (8), 1143-1154 (2015).
- Mei, F., et al. Micropillar arrays as a high-throughput screening platform for therapeutics in multiple sclerosis. Nature Medicine. 20 (8), 954-960 (2014).
- Madhavan, M., et al. Induction of myelinating oligodendrocytes in human cortical spheroids. Nature Methods. 15 (9), 700-706 (2018).
- Zhang, Y., et al. Purification and characterization of progenitor and mature human astrocytes reveals transcriptional and functional differences with mouse. Neuron. 89 (1), 37-53 (2016).
- Grubman, A., et al. A single-cell atlas of entorhinal cortex from individuals with Alzheimer's disease reveals cell-type-specific gene expression regulation. Nature Neuroscience. 22 (12), 2087-2097 (2019).
- Goldman, S. A., Kuypers, N. J. How to make an oligodendrocyte. Development. 142 (23), 3983-3995 (2015).
- Behrendt, G., et al. Dynamic changes in myelin aberrations and oligodendrocyte generation in chronic amyloidosis in mice and men. Glia. 61 (2), 273-286 (2013).
- Patzke, C., et al. Neuromodulator signaling bidirectionally controls vesicle numbers in human synapses. Cell. 179 (2), 498-513 (2019).
- Piao, J., et al. Human embryonic stem cell-derived oligodendrocyte progenitors remyelinate the brain and rescue behavioral deficits following radiation. Cell Stem Cell. 16 (2), 198-210 (2015).
- Keirstead, H. S., et al. Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury. Journal of Neuroscience. 25 (19), 4694-4705 (2005).
- Kim, D. S., et al. Rapid generation of OPC-like cells from human pluripotent stem cells for treating spinal cord injury. Experimental & Molecular Medicine. 49 (7), 361 (2017).
Erratum
Formal Correction: Erratum: Generation of Human Neurons and Oligodendrocytes from Pluripotent Stem Cells for Modeling Neuron-Oligodendrocyte Interactions
Posted by JoVE Editors on 12/29/2020. Citeable Link.
An erratum was issued for: Generation of Human Neurons and Oligodendrocytes from Pluripotent Stem Cells for Modeling Neuron-Oligodendrocyte Interactions. The Representative Results section has been updated.
Figure 3 was updated from:
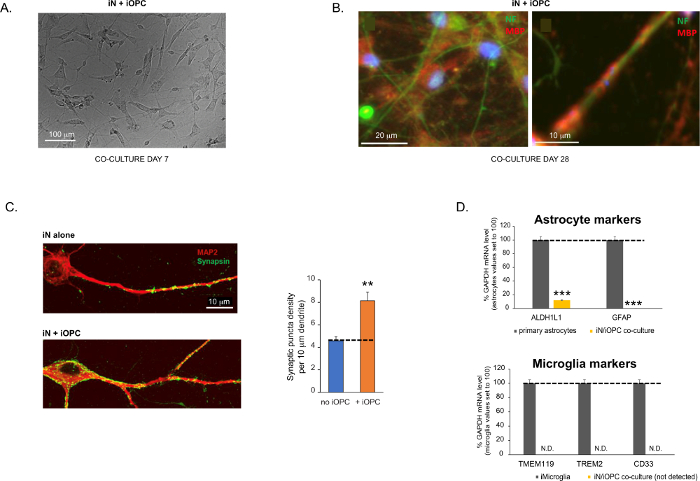
Figure 3: Co-culture of iNs and iOPCs. (A) Representative bright field image of co-cultured iNs and iOPCs at Day 7, showing a proper density for further maturation. (B) Representative immunofluorescence image of iNs and iOPCs co-cultured for 28 days. Axonal marker neurofilament NF is shown in green and oligodendrocytic marker MBP in red. Right, a segment of iN axon ensheathed by iOL process (MBP+). (C) Synapse formation assayed in 4-week-old co-cultures. Cells were stained for Synapsin 1 (Syn1, green) and MAP2 (red), and synaptic puncta were quantified by confocal analysis of density along the dendritic segments as described17,18. (D) In our co-cultures of iNs and iOPCs (7 days of co-culturing), the expression of astrocyte markers, ALDHL1 and GFAP, is minimal (top), and the expression of microglia markers, TMEM119, TREM2, and CD33, is not detected (N.D.) by qPCR. The contamination from these two glial cell types is thus excluded. Please click here to view a larger version of this figure.
to:
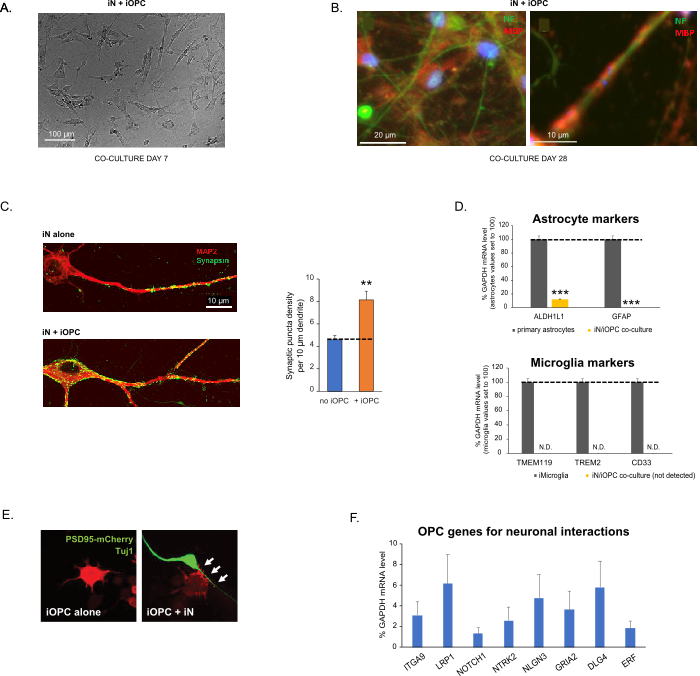
Figure 3: Co-culture of iNs and iOPCs. (A) Representative bright field image of co-cultured iNs and iOPCs at Day 7, showing a proper density for further maturation. (B) Representative immunofluorescence image of iNs and iOPCs co-cultured for 28 days. Axonal marker neurofilament NF is shown in green and oligodendrocytic marker MBP in red. Right, a segment of iN axon ensheathed by iOL process (MBP+). (C) Synapse formation assayed in 4-week-old co-cultures. Cells were stained for Synapsin 1 (Syn1, green) and MAP2 (red), and synaptic puncta were quantified by confocal analysis of density along the dendritic segments as described17,18. (D) In our co-cultures of iNs and iOPCs (7 days of co-culturing), the expression of astrocyte markers, ALDHL1 and GFAP, is minimal (top), and the expression of microglia markers, TMEM119, TREM2, and CD33, is not detected (N.D.) by qPCR. The contamination from these two glial cell types is thus excluded. (E) Coculturing iOPC with iN leads to the formation of neuron-OPC synapses. The fluorescence-tagged post-synaptic marker PSD95-mCherry is expressed only in OPCs, and display a diffuse pattern in single cultures (left) but aggregate to form puncta in cocultures (right, indicated by arrows; Tuj1, neuronal marker). (F) The expression of well-characterized oligodendroglial genes that can sense and respond to neuronal activities in the pure cultures of iOPCs at Day 14. Please click here to view a larger version of this figure.
The fourth paragraph was updated from:
Co-culturing of iNs and iOPCs
This protocol is optimized specifically for co-culturing iNs and iOPCs and allow our real-time monitoring of the inter-cellular communications between these two cell types along the course of neural development. The ideal plating densities for both cell types need to be decided with a series of cell number titration to achieve proper differentiation (Figure 3A). After 4 weeks in co-cultures, the iOPCs are expected to be adequately differentiated into OLs that are positive for specific markers such as MBP and extend processes to ensheath axons (Figure 3B). The co-culture system can robustly boost up the number of synapses, indicating that the iOPCs provide a neuronal support through physical contacts or release of trophic factors (Figure 3C). We can maintain the co-cultures in acceptable health condition for up to 6 weeks and observe that the synapse number and other neuronal attributes plateau around the fifth week. Of note, astrocytes and microglia are not present in our preparations and their absence can be documented by checking the expression of specific markers (Figure 3D).
to:
Co-culturing of iNs and iOPCs
This protocol is optimized specifically for co-culturing iNs and iOPCs and allow our real-time monitoring of the inter-cellular communications between these two cell types along the course of neural development. The ideal plating densities for both cell types need to be decided with a series of cell number titration to achieve proper differentiation (Figure 3A). After 4 weeks in co-cultures, the iOPCs are expected to be adequately differentiated into OLs that are positive for specific markers such as MBP and extend processes to ensheath axons (Figure 3B). The co-culture system can robustly boost up the number of synapses, indicating that the iOPCs provide a neuronal support through physical contacts or release of trophic factors (Figure 3C). We can maintain the co-cultures in acceptable health condition for up to 6 weeks and observe that the synapse number and other neuronal attributes plateau around the fifth week. Of note, astrocytes and microglia are not present in our preparations and their absence can be documented by checking the expression of specific markers (Figure 3D). The iOPCs express a good number of well-characterized genes that can potentially respond to and mediate the activity-dependent signals from neighboring neurons, in a paracrine (e.g. neurotrophins and metabolites) and/or a synaptic manner (Figure 3E and 3F).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved