É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Geração de neurônios humanos e oligodendrócitos a partir de células-tronco pluripotentes para modelagem de interações neurônio-oligodendrócitos
* Estes autores contribuíram igualmente
Neste Artigo
Erratum Notice
Resumo
As interações neurônio-glial na neurodegeneração não são bem compreendidas devido a ferramentas e métodos inadequados. Aqui, descrevemos protocolos otimizados para obter neurônios induzidos, células precursoras de oligodendrócitos e oligodendrócitos de células-tronco pluripotentes humanas e fornecemos exemplos dos valores desses métodos na compreensão das contribuições específicas do tipo celular na doença de Alzheimer.
Resumo
Na doença de Alzheimer (DA) e outros distúrbios neurodegenerativos, a falha oligodendroglial é uma característica patológica precoce comum, mas como ela contribui para o desenvolvimento e progressão da doença, particularmente na massa cinzenta do cérebro, permanece amplamente desconhecida. A disfunção das células da linhagem de oligodendrócitos é marcada por deficiências na mielinização e auto-renovação prejudicada das células precursoras de oligodendrócitos (OPCs). Esses dois defeitos são causados, pelo menos em parte, pela interrupção das interações entre neurônios e oligodendrócitos ao longo do acúmulo de patologia. Os OPCs dão origem a oligodendrócitos mielinizantes durante o desenvolvimento do SNC. No córtex cerebral maduro, as OPCs são as principais células proliferativas (compreendendo ~ 5% do total de células cerebrais) e controlam a formação de nova mielina de maneira dependente da atividade neural. Tais comunicações neurônio-oligodendrócitos são significativamente pouco estudadas, especialmente no contexto de condições neurodegenerativas, como a DA, devido à falta de ferramentas apropriadas. Nos últimos anos, nosso grupo e outros fizeram progressos significativos para melhorar os protocolos atualmente disponíveis para gerar neurônios funcionais e oligodendrócitos individualmente a partir de células-tronco pluripotentes humanas. Neste manuscrito, descrevemos nossos procedimentos otimizados, incluindo o estabelecimento de um sistema de co-cultura para modelar as conexões neurônio-oligodendrócitos. Nossos resultados ilustrativos sugerem uma contribuição inesperada dos OPCs/oligodendrócitos para a amiloidose cerebral e a integridade das sinapses e destacam a utilidade dessa metodologia para a pesquisa da DA. Essa abordagem reducionista é uma ferramenta poderosa para dissecar as interações heterocelulares específicas da complexidade inerente dentro do cérebro. Espera-se que os protocolos que descrevemos aqui facilitem futuros estudos sobre defeitos oligodendrogliais na patogênese da neurodegeneração.
Introdução
As células da linhagem de oligodendrócitos – incluindo células precursoras de oligodendrócitos (OPCs), oligodendrócitos mielinizantes e tipos de transição entre eles – constituem um grupo importante de células cerebrais humanas1 que participam ativamente de muitas funções críticas para o bom funcionamento e manutenção do nosso sistema nervoso central ao longo do desenvolvimento neural e envelhecimento 2,3,4 . Enquanto os oligodendrócitos são bem conhecidos por produzir mielina para facilitar a transmissão da atividade neuronal e apoiar a saúde axonal na substância branca, as OPCs são abundantes (~5%) na massa cinzenta, onde a mielinização é escassa e desempenham funções de sinalização dependentes da atividade para governar o comportamento de aprendizagem e a formação da memória 5,6,7,8 . Como as células oligodendrogliais funcionam e a disfunção na patogênese da doença de Alzheimer (DA) e outras condições neurodegenerativas associadas à idade têm sido pouco estudadas9. As inadequações de um sistema modelo adequado e as deficiências nos conhecimentos gerais para orientar um caminho experimental a seguir são as principais razões para essa lacuna.
À luz dos mais recentes avanços na derivação de células cerebrais humanas a partir de células-tronco pluripotentes, incluindo células-tronco embrionárias (ES) e células-tronco pluripotentes induzidas (iPS), tais modelos celulares em conjunto com ferramentas modernas de edição de genes surgiram como ferramentas robustas para lidar com o intrincado nexo de interações celulares no cérebro e são capazes de demonstrar manifestações de doenças específicas de humanos10, 11. Considerando que os tipos individuais de células cerebrais podem exibir efeitos distintos e até conflitantes diante das mesmas condições promotoras de DA12,13, essa metodologia de células-tronco oferece exclusivamente informações específicas do tipo de célula que anteriormente foram perdidas usando modelos estabelecidos in vivo ou in vitro que fornecem apenas leituras agregadas de coleções de tipos de células cerebrais. Na última década, um bom número de protocolos confiáveis tem sido desenvolvido para gerar neurônios humanos a partir da transdiferenciação de células ES/iPS ou conversão direta de outros tipos celulares terminalmente diferenciados (por exemplo, fibroblastos)14,15. Em particular, a aplicação de fatores-chave de transcrição neurogênica (por exemplo, neurogenina 2, Ngn2)16 a células-tronco pluripotentes humanas pode gerar uma população homogênea de tipos de células neuronais bem caracterizadas para culturas puras sem a necessidade de cocultura com células gliais12,17,18. Para oligodendrócitos humanos induzidos, existem alguns protocolos publicados que podem gerar células funcionais altamente semelhantes às suas contrapartes primárias, com uma ampla gama de eficiência e demanda em tempo e recursos 19,20,21,22,23,24,25,26,27,28 . Até o momento, nenhum desses protocolos foi aplicado para investigar como as células oligodendrogliais respondem e afetam a patogênese da DA.
Aqui, descrevemos nossos protocolos aprimorados para culturas únicas e mistas de neurônios induzidos por humanos (iNs) e OPCs/oligodendrócitos (iOPCs/iOLs). O protocolo iN descrito aqui é baseado na abordagem Ngn2 amplamente utilizada16 e tem a característica adicional de ser livre de glia. Os iNs resultantes são homogêneos e se assemelham muito aos neurônios excitatórios da camada cortical 2/3, com morfologia piramidal, padrão de expressão gênica e características eletrofisiológicascaracterísticas 17,18 (Figura 1). Para superar algumas das barreiras fundamentais na diferenciação dirigida de células-tronco pluripotentes, desenvolvemos um método simples e eficaz de pré-tratamento com baixa dose de dimetilsulfóxido (DMSO)29,30 e relatamos uma maior propensão das células ES/iPS humanas a se transdiferenciarem em iOPCs e iOLs31, com base em um protocolo amplamente adaptado de Douvaras e Fossati 32 . Simplificamos ainda mais o protocolo e incorporamos um composto promotor de diferenciação robusto, a clemastina 7,33,34, para acelerar o processo de maturação oligodendroglial. Como resultado (Figura 2), os iOPCs podem ser gerados em 2 semanas (~95% positivos para o marcador O4) e os iOLs em quatro semanas (expressando marcadores maduros MBP e PLP1). Curiosamente, descobrimos que as iOPCs sozinhas secretam uma quantidade notável de β amiloide (Aβ), consistente com os dados transcriptômicos independentes que mostram a expressão abundante da proteína precursora amiloide (APP) e da protease de processamento β-secretase (BACE1) em células de linhagem de oligodendrócitos35,36. Além disso, nosso sistema de cocultura iN-iOPC promove o revestimento de axônios por processos iOL positivos para MBP e fornece suporte significativo para a formação de sinapses (Figura 3). Assim, os protocolos que detalhamos abaixo têm vantagens técnicas e biológicas sobre os métodos de co-cultura neurônio-oligodendroglia previamente catalogados e são promissores na melhor modelagem da neurodegeneração na DA.
Protocolo
1. Indução de neurônios humanos a partir de células-tronco pluripotentes humanas
- Preparação de Lentivirus (~5 dias, protocolo detalhado conforme descrito anteriormente16)
- Placa ~1 milhão de células HEK293T cada frasco T75, para tê-las ~40% confluentes ao realizar a transfecção. Transfecte-os com plasmídeos que expressam Ngn2 induzível por tetraciclina e gene resistente à puromicina (PuroR; sob o mesmo controle promotor de TetO), rtTA e os três plasmídeos auxiliares pRSV-REV, pMDLg/pRRE e VSV-G (12 μg de DNA vetorial lentiviral e 6 μg de cada um dos DNA plasmídeos auxiliares). Preparar pelo menos três frascos por preparação de lentivírus. Use PEI para transfecção seguindo as instruções do fabricante. Troque a mídia após 16 h e descarte o problema.
- Colha partículas virais liberadas coletando meios de cultura todos os dias e substitua por meios frescos por 3 dias. Agrupe o meio coletado contendo partículas virais para purificação. Filtrar o vírus através de um filtro de 0,22 μm e centrifugar a 49.000 x g durante 90 min. Ressuscite o pellet no volume apropriado de PBS-glicose (~150 μL).
- Indução de neurônios (~ 5 dias)
NOTA: Este protocolo de indução (Figura 1A; diagrama de fluxo) é altamente eficaz para células iPS e ES de pluripotência validada (que pode ser ensaiada por coloração imuno-histoquímica de marcadores de pluripotência bem caracterizados; Figura 1B).- Utilizar células ES humanas H1 comercialmente disponíveis à passagem de 52 (ver Tabela de Materiais). Cultivar as células em placas de 6 poços revestidas de solução de matriz extracelular (~0,5 mg de solução matricial por placa de 6 poços; ver Tabela de Materiais) utilizando meio de manutenção celular ES (ver Tabela de Materiais) e incubar as placas a 37 °C com 5% de CO2.
- No Dia -2, desprenda as células ES (80% confluentes) com 1 mL de solução de descolamento celular (ver Tabela de Materiais) e incube à temperatura ambiente por 10 min. Transfira as células para um tubo; lavar o poço com 2 mL de meio e combinar no mesmo tubo. Centrifugar a 300 x g durante 5 min, ressuspender o pellet em meio e chapear as células em placas de 6 poços revestidas de matriz à densidade de semeadura de 1 x 105 células por poço.
- No Dia -1, adicione lentivírus expressando Ngn2 mais PuroR e rtTA juntamente com polibreno (8 μg/ml) às células ES em meio de manutenção celular ES fresco (ver Tabela de Materiais). A quantidade exata de vírus deve ser determinada por títulos reais ou pela titulação. Normalmente, adicionamos 5 μL de cada vírus por poço em uma placa de 6 poços.
- No Dia 0, adicione doxiciclina (2 μg/mL, para ativar a expressão de Ngn2) em meio DMEM-F12 com suplemento de N2 sem morfogênios.
- No Dia 1, adicionar Puromicina em meio fresco de DMEM-F12 mais N2 e doxiciclina, à concentração final de 1 μg/mL de meio. Selecione as células transduzidas em Puromicina por pelo menos 24 h. Maior concentração de puromicina (até 5 μg/mL) e período de seleção mais longo (até 48 h) podem ser necessários para remover adequadamente as células sub-transduzidas se o título do vírus for baixo.
- No Dia 2, desprenda os neurônios diferenciadores com solução de descolamento celular (ver Tabela de Materiais) e recoloque-os em placas de 24 poços (entre 80.000 e 200.000 células/poço) revestidas com solução de matriz (ver Tabela de Materiais) e mantenha-as em meio NBA/B27 sem doxiciclina. A densidade de semeadura é crítica.
- Nesta fase, os neurônios destacados podem ser congelados em meio de congelamento comercial especializado (ver Tabela de Materiais) e armazenados em nitrogênio líquido por até 3 meses. Os neurônios puros podem ser banhados pela típica morte celular de ~15% a 20% após o descongelamento, cultivados sozinhos ou co-cultivados com outros tipos de células cerebrais (ver etapa 3.2.3. para co-cultura com OPCs).
- Cultura de iNs puro nas placas revestidas com soluções extracelulares à base de matriz, conforme instruído pelo fabricante (ver Tabela de Materiais). A morfologia piramidal característica deve ser aparente no Dia 4 (e Dia 6; Figura 1C). A formação de sinapses pode ser detectada já no dia 14 a 16 e é proeminente no dia 24 por coloração imuno-histoquímica com marcadores pré e pós-sinápticos padrão. (Figura 1D; rotulado com o marcador pré-sináptico Sinapsina 1 e o marcador dendrítico Map2).
2. Indução de células precursoras de oligodendrócitos humanos (OPCs) a partir de células-tronco pluripotentes e maturação de oligodendrócitos
- Geração de Células Progenitoras Neurais (NPC): protocolo monocamada (~7 dias). Consulte a Figura 2A para obter o diagrama de fluxo.
- Cultive células ES humanas H1 conforme descrito anteriormente (ver etapa 1.2.1.) e transdiferencie-as em células progenitoras neurais (NPCs) por uma abordagem estabelecida chamada SMADi duplo, com inibidores de moléculas pequenas para múltiplas vias de sinalização. Aqui usamos um kit comercial amplamente aceito e seguimos o protocolo monocamada fornecido pelo fabricante (consulte Tabela de Materiais).
- No Dia -1, placa 0,5–1 x 10 6 células por poço em uma placa de 6 poços revestida por uma solução de matriz reduzida com fator de crescimento (ver Tabela de Materiais; ~0,5 mg de solução matricial por placa de6 poços) com meio de manutenção de células ES (ver Tabela de Materiais). Esta solução de matriz reduzida com fator de crescimento é usada para revestir todas as placas que serão usadas nas etapas seguintes.
- No Dia 0, trate as células durante 24 horas com meio de manutenção celular ES (ver Tabela de Materiais) suplementado por 2% de DMSO.
- No Dia 1 a 6, troque o meio completo com o meio de indução neural quente (37 °C) contendo os inibidores de SMAD do kit comercial (ver Tabela de Materiais). Se as células se dividirem e atingirem a confluência antes do Dia 7, passe-as para a densidade de semeadura de 0,5–1 x 106, conforme descrito anteriormente na etapa 2.1.2.
- No Dia 7, os NPCs de passagem usando solução de descolamento celular (ver Tabela de Materiais) e placa a uma densidade de semeadura de 1–2 x 105 células/poço de uma placa de 24 poços.
- Avalie a eficiência de diferenciação por coloração imuno-histoquímica (IHC) para ausência de marcador de pluripotência, OCT4, por exemplo, e presença de marcadores NPC como PAX6, Nestin e Sox1.
- Nesta fase, os NPCs destacados podem ser congelados no meio de congelamento de NPC comercial especializado (consulte Tabela de Materiais) e armazenados em nitrogênio líquido por até 3 meses. Após o congelamento e descongelamento por uma vez, os NPCs ainda retêm a multipotência para dar origem a neurônios, astrócitos e OPCs com protocolos confiáveis.
- Geração de células precursoras de oligodendrócitos (OPC) (~7 dias). Consulte a Figura 2A para o diagrama de fluxo.
- No Dia 7, os NPCs de passagem usando solução de descolamento celular (ver Tabela de Materiais) e chapeá-los a uma densidade de semeadura de 1-2 x 105 células por poço em uma placa de 24 poços em meio de indução neural quente (37 °C) mais inibidores de SMAD do kit comercial (ver Tabela de Materiais).
- No dia 8, prepare uma solução de DMSO a 1% no meio de diferenciação OPC e trate os NPCs banhados por 24 h. O meio de diferenciação OPC é composto por: meio DMEM/F12, suplemento de N2 a 1%, suplemento de B27 a 1%, bFGF a 20 ng/mL, SAG a 1 μM, PDGF-AA a 10 ng/mL (ver Tabela de Materiais).
- No dia 9, substitua a mídia por um novo meio de diferenciação OPC sem DMSO. Alimente as células a cada dois dias até o dia 15. Se as células atingirem a confluência antes do Dia 15, passe-as para a densidade de semeadura de 1 a 2 x 105 células por poço, conforme descrito na etapa 2.2.1.
- No Dia 14, as OPCs de placa em meio de diferenciação de OPC a uma densidade de 1–2 x 105 células/poço em uma placa de 24 poços.
- Nesta fase (Dia 15), células de teste para a presença de marcadores específicos de OPC por coloração IHC ou qPCR (por exemplo, O4, Olig1/2, CSPG4/Ng2, NKX2.2, PDGFRa; Figura 2B) e para a ausência de marcadores NPC (Pax6 ou Nestin; Figura 2D). Normalmente, detectamos a imunorreatividade do O4 em mais de 95% das células no Dia 15. De particular relevância para a doença de Alzheimer, a expressão de APP (proteína precursora amiloide), BACE1 (protease de processamento β-secreatase 1) e peptídeo amilóide-β (Aβ) é abundante em OPCs (Figura 2F).
- Maturação de oligodendrócitos (OL) (~7–20 dias)
- No Dia 15, substitua a mídia pelo meio de maturação OL: meio neurobasal-A, suplemento de B27 a 2%, 1 μM de cAMP, triiodotironina T3 de 200 ng/mL e clemastina de 1 μM (ver Tabela de Materiais). Mude o meio a cada dois dias ou todos os dias, se necessário.
- Quando as células atingirem 90% de confluência, dividam-se em uma proporção de 1:3 até 2 passagens ou até que a divisão celular diminua substancialmente. Se os OPCs se dividirem muito rápido e atingirem a confluência em menos de 3 dias, adicione Ara-C (ver Tabela de Materiais) a uma concentração de 2–5 μM por 1–3 dias. A proliferação ativa indica menor eficiência de maturação.
- Examine a eficiência da maturação oligodendroglial avaliando a expressão de marcadores OL, por exemplo, CLDN11, PLP1, MBP por qPCR, coloração IHC ou immunoblotting. A morfologia característica de estruturas de alta complexidade (Figura 2C) e a expressão de marcadores OL (Figura 2E) devem ser prontamente detectadas até o Dia 28.
3. Co-cultura de neurônios induzidos pelo homem (iNs) e células precursoras de oligodendrócitos (iOPCs)
- Revestimento iOPC (~3 dias)
- IOPCs de placa no dia 14 a uma densidade de 1 x 105 células por poço em uma placa de 24 poços (conforme descrito acima na etapa 2.2.4.) em meio de diferenciação OPC (conforme descrito na etapa 2.2.2.).
- Configuração da co-cultura iN-iOPC
- No Dia 15, desprenda os neurónios humanos induzidos no passo do Dia 2 após a seleção da Puromicina (conforme descrito no passo 1.2.6.) com a solução de descolamento celular (ver Tabela de Materiais).
- Adicionar neurônios aos OPCs cultivados, chapeando na densidade de semeadura de 2 x 105 células por poço na placa de 24 poços com OPCs em crescimento (a partir da etapa 3.1.1). Use o meio de co-cultura contendo meio Neurobasal-A, suplemento de B27 a 2% e triiodotironina T3 a 100 ng/mL. Mude o meio no dia seguinte e, em seguida, a cada dois dias depois. Se as OPCs proliferarem muito rápido e atingirem a confluência em menos de 3 dias, adicione Ara-C a uma concentração de 2–5 μM. Uma imagem representativa dos iNs e iOPCs cultivados em co-cultura após 7 dias de neurônios é mostrada na Figura 3A.
- Use neurônios congelados preparados conforme descrito acima na etapa 1.2.7 para co-cultura com OPCs. Placas congelam e descongelam neurônios a uma densidade mais alta de 3 x 105 células por poço.
- Após o Dia 14–16 em coculturas, a formação de sinapses em iNs pode ser observada pela coloração IHC de marcadores pré e pós-sinápticos, e no Dia 21 a punção sináptica deve ser abundante (Figura 3C) e as atividades neuronais podem ser registradas de forma confiável.
- A partir do dia 21, teste as células para marcadores específicos de OL (por exemplo, MBP e PLP1). No Dia 28, normalmente observamos o fenômeno de revestimento de axônios iN por processos iOL, marcados por coloração IHC para marcadores específicos (Figura 3B; neurofilamento NF para axônios iN e MBP para processos iOPC).
Resultados
Geração direta de neurônios induzidos por humanos a partir de células-tronco pluripotentes humanas
É muito importante que as células-tronco pluripotentes humanas iniciantes exibam um alto grau de pluripotência para a geração bem-sucedida de iNs ou iOPCs/iOLs. Portanto, as células devem ser coradas para marcadores específicos, como Oct4 e SOX2, antes de iniciar qualquer um dos protocolos de indução descritos no presente manuscrito (Figura 1A). Células H1 huma...
Discussão
Além do suporte físico e metabólico para estabilizar as estruturas das sinapses e facilitar a condução do sinal salino por mielinização, as células da linhagem de oligodendrócitos podem moldar o padrão de atividade neuronal por meio de conversas cruzadas rápidas e dinâmicas com neurônios 5,6,7. Enquanto na patologia da DA as respostas oligodendrogliais foram inicialmente consideradas meramente secundárias à inflam...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelas subvenções dos Institutos Nacionais de Saúde (R00 AG054616 para Y.A.H. e T32 GM136566 para K.C.), Stanford University School of Medicine e uma Siebel Fellowship (concedida a S.C.). Y.A.H. é professor translacional da GFL do Centro de Neurociência Translacional do Brown Institute for Translational Sciences.
Materiais
| Name | Company | Catalog Number | Comments |
| Accutase | STEMCELL Technologies | 7920 | |
| B27 supplement | ThermoFisher | 17504044 | |
| bFGF | ThermoFisher | PHG 0266 | |
| cAMP | MilliporeSigma | A9501 | |
| Clemastine | MilliporeSigma | SML0445 | |
| DMEM/F12 medium | STEMCELL Technologies | 36254 | |
| DMSO | ThermoFisher | D12345 | |
| Doxycycline | MilliporeSigma | D3072 | |
| Fetal Bovine Serum | ScienCell | 10 | |
| H1 human ES cells | WiCell | WA01 | |
| Matrigel | Corning | 354234 | |
| mTeSR plus | STEMCELL Technologies | 5825 | |
| N2 supplement | ThermoFisher | 17502001 | |
| Neurobasal A medium | ThermoFisher | 10888-022 | |
| Non Essential Amino Acids | ThermoFisher | 11140-050 | |
| PDGF-AA | R&D Systems | 221-AA-010 | |
| PEI | VWR | 71002-812 | |
| pMDLg/pRRE | Addgene | 12251 | |
| Polybrene | MilliporeSigma | TR-1003-G | |
| pRSV-REV | Addgene | 12253 | |
| Puromycin | ThermoFisher | A1113803 | |
| ROCK Inhibitor Y-27632 | STEMCELL Technologies | 72302 | |
| SAG | Tocris | 4366 | |
| STEMdiff Neural Progenitor Freezing Media | STEMCELL Technologies | 5838 | |
| STEMdiff SMADi Neural Induction Kit | STEMCELL Technologies | 8581 | |
| T3 triiodothyronine | MilliporeSigma | T6397 | |
| Tempo-iOlogo: Human iPSC-derived OPCs | Tempo BioScience | SKU102 | |
| TetO-Ng2-Puro | Addgene | 52047 | |
| VSV-G | Addgene | 12259 |
Referências
- Pelvig, D. P., Pakkenberg, H., Stark, A. K., Pakkenberg, B. Neocortical glial cell numbers in human brains. Neurobiology of Aging. 29 (11), 1754-1762 (2008).
- Barres, B. A. The mystery and magic of glia: a perspective on their roles in health and disease. Neuron. 60 (3), 430-440 (2008).
- De Strooper, B., Karran, E. The cellular phase of Alzheimer's disease. Cell. 164 (4), 603-615 (2016).
- Monje, M. Myelin plasticity and nervous system function. Annual Review of Neuroscience. 41, 61-76 (2018).
- Hughes, E. G., Orthmann-Murphy, J. L., Langseth, A. J., Bergles, D. E. Myelin remodeling through experience-dependent oligodendrogenesis in the adult somatosensory cortex. Nature Neuroscience. 21 (5), 696-706 (2018).
- Gibson, E. M., et al. Neuronal activity promotes oligodendrogenesis and adaptive myelination in the mammalian brain. Science. 344 (6183), 1252304 (2014).
- Pan, S., Mayoral, S. R., Choi, H. S., Chan, J. R., Kheirbek, M. A. Preservation of a remote fear memory requires new myelin formation. Nature Neuroscience. 23 (4), 487-499 (2020).
- Thornton, M. A., Hughes, E. G. Neuron-oligodendroglia interactions: Activity-dependent regulation of cellular signaling. Neuroscience Letters. 727, 134916 (2020).
- Ettle, B., Schlachetzki, J. C. M., Winkler, J. Oligodendroglia and myelin in neurodegenerative diseases: more than just bystanders. Molecular Neurobiology. 53 (5), 3046-3062 (2016).
- Essayan-Perez, S., Zhou, B., Nabet, A. M., Wernig, M., Huang, Y. A. Modeling Alzheimer's disease with human iPS cells: advancements, lessons, and applications. Neurobiology of Disease. 130, 104503 (2019).
- Li, L., et al. GFAP mutations in astrocytes impair oligodendrocyte progenitor proliferation and myelination in an hiPSC model of Alexander disease. Cell Stem Cell. 23 (2), 239-251 (2018).
- Lin, Y. T., et al. APOE4 causes widespread molecular and cellular alterations associated with Alzheimer's disease phenotypes in human iPSC-derived brain cell types. Neuron. 98 (6), 1294 (2018).
- TCW, J., et al. Cholesterol and matrisome pathways dysregulated in human APOE ε4 glia. bioRxiv. , (2019).
- Ang, C. E., Wernig, M. Induced neuronal reprogramming. Journal of Comparitive Neurology. 522 (12), 2877-2886 (2014).
- Penney, J., Ralvenius, W. T., Tsai, L. H. Modeling Alzheimer's disease with iPSC-derived brain cells. Molecular Psychiatry. 25 (1), 148-167 (2020).
- Zhang, Y., et al. Rapid single-step induction of functional neurons from human pluripotent stem cells. Neuron. 78 (5), 785-798 (2013).
- Huang, Y. A., Zhou, B., Nabet, A. M., Wernig, M., Sudhof, T. C. Differential signaling mediated by ApoE2, ApoE3, and ApoE4 in human neurons parallels Alzheimer's Disease risk. Journal of Neuroscience. 39 (37), 7408-7427 (2019).
- Huang, Y. A., Zhou, B., Wernig, M., Sudhof, T. C. ApoE2, ApoE3, and ApoE4 Differentially Stimulate APP Transcription and Abeta Secretion. Cell. 168 (3), 427-441 (2017).
- Yang, N., et al. Generation of oligodendroglial cells by direct lineage conversion. Nature Biotechnology. 31 (5), 434-439 (2013).
- Douvaras, P., et al. Efficient generation of myelinating oligodendrocytes from primary progressive multiple sclerosis patients by induced pluripotent stem cells. Stem Cell Reports. 3 (2), 250-259 (2014).
- Lee, E. H., Park, C. H. Comparison of reprogramming methods for generation of induced-oligodendrocyte precursor cells. Biomolecules & Therapeutics (Seoul). 25 (4), 362-366 (2017).
- Ehrlich, M., et al. Rapid and efficient generation of oligodendrocytes from human induced pluripotent stem cells using transcription factors. Proceedings of the National Academy of Sciences of the United States of America. 114 (11), 2243-2252 (2017).
- Rodrigues, G. M. C., et al. Defined and scalable differentiation of human oligodendrocyte precursors from pluripotent stem cells in a 3D culture system. Stem Cell Reports. 8 (6), 1770-1783 (2017).
- Hu, B. Y., Du, Z. W., Li, X. J., Ayala, M., Zhang, S. C. Human oligodendrocytes from embryonic stem cells: conserved SHH signaling networks and divergent FGF effects. Development. 136 (9), 1443-1452 (2009).
- Izrael, M., et al. Human oligodendrocytes derived from embryonic stem cells: Effect of noggin on phenotypic differentiation in vitro and on myelination in vivo. Molecular and Cellular Neuroscience. 34 (3), 310-323 (2007).
- Yamashita, T., et al. Differentiation of oligodendrocyte progenitor cells from dissociated monolayer and feeder-free cultured pluripotent stem cells. PLoS One. 12 (2), 0171947 (2017).
- Wang, S., et al. Human iPSC-derived oligodendrocyte progenitor cells can myelinate and rescue a mouse model of congenital hypomyelination. Cell Stem Cell. 12 (2), 252-264 (2013).
- Chanoumidou, K., Mozafari, S., Baron-Van Evercooren, A., Kuhlmann, T. Stem cell derived oligodendrocytes to study myelin diseases. Glia. 68 (4), 705-720 (2020).
- Chetty, S., et al. A simple tool to improve pluripotent stem cell differentiation. Nature Methods. 10 (6), 553-556 (2013).
- Li, J., et al. A transient DMSO treatment increases the differentiation potential of human pluripotent stem cells through the Rb family. PLoS One. 13 (12), 0208110 (2018).
- Sambo, D., Li, J., Brickler, T., Chetty, S. Transient treatment of human pluripotent stem cells with DMSO to promote differentiation. Journal of Visualized Experiments: JoVE. (149), (2019).
- Douvaras, P., Fossati, V. Generation and isolation of oligodendrocyte progenitor cells from human pluripotent stem cells. Nature Protocols. 10 (8), 1143-1154 (2015).
- Mei, F., et al. Micropillar arrays as a high-throughput screening platform for therapeutics in multiple sclerosis. Nature Medicine. 20 (8), 954-960 (2014).
- Madhavan, M., et al. Induction of myelinating oligodendrocytes in human cortical spheroids. Nature Methods. 15 (9), 700-706 (2018).
- Zhang, Y., et al. Purification and characterization of progenitor and mature human astrocytes reveals transcriptional and functional differences with mouse. Neuron. 89 (1), 37-53 (2016).
- Grubman, A., et al. A single-cell atlas of entorhinal cortex from individuals with Alzheimer's disease reveals cell-type-specific gene expression regulation. Nature Neuroscience. 22 (12), 2087-2097 (2019).
- Goldman, S. A., Kuypers, N. J. How to make an oligodendrocyte. Development. 142 (23), 3983-3995 (2015).
- Behrendt, G., et al. Dynamic changes in myelin aberrations and oligodendrocyte generation in chronic amyloidosis in mice and men. Glia. 61 (2), 273-286 (2013).
- Patzke, C., et al. Neuromodulator signaling bidirectionally controls vesicle numbers in human synapses. Cell. 179 (2), 498-513 (2019).
- Piao, J., et al. Human embryonic stem cell-derived oligodendrocyte progenitors remyelinate the brain and rescue behavioral deficits following radiation. Cell Stem Cell. 16 (2), 198-210 (2015).
- Keirstead, H. S., et al. Human embryonic stem cell-derived oligodendrocyte progenitor cell transplants remyelinate and restore locomotion after spinal cord injury. Journal of Neuroscience. 25 (19), 4694-4705 (2005).
- Kim, D. S., et al. Rapid generation of OPC-like cells from human pluripotent stem cells for treating spinal cord injury. Experimental & Molecular Medicine. 49 (7), 361 (2017).
Erratum
Formal Correction: Erratum: Generation of Human Neurons and Oligodendrocytes from Pluripotent Stem Cells for Modeling Neuron-Oligodendrocyte Interactions
Posted by JoVE Editors on 12/29/2020. Citeable Link.
An erratum was issued for: Generation of Human Neurons and Oligodendrocytes from Pluripotent Stem Cells for Modeling Neuron-Oligodendrocyte Interactions. The Representative Results section has been updated.
Figure 3 was updated from:
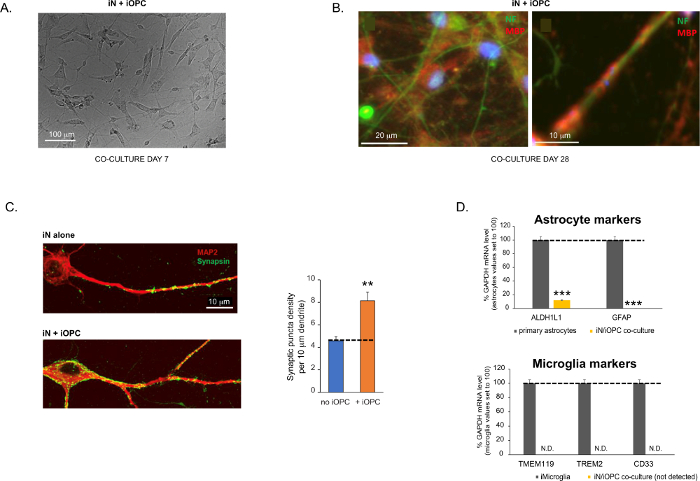
Figure 3: Co-culture of iNs and iOPCs. (A) Representative bright field image of co-cultured iNs and iOPCs at Day 7, showing a proper density for further maturation. (B) Representative immunofluorescence image of iNs and iOPCs co-cultured for 28 days. Axonal marker neurofilament NF is shown in green and oligodendrocytic marker MBP in red. Right, a segment of iN axon ensheathed by iOL process (MBP+). (C) Synapse formation assayed in 4-week-old co-cultures. Cells were stained for Synapsin 1 (Syn1, green) and MAP2 (red), and synaptic puncta were quantified by confocal analysis of density along the dendritic segments as described17,18. (D) In our co-cultures of iNs and iOPCs (7 days of co-culturing), the expression of astrocyte markers, ALDHL1 and GFAP, is minimal (top), and the expression of microglia markers, TMEM119, TREM2, and CD33, is not detected (N.D.) by qPCR. The contamination from these two glial cell types is thus excluded. Please click here to view a larger version of this figure.
to:
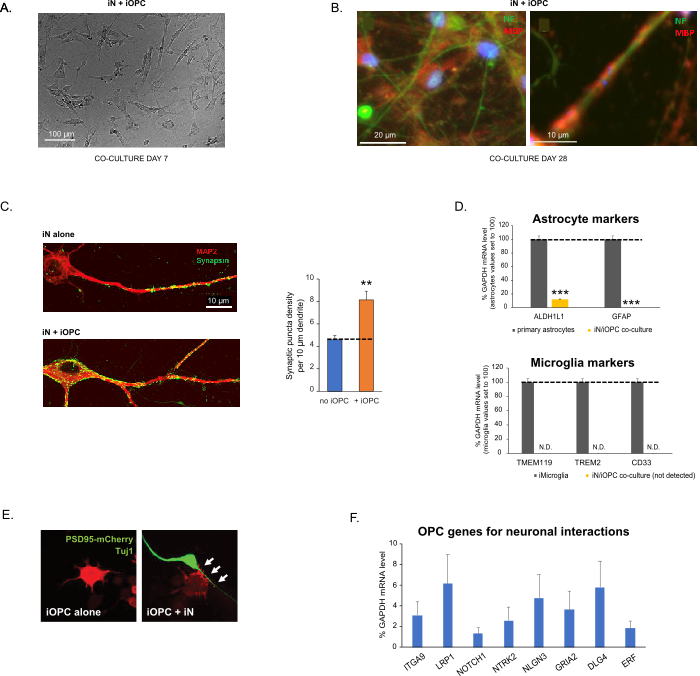
Figure 3: Co-culture of iNs and iOPCs. (A) Representative bright field image of co-cultured iNs and iOPCs at Day 7, showing a proper density for further maturation. (B) Representative immunofluorescence image of iNs and iOPCs co-cultured for 28 days. Axonal marker neurofilament NF is shown in green and oligodendrocytic marker MBP in red. Right, a segment of iN axon ensheathed by iOL process (MBP+). (C) Synapse formation assayed in 4-week-old co-cultures. Cells were stained for Synapsin 1 (Syn1, green) and MAP2 (red), and synaptic puncta were quantified by confocal analysis of density along the dendritic segments as described17,18. (D) In our co-cultures of iNs and iOPCs (7 days of co-culturing), the expression of astrocyte markers, ALDHL1 and GFAP, is minimal (top), and the expression of microglia markers, TMEM119, TREM2, and CD33, is not detected (N.D.) by qPCR. The contamination from these two glial cell types is thus excluded. (E) Coculturing iOPC with iN leads to the formation of neuron-OPC synapses. The fluorescence-tagged post-synaptic marker PSD95-mCherry is expressed only in OPCs, and display a diffuse pattern in single cultures (left) but aggregate to form puncta in cocultures (right, indicated by arrows; Tuj1, neuronal marker). (F) The expression of well-characterized oligodendroglial genes that can sense and respond to neuronal activities in the pure cultures of iOPCs at Day 14. Please click here to view a larger version of this figure.
The fourth paragraph was updated from:
Co-culturing of iNs and iOPCs
This protocol is optimized specifically for co-culturing iNs and iOPCs and allow our real-time monitoring of the inter-cellular communications between these two cell types along the course of neural development. The ideal plating densities for both cell types need to be decided with a series of cell number titration to achieve proper differentiation (Figure 3A). After 4 weeks in co-cultures, the iOPCs are expected to be adequately differentiated into OLs that are positive for specific markers such as MBP and extend processes to ensheath axons (Figure 3B). The co-culture system can robustly boost up the number of synapses, indicating that the iOPCs provide a neuronal support through physical contacts or release of trophic factors (Figure 3C). We can maintain the co-cultures in acceptable health condition for up to 6 weeks and observe that the synapse number and other neuronal attributes plateau around the fifth week. Of note, astrocytes and microglia are not present in our preparations and their absence can be documented by checking the expression of specific markers (Figure 3D).
to:
Co-culturing of iNs and iOPCs
This protocol is optimized specifically for co-culturing iNs and iOPCs and allow our real-time monitoring of the inter-cellular communications between these two cell types along the course of neural development. The ideal plating densities for both cell types need to be decided with a series of cell number titration to achieve proper differentiation (Figure 3A). After 4 weeks in co-cultures, the iOPCs are expected to be adequately differentiated into OLs that are positive for specific markers such as MBP and extend processes to ensheath axons (Figure 3B). The co-culture system can robustly boost up the number of synapses, indicating that the iOPCs provide a neuronal support through physical contacts or release of trophic factors (Figure 3C). We can maintain the co-cultures in acceptable health condition for up to 6 weeks and observe that the synapse number and other neuronal attributes plateau around the fifth week. Of note, astrocytes and microglia are not present in our preparations and their absence can be documented by checking the expression of specific markers (Figure 3D). The iOPCs express a good number of well-characterized genes that can potentially respond to and mediate the activity-dependent signals from neighboring neurons, in a paracrine (e.g. neurotrophins and metabolites) and/or a synaptic manner (Figure 3E and 3F).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados