A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ليزر خالية من هيدروكسيل البروتين الراديكالي البصمة لأداء أعلى ترتيب التحليل الهيكلي للبروتينات
In This Article
Summary
يقدم هذا البروتوكول طريقة لاستخدام قياس الجرعات الراديكالي المضمن ومصدر ضوء البلازما لأداء بصمة بروتين أكسدة الفلاش. هذه الطريقة تحل محل ليزر الأشعة فوق البنفسجية الخطرة لتبسيط وتحسين استنساخ الأكسدة الكيميائية الضوئية السريعة لدراسات البروتين.
Abstract
Hydroxyl الراديكالية البروتين البصمة (HRPF) هو الناشئة والواعدة أعلى ترتيب تقنية التحليل الهيكلي الذي يوفر معلومات عن التغيرات في بنية البروتين، والتفاعلات البروتين البروتين، أو التفاعلات البروتين ليغاند. HRPF يستخدم الجذور الهيدروكسيل(▪OH) لتسمية لا رجعة فيه سطح المذيبات البروتين يمكن الوصول إليها. وقد حد التعقيد المتأصل في أداء الشراكة البشرية المحمية وتكلفته وطبيعته الخطرة إلى حد كبير من الاعتماد الواسع النطاق في مجال الصيدلة الحيوية. وتشمل هذه العوامل: 1) استخدام الليزر المعقد والخطير والمكلف الذي يتطلب احتياطات أمان كبيرة؛ (2) استخدام أجهزة الليزر المعقدة والخطرة والمكلفة التي تتطلب احتياطات أمان كبيرة؛ (2) استخدام أجهزة الليزر المعقدة والكواية التي تتطلب احتياطات كبيرة للسلامة؛ (2) استخدام أجهزة الليزر المعقدة والكواية و 2) عدم قابلية الحماية من HRPF الناجمة عن مسح الخلفية من ▪OH التي تحد من الدراسات المقارنة. يوفر هذا المنشور بروتوكولا لتشغيل نظام HRPF خال من الليزر. يستخدم نظام HRPF الخالي من الليزر تقنية أكسدة فلاش مصدر ضوء البلازما عالية الطاقة والضغط العالي مع قياس الجرعات الراديكالي في الخط. مصدر ضوء البلازما هو أكثر أمانا، وأسهل في الاستخدام، وأكثر كفاءة في توليد الجذور الهيدروكسيل من أنظمة HRPF القائمة على الليزر، ومقياس الجرعات الراديكالية في الخط يزيد من استنساخ الدراسات. وإلى جانب ذلك، يعالج نظام HRPF الخالي من الليزر النقائص والقيود المذكورة في التقنيات القائمة على الليزر ويتغلب عليها.
Introduction
تشكيل البروتين وما يرتبط به من بنية النظام الأعلى (HOS) هي المحددات الرئيسية للوظيفة البيولوجية السليمة والسلوك الشاذ1. وينطبق الشيء نفسه على المستحضرات الصيدلانية الحيوية، التي يعتمد هيكلها ونشاطها الوظيفي على جوانب مختلفة من إنتاجها وبيئتها. وقد تم ربط التغير الصيدلاني الحيوي في HOS إلى ردود الفعل الدوائية السلبية (ADR) المنسوبة إلى الصيدلة غير المرغوب فيها والاستجابة المناعية للمريض2،3. وقد نبه ظهور ADRs صناعة الأدوية الحيوية إلى الدور الحاسم الذي يلعبه البروتين HOS في سلامة وفعالية العلاج الحيوي ، وأنها أثبتت الحاجة إلى تحليلات HOS جديدة ومحسنة4.
هيدروكسيل البروتين الراديكالي البصمة (HRPF) هو تقنية واعدة لتتبع التغيير في البروتين HOS. HRPF ينطوي على وضع علامات لا رجعة فيها من السطح الخارجي للبروتين مع ▪OH تليها تحليل الطيف الكتلي (MS) لتحديد سطح المذيبات التي يمكن الوصول إليها من البروتين5،6،7. HRPF وقد استخدمت بنجاح للكشف عن عيوب في البروتين HOS ووظيفته8،9، تميز هوس من الأجسام المضادة أحادية النسيلة (ماب)10،11،12،13، تحديد KD ملزمة من14ليغاند ، وأكثر من ذلك بكثير15،16،17،18،19. وهناك طريقة شائعة لتوليد ▪OH لHRPF هو الأكسدة الضوئية السريعة للبروتينات (FPOP) ، والذي يستخدم عالية الطاقة ، وأشعة الليزر فوق البنفسجية السريعة لإنتاج ▪OH من التحليل الضوئي من H2O2. بالنسبة للجزء الأكبر، FPOP يستخدم الليزر إكسيمر مكلفة تستخدم الغاز الخطرة (KrF) التي تتطلب ضمانات كبيرة لتجنب إصابات الجهاز التنفسي والعين20. لتجنب مخاطر الاستنشاق، استخدم آخرون تردد أربع مرات النيودميوم yttrium العقيق الألومنيوم (Nd:YAG) الليزر21،الذي يلغي استخدام الغاز السام ولكن لا تزال مكلفة، وتتطلب خبرة عملية كبيرة، والمطالبة بضوابط واسعة النطاق ضوء ضالة لحماية المستخدمين من إصابات العين.
على الرغم من أنه يمكن الحصول على معلومات وافرة باستخدام HRPF ، لم يتم الوفاء بالتبني الواسع النطاق في biopharma. 21- ومن بين العوائق التي تحول دون اعتماد قوة حماية حقوق الإنسان المحدودة: 1) استخدام الليزر الخطر والمكلف الذي يتطلب احتياطات أمان كبيرة 20؛ (2) استخدام أجهزة الليزر الخطرة والمكلفة التي تتطلب احتياطات كبيرة للسلامة 20؛ (2) استخدام الليزر الخطر والمكلف الذي يتطلب احتياطات أمان كبيرة20؛ (2)استخدام الليزر الخطر والمكلف الذي يتطلب احتياطات أمان كبيرة و 2) عدم قابلية الحماية من HRPF الناجمة عن مسح الخلفية من ▪OH التي تحد من الدراسات المقارنة22. لتحل محل استخدام الليزر، تم تطوير وحدة تحلل ضوئي عالية السرعة وعالية الطاقة بالبلازما لأداء FPOP بأمان بطريقة سهلة. لتحسين عدم قابلية عدم الحماية لتجارب HRPF ، يتم تنفيذ قياس الجرعات الراديكالية في الوقت الحقيقي.
وقد تم الحد من ممارسة HRPF من عدم القابلية لدحض يعزى إلى مسح الخلفية من ▪OH22. في حين أن ▪OH هي مسابير ممتازة من تضاريس البروتين ، إلا أنها تتفاعل أيضا مع العديد من المكونات الموجودة في الاستعدادات ، مما يجعل من الضروري قياس التركيز الفعال للراديكالية المتاحة لأكسدة البروتين المستهدف. يمكن أن تؤدي الاختلافات في إعداد العازلة ، وتركيز بيروكسيد الهيدروجين ، وخصائص الليغند ، أو التحلل الضوئي إلى اختلافات الأكسدة بين مجموعات التحكم والتجريبية التي تخلق غموضا في الدراسات التفاضلية HOS. إضافة قياس الجرعات الراديكالية في الوقت الحقيقي تمكن من تعديل تأثير ▪تحميل OH وبالتالي يزيد من الثقة والتكرار خلال تجربة HRPF. وقد وصف استخدام قياس الجرعات الراديكالية في FPOP في مكان آخر23،24،25، ويناقش بمزيد من التفصيل في منشور صدر مؤخرا26. هنا، ونحن نصف استخدام نظام التحلل الضوئي فلاش رواية وقياس الجرعات في الوقت الحقيقي لتسمية الخيول آبو-الميوجلوبين (AMb)، مقارنة مستويات أكسدة الببتيد في تجربة FPOP لتلك التي تم الحصول عليها عند استخدام ليزر إكسيمر.
Protocol
1. تركيب أنبوب الشعرية
- باستخدام الحجر السيليكا cleaving، يشق 250 ميكرومتر القطر الداخلي (معرف) السيليكا الشعرية إلى 27 بوصة. تحقق من النهايات الشعرية للحصول على قطع نظيفة ومستقيمة.
- إنشاء نافذتين تقريبا 15 ملم في الطول عن طريق حرق بعيدا طلاء البوليميد. بدءا من "الطرف السفلي" جعل نافذة التحلل الضوئي الأولى 90 ملم بعيدا عن "الطرف السفلي" ونافذة الجرعات الثانية 225 ملم بعيدا عن "الطرف السفلي".
ملاحظة: بمجرد حرق الطلاء بعيدا الشعرية هشة جدا. - فك الجوز والفرول في ميناء 5 وإدراج "الطرف السفلي" من الشعرية فقط وراء نهاية مخروطية من النمس (الشكل 1A).
- في وحدة التحلل الضوئي، قم بإزالة غطاء خلية التحلل الضوئي عن طريق سحبه مباشرة ثم قم بإزالة القناع المعدني المثبت مغناطيسيا والذي سيمسك الشعيرات الدموية في مكانها.
تنبيه: داخل غطاء الخلية تحلل ضوئي هو مرآة منحنية، لا تسمح أي شيء للمس المرآة. - على وحدة قياس الجرعات، افتح خلية مقياس الجرعات عن طريق الضغط على علامة التبويب على اليسار وتأرجح خلية مقياس الجرعات المفتوحة إلى اليمين. إزالة مقاطع محمولة مغناطيسيا والتي سوف تعقد الشعرية في مكانها.
- ضع الشعرية في القناة المخدودة في قاعدة خلية التحلل الضوئي. مركز النافذة الشعرية مع نافذة الخلية تحلل ضوئي. أثناء عقد الشعرية في موقف بيد واحدة، إضافة القناع المغناطيسي لعقد الشعرية في مكان. ضع غطاء التحلل الضوئي مرة أخرى في موضعه.
- ضع الشعرية في القناة المخدودة في قاعدة خلية الجرعات. مركز النافذة الشعرية الثانية على فتحة صغيرة في وسط قاعدة خلية الجرعات. في حين عقد الشعرية في موقف بيد واحدة، وضع اثنين من مقاطع المغناطيسي في موقف لعقد الشعرية في مكان. أغلق الخلية مقياس الجرعات حتى النقر فوق مغلق.
- إدراج الشعرية من خلال الجوز knurled فوق رفع الشعرية من جامع المنتج(الشكل 1B). تمديد الشعرية إلى ما فوق الجزء السفلي من القارورة.
ملاحظة: من المهم أن تصل الشعيرات الدموية إلى أسفل القارورة لضمان غمر الشعرية في محلول التبريد أثناء تشغيل تجربة.
2. تثبيت حلقة حقن
- استخدام أنابيب تفلون مع قطر خارجي 1/16 "وقطر داخلي من 0.015" (381 ميكرومتر). اتبع المعادلة 1 لحساب طول الأنابيب اللازمة للحجم المطلوب باستخدام المعادلة 1.
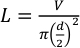
حيث L هو طول الأنابيب في ملليمترات، V هو الحجم المطلوب في microliters و د هو القطر الداخلي أنبوب في ملليمترات. لحجم حقن 25 ميكرولتر وقطرها الداخلي من 381 ميكرومتر، وطول الأنابيب يجب أن يكون ما يقرب من 219.3 ملم.
ملاحظة: بالنسبة للأحجام التي تقل عن 20 ميكرولتر، استخدم أنابيب PTFE بقطر داخلي يبلغ 0.01". - قطع أنابيب تفلون إلى الطول اللازم باستخدام قاطع أنبوب. تحقق من نهايات الأنبوب للحصول على قطع نظيفة ومستقيمة.
- إدراج نهاية واحدة من حلقة حقن جديدة من خلال واحدة من المكسرات ووضع فيرول جديدة على نهاية الأنبوب. عقد فيرول والجوز في مكان وأدخل الأنبوب في المنفذ 3 من صمام الحقن حتى قيعان في صمام. عقد أنبوب بحزم وتشديد إصبع الجوز ضيق. باستخدام وجع، تشديد الجوز 1/4 بدوره أبعد من ذلك. إزالة الجمعية وتفتيشها.
ملاحظة: إذا لم يتم إصلاح النمس في موضعه، قم بإعادة تثبيت وتشديد 1/8 بدوره أبعد من ذلك. كرر مع الطرف الآخر من الحلقة. - مرة واحدة كلا طرفي الجوز والثابتة فيرول، المسمار فضفاضة نهاية واحدة إلى ميناء 3 والطرف الآخر إلى ميناء 6(الشكل 1C). مرة واحدة في موقف تشديد كلا الجانبين إلى إصبع ضيق ثم 1/4 بدوره الاصبع الماضي ضيق مع وجع.
3. تهيئة نظام التحلل الضوئي
- تشغيل وحدات تحلل ضوئي بالترتيب التالي: (1) وحدة Fluidics Module (2) وحدة تحلل ضوئي (3) وحدة قياس الجرعات (4) جامع المنتج، وأخيرا (5) جهاز كمبيوتر النظام وإطلاق برنامج التحكم
ملاحظة: السماح الوحدة النمطية Dosimeter على الأقل نصف ساعة إلى الاحماء من بداية باردة. - غمر أنابيب بالكامل من موقف "صمام" على مضخة حقنة (الشكل 1D) إلى 10 مل من العازلة. وضع أنابيب من موقف "النفايات" (الشكل 1D) والأنابيب من ميناء 2 على منفذ حقنة (الشكل 1C) إلى حاوية فارغة لجمع النفايات.
ملاحظة: استخدام العازلة البروتين الخاص بك سيتم تعليق في. المخزن المؤقت الموصى به هو 10 mM NaPO4. - على دائري جامع المنتج، ضع أنابيب الطرد المركزي الدقيق 1.5 مل في الموضع الذي يحمل علامة H و6.
- إذا كنت تستخدم 250 ميكرومتر معرف الشعيرات الدموية، تعيين معدل تدفق الحمل إلى 500 ميكرولتر / دقيقة، ومعالجة معدل التدفق إلى 7.5 ميكرولتر / دقيقة، ومعدل تدفق النفايات إلى 500 ميكرولتر / دقيقة.
- حساب تأخير الفلاش ووقت المنتج ووقت الهدر لاستخدام الوضع شبه التلقائي باستخدام المعادلة 2.
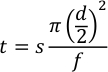
حيث t هو الوقت بالدقائق، s هو المسافة الشعرية بالملليمترات، d هو القطر الداخلي للشعيرات الدموية بالملليمترات، و هو معدل التدفق في μL/min.- بالنسبة لتأخير الفلاش ، تكون المسافة من "الطرف السفلي" من الشعرية إلى النافذة الأولى ، والتي يجب أن تكون حوالي 90 مم. باستخدام 250 ميكرومتر معرف الشعرية ومعدل تدفق المعالجة من 7.5 ميكرولتر / دقيقة العينة سوف تصل إلى نافذة التحلل الضوئي في حوالي 35 ثانية. السماح ومضات اثنين في 1 هرتز أن يحدث قبل وصول العينات، لذلك تعيين تأخير فلاش إلى 33 ثانية.
- بالنسبة لوقت المنتج ، أدخل مقدار الوقت الذي سيستغرقه المحلول المحقون للتدفق من صمام الحقن إلى نهاية الشعرية. لمدة 27 بوصة طويلة 250 ميكرومتر معرف الشعرية، تعيين وقت المنتج إلى 4.5 دقيقة.
- بالنسبة لوقت الهدر ، أدخل مقدار الوقت الذي سيستغرقه الحجم الإجمالي للحل المحقون ليتم جمعه. في هذا الوقت، سينتقل جامع المنتجات من موضع المنتج إلى قارورة النفايات. بالنسبة لحجم الحقن 25 ميكرولتر ومعدل تدفق 7.5 ميكرولتر/دقيقة، حدد وقت الهدر إلى 7.8 دقيقة.
- شطف خارج حلقة الحقن خمس مرات عن طريق حقن 25 ميكرولتر من الماء HPLC الصف في منفذ الحقن مع صمام الحقن تعيين إلى موقف الحمل.
- قم بتشغيل صمام الحقن يدويا حتى "موضع الحقن" لطرد بقية النظام. حدد عملية (خارج) على برنامج التحكم لبدء تدفق المياه. أثناء التدفق، ارفع رفع الشعرية جامع المنتج عن طريق تحديد أعلى تحت جامع المنتج بحيث يمكنك أن ترى نهاية الشعرية. تدفق المياه من خلال الشعرية حتى تتشكل قطرة.
ملاحظة: إذا لم تتشكل قطرة، تحقق من صمام الحقن بحثا عن تسربات. إذا كان هناك تسرب، وتخفيف الجوز، وإعادة تقسيط الشعرية، و retighten.
4. تحديد الفعلية ▪OH العائد لاختبار آثار الزبال الراديكالية من المخزن المؤقت.
- في "برنامج التحكم"، ابدأ التدفق بتحديد عملية (خارج). في علامة التبويب إعدادات، تعيين الجهد فلاش إلى 0 V. ضمن علامة التبويب التحكم اليدوي في قسم بيانات مقياس الجرعات، حدد بدء تشغيل البيانات + AutoZero.
- حدد موضع قارورة المنتج (H) وقارورة النفايات (6).
- حدد جاهز، يدويا تحويل صمام الحقن وصولا الى موقف الحمل ، وحقن 25 ميكرولتر من 1 مليون أدينين مع 100 م م ه2O2 في منفذ الحقن. بمجرد حقنها، قم بتحويل صمام الحقن يدويا إلى موضع الحقن.
ملاحظة: هذا تلقائيا بتشغيل النظام لبدء التدفق تشغيل مصدر البلازما والحصول على بيانات قياس الجرعات. - قم بزيادة الجهد الكهربائي عن طريق التنقل إلى علامة التبويب إعدادات وتغيير الجهد الفلاشي. كرر الخطوتين 4.2 و4.3 باستخدام 500 فولت و750 فولت و1000 فولت و1250 فولت قم بقراءة امتصاص الأدينين عند كل جهد في ثلاثية المستويات.
- حدد علامة التبويب حسابات لتحديد متوسط الامتصاص لكل عينة. أولا، انقر فوق تحديد، ثم حدد بداية ونهاية امتصاص الذروة يدويا. في المساحة المتوفرة، اكتب وصفا للعينة. كرر لجميع البيانات المكتسبة.
ملاحظة: قد تشكل فقاعات تسبب ارتفاع في قراءة مقياس الجرعات. عند تحديد البيانات لتحديد متوسط الامتصاص، احذف المناطق ذات الفقاعات. - نسخ ولصق البيانات في إكسيل لحساب متوسط التغير في امتصاص أدينين لكل جهد، وبالتالي تحديد فعالية ▪OH العائد.
- كرر الخطوات 4.1-4.6 إذا تم استخدام عدة نماذج الشروط (المخزن المؤقت/المضافات مختلفة) لتطبيع فعالية ▪OH العائد لكل شرط.
5. تعديل البروتين للكشف عن التغيرات في بنية النظام الأعلى.
- اخلط 4 مليون أدينين مع 20 ميكرومتر من البروتين بنسبة واحد إلى واحد لصنع محلول يحتوي على 2 مليون أدينين و 10 ميكرومتر بروتين.
- جعل محلول إخماد باستخدام 0.3 ملغ / مل كاتالاز لكسر بيروكسيد الهيدروجين الزائد و 35 mM ميثيونين أميد لإرواء أي الجذور المتبقية. Aliquot 25 ميكرولتر من محلول إخماد في 200 ميكروتوب μL بحيث يتم خلط حجم متساو من إخماد والمنتج المسمى.
- تمييع H2O2 إلى 200 mM والحفاظ على الجليد.
- في برنامج التحكم في علامة التبويب إعدادات، بدء الجهد فلاش في 0 V لتحديد أي أكسدة الخلفية.
- في علامة التبويب التحكم اليدوي، حدد بدء البيانات + AutoZero، متبوعا بعملية (خارج)، ثم جاهز، وأخيرا قم بتشغيل صمام الحقن لأسفل إلى موضع التحميل.
- وضع محلول إخماد في الموقف 1 على المنتج جمع دائري. على "برنامج التحكم في النظام" تغيير قارورة المنتج إلى 1.
- مباشرة قبل الحقن، مزيج 12.5 ميكرولتر من خليط الأدينين والبروتين مع 12.5 ميكرولتر من H2O2 لجعل تركيز نهائي من 1 مل أدينين، 5 ميكرومتر بروتين، و 100 م م H2O2. ماصة بلطف صعودا وهبوطا لخلط، تدور بسرعة إلى أسفل، وحقن 25 ميكرولتر باستخدام منفذ الحقن في غضون 10 ثانية من الاختلاط.
- قم بتبديل صمام الحقن إلى موضع الحقن وانتظر أثناء معالجة العينة.
- كرر عملية الاستحواذ مع 500 فولت و750 فولت و1000 فولت و1250 فولت قم بإجراء كل قياس للجهد الكهربائي ثلاثي اليكل.
- حساب متوسط الامتصاص كما هو موضح في الخطوة 4.5. نسخ ولصق كافة البيانات إلى Excel.
6. إيقاف تشغيل النظام
- بعد جمع جميع العينات، طرد منفذ الحقنة وحلقة العينة عن طريق وضع صمام الحقن وصولا الى موقف الحمل وحقن 25 ميكرولتر من المياه HPLC خمس مرات.
- قم بتشغيل صمام الحقن حتى موضع الحقن لطرد بقية النظام بماء HPLC.
- وقف تدفق، وإغلاق برنامج التحكم في النظام، وإيقاف تشغيل وحدات بدءا من جامع المنتج، وحدة قياس الجرعات، وحدة التحلل الضوئي، ثم أخيرا وحدة fluidics.
7. إعداد العينة وقياس الطيف اللوني الكتلي السائل
- إزالة البروتين عن طريق احتضان عينات في 80 درجة مئوية لمدة 20 دقيقة في وجود 50 متر تريس و 1 م مكاكلوريك 2. عينات باردة لدرجة حرارة الغرفة وإضافة 1:20 تريبسين إلى البروتين. هضم البروتين بين عشية وضحاها في 37 درجة مئوية مع خلط العينة. في صباح اليوم التالي، إنهاء الهضم التريبسين عن طريق تسخين العينات إلى 95 درجة مئوية لمدة 10 دقائق.
- اكتشف الببتيدات باستخدام نظام LC-MS/MS عالي الدقة متصل بنظام UPLC.
- تحميل العينة أولا على عمود فخ (300 μm معرف X 5 مم 100 حجم المسام، 5 ميكرومتر حجم الجسيمات) ويغسل في 5.0 ميكرولتر / مل لمدة 3 دقائق مع الماء الذي يحتوي على 2٪ المذيبات B (أسيتونيتريل وحمض الفورميك 0.1٪).
- فصل الببتيدات على نانوكولون C18 (0.75 مم × 150 مم، 2 ميكرومتر حجم الجسيمات، 100 حجم المسام) بمعدل تدفق 300 نانولتر / دقيقة مع الانحدار بين المذيبات A (المياه التي تحتوي على حمض الفورميك 0.1٪) والمذيب B. يتكون تدرج الببتيد من زيادة خطية من 2 إلى 35٪ B على مدى 22 دقيقة، وصعد إلى 95٪ B على مدى 5 دقائق وعقد لمدة 3 دقائق لغسل العمود، ثم عاد إلى 2٪ B أكثر من 3 دقائق وعقد لمدة 9 دقائق لإعادة توازن العمود.
- الحصول على البيانات في وضع الأيونات الموجبة. تعيين الجهد رذاذ إلى 2400 V، ودرجة حرارة أنبوب نقل الأيونات إلى 300 درجة مئوية.
- الحصول على مسح مرض التصلب العصبي المتعدد الكامل من 250-2000 م / ض تليها ثمانية اللاحقة التي تعتمد على البيانات MS / MS بمسح على أعلى ثمانية أيونات الببتيد الأكثر وفرة. استخدام التفكك الناجم عن الاصطدام في 35٪ الطاقة العادية لتفتيت الببتيدات.
- تحديد جميع الببتيدات غير المعدلة التي تم اكتشافها من تحليل MS / MS باستخدام برنامج تحليل البروتين المتاح مقابل ملف FASTA الضروري الذي يحتوي على تسلسل البروتين والانزيم البروتيوليكي ذي الصلة.
- البحث عن الببتيدات المعدلة وتحديدها كميا باستخدام برنامج معالجة البيانات HRPF. يتم حساب مدى الأكسدة لكل ببتيد محدد عن طريق تقسيم منطقة الذروة اللونية لجمل الببتيد المعدلة على إجمالي منطقة الذروة الكروماتوغرافية لذلك الببتيد المعدل وغير المعدل باستخدام المعادلة 3.
P = [I(مؤأكسدة بشكل متشح) X 1 + I (مؤأكسدة بشكل مضاعف) X 2 + I(مؤأكسدة ثلاث نسخا) X 3 + .../[Iunoxidized + I(مؤأكسد بشكل متشد بشكل مضاعف) + I(مؤأكسدة ثلاثنسخ ) ...]
حيث P يدل على متوسط عدد أحداث الأكسدة لكل جزيء الببتيد، وأنا يمثل منطقة الذروة للببتيد غير الموكسي(Iunoxidized)والببتيد مع ن أحداث الأكسدة.
8. لدراسة تفاضلية، كرر الخطوات 5-7 على الشرط الثاني.
ملاحظة: لتأكيد القابلية للتكرار، يوصى بتكرارين بيولوجيين بالإضافة إلى ثلاثيات تقنية لكل حالة.
النتائج
مصدر البلازما عالي الضغط إلى جانب قياس الجرعات في الوقت الحقيقي يسمح بالتحكم بشكل أفضل في ▪OH لمراقبة التغيرات في بنية البروتين الأعلى ترتيبا بشكل أكثر دقة. إضافة أدينين يسمح لجرعات جذرية فعالة في الوقت الحقيقي. عند الأكسدة، الأدينين يفقد امتصاص الأشعة فوق البنفسجية في 265 نانومتر (
Discussion
هناك العديد من الخطوات الحاسمة لضمان وضع العلامات المناسبة للبروتينات خلال أي تجربة HRPF. أولا، يتم تحديد معدل تدفق مناسب ومعدل فلاش المصدر للتأكد من أن كل بولوس من العينة مشع مرة واحدة. وهذا يضمن أن يتعرض البروتين لبول واحد من oh ▪OH التي تشكلت حديثا. بمجرد أكسدة البروتين ، يمكن تغيير ب?...
Disclosures
E.E.C. ، J.S.S. ، وS.R.W. تكشف عن اهتمام مالي كبير في شركة GenNext Technologies ، وهي شركة في مرحلة مبكرة تسعى إلى تسويق التقنيات لتحليل بنية البروتين ذات الترتيب الأعلى. وقد استعرضت S.K.M البيانات التمثيلية المقدمة، وليس لديها تضارب مالي في المصالح.
Acknowledgements
تم تمويل هذا العمل من قبل المعهد الوطني للعلوم الطبية العامة (R43GM125420 وR44GM125420).
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-53A | any brand is sufficient |
| 50 µL SGE Gastight Syringes | Fisher Scientific | SG-00723 | |
| Acclaim PepMap 100 C18 nanocolumn (0.75 mm X 150 mm, 2 µm) | Thermo Scientific | ||
| Acetonitrile with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | LS120-500 | |
| Apomyoglobin | Sigma-Aldrich | ||
| Catalase | Sigma-Aldrich | C9322 | |
| Centrifuge | Eppendorf | 022625501 | |
| Delicate Task Wipers | Fisher Scientific | 06-666A | |
| Hydrogen Peroxide | Fisher Scientific | H325-100 | any 30% hydrogen peroxide is sufficient |
| Methionine amide | Chem-Impex | 03109 | |
| Microcentrifuge | Thermo Scientific | 75002436 | |
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | Orbitrap Fusion Lumos Tribrid Mass Spectrometer | other high resolution instruments (e.g. Q exactive Orbitrap or Orbitrap Fusion) can be used |
| Pierce Trypsin Protease, MS Grade | Thermo Scientific | 90058 | |
| Polymicro Cleaving Stone, 1" x 1" x 1/32” | Molex | 1068680064 | any capillary tubing cutter is sufficient |
| UPLC | Thermo Scientific | ||
| Water with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | LS118-500 | |
| Water, LC/MS Grade | Fisher Scientific | W6-4 |
References
- Nagarkar, R. P., Murphy, B. M., Yu, X., Manning, M. C., Al-Azzam, W. A. Characterization of protein higher order structure using vibrational circular dichroism spectroscopy. Current Pharmaceutical Biotechnology. 14 (2), 199-208 (2013).
- Giezen, T. J., Schneider, C. K. Safety assessment of biosimilars in Europe: a regulatory perspective. Generics and Biosimilars Initiative Journal. , 1-8 (2014).
- Giezen, T. J., Mantel-Teeuwisse, A. K., Strauss, S. Safety-related regulatory actions for biologicals approved in the United States and the Europena Union. Journal of the American Medical Society. 300 (16), 1887-1896 (2008).
- Gabrielson, J. P., Weiss, W. F. Technical decision-making with higher order structure data: starting a new dialogue. Journal of Pharmaceutical Sciences. 104 (1), 1240-1245 (2015).
- Brenowitz, M., Erie, D. A., Chance, M. R. Catching RNA polymerase in the act of binding: intermediates in transcription illuminated by synchrotron footprinting. Proceedings of the National Academy of Sciences U S A. 102 (13), 4659-4660 (2005).
- Guan, J. Q., Takamoto, K., Almo, S. C., Reisler, E., Chance, M. R. Structure and dynamics of the actin filament. Biochemistry. 44 (9), 3166-3175 (2005).
- Hambly, D. M., Gross, M. L. Laser flash photochemical oxidataion to locate heme binding and conformataional changes in myoglobin. International Journal of Mass Spectrometry. 259 (2007), 124-129 (2007).
- Li, K. S., Shi, L., Gross, M. L. Mass Spectrometry-Based Fast Photochemical Oxidation of Proteins (FPOP) for Higher Order Structure Characterization. Accounts of Chemical Research. 51 (3), 736-744 (2018).
- Watson, C., Sharp, J. S. Conformational Analysis of Therapeutic Proteins by Hydroxyl Radical Protein Footprinting. American Association of Pharmaceutical Scientists Journal. 14 (2), 206-217 (2012).
- Deperalta, G., et al. Structural analysis of a therapeutic monoclonal antibody dimer by hydroxyl radical footprinting. mAbs. 5 (1), 86-101 (2013).
- Jones, L. M., et al. Complementary MS methods assist conformational characterization of antibodies with altered S-S bonding networks. Journal of American Society of Mass Spectrometry. 24 (6), 835-845 (2013).
- Storek, K. M., et al. Monoclonal antibody targeting the β-barrel assembly machine of Escherichia coli is bactericidal. Proceedings of the National Academy of Sciences. , (2018).
- Vij, R., et al. A targeted boost-and-sort immunization strategy using Escherichia coli BamA identifies rare growth inhibitory antibodies. Scientific Reports. 8 (1), 7136 (2018).
- Liu, X. R., Zhang, M. M., Rempel, D. L., Gross, M. L. A Single Approach Reveals the Composite Conformational Changes, Order of Binding, and Affinities for Calcium Binding to Calmodulin. Analytical Chemistry. 91 (9), 5508-5512 (2019).
- Lu, Y., et al. Fast Photochemical Oxidation of Proteins Maps the Topology of Intrinsic Membrane Proteins: Light-Harvesting Complex 2 in a Nanodisc. Analytical Chemistry. 88 (17), 8827-8834 (2016).
- Marty, M., Zhang, H., Cui, W., Gross, M., Sligar, S. Interpretation and Deconvolution of Nanodisc Native Mass Spectra. Journal of American Society of Mass Spectrometry. 25, (2013).
- Johnson, D. T., Di Stefano, L. H., Jones, L. M. Fast photochemical oxidation of proteins(FPOP): A powerful mass spectrometry based structural proteomics tool. Journal of Biological Chemistry. , (2019).
- Chea, E. E., Jones, L. M. Analyzing the structure of macromolecules in their native cellular environment using hydroxyl radical footprinting. Analyst. 143 (4), 798-807 (2018).
- Aprahamian, M. L., Chea, E. E., Jones, L. M., Lindert, S. Rosetta Protein Structure Prediction from Hydroxyl Radical Protein Footprinting Mass Spectrometry Data. Analytical chemistry. 90 (12), 7721-7729 (2018).
- Linde. . Linde Specialty Gases of North America. , (2009).
- Aye, T. T., Low, T. Y., Sze, S. K. Nanosecond laser-induced photochemical oxidation method for protein surface mapping with mass spectrometry. Analytical Chemistry. 77 (18), 5814-5822 (2005).
- Niu, B., Zhang, H., Giblin, D., Rempel, D. L., Gross, M. L. Dosimetry determines the initial OH radical concentration in fast photochemical oxidation of proteins (FPOP). Journal of American Society of Mass Spectrometry. 26 (5), 843-846 (2015).
- Misra, S. K., Orlando, R., Weinberger, S. R., Sharp, J. S. Compensated Hydroxyl Radical Protein Footprinting Measures Buffer and Excipient Effects on Conformation and Aggregation in an Adalimumab Biosimilar. American Association of Pharmaceutical Scientists Journal. 21 (5), 87 (2019).
- Olson, L. J., Misra, S. K., Ishihara, M., Battaile, K. P., Grant, O. C., Sood, A., Woods, R. J., Kim, J. P., Tiemeyer, M., Ren, G., Sharp, J. S., Dahms, N. M. Allosteric regulation of lysosomal enzyme recognition by the cation-independent mannose 6-phosphate receptor. Communications Biology. 3 (1), 498 (2020).
- Sharp, J. S., Misra, S. K., Persoff, J. J., Egan, R. W., Weinberger, S. R. Real Time Normalization of Fast Photochemical Oxidation of Proteins Experiments by Inline Adenine Radical Dosimetry. Analytical Chemistry. 90 (21), 12625-12630 (2018).
- Misra, S. K., Sharp, J. S. Enabling Real-Time Compensation in Fast Photochemical Oxidations of Proteins for the Determination of Protein Topography Changes. Journal of Visualized Experiments. 163, (2020).
- Hambly, D. M., Gross, M. L. Laser flash photolysis of hydrogen peroxide to oxidize protein solvent-accessible residues on the microsecond timescale. Journal of American Society of Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Liu, X. R., Zhang, M. M., Gross, M. L. Mass Spectrometry-Based Protein Footprinting for Higher-Order Structure Analysis: Fundamentals and Applications. Chemical Reviews. 120 (10), 4355 (2020).
- Jones, L. M., Sperry, B. J., Carroll, A. J., Gross, M. L. Fast photochemical oxidation of proteins for epitope mapping. Analytical chemistry. 83 (20), 7657-7661 (2011).
- Li, J., et al. Mapping the Energetic Epitope of an Antibody/Interleukin-23 Interaction with Hydrogen/Deuterium Exchange, Fast Photochemical Oxidation of Proteins Mass Spectrometry, and Alanine Shave Mutagenesis. Analytical chemistry. 89 (4), 2250-2258 (2017).
- Liu, X. R., Zhang, M. M., Rempel, D. L., Gross, M. L. A Single Approach Reveals the Composite Conformational Changes, Order of Binding, and Affinities for Calcium Binding to Calmodulin. Analytical Chemistry. 91 (9), 5508-5512 (2019).
- Kiselar, J. G., Janmey, P. A., Almo, S. C., Chance, M. R. Structural analysis of gelsolin using synchrotron protein footprinting. Molecular and Cellular Proteomics. 2 (10), 1120-1132 (2003).
- Chea, E. E., Deredge, D. J., Jones, L. M. Insights on the Conformational Ensemble of Cyt C Reveal a Compact State during Peroxidase Activity. Biophysical Journal. 118 (1), 128-137 (2020).
- Poor, T. A., et al. Probing the paramyxovirus fusion (F) protein-refolding event from pre- to postfusion by oxidative footprinting. Proceedings of the National Academy of Sciences U S A. 111 (25), 2596-2605 (2014).
- Roush, A. E., Riaz, M., Misra, S. K., Weinberger, S. R., Sharp, J. S. Intrinsic Buffer Hydroxyl Radical Dosimetry Using Tris(hydroxymethyl)aminomethane. Journal of American Society of Mass Spectrometry. 31 (2), 169-172 (2020).
- Everett, E. A., Falick, A. M., Reich, N. O. Identification of a critical cysteine in EcoRI DNA methyltransferase by mass spectrometry. Journal of Biological Chemistry. 265 (29), 17713-17719 (1990).
- Sanderson, R. J., Mosbaugh, D. W. Identification of specific carboxyl groups on uracil-DNA glycosylase inhibitor protein that are required for activity. Journal of Biological Chemistry. 271 (46), 29170-29181 (1996).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved