Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Лазерный гидроксилрадикал белковый след для выполнения структурного анализа белков более высокого порядка
В этой статье
Резюме
Этот протокол представляет собой метод использования встроенной радикальной дозиметрии и плазменного источника света для выполнения флеш-окисления белка. Этот метод заменяет опасный УФ-лазер для упрощения и улучшения воспроизводимости быстрого фотохимического окисления белковых исследований.
Аннотация
Гидроксилрадикалящий белковый след (HRPF) является новым и перспективным методом структурного анализа более высокого порядка, который предоставляет информацию об изменениях в структуре белка, белково-белковых взаимодействиях или белково-лигандных взаимодействиях. HRPF использует гидроксильные радикалы(▪ОН) для необратимой маркировки поверхности белка, доступной для растворителя. Сложность, стоимость и опасный характер выполнения HRPF существенно ограничили широкое внедрение в биофармацевтических системах. К таким факторам относятся: 1) использование сложных, опасных и дорогостоящих лазеров, требующих существенных мер предосторожности; и 2) невоспроизводимость HRPF, вызванная фоновой засоряющей ▪ОН, которые ограничивают сравнительные исследования. Данная публикация содержит протокол работы системы HRPF без лазера. Эта безлазерная система HRPF использует высокоэнергетическую технологию окисления плазменного источника света высокого давления с поточной радикальной дозиметрией. Плазменный источник света безопаснее, проще в использовании и более эффективен в генерации гидроксильных радикалов, чем лазерные системы HRPF, а поточный радикальный дозиметр повышает воспроизводимость исследований. В совокупности система HRPF без лазера устраняет и преодолевает упомянутые недостатки и ограничения лазерных методов.
Введение
Конформация белка и связанная с ней структура высшего порядка (HOS) являются основными детерминантами правильной биологической функции и аберрантного поведения1. То же самое относится и к биофармацевтическим препаратам, структура и функциональная активность которых зависит от различных аспектов их производства и среды. Биофармацевтические изменения в ХОС были связаны с побочными лекарственными реакциями (ADR), приписываемыми нежелательной фармакологии и иммунологическому ответу пациента2,3. Появление АДР предупредило биофармацевтическую промышленность о критической роли, которую белок HOS играет в безопасности и эффективности биотерапевтических средств, и они установили необходимость в новой и улучшенной аналитике HOS4.
Гидроксилрадикалирование белка (HRPF) является перспективным методом отслеживания изменения белка HOS. HRPF включает необратимую маркировку внешней стороны белка с ▪OH с последующим масс-спектрометрическим (MS) анализом для идентификации доступной растворителю поверхности белка5,6,7. HRPF успешно применяется для выявления дефектов белка HOS и его функции8,9,характеризуют HOS моноклональных антител (mAb)10,11,12,13,определяют связывание Kd с лигандом14и более15,16,17,18,19. Распространенным методом генерации ▪OH для HRPF является быстрое фотохимическое окисление белков (FPOP), в котором используются высокоэнергетические, быстрые УФ-лазеры для получения ▪OH из фотолиза H2O2. По большей части, FPOP использует дорогие эксимерные лазеры, использующие опасный газ (KrF), который требует существенных гарантий, чтобы избежать травм дыхания и глаз20. Чтобы избежать опасности вдыхания, другие использовали частотные четырехкратные лазеры21из неодима иттрия алюминиевого граната (Nd: YAG), которые исключают использование токсичного газа, но по-прежнему являются дорогостоящими, требуют значительных эксплуатационных знаний и требуют обширных элементов управления рассеянным светом для защиты пользователей от травм глаз.
Хотя с помощью HRPF можно получить обширную информацию, широкое распространение в биофармацевтической отрасли не было достигнуто. Два барьера для ограниченного принятия HRPF включают: 1) использование опасных и дорогих лазеров, которые требуют существенных мер предосторожности20; и 2) невоспроизводимость HRPF, вызванная фоновой засорением ▪ОН, которые ограничивают сравнительные исследования22. Чтобы вытеснить использование лазера, была разработана высокоскоростная высокоэнергетическая установка фотолиза плазменной вспышки для безопасного выполнения FPOP в легкой манере. Для повышения невоспроизводимости экспериментов HRPF внедрена радикальная дозиметрия в реальном времени.
Практика ППЧ была ограничена невоспроизводимостью, приписываемой фоновому мусору ▪OH22. Хотя ▪ОН являются отличными зондами топографии белка, они также реагируют со многими компонентами, обнаруженными в препаратах, что делает необходимым измерение эффективной концентрации радикала, доступного для окисления целевого белка. Изменения в буферном препарате, концентрации перекиси водорода, свойствах лигандов или фотолизе могут привести к различиям в окислении между контрольной и экспериментальной группами, которые создают неопределенность в дифференциальных исследованиях HOS. Добавление радикальной дозиметрии в реальном времени позволяет регулировать эффект ▪нагрузки ОН и, следовательно, повышает уверенность и воспроизводимость во время эксперимента HRPF. Использование радикальной дозиметрии в FPOP было описано в другом месте23,24,25и подробно обсуждается в недавней публикации26. Здесь мы описываем использование новой системы фотолиза со вспышкой и дозиметрии в реальном времени для маркировки апомиоглобина лошадей (aMb), сравнивая уровни окисления пептидов в эксперименте FPOP с уровнями, полученными при использовании эксимерного лазера.
протокол
1. Установка капиллярной трубки
- Используя кремнеземный расщепляющий камень, расщепление капилляра кремнезема внутреннего диаметра (ID) до 27 дюймов. Проверьте концы капилляров на наличие чистого, прямого разреза.
- Создайте два окна длиной примерно 15 мм, сжег полиимидное покрытие. Начиная с «нижнего конца», сделайте первое окно фотолиза на 90 мм от «нижнего конца» и второе дозиметрическое окно на 225 мм от «нижнего конца».
ПРИМЕЧАНИЕ: Как только покрытие сгорает, капилляр очень хрупкий. - Открутите гайку и наконечник в порту 5 и вставьте «нижний конец» капилляра сразу за коническим концомнаконечника (рисунок 1А).
- На модуле фотолиза снимите колпачок фотолизной ячейки, вытащив его прямо, а затем снимите магнитно установленную металлическую маску, которая будет удерживать капилляр на месте.
ВНИМАНИЕ: Внутри колпачка фотолизной ячейки находится изогнутое зеркало, не позволяйте ничему прикасаться к зеркалу. - На модуле дозиметра откройте ячейку дозиметра, нажав на выступ слева, и покачайте ячейку дозиметра открытой вправо. Снимите магнитные зажимы, которые будут удерживать капилляр на месте.
- Поместите капилляр в рифленый канал в основании фотолизной ячейки. Центрирование капиллярного окна с окном фотолизной ячейки. Удерживая капилляр в нужном положении одной рукой, добавьте магнитную маску, чтобы удерживать капилляр на месте. Верните колпачок фотолиза обратно в положение.
- Поместите капилляр в рифленый канал в основании дозиметрической ячейки. Центр второго капиллярного окна на небольшом отверстии в центре основания ячейки дозиметра. Удерживая капилляр в нужном положении одной рукой, поместите два магнитных зажима в положение, чтобы удерживать капилляр на месте. Закройте ячейку дозиметра до щелчка мышью.
- Вставьте капилляр через накатанный гайку поверх капиллярного подъемника коллектора продукта(рисунок 1B). Вытяните капилляр чуть выше дна флакона.
ПРИМЕЧАНИЕ: Важно, чтобы капилляр достиг дна флакона, чтобы убедиться, что капилляр погружен в раствор для закалки во время проведения эксперимента.
2. Установка инжекторного контура
- Используйте тефлоновую трубку с наружным диаметром 1/16" и внутренним диаметром 0,015" (381 мкм). Следуйте уравнению 1, чтобы рассчитать длину трубки, необходимую для желаемого объема, используя уравнение 1.
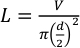
Где L - длина трубки в миллиметрах, V - желаемый объем в микролитрах, а d - внутренний диаметр трубки в миллиметрах. Для впрыска 25 мкл и внутреннего диаметра 381 мкм длина трубки должна составлять примерно 219,3 мм.
ПРИМЕЧАНИЕ: Для объемов менее 20 мкл используйте трубки из ПТФЭ с внутренним диаметром 0,01". - Разрежьте тефлоновую трубку на необходимую длину с помощью трубореза. Проверьте концы трубки на наличие чистого, прямого разреза.
- Вставьте один конец новой петли впрыска через одну из гаек и поместите новый наконечник на конец трубки. Удерживайте наконечник и гайку на месте и вставьте трубку в порт 3 инжекторного клапана до тех пор, пока он не дойнится до клапана. Крепко держите трубку и плотно затяните палец гайки. С помощью гаечный ключ затяните гайку на 1/4 оборота дальше. Извлеките и осмотрите узел.
ПРИМЕЧАНИЕ: Если наконечник не закреплен в положении, переустановите и затяните на 1/8 оборота дальше. Повторите с другим концом цикла. - Как только оба конца имеют гайку и фиксированный наконечник, свободно прикрутите один конец к порту 3, а другой конец к порту 6(рисунок 1C). Оказавшись в положении, затяните обе стороны до плотного пальца, затем на 1/4 поверните мимо пальца туго с помощью ключа.
3. Инициализируйте систему фотолиза
- Включите модули фотолиза в следующем порядке: (1) Модуль флюидики (2) Модуль фотолиза (3) Модуль дозиметрии (4) Сборщик продукта и, наконец, (5) системный компьютер и запустите управляя программное обеспечение
ПРИМЕЧАНИЕ: Дайте дозиметровому модулю не менее получаса прогреться от холодного запуска. - Полностью погрузить трубку из положения "Клапан" на шприцевом насосе(рисунок 1D)в буфер по 10 мл. Поместите трубку из положения "Отходы"(рисунок 1D)и трубку из порта 2 на шприцевом отверстии(рисунок 1C)в пустой контейнер для сбора отходов.
ПРИМЕЧАНИЕ: Используйте буфер, в который будет ввешен ваш белок. Рекомендуемый буфер составляет 10 мМ NaPO4. - На карусели Product Collector поместите микроцентрифужные трубки 1,5 мл в положение с маркировкой H и 6.
- При использовании капилляра ID 250 мкм установите скорость потока нагрузки на 500 мкл/мин, скорость обработки на 7,5 мкл/мин и скорость потока отходов на 500 мкл/мин.
- Рассчитайте задержку вспышки, время продукта и время потери для использования полуавтоматического режима с помощью уравнения 2.
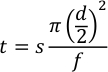
Где t — время в минутах, s — капиллярное расстояние в миллиметрах, d — внутренний диаметр капилляра в миллиметрах, а f — скорость потока в мкл/мин.- Для задержки вспышки расстояние составляет от «нижнего конца» капилляра до первого окна, которое должно составлять примерно 90 мм. Используя 250 мкм ID капилляра и скорость обработки 7,5 мкл/мин, образец попадет в окно фотолиза примерно через 35 секунд. До прибытия образцов до прибытия образцов вспыхнет две вспышки с частотой 1 Гц, установите задержку вспышки на 33 секунды.
- Для времени продукта введите количество времени, которое потребуется инъекционному раствору, чтобы течь от инжекторного клапана к концу капилляра. Для 27-дюймового ID-капилляра длиной 250 мкм установите время продукта на 4,5 минуты.
- Для времени отходов введите количество времени, которое потребуется для сбора общего объема вводимого раствора. В это время сборщик продукта перейдет из положения продукта в флакон для отходов. Для объема впрыска 25 мкл и расхода 7,5 мкл/мин установите время отходов на уровне 7,8 минут.
- Промыть инжекторный контур пять раз, впрыскивая 25 мкл воды класса ВЭЖХ в инжекторное отверстие с клапаном впрыска, установленным в положение нагрузки.
- Вручную поверните инжекторный клапан в положение «впрыска», чтобы промыть остальную часть системы. Выберите Процесс (выход) в управляющей программе, чтобы начать проточную воду. Во время текучения поднимите капилляр коллектора продукта, выбрав Вверх под коллектором продукта, чтобы вы могли видеть конец капилляра. Протойте воду через капилляр до тех пор, пока не образуется капля.
ПРИМЕЧАНИЕ: Если капля не образуется, проверьте клапан инжектора на наличие утечек. Если есть утечка, ослабьте гайку, пересесть капилляр и повторно запрячь.
4. Определите фактический выход ▪ОН для проверки эффектов радикального падания из буфера.
- В управляющей программе запустите поток, выбрав Процесс (Выход). На вкладке настроек установите напряжение вспышки на 0 В. На вкладке Ручное управление в разделе данных дозиметра выберите Пуск данных + AutoZero.
- Выберите положение флакона с продуктом (H) и флакона для отходов (6).
- Выберите Готово,вручную поверните инжекторный клапан вниз в положение нагрузки и впрыскивайте 25 мкл 1 мМ аденина со 100 мМ H2O2 в порт впрыска. После впрыска вручную поверните инжекторный клапан до положения впрыска.
ПРИМЕЧАНИЕ: Это автоматически запускает систему, чтобы начать поток, включить источник плазмы и получить данные дозиметрии. - Увеличйте напряжение, перейдя на вкладку настроек и изменив напряжение вспышки. Повторите шаги 4.2 и 4.3, используя 500 В, 750 В, 1000 В и 1250 В. Выполните показания поглощения аденина при каждом напряжении в трех значениях.
- Выберите вкладку расчетов, чтобы определить среднюю абсорбию каждого образца. Сначала нажмите «Выбрать»,затем вручную выберите начало и конец пикового поглощения. В доступном пространстве напишите в описание образца. Повторите для всех полученных данных.
ПРИМЕЧАНИЕ: Могут образовываться пузырьки, вызывающие скачок показаний дозиметра. При выборе данных для определения среднего поглощения опустите участки с пузырьками. - Скопируйте и вставьте данные в Excel, чтобы рассчитать среднее изменение поглощения аденина для каждого напряжения, тем самым определяя эффективное ▪выход ОН.
- Повторите шаги 4.1-4.6, если для нормализации эффективного выхода ▪ОН для каждого условия используется несколько условий отбора проб (разные буферы/добавки).
5. Модификация белка для выявления изменений в структуре более высокого порядка.
- Смешайте 4 мМ аденина с 20 мкМ белка в соотношении один к одному, чтобы получить раствор, содержащий 2 мМ аденина и 10 мкМ белка.
- Сделайте раствор для закалки, используя 0,3 мг / мл каталазы для раскалывания избытка перекиси водорода и 35 мМ метионина амида для гашения любых оставшихся радикалов. Aliquot 25 мкл раствора закалки в микропробирку объемом 200 мкл таким образом, чтобы смешивали равный объем закалки и маркированный продукт.
- РазбавитьH2O2 до 200 мМ и держать на льду.
- На вкладке «Управляющее программное обеспечение» на вкладке настроек запустите напряжение вспышки на уровне 0 В, чтобы определить фоновое окисление.
- На вкладке ручного управления выберите Start Data + AutoZero, затем Process (Out),затем Ready, и, наконец, поверните клапан впрыска в положение нагрузки.
- Поместите раствор для закалки в положение 1 на карусели сбора продукта. В программном обеспечении системного управления измените флакон продукта на 1.
- Непосредственно перед инъекцией смешайте 12,5 мкл смеси аденина и белка с 12,5 мклH2O2, чтобы получить конечную концентрацию 1 мМ аденина, белка 5 мкМ и 100 мМ H2O2. Осторожно пипетку вверх и вниз для смешивания, быстро вращайте вниз и вводите 25 мкл с помощью инжекционного порта в течение 10 секунд после смешивания.
- Переключите инжекторный клапан в положение впрыска и подождите, пока образец обрабатывается.
- Повторите сбор данных с напряжением 500 В, 750 В, 1000 В и 1250 В. Выполните каждое измерение напряжения в трех значениях.
- Рассчитайте среднюю абсорбию, как описано в шаге 4.5. Скопируйте и вставьте все данные в Excel.
6. Выключите систему
- После того, как все образцы были собраны, промывайте шприцевой порт и контур образца, установив инжекторный клапан в положение нагрузки и впрыскивая 25 мкл воды ВЭЖХ пять раз.
- Поверните инжекторный клапан в положение впрыска, чтобы промыть остальную часть системы водой ВЭЖХ.
- Остановите поток, закройте программное обеспечение управления системой и выключите модули, начиная с коллектора продукта, модуля дозиметра, модуля фотолиза, а затем, наконец, модуля жидкости.
7. Пробоподготовка и жидкостная хроматография-масс-спектрометрия
- Денектировать белок путем инкубации образцов при 80 °C в течение 20 мин в присутствии 50 мМ Tris и 1 мМ CaCl2. Охладите образцы до комнатной температуры и добавьте в белок 1:20 трипсина. Переварите белок в течение ночи при 37 °C с перемешиванием образцов. На следующее утро прекратите переваривание трипсина, нагревая образцы до 95 °C в течение 10 минут.
- Обнаружение пептидов с помощью системы высокого разрешения LC-MS/MS, подключенной к системе UPLC.
- Сначала загрузите образец на колонку ловушки (300 мкм ID X 5 мм 100 Å размер пор, размер частиц 5 мкм) и промывайте при 5,0 мкл/мл в течение 3 мин водой, содержащей 2% растворителя B (ацетонитрил и 0,1% муравьиной кислоты).
- Разделяйте пептиды на наноколонке C18 (0,75 мм x 150 мм, размер частиц 2 мкм, размер пор 100 Å) со скоростью потока 300 нл/мин с градиентом между растворителем А (вода, содержащая 0,1% муравьиной кислоты) и растворителем В. Градиент для пептидного элюирования состоит из линейного увеличения от 2 до 35% В в течение 22 мин, нарастают до 95% В в течение 5 мин и удерживают в течение 3 мин для промывки колонны, а затем возвращают до 2% В в течение 3 мин и удерживают в течение 9 мин для повторного уравновешивания колонны.
- Получение данных в режиме положительных ионов. Установите напряжение распыления на 2400 В, а температуру трубки переноса ионов на 300 °C.
- Получите полное сканирование MS от 250 до 2000 м / z, а затем восемь последующих сканирования MS / MS, зависящих от данных, на восьми наиболее распространенных пептидных ионах. Используйте диссоциацию, вызванную столкновением, при 35% нормализованной энергии для фрагментации пептидов.
- Идентифицируйте все немодифицированные пептиды, обнаруженные в результате анализа MS / MS, используя доступное программное обеспечение для анализа белка, по необходимому файлу FASTA, содержащему последовательность белка и соответствующий протеолитический фермент.
- Поиск и количественная оценка модифицированных пептидов с помощью программного обеспечения для обработки данных HRPF. Степень окисления для каждого идентифицированного пептида рассчитывается путем деления суммарной хроматографической пиковой площади модифицированного пептида на общую хроматографическую пиковую площадь этого модифицированного и немодифицированного пептида с использованием уравнения 3.
P = [I(по отдельностью окисленный) X 1 + I (одновременно окисленный) X 2 + I(тройный окисленный) X 3 + .../[Иуноксидированный + I(отдельно окисленный) + I(одновременно окисленный) + I(тройный окисленный) ...]
где P обозначает среднее число событий окисления на молекулу пептида, а I представляет пиковую площадь неокисленного пептида(юнокисленного)и пептида с n событиями окисления.
8. Для дифференциального исследования повторите шаги 5-7 на втором условии.
ПРИМЕЧАНИЕ: Для подтверждения воспроизводимости рекомендуются две биологические реплики в дополнение к техническим трипликатам для каждого состояния.
Результаты
Плазменный источник высокого давления в сочетании с дозиметрией в реальном времени позволяет лучше контролировать выход ▪OH, чтобы более точно наблюдать изменения в структуре белка более высокого порядка. Добавление аденина позволяет создать эффективный радикальный дозиметр в...
Обсуждение
Существует несколько критических шагов для обеспечения правильной маркировки белков во время любого эксперимента HRPF. Во-первых, выбирается соответствующая скорость потока и скорость вспышки источника, чтобы убедиться, что каждый болюс образца облучается один раз. Это гарантирует, чт?...
Раскрытие информации
E.E.C., J.S.S. и S.R.W. раскрывают значительную финансовую заинтересованность в GenNext Technologies, Inc., компании на ранней стадии, стремящейся коммерциализировать технологии для анализа структуры белка более высокого порядка. Представленные репрезентативные данные были рассмотрены S.K.M., у которого нет финансового конфликта интересов.
Благодарности
Эта работа финансировалась Национальным институтом общих медицинских наук (R43GM125420 и R44GM125420).
Материалы
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Centrifuge Tubes | Fisher Scientific | 14-959-53A | any brand is sufficient |
| 50 µL SGE Gastight Syringes | Fisher Scientific | SG-00723 | |
| Acclaim PepMap 100 C18 nanocolumn (0.75 mm X 150 mm, 2 µm) | Thermo Scientific | ||
| Acetonitrile with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | LS120-500 | |
| Apomyoglobin | Sigma-Aldrich | ||
| Catalase | Sigma-Aldrich | C9322 | |
| Centrifuge | Eppendorf | 022625501 | |
| Delicate Task Wipers | Fisher Scientific | 06-666A | |
| Hydrogen Peroxide | Fisher Scientific | H325-100 | any 30% hydrogen peroxide is sufficient |
| Methionine amide | Chem-Impex | 03109 | |
| Microcentrifuge | Thermo Scientific | 75002436 | |
| Orbitrap Fusion Lumos Tribrid Mass Spectrometer | Thermo Scientific | Orbitrap Fusion Lumos Tribrid Mass Spectrometer | other high resolution instruments (e.g. Q exactive Orbitrap or Orbitrap Fusion) can be used |
| Pierce Trypsin Protease, MS Grade | Thermo Scientific | 90058 | |
| Polymicro Cleaving Stone, 1" x 1" x 1/32” | Molex | 1068680064 | any capillary tubing cutter is sufficient |
| UPLC | Thermo Scientific | ||
| Water with 0.1% Formic Acid (v/v), LC/MS Grade | Fisher Scientific | LS118-500 | |
| Water, LC/MS Grade | Fisher Scientific | W6-4 |
Ссылки
- Nagarkar, R. P., Murphy, B. M., Yu, X., Manning, M. C., Al-Azzam, W. A. Characterization of protein higher order structure using vibrational circular dichroism spectroscopy. Current Pharmaceutical Biotechnology. 14 (2), 199-208 (2013).
- Giezen, T. J., Schneider, C. K. Safety assessment of biosimilars in Europe: a regulatory perspective. Generics and Biosimilars Initiative Journal. , 1-8 (2014).
- Giezen, T. J., Mantel-Teeuwisse, A. K., Strauss, S. Safety-related regulatory actions for biologicals approved in the United States and the Europena Union. Journal of the American Medical Society. 300 (16), 1887-1896 (2008).
- Gabrielson, J. P., Weiss, W. F. Technical decision-making with higher order structure data: starting a new dialogue. Journal of Pharmaceutical Sciences. 104 (1), 1240-1245 (2015).
- Brenowitz, M., Erie, D. A., Chance, M. R. Catching RNA polymerase in the act of binding: intermediates in transcription illuminated by synchrotron footprinting. Proceedings of the National Academy of Sciences U S A. 102 (13), 4659-4660 (2005).
- Guan, J. Q., Takamoto, K., Almo, S. C., Reisler, E., Chance, M. R. Structure and dynamics of the actin filament. Biochemistry. 44 (9), 3166-3175 (2005).
- Hambly, D. M., Gross, M. L. Laser flash photochemical oxidataion to locate heme binding and conformataional changes in myoglobin. International Journal of Mass Spectrometry. 259 (2007), 124-129 (2007).
- Li, K. S., Shi, L., Gross, M. L. Mass Spectrometry-Based Fast Photochemical Oxidation of Proteins (FPOP) for Higher Order Structure Characterization. Accounts of Chemical Research. 51 (3), 736-744 (2018).
- Watson, C., Sharp, J. S. Conformational Analysis of Therapeutic Proteins by Hydroxyl Radical Protein Footprinting. American Association of Pharmaceutical Scientists Journal. 14 (2), 206-217 (2012).
- Deperalta, G., et al. Structural analysis of a therapeutic monoclonal antibody dimer by hydroxyl radical footprinting. mAbs. 5 (1), 86-101 (2013).
- Jones, L. M., et al. Complementary MS methods assist conformational characterization of antibodies with altered S-S bonding networks. Journal of American Society of Mass Spectrometry. 24 (6), 835-845 (2013).
- Storek, K. M., et al. Monoclonal antibody targeting the β-barrel assembly machine of Escherichia coli is bactericidal. Proceedings of the National Academy of Sciences. , (2018).
- Vij, R., et al. A targeted boost-and-sort immunization strategy using Escherichia coli BamA identifies rare growth inhibitory antibodies. Scientific Reports. 8 (1), 7136 (2018).
- Liu, X. R., Zhang, M. M., Rempel, D. L., Gross, M. L. A Single Approach Reveals the Composite Conformational Changes, Order of Binding, and Affinities for Calcium Binding to Calmodulin. Analytical Chemistry. 91 (9), 5508-5512 (2019).
- Lu, Y., et al. Fast Photochemical Oxidation of Proteins Maps the Topology of Intrinsic Membrane Proteins: Light-Harvesting Complex 2 in a Nanodisc. Analytical Chemistry. 88 (17), 8827-8834 (2016).
- Marty, M., Zhang, H., Cui, W., Gross, M., Sligar, S. Interpretation and Deconvolution of Nanodisc Native Mass Spectra. Journal of American Society of Mass Spectrometry. 25, (2013).
- Johnson, D. T., Di Stefano, L. H., Jones, L. M. Fast photochemical oxidation of proteins(FPOP): A powerful mass spectrometry based structural proteomics tool. Journal of Biological Chemistry. , (2019).
- Chea, E. E., Jones, L. M. Analyzing the structure of macromolecules in their native cellular environment using hydroxyl radical footprinting. Analyst. 143 (4), 798-807 (2018).
- Aprahamian, M. L., Chea, E. E., Jones, L. M., Lindert, S. Rosetta Protein Structure Prediction from Hydroxyl Radical Protein Footprinting Mass Spectrometry Data. Analytical chemistry. 90 (12), 7721-7729 (2018).
- Linde. . Linde Specialty Gases of North America. , (2009).
- Aye, T. T., Low, T. Y., Sze, S. K. Nanosecond laser-induced photochemical oxidation method for protein surface mapping with mass spectrometry. Analytical Chemistry. 77 (18), 5814-5822 (2005).
- Niu, B., Zhang, H., Giblin, D., Rempel, D. L., Gross, M. L. Dosimetry determines the initial OH radical concentration in fast photochemical oxidation of proteins (FPOP). Journal of American Society of Mass Spectrometry. 26 (5), 843-846 (2015).
- Misra, S. K., Orlando, R., Weinberger, S. R., Sharp, J. S. Compensated Hydroxyl Radical Protein Footprinting Measures Buffer and Excipient Effects on Conformation and Aggregation in an Adalimumab Biosimilar. American Association of Pharmaceutical Scientists Journal. 21 (5), 87 (2019).
- Olson, L. J., Misra, S. K., Ishihara, M., Battaile, K. P., Grant, O. C., Sood, A., Woods, R. J., Kim, J. P., Tiemeyer, M., Ren, G., Sharp, J. S., Dahms, N. M. Allosteric regulation of lysosomal enzyme recognition by the cation-independent mannose 6-phosphate receptor. Communications Biology. 3 (1), 498 (2020).
- Sharp, J. S., Misra, S. K., Persoff, J. J., Egan, R. W., Weinberger, S. R. Real Time Normalization of Fast Photochemical Oxidation of Proteins Experiments by Inline Adenine Radical Dosimetry. Analytical Chemistry. 90 (21), 12625-12630 (2018).
- Misra, S. K., Sharp, J. S. Enabling Real-Time Compensation in Fast Photochemical Oxidations of Proteins for the Determination of Protein Topography Changes. Journal of Visualized Experiments. 163, (2020).
- Hambly, D. M., Gross, M. L. Laser flash photolysis of hydrogen peroxide to oxidize protein solvent-accessible residues on the microsecond timescale. Journal of American Society of Mass Spectrometry. 16 (12), 2057-2063 (2005).
- Liu, X. R., Zhang, M. M., Gross, M. L. Mass Spectrometry-Based Protein Footprinting for Higher-Order Structure Analysis: Fundamentals and Applications. Chemical Reviews. 120 (10), 4355 (2020).
- Jones, L. M., Sperry, B. J., Carroll, A. J., Gross, M. L. Fast photochemical oxidation of proteins for epitope mapping. Analytical chemistry. 83 (20), 7657-7661 (2011).
- Li, J., et al. Mapping the Energetic Epitope of an Antibody/Interleukin-23 Interaction with Hydrogen/Deuterium Exchange, Fast Photochemical Oxidation of Proteins Mass Spectrometry, and Alanine Shave Mutagenesis. Analytical chemistry. 89 (4), 2250-2258 (2017).
- Liu, X. R., Zhang, M. M., Rempel, D. L., Gross, M. L. A Single Approach Reveals the Composite Conformational Changes, Order of Binding, and Affinities for Calcium Binding to Calmodulin. Analytical Chemistry. 91 (9), 5508-5512 (2019).
- Kiselar, J. G., Janmey, P. A., Almo, S. C., Chance, M. R. Structural analysis of gelsolin using synchrotron protein footprinting. Molecular and Cellular Proteomics. 2 (10), 1120-1132 (2003).
- Chea, E. E., Deredge, D. J., Jones, L. M. Insights on the Conformational Ensemble of Cyt C Reveal a Compact State during Peroxidase Activity. Biophysical Journal. 118 (1), 128-137 (2020).
- Poor, T. A., et al. Probing the paramyxovirus fusion (F) protein-refolding event from pre- to postfusion by oxidative footprinting. Proceedings of the National Academy of Sciences U S A. 111 (25), 2596-2605 (2014).
- Roush, A. E., Riaz, M., Misra, S. K., Weinberger, S. R., Sharp, J. S. Intrinsic Buffer Hydroxyl Radical Dosimetry Using Tris(hydroxymethyl)aminomethane. Journal of American Society of Mass Spectrometry. 31 (2), 169-172 (2020).
- Everett, E. A., Falick, A. M., Reich, N. O. Identification of a critical cysteine in EcoRI DNA methyltransferase by mass spectrometry. Journal of Biological Chemistry. 265 (29), 17713-17719 (1990).
- Sanderson, R. J., Mosbaugh, D. W. Identification of specific carboxyl groups on uracil-DNA glycosylase inhibitor protein that are required for activity. Journal of Biological Chemistry. 271 (46), 29170-29181 (1996).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены