Method Article
بسيطة، بأسعار معقولة، ونمط وحدات من الخلايا باستخدام الحمض النووي
In This Article
Summary
هنا نقدم بروتوكولا لخلايا الخلايا الدقيقة بدقة خلية واحدة باستخدام التصاق مبرمجة الحمض النووي. يستخدم هذا البروتوكول منصة تصوير ضوئي على سطح المقعد لإنشاء أنماط أوليغونوكليوتيدات الحمض النووي على شريحة زجاجية ثم تسميات أغشية الخلايا مع أوليغونوكليوتيدات تكميلية متاحة تجاريا. التهجين من oligos النتائج في التصاق الخلايا المبرمجة.
Abstract
تحديد المواقع النسبية للخلايا هو سمة رئيسية من سمات البيئة الدقيقة التي تنظم التفاعلات بين الخلية والخلية. لدراسة التفاعلات بين الخلايا من نفس النوع أو نوع مختلف، أثبتت تقنيات الترنيخ الدقيق فائدتها. الحمض النووي المبرمجة تجميع الخلايا (DPAC) هو تقنية micropatterning التي تستهدف التصاق الخلايا إلى ركيزة أو غيرها من الخلايا باستخدام التهجين الحمض النووي. تبدأ العمليات الأساسية في DPAC بتزيين أغشية الخلايا مع أوليغونوكليوتيدات معدلة بالدهون ، ثم تتدفق عليها فوق ركيزة تم نقشها بتسلسل الحمض النووي التكميلي. تلتزم الخلايا بشكل انتقائي بالركيزة فقط عندما تجد تسلسل الحمض النووي التكميلي. يتم غسل الخلايا غير الملتصقة ، مما يكشف عن نمط من الخلايا الملتصقة. وتشمل العمليات الإضافية جولات أخرى من الركيزة الخلوية أو التصاق خلايا الخلية، فضلا عن نقل الأنماط التي شكلتها DPAC إلى هيدروجيل مضمن للثقافة على المدى الطويل. في السابق، كانت طرق نقش أوليغونوكليوتيدات على الأسطح وتزيين الخلايا بتسلسلات الحمض النووي تتطلب معدات متخصصة وتوليف الحمض النووي المخصص، على التوالي. نحن تقرير نسخة محدثة من البروتوكول، وذلك باستخدام الإعداد الضوئي benchtop رخيصة والكوليسترول المتاحة تجاريا تعديل أوليغونوكليوتيدات (CMOs) نشرت باستخدام شكل وحدات. تلتزم الخلايا المسماة بالكائنات الحية المغلقة بكفاءة عالية بالركائز المنقوشة بالحمض النووي. يمكن استخدام هذا النهج لنمط أنواع خلايا متعددة في وقت واحد بدقة عالية وإنشاء صفائف من الخلايا المجهرية المضمنة في مصفوفة خارج الخلية. وتشمل مزايا هذه الطريقة دقتها العالية، وقدرتها على تضمين الخلايا في بيئة صغيرة ثلاثية الأبعاد دون تعطيل الميكروبيترن، والمرونة في نقش أي نوع من الخلايا.
Introduction
تحديد مواقع الخلايا فيما يتعلق بعضها البعض في الأنسجة هو سمة هامة من سمات البيئة الدقيقة1،2،3،4. التقنيات المستخدمة لنمط الخلايا الحية في ترتيبات تسيطر عليها مكانيا هي أدوات تجريبية قيمة لدراسة التمايز4،5،6،7،8، حركية الخلية9، مورفوجينيسيس10،11،12، التمثيل الغذائي13، وتفاعلات الخلية الخلية7،14 . وهناك مجموعة متنوعة من الأساليب لخلايا النقش، ولكل منها مزاياها الخاصةوعيوبها 3،4. الطرق التي تخلق جزر لاصقة من البروتينات مصفوفة خارج الخلية (ECM) ، مثل الطباعة microcontact والاستنسل قطع الليزر ، هي بسيطة وقابلة للتطوير. ومع ذلك، فمن الصعب لنمط أكثر من واحد أو اثنين من أنواع الخلايا في وقت واحد لأن خصائص لاصقة من أنواع الخلايا المختلفة لجزيئات ECM مختلفة غالبا ما تكون مماثلة15،16،17. يمكن إنشاء أجهزة مجهرية أكثر تعقيدا مع الامتزاز الجزيئي الناجم عن الضوء (LIMAP) ، وهي تقنية تستخدم ضوء الأشعة فوق البنفسجية لتبخيض المناطق المغلفة PEG والسماح لامتزاز البروتين اللاحق18،19. يمكن تكرار هذه العملية لإنشاء أجهزة مجهرية عالية الدقة ذات أنواع خلايا متعددة. ومع ذلك ، يمكن أن يحدث ربط الخلايا عبر بقع البروتين المختلفة ، مما يؤدي إلى سوء خصوصية النمط19. يمكن للأساليب الفيزيائية مثل زرع الخلايا على أجهزة الثقافة القابلة لإعادة التشكيل الميكروميكاميكية إنشاء ثقافات مشتركة منظمة مع التحكم الديناميكي ، ولكن دون مرونة في تصميم نمط الطباعة microcontact أو LIMAP14،8. على عكس التقنيات الأخرى ، يمكن للطباعة الحيوية إنشاء ترتيبات ثلاثية الأبعاد للخلايا داخل الهيدروجيل20،21. ومع ذلك ، فإن البنى المطبوعة بيولوجيا لديها دقة أقل بكثير من تقنيات micropatterning الأخرى ، مع متوسط حجم الميزة على ترتيب مئات الميكرونات22. وهناك طريقة مثالية لأنماط الخلية لديها عالية الدقة، وأنماط أنواع الخلايا المتعددة، واستخدام المعدات والكواشف التي يمكن الوصول إليها بسهولة، ولها القدرة على تضمين أنماط ناجحة في هيدروجيل لثقافة الخلية ثلاثية الأبعاد (3D). في هذه المقالة، نقدم CMO-DPAC، تقنية التصغير الخلية التي تستخدم مرونة وسرعة تهجين الحمض النووي لاستهداف الالتصاق الخلية إلى الركيزة. وقد تم تكييف هذه الطريقة من بروتوكولاتنا السابقة23،24 لجعلها أكثر بأسعار معقولة ، وحدات ، ويمكن الوصول إليها. وباستخدام البروتوكول الحالي، ينبغي أن يكون أي مختبر قادرا على إنشاء نظام يعمل بكامل طاقته دون أي معدات أو خبرات متخصصة.
الحمض النووي المبرمجة تجميع الخلايا (DPAC) هو تقنية قوية هندسة الأنسجة التي أنماط الخلايا في قرار خلية واحدة مع السيطرة الدقيقة على تباعد الخلايا الخلية وهندسة الأنسجة. في DPAC ، زينت أغشية الخلايا مع أوليغونوكليوتيدات الحمض النووي (أوليغوس) باستخدام اثنين من أوليغو تعديل الدهون المصممة للتهجين على غشاء الخلية. لأن يتم اقتران أوليغو إلى الدهون الكارهة للماء، فإنها تقسيم بسرعة إلى غشاء الخلية25 حيث أنها تهجين، وزيادة صافي رهاب الماء من الجزيئات غير ملزمة بشكل متناقض، وبالتالي تعزيز حياتهم على سطح الخلية26. يتم تقديم oligos على سطح الخلية بطريقة حيث يمكنهم التهجين مع أوليغو تكميلية على خلايا أخرى أو شرائح زجاجية تعمل بالحمض النووي لإنشاء أنماط خلايا 2D أو 3D محددة مع التركيب الموصوف ، وتباعد خلايا الخلية ، والهندسة23،24. يمكن أن تكون مشقوق microtissues منقوشة الخروج من السطح انزيميا وجزءا لا يتجزأ من هيدروجيل للثقافة 3D لفترات طويلة. عند استخدامها في تركيبة مع الخلايا الأساسية أو الخلايا الجذعية ، يمكن أن تخضع المجموعات الناتجة من الخلايا لنشأة مورفوجينيسيس وتتشكل إلى أعضاءعضوية 23و27و28. وقد تم تطبيق DPAC للتحقيق في ديناميات مصير الخلايا الجذعية العصبية الكبار ردا على الإشارات المتنافسة6,29, لدراسة التنظيم الذاتي للخلايا الظهارية الثديية23,28, وتوليد "اوريغامي الأنسجة" من خلال التكثيف mesenchymal27.
DPAC يسمح لوضع دقيق من مجموعات خلايا متعددة ولها دقة أفضل بكثير من الطابعات الحيوية القائمة على البثق (على ترتيب ميكرون)22،23. بالإضافة إلى ذلك ، على عكس أساليب النقش المستندة إلى ECM مثل الطباعة الدقيقة ، لا تتطلب DPAC التصاقا تفاضلا لأنواع الخلايا المختلفة بسطح مغلف ب ECM15و23. وهو مثالي للإجابة على الأسئلة حول كيفية تأثير تكوين الأنسجة على سلوكه ، وكيف تدمج الخلايا إشارات خلوية وبيئة دقيقة متعددة عند اتخاذ القرارات6،29، وكيف تتفاعل أزواج الخلايا مع بعضها البعض. ميزة هذه الطريقة على غيرها من أساليب micropatterning هو أنه يمكن استخدامه لثقافة الخلايا 3D في طائرة تصوير واحدة، وتسهيل دراسات الفاصل الزمني للتنظيم الذاتي الأنسجة والمورفوجيني العضوي23،27،30.
على الرغم من هذه المزايا، يتطلب التنفيذ الناجح ل DPAC تركيب كواشف أوليغونوكليوتيد مخصصة والوصول إلى المعدات المتخصصة لأنماط الحمض النووي23،24، مما يحد من التبني على نطاق واسع. على سبيل المثال، يجب أن تكون القلة المعدلة الدهون الأمثل (LMOs) المستخدمة في البروتوكول الأصلي توليفها خصيصا، وتعديلها مع حمض الليغنوسيريك أو حمض البالمتيك، وتنقية26. وتتطلب هذه العملية استخدام مركب الحمض النووي وأداة كروماتوغرافيا سائلة عالية الأداء، فضلا عن شراء الكواشف المرتبطة بها مثل الميثيلامين، وهي مادة خاضعة للرقابة وتخضع للوائح المؤسسية والاتحادية على حد سواء. وكبديل عن ذلك، يمكن شراء الكائنات الحية المحورة بشكل مخصص بكميات كبيرة، ولكن هذا يتطلب استثمارا مقدما كبيرا في التكنولوجيا.
للتغلب على هذه القيود، قمنا بتطوير نسخة منقحة من DPAC التي تستخدم أوليغو المعدلة الكوليسترول المتاحة تجاريا (CMOs) بدلا من الكائنات الحية المحورة توليفها حسب الطلب. لزيادة خفض التكاليف وزيادة مرونة المنصة ، قمنا بتغيير نظام وحدات ، ثلاثة أوليغو. بدلا من طلب أوليغو جديد معدلة الكوليسترول لكل مجموعة خلايا فريدة من نوعها، يمكن للمستخدم من هذا البروتوكول بدلا من ذلك استخدام نفس أوليغوس المعدلة الكوليسترول ("مرساة العالمي" و "العالمي المشترك مرساة") لكل مجموعة من الخلايا ومن ثم توظيف غير مكلفة، أوليغو غير معدلة ("محول ستراند") أن تهجين مع كل من مرساة العالمي وإما الحمض النووي أمين وظيفية على السطح أو حبلا محول من نوع خلية أخرى.
وكان قيد آخر من بروتوكول DPAC الأصلي أنه خلق الشرائح منقوشة الحمض النووي باستخدام طابعة سائلة عالية الدقة (على سبيل المثال، نانو eNabler، BioForce علوم النانو)23،24. في حين أن هذا الصك يضم دقة استثنائية ومتطلبات كاشف منخفضة، فإنه غير متوفر لمعظم المؤسسات ولديه معدل طباعة منخفض نسبيا (حوالي 1 سمة منقوشة في الثانية). في الآونة الأخيرة، تم تطوير طريقتين فوتوليتوغرافية لنمط ملامح الحمض النووي على الأسطح. فيولا وزملاؤه استخدام طلاء البولي أكريلاميد والبنزوفينون التي تربط بشكل متناقض واحد تقطعت بهم السبل Oligos الحمض النووي عند التعرض للأشعة فوق البنفسجية الخفيفة30. وباستخدام هذه الطريقة، تمكنوا من إنشاء سقالات أنسجة خضعت لتغييرات واسعة النطاق مبرمجة في الشكل نتيجة انقباض الخلايا والتنظيم الذاتي. Scheideler وآخرون وضعت طريقة تستخدم التعرض للأشعة فوق البنفسجية من مضاد للضوء إيجابية لفضح انتقائي أمين تعديل الحمض النووي oligos إلى الشريحة aldehyde وظيفية29. بعد الخبز والاختزال، يرتبط الحمض النووي المعدل بالأمين بالسطح بشكل مشترك. وقد استخدمت هذه الطريقة للتحقيق في استجابة الخلايا الجذعية العصبية البالغة للتجديد الذاتي المقدم مكانيا وإشارات التمايز. هذه المقالة تتكيف مع بروتوكول Scheideler وآخرون لإنشاء أنماط الحمض النووي التي سوف التقاط الخلايا CMO المسمى. يمكن تنفيذ بروتوكول التصوير الضوئي هذا دون استخدام غرفة نظيفة. ويستخدم معدات غير مكلفة ومتاحة تجاريا التي يتم نشرها بسهولة على مقاعد البدلاء أو غطاء محرك السيارة الدخان. استخدام معدات التصوير الضوئي غير مكلفة أو DIY (افعل ذلك بنفسك) يزيد من إمكانية الوصول إلى الباحثين دون الوصول إلى مرافق الغرف النظيفة ويسمح للباحثين بتجربة هذه التقنية دون استثمار كبير في الوقت أو الموارد31،32. ومع ذلك، يمكن تحقيق دقة أفضل ومحاذاة ميزات الحمض النووي متعددة باستخدام المغلف تدور التجارية وقناع المحاذاة الموجودة عادة في مرافق غرفة نظيفة.
هنا، نقوم بوصف طريقة لأنماط الخلايا بدقة الخلية الواحدة باستخدام التصاق الحمض النووي. أولا، يتم استخدام التصوير الضوئي باستخدام جهاز مضاد ضوئي إيجابي لإنشاء أنماط عالية الدقة من الحمض النووي المعدل الأمين على ركيزة زجاجية معدلة من ألدهيد. بعد ذلك، يتم التعامل مع الشريحة لتقليل مرفق الخلية غير محددة ويتم إنشاء خلايا تدفق PDMS لحصر الخلايا عبر المناطق المنقوشة. ثم يتم تسمية الخلايا مع أوليغونوكليوتيدات الحمض النووي قصيرة التي تعمل مع الكوليسترول ونتيجة لذلك إدراج في غشاء الخلية. ثم تتدفق الخلايا فوق الخلايا الدقيقة للحمض النووي. يؤدي التهجين بين الحمض النووي سطح الخلية والحمض النووي على سطح الزجاج إلى التصاق محدد للخلايا بنمط الحمض النووي. يتم غسل الخلايا غير الملتصقة ، مما يكشف عن نمط الخلية الملتصقة. يمكن تكرار هذه العملية لأنماط أنواع خلايا متعددة أو لإنشاء بنيات متعددة الطبقات. إذا رغبت في ذلك، يمكن أن تكون جزءا لا يتجزأ من الخلايا بالكامل في ECM لثقافة الخلية 3D.
Protocol
1. تجربة التصميم
- تخطيط التجربة المطلوبة، مع الأخذ في الاعتبار حجم الميزة، والتباعد بين الميزات، وعدد أنواع الخلايا المعنية، وترتيب الخلايا فيما يتعلق بعضها البعض. الرجوع إلى ملف تكميلي 1, دليل للتصميم التجريبي, وملف تكميلي 2, الذي يحتوي على تسلسل أوليغو المثال.
- تصميم قناع ضوئي باستخدام برنامج تصميم بمساعدة الكمبيوتر. مثال على ذلك يتم توفير قناع ضوئي في الملف التكميلي 3.
- رسم مستطيل أبعاد شريحة المجهر القياسية (25 ملم × 75 ملم).
- رسم أربع مناطق مستطيلة 10 ملم واسعة و 10 ملم طويلة، موزعة بالتساوي عبر الشريحة.
- ضمن كل منطقة، رسم الميزات التي هي الحجم والشكل والتباعد المطلوب للتجربة. سوف تلتزم الخلايا بهذه الميزات فقط في التجربة.
- لإنشاء كتل ضوئية متوائمة لأنواع خلايا متعددة، قم بإنشاء رسم رئيسي مع كافة مجموعات الميزات، ثم احفظ الإصدارات التي تتوافق مع كل نوع من أنواع الخلايا.
- اطلب قناع ضوئي عالي الدقة (20000 نقطة على الأقل لكل بوصة) الشفافية من هذا الرسم CAD مع الميزات المرسومة في 1.2.3 شفافة والمناطق الأكبر باللون الأسود.
2. الحمض النووي Photopattern على الشرائح aldehyde وظيفية (بروتوكول مقتبس من Scheideler وآخرون.29 )
- إذا نقش أنواع خلايا متعددة، تلفيق علامات fiducial على الشريحة aldehyde وظيفية قبل أي نمط الحمض النووي لتسهيل محاذاة الميزات. ويقترح أساليب بديلة لإنشاء علامات fiducial في ملف التكميلية 1.
- لإنشاء علامات المعادن fiducial، وتطبيق S1813 إيجابية الضوئية كما هو موضح في الخطوات 2.3 -2.11. استخدم قناع ضوئي يحتوي على ميزات كبيرة يسهل محاذاتها لاحقا. دمج هذه الميزات في تصميم الكتل الضوئية التي سيتم استخدامها لأنماط الحمض النووي.
- إيداع فيلم رقيقة (100 Angstroms) من التيتانيوم على الشريحة باستخدام التبخر الإلكترون بندقية29. إزالة المعادن الزائدة وواقعي باستخدام الأسيتون، ومن ثم المضي قدما إلى photopatterning الحمض النووي.
- إعداد محلول 20 ميكرومتر من أوليغو 5'-الأمين المعدلة في مخزن الحمض النووي (50 مليون متر من فوسفات الصوديوم في الماء، درجة الحموضة = 8.5). انظر الملف التكميلي 2 لتسلسل oligo المقترحة.
ملاحظة: من الممكن استخدام أقل من 5 ميكرومتر من أوليغو المعدلة الأمين لبعض الأنماط والتطبيقات، لذلك قد تحتاج إلى تركيز الحمض النووي السطحي إلى تحسين. - سخني طبق ساخن مسبقا إلى 100 درجة مئوية.
- استخدام الشريط على الوجهين أو فراغ لإرفاق شريحة زجاجية تعمل بالالديهايد إلى الدوار من معطف تدور.
تنبيه: مفرزة الشرائح أثناء الطلاء الدوراني هي خطر على السلامة. استخدم دائما معطف الدوران في حاوية مغلقة مع غطاء ، مثل صندوق الأكريليك.
ملاحظة: تسمية زاوية الشريحة باستخدام كاتب الماس أو تنفيذ مشابهة إلى خدش الزجاج. يساعد هذا في تحديد الشريحة والتوجه بعد غسلها من قبل الكواتر الضوئي. - استخدام ماصة المتاح لإسقاط الضوئية إيجابية على الشريحة ألدهيد. حتى بالنسبة للطلاء، إضافة قطرات صغيرة من فوتوريست عبر الشريحة، بدلا من قطرة واحدة كبيرة في الوسط(الشكل التكميلي 1A).
- باستخدام coater الدوران، تدور الشريحة في 3000 دورة في الدقيقة لمدة 30 s.
- ضع الشريحة على لوحة ساخنة 100 درجة مئوية لمدة 1.5 دقيقة (خبز ناعم) للحفاظ على الروابط المتقاطعة.
- إزالة الشريحة من لوحة ساخنة. وضع قناع ضوئي مع الميزات المطلوبة لهذه التجربة على رأس الشريحة وتزن قناع ضوئي أسفل مع قطعة من الزجاج (الشكل التكميلي 1B، C). قم بتغطية الإعداد بالكامل في مربع معتم(الشكل التكميلي 1D). يعرض مع مصباح الأشعة فوق البنفسجية (الطول الموجي 365 نانومتر، 360 كيلوواط، 5 بوصات من الشريحة، مجموع كثافة الطاقة المشعة 100 mJ/cm2) لمدة 2 دقيقة.
ملاحظة: سوف الضوء فوق البنفسجي كسر السندات البوليمر في قارورة ضوئية تحت مناطق شفافة من قناع ضوئي، وخلق المناطق حيث الحمض النووي سوف تكون قادرة على الانضمام في وقت لاحق. - تطوير الشريحة عن طريق الانغماس في حل المطور لمدة 3-5 دقائق (الشكل التكميلي 1E).
- شطف بعيدا حل المطور الزائد بالماء. الجافة تحت تيار من الهواء أو النيتروجين. (الشكلالتكميلي 1F).
- تأكد من نجاح التصوير الضوئي من خلال النظر إلى الشريحة تحت المجهر. نظرا لأن حساسية حساسية ضوء الأشعة فوق البنفسجية هي حساسية لأخصائي التصوير الضوئي، قم بهذه الخطوة بسرعة ثم قم بتخزين الشريحة في الظلام أثناء إعداد الشرائح الأخرى (إن وجدت).
ملاحظة: يجب أن يكون لشريحة منقوشة بنجاح حواف محددة بشكل حاد لكل ميزة، ولا تكسير، ولا يوجد تشويه للميزة عند الحواف. وترد أمثلة من التصوير الضوئي الصحيح وغير صحيحة في الشكل التكميلي 2A. راجع الجدول 1 لاستكشاف الاقتراحات إذا لم يوفر التصوير الضوئي جودة الميزة المطلوبة. - أضف قطرة من محلول أوليغو المعدل 20 ميكرومتر (الخطوة 2.1) على كل منطقة فوتوباترنيد من الشريحة. استخدام طرف ماصة لنشر بلطف قطرة في جميع أنحاء المنطقة بأكملها، مع الحرص على عدم خدش الشريحة. (الشكل التكميلي 1G).
- خبز الشريحة في فرن 65-70 درجة مئوية حتى محلول الحمض النووي قد جفت تماما على سطح الشريحة (حوالي 1 ساعة).
- أداء أمينة اختزالية عن طريق وضع منقوشة، والشرائح المخبوزة في طبق 15 سم الخلية الثقافة ووضعها في غطاء محرك السيارة الدخان على رأس شاكر. تزن 100 ملغ من بوروهيدريد الصوديوم. في غطاء الدخان، أضف 40 مل من المالحة المخزنة بالفوسفات (PBS)، واخلطها برفق، وأضفها إلى الطبق الذي يحتوي على الشرائح المنقوشة. دع رد الفعل يستمر لمدة 15 دقيقة مع اهتزاز لطيف.
ملاحظة: الأمين على أوليغو يشكل أولا قاعدة شيف مع aldehydes على سطح الشريحة. هذا هو السند التساهمي عكسها التي يجب تحويلها إلى سند لا رجعة فيه قبل استخدامها في DPAC. إضافة عامل تخفيض (بوروهيدريد الصوديوم) يحول قاعدة شيف إلى أمين ثانوي عن طريق الأمينية الاختزالية.
تنبيه: تفاعل بوروهيدريد الصوديوم بالماء يخلق غاز الهيدروجين وسيستمر في القيام بذلك لساعات أو أيام بعد بدء التفاعل. قم بتنفيذ خطوة الأمينية الاختزالية في غطاء الدخان والحفاظ على جميع نفايات محلول بوروهيدريد الصوديوم في حاوية مفتوحة أو مغطاة بشكل فضفاض في غطاء الدخان لمدة 24 ساعة على الأقل. - إزالة الحمض النووي غير المنقحة عن طريق غسل مرتين مع 0.1٪ كبريتات دودسيل الصوديوم (SDS) في الماء، ثم ثلاث مرات مع الماء المقطر. جفف الشريحة تحت تيار من النيتروجين أو الهواء.
- شطف الشريحة مع الأسيتون لإزالة مزيلات ضوئية المتبقية.
ملاحظة: في هذه المرحلة، تم ربط الحمض النووي بشكل لا رجعة فيه وبشكل متناقض بالشريحة وتم تحويل جميع المجموعات الوظيفية الألديهيد غير المتفاعلة إلى كحول. لم تعد هناك حاجة إلى وازالة الصور. - إذا تم نقش oligos متعددة، والعودة إلى الخطوة 2.4، محاذاة قناع ضوئي مع علامات fiducial، وكرر.
ملاحظة: يمكن إيقاف التجربة مؤقتا هنا. تخزين الشرائح في فراغ المجفف. في ظل الظروف الجافة، يمكن تخزين الشرائح لمدة تصل إلى 3 أشهر دون فقدان الجودة.
3. جعل الشريحة الكارهة للماء (اختياري) (بروتوكول مقتبس من تودهنتروآخرون. 24 )
ملاحظة: من المفيد، ولكن ليس مطلوبا، تعديل كيمياء سطح الشريحة لجعلها أكثر خاملة ومسعورة. يتم تقليل مرفق الخلية غير محددة على هذه السطوح33، وبالتالي التخفيف من ربط غير محددة من الخلايا إلى مناطق غير منقوشة من الشريحة. بالإضافة إلى ذلك ، إذا كانت الخلايا المنقوشة سيتم تضمينها في نهاية المطاف داخل الهيدروجيل ونقلها من الشريحة ، فإن المعالجة السطحية ضرورية لحركة موثوقة للهيدروجيل المحمل بالخلايا عبر الشريحة دون تشويه أو تمزق. السيلانينج مع (tridecafluoro-1,1,2,2-رباعي هيدروكتيل) ثنائي ميثيل كلوروسلين يؤدي إلى وجود مجموعات فلوراولكيل الكارهة للماء على سطح الشريحة.
تنبيه: قم بتنفيذ جميع الخطوات من 3.1 فصاعدا في غطاء الدخان الكيميائي لمنع التعرض لأبخرة كلوريد الخليك وحمض الخليك.
- شطف الشريحة مع حمض الخليك 10٪ ثم تجف تحت تيار الهواء.
- في جرة كوبلين زجاجية، قم بإعداد محلول من كلوريد الميثيلين 60 مل (ثنائي كلورو الميثان)، و0.6 مل من ثلاثي الإيثيلامين، و0.6 مل من ثنائي هيدروسيلكلوروسيلين (tridecafluoro-1,1,2,2-tetrahydrooctyl). يحرك المزيج مع ملعقة معدنية ليخلط.
ملاحظة: هذه الكواشف حساسة للماء. وينبغي تخزينها في ظروف جافة واستخدامها طازجة قدر الإمكان. - أضف الشريحة إلى جرة كوبلين التي تحتوي على محلول السيلان. ضع جرة كوبلين على شاكر مداري (تعيين إلى 60-80 دورة في الدقيقة) والسماح لرد فعل السيلان والشريحة للتقدم لمدة 15 دقيقة.
- استخدام ملقط معدني لإزالة الشريحة من محلول سيلان. انغمس في جرة كوبلين تحتوي على كلوريد الميثيلين لمدة دقيقة واحدة لإزالة السيلان الزائد من الشريحة.
- تزج الشريحة في أنبوب مخروطي 50 مل تحتوي على الإيثانول. أهاج. تزج الشريحة في أنبوب مخروطي 50 مل تحتوي على الماء المقطر. أهاج.
ملاحظة: كلوريد الميثيلين والماء ليست خاطئة، لذلك هناك حاجة إلى شطف الإيثانول لإزالة كلوريد الميثيلين الزائد قبل شطف الماء النهائي. - إزالة الشريحة من الماء وتفتيشها. يجب أن تكون الشريحة جافة إلى حد ما ، مع وجود أي قطرات ماء بزاوية اتصال تزيد عن 90 درجة. السماح للشرائح لتجف تماما وتخزينها في فراغ المجفف حتى الاستخدام.
ملاحظة: يمكن إيقاف التجربة مؤقتا هنا. تخزين الشريحة تحت ظروف جافة.
4. إعداد خلايا تدفق PDMS والانزلاق للتجربة
ملاحظة: يتم استخدام خلايا تدفق PDMS مستطيلة لتركيز الخلايا فوق المناطق المنقوشة من الشريحة. للتجارب المستزرعة في 3D، تشكل خلايا التدفق قالبا للهيدروجيل.
- جعل SU-8 الرئيسية لاستخدامها كقالب لخلايا تدفق PDMS.
- ما قبل الحرارة الساخنة إلى 95 درجة مئوية.
- أضف 5 مل من SU-8 2075 إلى رقاقة السيليكون.
- تدور معطف SU-8 على رقاقة في 500 دورة في الدقيقة لمدة 10s، تليها 1000 دورة في الدقيقة لمدة 30s. هذا يجب أن يخلق ميزات تصل إلى 240 ميكرومتر في ارتفاع34.
- خبز ناعم رقاقة على لوحة ساخنة لمدة 45 دقيقة على الأقل.
- إزالة رقاقة من لوحة ساخنة. ضع قناع الصورة (انظر الملف التكميلي 4)(الجانب المستحلب لأسفل) أعلى الرقاقة وقم بوزنه بقرص زجاجي لضمان الاتصال بين قناع الصورة والشريحة.
- عرض مع ضوء الأشعة فوق البنفسجية (365 نانومتر) لكثافة الطاقة مشع من 350 mJ/cm2.
- خبز رقاقة على لوحة ساخنة لمدة 12-15 دقيقة.
- ضع رقاقة في وعاء زجاجي واسع. رقاقة تغطية مع SU-8 حل المطور. مكان على شاكر وتطوير أثناء التحريض لمدة 15 دقيقة على الأقل.
- استخدم ملقط لإزالة رقاقة من الحل المطور. شطف لمدة 5 ق عن طريق رش محلول المطور أكثر من زجاجة بخ. رش مع الكحول ايزوبروبيل لشطف. إذا ظهر ترسب أبيض، أعد الرقاقة إلى حل المطور وطورها لفترة أطول.
- رقاقة جافة تحت تيار من الهواء أو النيتروجين.
- خبز الشريحة لمدة 5 دقائق.
ملاحظة: بمجرد إنشاء رقاقة رئيسية يمكن إعادة استخدامها إلى أجل غير مسمى طالما تبقى الميزات سليمة.
- إعداد PDMS.
- في قارب وزن، إضافة البوليديمثيلسيلوكسيان الاستومر واللينكر في نسبة 10:1 (حسب الكتلة). يحرك بقوة لضمان حتى خلط.
- إزالة الغاز PDMS في فراغ المجفف لمدة 15-30 دقيقة حتى لا مزيد من الفقاعات مرئية.
- ضع الرقاقة الرئيسية في طبق زراعة الأنسجة 15 سم. صب PDMS على رقاقة. إذا ظهرت فقاعات، دي الغاز في مجفف فراغ لبضع دقائق.
- خبز في فرن 60 درجة مئوية لمدة 3 ساعة.
ملاحظة: بعد الخبز، يمكن تخزين خلايا تدفق PDMS على سطح المقعد إلى أجل غير مسمى.
- قم بإعداد خلايا تدفق PDMS للتجربة.
- قبل وقت قصير من بدء تجربة CMO-DPAC ، اقطع العدد المطلوب من خلايا تدفق PDMS من الرقاقة الرئيسية. تتأكسد البلازما مع 10 سم مكعب / دقيقة هواء الغرفة لمدة 90 ثانية لجعل هيدروفيليك السطح.
- قطع كل خلية تدفق الفردية بحيث يكون هناك 1-2 مم من PDMS المتبقية على كل جانب، ثم قطع فتح الجزء العلوي والسفلي من الخلية تدفق لإنشاء مدخل ومنفذ.
- استرداد الشريحة المنقوشة التي تم إنشاؤها في الخطوتين 2 و3. محاذاة أعلى قناع ضوئي.
- باستخدام قناع ضوئي كمرجع، ضع خلايا تدفق PDMS على الشريحة في موقع كل منطقة منقوشة.
- إضافة 50 ميكرولتر من الفوسفات المالحة المخزنة (PBS) + 1٪ ألبوم مصل البقر (BSA) إلى مدخل كل خلية تدفق، كما هو مبين في الشكل التكميلي 1H. تأكد من أن الخلية تدفق شغلها تماما من قبل برنامج تلفزيوني + 1٪ BSA وأنه لا توجد فقاعات كبيرة. انتقل فورا إلى الخطوتين 5 و6.
ملاحظة: الحظر باستخدام BSA يقلل من الالتصاق غير المحدد للخلية إلى سطح الشريحة.
5. رفع وتسمية الخلايا مع الحمض النووي المعدلة الكوليسترول
- إعداد حلول الحمض النووي المعدلة الكوليسترول.
- لكل مجموعة من الخلايا في التجربة، اخلط معا 3 ميكرولتر من محلول مخزون 100 ميكرومتر من ستراند المرساة العالمي المعدلة في الكوليسترول مع 3 ميكرولتر من محلول مخزون 100 ميكرومتر من حبلا المحول. حضانة لمدة 1 دقيقة. هذا سوف تهجين مسبقا أوليغوس. إضافة 69 ميكرولتر من المالحة الفوسفات المخزنة (PBS) لإنشاء 4 ميكرومتر مرساة العالمي + محول الحل.
- لكل مجموعة من الخلايا في التجربة، إضافة 3 ميكرولتر من 100 ميكرومتر عالمي الكوليسترول المعدلة المشترك مرساة ستراند حل الأسهم إلى 12 ميكروغرام من برنامج تلفزيوني، وخلق حل 20 ميكرومتر.
- إعداد تعليق خلية واحدة (ق).
- بالنسبة للخلايا الملتصقة، استخدم التريبسين أو أي عامل انفصال آخر لإزالة الخلايا من قارورة الثقافة. إضافة وسائل الإعلام الثقافية لتحييد التريبسين والطرد المركزي لبيليه الخلايا. للخلايا غير الملتصقة، اجمع تعليق الخلية والطرد المركزي لكريات الخلايا.
- Resuspend بيليه الخلية في 1 مل من الجليد الباردة PBS أو وسائل الإعلام الخالية من المصل. نقل 1-3 ملايين خلية إلى أنبوب 1.5 مل من أجهزة الطرد المركزي الدقيق. جهاز طرد مركزي عند 160 x g لمدة 4 دقائق.
ملاحظة: إذا كان نوع الخلية المستخدمة عرضة للتكتل/ التجميع، فاستخدم برنامج تلفزيوني بدون أيونات الكالسيوم والمغنيسيوم لجميع خطوات الغسيل لتقليل تجميع الخلايا غير المرغوب فيها. إذا كانت الجدوى مصدر قلق خاص لنوع الخلية المستخدمة، استخدم الوسائط الخالية من المصل بدلا من PBS. لا ينصح وسائل الإعلام التي تحتوي على مصل البقر الجنيني لوسم الخلية لأنها يمكن أن تعوق دمج أوليغوس المعدلة الدهون. 35
- تسمية الخلايا مع أوليغوس المعدلة الكوليسترول.
- Resuspend بيليه الخلية في 75 ميكروغرام من الجليد الباردة PBS أو وسائل الإعلام الخالية من المصل. الحفاظ على الخلايا في دلو الثلج في جميع أنحاء عملية وضع العلامات والغسيل لتحقيق أقصى قدر من صلاحية الخلية وتقليل فقدان أوليغو المعدلة الكوليسترول من سطح الخلية.
ملاحظة: إعادة تعليق الخلايا قبل إضافة الحمض النووي يضمن أن توزيع الحمض النووي موحد عبر مجموعة الخلايا. - أضف 75 ميكرولتر من محلول المرساة العالمي + المحول 4 ميكرومتر الذي تم إنشاؤه في الخطوة 5.1.1 إلى أنبوب الطرد المركزي الدقيق الذي يحتوي على تعليق الخلية. تخلط جيدا عن طريق pipetting. حضانة لمدة 5 دقائق على الجليد.
- أضف 15 ميكرولتر من حل الإرساء المشترك العالمي إلى أنبوب الطرد المركزي الدقيق. تخلط جيدا عن طريق pipetting. حضانة لمدة 5 دقائق على الجليد.
- إزالة أوليغو الزائدة من تعليق الخلية. أضف 1 مل من برنامج تلفزيوني بارد أو وسائط خالية من المصل إلى أنبوب الطرد المركزي الدقيق. مزيج مع ماصة P1000. جهاز طرد مركزي عند 160 x g لمدة 4 دقائق عند 4 درجات مئوية. تجاهل الناتنات الفائق. كرر مرتين أخريين.
ملاحظة: إذا كانت الخلايا عرضة للتكتل، مرر تعليق الخلية من خلال فلتر 40 ميكرومتر قبل الغسل النهائي. إذا كانت الخلايا عرضة للامتزاز على جانب أنبوب الطرد المركزي الدقيق، ففكر في منع الأنبوب مسبقا باستخدام الكازين.
- Resuspend بيليه الخلية في 75 ميكروغرام من الجليد الباردة PBS أو وسائل الإعلام الخالية من المصل. الحفاظ على الخلايا في دلو الثلج في جميع أنحاء عملية وضع العلامات والغسيل لتحقيق أقصى قدر من صلاحية الخلية وتقليل فقدان أوليغو المعدلة الكوليسترول من سطح الخلية.
6. نمط الخلايا المسماة الحمض النووي
- إعادة إنفاق الخلايا في برنامج تلفزيوني الجليد الباردة أو وسائل الإعلام الخالية من المصل لخلق حل الخلايا الكثيفة من ما لا يقل عن 25 مليون خلية / مل.
ملاحظة: بالنسبة لشريحة واحدة باستخدام أربعة من خلايا تدفق PDMS مقاس 10 مم × 15 مم × 200 ميكرومتر الموضحة في الخطوة 4، يلزم وجود حوالي 100 ميكرولتر من تعليق الخلية الكثيف هذا. على الرغم من أن معظم هذه الخلايا لن تلتزم بالنمط وسيتم التخلص منها في نهاية المطاف ، فإن وجود حل مركز للغاية للخلايا على النمط يحسن بشكل كبير من كفاءة نقش الخلايا. - التقط الشريحة وإمالتها قليلا. أضف 25 ميكرولتر من تعليق الخلية إلى مدخل كل خلية تدفق على الشريحة المنقوشة. قم بإزالة حل PBS + 1٪ BSA من المنفذ، مما يسمح لتعليق الخلية بملء خلية تدفق PDMS. احتضان على الجليد أو في درجة حرارة الغرفة لمدة 30 s.
ملاحظة: عند هذه النقطة، يجب أن يظهر النظر إلى خلية التدفق تحت المجهر خلايا مكتظة بخلايا قليلة أو معدومة مرئية بين الخلايا. انظر الشكل التكميلي 2B. - أسبيرات 5 ميكرولتر من تعليق الخلية من منفذ الشريحة وإضافته مرة أخرى إلى المدخل. كرر 10 مرات لكل خلية تدفق.
ملاحظة: إن التصاق الخلايا المسماة بالكائنات الحية المغلقة بالشريحة المنقوشة بالحمض النووي هو لحظي تقريبا. تدفق الخلايا على نمط عدة مرات يزيد من احتمال أن الخلية سوف تتدفق على بقعة الحمض النووي معينة ويتم التقاطها. - بلطف ماصة PBS أو وسائل الإعلام الخالية من المصل في مدخل كل خلية تدفق لغسل الخلايا الزائدة. جمع تعليق الخلية من منفذ. كرر 2-4 مرات أو حتى الفحص البصري للشريحة تحت المجهر يؤكد أنه لا توجد خلايا زائدة متبقية.
ملاحظة: يمكن أن يكون من المفيد حفظ الخلايا الزائدة من الغسيل الأول. إذا كانت كفاءة النقش غير مرضية، يمكن طرد الخلايا الزائدة وإعادة إنفاقها في حجم أقل من برنامج تلفزيوني لإنشاء حل أكثر كثافة الخلية، ومن ثم يمكن تكرار العملية من الخطوة 6.2. - كرر الخطوات 6.1-6.4 لكل مجموعة من الخلايا في النقش. بالنسبة للأنماط التي يتم فيها نقش أنواع الخلايا المتعددة بشكل مباشر بواسطة قالب السطح ، ابدأ بنوع الخلية الأقل وفرة من النمط وانتهى بنوع الخلية الأكثر وفرة.
ملاحظة: من المستحسن القيام بكل جولة من التجميع الخلوي بشكل متسلسل بدلا من تجميع الخلايا ، حتى في الظروف التي يتم فيها تسمية جميع الخلايا بتسلسلات الحمض النووي المتعامدة. تجميع الخلايا يخفف بشكل فعال كل مجموعة من الخلايا ويقلل من كفاءة النقش. - بعد اكتمال الجولة النهائية لتجميع الخلية، ستختلف الخطوات التالية استنادا إلى التجربة المحددة. إذا كان المقصود من الخلايا أن تبقى على الزجاج، إضافة وسائط إلى طبق بيتري التي تحتوي على الشريحة، ومن ثم استخدام ملقط بلطف لدفع خلايا تدفق PDMS الخروج من الشريحة. إذا كانت الخلايا سوف تكون جزءا لا يتجزأ من هيدروجيل ومثقفة في 3D، انتقل إلى الخطوة 7.
7. نقل إلى هيدروجيل للثقافة 3D (اختياري)
- إعداد محلول السلائف هيدروجيل التي تحتوي على 2٪ DNase.
ملاحظة: يختلف تكوين الحل استنادا إلى الإعداد التجريبي. Matrigel ومخاليط من ماتريغل والكولاجين أعمل بشكل جيد في هذا البروتوكول، ولكن الهيدروجيلات الأخرى ممكنة أيضا. - إضافة 50 ميكرولتر من محلول هيدروجيل تحتوي على 2٪ DNase إلى مدخل كل خلية تدفق. يستنشق السائل الزائد من منفذ، مما دفع محلول هيدروجيل في خلية التدفق. بالنسبة للسلائف الهيدروجيل اللزجة ، قد تكون هناك حاجة إلى إمالة الشريحة قليلا لمساعدة الهيدروجيل على التدفق إلى خلية التدفق.
- احتضان الشريحة عند 37 درجة مئوية لمدة 30-45 دقيقة (اعتمادا على حركية هلام الهيدروجيل) للسماح للهيدروجيل بتعيين والالتصاق القائم على الحمض النووي بين الخلايا والسطح.
- إزالة كل خلية تدفق من الشريحة ومكان على رأس محلول السلائف هيدروجيل.
- إضافة 50 ميكرولتر من هيدروجيل السلائف إلى بئر من شريحة غرفة 2-جيدا أو لوحة 6-جيدا.
- ماصة 10 ميكرولتر من برنامج تلفزيوني على جانبي كل خلية تدفق.
- استخدام شفرة حلاقة أو ملاقط غرامة نقطة لتوزيع برنامج تلفزيوني على طول كامل من الخلية تدفق، ثم رفع بلطف جانبي الخلية تدفق بحيث يندفع برنامج تلفزيوني تحت الهيدروجيل.
ملاحظة: هذا سوف "تعويم" هيدروجيل عبر الشريحة، مما يسمح للنقل دون تشويه أو تمزيق. - استخدم شفرة حلاقة لتحريك خلية التدفق برفق إلى حافة الشريحة الزجاجية.
- عكس الشريحة. مع شفرة الحلاقة، دفع خلية تدفق قبالة الشريحة بحيث تهبط على رأس شفرة الحلاقة.
- اختر خلية التدفق من شفرة الحلاقة باستخدام ملقط منحني. عكس خلية التدفق بحيث تكون الخلايا في الجزء السفلي، ومن ثم وضع على رأس قطرة من محلول السلائف هيدروجيل.
- كرر الخطوات 7.4.1 - 7.4.6 لكل خلية تدفق.
- احتضان لمدة 30 دقيقة على الأقل بحيث الهيدروجيل التي تحتوي على الخلايا المنقوشة يمكن أن ترتبط الأساس الهيدروجيل، مما أدى إلى تضمين كامل من الخلايا المنقوشة.
- إزالة الخلية تدفق PDMS.
- أضف وسائط كافية لغمر خلية تدفق PDMS.
ملاحظة: تدفق الوسائط سوف تخفف من التصاق بين هيدروجيل وخلية تدفق PDMS. - استخدم ملقط منحني، موجه على طول المحور الطويل لخلية التدفق، لدفع خلية التدفق برفق حتى تنبثق وتطفو في الوسائط. جمع خلية تدفق مع ملقط وتجاهل.
ملاحظة: للحصول على أفضل النتائج، انشر ملقطات منحنية و قم بتطبيق ضغط لطيف على جدران خلية تدفق PDMS. تطبيق القوة في اتجاه المحور الطويل من الخلية تدفق.
- أضف وسائط كافية لغمر خلية تدفق PDMS.
8. تأكيد وضع العلامات الناجحة للخلايا مع CMO (اختياري، لاستكشاف الأخطاء وإصلاحها)
- اطلب أوليغونوكليوتيد معدلا فلوريا (FAM أو AF647) مكملا لتسلسل التصاق السطح لخيط المحول المستخدم في التجربة.
- تسمية الخلايا مع الحمض النووي CMO وغسل الحمض النووي الزائد كما هو موضح في الخطوة 5. Resuspend في 200 ميكرولتر من الجليد الباردة برنامج تلفزيوني.
- تشكل حلا 4 ميكرومتر من oligonucleotide التكميلية المسمى fluorescently في برنامج تلفزيوني. أضف 200 ميكرولتر من هذا الحل إلى تعليق الخلية. احتضان على الجليد لمدة 5 دقائق.
- إضافة 1 مل من برنامج تلفزيوني الجليد الباردة. Mix. الطرد المركزي الخلايا بيليه لهم. إزالة فائقة. كرر هذه العملية مرتين أخريين لغسل أي حمض نووي لم يهجين.
- إجراء قياس التدفق الخلوي التحليلي لتحديد وجود الحمض النووي على سطح الخلية.
- على مقياس التدفق الخلوي، قم بتحليل خلايا التحكم التي لم يتم تصنيفها بالحمض النووي. اقامة بوابات على أساس هذه المجموعة من السكان.
- تحليل الخلايا التي تحمل علامة CMO التي تم علاجها مع أوليغونوكليوتيد تكميلية وصفت الفلورسنت.
- حساب متوسط كثافة الفلورسينس.
النتائج
هذا البروتوكول يجعل من الممكن لنمط الخلايا في 2D و 3D بدقة عالية ودون استخدام الكواشف المخصصة أو معدات غرفة نظيفة مكلفة. يوضح الشكل 1 نظرة عامة على البروتوكول. أولا، يتم إنشاء الشرائح الوظيفية للحمض النووي من خلال التصوير الضوئي. بعد ذلك، يتم تسمية الخلايا مع منظمات الإدارة الجماعية. ثم يتم تدفق الخلايا فوق الشريحة ، حيث تعلق فقط على المناطق الوظيفية للحمض النووي من الشريحة. بعد غسل الخلايا الزائدة ، يتم الكشف عن النمط المطلوب من الخلايا. يمكن استزراع هذه الخلايا على الشريحة أو تضمينها في هيدروجيل يحتوي على DNase ونقلها من الشريحة لثقافة الخلية ثلاثية الأبعاد.
وضع العلامات على الخلايا مع CMOs يسمح لتعلقها على الشريحة منقوشة الحمض النووي(الشكل 2). أولا، يتم تهجين ستراند المرساة العالمي المعدلة الكوليسترول مسبقا مع ستراند محول. بعد ذلك، يتم خلط حل Anchor + محول العالمي 1:1 مع تعليق الخلية. الكوليسترول في مركب Universal Anchor + Adapter يدخل في غشاء الخلية. إضافة الكولسترول المعدلة العالمي المشترك مرساة ستراند, الذي يهجين مع ستراند مرساة العالمي, يحسن استقرار مجمع CMO في غشاء الخلية عن طريق زيادة صافي رهاب الماء منمجمع 26. بعد غسل الحمض النووي الزائد من تعليق الخلية ، يتم تدفق الخلايا فوق الشريحة. يؤدي التهجين بين حبلا المحول وستراند الحمض النووي Surface إلى ارتباط الخلايا بالمناطق المنقوشة بالحمض النووي للشريحة.
يتم إنشاء نمط الخلايا باستخدام التصوير الضوئي لتقييد مرفق أوليغوس الحمض النووي المعدلة أمين إلى مناطق محددة من الشريحة الزجاجية المعدلة ألدهيد29 (الشكل 3A). يتم تدوير مضاد ضوئي إيجابي مغلف على شريحة تعمل بالالديهيد. ثم يتم وضع قناع ضوئي الشفافية على رأس الشريحة ويتم عرض الشريحة للأشعة فوق البنفسجية. بعد التطور ، لم تعد مناطق الشريحة التي تعرضت للأشعة فوق البنفسجية مغلفة في وازالة ضوئية ، وبالتالي تعرضت مجموعات ألدهيد. ثم يتم إسقاط محلول 20 ميكرومتر من أوليغوس الحمض النووي المعدلة الأمين على الشريحة وانتشارها لتغطية المناطق المنقوشة. الخبز تليها الأمينية الاختزالية النتائج في رابطة التكافؤ بين الحمض النووي المعدلة الأمين والشريحة. ومن اللافت للنظر أن هذه العملية يمكن تكرارها لنمط أوليغوس متعددة دون أي فقدان وظائف أوليغوس منقوشة سابقا(الشكل 3B). ومع ذلك ، ينبغي توخي الحذر لتجنب أنماط متداخلة ، مما يؤدي إلى وجود كل من أوليغو بتركيز منخفض(الشكل التكميلي 3). يمكن أن تكون منقوشة مجموعات خلايا متعددة بشكل تسلسلي باستخدام خيوط المحول التي تختلف في مجال وحدات الخاصة بهم (القواعد 20 الأقرب إلى نهاية 3').
على الرغم من أن هذا البروتوكول الضوئي تم تطويره من قبل Scheideler وآخرون في سياق غرفة نظيفة ، فقد أثبتنا أنه من الممكن تحقيق نتائج مماثلة مع إعداد تصوير ضوئي "منزلي" غير مكلف يناسب بسهولة داخل غطاء الدخان الكيميائي. الإعداد يتضمن 400 $ تدور coater مصنوعة من محرك العاصمة ، وحدة تحكم رقمية ، وقرص مضغوط مربع كعكة ، فضلا عن مصباح الأشعة فوق البنفسجية التي تم تجميعها من مكونات فردية ويسكن في حاوية حادة المعاد استخدامها(الشكل التكميلي 1). الميزة الرئيسية لإعداد التصوير الضوئي المشروب المنزلي هو أنه بأسعار معقولة جدا (< 1000 دولار لجميع المعدات) في حين لا تزال قادرة على خلق ميزات واحدة الحجم الخلية. ومع ذلك ، فإن استخدام المعدات غير المكلفة له حدوده - على سبيل المثال ، من الصعب محاذاة العلامات الانشطارية بدقة لنمط أوليغو الحمض النووي المتعدد دون استخدام جهاز محاذاة القناع. نوصي هذا الإعداد الضوئي غير مكلفة للمختبرات التي ليس لديها وصول مريح إلى غرفة نظيفة أو التي ترغب في محاولة هذا الأسلوب دون استثمار كبير.
لتحديد الظروف المثلى لتصاق الخلايا المبرمجة بالحمض النووي، قمنا بشكل منهجي بتنوع تركيزات خيوط الحمض النووي على أسطح الخلايا وقياس كفاءة التصاق الخلايا بالأسطح الزجاجية المعدلة للحمض النووي. تم تباين تركيز مرساة العالمي + محول ستراند والعالمية المشارك مرساة في حلول وضع العلامات عبر عدة أوامر من حجم (الشكل 4A, B), مما أدى إلى 104 - 106 مجمعات الحمض النووي لكل خلية (الشكل التكميلي 4). كان التصاق الخلية يعتمد على الجرعة، مع الحد الأدنى من التصاق الخلية بنمط الحمض النووي عندما تم تصنيف الخلايا مع منظمات الإدارة الجماعية بتركيز 0.05 ميكرومتر أو أقل، وارتفاع الإشغال بتركيز 2.5 ميكرومتر وأعلى. لذلك، استخدمنا حل 2 ميكرومتر من Universal Anchor + محول ستراند و2 ميكرومتر من Universal Co-Anchor في معظم التجارب. ومن المتوقع أيضا أن ينخفض التصاق الخلايا إذا انخفضت كمية الحمض النووي المستخدم على السطح الزجاجي29 أو إذا زادت حالات عدم التطابق بين حبلا المحول وخصلة السطح. يتم توفير مزيد من المعلومات حول تصميم تسلسل محول ستراند في ملف تكميلي 2. CMO وضع العلامات باستخدام خيوط محول دون CpG يكرر لم يحفز TLR9 في خلايا HEK التعبير عن الماوس TLR9 (الشكل التكميلي 5).
نقدم العديد من المظاهرات التي توفر البروتوكول المنقح إعادة إنتاجها وكفاءة الحمض النووي المبرمجة الالتصاق الخلية. على سبيل المثال، انضمت الخلايا البطانية الوريدية البشرية (HUVECs) المسماة ب CMOs إلى أنماط الحمض النووي بكفاءة عالية. وقد انضمت مركبات HUVECs التي تحمل اسم CMO وكذلك HUVECs التي تحمل اسم LMO(الشكل 5A). احتفظت الخلايا المنقوشة باستخدام CMO-DPAC بقابليتها للحياة ووظائفها. كانت ملطخة الخلايا المسماة مع منظمات الإدارة الجماعية من قبل calcein AM وethidium homodimer لتقييم الجدوى (الشكل التكميلي 6). وكانت الاختلافات في الجدوى مقارنة بخلايا التحكم غير الملساء صغيرة (94٪ مقابل 97٪). MDCKs واحد منقوشة عبر CMO-DPAC ونقلها إلى Matrigel كانت قادرة على الانتشار والاستقطاب بشكل صحيح بعد 5 أيام من الثقافة (الشكل 5B). DPAC كما يوفر وسيلة لوضع أنماط الخلايا في البعد الثالث(الشكل 5C). على سبيل المثال، يمكن إنشاء مجاميع متعددة الطبقات والخلايا عن طريق طبقات متناوبة من الخلايا المسماة مع منظمات الإدارة الجماعية التكميلية(الشكل 5C). وتبين هذه التجارب أن البروتوكول قابل للاستنساخ، ولا يؤثر سلبا على صلاحية الخلية أو وظائفها، وينتج عنه أنماط خلوية يمكن استزراعها بنجاح داخل مستوى تصوير واحد في تخطيط كهربية القلب ثلاثي الأبعاد.
من خلال توفير تسلسل الحمض النووي المتعامد لتوجيه التصاق الخلية ، يوفر DPAC وسيلة لتكييف أنواع خلايا متعددة على سطح واحد. لتنفيذ هذه الميزة من DPAC، يجب أن تتماشى أنماط الحمض النووي التي تم إنشاؤها بواسطة التصوير الضوئي فيما يتعلق بعضها البعض. سمحت العلامات الائتمانية المعدنية المودعة على الشريحة بمحاذاة الكتل الضوئية المتعددة وبالتالي نقش أنواع الخلايا المتعددة في وقت واحد. وصفت MCF10As ملطخة الأصباغ الفريدة المختلفة مع CMOs متعامدة ومنقوشة لخلق تصور لل UC بيركلي و UCSF الشعارات(الشكل 6). وتبين هذه التجربة أن مجموعات خلايا فريدة متعددة يمكن أن تكون منقوشة جنبا إلى جنب مع دقة عالية ودون تلوث متقاطع.
يتطلب النقش الناجح للخلايا باستخدام CMO-DPAC تصويرا ضوئيا عالي الجودة وتركيزا كافيا من أوليغو على سطح الخلية وكثافة عالية من الخلايا فوق النمط وغسلا كافيا. فشل أي من هذه الخطوات يؤثر على النتيجة النهائية. الشكل التكميلي 2 يتضمن مثال صور من التصوير الضوئي الصحيح وغير صحيحة (الشكل التكميلي 2A), كثافة الخلية المطلوبة على نمط لخلق أنماط المحتلة بالكامل (الشكل التكميلي 2B), فقدان الخلايا المنقوشة بسبب الأنابيب قوية بشكل مفرط خلال الخطوات اللاحقة من DPAC (الشكل التكميلي 2C), وتكتل غير مرغوب فيه من الخلايا (الشكل التكميلي 2D). يتضمن الجدول 1 قائمة بنقاط الفشل الشائعة واستكشاف الأخطاء وإصلاحها المقترحة. ويوصى باستخدام أوليغوس الفلورسنت التكميلي كأداة لاستكشاف الأخطاء وإصلاحها لتأكيد وجود الحمض النووي المنقوش على الشريحة ووجود منظمات الإدارة الجماعية على سطح الخلية عن طريق قياس التدفق الخلوي (انظر الخطوة 8 من البروتوكول).
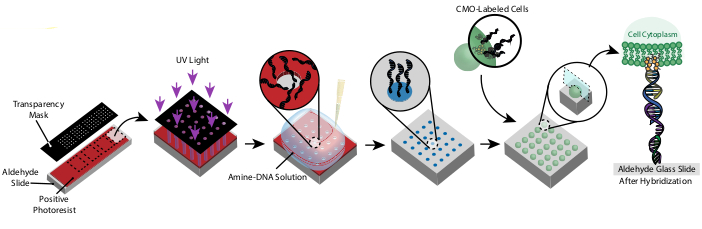
الشكل 1:نظرة عامة على بروتوكول CMO-DPAC. أولا، يتم إنشاء شريحة منقوشة بالحمض النووي عن طريق طلاء شريحة زجاجية تعمل بالالديهيد مع جهاز قياس ضوئي إيجابي، وتغطيتها بقناع شفافية في النمط المطلوب، وتعريضها للأشعة فوق البنفسجية. يتم غسلها من قبل المطور، وترك المناطق المكشوفة من الشريحة ألدهيد والسماح لربط الحمض النووي أمين وظيفية إلى السطح. ثم يتم تسمية الخلايا مع CMOs وتدفقها على السطح. الحمض النووي على غشاء الخلية يهجين إلى الحمض النووي على السطح، مما يؤدي إلى الالتصاق. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
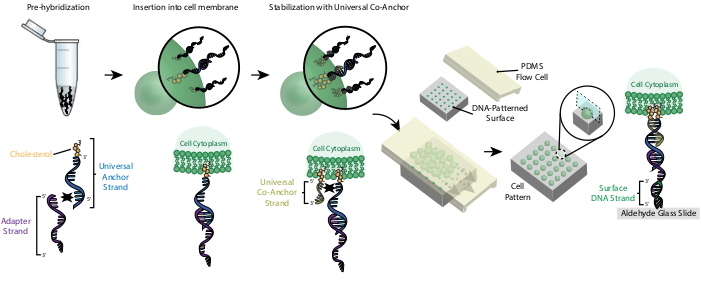
الشكل 2:يتم تسمية الخلايا مع منظمات الإدارة الجماعية في عملية تدريجية. أولا، يتم تهجين ستراند المرساة العالمي المعدلة الكوليسترول مسبقا مع ستراند محول. بعد ذلك، يتم خلط حل Anchor + محول العالمي مع تعليق الخلية. الكوليسترول في مركب Universal Anchor + Adapter يدخل في غشاء الخلية. بعد الحضانة، يتم إضافة ستراند العالمي المشترك مرساة المعدلة الكوليسترول إلى تعليق الخلية، حيث يهجين مع ستراند مرساة العالمي ويدخل في غشاء الخلية. إضافة جزيء الكوليسترول الثاني يزيد من صافي رهاب الماء من مجمع الحمض النووي ويستقر داخل الغشاء26. بعد غسل الحمض النووي الزائد ، تتركز الخلايا وتضاف إلى خلية تدفق PDMS على سطح منقوش. 3'end of the محول Strand يهجن مع ستراند الحمض النووي السطح على الشريحة الزجاجية, مما أدى إلى الالتصاق إلى الشريحة على وجه التحديد في المناطق وظيفية مع الحمض النووي التكميلية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
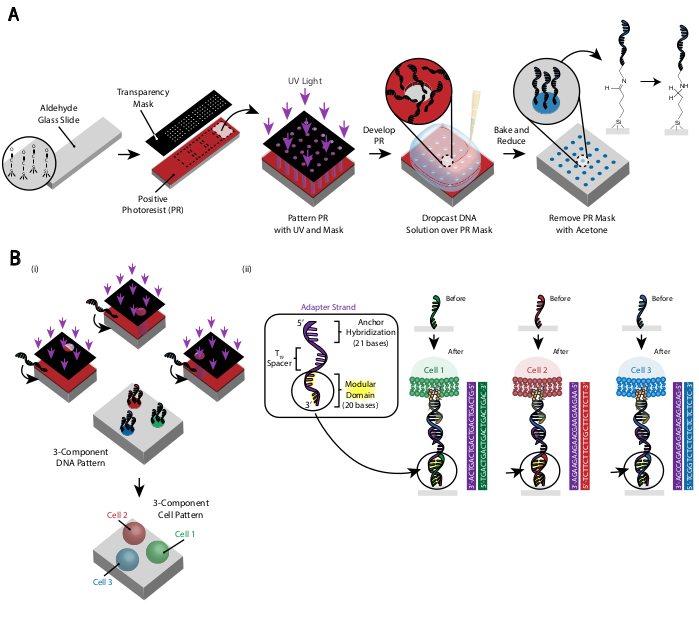
الشكل 3: يستخدم التصوير الضوئي لإنشاء الشرائح المنقوشة بالحمض النووي التي ستملي في نهاية المطاف موضع الخلايا. (أ) نظرة عامة على عملية التصوير الضوئي. شريحة تعمل بالالديهيد مغلفة بطبقة ضوئية إيجابية. يضيء ضوء الأشعة فوق البنفسجية على الشريحة من خلال قناع ضوئي شفاف شفاف حيث يتم المرغوب في التصاق الخلية. بعد تطوير الشريحة، المناطق التي تعرضت سابقا للأشعة فوق البنفسجية الآن قد تعرضت مجموعات ألدهيد. ثم يتم إسقاط محلول 20 ميكرومتر من أوليغو الحمض النووي الأمين وظيفية على الشريحة وتنتشر على المناطق المنقوشة. ثم يتم خبز الشريحة للحث على تشكيل سندات شيف (C = N) بين مجموعتي الأمين والألدهيد ، وهي رابطة تساهمية قابلة للعكس29. الأمينية الاختزالية اللاحقة مع 0.25٪ بوروهيدريد الصوديوم في برنامج تلفزيوني يحول قاعدة شيف إلى أمين ثانوي عن طريق الأمينية الاختزالية، مما أدى إلى رابطة لا رجعة فيها بين الحمض النووي والشريحة. يمكن بعد ذلك إزالة المصابر الضوئي المتبقي عن طريق الشطف بالأسيتون. (ب)يمكن تكرار هذه العملية لإنشاء أنماط الحمض النووي متعددة المكونات، وبالتالي إجراء تجارب مع مجموعات خلايا متعددة. '1' بعد نقش أول أوليغو، تغلف الشريحة مرة أخرى بأخصائية التصوير الضوئي، ويمضي البروتوكول كما كان من قبل. محاذاة الكتل الضوئية باستخدام علامات ائتمانية ضروري لأنماط خيوط الحمض النووي متعددة. '2' يختلف كل نوع من أنواع الخلايا التي يجري نقشها في المجال المعياري ذو القاعدة العشرين في نطاق المحول. باستخدام مجموعات متعامدة من أوليغو التكميلية، يمكن أن تكون منقوشة أنواع خلايا متعددة دون التصاق المتبادل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
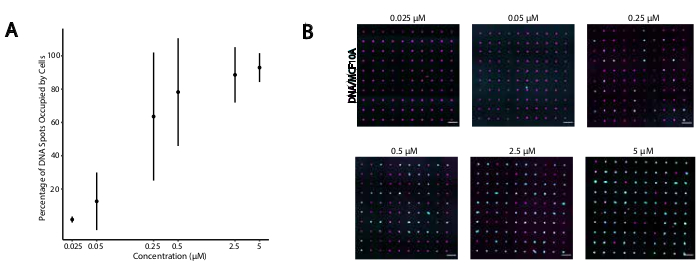
الشكل 4:يزداد التصاق الخلايا المسماة بالكائنات الحية المحورة بأنماط الحمض النووي كدالة لتركيز الكائنات الحية المحورة أثناء وضع العلامات. في هذه التجربة، تم استخدام مرساة العالمي + محول ستراند (مهجنة مسبقا) و Universal Co-Anchor بتركيزات متساوية. يشير التركيز إلى تركيز الكائنات الحية المغلقة في تعليق الخلية أثناء وضع علامات على الخلايا. (أ)تحديد كمية النسبة المئوية للبقع الحمض النووي قطرها 15 ميكرومتر التي احتلتها خلايا MCF10A المسمى CMO كدالة لتركيز CMO أثناء وضع العلامات الخلية. البيانات الممثلة كمؤسح ± الانحراف المعياري عن ثلاث تجارب. (ب)صور تمثيلية لأنماط الحمض النووي (أرجواني) وتلتزم MCF10As (سماوي) بتركيزات مختلفة من CMO. مقياس الشريط = 100 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
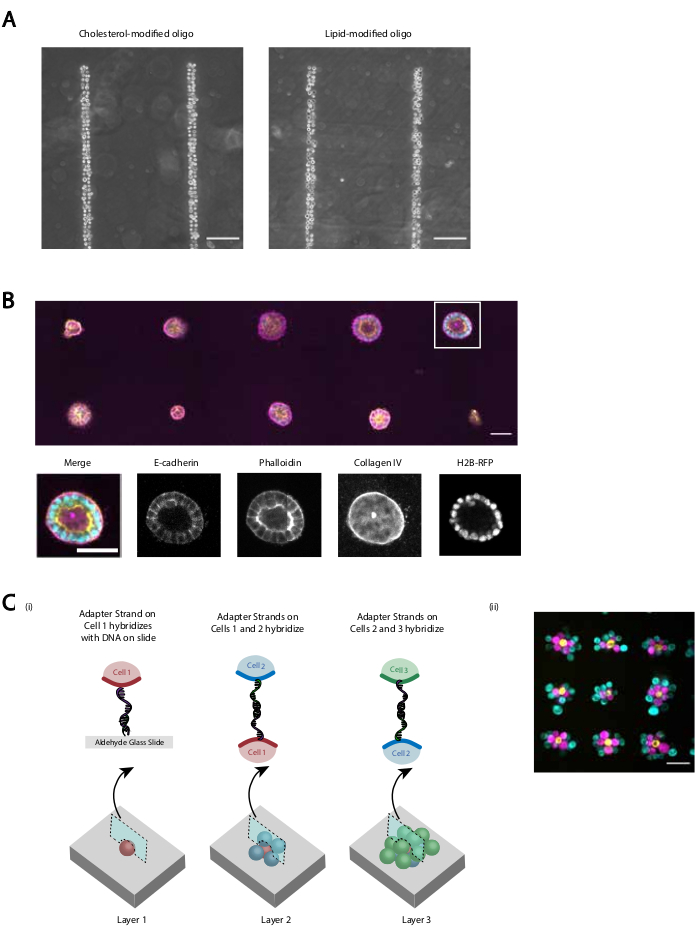
الشكل 5: يمكن استخدام CMO-DPAC لإنشاء أنماط خلايا ثنائية الأبعاد يمكن تضمينها لاحقا في هيدروجيل ثلاثي الأبعاد للثقافة و / أو طبقات لإنشاء هياكل متعددة الطبقات. (أ)المقارنة المباشرة بين الخلايا البطانية الوريدية البشرية المسماة CMO (HUVECs) و HUVECs المسماة بالكائنات الحية المحورة تلتزم بنمط الحمض النووي الخطي. تؤدي كلتا طريقتي وضع العلامات على الخلايا إلى إشغال نمط الحمض النووي بنسبة 100٪ تقريبا. (ب)تم نقش خلايا الكلى النابينة مادين داربي واحد (MDCKs) التعبير عن H2B-RFP على 15 بقع قطرها ميكرومتر متباعدة 200 ميكرومتر وبصرف النظر في وقت لاحق جزءا لا يتجزأ من Matrigel. بعد 120 ساعة من الثقافة، تم إصلاح الخراجات الظهارية الناتجة وملطخة لE-cadherin، أكتين، والكولاجين الرابع. يظهر كرويد في مربع أبيض بالتفصيل. شريط مقياس = 50 ميكرومتر (C) يمكن إنشاء هياكل الخلوية متعدد الطبقات عن طريق وضع علامات على مجموعات خلايا منفصلة مع خيوط محول تكميلية ونقش تسلسليا بحيث كل إضافة جديدة من الخلايا تلتزم طبقة الخلية قبل ذلك. (1)تخطيطي للأنماط المتسلسلة لتجمعات الخلايا لإنشاء هياكل متعددة الطبقات. (2) تم إنشاء مجاميع الخلايا ثلاثية الطبقات من MCF10As (تصور باستخدام الأصباغ) باستخدام هذه العملية. مقياس الشريط = 50 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6:يمكن أن تكون أنماط أنواع متعددة من الخلايا دون التلوث المتبادل أو فقدان التصاق. تم نقش العديد من أوليغو الحمض النووي المعدلة الأمين بالتسلسل على شريحة ألدهيد ومحاذاتها من خلال استخدام علامات ائتمانية معدنية. كانت ثلاثة مجموعات من MCF10As (سماوي ، أرجواني ، أصفر) ملطخة بأصباغ فريدة تحمل علامات CMOs تكميلية ، ومنقوشة على الشريحة ، مما أدى إلى صورة لشعاري UC Berkeley و UCSF. شريط مقياس 1 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: صور مثال لإعداد التصوير الضوئي على سطح المقعد. (أ) الشريحة على coater تدور، مغطاة بموجب ضوئي إيجابي، قبل طلاء تدور. (ب) صورة لسمة ضوئية الشفافية. (ج)أثناء التعرض، تقع قناع ضوئي بين الشريحة المغلفة بحازلة ضوئية وقرص زجاجي. (D) تم صنع مصباح الإسكان للأشعة فوق البنفسجية من حاوية حادة أعيد أغراضها. (E) الشريحة مغمورة في حل المطور. (F) الشريحة المتقدمة. (G) محلول الحمض النووي المعدلة الأمين تنتشر على مناطق منقوشة من الشريحة. (H) PDMS تدفق الخلايا وضعت على رأس المناطق المنقوشة من الشريحة. الرجاء الضغط هنا لتحميل هذا الملف.
الشكل التكميلي 2: بعض الأمثلة على الإخفاقات الشائعة لهذا البروتوكول. (أ)(1)تحت الخبز قبل التعرض للأشعة فوق البنفسجية أو الإفراط في تطوير ميزات ما بعد التعرض يمكن أن يؤدي إلى الميزات التي لها حواف خشنة، وربما تكون غير منتظمة في الحجم. (2)مثال على شريحة photopatterned بشكل صحيح التي لديها حواف نظيفة حول الميزات، وحجم ميزة موحدة، وليس الشقوق واضحة في النمط. مقياس الشريط = 50 ميكرومتر (ب) كثافة الخلية أمر بالغ الأهمية لتكتك كفاءة. عند مراقبة الخلايا فوق النمط تحت المجهر ، يجب وجود فجوات قليلة بين الخلايا ، كما يتضح من صورة المثال على اليسار. مقياس شريط = 50 ميكرومتر(C)يمكن أن تكون الخلايا المنقوشة حساسة لقوى السوائل الناشئة عن الأنابيب قوية بشكل مفرط، والتي يمكن أن تلحق الضرر وطرد الخلايا المنقوشة. تجمعات الخلايا متعددة الطبقات معرضة للخطر بشكل خاص ، حيث تدعم خلية واحدة في الأسفل بنية خلايا متعددة. (ط)مجموعة من المجاميع الخلية جزءا لا يتجزأ بنجاح في Matrigel. (2)شبكة من المجاميع الخلية التي طردت نتيجة لmatrigel لزجة pipetting بقوة جدا. (د)يمكن أن يحدث تكتل الخلايا، لا سيما مع الخلايا الظهارية. هذه الكتل عادة ما تكون متجانسة ولكن يمكن أن تكون غير نمطية (الخلايا التي تلتزم خلايا منقوشة بالفعل من نوع مختلف) إذا كانت الخلايا لزجة بشكل خاص. تظهر الصورة ثلاث مجموعات مختلفة من MCF10As منقوشة على صفيف مكون من ثلاث بقع مختلفة من الحمض النووي بحجم خلية واحدة (15 ميكرومتر). معظم بقع الحمض النووي لديها 2-4 خلايا مرفقة. يمكن حل التكتل عن طريق علاج EDTA أو عن طريق تصفية الكتل قبل النقش. شريط المقياس = 100 ميكرومتر. الرجاء الضغط هنا لتحميل هذا الملف.
الشكل التكميلي 3: تؤدي التربات الضوئية المتداخلة إلى وجود كل من أوليغو بتركيز منخفض. تم فوتوباترند اثنين من أوليغو أمين تعديل متعامدة بشكل متسلسل، أولا خط عمودي (ستراند 1)، تليها خط أفقي التي تتداخل معها (ستراند 2). ثم تم تصور أوليغوس عن طريق التهجين مع أوليغو الفلورسنت التكميلية. (أ) صورة مفلورة من ستراند 1. (ب)تحديد كمي للملف الفلوري من ستراند 1 على خط عمودي 100 ميكرومتر تمتد التداخل. (ج) صورة مفلورة ستراند 2. (د)تحديد كمي للملف الفلوري من ستراند 2 على خط أفقي 100 ميكرومتر تمتد التداخل. شريط المقياس = 50 ميكرومتر. الرجاء الضغط هنا لتحميل هذا الملف.
الشكل التكميلي 4: تحديد كمية مجمعات الحمض النووي على سطح الخلية كدالة لتركيز وضع العلامات على الكائنات الحية المحورة. وصفت HUVECs بتركيزات مختلفة من محلول CMO ، وغسلها ، ثم احتضانها بخيط تكميلي فلوري. تم استخدام مجموعة ميكروسفير MESF (جزيئات الفلوروشروم القابلة للذوبان المكافئة) للقيام بقياسات الخلايا التدفق الكمي وتقدير عدد مجمعات الحمض النووي على سطح الخلية كدالة لتركيز CMO أثناء وضع العلامات. الرجاء الضغط هنا لتحميل هذا الملف.
الشكل التكميلي 5: لا يحفز وضع العلامات على CMO استجابة TLR9. وأجريت تجربة لمعرفة ما إذا كان وضع العلامات على الكائنات الحية المغلقة سيؤدي إلى تشغيل آلية الكشف عن الحمض النووي لTLR9 وما إذا كان ذلك سيتأثر ب CpGs في تسلسل محول ستراند. تم احتضان خلايا HEK التي تعبر عن الماوس TLR9 بين عشية وضحاها مع 0.2 ميكرومتر من أي من ODN 1826 (ناهض TLR9 المحتوي على CpG) ، CMO Universal Anchor + Universal Co-Anchor + محول ستراند التي تحتوي على نفس التسلسل كما ODN 1826 (CMO-CpG)، أو CMO مرساة العالمي + العالمي المشترك مرساة + محول ستراند تحتوي على تسلسل مماثل ولكن مع استبدال CpGs مع GPCs (CMO-GpC). TLR9 التحفيز سيؤدي إلى إنتاج سيب (إفراز الفوسفاتاز القلوية الجنينية). تم قياس إفراز SEAP كميا بواسطة مقايسة لونية (امتصاص). تمت مقارنة حالات العلاج بخلايا الراحة التي تم علاجها فقط مع برنامج تلفزيوني. لم يحفز الحضانة مع CMO-GPC التعبير TLR9. كان الحضانة مع CMO-CpG أعلى قليلا من الخلايا المريحة ولكن أقل بكثير من ODN-1826. الرجاء الضغط هنا لتحميل هذا الملف.
الشكل التكميلي 6: صلاحية الخلايا بعد عملية وضع العلامات على CMO. ولتقييم كيفية تأثير البروتوكول على الجدوى، انقسمت مركبات HUVECs إلى أربع مجموعات سكانية: واحدة بقيت على الجليد لمدة ساعة واحدة، وواحدة وصفت بالعلامة الوهمية مع برنامج تلفزيوني ولكن تم اتخاذها من خلال جميع أجهزة الطرد المركزي وخطوات الغسيل، وواحدة وصفت مع منظمات الإدارة الجماعية، وواحدة وصفت مع منظمات الإدارة الجماعية وتصفيتها من خلال مرشح 40 ميكرومتر لإزالة الكتل. ثم لطخت الخلايا بالكالسين صباحا والهوموديمر الإيثيديوم لتقييم عدد الخلايا الحية والميتة. أدت جميع العلاجات إلى انخفاض كبير في الجدوى من التحكم في الجليد (ANOVA في اتجاه واحد مع تحليل توكي اللاحق) ، ولكن متوسط الجدوى لوسم CMO (مع أو بدون تصفية) كان حوالي 94٪. البيانات التي تم جمعها من ثلاث تجارب مستقلة. * = ص < 0.05. = p < 0.0001 الرجاء الضغط هنا لتحميل هذا الملف.
| نتيجة | السبب المحتمل (الأسباب) | الإصلاحات المقترحة |
| التصوير الضوئي – يتم تصدع الميزات | غير متناسقة أو غير كافية لينة خبز | زيادة الوقت من خبز لينة تصل إلى 3 دقائق. التحقق من درجة الحرارة الفعلية للسخونة وزيادة درجة الحرارة حسب الضرورة |
| التصوير الضوئي – الميزات ليست حادة أو لديها وازالة ضوئية المتبقية داخلها | التنمية الناقصة | زيادة الوقت الذي تقضيه الشريحة في حل المطور؛ دمج التحريض لطيف |
| التصوير الضوئي – ميزات غير متناسقة عبر الشريحة | قد لا يكون الضوء فوق البنفسجي مركزة أو لا تركز بشكل صحيح | ضبط إعداد ضوء الأشعة فوق البنفسجية لضمان ضوء collimated من كثافة موحدة |
| الخلايا لا تلتزم البقع منقوشة مع كفاءة عالية | لا يوجد ما يكفي من الحمض النووي على السطح | تأكد من وجود الحمض النووي على السطح عن طريق تهجين الشريحة مع أوليغوس الفلورسنت التكميلية ومن ثم التصوير تحت المجهر |
| الخلايا غير المسماة بشكل كاف مع CMO | إضافة أوليغو الفلورسنت التكميلية إلى تعليق الخلية وتأكيد الفلورسينس عن طريق قياس التدفق الخلوي | |
| لا توجد خلايا كافية على النمط | جمع الخلايا عن طريق الغسيل من خلية تدفق PDMS، والطرد المركزي، وإعادة تعليق في انخفاض حجم لتركيز الخلايا | |
| الكثير من CMO المتبقية في تعليق الخلية، والتهجين مع الحمض النووي على الشريحة | إضافة خطوة غسل أخرى. تأكد من إزالة أكبر قدر ممكن من الناسخ مع كل غسل. | |
| استيعاب الكثير من CMO بسبب الوقت ودرجة الحرارة | العمل بسرعة بعد وضع علامة على الخلايا مع CMO; إبقاء الخلايا والانزلاق على الجليد واستخدام الكواشف الباردة الجليد | |
| كتلة الخلايا | لم يتم فصل الخلايا بشكل كاف أثناء المحاولة | استخدام برنامج تلفزيوني + 0.04٪ EDTA أثناء يغسل الخلية. تمرير تعليق الخلية من خلال مرشح 35 ميكرومتر قبل غسل النهائي |
| تلتزم الخلايا بشكل غير محدد | إذا كان في منطقة واحدة محددة – يمكن أن يكون بسبب الخدوش على الشريحة, اختلال خلايا تدفق PDMS, أو تسرب الحمض النووي خارج منطقة نمط | تجنب الخدوش، كن حذرا لمحاذاة خلايا تدفق PDMS إلى منطقة النقش |
| إذا كانت الخلايا تلتزم في كل مكان - حظر غير كافية أو غسل | إضافة في يغسل أكثر بعد نقش الخلايا; pipet بقوة أكبر أثناء يغسل; كتلة مع 1٪ BSA لفترة أطول قبل بدء نمط الخلية؛ شريحة silanize (الخطوة الاختيارية 3) أو تأكيد السيلانينج كان ناجحا عن طريق قياس زاوية الاتصال من قطرة الماء | |
| شكل فقاعات داخل خلية التدفق | أخطاء الأنابيب، سطح هيدروفيلي متفاوتة التي تم إنشاؤها أثناء أكسدة البلازما | إذا كانت الفقاعات صغيرة، أضف برنامج تلفزيوني إلى مدخل خلية التدفق وقد يتم غسلها. إذا كانت الفقاعات أكبر، فاضغط ضغطا لطيفا على خلية تدفق PDMS، ودفع الفقاعات نحو المدخل أو المنفذ. |
| الخلايا تلتزم في البداية إلى نمط ولكن تتم إزالتها أثناء يغسل، ونقش أنواع الخلايا الأخرى، أو إضافة السلائف هيدروجيل | يمكن أن تتسبب قوى القص من الأنابيب بقوة كبيرة في انفصال الخلايا عن السطح | Pipet أكثر بلطف خلال يغسل اللاحقة، جولات من خلية النقش، أو إضافة السلائف هيدروجيل. لأن السلائف الهيدروجيل لزجة ، فمن المرجح أن تسبب هذا النمط للإزاحة ، لذا خذ المزيد من الحذر. تميل الهياكل متعددة الطبقات إلى أن تكون ثقيلة للغاية وأكثر عرضة للطرد. |
| تشوه الأنسجة أثناء النقل ثلاثي الأبعاد | هيدروجيل العصي على الشريحة | تأكيد رهاب الماء من الشريحة باستخدام قياسات زاوية الاتصال |
| استخدام شفرة الحلاقة لرفع PDMS تماما على كلا الحواف، مما يسمح لبرنامج تلفزيوني لتعويم تحت الأنسجة | ||
| هذا يمكن أن يحدث مع هيدروجيل الكولاجين النقي – النظر في ضبط تركيز البروتين أو تكوين هيدروجيل | ||
| الخلايا لا تنقل مع الهيدروجيل وتظل على الشريحة | زيادة تركيز توربو DNAse أو زيادة وقت الحضانة | |
| هيدروجيل ليست صلبة بما فيه الكفاية | زيادة وقت الحضانة و / أو آلية هلام الهيدروجيل المعني (على سبيل المثال بالنسبة للكولاجين ، تأكد من أن الرقم الحموضة صحيح) | |
| هيدروجيل الدموع عند إزالة PDMS | جعل PDMS تدفق الخلايا هيدروفيلي باستخدام أكسدة البلازما قبل بدء التجربة بحيث تنفصل بسهولة عند إضافة وسائل الإعلام. استخدام ملقط بلطف جدا لفصل PDMS. |
الجدول 1: دليل استكشاف الأخطاء وإصلاحها لتحديد وحل الإخفاقات المحتملة التي يمكن أن تنشأ من هذا البروتوكول. وعلى وجه الخصوص، يمكن أن يكون لضعف الالتصاق بالخلايا بالنمط أسباب جذرية كثيرة، وينبغي أن يساعد هذا الدليل في تحديد هذه المسائل وحلها.
الملف التكميلي 1. الرجاء الضغط هنا لتحميل هذا الملف.
الملف التكميلي 2. الرجاء الضغط هنا لتحميل هذا الملف.
الملف التكميلي 3. الرجاء الضغط هنا لتحميل هذا الملف.
الملف التكميلي 4. الرجاء الضغط هنا لتحميل هذا الملف.
Discussion
في هذه المقالة، نقدم بروتوكول مفصل لأنماط عالية الدقة من الخلايا في 2D و 3D لتجارب ثقافة الخلايا المختبرية. وخلافا للإصدارات المنشورة سابقا من هذه الطريقة، يركز البروتوكول المعروض هنا على قابلية الاستخدام: فهو لا يتطلب معدات عالية التخصص ويمكن شراء جميع الكواشف من البائعين بدلا من الحاجة إلى توليف مخصص. وخلافا لغيرها من أساليب micropatterning الخلية، وهذا الأسلوب هو اللاأدرية سريعة والخلية من نوع: أنها لا تتطلب التصاق محددة إلى البروتينات مصفوفة خارج الخلية15. يمكن تضمين الخلايا المنقوشة بواسطة CMO-DPAC داخل مصفوفة خارج الخلية مثل Matrigel أو Collagen ، مما يؤدي إلى ثقافات ثلاثية الأبعاد بدقة مكانية أعلى بكثير مما هو ممكن حاليا مع الطرق القائمة على الطباعةالبثق 22. يمكن استخدام CMO-DPAC لإنشاء مئات إلى آلاف الميزات المجهرية لكل شريحة ، مما يسمح بإجراء العديد من النسخ المتماثلة في نفس الوقت.
واحدة من أهم المعلمات في نجاح هذا البروتوكول هو كثافة الخلايا المضافة إلى خلايا التدفق على رأس الشريحة المنقوشة. من الناحية المثالية ، يجب أن تكون الكثافة على الأقل 25 مليون خلية / مل. عند تحميلها في خلايا التدفق، تؤدي هذه الكثافة من الخلايا إلى طبقة أحادية معبأة تقريبا من الخلايا فوق النمط(الشكل التكميلي 2B). هذه الكثافات الخلية العالية تعظيم احتمال أن الخلية سوف يستقر مباشرة على رأس بقعة الحمض النووي والالتزام. تقليل كثافة الخلية سوف يقلل من كفاءة النقش الكلي. خطوة حاسمة أخرى في هذا البروتوكول هو تماما إعادة تعليق الخلايا في برنامج تلفزيوني أو وسائل الإعلام الخالية من المصل قبل إضافة حل CMO. تقسيم CMOs بسرعة كبيرة في أغشية الخلايا وإضافة محلول CMO مباشرة إلى بيليه الخلية سيؤدي إلى وضع علامات غير متجانسة للخلايا. بعد إضافة حل CMO إلى تعليق الخلية ، من المهم خلط جيدا عن طريق الأنابيب بحيث يتم تسمية الخلايا بشكل موحد مع منظمات الإدارة الجماعية. بعد الحضانات ، من الضروري غسل منظمات الإدارة الجماعية الزائدة جيدا من خلال أجهزة الطرد المركزي المتعددة وخطوات الغسيل. سوف يرتبط CMO الحرة الزائدة الموجودة في تعليق الخلية إلى الحمض النووي المعدلة الأمين منقوشة على الشريحة الزجاجية، ومنع التهجين والالتصاق من الخلايا المعدلة CMO في التعليق. الوقت هو أيضا الاعتبار الرئيسي لهذا البروتوكول. من المهم العمل بأسرع وقت ممكن عند استخدام منظمات الإدارة الجماعية والحفاظ على الخلايا على الجليد من أجل تقليل استيعاب منظمات الإدارة الجماعية وتحقيق أقصى قدر من صلاحية الخلية. وقد أظهرت تجارب قياس التدفق الخلوي أن منظمات الإدارة الجماعية لا تستمر طالما على سطح الخلية مثل الكائنات الحية المحورة ، مع فقدان 25٪ من مجمعات CMO على مدى ساعتين من الحضانة على الجليد36. وعلاوة على ذلك، فإن صلاحية الخلايا تنخفض مع زيادة وقت التعامل مع الخلية. يمكن تعظيم الجدوى من خلال العمل بسرعة، والحفاظ على الخلايا على الجليد، واستخدام الكواشف الباردة الجليد، واستخدام وسائل الإعلام الخالية من المصل لتوفير بعض المواد الغذائية.
على الرغم من أن CMO-DPAC يمكن أن يكون وسيلة قوية لدراسة بيولوجيا الخلايا عن طريق نقش الخلايا بدقة عالية ، إلا أن لها حدودها. يمكن أن تكون تجارب CMO-DPAC صعبة ، خاصة مع إضافة التعقيد التجريبي مع أنواع خلايا متعددة أو طبقات أو ثقافة خلايا ثلاثية الأبعاد(ملف تكميلي 1). يمكن أن تكون الإخفاقات التجريبية شائعة عند بدء تشغيل هذا البروتوكول، كما هو موضح في الجدول 1. لذلك، نوصي المستخدمين بإجراء فحوصات لمراقبة الجودة (التأكد من وجود الحمض النووي على الشريحة، مما يؤكد أن الخلايا تحمل علامة كافية بالحمض النووي (الخطوة 8)، مما يؤكد أن الخلايا الزائدة قد جرفت تماما، وما إلى ذلك) للتأكد من نجاح التجربة وتحديد الخطوات التي قد تتطلب المزيد من التحسين. نأمل أن تساعد المعلومات الواردة في هذه المخطوطة وملفاتها التكميلية في تسهيل أي استكشاف مطلوب لأعطال وإصلاحها.
الكوليسترول هو جزيء النشطة بيولوجيا التي قد تؤثر على استيعاب التمثيل الغذائي للخلايا, التعبير الجيني, وسيولة الغشاء37,38. قارنت دراسة سابقة الآثار على التعبير الجيني للخلايا المسماة CMO و LMO باستخدام تسلسل الحمض النووي الريبي أحادي الخلية. وقد غيرت خلايا HEK المسماة CMO التعبير الجيني مقارنة بالخلايا غير المسماة والخلايا التي تحمل علامة LMO36. أدى وضع العلامات على الخلايا ذات الخلايا ذات العلامات CMOs إلى التعبير التفاضلي (> 1.5 أضعاف) لثماني جينات نسبة إلى الضوابط غير المسماة ، بما في ذلك AP2B1 ، والتي تم ربطها بالكولسترول والنقل sphingolipid (GeneCards) ، وMALT1 ، وهو حمض نووي طويل غير ترميز ينظم تراكم الكوليسترول39. في حين طفيفة، قد تكون هذه الاستجابات النسخية مع ذلك مصدر قلق إذا كانت التجربة المعنية تدرس التمثيل الغذائي، ديناميات الأغشية، أو غيرها من المسارات المرتبطة بالكوليسترول في الخلايا.
هذا البروتوكول مرن ويمكن تعديله لتلبية احتياجات كل تجربة. لأن CMO يدخل نفسه في غشاء الدهون بدلا من استخدام أي مستقبلات محددة، والأسلوب هو نوع الخلية الملحد (HUVECs، MCF10As، HEKs، و MDCKs وقد ثبت هنا). على الرغم من أن الكوليسترول هو مرساة مسعورة مختلفة عن الكائنات الحية المحورة المنشورة سابقا ، فقد وجدناها حتى الآن تتصرف بالمثل. وهكذا، فإننا نتوقع من منظمات الإدارة الجماعية للعمل مع أي من مجموعة واسعة من أنواع الخلايا التي نشرناها سابقا مع الكائنات الحية المحورة، بما في ذلك على سبيل المثال لا الحصر الخلايا الجذعية العصبية، والخلايا الليفية، والخلايا أحادية النووية في الدم المحيطي، والخلايا السرطانية، والخلايا الظهارية الثديية الأولية6،23،27،29،36 . لا يحفز وضع العلامات على CMO TLR9 ، مما يشير إلى أن البروتوكول متوافق مع الخلايا المناعية. دمج الغشاء من CMO هو وظيفة من إجمالي حجم الخلية ودرجة الشحن السلبي في الخلية الجليكوكاليx35. وهكذا، قمنا بتضمين بروتوكول (الخطوة 8) لاختبار مدى دمج الأغشية التي يمكن أن تكون قابلة للتحسين السريع. الميزات المحددة لكل نمط الخلية سوف تختلف حتما على أساس التصميم التجريبي (انظر الملف التكميلي 1 لمزيد من التوجيه). على الرغم من أن بروتوكول التصوير الضوئي الموصوف أعلاه لتكتكز الحمض النووي يوصى به ، إلا أن أي طريقة لحصر قطرات محلول الأمين الحمض النووي مكانيا يجب أن تعمل ، مثل استخدام طابعات قطرات عالية الدقة. تختلف دقة النقش والحد الأدنى لتباعد المعالم استنادا إلى الطريقة المستخدمة. ومن الممكن نظريا أيضا الجمع بين أقسام الحمض النووي photopatterning من هذا البروتوكول مع الأساليب الأخرى التي تم استخدامها لتسمية الخلايا مع الحمض النووي، مثل مع الحمض النووي المهجن إلى أصابع الزنك المعبر عنها غشاء40،وذلك باستخدام الحمض النووي41NHS-المقترنة، والتفاعل مع بقايا حمض الرياليك azido على سطح الخلية مع الحمض النووي الفوسفينالمقترنة 42 . يمكن تطبيق CMO-DPAC على مجموعة متنوعة من التجارب التي تتطلب رقابة مشددة على تباعد خلايا الخلية ، بما في ذلك دراسات التفاعلات بين أزواج الخلايا ، وتجارب الثقافة المشتركة التي تبحث في نقل الإشارات من خلايا "المرسل" إلى خلايا "المتلقي" ، والتحقيقات في تأثير الإشارات خارج الخلية القريبة علىتمايزالخلايا الجذعية 6،29 . ويمكن أيضا أن تستخدم هذه الطريقة لإنشاء microtissues التي يمكن استخدامها لدراسة هجرة الخلايا في ثلاثة أبعاد، والتنظيم الذاتي للخلايا في الأنسجة23،27، والتفاعل الديناميكي بين الخلايا وECM27. نأمل أن يوفر هذا البروتوكول للباحثين منصة يمكن الوصول إليها لاستكشاف تطبيقات جديدة لأنماط الخلايا عالية الدقة القائمة على الحمض النووي في مختبراتهم الخاصة.
Disclosures
Z.J.G. هو مستشار وصاحب الأسهم في العلوم البيولوجية المصدر.
Acknowledgements
ويود المؤلفان أن يشكرا جيريمي غارسيا على اختبار هذا البروتوكول وبوشان خاربيكار على توفير التدريب على المعدات في جامعة كاليفورنيا في سان جرما مايكرو الطبية الحيوية وتكنولوجيا النانو الأساسية. تم دعم هذا البحث جزئيا من خلال منح من وزارة الدفاع برنامج أبحاث سرطان الثدي (W81XWH-10-1-1023 وW81XWH-13-1-0221)، المعاهد القومية للصحة (U01CA199315، DP2 HD080351-01، 1R01CA190843-01، 1R21EB019181-01A، و1R21CA182375-01A1)، وNSF (MCB1330864)، ومركز UCSF للبناء الخلوي (DBI-1548297)، وهو مركز العلوم والتكنولوجيا NSF. تم تمويل O.J.S من قبل زمالة أبحاث الدراسات العليا NSF ، ومنحة سيبل ، ومنحة P.E.O. (زي جي جي) و(آر آر أي) محققان من (تشان زوكربيرج بيو هوب)
Materials
| Name | Company | Catalog Number | Comments |
| 2-well Chambered Coverglass w/ non-removable wells | Thermo Fisher Scientific | 155379 | |
| Acetic Acid | Sigma-Aldrich | A6283 | |
| Adapter with External SM1 Threads and Internal SM3 Thread | ThorLabs | SM3A1 | |
| Aldehyde Functionalized Slides | Schott | Nexterion Slide AL | Store under dry conditions after opening. |
| All Plastic Syringes, 1 mL | Fisher Scientific | 14-817-25 | |
| Amine-Modified DNA Oligo | IDT | n/a | See Supplemental File 1 for suggested sequences. |
| Aspheric Condenser Lens | ThorLabs | ACL7560 | |
| Borosilicate Disc, 6in Diameter X 1/2in Thick | Chemglass | CG-1906-23 | |
| Cell Culture Dishes 60x15 mm style | Corning | 353002 | |
| Cholesterol-Modified Oligo | IDT | n/a | See Supplemental File 1 for suggested sequences. |
| Diamond Scribe | Excelta | 475B | |
| DNA Oligonucleotide | IDT | n/a | See Supplemental File 1 for suggested sequences. |
| DPBS, no calcium, no magnesium | Thermo Fisher Scientific | 14190250 | |
| Isopropyl Alcohol | Sigma-Aldrich | 278475 | |
| Matrigel Matrix, Growth Factor Reduced | Corning | 354230 | |
| Methylene Chloride (Stabilized/Certified ACS) | Fisher Scientific | D37-4 | |
| MF-321 Developer | Kayaku Advanced Materials | n/a | |
| Microposit S1813 Positive Photoresist | Kayaku Advanced Materials | n/a | |
| Ø3" Adjustable Lens Tube, 0.81" Travel | ThorLabs | SM3V10 | |
| Oven | Thermo Scientific | 51-028-112H | |
| PE-50 Compact Benchtop Plasma Cleaning System | Plasma Etch | PE-50 | |
| Photomask (custom) | CAD/Art Services | n/a | Minimum feature size guaranteed by CAD/Art Services is 10 microns. |
| Razor Blades | Fisher Scientific | 12-640 | |
| RCT Basic Hot Plate | IKA | 3810001 | |
| Silicon Wafer (100 mm) | University Wafer | 590 | |
| Sodium Borohydride, 98%, granules | Acros Organics | 419471000 | |
| Spin Coater Kit | Instras | SCK-200 | This is a low cost option, but any spin coater that can maintain a speed of 3000 rpm will suffice. |
| SU-8 2075 | Microchem | Y111074 0500L1GL | |
| SU-8 Developer | Microchem | Y020100 4000L1PE | |
| Sylgard 184 Silicone Elastomer Kit | Dow | 2646340 | |
| Syringe Needles | Sigma-Aldrich | Z192341 | |
| T-Cube LED Driver, 1200 mA Max Drive Current | ThorLabs | LEDD1B | |
| Tridecafluoro-1,1,2,2-tetrahydrooctyl dimethylchlorosilane | Gelest | SIT8170.0 | |
| Triethylamine | Sigma-Aldrich | 90335 | |
| Turbo DNase | Thermo Fisher Scientific | AM2238 | |
| Tweezers Style N7 | VWR | 100488-324 | The curved shape of these tweezers is essential for delicately picking up the PDMS flow cells containing patterned tissues. |
| UV LED (365 nm, 190 mW (Min) Mounted LED, 700 mA) | ThorLabs | M365L2 | |
| Wafer Tweezers | Agar Scientific | T5063 | |
| WHEATON Dry-Seal vacuum desiccator | Millipore Sigma | W365885 |
References
- Kreeger, P. K., Strong, L. E., Masters, K. S. Engineering approaches to study cellular decision-making. Annual Review of Biomedical Engineering. , 49-72 (2018).
- Goubko, C. a., Cao, X. Patterning multiple cell types in co-cultures: A review. Materials Science and Engineering C. 29 (6), 1855 (2009).
- Sun, W., et al. The bioprinting roadmap. Biofabrication. 12 (2), 022002 (2020).
- Liu, W. F., Chen, C. S. Cellular and multicellular form and function. Advanced Drug Delivery Reviews. 59 (13), 1319-1328 (2007).
- Duffy, R. M., Sun, Y., Feinberg, A. W. Understanding the role of ECM protein composition and geometric micropatterning for engineering human skeletal muscle. Annals of Biomedical Engineering. 44 (6), 2076-2089 (2016).
- Chen, S., et al. Interrogating cellular fate decisions with high-throughput arrays of multiplexed cellular communities. Nature Communications. 7, 10309 (2016).
- Shaya, O., et al. Cell-cell contact area affects notch signaling and notch-dependent patterning. Developmental Cell. 40 (5), 505-511 (2017).
- Rao, N., et al. A co-culture device with a tunable stiffness to understand combinatorial cell-cell and cell-matrix interactions. Integrative Biology. 5 (11), 1344 (2013).
- Sriraghavan, V., Desai, R. A., Kwon, Y., Mrksich, M., Chen, C. S. Micropatterned dynamically adhesive substrates for cell migration. Langmuir. 26 (22), 17733-17738 (2010).
- Wong, L., Pegan, J. D., Gabela-Zuniga, B., Khine, M., McCloskey, K. E. Leaf-inspired microcontact printing vascular patterns. Biofabrication. 9 (2), 021001 (2017).
- Chen, T. H., et al. Directing tissue morphogenesis via self-assembly of vascular mesenchymal cells. Biomaterials. 33 (35), 9019-9026 (2012).
- Laurent, J., et al. Convergence of microengineering and cellular self-organization towards functional tissue manufacturing. Nature Biomedical Engineering. 1 (12), 939-956 (2017).
- Lin, C., Khetani, S. R. Micropatterned co-cultures of human hepatocytes and stromal cells for the assessment of drug clearance and drug-drug interactions. Current Protocols in Toxicology. 2017, 1-23 (2017).
- Hui, E. E., Bhatia, S. N. Micromechanical control of cell-cell interactions. Proceedings of the National Academy of Sciences of the United States of America. 104 (14), 5722-5726 (2007).
- D'Arcangelo, E., McGuigan, A. P. Micropatterning strategies to engineer controlled cell and tissue architecture in vitro. BioTechniques. 58 (1), 13-23 (2015).
- Martinez-Rivas, A., González-Quijano, G. K., Proa-Coronado, S., Séverac, C., Dague, E. Methods of micropatterning and manipulation of cells for biomedical applications. Micromachines. 8 (12), (2017).
- Lee, S., et al. Simple lithography-free single cell micropatterning using laser-cut stencils. Journal of Visualized Experiments. (158), e60888 (2020).
- Strale, P. O., et al. Multiprotein printing by light-induced molecular adsorption. Advanced Materials. 28 (10), 2024-2029 (2016).
- Melero, C., et al. Light-induced molecular adsorption of proteins using the primo system for micro-patterning to study cell responses to extracellular matrix proteins. Journal of Visualized Experiments. (152), e60092 (2019).
- Reid, J. A., Mollica, P. M., Bruno, R. D., Sachs, P. C. Consistent and reproducible cultures of large-scale 3D mammary epithelial structures using an accessible bioprinting platform. Breast Cancer Research. , 1-13 (2018).
- Wang, Z., Lee, S. J., Cheng, H. -. J., Yoo, J. J., Atala, A. 3D bioprinted functional and contractile cardiac tissue constructs. Acta Biomaterialia. 70, 48-56 (2018).
- Miri, A. K., et al. Effective bioprinting resolution in tissue model fabrication. Lab on a Chip. 19 (11), 2019-2037 (2019).
- Todhunter, M. E., et al. Programmed synthesis of three-dimensional tissues. Nature Methods. 12 (10), 975-981 (2015).
- Todhunter, M. E., Weber, R. J., Farlow, J., Jee, N. Y., Gartner, Z. J. Fabrication of 3D microtissue arrays by DNA programmed assembly of cells. Current Protocols in Chemical Biology. 8 (3), 147-178 (2016).
- Csizmar, C. M., Petersburg, J. R., Wagner, C. R. Programming cell-cell interactions through non-genetic membrane engineering. Cell Chemical Biology. 25 (8), 931-940 (2018).
- Weber, R. J., Liang, S. I., Selden, N. S., Desai, T. A., Gartner, Z. J. Efficient targeting of fatty-acid modified oligonucleotides to live cell membranes through stepwise assembly. Biomacromolecules. 15 (12), 4621-4626 (2014).
- Hughes, A. J., et al. Engineered tissue folding by mechanical compaction of the mesenchyme. Developmental Cell. 44 (2), 165-178 (2018).
- Weber, R. J., et al. Rapid organoid reconstitution by chemical micromolding. ACS Biomaterials Science & Engineering. 2 (11), 1851-1855 (2016).
- Scheideler, O. J., et al. Recapitulating complex biological signaling environments using a multiplexed, DNA-patterning approach. Science Advances. 6 (12), (2020).
- Viola, J. M., et al. Guiding cell network assembly using shape-morphing hydrogels. Advanced materials (Deerfield Beach, Fla.). , 2002195 (2020).
- Mohammad, A., Davis, M., Aprelev, A., Ferrone, F. A. Note: Professional grade microfluidics fabricated simply. Review of Scientific Instruments. 87 (10), 1-4 (2016).
- Lee, O. J., Chuah, H. S., Umar, R., Chen, S. K., Yusra, A. F. I. Construction of cost effective homebuilt spin coater for coating amylose-amylopectin thin films. Journal of Fundamental and Applied Sciences. 9 (2), 279 (2018).
- Webb, K., Hlady, V., Tresco, P. A. Relative importance of surface wettability and charged functional groups on NIH 3T3 fibroblast attachment, spreading, and cytoskeletal organization. Journal of Biomedical Materials Research. 41 (3), 422-430 (1998).
- Processing Guidelines for: SU-8 2025, SU-8 2035, SU-8 2050, SU-8 2075. Microchem SU-8 2000 Permanent Expoxy Negative Photoresist Available from: https://kayakuam.com/wp-content/uploads/2019/09/SU-82000DataSheet2025thru2075Ver4.pdf (2019)
- Palte, M. J., Raines, R. T. Interaction of nucleic acids with the glycocalyx. Journal of the American Chemical Society. 134 (14), 6218-6223 (2012).
- McGinnis, C. S., et al. MULTI-seq: sample multiplexing for single-cell RNA sequencing using lipid-tagged indices. Nature Methods. 16 (7), 619-626 (2019).
- Maxfield, F. R., van Meer, G. Cholesterol, the central lipid of mammalian cells. Current Opinion in Cell Biology. 22 (4), 422-429 (2010).
- Luo, J., Yang, H., Song, B. L. Mechanisms and regulation of cholesterol homeostasis. Nature Reviews Molecular Cell Biology. 21 (4), 225-245 (2020).
- Liu, L., Tan, L., Yao, J., Yang, L. Long non-coding RNA MALAT1 regulates cholesterol accumulation in ox-LDL-induced macrophages via the microRNA-17-5p/ABCA1 axis. Molecular Medicine Reports. 21 (4), 1761-1770 (2020).
- Mali, P., Aach, J., Lee, J. H., Levner, D., Nip, L., Church, G. M. Barcoding cells using cell-surface programmable DNA-binding domains. Nature Methods. 10 (5), 403-406 (2013).
- Hsiao, S. C., et al. Direct cell surface modification with DNA for the capture of primary cells and the investigation of myotube formation on defined patterns. Langmuir. 25 (12), 6985-6991 (2009).
- Gartner, Z. J., Bertozzi, C. R. Programmed assembly of 3-dimensional microtissues with defined cellular conductivity. Proceedings of the National Academy of Sciences. (17), 1-5 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved