Method Article
Modellazione semplice, economica e modulare delle cellule utilizzando il DNA
In questo articolo
Riepilogo
Qui presentiamo un protocollo alle cellule micropattern a risoluzione monocellulare utilizzando l'adesione programmata dal DNA. Questo protocollo utilizza una piattaforma di fotolitografia da banco per creare modelli di oligonucleotidi del DNA su un vetrino e quindi etichetta le membrane cellulari con oligonucleotidi complementari disponibili in commercio. L'ibridazione degli oligos si traduce in adesione cellulareprogrammata.
Abstract
Il posizionamento relativo delle cellule è una caratteristica chiave del microambiente che organizza le interazioni cellula-cellula. Per studiare le interazioni tra cellule dello stesso tipo o di un tipo diverso, le tecniche di micropatterning si sono rivelate utili. IL DNA Programmed Assembly of Cells (DPAC) è una tecnica di micropatterning che mira all'adesione delle cellule a un substrato o ad altre cellule utilizzando l'ibridazione del DNA. Le operazioni più basilari in DPAC iniziano con la decorazione delle membrane cellulari con oligonucleotidi lipidici modificati, quindi li fa scorrere su un substrato che è stato modellato con sequenze di DNA complementari. Le cellule aderiscono selettivamente al substrato solo dove trovano una sequenza di DNA complementare. Le cellule non aderenti vengono lavate via, rivelando un modello di cellule aderenti. Ulteriori operazioni includono ulteriori cicli di adesione cellula-substrato o cellula-cellula, nonché il trasferimento dei modelli formati da DPAC a un idrogel incorporante per la coltura a lungo termine. In precedenza, i metodi per modellare oligonucleotidi su superfici e decorare le cellule con sequenze di DNA richiedevano rispettivamente attrezzature specializzate e sintesi del DNA personalizzata. Riportiamo una versione aggiornata del protocollo, utilizzando una configurazione di fotolitografia da banco economica e oligonucleotidi modificati dal colesterolo (CMO) disponibili in commercio distribuiti utilizzando un formato modulare. Le cellule etichettate con CMO aderiscono con alta efficienza ai substrati modellati sul DNA. Questo approccio può essere utilizzato per modellare più tipi di cellule contemporaneamente con alta precisione e per creare matrici di microtissue incorporate all'interno di una matrice extracellulare. I vantaggi di questo metodo includono la sua alta risoluzione, la capacità di incorporare le cellule in un microambiente tridimensionale senza interrompere il micropattern e la flessibilità nel modellare qualsiasi tipo di cellula.
Introduzione
Il posizionamento delle cellule l'una rispetto all'altra in un tessuto è una caratteristica importante del microambiente1,2,3,4. Le tecniche utilizzate per modellare le cellule vive in disposizioni controllate spazialmente sono preziosi strumenti sperimentali per studiare la differenziazione4,5,6,7,8,la motilità cellulare9,la morfogenesi10,11,12,il metabolismo13e le interazioni cellula-cellula7,14 . Esiste una varietà di metodi per modellare le cellule, ognuno con i propri vantaggi e svantaggi3,4. I metodi che creano isole adesive di proteine della matrice extracellulare (ECM), come la stampa di microcontatti e gli stencil tagliati al laser, sono semplici e scalabili. Tuttavia, è difficile modellare più di uno o due tipi di cellule alla volta perché le proprietà adesive di diversi tipi di cellule a diverse molecole di ECM sono spesso simili15,16,17. Micropattern più complessi possono essere creati con adsorbimento molecolare indotto dalla luce (LIMAP), una tecnica che utilizza la luce UV per ablare le regioni rivestite di PEG e consentire il successivo adsorbimento proteico18,19. Questo processo può essere ripetuto per creare micropattern ad alta risoluzione con più tipi di celle. Tuttavia, può verificarsi un legame incrociato delle cellule ai diversi cerotti proteici, con conseguente scarsa specificità del modello19. Metodi fisici come la semina di celle su dispositivi di coltura micromeccanici riconfigurabili possono creare co-colture strutturate con controllo dinamico, ma senza la flessibilità nella progettazione di modelli di stampa a microcontatto o LIMAP14,8. A differenza delle altre tecniche, il bioprinting può creare disposizioni tridimensionali delle cellule all'interno di idrogel20,21. Tuttavia, i costrutti bioprinted hanno una risoluzione molto più bassa rispetto ad altre tecniche di micropatterning, con una dimensione media delle caratteristiche dell'ordine di centinaia di micron22. Un metodo di modellazione cellulare ideale avrebbe un'alta risoluzione, modelli di più tipi di cellule, utilizzerebbe apparecchiature e reagenti facilmente accessibili e avrebbe la capacità di incorporare modelli di successo in un idrogel per la coltura cellulare tridimensionale (3D). In questo articolo, presentiamo CMO-DPAC, una tecnica di micropatterning cellulare che utilizza la flessibilità e la velocità dell'ibridazione del DNA per indirizzare l'adesione cellulare a un substrato. Questo metodo è stato adattato dai nostri precedenti protocolli23,24 per renderlo più conveniente, modulare e accessibile. Utilizzando il protocollo corrente, qualsiasi laboratorio dovrebbe essere in grado di configurare un sistema completamente funzionale senza alcuna attrezzatura o competenza specializzata.
DNA Programmed Assembly of Cells (DPAC) è una potente tecnica di ingegneria tissutale che modelli le cellule alla risoluzione di una singola cellula con un controllo preciso sulla spaziatura cellula-cellula e sulla geometria del tessuto. Nel DPAC, le membrane cellulari sono decorate con oligonucleotidi del DNA (oligos) utilizzando due oligo modificati lipidici progettati per ibridarsi sulla membrana cellulare. Poiché gli oligo sono coniugati ai lipidi idrofobici, si dividono rapidamente nella membrana cellulare25 dove si ibridano, aumentando l'idrofobicità netta delle molecole non legate covalentemente e migliorando così la loro durata sulla superficie cellulare26. Gli oligo sono presentati sulla superficie cellulare in un modo in cui possono ibridarsi con oligo complementari su altre cellule o vetrini di vetro funzionalizzati al DNA per creare modelli cellulari 2D o 3D definiti con composizione prescritta, spaziatura cellula-cellula e geometria23,24. I microsessu modellati possono essere scissi dalla superficie enzimaticamente e incorporati in un idrogel per una coltura 3D prolungata. Se utilizzate in combinazione con cellule primarie o cellule staminali, le raccolte risultanti di cellule possono subire morfogenesi e formarsi in organoidi23,27,28. Il DPAC è stato applicato per studiare la dinamica del destino delle cellule staminali neurali adulte in risposta ai segnali concorrenti6,29,per studiare l'auto-organizzazione delle cellule epiteliali mammarie23,28,e per generare "origami tissutali" attraverso la condensazione mesenchimale27.
DPAC consente il posizionamento preciso di più popolazioni cellulari e ha una risoluzione sostanzialmente migliore rispetto alle biostampanti basate sull'estrusione (dell'ordine dei micron)22,23. Inoltre, a differenza dei metodi di patterning basati su ECM come la stampa a microcontatto, DPAC non richiede l'adesione differenziale dei diversi tipi di cellule a una superficie rivestita in ECM15,23. È ideale per rispondere a domande su come la composizione di un tessuto influisce sul suo comportamento, su come le cellule integrano più segnali cellulari e microambiente quando prendono decisioni6,29e su come coppie di cellule interagiscono tra loro. Un vantaggio di questo metodo rispetto ad altri metodi di micropatterning è che può essere utilizzato per la coltura cellulare 3D in un singolo piano di imaging, facilitando gli studi time-lapse dell'auto-organizzazione tissutale e della morfogenesi organoide23,27,30.
Nonostante questi vantaggi, l'implementazione di successo del DPAC ha richiesto la sintesi di reagenti oligonucleotidici personalizzati e l'accesso ad apparecchiature specializzate per il pattern del DNA23,24,limitando l'adozione diffusa. Ad esempio, gli oligos lipidi modificati ottimali (LMO) utilizzati nel protocollo originale devono essere sintetizzati su misura, modificati con acido lignocerico o acido palmitico e purificati26. Questo processo richiede l'uso di un sintetizzatore di DNA e di uno strumento di cromatografia liquida ad alte prestazioni, nonché l'acquisto dei reagenti associati come la metilammina, una sostanza controllata soggetta alle normative istituzionali e federali. In alternativa, gli LMO possono essere acquistati su misura all'ingrosso, ma ciò richiede un significativo investimento iniziale nella tecnologia.
Per superare queste limitazioni, abbiamo sviluppato una versione rivista di DPAC che utilizza oligo modificati per il colesterolo (CMO) disponibili in commercio al posto degli LMO sintetizzati su misura. Per ridurre ulteriormente i costi e aumentare la flessibilità della piattaforma, siamo passati a un sistema modulare a tre oligo. Invece di ordinare un nuovo oligo modificato dal colesterolo per ogni singola popolazione cellulare, un utente di questo protocollo può invece utilizzare gli stessi oligo modificati dal colesterolo ("Universal Anchor" e "Universal Co-Anchor") per ogni popolazione cellulare e quindi impiegare un oligo economico e non modificato ("Adapter Strand") che si ibrida sia con l'Universal Anchor che con il DNA funzionalizzato all'ammina sulla superficie o con l'Adapter Strand di un altro tipo di cellula.
Un'altra limitazione del protocollo DPAC originale era che creava le diapositive modellate sul DNA utilizzando una stampante liquida ad alta risoluzione (ad esempio, Nano eNabler, BioForce Nanosciences)23,24. Sebbene questo strumento vanti una risoluzione straordinaria e bassi requisiti di reagenti, non è disponibile per la maggior parte delle istituzioni e ha una velocità di stampa relativamente bassa (circa 1 caratteristica modellata al secondo). Recentemente, sono stati sviluppati due metodi fotolitografici per modellare le caratteristiche del DNA sulle superfici. Viola e colleghi hanno utilizzato un rivestimento in poliacrilammide e benzofenone che legava covalentemente oligos di DNA a singolo filamento dopo l'esposizione alla luce UV30. Usando questo metodo, sono stati in grado di creare scaffold tissutali che hanno subito cambiamenti di forma programmati su larga scala a seguito della contrattilità cellulare e dell'auto-organizzazione. Scheideler et al. hanno sviluppato un metodo che utilizza l'esposizione ai raggi UV di un fotoresist positivo per esporre selettivamente oligos di DNA modificato da ammine a un vetrino funzionalizzato con aldeide29. Dopo la cottura e l'aminazione riduttiva, il DNA amminico modificato è legato covalentemente alla superficie. Questo metodo è stato utilizzato per studiare la risposta delle cellule staminali neurali adulte ai segnali di auto-rinnovamento e differenziazione presentati spazialmente. Questo articolo adatta il protocollo di Scheideler et al. per creare i modelli di DNA che cattureranno le cellule etichettate cmo. Questo protocollo di fotopatterning può essere eseguito senza utilizzare una camera bianca. Utilizza attrezzature economiche e disponibili in commercio che possono essere facilmente implementate su un banco o su una cappa aspirante. L'uso di apparecchiature di fotolitografia economiche o fai-da-te (fai-da-te) aumenta l'accessibilità ai ricercatori senza accesso alle strutture delle camere bianche e consente ai ricercatori di provare la tecnica senza un grande investimento di tempo o risorse31,32. Tuttavia, una migliore risoluzione e l'allineamento di più caratteristiche del DNA possono essere ottenuti utilizzando lo spin coater commerciale e l'allineatore di maschere che si trovano comunemente nelle camere bianche.
Qui, descriviamo un metodo per modellare le cellule a risoluzione di una singola cellula usando l'adesione basata sul DNA. In primo luogo, il fotopatterning con un fotoresist positivo viene utilizzato per creare modelli ad alta risoluzione di DNA amminico modificato su un substrato di vetro modificato con aldeide. Successivamente, il vetrino viene trattato per ridurre l'attaccamento cellulare non specifico e le celle di flusso PDMS vengono create per confinare le cellule su regioni modellate. Le cellule vengono quindi etichettate con oligonucleotidi di DNA corti che vengono funzionalizzati con il colesterolo e di conseguenza inseriti nella membrana cellulare. Le cellule vengono quindi fluite sui micropattern del DNA. L'ibridazione tra il DNA della superficie cellulare e il DNA sulla superficie del vetro si traduce in un'adesione specifica delle cellule al modello di DNA. Le cellule non aderenti vengono lavate via, rivelando il modello cellulare aderente. Questo processo può essere ripetuto per creare più tipi di celle o per creare strutture a più livelli. Se lo si desidera, le cellule possono essere completamente incorporate in un ECM per la coltura cellulare 3D.
Protocollo
1. Esperimento di progettazione
- Pianificare l'esperimento desiderato, considerando le dimensioni delle feature, la spaziatura delle feature, il numero di tipi di celle coinvolti e la disposizione delle celle l'una rispetto all'altra. Fare riferimento al file supplementare 1, una guida per la progettazione sperimentale, e al file supplementare 2, che contiene esempi di sequenze oligo.
- Progetta fotomaschere utilizzando un software di progettazione assistita da computer. Un esempio di fotomaschera è fornito in File supplementare 3.
- Disegnare un rettangolo delle dimensioni di un vetrino per microscopio standard (25 mm x 75 mm).
- Disegnare quattro regioni rettangolari larghe 10 mm e lunghe 10 mm, distribuite uniformemente sulla diapositiva.
- All'interno di ogni regione, disegna le feature che sono le dimensioni, la forma e la spaziatura desiderate per l'esperimento. Le cellule aderiranno solo a queste caratteristiche nell'esperimento.
- Per creare fotomaschere allineate per più tipi di celle, create un disegno master con tutti i set di feature, quindi salvate le versioni corrispondenti a ciascun tipo di cella.
- Ordinate una fotomaschera di trasparenza ad alta risoluzione (almeno 20.000 punti per pollice) da questo disegno CAD con le feature disegnate in 1.2.3 trasparente e le regioni più grandi nere.
2. Photopattern DNA su vetrini funzionalizzati con aldeide (protocollo adattato da Scheideler et al.29 )
- Se si modellizzano più tipi di cellule, fabbricare marcatori fiduciali sul vetrino funzionalizzato con aldeide prima di qualsiasi modello di DNA per facilitare l'allineamento delle caratteristiche. Metodi alternativi per la creazione di marcatori fiduciali sono suggeriti nel file supplementare 1.
- Per creare marcatori fiduciali in metallo, applicare il fotoresist positivo S1813 come descritto nei passaggi da 2.3 a 2.11. Usa una maschera fotografica che contenga funzionalità di grandi dimensioni che saranno facili da allineare in seguito. Incorporare queste caratteristiche nel design delle fotomaschere che verranno utilizzate per la modellazione del DNA.
- Depositare un film sottile (100 Angstrom) di titanio sul vetrino usando l'evaporazione a pistola elettronica29. Rimuovere il metallo in eccesso e fotoresist usando l'acetone, quindi procedere alla fotopatterazione del DNA.
- Preparare una soluzione da 20 μM di un oligo modificato da 5' ammine in tampone DNA (50 mM di fosfato di sodio in acqua, pH = 8,5). Vedere il file supplementare 2 per le sequenze oligo suggerite.
NOTA: è possibile utilizzare un minimo di 5 μM di oligo modificato dall'ammina per alcuni modelli e applicazioni, quindi potrebbe essere necessario ottimizzare la concentrazione di DNA superficiale. - Preriscaldare una piastra calda a 100 °C.
- Utilizzare nastro biadesivo o un vuoto per fissare una slitta di vetro funzionalizzata all'aldeide al rotore di una centrifuga.
ATTENZIONE: il distacco della slitta durante lo spin-coating è un rischio per la sicurezza. Utilizzare sempre la centrifuga in un contenitore chiuso con un coperchio, ad esempio una scatola acrilica.
NOTA: etichettare un angolo della diapositiva utilizzando uno scriba diamantato o un attrezzo simile per graffiare il vetro. Questo aiuta con l'identificazione e l'orientamento della diapositiva dopo che il fotoresist è stato lavato via. - Utilizzare una pipetta monouso per far cadere il fotoresist positivo sul vetrino di aldeide. Per i rivestimenti pari, aggiungere piccole gocce del fotoresist attraverso la diapositiva, invece di una grande goccia nel mezzo (Figura supplementare 1A).
- Utilizzando lo spin coater, ruotare la slitta a 3000 giri / min per 30 s.
- Posizionare la diapositiva su una piastra riscaldatrice a 100 °C per 1,5 minuti (cottura morbida) per reticolare la fotoresistente.
- Rimuovere la diapositiva dalla piastra di cottura. Posizionare una fotomaschera con le caratteristiche desiderate per questo esperimento sulla parte superiore della diapositiva e pesare la fotomaschera con un pezzo di vetro (Figura supplementare 1B,C). Coprire l'intera configurazione in una casella opaca (Figura supplementare 1D). Esporre con una lampada UV (lunghezza d'onda 365 nm, 360 mW, 5 pollici dalla slitta, densità di energia radiante totale 100 mJ/cm2)per 2 min.
NOTA: la luce UV romperà i legami polimerici nel fotoresist sotto le regioni trasparenti della fotomaschera, creando regioni in cui il DNA sarà successivamente in grado di aderire. - Sviluppare la diapositiva immergendosi nella soluzione di sviluppo per 3-5 minuti (Figura supplementare 1E).
- Risciacquare la soluzione di sviluppo in eccesso con acqua. Asciugare sotto un flusso d'aria o azoto. (Figura supplementare 1F).
- Conferma che la fotolitografia ha avuto successo guardando il vetrino al microscopio. Poiché il fotoresist è sensibile ai raggi UV, eseguire rapidamente questo passaggio e quindi conservare la diapositiva al buio durante la preparazione di altre diapositive (se applicabile).
NOTA: una diapositiva di cui è stata create una serie corretta deve avere spigoli ben definiti per ogni feature, nessuna fessurazione e nessuna distorsione della feature sugli spigoli. Esempi di fotolitografia corretta e scorretta sono forniti nella Figura supplementare 2A. Vedere la Tabella 1 per suggerimenti per la risoluzione dei problemi se la fotolitografia non fornisce la qualità di funzionalità desiderata. - Aggiungere una goccia della soluzione oligo modificata con ammina da 20 μM (Fase 2.1) su ciascuna regione fotopatterata del vetrino. Utilizzare una punta della pipetta per distribuire delicatamente la goccia su tutta la regione, facendo attenzione a non graffiare la diapositiva. (Figura supplementare 1G).
- Cuocere il vetrino in forno a 65-70 °C fino a quando la soluzione di DNA non si è completamente asciugata sulla superficie del vetrino (circa 1 ora).
- Eseguire l'aminazione riduttiva posizionando i vetrini cotti a motivi geometrici in un piatto di coltura cellulare di 15 cm e posizionandoli in una cappa aspirante sopra uno shaker. Pesare 100 mg di boroidro di sodio. In una cappa aspirante, aggiungere 40 ml di soluzione salina tamponata con fosfato (PBS), mescolare delicatamente e aggiungere al piatto contenente i vetrini modellati. Lasciare che la reazione proceda per 15 minuti con un leggero scuotimento.
NOTA: L'ammina sull'oligo forma prima una base di Schiff con le aldeidi sulla superficie di scorrimento. Questo è un legame covalente reversibile che deve essere convertito in un legame irreversibile prima dell'uso in DPAC. L'aggiunta di un agente riducente (boroidrato di sodio) converte la base di Schiff in un'ammina secondaria mediante aminazione riduttiva.
ATTENZIONE: La reazione del boroidro di sodio con l'acqua crea idrogeno gassoso e continuerà a farlo per ore o giorni dopo l'inizio della reazione. Eseguire la fase di aminazione riduttiva in una cappa aspirante e conservare tutti i rifiuti della soluzione di boroidrouro di sodio in un contenitore aperto o con cappuccio sciolto nella cappa aspirante per almeno 24 ore. - Rimuovere il DNA non reattato lavando due volte con lo 0,1% di sodio dodecil solfato (SDS) in acqua, quindi tre volte con acqua distillata. Asciugare la diapositiva sotto un flusso di azoto o aria.
- Risciacquare il vetrino con acetone per rimuovere il fotoresist rimanente.
NOTA: A questo punto, il DNA è stato irreversibilmente e covalentemente attaccato al vetrino e tutti i gruppi funzionali di aldeide non reazionati sono stati convertiti in alcoli. Il photoresist non è più necessario. - Se verranno modellati più oligo, tornare al passaggio 2.4, allineare la fotomaschera con segni fiduciali e ripetere.
NOTA: l'esperimento può essere messo in pausa qui. Conservare i vetrini in un essiccatore sottovuoto. In condizioni asciutte, le diapositive possono essere conservate fino a 3 mesi senza perdita di qualità.
3. Rendere il vetrino idrofobo (opzionale) (protocollo adattato da Todhunter et al.24)
NOTA: È vantaggioso, ma non obbligatorio, modificare la chimica superficiale del vetrino per renderlo più inerte e idrofobo. L'attacco cellulare non specifico è ridotto su queste superfici33, alleviando così il legame non specifico delle celle alle aree non modellate della diapositiva. Inoltre, se le cellule modellate alla fine saranno incorporate all'interno di un idrogel e trasferite fuori dal vetrino, il trattamento superficiale è essenziale per un movimento affidabile dell'idrogel carico di cellule attraverso il vetrino senza distorsioni o strappi. La silanizzazione con (tridecafluoro-1,1,2,2-tetraidroottilo) dimetilclorosilano provoca la presenza di gruppi fluoroalchilici idrofobici sulla superficie del vetrino.
ATTENZIONE: Eseguire tutte le fasi dalla 3.1 in poi in una cappa aspirante chimica per prevenire l'esposizione ai fumi dell'acido acetico e del cloruro di metilene.
- Risciacquare il vetrino con acido acetico al 10% e quindi asciugare sotto un flusso d'aria.
- In un barattolo di vetro Coplin, preparare una soluzione di 60 mL di cloruro di metilene (diclorometano), 0,6 mL di trietilammina e 0,6 mL di (tridecafluoro-1,1,2,2-tetraidroottilo) dimetilclorosilano. Mescolare con una spatola metallica per mescolare.
NOTA: Questi reagenti sono sensibili all'acqua. Dovrebbero essere conservati in condizioni asciutte e usati il più freschi possibile. - Aggiungere la diapositiva al barattolo Coplin contenente la soluzione di silano. Posizionare il barattolo Coplin su uno shaker orbitale (impostato a 60-80 giri / min) e consentire alla reazione del silano e della slitta di progredire per 15 minuti.
- Utilizzare pinci metallici per rimuovere il vetrino dalla soluzione di silano. Immergere il vetrino in un barattolo coplin contenente cloruro di metilene per 1 minuto per rimuovere il silano in eccesso dal vetrino.
- Immergere il vetrino in un tubo conico da 50 ml contenente etanolo. Agitare. Immergere la diapositiva in un tubo conico da 50 ml contenente acqua distillata. Agitare.
NOTA: il cloruro di metilene e l'acqua non sono miscibili, quindi è necessario un risciacquo con etanolo per rimuovere il cloruro di metilene in eccesso prima del risciacquo finale dell'acqua. - Rimuovere lo scivolo dall'acqua e ispezionarlo. Lo scivolo deve essere abbastanza asciutto, con eventuali goccioline d'acqua con un angolo di contatto superiore a 90°. Lasciare asciugare completamente i vetrini e conservare sottovuoto fino all'uso.
NOTA: l'esperimento può essere messo in pausa qui. Conservare la diapositiva in condizioni asciutte.
4. Preparare le celle di flusso PDMS e scorrere per l'esperimento
NOTA: le celle di flusso PDMS rettangolari vengono utilizzate per concentrare le celle sulle aree modellate della diapositiva. Per gli esperimenti coltivati in 3D, le cellule di flusso formano uno stampo per l'idrogel.
- Realizzare il master SU-8 da utilizzare come stampo per le celle di flusso PDMS.
- Piastra riscalda riscalda a 95 °C.
- Aggiungere 5 ml di SU-8 2075 a un wafer di silicio.
- Spin coat il SU-8 sul wafer a 500 rpm per 10s, seguito da 1.000 rpm per 30s. Questo dovrebbe creare feature fino a 240 μm in altezza34.
- Cuocere morbidamente il wafer sulla piastra elettrica per almeno 45 minuti.
- Rimuovere il wafer dalla piastra elettrica. Metti la fotomaschera (vedi File supplementare 4) (emulsione verso il basso) sopra il wafer e appesantila con un disco di vetro per garantire il contatto tra la fotomaschera e il vetrino.
- Esporre con luce UV (365 nm) per una densità di energia radiante di 350 mJ/cm2.
- Cuocere il wafer sulla piastra elettrica per 12-15 min.
- Mettere il wafer in un ampio contenitore di vetro. Coprire il wafer con la soluzione di sviluppo SU-8. Posizionare su uno shaker e sviluppare mentre si agita per almeno 15 minuti.
- Utilizzare una pina di forza per rimuovere il wafer dalla soluzione per sviluppatori. Risciacquare per 5 s spruzzando più soluzione per sviluppatori da una bottiglia di schizzo. Spruzzare con alcool isopropilico per risciacquare. Se appare un precipitato bianco, restituire il wafer alla soluzione di sviluppo e sviluppare più a lungo.
- Wafer secco sotto un flusso di aria o azoto.
- Cuocere in forno per 5 min.
NOTA: una volta creato il wafer master, può essere riutilizzato a tempo indeterminato purché le feature rimangano intatte.
- Preparare PDMS.
- In una barca di pesatura, aggiungere l'elastomero polidimetilsilossano e il reticolante in un rapporto 10: 1 (in massa). Mescolare energicamente per garantire una miscelazione uniforme.
- Degassare il PDMS in un essiccatore sottovuoto per 15-30 minuti fino a quando non sono più visibili bolle.
- Posizionare il wafer principale in un piatto di coltura tissutale di 15 cm. Versare PDMS sul wafer. Se compaiono bolle, degassare in un essiccatore a vuoto per alcuni minuti.
- Cuocere in forno a 60 °C per 3 h.
NOTA: dopo la cottura, le celle di flusso PDMS possono essere conservate sul banco a tempo indeterminato.
- Preparare le celle di flusso PDMS per l'esperimento.
- Poco prima di iniziare un esperimento CMO-DPAC, tagliare il numero richiesto di celle di flusso PDMS dal wafer master. Il plasma ossida con aria ambiente di 10 cc/min per 90 s per rendere la superficie idrofila.
- Ritagliare ogni singola cella di flusso in modo che rimangano 1-2 mm di PDMS su ciascun lato, quindi aprire la parte superiore e inferiore della cella di flusso per creare un ingresso e un'uscita.
- Recuperate la diapositiva creata in serie creata nei passaggi 2 e 3. Allineati sopra la fotomaschera.
- Utilizzando la fotomaschera come riferimento, posizionare le celle di flusso PDMS sulla diapositiva nella posizione di ciascuna regione modellata.
- Aggiungere 50 μL di soluzione salina tamponata con fosfato (PBS) + 1% di albumina sierica bovina (BSA) all'ingresso di ciascuna cellula di flusso, come mostrato nella Figura supplementare 1H. Confermare che la cella di flusso sia completamente riempita dal PBS + 1% BSA e che non ci siano bolle di grandi dimensioni. Procedere immediatamente ai passaggi 5 e 6.
NOTA: il blocco con BSA riduce al minimo l'adesione della cella non specifica alla superficie di scorrimento.
5. Sollevare ed etichettare le cellule con DNA modificato dal colesterolo
- Preparare le soluzioni di DNA modificato dal colesterolo.
- Per ogni insieme di cellule nell'esperimento, mescolare insieme 3 μL di una soluzione stock da 100 μM del filamento di ancoraggio universale modificato con colesterolo con 3 μL di una soluzione stock da 100 μM di un filamento adattatore. Incubare per 1 minuto. Questo pre-ibridare gli oligo. Aggiungere 69 μL di soluzione salina tamponata con fosfato (PBS) per creare una soluzione Universal Anchor + Adapter da 4 μM.
- Per ogni insieme di cellule nell'esperimento, aggiungere 3 μL di una soluzione stock Universal Co-Anchor Strand da 100 μM modificata per il colesterolo a 12 μL di PBS, creando una soluzione da 20 μM.
- Preparare le sospensioni monocellulari.
- Per le cellule aderenti, utilizzare tripsina o altro agente di dissociazione per rimuovere le cellule dal pallone di coltura. Aggiungere i mezzi di coltura per neutralizzare la tripsina e la centrifuga per pellettizzare le cellule. Per le cellule non aderenti, raccogliere la sospensione cellulare e la centrifuga per pellettare le celle.
- Risusciendi il pellet cellulare in 1 mL di PBS ghiacciato o di supporto privo di siero. Trasferire 1-3 milioni di celle in un tubo microcentrifuga da 1,5 ml. Centrifuga a 160 x g per 4 min.
NOTA: se il tipo di cellula utilizzato è soggetto ad aggregazione/aggregazione, utilizzare PBS senza ioni di calcio e magnesio per tutte le fasi di lavaggio per ridurre l'aggregazione cellulare indesiderata. Se la vitalità è una preoccupazione particolare per il tipo di cellula utilizzata, utilizzare mezzi privi di siero invece di PBS. I mezzi contenenti siero bovino fetale non sono raccomandati per l'etichettatura cellulare in quanto possono ostacolare l'incorporazione di oligo modificati dai lipidi. 35 anni
- Etichettare le cellule con oligo modificati dal colesterolo.
- Spese di sospensione del pellet cellulare in 75 μL di PBS ghiacciato o di supporti privi di siero. Tenere le cellule in un secchiello del ghiaccio durante tutto il processo di etichettatura e lavaggio per massimizzare la vitalità cellulare e ridurre al minimo la perdita di oligo modificati dal colesterolo dalla superficie cellulare.
NOTA: la riconsosezione delle cellule prima di aggiungere il DNA garantisce che la distribuzione del DNA sia uniforme in tutta la popolazione cellulare. - Aggiungere i 75 μL della soluzione Universal Anchor + Adapter da 4 μM creata nel passaggio 5.1.1 al tubo microcentrifuga contenente la sospensione cellulare. Mescolare accuratamente mediante pipettaggio. Incubare per 5 minuti su ghiaccio.
- Aggiungere 15 μL della soluzione universale di co-ancoraggio al tubo microcentrifuga. Mescolare accuratamente mediante pipettaggio. Incubare per 5 minuti su ghiaccio.
- Rimuovere gli oligo in eccesso dalla sospensione cellulare. Aggiungere 1 mL di PBS ghiacciato o di supporto privo di siero al tubo del microcentrifuga. Mescolare con una pipetta P1000. Centrifugare a 160 x g per 4 min a 4 °C. Scartare il surnatante. Ripeti altre due volte.
NOTA: se le cellule sono soggette ad aggregazione, far passare la sospensione cellulare attraverso un filtro da 40 μm prima del lavaggio finale. Se le cellule sono inclini all'adsorbimento sul lato del tubo della microcentrifuga, considerare il pre-blocco del tubo con caseina.
- Spese di sospensione del pellet cellulare in 75 μL di PBS ghiacciato o di supporti privi di siero. Tenere le cellule in un secchiello del ghiaccio durante tutto il processo di etichettatura e lavaggio per massimizzare la vitalità cellulare e ridurre al minimo la perdita di oligo modificati dal colesterolo dalla superficie cellulare.
6. Modellare le cellule etichettate con il DNA
- Risuscindi le cellule in PBS ghiacciato o in mezzi privi di siero per creare una soluzione densa di cellule di almeno 25 milioni di cellule / ml.
NOTA: per una diapositiva che utilizza quattro delle celle di flusso PDMS da 10 mm x 15 mm x 200 μm descritte nella fase 4, sono necessari circa 100 μL di questa sospensione cellulare densa. Sebbene la maggior parte di queste cellule non aderisca al modello e alla fine venga scartata, avere una soluzione estremamente concentrata di cellule sul modello migliora notevolmente l'efficienza del pattern cellulare. - Raccogli la diapositiva e inclinala leggermente. Aggiungere 25 μL di sospensione cellulare all'ingresso di ciascuna cella di flusso sulla diapositiva modellata. Rimuovere la soluzione PBS + 1% BSA dall'uscita, consentendo alla sospensione cellulare di riempire la cella di flusso PDMS. Incubare su ghiaccio o a temperatura ambiente per 30 s.
NOTA: A questo punto, guardando la cella di flusso al microscopio dovrebbero mostrare cellule densamente imballate con poco o nessun intervallo visibile tra le cellule. Vedere la Figura supplementare 2B. - Aspirare 5 μL di sospensione cellulare dall'uscita del vetrino e aggiungerlo nuovamente all'ingresso. Ripetere l'operazione 10 volte per cella di flusso.
NOTA: L'adesione delle cellule etichettate CMO al vetrino modellato sul DNA è quasi istantanea. Il flusso delle cellule sul modello più volte aumenta la probabilità che una cellula fluisca su un determinato punto del DNA e venga catturata. - Pipettare delicatamente PBS o fluidi privi di siero nell'ingresso di ciascuna cella di flusso per lavare le cellule in eccesso. Raccogliere la sospensione cellulare dall'uscita. Ripetere 2-4 volte o fino a quando un'ispezione visiva del vetrino al microscopio conferma che non rimangono cellule in eccesso.
NOTA: Può essere vantaggioso salvare le celle in eccesso dal primo lavaggio. Se l'efficienza di pattern è insoddisfacente, le celle in eccesso possono essere centrifugate e risuscilate in un volume inferiore di PBS per creare una soluzione più densa di cellule, e quindi il processo può essere ripetuto dal passaggio 6.2. - Ripetere i passaggi da 6.1 a 6.4 per ogni set di celle della serie. Per le serie in cui più tipi di cella sono modellati direttamente dalla maschera di superficie, iniziare con il tipo di cella meno abbondante del modello e terminare con il tipo di cella più abbondante.
NOTA: Si consiglia di eseguire ogni ciclo di assemblaggio cellulare in sequenza invece di mettere in comune le cellule, anche in condizioni in cui le cellule sono tutte etichettate con sequenze di DNA ortogonali. Il pooling delle cellule diluisce efficacemente ogni popolazione cellulare e riduce l'efficienza del patterning. - Una volta completato il round finale dell'assemblaggio delle celle, i passaggi successivi varieranno in base all'esperimento specifico. Se le celle sono destinate a rimanere sul vetro, aggiungere un supporto a una capsula di Petri contenente il vetrino, quindi utilizzare delicatamente una pinica per spingere le celle di flusso PDMS fuori dal vetrino. Se le cellule saranno incorporate in un idrogel e coltivate in 3D, procedere al passaggio 7.
7. Trasferimento in idrogel per la coltura 3D (opzionale)
- Preparare una soluzione precursore di idrogel contenente il 2% di DNasi.
NOTA: la composizione della soluzione varia in base all'impostazione sperimentale. Matrigel e miscele di Matrigel e collagene Funzionano bene in questo protocollo, ma sono possibili anche altri idrogel. - Aggiungere 50 μL di soluzione di idrogel contenente il 2% di DNasi all'ingresso di ciascuna cella di flusso. Aspirare il fluido in eccesso dall'uscita, guidando la soluzione di idrogel nella cella di flusso. Per i precursori dell'idrogel viscoso, può essere necessario inclinare leggermente il vetrino per aiutare l'idrogel a fluire nella cella di flusso.
- Incubare il vetrino a 37 °C per 30-45 minuti (a seconda della cinetica di gelificazione dell'idrogel) per consentire all'idrogel di fissarsi e scindere l'adesione basata sul DNA tra le cellule e la superficie.
- Rimuovere ogni cella di flusso dal vetrino e posizionare sopra la soluzione di precursore dell'idrogel.
- Aggiungere 50 μL di precursore dell'idrogel a un pozzo di una slitta a 2 pozzetti o una piastra a 6 pozzetti.
- Pipetta 10 μL di PBS su entrambi i lati di ciascuna cella di flusso.
- Utilizzare una lama di rasoio o una pinzetta a punta fine per distribuire il PBS lungo l'intera lunghezza della cella di flusso, quindi sollevare delicatamente i lati della cella di flusso in modo che il PBS si precipiti sotto l'idrogel.
NOTA: Questo "farà galleggiare" l'idrogel attraverso la diapositiva, consentendo il trasferimento senza distorsioni o strappi. - Utilizzare una lama di rasoio per spostare delicatamente la cella di flusso sul bordo della diapositiva di vetro.
- Invertire la diapositiva. Con la lama del rasoio, spingere la cella di flusso fuori dalla diapositiva in modo che atterri sopra la lama del rasoio.
- Prelevare la cella di flusso dalla lama del rasoio utilizzando una pinca curva. Invertire la cella di flusso in modo che le celle siano sul fondo, quindi posizionare sopra la goccia della soluzione precursore dell'idrogel.
- Ripetere i passaggi da 7.4.1 a 7.4.6 per ogni cella di flusso.
- Incubare per almeno 30 minuti in modo che l'idrogel contenente le cellule modellate possa legarsi al sottofondo dell'idrogel, con conseguente incorporamento completo delle cellule modellate.
- Rimuovere la cella di flusso PDMS.
- Aggiungere un numero sufficiente di supporti per immergere la cella di flusso PDMS.
NOTA: l'afflusso di fluidi allenterà l'adesione tra l'idrogel e la cella di flusso PDMS. - Utilizzate una pinzetta curva, orientata lungo l'asse lungo della cella di flusso, per spingere delicatamente la cella di flusso fino a quando non si stacca e fluttua nel supporto. Raccogliere la cella di flusso con una pinpetta e scartare.
NOTA: per risultati ottimali, stendere la pinna curva e applicare una leggera pressione sulle pareti della cella di flusso PDMS. Applicare la forza nella direzione dell'asse lungo della cella di flusso.
- Aggiungere un numero sufficiente di supporti per immergere la cella di flusso PDMS.
8. Confermare l'etichettatura corretta delle celle con CMO (facoltativo, per la risoluzione dei problemi)
- Ordinare un oligonucleotide modificato fluorescentemente (FAM o AF647) che sia complementare alla sequenza di adesione superficiale dello strand adattatore utilizzato nell'esperimento.
- Etichettare le cellule con DNA CMO e lavare via il DNA in eccesso come descritto nella fase 5. Spese in 200 μL di PBS ghiacciato.
- Costituiscono una soluzione di 4 μM dell'oligonucleotide complementare marcato fluorescentemente in PBS. Aggiungere 200 μL di questa soluzione alla sospensione cellulare. Incubare su ghiaccio per 5 min.
- Aggiungere 1 mL di PBS ghiacciato. Mescolare. Centrifugare le celle per pellettarle. Rimuovere il surnatante. Ripeti questo processo altre due volte per lavare via il DNA che non si è ibridato.
- Eseguire la citometria analitica a flusso per quantificare la presenza di DNA sulla superficie cellulare.
- Su un citometro a flusso, analizzare le cellule di controllo che non sono state etichettate con il DNA. Imposta cancelli in base a questa popolazione.
- Analizzare le cellule marcate con CMO che sono state trattate con un oligonucleotide complementare marcato fluorescentemente.
- Calcola l'intensità media della fluorescenza.
Risultati
Questo protocollo consente di modellare le celle in 2D e 3D con alta precisione e senza l'uso di reagenti personalizzati o costose attrezzature per camere bianche. Nella Figura 1 viene illustrata una panoramica del protocollo. In primo luogo, le diapositive funzionalizzate al DNA vengono create attraverso la fotolitografia. Successivamente, le celle sono etichettate con CMO. Le cellule vengono quindi fluite sul vetrino, dove si attaccano solo alle regioni funzionalizzate del DNA del vetrino. Dopo che le cellule in eccesso sono state lavate via, viene rivelato il modello desiderato di cellule. Queste cellule possono essere coltivate sul vetrino o incorporate in un idrogel contenente DNasi e trasferite fuori dal vetrino per la coltura cellulare 3D.
L'etichettatura delle cellule con CMO consente il loro attaccamento al vetrino modellato sul DNA (Figura 2). Innanzitutto, l'Universal Anchor Strand modificato per il colesterolo è pre-ibridato con l'Adapter Strand. Successivamente, la soluzione Universal Anchor + Adapter viene miscelata 1:1 con la sospensione cellulare. Il colesterolo sul complesso Universal Anchor + Adapter si inserisce nella membrana cellulare. L'aggiunta dell'Universal Co-Anchor Strand modificato per il colesterolo, che si ibrida con l'Universal Anchor Strand, migliora la stabilità del complesso CMO nella membrana cellulare aumentando l'idrofobicità netta del complesso26. Dopo aver lavato il DNA in eccesso dalla sospensione cellulare, le cellule vengono portate sul vetrino. L'ibridazione tra il filamento adattatore e il filamento di DNA di superficie provoca l'attaccamento delle cellule alle regioni modellate dal DNA del vetrino.
Il modello delle cellule viene creato utilizzando la fotolitografia per limitare l'attaccamento di oligos di DNA amminico modificato a regioni specifiche di un vetrino modificato con aldeide29 (Figura 3A). Il fotoresist positivo è rivestito di spin su una diapositiva funzionalizzata all'aldeide. Una fotomaschera trasparente viene quindi posizionata sopra la diapositiva e la diapositiva viene esposta alla luce UV. Dopo lo sviluppo, le regioni del vetrino che sono state esposte alla luce UV non sono più rivestite di fotoresist e quindi hanno esposto gruppi di aldeidi. Una soluzione di 20 μM di oligos di DNA amminico-modificato viene quindi lasciata cadere sul vetrino e diffusa per coprire le regioni modellate. La cottura seguita da un'aminazione riduttiva provoca un legame covalente tra il DNA amminico modificato e il vetrino. Sorprendentemente, questo processo può essere ripetuto per modellare più oligo senza alcuna perdita di funzionalità degli oligo precedentemente modellati (Figura 3B). Tuttavia, è necessario prestare attenzione per evitare modelli sovrapposti, il che si traduce nella presenza di entrambi gli oligo a una concentrazione ridotta (Figura supplementare 3). Più popolazioni di cellule possono essere modellate in sequenza utilizzando filamenti adattatore che differiscono nel loro dominio modulare (le 20 basi più vicine all'estremità 3').
Sebbene questo protocollo di fotopatterning sia stato sviluppato da Scheideler et al. nel contesto di una camera bianca, abbiamo dimostrato che è possibile ottenere risultati simili con una configurazione fotolitografica economica e "casalinga" che si adatta facilmente all'interno di una cappa chimica. La configurazione include una spin coater da $ 400 fatta di un motore DC, controller digitale e scatola per torte CD, nonché una lampada UV che è stata assemblata da singoli componenti e alloggiata in un contenitore di taglienti riproposto (Figura supplementare 1). Il vantaggio principale della configurazione della fotolitografia casalinga è che è molto conveniente (< $ 1000 per tutte le apparecchiature) pur essendo in grado di creare funzionalità di dimensioni a cella singola. Tuttavia, l'uso di apparecchiature economiche ha i suoi limiti: ad esempio, è più difficile allineare con precisione i marcatori fiduciali per modellare più oligo del DNA senza l'uso di un allineatore di maschere. Raccomandiamo questa configurazione di fotolitografia economica per i laboratori che non hanno un comodo accesso a una camera bianca o che vogliono provare questo metodo senza un grande investimento.
Per identificare le condizioni ottimali per l'adesione cellulare programmata dal DNA, abbiamo sistematicamente variato le concentrazioni di filamenti di DNA sulle superfici cellulari e misurato l'efficienza dell'adesione cellulare alle superfici di vetro modificate dal DNA. La concentrazione di Universal Anchor + Adapter Strand e Universal Co-Anchor nelle soluzioni di etichettatura è stata variata su diversi ordini di grandezza (Figura 4A,B), risultando in 104 -10 6 complessi di DNA per cellula (Figura supplementare 4). L'adesione cellulare era dose-dipendente, con un'adesione cellulare minima al modello di DNA quando le cellule erano etichettate con CMO a una concentrazione di 0,05 μM o inferiore e un'elevata occupazione a una concentrazione di 2,5 μM e superiore. Pertanto, abbiamo utilizzato una soluzione da 2 μM di Universal Anchor + Adapter Strand e una soluzione da 2 μM di Universal Co-Anchor nella maggior parte degli esperimenti. Ci si aspetterebbe anche che l'adesione cellulare diminuisca se la quantità di DNA utilizzata sulla superficie del vetro diminuissedi 29 o se aumentassero le discrepanze tra il filamento adattatore e il filamento superficiale. Ulteriori informazioni sulla progettazione della sequenza Adapter Strand sono disponibili nel file supplementare 2. L'etichettatura CMO utilizzando filamenti adattatori senza ripetizioni CpG non ha stimolato TLR9 nelle cellule HEK che esprimono TLR9 del topo ( Figurasupplementare 5).
Forniamo diverse dimostrazioni che il protocollo rivisto fornisce un'adesione cellulare programmata dna riproducibile ed efficiente. Ad esempio, le cellule endoteliali della vena ombelicale umana (HUVEC) etichettate con CMO hanno aderito ai modelli di DNA con alta efficienza. HURC con etichetta CMO e HUVEC con etichetta LMO (Figura 5A). Le celle modellate utilizzando CMO-DPAC hanno mantenuto la loro vitalità e funzionalità. Le cellule etichettate con CMO sono state colorate con calceina AM e omodimero di etidio per valutare la vitalità (Figura supplementare 6). Le differenze nella vitalità rispetto alle cellule di controllo non etichettate erano piccole (94% vs 97%). I singoli HDDC modellati tramite CMO-DPAC e trasferiti in Matrigel sono stati in grado di proliferare e polarizzare correttamente dopo 5 giorni di coltura (Figura 5B). DPAC fornisce anche un mezzo per elaborare modelli di celle nella terza dimensione (Figura 5C). Ad esempio, gli aggregati multistrato e multicellulari possono essere creati alternando strati di cellule etichettate con CMO complementari (Figura 5C). Questi esperimenti dimostrano che il protocollo è riproducibile, non influisce negativamente sulla vitalità o funzionalità cellulare e produce modelli cellulari che possono essere coltivati con successo all'interno di un singolo piano di imaging in un ECM 3D.
Fornendo sequenze di DNA ortogonali per dirigere l'adesione cellulare, DPAC fornisce un mezzo per modellare più tipi di cellule su una singola superficie. Per implementare questa caratteristica del DPAC, i modelli di DNA generati dalla fotolitografia devono essere allineati l'uno rispetto all'altro. I marcatori fiduciari metallici depositati sulla diapositiva hanno permesso l'allineamento di più fotomaschere e quindi la modellazione di più tipi di cellule contemporaneamente. Gli MCF10A colorati con diversi coloranti unici sono stati etichettati con CMO ortogonali e modellati per creare una visualizzazione dei loghi UC Berkeley e UCSF (Figura 6). Questo esperimento dimostra che più popolazioni cellulari uniche possono essere modellate insieme con alta precisione e senza contaminazione incrociata.
Il successo della modellazione delle cellule utilizzando CMO-DPAC richiede fotolitografia di alta qualità, sufficiente concentrazione di oligo sulla superficie cellulare, un'alta densità di cellule sul modello e un lavaggio sufficiente. Il fallimento di uno qualsiasi di questi passaggi influisce sul risultato finale. La Figura 2 supplementare include immagini di esempio di fotolitografia corretta e scorretta (Figura supplementare 2A), la densità cellulare desiderata sul modello per creare modelli completamente occupati (Figura supplementare 2B), la perdita di cellule modellate a causa di pipettaggio eccessivamente vigoroso durante le fasi successive di DPAC (Figura supplementare 2C) e aggregazione indesiderata di cellule (Figura supplementare 2D). La tabella 1 include un elenco di punti di errore comuni e la risoluzione dei problemi suggerita. L'uso di oligos complementari fluorescenti è raccomandato come strumento per la risoluzione dei problemi per confermare la presenza di DNA modellato sul vetrino e la presenza di CMO sulla superficie cellulare mediante citometria a flusso (vedere la fase 8 del protocollo).
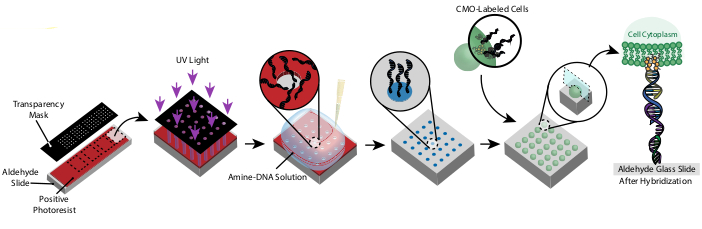
Figura 1: Panoramica del protocollo CMO-DPAC. In primo luogo, un vetrino con motivi a DNA viene creato rivestendo un vetrino funzionalizzato con aldeide con un fotoresist positivo, coprendolo con una maschera di trasparenza nel modello desiderato ed esponendolo alla luce UV. Il fotoresist esposto ai raggi UV viene lavato via con lo sviluppatore, lasciando le regioni esposte del vetrino di aldeide e consentendo il legame del DNA funzionalizzato amminico alla superficie. Le celle vengono quindi etichettate con CMO e fluiscono sulla superficie. Il DNA sulla membrana cellulare si ibrida con il DNA sulla superficie, con conseguente adesione. Fare clic qui per visualizzare una versione più grande di questa figura.
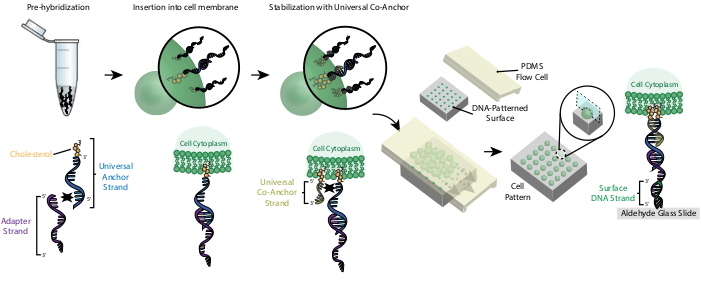
Figura 2: Le celle sono etichettate con CMO in un processo graduale. Innanzitutto, l'Universal Anchor Strand modificato per il colesterolo è pre-ibridato con l'Adapter Strand. Successivamente, la soluzione Universal Anchor + Adapter viene miscelata con la sospensione cellulare. Il colesterolo sul complesso Universal Anchor + Adapter si inserisce nella membrana cellulare. Dopo l'incubazione, l'Universal Co-Anchor Strand modificato per il colesterolo viene aggiunto alla sospensione cellulare, dove si ibrida con l'Universal Anchor Strand e si inserisce nella membrana cellulare. L'aggiunta della seconda molecola di colesterolo aumenta l'idrofobicità netta del complesso del DNA e la stabilizza all'interno della membrana26. Dopo aver lavato via il DNA in eccesso, le cellule vengono concentrate e aggiunte a una cella di flusso PDMS sulla superficie modellata. L'estremità 3' dell'Adapter Strand si ibrida con il Surface DNA Strand sul vetrino, con conseguente adesione al vetrino in particolare in regioni funzionalizzate con DNA complementare. Fare clic qui per visualizzare una versione più grande di questa figura.
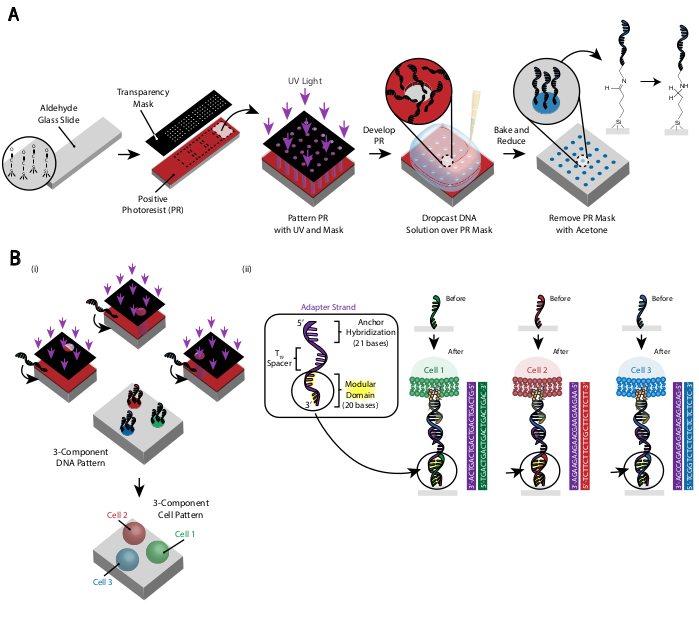
Figura 3: La fotolitografia viene utilizzata per creare le diapositive modellate sul DNA che alla fine determineranno il posizionamento delle cellule. (A) Panoramica del processo di fotolitografia. Un vetrino funzionalizzato con aldeide è rivestito con un fotoresist positivo. La luce UV brilla sulla diapositiva attraverso una fotomaschera trasparente che è trasparente dove si desidera l'adesione cellulare. Dopo che la diapositiva è stata sviluppata, le regioni che erano precedentemente esposte alla luce UV ora hanno esposto gruppi di aldeidi. Una soluzione di 20 μM di un oligo DNA funzionalizzato dalle ammine viene quindi lasciata cadere sul vetrino e distribuita sulle regioni modellate. Il vetrino viene quindi cotto per indurre la formazione di legami di Schiff (C=N) tra i gruppi ammina e aldeide, un legame covalente reversibile29. La successiva aminazione riduttiva con boroidrato di sodio allo 0,25% in PBS converte la base di Schiff in un'ammina secondaria mediante aminazione riduttiva, con conseguente legame irreversibile tra il DNA e il vetrino. Il fotoresist rimanente può quindi essere rimosso risciacquando con acetone. (B) Questo processo può essere ripetuto per creare modelli di DNA multicomponente e quindi eseguire esperimenti con più popolazioni cellulari. (i) Dopo che il primo oligo è modellato, il vetrino viene nuovamente rivestito in photoresist e il protocollo procede come prima. L'allineamento delle fotomaschere utilizzando marcatori fiduciari è necessario per modellare più filamenti di DNA. (ii) Ogni tipo di cella modellata differisce nel dominio modulare a 20 basi del filamento adattatore. Utilizzando insiemi ortogonali di oligo complementari, è possibile modellare più tipi di cellule senza adesione incrociata. Fare clic qui per visualizzare una versione più grande di questa figura.
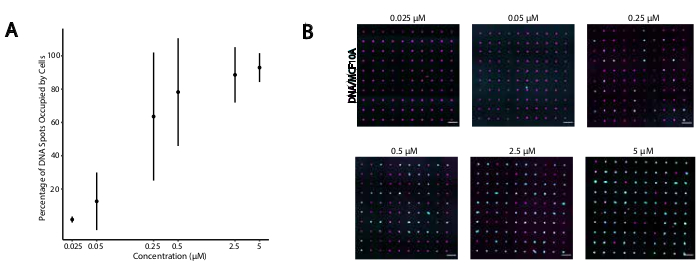
Figura 4: L'adesione delle cellule etichettate con CMO ai modelli di DNA aumenta in funzione della concentrazione di CMO durante l'etichettatura. In questo esperimento, l'Universal Anchor + Adapter Strand (pre-ibridato) e l'Universal Co-Anchor sono stati utilizzati a concentrazioni uguali. La concentrazione si riferisce alla concentrazione di CMO nella sospensione cellulare durante l'etichettatura CMO delle cellule. (A) Quantificazione della percentuale di macchie di DNA di 15 μm di diametro occupate da cellule MCF10A etichettate come CMO in funzione della concentrazione di CMO durante l'etichettatura cellulare. Dati rappresentati come la media ± deviazione standard da tre esperimenti. (B) Immagini rappresentative dei modelli di DNA (magenta) e MCF10As aderenti (ciano) a diverse concentrazioni di CMO. Barra della scala = 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
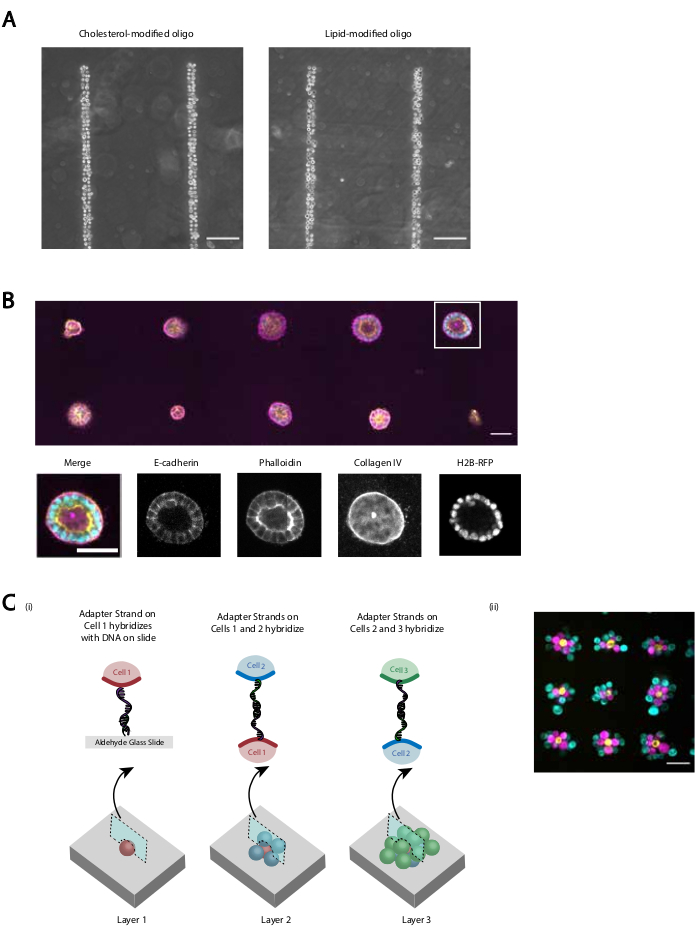
Figura 5: CMO-DPAC può essere utilizzato per creare modelli cellulari bidimensionali che possono successivamente essere incorporati in un idrogel tridimensionale per la coltura e/ o stratificati per creare strutture multistrato. (A) Il confronto diretto tra le cellule endoteliali della vena ombelicale umana (HUVEC) etichettate con CMO e le HUVEC etichettate con LMO ha aderito a un modello di DNA lineare. Entrambi i metodi di etichettatura cellulare si traducono in quasi il 100% di occupazione del modello di DNA. (B) Le singole cellule renali canine di Madin-Darby (MDCK) che esprimono H2B-RFP sono state modellate su punti di diametro 15 μm distanziati di 200 μm e successivamente incorporati in Matrigel. Dopo 120 ore di coltura, le cisti epiteliali risultanti sono state fissate e colorate per E-caderina, actina e collagene IV. Lo sferoide nella scatola bianca è mostrato in dettaglio. Barra di scala = 50 μm. (C) Le strutture cellulari multistrato possono essere create etichettando popolazioni cellulari separate con filamenti adattatori complementari e modellate sequenzialmente in modo che ogni nuova aggiunta di cellule aderisca allo strato cellulare prima di esso. (i) Schema del pattern sequenziale delle popolazioni cellulari per creare strutture multistrato. (ii) Aggregati cellulari a tre strati di MCF10A (visualizzati utilizzando coloranti) sono stati creati utilizzando questo processo. Barra della scala = 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: È possibile modellare più tipi di cellule senza contaminazione incrociata o perdita di adesione. Più oligo di DNA modificati da ammine sono stati modellati sequenzialmente su un vetrino di aldeide e allineati attraverso l'uso di marcatori fiduciari metallici. Tre popolazioni di MCF10A (ciano, magenta, giallo) sono state colorate con coloranti unici etichettati con CMO complementari e modellate sul vetrino, risultando in un'immagine dei loghi UC Berkeley e UCSF. Barra della scala 1 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura supplementare 1: Immagini di esempio della configurazione della fotolitografia da banco. (A) Slide on spin coater, coperto con fotoresist positivo, prima del rivestimento di spin. (B) Immagine di fotomaschera trasparente. (C) Durante l'esposizione, la fotomaschera è inserita tra il vetrino rivestito di fotoresiste e un disco di vetro. (D) L'alloggiamento per la lampada UV è stato ricavato da un contenitore di oggetti taglienti riproposto. (E) Slide immerso nella soluzione per sviluppatori. (F) Diapositiva sviluppata. (G) Soluzione di DNA amminico-modificato diffusa su regioni modellate del vetrino. (H) Celle di flusso PDMS posizionate sopra le regioni modellate della diapositiva. Fare clic qui per scaricare questo file.
Figura supplementare 2: Alcuni esempi di errori comuni di questo protocollo. (A) (i) La sotto-cottura prima dell'esposizione ai raggi UV o le caratteristiche di sviluppo eccessivo post-esposizione possono causare caratteristiche che hanno bordi frastagliati e possono essere di dimensioni irregolari. (ii) Un esempio di diapositiva correttamente fotopatterata che ha bordi puliti intorno alle feature, dimensioni uniformi della feature e nessuna evidente crepa nel pattern. Barra di scala = 50 μm. (B) La densità delle celle è fondamentale per l'efficienza del patterning. Quando si osservano le cellule sopra il modello al microscopio, dovrebbero esistere pochi spazi tra le cellule, come evidenziato dall'immagine di esempio a sinistra. Barra della scala = 50 μm. (C) Le cellule modellate possono essere sensibili alle forze fluide derivanti da un pipettaggio eccessivamente vigoroso, che può danneggiare e rimuovere le cellule modellate. Gli aggregati di cellule multistrato sono particolarmente vulnerabili, poiché una cella nella parte inferiore supporta una struttura di più celle. (i) Una matrice di aggregati cellulari incorporati con successo in Matrigel. (ii) Una griglia di aggregati cellulari che si sono spostati a seguito del pipettaggio troppo vigoroso di Matrigel viscoso. (D) Può verificarsi l'aggregazione delle cellule, in particolare con le cellule epiteliali. Questi grumi sono di solito omotipici ma possono essere eterotipici (cellule aderenti a cellule già modellate di un tipo diverso) se le cellule sono particolarmente appiccicose. L'immagine mostra che tre diverse popolazioni di MCF10A sono state modellate su un array composto da tre diverse macchie di DNA di dimensioni monocellulari (15 μm). La maggior parte delle macchie di DNA ha 2-4 cellule attaccate. L'aggregazione può essere risolta mediante trattamento EDTA o filtrando i grumi prima della modellata. Barra della scala = 100 μm. Fare clic qui per scaricare questo file.
Figura supplementare 3: La sovrapposizione di fotopattern provoca la presenza di entrambi gli oligo a concentrazione ridotta. Due oligo ortogonali ammine-modificati sono stati fotopatterati in sequenza, prima una linea verticale (Strand 1), seguita da una linea orizzontale che si sovrapponeva (Strand 2). Gli oligo sono stati poi visualizzati per ibridazione con oligo complementari fluorescenti. (A) Immagine di fluorescenza del punto 1. (B) Quantificazione del profilo di fluorescenza dello strand 1 su una linea verticale di 100 μm che attraversa la sovrapposizione. (C) Immagine di fluorescenza del punto 2. (D) Quantificazione del profilo di fluorescenza dello strand 2 su una linea orizzontale di 100 μm che attraversa la sovrapposizione. Barra della scala = 50 μm. Fare clic qui per scaricare questo file.
Figura supplementare 4: Quantificazione dei complessi di DNA sulla superficie cellulare in funzione della concentrazione di etichettatura CMO. Gli HUVEC sono stati etichettati con diverse concentrazioni di soluzione cmO, lavati e quindi incubati con un filamento complementare fluorescente. Un kit di microsfere MESF (Molecules of Equivalent Soluble Fluorochrome) è stato utilizzato per eseguire la citometria a flusso quantitativa e stimare il numero di complessi di DNA sulla superficie cellulare in funzione della concentrazione di CMO durante l'etichettatura. Fare clic qui per scaricare questo file.
Figura 5 supplementare: L'etichettatura CMO non stimola la risposta TLR9. È stato condotto un esperimento per vedere se l'etichettatura CMO avrebbe innescato il meccanismo di rilevamento del DNA di TLR9 e se questo sarebbe stato influenzato dai CpG nella sequenza Adapter Strand. Le cellule HEK che esprimono TLR9 di topo sono state incubate durante la notte con 0,2 μM di ODN 1826 (un agonista TLR9 contenente CpG), CMO Universal Anchor + Universal Co-Anchor + Adapter Strand contenente la stessa sequenza di ODN 1826 (CMO-CpG), o CMO Universal Anchor + Universal Co-Anchor + Adapter Strand contenente una sequenza simile ma con sostituzione dei CpG con GpC (CMO-GpC). La stimolazione TLR9 comporterebbe la produzione di SEAP (fosfatasi alcalina embrionale secreta). La secrezione PAES è stata quantificata mediante un saggio colorimetrico (assorbanza). Le condizioni di trattamento sono state confrontate con le cellule a riposo che sono state trattate solo con PBS. L'incubazione con CMO-GPC non ha stimolato l'espressione di TLR9. L'incubazione con CMO-CpG era leggermente superiore a quella delle cellule a riposo, ma molto inferiore a ODN-1826. Fare clic qui per scaricare questo file.
Figura supplementare 6: Vitalità delle cellule dopo il processo di etichettatura CMO. Per valutare in che modo il protocollo influisce sulla vitalità, gli HUVEC sono stati suddivisi in quattro popolazioni: una è rimasta sul ghiaccio per 1 ora, una è stata finta etichettata con PBS ma altrimenti portata attraverso tutte le fasi di centrifuga e lavaggio, una è stata etichettata con CMO e una è stata etichettata con CMO e filtrata attraverso un filtro da 40 μm per rimuovere i grumi. Le cellule sono state poi colorate con calceina AM e omodimero etidio per valutare il numero di cellule vive e morte. Tutti i trattamenti hanno determinato una significativa riduzione della vitalità rispetto al controllo del ghiaccio (ANOVA uniodo con analisi post-hoc Tukey), ma la vitalità mediana per l'etichettatura CMO (con o senza filtraggio) è stata di circa il 94%. Dati raccolti da tre esperimenti indipendenti. * = p < 0,05. = p < 0.0001 Per scaricare questo file clicca qui.
| Risultato | Possibili cause | Correzioni suggerite |
| Fotolitografia: le caratteristiche sono incrinate | Incoerenza o inadeguata cottura morbida | Aumentare il tempo di cottura morbida fino a 3 minuti; verificare la temperatura effettiva della piastra elettrica e aumentare la temperatura se necessario |
| Fotolitografia: le caratteristiche non sono nitide o hanno il fotoresist che rimane al loro interno | Sottososrediso | Aumentare il tempo che la diapositiva trascorre nella soluzione per sviluppatori; incorporare un'agitazione delicata |
| Fotolitografia: caratteristiche incoerenti tra le diapositive | La luce UV potrebbe non essere centrata o non focalizzata correttamente | Regolare la configurazione della luce UV per garantire una luce collimata di intensità uniforme |
| Le cellule non aderiscono ai punti modellati con alta efficienza | Non abbastanza DNA in superficie | Confermare che il DNA è presente in superficie ibridando il vetrino con oligos complementari fluorescenti e quindi l'imaging al microscopio |
| Le cellule non sono adeguatamente etichettate con CMO | Aggiungere oligos complementari fluorescenti alla sospensione cellulare e confermare la fluorescenza tramite citometria a flusso | |
| Non abbastanza celle sul modello | Raccogliere le cellule lavando fuori dalla cella di flusso PDMS, centrifugare e ri-sospendere in volume inferiore per concentrare le cellule | |
| Troppo CMO rimanente in sospensione cellulare, ibridandosi con il DNA su vetrino | Aggiungi un altro passaggio di lavaggio. Assicurati di rimuovere il maggior numero possibile di surnatante ad ogni lavaggio. | |
| Troppa internalizzazione del CMO a causa del tempo e della temperatura | Lavorare rapidamente dopo aver etichettato le celle con CMO; mantenere le cellule e scivolare sul ghiaccio e utilizzare reagenti ghiacciati | |
| Grumo di cellule | Le cellule non sono state adeguatamente separate durante la tripsinizzazione | Utilizzare PBS + 0,04% EDTA durante i lavaggi cellulari; far passare la sospensione cellulare attraverso il filtro da 35 μm prima del lavaggio finale |
| Le cellule aderiscono in modo non specifico | Se in un'area specifica - potrebbe essere dovuto a graffi sul vetrino, disallineamento delle cellule di flusso PDMS o fuoriuscita di DNA al di fuori della regione del modello | Evitare graffi, fare attenzione ad allineare le celle di flusso PDMS alla regione del modello |
| Se le cellule aderiscono ovunque – blocco o lavaggio inadeguati | Aggiungere altri lavaggi dopo aver modellato le celle; pipettare più vigorosamente durante i lavaggi; blocco con BSA all'1% più a lungo prima di iniziare il pattern cellulare; silanizzare il vetrino (passaggio opzionale 3) o confermare che la silanizzazione ha avuto successo misurando l'angolo di contatto della goccia d'acqua | |
| Le bolle si formano all'interno della cella di flusso | Errori di pipettaggio, superficie idrofila irregolare creata durante l'ossidazione del plasma | Se le bolle sono piccole, aggiungere PBS all'ingresso della cella di flusso e potrebbero essere lavate via. Se le bolle sono più grandi, applicare una leggera pressione sulla cella di flusso PDMS, spingendo le bolle verso l'ingresso o l'uscita. |
| Le cellule inizialmente aderiscono al modello, ma vengono rimosse durante i lavaggi, il patterning di altri tipi di cellule o l'aggiunta del precursore dell'idrogel | Le forze di taglio derivanti dal pipettaggio troppo vigoroso possono causare il distacco delle cellule dalla superficie | Pipettare più delicatamente durante i lavaggi successivi, i cicli di pattern cellulare o l'aggiunta di precursori dell'idrogel. Poiché i precursori dell'idrogel sono viscosi, è più probabile che causino lo spostamento del modello, quindi fai molta attenzione. Le strutture multistrato tendono ad essere pesanti e sono più suscettibili di essere spostate. |
| Deformazioni tissutali durante il trasferimento 3D | Bastoncini di idrogel per scivolare | Confermare l'idrofobicità del vetrino utilizzando le misurazioni dell'angolo di contatto |
| Usa la lama del rasoio per sollevare completamente il PDMS su entrambi i bordi, consentendo al PBS di galleggiare sotto il tessuto | ||
| Questo può accadere con idrogel di collagene puro - considera di regolare la concentrazione proteica o la composizione dell'idrogel | ||
| Le cellule non si trasferiscono con l'idrogel e rimangono sul vetrino | Aumentare la concentrazione di Turbo DNAse o aumentare il tempo di incubazione | |
| L'idrogel non è abbastanza solido | Aumentare il tempo di incubazione e/o il meccanismo di gelificazione per l'idrogel in questione (ad es. per il collagene, assicurarsi che il pH sia corretto) | |
| Lacrime di idrogel dopo la rimozione di PDMS | Rendi idrofile le cellule di flusso PDMS usando l'ossidazione al plasma prima di iniziare l'esperimento in modo che si stacchino facilmente dopo l'aggiunta di mezzi. Utilizzare una pincitta molto delicatamente per staccare il PDMS. |
Tabella 1: Guida alla risoluzione dei problemi per identificare e risolvere potenziali errori che possono derivare da questo protocollo. In particolare, la scarsa adesione delle cellule al modello può avere molte cause alla radice e questa guida dovrebbe aiutare con l'identificazione e la risoluzione di tali problemi.
File supplementare 1. Fare clic qui per scaricare questo file.
File supplementare 2. Fare clic qui per scaricare questo file.
File supplementare 3. Fare clic qui per scaricare questo file.
File supplementare 4. Fare clic qui per scaricare questo file.
Discussione
In questo articolo, presentiamo un protocollo dettagliato per la modellazione ad alta risoluzione delle cellule in 2D e 3D per esperimenti di coltura cellulare in vitro. A differenza delle versioni precedentemente pubblicate di questo metodo, il protocollo qui presentato si concentra sull'usabilità: non richiede apparecchiature altamente specializzate e tutti i reagenti possono essere acquistati dai fornitori invece di richiedere una sintesi personalizzata. A differenza di altri metodi di micropatterning cellulare, questo metodo è rapido e agnostico di tipo cellulare: non richiede un'adesione specifica alle proteine della matrice extracellulare15. Le cellule modellate da CMO-DPAC possono essere incorporate all'interno di una matrice extracellulare come Matrigel o collagene, risultando in colture 3D con una risoluzione spaziale molto più elevata di quella attualmente possibile con i metodi basati sulla stampa di estrusione22. CMO-DPAC può essere utilizzato per creare da centinaia a migliaia di feature microscopiche per diapositiva, consentendo di eseguire molte repliche contemporaneamente.
Uno dei parametri più importanti per il successo di questo protocollo è la densità delle celle aggiunte alle celle di flusso sopra la diapositiva modellata. Idealmente, la densità dovrebbe essere di almeno 25 milioni di cellule / ml. Quando viene caricata nelle celle di flusso, questa densità di celle si traduce in un monostrato di celle quasi ravvicinato al di sopra del modello (Figura supplementare 2B). Queste alte densità cellulari massimizzano la probabilità che una cellula si depositi direttamente sopra un punto del DNA e aderisca. La riduzione della densità della cella diminuirà l'efficienza complessiva del patterning. Un altro passo critico in questo protocollo è la sospensione completa delle cellule in PBS o mezzi privi di siero prima di aggiungere la soluzione CMO. Le CMO si dividono molto rapidamente in membrane cellulari e l'aggiunta della soluzione CMO direttamente a un pellet cellulare comporterà un'etichettatura eterogenea delle cellule. Dopo aver aggiunto la soluzione CMO alla sospensione cellulare, è importante miscelare accuratamente mediante pipettaggio in modo che le cellule siano etichettate uniformemente con le CMO. Dopo le incubazioni, è necessario lavare accuratamente le CMO in eccesso attraverso più centrifugazione e fasi di lavaggio. L'eccesso di CMO libero presente nella sospensione cellulare si legherà al DNA modificato dall'ammina modellato sul vetrino, bloccando l'ibridazione e l'adesione delle cellule modificate dall'OCM in sospensione. Anche il tempo è una considerazione chiave per questo protocollo. È importante lavorare il più rapidamente possibile quando si utilizzano CMO e mantenere le cellule sul ghiaccio al fine di ridurre al minimo l'internalizzazione delle CMO e massimizzare la vitalità cellulare. Esperimenti di citometria a flusso hanno dimostrato che le CMO non persistono sulla superficie cellulare tanto a lungo quanto le LMO, con una perdita del 25% di complessi CMO in due ore di incubazione sul ghiaccio36. Inoltre, la vitalità delle cellule diminuirà con l'aumentare del tempo di gestione delle cellule. La vitalità può essere massimizzata lavorando rapidamente, mantenendo le cellule sul ghiaccio, usando reagenti ghiacciati e utilizzando mezzi privi di siero per fornire alcuni nutrienti.
Sebbene CMO-DPAC possa essere un modo potente per studiare la biologia cellulare modellato le cellule con alta precisione, ha i suoi limiti. Gli esperimenti CMO-DPAC possono essere impegnativi, in particolare perché la complessità sperimentale viene aggiunta con più tipi di cellule, strati o colture cellulari 3D (File supplementare 1). I fallimenti sperimentali possono essere comuni all'avvio di questo protocollo, come descritto nella Tabella 1. Pertanto, raccomandiamo agli utenti di istituire controlli di qualità (confermando che il DNA è presente sul vetrino, confermando che le cellule sono sufficientemente etichettate con dna (Fase 8), confermando che le cellule in eccesso sono state accuratamente lavate via, ecc.) per assicurarsi che l'esperimento abbia successo e per identificare i passaggi che potrebbero richiedere un'ulteriore ottimizzazione. Ci auguriamo che le informazioni fornite in questo manoscritto e nei suoi file supplementari contribuiscano a facilitare qualsiasi risoluzione dei problemi richiesta.
Il colesterolo è una molecola bioattiva la cui internalizzazione può influenzare il metabolismo cellulare, l'espressione genica e la fluidità della membrana37,38. Uno studio precedente ha confrontato gli effetti sull'espressione genica delle cellule etichettate CMO e LMO utilizzando il sequenziamento dell'RNA a singola cellula. Le cellule HEK etichettate con CMO avevano alterato l'espressione genica rispetto alle cellule non etichettate eLMO-labeled 36. L'etichettatura delle cellule con CMO ha determinato l'espressione differenziale (> 1,5 volte) di otto geni rispetto a controlli non etichettati, tra cui AP2B1, che è stato collegato al trasporto di colesterolo e sfingolipidi (GeneCards), e MALAT1, un lungo RNA non codificante che regola l'accumulo di colesterolo39. Sebbene minori, queste risposte trascrizionali possono comunque essere preoccupanti se l'esperimento in questione sta studiando il metabolismo, la dinamica della membrana o altri percorsi associati al colesterolo nelle cellule.
Questo protocollo è flessibile e può essere regolato per soddisfare le esigenze di ogni esperimento. Poiché il CMO si inserisce nella membrana lipidica invece di utilizzare un recettore specifico, il metodo è indipendente dal tipo cellulare (HUVECs, MCF10As, HEKs e MDCK sono stati dimostrati qui). Sebbene il colesterolo sia un'ancora idrofobica diversa rispetto ai nostri LMO precedentemente pubblicati, finora abbiamo scoperto che si comportano in modo simile. Pertanto, ci aspetteremmo che i CMO funzionino con una qualsiasi delle ampie varietà di tipi di cellule che abbiamo precedentemente pubblicato con LMO, incluse ma non limitate a cellule staminali neurali, fibroblasti, cellule mononucleate del sangue periferico, cellule tumorali e cellule epiteliali mammarie primarie6,23,27,29,36 . L'etichettatura CMO non stimola TLR9, suggerendo che il protocollo è compatibile con le cellule immunitarie. L'incorporazione di membrana del CMO è una funzione della dimensione totale della cellula e del grado di carica negativa nel glicocalyxcellulare 35. Pertanto, abbiamo incluso un protocollo (Fase 8) per testare l'entità dell'incorporazione della membrana che è suscettibile di una rapida ottimizzazione. Le caratteristiche specifiche di ciascun modello cellulare varieranno inevitabilmente in base al disegno sperimentale (vedere il file supplementare 1 per ulteriori indicazioni). Sebbene sia raccomandato il protocollo di fotopatterning sopra descritto per modellare il DNA, qualsiasi metodo per confinare spazialmente le goccioline di soluzione ammina-DNA dovrebbe funzionare, come l'uso di stampanti a goccia ad alta risoluzione. La risoluzione della serie e la spaziatura minima delle feature variano in base al metodo utilizzato. È anche teoricamente possibile combinare le sezioni di fotopattering del DNA di questo protocollo con altri metodi che sono stati utilizzati per etichettare le cellule con DNA, come ad esempio con DNA ibridato a dita di zinco espresse a membrana40, utilizzando DNA41coniugato NHS e facendo reagire residui di acido azido sialico sulla superficie cellulare con DNA coniugato con fosfina42 . CMO-DPAC può essere applicato a una varietà di esperimenti che richiedono uno stretto controllo sulla spaziatura cellula-cellula, compresi studi sulle interazioni tra coppie di cellule, esperimenti di co-coltura che esaminano il trasferimento di segnali da cellule "mittenti" a cellule "riceventi" e indagini sull'effetto di segnali extracellulari vicini sulla differenziazione delle cellule staminali6,29 . Il metodo può anche essere utilizzato per creare microtissue che possono essere utilizzati per studiare la migrazione cellulare in tre dimensioni, l'auto-organizzazione delle cellule nei tessuti23,27e l'interazione dinamica tra le cellule e l'ECM27. Speriamo che questo protocollo fornisca ai ricercatori una piattaforma accessibile per esplorare nuove applicazioni di modellazione cellulare ad alta risoluzione basata sul DNA nei propri laboratori.
Divulgazioni
Z.J.G. è consulente e azionista in Provenance Biosciences.
Riconoscimenti
Gli autori desiderano ringraziare Jeremy Garcia per aver testato questo protocollo e Bhushan Kharbikar per aver fornito formazione sulle apparecchiature presso l'UCSF Biomedical Micro and Nanotechnology Core. Questa ricerca è stata supportata in parte da sovvenzioni del Programma di ricerca sul cancro al seno del Dipartimento della Difesa (W81XWH-10-1-1023 e W81XWH-13-1-0221), NIH (U01CA199315, DP2 HD080351-01, 1R01CA190843-01, 1R21EB019181-01A e 1R21CA182375-01A1), NSF (MCB1330864) e UCSF Center for Cellular Construction (DBI-1548297), un NSF Science and Technology Center. O.J.S è stato finanziato da una borsa di ricerca universitaria NSF, una borsa di studio Siebel e una borsa di studio P.E.O. Z.J.G e A.R.A. sono chan-Zuckerberg BioHub Investigators.
Materiali
| Name | Company | Catalog Number | Comments |
| 2-well Chambered Coverglass w/ non-removable wells | Thermo Fisher Scientific | 155379 | |
| Acetic Acid | Sigma-Aldrich | A6283 | |
| Adapter with External SM1 Threads and Internal SM3 Thread | ThorLabs | SM3A1 | |
| Aldehyde Functionalized Slides | Schott | Nexterion Slide AL | Store under dry conditions after opening. |
| All Plastic Syringes, 1 mL | Fisher Scientific | 14-817-25 | |
| Amine-Modified DNA Oligo | IDT | n/a | See Supplemental File 1 for suggested sequences. |
| Aspheric Condenser Lens | ThorLabs | ACL7560 | |
| Borosilicate Disc, 6in Diameter X 1/2in Thick | Chemglass | CG-1906-23 | |
| Cell Culture Dishes 60x15 mm style | Corning | 353002 | |
| Cholesterol-Modified Oligo | IDT | n/a | See Supplemental File 1 for suggested sequences. |
| Diamond Scribe | Excelta | 475B | |
| DNA Oligonucleotide | IDT | n/a | See Supplemental File 1 for suggested sequences. |
| DPBS, no calcium, no magnesium | Thermo Fisher Scientific | 14190250 | |
| Isopropyl Alcohol | Sigma-Aldrich | 278475 | |
| Matrigel Matrix, Growth Factor Reduced | Corning | 354230 | |
| Methylene Chloride (Stabilized/Certified ACS) | Fisher Scientific | D37-4 | |
| MF-321 Developer | Kayaku Advanced Materials | n/a | |
| Microposit S1813 Positive Photoresist | Kayaku Advanced Materials | n/a | |
| Ø3" Adjustable Lens Tube, 0.81" Travel | ThorLabs | SM3V10 | |
| Oven | Thermo Scientific | 51-028-112H | |
| PE-50 Compact Benchtop Plasma Cleaning System | Plasma Etch | PE-50 | |
| Photomask (custom) | CAD/Art Services | n/a | Minimum feature size guaranteed by CAD/Art Services is 10 microns. |
| Razor Blades | Fisher Scientific | 12-640 | |
| RCT Basic Hot Plate | IKA | 3810001 | |
| Silicon Wafer (100 mm) | University Wafer | 590 | |
| Sodium Borohydride, 98%, granules | Acros Organics | 419471000 | |
| Spin Coater Kit | Instras | SCK-200 | This is a low cost option, but any spin coater that can maintain a speed of 3000 rpm will suffice. |
| SU-8 2075 | Microchem | Y111074 0500L1GL | |
| SU-8 Developer | Microchem | Y020100 4000L1PE | |
| Sylgard 184 Silicone Elastomer Kit | Dow | 2646340 | |
| Syringe Needles | Sigma-Aldrich | Z192341 | |
| T-Cube LED Driver, 1200 mA Max Drive Current | ThorLabs | LEDD1B | |
| Tridecafluoro-1,1,2,2-tetrahydrooctyl dimethylchlorosilane | Gelest | SIT8170.0 | |
| Triethylamine | Sigma-Aldrich | 90335 | |
| Turbo DNase | Thermo Fisher Scientific | AM2238 | |
| Tweezers Style N7 | VWR | 100488-324 | The curved shape of these tweezers is essential for delicately picking up the PDMS flow cells containing patterned tissues. |
| UV LED (365 nm, 190 mW (Min) Mounted LED, 700 mA) | ThorLabs | M365L2 | |
| Wafer Tweezers | Agar Scientific | T5063 | |
| WHEATON Dry-Seal vacuum desiccator | Millipore Sigma | W365885 |
Riferimenti
- Kreeger, P. K., Strong, L. E., Masters, K. S. Engineering approaches to study cellular decision-making. Annual Review of Biomedical Engineering. , 49-72 (2018).
- Goubko, C. a., Cao, X. Patterning multiple cell types in co-cultures: A review. Materials Science and Engineering C. 29 (6), 1855 (2009).
- Sun, W., et al. The bioprinting roadmap. Biofabrication. 12 (2), 022002 (2020).
- Liu, W. F., Chen, C. S. Cellular and multicellular form and function. Advanced Drug Delivery Reviews. 59 (13), 1319-1328 (2007).
- Duffy, R. M., Sun, Y., Feinberg, A. W. Understanding the role of ECM protein composition and geometric micropatterning for engineering human skeletal muscle. Annals of Biomedical Engineering. 44 (6), 2076-2089 (2016).
- Chen, S., et al. Interrogating cellular fate decisions with high-throughput arrays of multiplexed cellular communities. Nature Communications. 7, 10309 (2016).
- Shaya, O., et al. Cell-cell contact area affects notch signaling and notch-dependent patterning. Developmental Cell. 40 (5), 505-511 (2017).
- Rao, N., et al. A co-culture device with a tunable stiffness to understand combinatorial cell-cell and cell-matrix interactions. Integrative Biology. 5 (11), 1344 (2013).
- Sriraghavan, V., Desai, R. A., Kwon, Y., Mrksich, M., Chen, C. S. Micropatterned dynamically adhesive substrates for cell migration. Langmuir. 26 (22), 17733-17738 (2010).
- Wong, L., Pegan, J. D., Gabela-Zuniga, B., Khine, M., McCloskey, K. E. Leaf-inspired microcontact printing vascular patterns. Biofabrication. 9 (2), 021001 (2017).
- Chen, T. H., et al. Directing tissue morphogenesis via self-assembly of vascular mesenchymal cells. Biomaterials. 33 (35), 9019-9026 (2012).
- Laurent, J., et al. Convergence of microengineering and cellular self-organization towards functional tissue manufacturing. Nature Biomedical Engineering. 1 (12), 939-956 (2017).
- Lin, C., Khetani, S. R. Micropatterned co-cultures of human hepatocytes and stromal cells for the assessment of drug clearance and drug-drug interactions. Current Protocols in Toxicology. 2017, 1-23 (2017).
- Hui, E. E., Bhatia, S. N. Micromechanical control of cell-cell interactions. Proceedings of the National Academy of Sciences of the United States of America. 104 (14), 5722-5726 (2007).
- D'Arcangelo, E., McGuigan, A. P. Micropatterning strategies to engineer controlled cell and tissue architecture in vitro. BioTechniques. 58 (1), 13-23 (2015).
- Martinez-Rivas, A., González-Quijano, G. K., Proa-Coronado, S., Séverac, C., Dague, E. Methods of micropatterning and manipulation of cells for biomedical applications. Micromachines. 8 (12), (2017).
- Lee, S., et al. Simple lithography-free single cell micropatterning using laser-cut stencils. Journal of Visualized Experiments. (158), e60888 (2020).
- Strale, P. O., et al. Multiprotein printing by light-induced molecular adsorption. Advanced Materials. 28 (10), 2024-2029 (2016).
- Melero, C., et al. Light-induced molecular adsorption of proteins using the primo system for micro-patterning to study cell responses to extracellular matrix proteins. Journal of Visualized Experiments. (152), e60092 (2019).
- Reid, J. A., Mollica, P. M., Bruno, R. D., Sachs, P. C. Consistent and reproducible cultures of large-scale 3D mammary epithelial structures using an accessible bioprinting platform. Breast Cancer Research. , 1-13 (2018).
- Wang, Z., Lee, S. J., Cheng, H. -. J., Yoo, J. J., Atala, A. 3D bioprinted functional and contractile cardiac tissue constructs. Acta Biomaterialia. 70, 48-56 (2018).
- Miri, A. K., et al. Effective bioprinting resolution in tissue model fabrication. Lab on a Chip. 19 (11), 2019-2037 (2019).
- Todhunter, M. E., et al. Programmed synthesis of three-dimensional tissues. Nature Methods. 12 (10), 975-981 (2015).
- Todhunter, M. E., Weber, R. J., Farlow, J., Jee, N. Y., Gartner, Z. J. Fabrication of 3D microtissue arrays by DNA programmed assembly of cells. Current Protocols in Chemical Biology. 8 (3), 147-178 (2016).
- Csizmar, C. M., Petersburg, J. R., Wagner, C. R. Programming cell-cell interactions through non-genetic membrane engineering. Cell Chemical Biology. 25 (8), 931-940 (2018).
- Weber, R. J., Liang, S. I., Selden, N. S., Desai, T. A., Gartner, Z. J. Efficient targeting of fatty-acid modified oligonucleotides to live cell membranes through stepwise assembly. Biomacromolecules. 15 (12), 4621-4626 (2014).
- Hughes, A. J., et al. Engineered tissue folding by mechanical compaction of the mesenchyme. Developmental Cell. 44 (2), 165-178 (2018).
- Weber, R. J., et al. Rapid organoid reconstitution by chemical micromolding. ACS Biomaterials Science & Engineering. 2 (11), 1851-1855 (2016).
- Scheideler, O. J., et al. Recapitulating complex biological signaling environments using a multiplexed, DNA-patterning approach. Science Advances. 6 (12), (2020).
- Viola, J. M., et al. Guiding cell network assembly using shape-morphing hydrogels. Advanced materials (Deerfield Beach, Fla.). , 2002195 (2020).
- Mohammad, A., Davis, M., Aprelev, A., Ferrone, F. A. Note: Professional grade microfluidics fabricated simply. Review of Scientific Instruments. 87 (10), 1-4 (2016).
- Lee, O. J., Chuah, H. S., Umar, R., Chen, S. K., Yusra, A. F. I. Construction of cost effective homebuilt spin coater for coating amylose-amylopectin thin films. Journal of Fundamental and Applied Sciences. 9 (2), 279 (2018).
- Webb, K., Hlady, V., Tresco, P. A. Relative importance of surface wettability and charged functional groups on NIH 3T3 fibroblast attachment, spreading, and cytoskeletal organization. Journal of Biomedical Materials Research. 41 (3), 422-430 (1998).
- Processing Guidelines for: SU-8 2025, SU-8 2035, SU-8 2050, SU-8 2075. Microchem SU-8 2000 Permanent Expoxy Negative Photoresist Available from: https://kayakuam.com/wp-content/uploads/2019/09/SU-82000DataSheet2025thru2075Ver4.pdf (2019)
- Palte, M. J., Raines, R. T. Interaction of nucleic acids with the glycocalyx. Journal of the American Chemical Society. 134 (14), 6218-6223 (2012).
- McGinnis, C. S., et al. MULTI-seq: sample multiplexing for single-cell RNA sequencing using lipid-tagged indices. Nature Methods. 16 (7), 619-626 (2019).
- Maxfield, F. R., van Meer, G. Cholesterol, the central lipid of mammalian cells. Current Opinion in Cell Biology. 22 (4), 422-429 (2010).
- Luo, J., Yang, H., Song, B. L. Mechanisms and regulation of cholesterol homeostasis. Nature Reviews Molecular Cell Biology. 21 (4), 225-245 (2020).
- Liu, L., Tan, L., Yao, J., Yang, L. Long non-coding RNA MALAT1 regulates cholesterol accumulation in ox-LDL-induced macrophages via the microRNA-17-5p/ABCA1 axis. Molecular Medicine Reports. 21 (4), 1761-1770 (2020).
- Mali, P., Aach, J., Lee, J. H., Levner, D., Nip, L., Church, G. M. Barcoding cells using cell-surface programmable DNA-binding domains. Nature Methods. 10 (5), 403-406 (2013).
- Hsiao, S. C., et al. Direct cell surface modification with DNA for the capture of primary cells and the investigation of myotube formation on defined patterns. Langmuir. 25 (12), 6985-6991 (2009).
- Gartner, Z. J., Bertozzi, C. R. Programmed assembly of 3-dimensional microtissues with defined cellular conductivity. Proceedings of the National Academy of Sciences. (17), 1-5 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon