Method Article
Padronização simples, acessível e modular de células usando DNA
Neste Artigo
Resumo
Aqui apresentamos um protocolo para células de micropattern em resolução unicelular usando a adesão programada pelo DNA. Este protocolo usa uma plataforma de fotolitografia benchtop para criar padrões de oligonucleotídeos de DNA em um slide de vidro e, em seguida, rotula membranas celulares com oligonucleotídeos complementares disponíveis comercialmente. A hibridização dos oligos resulta em adesão celularprogramada.
Resumo
O posicionamento relativo das células é uma característica fundamental do microambiente que organiza interações célula-células. Para estudar as interações entre células do mesmo tipo ou diferentes, as técnicas de micropattering têm se mostrado úteis. DNA Programado Assembly of Cells (DPAC) é uma técnica de micropatterning que visa a adesão das células a um substrato ou outras células usando hibridização do DNA. As operações mais básicas no DPAC começam com a decoração de membranas celulares com oligonucleotídeos modificados por lipídios, depois fluindo-as sobre um substrato que foi padronizado com sequências complementares de DNA. As células aderem seletivamente ao substrato apenas onde encontram uma sequência complementar de DNA. Células não aderentes são lavadas, revelando um padrão de células aderentes. Operações adicionais incluem outras rodadas de substrato celular ou adesão celular, bem como a transferência dos padrões formados pelo DPAC para um hidrogel de incorporação para cultura de longo prazo. Anteriormente, métodos para padronizar oligonucleotídeos em superfícies e decorar células com sequências de DNA exigiam equipamentos especializados e síntese de DNA personalizada, respectivamente. Relatamos uma versão atualizada do protocolo, utilizando uma configuração de fotolitografia de bancada barata e oligonucleotídeos modificados de colesterol (CMOs) comercialmente disponíveis, implantados usando um formato modular. Células rotuladas por CMO aderem com alta eficiência a substratos padronizados pelo DNA. Essa abordagem pode ser usada para padronizar vários tipos de células ao mesmo tempo com alta precisão e para criar matrizes de microtissues incorporados dentro de uma matriz extracelular. As vantagens deste método incluem sua alta resolução, capacidade de incorporar células em um microambiente tridimensional sem interromper o micropattern, e flexibilidade na padronização de qualquer tipo de célula.
Introdução
O posicionamento das células em relação umas às outras em um tecido é uma característica importante do microambiente1,2,3,4. Técnicas utilizadas para padronizar células vivas em arranjos espacialmente controlados são ferramentas experimentais valiosas para estudar a diferenciação4,5,6,7,8, motilidade celular9,morfogênese10,11,12, metabolismo13, e interações célula-células7,14 . Existem uma variedade de métodos para padronizar células, cada uma com suas próprias vantagens e desvantagens3,4. Métodos que criam ilhas adesivas de proteínas de matriz extracelular (ECM), como impressão de microcontatos e estêncil cortado a laser, são simples e escaláveis. No entanto, é difícil padronizar mais de um ou dois tipos de células por vez, pois as propriedades adesivas de diferentes tipos de células para diferentes moléculas de ECM são muitas vezes semelhantes15,16,17. Micropatterns mais complexos podem ser criados com adsorção molecular induzida pela luz (LIMAP), uma técnica que usa luz UV para ablatar regiões revestidas de PEG e permitir a adsorção de proteínas subsequente18,19. Esse processo pode ser repetido para criar micropatterns de alta resolução com vários tipos de células. No entanto, pode ocorrer a ligação cruzada das células com as diferentes manchas proteicas, resultando em má especificidade padrão19. Métodos físicos como a semeadura de células em dispositivos de cultura reconfiguráveis micromecânicas podem criar co-culturas estruturadas com controle dinâmico, mas sem a flexibilidade no design padrão de impressão de microcontatos ou LIMAP14,8. Ao contrário das outras técnicas, a bioimpressão pode criar arranjos tridimensionais de células dentro dos hidrogéis20,21. No entanto, os construtos bioimpressos têm resolução muito menor do que outras técnicas de micropatterning, com um tamanho médio de característica na ordem de centenas de mícrons22. Um método ideal de padronização celular teria alta resolução, padrão múltiplos tipos de células, usar equipamentos e reagentes que são facilmente acessíveis, e ter a capacidade de incorporar padrões bem sucedidos em um hidrogel para cultura celular tridimensional (3D). Neste artigo, apresentamos o CMO-DPAC, uma técnica de micropatterning celular que usa a flexibilidade e a velocidade da hibridização do DNA para direcionar a adesão celular a um substrato. Este método foi adaptado de nossos protocolos anteriores23,24 para torná-lo mais acessível, modular e acessível. Usando o protocolo atual, qualquer laboratório deve ser capaz de configurar um sistema totalmente funcional sem qualquer equipamento ou perícia especializada.
DNA Programado Assembly of Cells (DPAC) é uma poderosa técnica de engenharia de tecidos que padrona células em resolução unicelular com controle preciso sobre espaçamento celular e geometria tecidual. No DPAC, as membranas celulares são decoradas com oligonucleotídeos de DNA (oligos) usando dois oligos modificados por lipídio projetados para hibridizar na membrana celular. Como os oligos são conjugados a lipídios hidrofóbicos, eles rapidamente se particionam para a membrana celular25 onde hibridizam, aumentando a hidroofobidade líquida das moléculas não covalentemente ligadas, e assim aumentando sua vida útil na superfície celular26. Os oligos são apresentados na superfície celular de forma que podem hibridizar com oligos complementares em outras células ou lâminas de vidro funcionalizadas pelo DNA para criar padrões de células 2D ou 3D definidas com composição prescrita, espaçamento celular e geometria23,24. As microtissues padronizadas podem ser arrancadas da superfície enzimáticamente e incorporadas em um hidrogel para cultura 3D prolongada. Quando usadas em combinação com células primárias ou células-tronco, as coleções resultantes de células podem sofrer morfogênese e formar-se em organoides23,27,28. O DPAC tem sido aplicado para investigar a dinâmica do destino das células-tronco neurais adultas em resposta aos sinais concorrentes6,29, para estudar a auto-organização das células epiteliais mamárias23,28, e gerar "origami tecidual" através da condensação mesenquimal27.
O DPAC permite a colocação precisa de múltiplas populações celulares e tem resolução substancialmente melhor do que bioimpressoras baseadas em extrusão (na ordem dos mícrons)22,23. Além disso, ao contrário dos métodos de padronização baseados em ECM, como a impressão de microcontatos, o DPAC não requer adesão diferencial dos diferentes tipos de células a uma superfície revestida de ECM15,23. É ideal para responder perguntas sobre como a composição de um tecido afeta seu comportamento, como as células integram múltiplas pistas celulares e microambientais ao tomar decisões6,29, e como pares de células interagem entre si. Uma vantagem desse método em relação a outros métodos de micropatterning é que ele pode ser usado para a cultura celular 3D em um único plano de imagem, facilitando estudos de lapso de tempo da auto-organização tecidual e da morfogênese organoide23,27,30.
Apesar dessas vantagens, a implementação bem-sucedida do DPAC tem exigido a síntese de reagentes de oligonucleotídeos personalizados e o acesso a equipamentos especializados para padronização de DNA23,24, limitando a adoção generalizada. Por exemplo, os oligos modificados por lipídios (LMOs) usados no protocolo original devem ser sintetizados sob medida, modificados com ácido lignocerico ou ácido palmítico, e purificados26. Este processo requer o uso de um sintetizador de DNA e um instrumento de cromatografia líquida de alto desempenho, bem como a compra de reagentes associados, como a metilamina, substância controlada que está sujeita tanto às regulamentações institucionais quanto federais. Como alternativa, os LMOs podem ser comprados a granel, mas isso requer um investimento significativo na tecnologia.
Para superar essas limitações, desenvolvemos uma versão revisada do DPAC que utiliza oligos modificados pelo colesterol (CMOs) comercialmente disponíveis no lugar dos LMOs sintetizados sob medida. Para reduzir ainda mais os custos e aumentar a flexibilidade da plataforma, mudamos para um sistema modular de três oligo. Em vez de encomendar um novo oligo modificado pelo colesterol para cada população celular única, um usuário deste protocolo pode, em vez disso, usar os mesmos oligos modificados pelo colesterol ("Âncora Universal" e "Co-Âncora Universal") para cada população celular e, em seguida, empregar um oligo barato e não modificado ("Adapter Strand") que hibridiza tanto com a Âncora Universal quanto com o DNA funcionalizado amina na superfície ou o Adaptador Strand de outra célula.
Outra limitação do protocolo DPAC original foi que ele criou os slides padronizados em DNA usando uma impressora líquida de alta resolução (por exemplo, Nano eNabler, BioForce Nanosciences)23,24. Embora este instrumento tenha resolução extraordinária e baixos requisitos de reagente, ele não está disponível para a maioria das instituições e tem uma taxa de impressão relativamente baixa (aproximadamente 1 característica padronizada por segundo). Recentemente, dois métodos fotolithográficos foram desenvolvidos para padronizar características de DNA em superfícies. Viola e colegas usaram um revestimento de poliacrilamida e benzofenona que covalentemente amarrou oligos de DNA de fio único após a exposição à luz UV30. Usando este método, eles foram capazes de criar andaimes de tecido que sofreram mudanças de forma programadas em larga escala como resultado da contratude celular e da auto-organização. Scheideler et al. desenvolveram um método que usa exposição UV de um fotoresist positivo para expor seletivamente oligos de DNA modificados amina a um slide funcionalizado de aldeído29. Após assar e aminação redutiva, o DNA modificado por amina é covalentemente ligado à superfície. Este método foi utilizado para investigar a resposta de células-tronco neurais adultas a sinais de autoconexão e diferenciação que apresentavam espacialmente. Este artigo adapta o protocolo de Scheideler et al.para criar os padrões de DNA que capturarão células rotuladas por CMO. Este protocolo de fotopatterning pode ser realizado sem o uso de uma sala limpa. Ele usa equipamentos baratos e comercialmente disponíveis que são facilmente implantados em um banco ou capô de fumaça. O uso de equipamentos de fotolitografia barato ou DIY (faça você mesmo) aumenta a acessibilidade aos pesquisadores sem acesso a instalações limpas da sala e permite que os pesquisadores experimentem a técnica sem um grande investimento de tempo ou recursos31,32. No entanto, uma melhor resolução e o alinhamento de múltiplas características de DNA podem ser alcançados usando o revestimento de spin e o alinhador de máscaras comerciais comumente encontrados em instalações de limpeza.
Aqui, descrevemos um método para padronizar células em resolução unicelular usando a adesão baseada em DNA. Primeiro, fotopatterning com um fotoresist positivo é usado para criar padrões de alta resolução de DNA modificado por amina em um substrato de vidro modificado por aldeído. Em seguida, o slide é tratado para reduzir o apego celular não específico e as células de fluxo PDMS são criadas para limitar as células sobre regiões padronizadas. As células são então rotuladas com oligonucleotídeos de DNA curtos que são funcionalizados com colesterol e, como resultado, inserem na membrana celular. As células são então fluídas sobre os micropatterns de DNA. A hibridização entre o DNA da superfície celular e o DNA na superfície do vidro resulta em adesão específica das células ao padrão de DNA. Células não aderentes são lavadas, revelando o padrão celular aderente. Esse processo pode ser repetido para padronizar vários tipos de células ou para criar estruturas em várias camadas. Se desejar, as células podem ser totalmente incorporadas em um ECM para cultura celular 3D.
Protocolo
1. Experimento de design
- Planeje o experimento desejado, considerando o tamanho do recurso, o espaçamento do recurso, o número de tipos de células envolvidos e o arranjo de células em relação um ao outro. Consulte o Arquivo Suplementar 1, um guia para design experimental e o arquivo suplementar 2,que contém sequências de oligo de exemplo.
- Projete a máscara fotográfica usando um software de design auxiliado por computador. Uma máscara de exemplo é fornecida no Arquivo Suplementar 3.
- Desenhe um retângulo das dimensões de um slide de microscópio padrão (25 mm x 75 mm).
- Desenhe quatro regiões retangulares de 10 mm de largura e 10 mm de comprimento, distribuídas uniformemente pelo escorregador.
- Dentro de cada região, desenhe características que são o tamanho, forma e espaçamento desejados para o experimento. As células serão adere apenas a essas características no experimento.
- Para criar máscaras alinhadas para vários tipos de células, crie um desenho mestre com todos os conjuntos de recursos e, em seguida, salve versões que correspondam a cada tipo de célula.
- Peça uma fotomak de transparência de alta resolução (pelo menos 20.000 pontos por polegada) deste desenho CAD com as características desenhadas em 1.2.3 transparente e as regiões maiores pretas.
2. DNA de foteiro em lâminas funcionalizadas por aldeído (protocolo adaptado de Scheideler et al.29 )
- Se padronizar vários tipos de células, fabricar marcadores fiduciários no slide funcionalizado por aldeído antes de qualquer padronização de DNA para facilitar o alinhamento dos recursos. Métodos alternativos para a criação de marcadores fiduciais são sugeridos no Arquivo Suplementar 1.
- Para criar marcadores fiduciais metálicos, aplique fotoresist positivo S1813, conforme descrito nas etapas 2.3 - 2.11. Use uma máscara fotográfica que contenha grandes características que serão fáceis de alinhar mais tarde. Incorpore essas características no design das máscaras fotográficas que serão usadas para padronização de DNA.
- Deposite uma película fina (100 Angstroms) de titânio no slide usando evaporação de arma eletrônica29. Remova o excesso de metal e fotoresist usando acetona e, em seguida, prossiga para a fotopatterning de DNA.
- Prepare uma solução de 20 μM de um oligo modificado de 5'amina no buffer de DNA (50 mM de fosfato de sódio na água, pH = 8,5). Consulte o Arquivo Suplementar 2 para obter sequências de oligo sugeridas.
NOTA: É possível usar apenas 5 μM de oligo modificado por amina para alguns padrões e aplicações, de modo que a concentração de DNA de superfície pode precisar ser otimizada. - Pré-aqueça uma placa quente a 100 °C.
- Use fita dupla face ou um vácuo para anexar um deslizamento de vidro funcionalizado por aldeído ao rotor de um revestimento de spin.
ATENÇÃO: O descolamento de lâminas durante o revestimento de spin é um risco para a segurança. Use sempre o revestimento de giro em um recipiente fechado com uma tampa, como uma caixa de acrílico.
NOTA: Rotule um canto do slide usando um escriba de diamante ou um instrumento similar para arranhar o vidro. Isso ajuda na identificação e orientação do slide depois que o fotoresist foi lavado. - Use uma pipeta descartável para soltar o fotoresist positivo no slide do aldeído. Para até mesmo revestimentos, adicione pequenas gotas do fotoresistista através do slide, em vez de uma grande queda no meio(Figura Suplementar 1A).
- Usando o revestimento de giro, gire o slide a 3000 rpm por 30 s.
- Coloque o slide na placa de 100 °C por 1,5 min (cozimento macio) para a fotoresistia crosslink.
- Remova o slide da placa quente. Coloque uma máscara fotográfica com as características desejadas para este experimento em cima do slide e pese a máscara com um pedaço de vidro(Figura Suplementar 1B,C). Cubra toda a configuração em uma caixa opaca(Figura Suplementar 1D). Exponha com uma lâmpada UV (comprimento de onda de 365 nm, 360 mW, 5 polegadas de deslizamento, densidade total de energia radiante 100 mJ/cm2) por 2 min.
NOTA: A luz UV quebrará as ligações do polímero no fotoresistão sob regiões transparentes da fotomasca, criando regiões onde o DNA poderá posteriormente aderir. - Desenvolva o slide imergindo na solução do desenvolvedor por 3-5 min(Figura Suplementar 1E).
- Enxágüe a solução do desenvolvedor em excesso com água. Seque sob um fluxo de ar ou nitrogênio. (Figura Suplementar 1F).
- Confirme que a fotolitografia foi bem sucedida olhando para o slide sob o microscópio. Como o fotoresist é sensível à luz UV, faça este passo rapidamente e, em seguida, armazene o slide no escuro enquanto prepara outros slides (se aplicável).
NOTA: Um slide padronizado com sucesso deve ter bordas definidas com sucesso para cada recurso, sem rachaduras e sem distorção de características nas bordas. Exemplos de fotolitografia correta e incorreta são fornecidos na Figura Suplementar 2A. Consulte a Tabela 1 para obter sugestões de solução de problemas se a fotolitografia não fornecer a qualidade desejada do recurso. - Adicione uma gotícula da solução de oligo modificada amina de 20 μM (Passo 2.1) em cada região fotopatterada do slide. Use uma ponta de pipeta para espalhar suavemente a gota por toda a região, tomando cuidado para não arranhar o slide. (Figura Suplementar 1G).
- Asse o slide em um forno de 65-70 °C até que a solução de DNA esteja totalmente seca na superfície do slide (cerca de 1h).
- Realize a aminação redutiva colocando os slides padronizados e cozidos em um prato de cultura celular de 15 cm e coloque em um capuz de fumaça em cima de um shaker. Pesar 100 mg de boroidido de sódio. Em um capô de fumaça, adicione 40 mL de soro fisiológico tamponado de fosfato (PBS), misture delicadamente e adicione ao prato contendo os slides padronizados. Deixe a reação prosseguir por 15 minutos com agitação suave.
NOTA: A amina no oligo forma pela primeira vez uma base de Schiff com os aldeídos na superfície do slide. Trata-se de um vínculo covalente reversível que deve ser convertido em um vínculo irreversível antes de ser usado no DPAC. A adição de um agente redutor (boroidride de sódio) converte a base de Schiff em uma amina secundária por aminação redutiva.
ATENÇÃO: A reação do boroidido de sódio com a água cria gás hidrogênio e continuará a fazê-lo por horas ou dias após o início da reação. Realize o passo de aminação redutivo em um capô de fumaça e mantenha todos os resíduos de solução de borhidride de sódio em um recipiente aberto ou frouxamente tampado no capô da fumaça por pelo menos 24 h. - Remova o DNA não redigido lavando duas vezes com sulfato de dodecil de sódio de 0,1% de sódio (SDS) na água, depois três vezes com água destilada. Seque o deslizamento sob um fluxo de nitrogênio ou ar.
- Enxágüe o slide com acetona para remover o fotoresist restante.
NOTA: Neste ponto, o DNA foi irreversivelmente e covalentemente ligado ao slide e todos os grupos funcionais aldeídos não redigidos foram convertidos em álcoois. O fotoresist não é mais necessário. - Se vários oligos forem padronizados, retorne à etapa 2.4, alinhe a máscara com marcas fiduciárias e repita.
NOTA: O experimento pode ser pausado aqui. Armazene slides em um desiccador de vácuo. Em condições secas, os slides podem ser armazenados por até 3 meses sem perda de qualidade.
3. Faça slide hidrofóbico (opcional) (protocolo adaptado de Todhunter et al.24 )
NOTA: É vantajoso, mas não necessário, modificar a química da superfície do slide para torná-lo mais inerte e hidrofóbico. O acessório celular não específico é reduzido nessas superfícies33,aliviando assim a ligação não específica das células às áreas não padronizadas do slide. Além disso, se as células padronizadas serão em última análise incorporadas dentro de um hidrogel e transferidas para fora do slide, o tratamento superficial é essencial para o movimento confiável do hidrogel carregado de células através do slide sem distorção ou rasgo. Silanização com dimetilcloosilano (tridecafluoro-1,1,2,2-tetrahidrooctyl) resulta na presença de grupos hidrofóbicos fluoroalquilo na superfície do slide.
ATENÇÃO: Realize todas as etapas a partir de 3.1 em uma capa de fumaça química para evitar a exposição a ácido acético e vapores de cloreto de metileno.
- Enxágüe slide com 10% de ácido acético e depois seque sob uma corrente de ar.
- Em um frasco de Coplin de vidro, prepare uma solução de 60 mL de cloreto de metileno (diclorometano), 0,6 mL de trietilamina e 0,6 mL de dimetilcloosilano (tridecafluoro-1,1,2,2-tetrahidrooctyl). Mexa com uma espátula de metal para misturar.
NOTA: Estes reagentes são sensíveis à água. Devem ser armazenados em condições secas e usados o mais fresco possível. - Adicione o slide ao frasco Coplin contendo a solução de silano. Coloque o frasco de Coplin em um agitador orbital (definido para 60-80 rpm) e permita que a reação do silano e do slide progridam por 15 minutos.
- Use fórceps metálicos para remover o slide da solução de silano. Mergulhe slide em um frasco de Coplin contendo cloreto de metileno por 1 minuto para remover o excesso de silano do slide.
- Mergulhe o slide em um tubo cônico de 50 mL contendo etanol. Agitar. Mergulhe o slide em um tubo cônico de 50 mL contendo água destilada. Agitar.
NOTA: Cloreto de metileno e água não são miscíveis, por isso é necessário enxaguar etanol para remover o excesso de cloreto de metileno antes da lavagem final da água. - Retire o escorregador da água e inspecione-o. O slide deve ser bastante seco, com qualquer gotícula de água com um ângulo de contato superior a 90°. Deixe os slides secarem completamente e armazene no desiccator de vácuo até usar.
NOTA: O experimento pode ser pausado aqui. Armazene o escorregador em condições secas.
4. Prepare células de fluxo PDMS e deslize para experimento
NOTA: As células de fluxo PDMS retangulares são usadas para concentrar as células sobre as regiões padronizadas do slide. Para experimentos cultivados em 3D, as células de fluxo formam um molde para o hidrogel.
- Faça com que o SU-8 seja usado como molde para células de fluxo PDMS.
- Placa de pré-aquecimento a 95 °C.
- Adicione 5 mL de SU-8 2075 a um wafer de silício.
- Gire o SU-8 no wafer a 500 rpm por 10s, seguido de 1.000 rpm para 30s. Isso deve criar recursos de até 240 μm de altura34.
- Asse suavemente a bolacha na placa por pelo menos 45 min.
- Remova o wafer da placa de aquecimento. Coloque a máscara (ver Arquivo Suplementar 4) (lado da emulsão para baixo) em cima do wafer e pese-a com um disco de vidro para garantir o contato entre a máscara fotográfica e o slide.
- Exponha com luz UV (365 nm) para uma densidade energética radiante de 350 mJ/cm2.
- Asse wafer na placa por 12-15 min.
- Coloque o wafer em um recipiente de vidro largo. Cubra o wafer com a solução do desenvolvedor SU-8. Coloque em um agitador e desenvolva enquanto agita por pelo menos 15 minutos.
- Use fórceps para remover o wafer da solução do desenvolvedor. Enxágüe para 5 s pulverizando mais solução de desenvolvedor a partir de uma garrafa de esguicho. Pulverizar com álcool isopropílico para enxaguar. Se um precipitado branco aparecer, devolva o wafer à solução do desenvolvedor e se desenvolva por mais tempo.
- Bolacha seca sob um fluxo de ar ou nitrogênio.
- Asse slide por 5 min.
NOTA: Uma vez que o wafer mestre tenha sido criado, ele pode ser reutilizado indefinidamente, desde que as características permaneçam intactas.
- Prepare PDMS.
- Em um barco de pesagem, adicione o elastomer polidimetilsiloxano e o crosslinker em uma proporção de 10:1 (por massa). Mexa vigorosamente para garantir a mistura uniforme.
- Desapor o PDMS em um desiccador a vácuo por 15-30 min até que não sejam visíveis mais bolhas.
- Coloque o wafer mestre em um prato de cultura de tecido de 15 cm. Despeje PDMS sobre o wafer. Se aparecerem bolhas, desapareçam em um desiccador a vácuo por alguns minutos.
- Asse em forno de 60 °C por 3h.
NOTA: Após o cozimento, as células de fluxo PDMS podem ser armazenadas no banco indefinidamente.
- Prepare células de fluxo PDMS para o experimento.
- Pouco antes de iniciar um experimento CMO-DPAC, corte o número necessário de células de fluxo PDMS do wafer mestre. Oxidação plasmática com ar de 10 cc/min para 90 s para tornar a superfície hidrofílica.
- Corte cada célula de fluxo individual para que haja 1-2 mm de PDMS restantes em cada lado e, em seguida, corte a parte superior e inferior da célula de fluxo para criar uma entrada e saída.
- Recuperar slide padronizado criado nas etapas 2 e 3. Alinhe em cima da máscara fotográfica.
- Usando a máscara fotográfica como referência, coloque as células de fluxo PDMS no slide na localização de cada região padronizada.
- Adicione 50 μL de salina tamponada de fosfato (PBS) + 1% de albumina de soro bovino (BSA) à entrada de cada célula de fluxo, como mostrado na Figura Suplementar 1H. Confirme que a célula de fluxo é completamente preenchida pelo PBS + 1% BSA e que não há bolhas grandes. Prossiga imediatamente para as etapas 5 e 6.
NOTA: O bloqueio com BSA minimiza a adesão celular não específica à superfície do slide.
5. Levantar e rotular células com DNA modificado pelo colesterol
- Prepare as soluções de DNA modificadas pelo colesterol.
- Para cada conjunto de células do experimento, misture 3 μL de uma solução de estoque de 100 μM da Cadeia de Âncora Universal modificada pelo colesterol com 3 μL de uma solução de estoque de 100 μM de uma Strand Adaptador. Incubar por 1 minuto. Isso vai pré-hibridizar os oligos. Adicione 69 μL de soro fisiológico tamponado de fosfato (PBS) para criar uma solução de âncora universal + adaptador de 4 μM.
- Para cada conjunto de células no experimento, adicione 3 μL de uma solução de estoque de co-âncora modificada pelo colesterol universal de 100 μM a 12 μL de PBS, criando uma solução de 20 μM.
- Prepare a suspensão de célula única( s).
- Para células aderentes, use trippsina ou outro agente de dissociação para remover as células do frasco de cultura. Adicione mídia cultural para neutralizar a trippsina e a centrífuga para pelotar as células. Para células não aderentes, colete a suspensão celular e a centrífuga para pelotar as células.
- Resuspende a pelota de célula em 1 mL de PBS gelado ou mídia sem soro. Transfira 1-3 milhões de células para um tubo de microcentrifuge de 1,5 mL. Centrifugar a 160 x g por 4 min.
NOTA: Se o tipo de célula que está sendo usado estiver propenso a aglomeração/agregação, use PBS sem íons de cálcio e magnésio para todas as etapas de lavagem para reduzir a agregação celular indesejada. Se a viabilidade é uma preocupação particular para o tipo de célula que está sendo usado, use mídia livre de soro em vez de PBS. A mídia que contém soro bovino fetal não é recomendada para rotulagem celular, pois pode dificultar a incorporação de oligos modificados por lipídios. 35
- Rotule as células com oligos modificados pelo colesterol.
- Resuspende a pelota de célula em 75 μL de PBS gelado ou mídia sem soro. Mantenha as células em um balde de gelo durante todo o processo de rotulagem e lavagem para maximizar a viabilidade celular e minimizar a perda dos oligos modificados pelo colesterol da superfície celular.
NOTA: Reutilizar as células antes de adicionar o DNA garante que a distribuição do DNA seja uniforme em toda a população celular. - Adicione os 75 μL da solução Universal Anchor + Adapter de 4 μM criada na Etapa 5.1.1 ao tubo de microcentrifuuge contendo a suspensão celular. Misture bem por pipetar. Incubar por 5 minutos no gelo.
- Adicione 15 μL da solução universal co-âncora ao tubo de microcentrifuuge. Misture bem por pipetar. Incubar por 5 minutos no gelo.
- Remova o excesso de oligos da suspensão celular. Adicione 1 mL de PBS gelado ou mídia sem soro ao tubo de microcentrifuuge. Misture com uma pipeta P1000. Centrifugar a 160 x g por 4 min a 4 °C. Descarte o supernatante. Repita mais duas vezes.
NOTA: Se as células estiverem propensas a aglomeração, passe a suspensão da célula através de um filtro de 40 μm antes da lavagem final. Se as células estiverem propensas à adsorção na lateral do tubo de microcentrifutura, considere bloquear previamente o tubo com caseína.
- Resuspende a pelota de célula em 75 μL de PBS gelado ou mídia sem soro. Mantenha as células em um balde de gelo durante todo o processo de rotulagem e lavagem para maximizar a viabilidade celular e minimizar a perda dos oligos modificados pelo colesterol da superfície celular.
6. Padrone as células rotuladas por DNA
- Resuspende as células em PBS gelado ou mídia sem soro para criar uma solução denso celular de pelo menos 25 milhões de células/mL.
NOTA: Para um slide usando quatro das células de fluxo PDM de 10 mm x 15 mm x 200 μm descritas na Etapa 4, é necessário cerca de 100 μL desta densa suspensão celular. Embora a maioria dessas células não adere ao padrão e, em última análise, será descartada, ter uma solução extremamente concentrada de células sobre o padrão melhora drasticamente a eficiência da padronização celular. - Pegue o slide e incline-o ligeiramente. Adicione 25 μL de suspensão celular à entrada de cada célula de fluxo no slide padronizado. Remova a solução PBS + 1% BSA da tomada, permitindo que a suspensão da célula encha a célula de fluxo PDMS. Incubar no gelo ou à temperatura ambiente por 30 s.
NOTA: Neste ponto, olhar para a célula de fluxo sob um microscópio deve mostrar células densamente embaladas com pouca ou nenhuma lacuna visível entre as células. Ver Figura Suplementar 2B. - Aspire 5 μL de suspensão celular a partir da saída do slide e adicione-o de volta na entrada. Repita 10 vezes por célula de fluxo.
NOTA: A adesão de células rotuladas por CMO ao slide padronizado pelo DNA é quase instantânea. Fluir as células sobre o padrão várias vezes aumenta a probabilidade de que uma célula flua sobre um determinado ponto de DNA e seja capturada. - Delicadamente pipeta PBS ou mídia livre de soro na entrada de cada célula de fluxo para lavar células em excesso. Pegue a suspensão do celular na tomada. Repita 2-4 vezes ou até que uma inspeção visual do slide sob o microscópio confirme que não há células em excesso restantes.
NOTA: Pode ser vantajoso salvar o excesso de células da primeira lavagem. Se a eficiência de padronização for insatisfatória, o excesso de células pode ser centrifusado e resuspendido em um volume menor de PBS para criar uma solução mais densa celular, e então o processo pode ser repetido a partir do Passo 6.2. - Repita as etapas 6.1-6.4 para cada conjunto de células no padrão. Para padrões em que vários tipos de células são diretamente padronizados pelo modelo de superfície, comece com o tipo celular menos abundante do padrão e finalize com o tipo celular mais abundante.
NOTA: É aconselhável fazer cada rodada de montagem celular sequencialmente em vez de agrupar as células, mesmo em condições onde as células são todas rotuladas com sequências ortogonais de DNA. A junção das células dilui efetivamente cada população celular e reduz a eficiência de padronização. - Após a conclusão da rodada final de montagem celular, os próximos passos variam de acordo com o experimento específico. Se as células forem destinadas a permanecer no vidro, adicione mídia a uma placa de Petri contendo o slide e, em seguida, use suavemente fórceps para empurrar as células de fluxo PDMS para fora do slide. Se as células forem incorporadas em um hidrogel e cultivadas em 3D, siga para o Passo 7.
7. Transfira para hidrogel para cultura 3D (opcional)
- Prepare uma solução precursora de hidrogel contendo 2% de DNase.
NOTA: A composição da solução varia de acordo com a configuração experimental. Matrigel e misturas de Matrigel e colágeno Eu trabalho bem neste protocolo, mas outros hidrogéis também são possíveis. - Adicione 50 μL de solução de hidrogel contendo 2% DNase à entrada de cada célula de fluxo. Aspire o excesso de fluido da tomada, levando a solução de hidrogel para a célula de fluxo. Para precursores de hidrogel viscoso, inclinar ligeiramente o slide pode ser necessário para ajudar o hidrogel a fluir para a célula de fluxo.
- Incubar o slide a 37 °C por 30-45 min (dependendo da cinética de gelação de hidrogel) para permitir que o hidrogel ajuste e corte a adesão baseada em DNA entre as células e a superfície.
- Remova cada célula de fluxo do slide e coloque em cima da solução precursora do hidrogel.
- Adicione 50 μL de precursor de hidrogel a um poço de um escorregador de câmara de 2 poços ou uma placa de 6 poços.
- Pipeta 10 μL de PBS em cada lado de cada célula de fluxo.
- Use uma lâmina de barbear ou pinças de ponta fina para distribuir o PBS ao longo de toda a extensão da célula de fluxo, em seguida, levante suavemente os lados da célula de fluxo para que o PBS corra sob o hidrogel.
NOTA: Este irá "flutuar" o hidrogel através do slide, permitindo a transferência sem distorção ou rasgo. - Use uma lâmina de barbear para mover suavemente a célula de fluxo para a borda do deslizamento de vidro.
- Inverta o slide. Com a lâmina de barbear, empurre a célula de fluxo para fora do slide para que ela caia em cima da lâmina de barbear.
- Pegue a célula de fluxo da lâmina de barbear usando fórceps curvos. Inverta a célula de fluxo para que as células estejam na parte inferior e, em seguida, coloque em cima da gota da solução precursora do hidrogel.
- Repetia as etapas 7.4.1 - 7.4.6 para cada célula de fluxo.
- Incubar por pelo menos 30 min para que o hidrogel contendo as células padronizadas possa se ligar à base de hidrogel, resultando na incorporação completa das células padronizadas.
- Remova a célula de fluxo PDMS.
- Adicione mídia suficiente para imergir a célula de fluxo PDMS.
NOTA: O fluxo de mídia afrouxará a adesão entre o hidrogel e a célula de fluxo PDMS. - Use fórceps curvas, orientados ao longo do longo eixo da célula de fluxo, para cutucar suavemente a célula de fluxo até que ela apareça e flutue para a mídia. Colete a célula de fluxo com fórceps e descarte.
NOTA: Para obter resultados ótimos, espalhe as fórceps curvas e aplique pressão suave nas paredes da célula de fluxo PDMS. Aplique força na direção do eixo longo da célula de fluxo.
- Adicione mídia suficiente para imergir a célula de fluxo PDMS.
8. Confirme a rotulagem bem sucedida de células com CMO (opcional, para solução de problemas)
- Ordene um oligonucleotídeo fluorescente modificado (FAM ou AF647) que seja complementar à sequência de adesão superficial da Cadeia Adaptador que está sendo usada no experimento.
- Rotular células com DNA CMO e lavar DNA em excesso como descrito no Passo 5. Resuspend em 200 μL de PBS gelado.
- Coma uma solução de 4 μM do oligonucleotídeo complementar rotulado fluorescentemente em PBS. Adicione 200 μL desta solução à suspensão da célula. Incubar no gelo por 5 minutos.
- Adicione 1 mL de PBS gelado. Misture. Centrifugar as células para dotrá-las. Remova o supernante. Repita este processo mais duas vezes para lavar qualquer DNA que não tenha hibridizado.
- Realize citometria de fluxo analítico para quantificar a presença de DNA na superfície celular.
- Em um citómetro de fluxo, analise células de controle que não foram rotuladas com DNA. Montar portões com base nessa população.
- Analise as células rotuladas pelo CMO que foram tratadas com oligonucleotídeos complementares rotulados fluorescentemente.
- Calcule a intensidade média da fluorescência.
Resultados
Este protocolo permite padronizar células em 2D e 3D com alta precisão e sem o uso de reagentes personalizados ou equipamentos de limpeza caros. A Figura 1 mostra uma visão geral do protocolo. Primeiro, slides funcionalizados de DNA são criados através da fotolitografia. Em seguida, as células são rotuladas com CMOs. As células são então fluídas sobre o slide, onde se anexam apenas às regiões funcionalizadas de DNA do slide. Depois que o excesso de células é lavado, o padrão desejado das células é revelado. Essas células podem ser cultivadas no slide ou embutidas em um hidrogel contendo DNase e transferidas para a cultura celular 3D.
A rotulagem de células com CMOs permite sua fixação ao slide padronizado de DNA(Figura 2). Primeiro, o Fio de Âncora Universal modificado pelo colesterol é pré-hibridizado com o Adapter Strand. Em seguida, a solução Universal Anchor + Adaptador é misturada 1:1 com a suspensão do celular. O colesterol no complexo Universal Anchor + Adaptador insere-se na membrana celular. A adição do Fio Co-Âncora Universal modificado pelo colesterol, que hibridiza com a Cadeia De Âncora Universal, melhora a estabilidade do complexo CMO na membrana celular aumentando a hidrofobitude líquida do complexo26. Depois de lavar o DNA em excesso da suspensão celular, as células são fluídas sobre o slide. A hibridização entre a Cadeia Adaptador e a Cadeia de DNA da Superfície resulta na fixação das células às regiões padronizadas pelo DNA do slide.
O padrão das células é criado usando fotolitografia para restringir a fixação de oligos de DNA modificados por amina a regiões específicas de um lâmina de vidro modificada por aldeído29 (Figura 3A). Fotoresist positivo é revestido de spin em um slide funcionalizado por aldeído. Uma máscara de transparência é então colocada em cima do slide e o slide é exposto à luz UV. Após o desenvolvimento, as regiões do slide que foram expostas à luz UV não são mais revestidas em fotoresistia e, portanto, têm grupos de aldeído expostos. Uma solução de 20 μM de oligos de DNA modificados amina é então lançada sobre o slide e espalhada para cobrir as regiões padronizadas. Cozimento seguido de aminação redutiva resulta em uma ligação covalente entre o DNA modificado por amina e o slide. Notavelmente, esse processo pode ser repetido para padronizar múltiplos oligos sem qualquer perda de funcionalidade dos oligos previamente padronizados(Figura 3B). No entanto, deve-se tomar cuidado para evitar padrões sobrepostos, o que resulta na presença de ambos os oligos em uma concentração reduzida(Figura Suplementar 3). Várias populações de células podem ser padronizadas sequencialmente usando fios adaptador que diferem em seu domínio modular (as 20 bases mais próximas do final de 3').
Embora este protocolo de fotopatterning tenha sido desenvolvido por Scheideler et al. no contexto de uma sala limpa, demonstramos que é possível alcançar resultados semelhantes com uma configuração de fotolitografia "caseira" barata que se encaixa facilmente dentro de uma capa de fumaça química. A configuração inclui um revestimento de spin de US$ 400 feito de um motor DC, controlador digital e caixa de bolo de CD, bem como uma lâmpada UV que foi montada a partir de componentes individuais e alojada em um recipiente de sharps reaproveitados(Figura Suplementar 1). A principal vantagem da configuração de fotolitografia caseira é que ela é muito acessível (<$1000 para todos os equipamentos) enquanto ainda é capaz de criar recursos do tamanho de células únicas. No entanto, o uso de equipamentos baratos tem suas limitações - por exemplo, é mais desafiador alinhar com precisão marcadores fiduciários para padronizar múltiplos oligos de DNA sem o uso de um alinhador de máscaras. Recomendamos esta configuração de fotolitografia barata para laboratórios que não têm acesso conveniente a uma sala limpa ou que queiram experimentar este método sem um grande investimento.
Para identificar as condições ideais para a adesão celular programada pelo DNA, variamos sistematicamente as concentrações de fios de DNA nas superfícies celulares e medimos a eficiência da adesão celular às superfícies de vidro modificadas pelo DNA. A concentração de Universal Anchor + Adapter Strand e Universal Co-Anchor em soluções de rotulagem foram variadas em várias ordens de magnitude (Figura 4A, B), resultando em 104 - 106 complexos de DNA por célula(Figura Suplementar 4). A adesão celular foi dependente de dose, com adesão celular mínima ao padrão de DNA quando as células foram rotuladas com CMOs a uma concentração de 0,05 μM ou menos, e alta ocupação a uma concentração de 2,5 μM e superior. Utilizamos, portanto, uma solução de 2 μM da Universal Anchor + Adapter Strand e uma solução de 2 μM da Universal Co-Anchor na maioria dos experimentos. Espera-se também que a adesão celular diminua se a quantidade de DNA usada na superfície do vidro diminuísse29 ou se os desencontros entre o Fio Adaptador e o fio da superfície aumentassem. Mais informações sobre o design da sequência do Adapter Strand são fornecidas no Arquivo Suplementar 2. A rotulagem CMO usando fios adaptador sem repetições de CpG não estimulou tLR9 em células HEK expressando o mouse TLR9 (Figura Suplementar 5).
Fornecemos várias demonstrações de que o protocolo revisado fornece uma adesão celular auto-reproduzida e eficiente programada pelo DNA. Por exemplo, as células endoteliais da veia umbilical humana (HUVECs) rotuladas com CMOs aderiram aos padrões de DNA com alta eficiência. Huvecs rotulados por CMO aderiram, bem como HUVECs rotulados em LMO (Figura 5A). As células padronizadas usando CMO-DPAC mantiveram sua viabilidade e funcionalidade. As células rotuladas com CMOs foram manchadas por calcein AM e ethidium homodimer para avaliar a viabilidade (Figura Suplementar 6). As diferenças na viabilidade em relação às células de controle não rotuladas foram pequenas (94% vs 97%). MDCKs únicos padronizados via CMO-DPAC e transferidos para Matrigel foram capazes de proliferar e polarizar corretamente após 5 dias de cultura(Figura 5B). O DPAC também fornece um meio de elaborar padrões de células na terceira dimensão(Figura 5C). Por exemplo, agregados multicamadas e multicelulares podem ser criados alternando camadas de células rotuladas com CMOs complementares(Figura 5C). Esses experimentos demonstram que o protocolo é reprodutível, não afeta negativamente a viabilidade ou funcionalidade celular, e produz padrões celulares que podem ser cultivados com sucesso dentro de um único plano de imagem em um ECM 3D.
Ao fornecer sequências ortogonais de DNA para a adesão celular direta, o DPAC fornece um meio de padronizar vários tipos de células em uma única superfície. Para implementar esse recurso de DPAC, os padrões de DNA gerados pela fotolitografia devem estar alinhados em relação uns aos outros. Marcadores fiduciários metálicos depositados no slide permitiram o alinhamento de múltiplas máscaras fotográficas e, portanto, a padronização de vários tipos de células ao mesmo tempo. MCF10As manchadas com diferentes corantes exclusivos foram rotuladas com CMOs ortogonais e padronizadas para criar uma visualização dos logotipos UC Berkeley e UCSF(Figura 6). Este experimento demonstra que várias populações celulares únicas podem ser padronizadas juntamente com alta precisão e sem contaminação cruzada.
A padronização bem sucedida das células usando CMO-DPAC requer fotolitografia de alta qualidade, concentração suficiente de oligo na superfície celular, alta densidade de células sobre o padrão e lavagem suficiente. O fracasso de qualquer uma dessas etapas afeta o resultado final. A Figura Suplementar 2 inclui imagens exemplos de fotolitografia correta e incorreta(Figura Suplementar 2A),a densidade celular desejada sobre o padrão para criar padrões totalmente ocupados(Figura Suplementar 2B),a perda de células padronizadas devido à tubulação excessivamente vigorosa durante as etapas subsequentes de DPAC (Figura Suplementar 2C) e agrupamento indesejado de células(Figura Suplementar 2D). A Tabela 1 inclui uma lista de pontos de falha comuns e a solução de problemas sugerida. O uso de oligos complementares fluorescentes é recomendado como uma ferramenta para solução de problemas para confirmar a presença de DNA padronizado na lâmina e a presença de CMOs na superfície celular por citometria de fluxo (ver Passo 8 do protocolo).
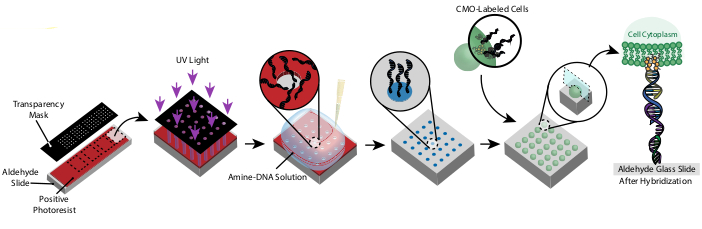
Figura 1: Visão geral do protocolo CMO-DPAC. Primeiro, um slide com padrão de DNA é criado por revestir um slide de vidro funcionalizado por aldeído com um fotoresist positivo, cobrindo-o com uma máscara de transparência no padrão desejado, e expondo-o à luz UV. O fotoresist exposto a UV é lavado com o desenvolvedor, deixando regiões expostas do slide aldeído e permitindo a ligação do DNA funcionalizado amina à superfície. As células são então rotuladas com CMOs e fluídas sobre a superfície. O DNA da membrana celular hibridiza o DNA na superfície, resultando em adesão. Clique aqui para ver uma versão maior desta figura.
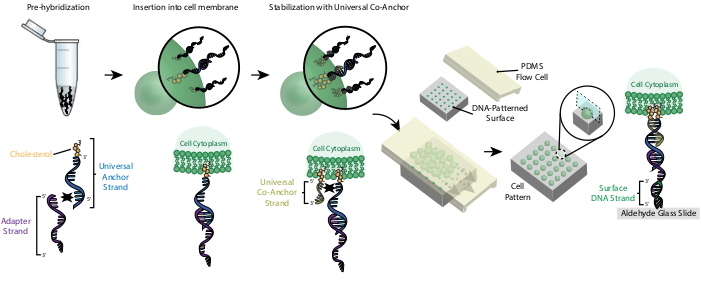
Figura 2: As células são rotuladas com CMOs em um processo stepwise. Primeiro, o Fio de Âncora Universal modificado pelo colesterol é pré-hibridizado com o Adapter Strand. Em seguida, a solução Universal Anchor + Adaptador é misturada com a suspensão do celular. O colesterol no complexo Universal Anchor + Adaptador insere-se na membrana celular. Após a incubação, o Fio Co-Âncora Universal modificado pelo colesterol é adicionado à suspensão celular, onde hibridiza com o Fio de Âncora Universal e insere-se na membrana celular. A adição da segunda molécula de colesterol aumenta a hidrofobitude líquida do complexo de DNA e a estabiliza dentro da membrana26. Depois de lavar o DNA em excesso, as células são concentradas e adicionadas a uma célula de fluxo PDMS em cima da superfície padronizada. A extremidade de 3' do Adapter Strand hibridiza com o Surface DNA Strand na lâmina de vidro, resultando em adesão ao slide especificamente em regiões funcionalizadas com DNA complementar. Clique aqui para ver uma versão maior desta figura.
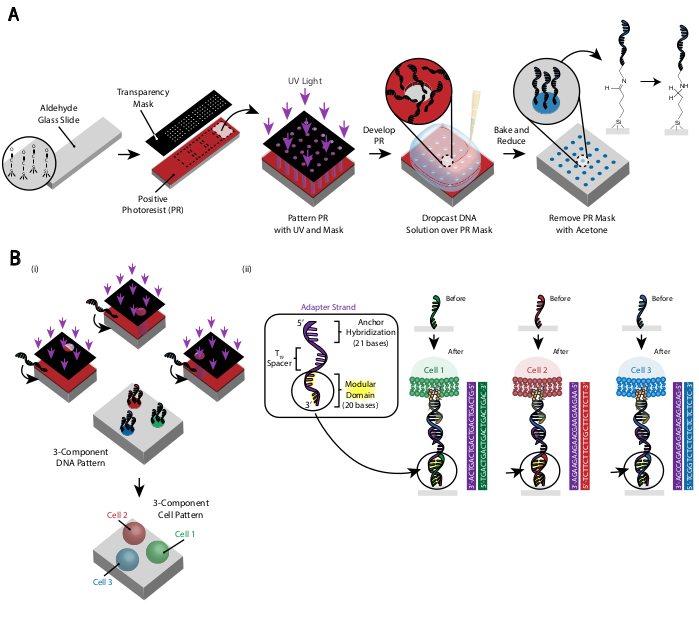
Figura 3: A fotolitografia é usada para criar os slides padronizados pelo DNA que, em última análise, ditarão a colocação das células. (A) Visão geral do processo de fotolitografia. Um slide funcionalizado por aldeído é revestido com um fotoresist positivo. A luz UV brilha sobre o slide através de uma máscara de transparência transparente que é transparente onde a adesão celular é desejada. Após o desenvolvimento do slide, as regiões que antes eram expostas à luz UV agora têm grupos de aldeído expostos. Uma solução de 20 μM de um oligo de DNA funcionalizado amina é então lançada sobre o slide e espalhada sobre as regiões padronizadas. O slide é então assado para induzir a formação de ligações de Schiff (C=N) entre os grupos amina e aldeído, uma ligação covalente reversível29. A aminação redutiva subsequente com 0,25% de boroidride de sódio na PBS converte a base de Schiff em uma amina secundária por aminação redutiva, resultando em uma ligação irreversível entre o DNA e o slide. O fotoresist restante pode então ser removido enxaguando com acetona. (B) Este processo pode ser repetido para criar padrões de DNA multicomponindo e, portanto, realizar experimentos com múltiplas populações celulares. (i) Depois que o primeiro oligo é padronizado, o slide é novamente revestido em fotoresist e o protocolo prossegue como antes. O alinhamento das máscaras fotográficas usando marcadores fiduciários é necessário para padronizar múltiplos fios de DNA. (ii) Cada tipo de célula que está sendo padronizada difere no domínio modular de 20 bases da Cadeia adaptador. Usando conjuntos ortogonais de oligos complementares, vários tipos de células podem ser padronizados sem adesão cruzada. Clique aqui para ver uma versão maior desta figura.
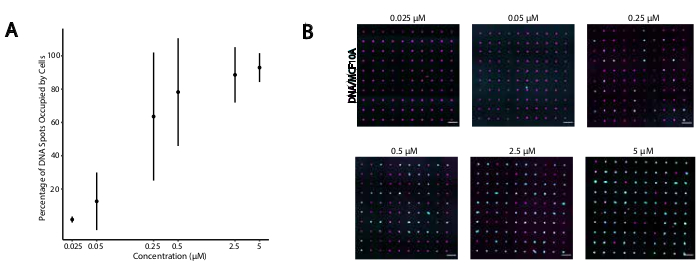
Figura 4: A adesão de células rotuladas por CMO aos padrões de DNA aumenta em função da concentração de CMO durante a rotulagem. Neste experimento, o Universal Anchor + Adapter Strand (pré-hibridizado) e o Universal Co-Anchor foram usados em concentrações iguais. A concentração refere-se à concentração de CMO na suspensão celular durante a rotulagem CMO das células. (A) Quantificação da porcentagem de 15 pontos de DNA de diâmetro de 15 μm que foram ocupados por células MCF10A rotuladas pelo CMO em função da concentração de CMO durante a rotulagem celular. Os dados representaram como a média ± desvio padrão de três experimentos. (B) Imagens representativas dos padrões de DNA (magenta) e aderidas MCF10As (ciano) em diferentes concentrações de CMO. Barra de escala = 100 μm. Clique aqui para ver uma versão maior desta figura.
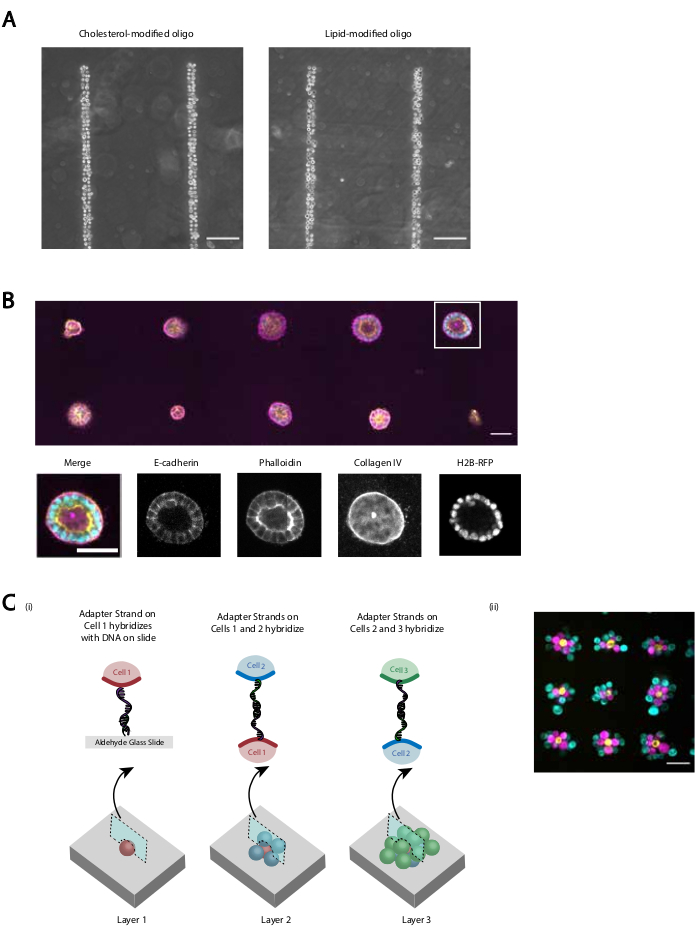
Figura 5: CMO-DPAC pode ser usado para criar padrões celulares bidimensionais que podem ser posteriormente incorporados em um hidrogel tridimensional para cultura e/ou camadas para criar estruturas multicamadas. (A) Comparação direta entre células endoteliais de veia umbilical humana (HUVECs) e HUVECs rotulados em LMO aderiram a um padrão de DNA linear. Ambos os métodos de rotulagem celular resultam em quase 100% de ocupação do padrão de DNA. (B) As células simples dos rins caninos de Madin-Darby (MDCKs) expressando H2B-RFP foram padronizadas em pontos de diâmetro de 15 μm espaçados a 200 μm de distância e posteriormente incorporados em Matrigel. Após 120 h de cultura, os cistos epiteliais resultantes foram fixados e manchados para E-cadherin, actin e colágeno IV. Spheroid em caixa branca é mostrado em detalhes. Barra de escala = 50 μm. (C) Estruturas celulares multicamadas podem ser criadas rotulando populações celulares separadas com fios adaptadores complementares e padronizando sequencialmente para que cada nova adição de células adere à camada celular antes dela. iUm esquema da padronização sequencial das populações celulares para criar estruturas multicamadas. (ii) Foram criados agregados celulares de três camadas de MCF10As (visualizados usando corantes) utilizando esse processo. Barra de escala = 50 μm. Clique aqui para ver uma versão maior desta figura.

Figura 6: Vários tipos de células podem ser padronizados sem contaminação cruzada ou perda de adesão. Múltiplos oligos de DNA modificados por amina foram padronizados sequencialmente em um slide de aldeído e alinhados através do uso de marcadores fiduciários metálicos. Três populações de MCF10As (ciano, magenta, amarelo) foram manchadas com corantes únicos rotulados com CMOs complementares, e padronizados no slide, resultando em uma imagem dos logotipos da UC Berkeley e UCSF. Barra de escala 1 mm. Clique aqui para ver uma versão maior desta figura.
Figura suplementar 1: Exemplos de imagens da configuração da fotolitografia benchtop. (A) Deslize no revestimento de giro, coberto com fotoresist positivo, antes de girar o revestimento. (B) Foto de fotomask transparência. (C) Durante a exposição, a máscara fotográfica é sanduíche entre o slide revestido de fotoresistista e um disco de vidro. (D) A carcaça da lâmpada UV foi feita de um recipiente de ponta afiada re-proposital. (E) Slide imerso na solução do desenvolvedor. (F) Slide desenvolvido. (G) A solução de DNA modificada por amina se espalhou em regiões padronizadas do slide. (H) Células de fluxo PDMS colocadas em cima de regiões padronizadas do slide. Clique aqui para baixar este arquivo.
Figura Suplementar 2: Alguns exemplos de falhas comuns deste protocolo. (A)(i) Sub-cozimento antes da exposição uv ou recursos de desenvolvimento excessivo pós-exposição pode resultar em características que têm bordas irregulares e podem ser irregulares em tamanho. (ii) Um exemplo de um slide corretamente fotopatterado que tem bordas limpas em torno de características, tamanho de característica uniforme, e nenhuma rachadura óbvia no padrão. Barra de escala = 50 μm. (B) A densidade celular é fundamental para a eficiência de padronização. Ao observar as células no topo do padrão sob um microscópio, poucas lacunas devem existir entre as células, como evidenciado pela imagem do exemplo à esquerda. Barra de escala = 50 μm. (C) As células padronizadas podem ser sensíveis às forças fluidas decorrentes de tubulações excessivamente vigorosas, que podem danificar e desalojar as células padronizadas. Agregados de células multicamadas são particularmente vulneráveis, pois uma célula na parte inferior está suportando uma estrutura de múltiplas células. (i) Uma matriz de agregados celulares incorporados com sucesso em Matrigel. (ii) Uma grade de agregados celulares que se desalojaram como resultado de pipetting viscoso Matrigel muito vigorosamente. (D) O agrupamento de células pode ocorrer, particularmente com células epiteliais. Esses aglomerados geralmente são homotípicos, mas podem ser heterotípicos (células aderindo a células já padronizadas de um tipo diferente) se as células são particularmente pegajosas. A imagem mostra que três populações diferentes de MCF10As foram padronizadas em uma matriz composta por três diferentes pontos de DNA de tamanho único (15 μm). A maioria dos pontos de DNA tem 2-4 células ligadas. O clumping pode ser resolvido pelo tratamento EDTA ou filtrando os aglomerados antes da padronização. Barra de escala = 100 μm. Clique aqui para baixar este arquivo.
Figura suplementar 3: Os fótons sobrepostos resultam na presença de ambos os oligos em menor concentração. Dois oligos ortogonais modificados por amina foram foto-picados sequencialmente, primeiro uma linha vertical (Strand 1), seguido por uma linha horizontal que se sobrepôs a ela (Strand 2). Os oligos foram então visualizados pela hibridização com oligos complementares fluorescentes. (A) Imagem de fluorescência da Strand 1. (B) Quantificação do perfil de fluorescência da Strand 1 sobre uma linha vertical de 100 μm que abrange a sobreposição. (C) Imagem de fluorescência da Strand 2. (D) Quantificação do perfil de fluorescência da Strand 2 sobre uma linha horizontal de 100 μm que abrange a sobreposição. Barra de escala = 50 μm. Clique aqui para baixar este arquivo.
Figura suplementar 4: Quantificação de complexos de DNA na superfície celular em função da concentração de rotulagem de CMO. Os HUVECs foram rotulados com diferentes concentrações de solução CMO, lavados e incubados com uma vertente complementar fluorescente. Um kit de microesfera mesf (moléculas de fluorocromo solúvel equivalente) foi usado para fazer citometria de fluxo quantitativo e estimar o número de complexos de DNA na superfície celular em função da concentração de CMO durante a rotulagem. Clique aqui para baixar este arquivo.
Figura suplementar 5: A rotulagem de CMO não estimula a resposta TLR9. Um experimento foi realizado para ver se a rotulagem de CMO desencadearia o mecanismo de detecção de DNA do TLR9 e se isso seria afetado por CpGs na sequência adapter strand. As células HEK que expressam o mouse TLR9 foram incubadas durante a noite com 0,2 μM de ODN 1826 (um agonista TLR9 contendo CpG), CMO Universal Anchor + Universal Co-Anchor + Adaptador Strand contendo a mesma sequência que ODN 1826 (CMO-CpG), ou CMO Universal Anchor + Universal Co-Anchor + Adapter Strand contendo uma sequência semelhante, mas com substituição dos CpGs por CMO-GPC. A estimulação TLR9 resultaria na produção de SEAP (fosfattase alcalina embrionária secretada). A secreção do SEAP foi quantificada por um ensaio colorimétrico (absorvência). As condições de tratamento foram comparadas com as células de repouso que foram tratadas apenas com PBS. A incubação com CMO-GPC não estimulou a expressão TLR9. A incubação com CMO-CpG foi ligeiramente superior às células de repouso, mas muito inferior à ODN-1826. Clique aqui para baixar este arquivo.
Figura Suplementar 6: Viabilidade das células após o processo de rotulagem de CMO. Para avaliar como o protocolo impacta a viabilidade, os HUVECs foram divididos em quatro populações: uma permaneceu no gelo por 1h, uma foi rotulada simulada com PBS, mas de outra forma tomada através de todas as etapas de centrífugas e lavagem, uma foi rotulada com CMOs, e uma foi rotulada com CMOs e filtrada através de um filtro de 40 μm para remover moitas. As células foram então manchadas com calcein AM e homodimer de ethidium para avaliar o número de células vivas e mortas. Todos os tratamentos resultaram em uma diminuição significativa da viabilidade do que o controle de gelo (ANOVA unidirecional com análise pós-hoc de Tukey), mas a viabilidade mediana para rotulagem de CMO (com ou sem filtragem) foi de cerca de 94%. Dados coletados de três experimentos independentes. * = p < 0,05. = p < 0,0001 Clique aqui para baixar este arquivo.
| Resultado | Causas Possíveis | Correções sugeridas |
| Fotolitografia – características são rachadas | Bolo macio inconsistente ou inadequado | Aumentar o tempo de cozimento macio até 3 minutos; verifique a temperatura real da placa quente e aumente a temperatura conforme necessário |
| Fotolitografia – características não são nítidas ou têm fotoresistista permanecendo dentro delas | Sub-desenvolvimento | Aumentar o tempo que desliza gastar na solução do desenvolvedor; incorporar agitação suave |
| Fotolitografia – características inconsistentes no slide | A luz UV pode não ser centrada ou não se concentrar adequadamente | Ajuste a configuração da luz UV para garantir a luz colidida da intensidade uniforme |
| As células não aderem a pontos padronizados com alta eficiência | Não há DNA suficiente na superfície | Confirme que o DNA está presente na superfície hibridizando o slide com oligos complementares fluorescentes e, em seguida, imagens sob microscópio |
| As células são inadequadamente rotuladas com CMO | Adicione oligos complementares fluorescentes à suspensão celular e confirme a fluorescência através da citometria de fluxo | |
| Não há células suficientes sobre o padrão | Coletar células lavando da célula de fluxo PDMS, centrífuga e re-suspender em menor volume para concentrar as células | |
| CMO muito restante na suspensão celular, hibridizando com DNA no slide | Adicione mais um passo de lavagem. Certifique-se de remover o máximo de sobrenaante possível a cada lavagem. | |
| Muita internalização do CMO devido ao tempo e temperatura | Trabalhar rapidamente após rotular as células com CMO; manter células e deslizar no gelo e usar reagentes gelados | |
| Células se aglomeram | As células não foram adequadamente separadas durante a experimentação | Use PBS + 0,04% EDTA durante lavagens celulares; passar suspensão celular através de filtro de 35 μm antes da lavagem final |
| As células aderem não especificamente | Se em uma área específica – pode ser devido a arranhões no slide, desalinhamento de células de fluxo PDMS ou derramamento de DNA fora da região padrão | Evite arranhões, tenha cuidado para alinhar as células de fluxo PDMS à região padrão |
| Se as células estiverem aderindo em todos os lugares – bloqueio ou lavagem inadequados | Adicione mais lavagens após a padronização das células; pipet mais vigorosamente durante lavagens; bloquear com 1% de BSA por mais tempo antes de iniciar a padronização celular; silanize slide (etapa opcional 3) ou confirme que a silanização foi bem sucedida medindo o ângulo de contato da gotícula de água | |
| Bolhas se formam dentro da célula de fluxo | Erros de pipetação, superfície hidrofílica desigual criada durante a oxidação do plasma | Se as bolhas forem pequenas, adicione PBS à entrada da célula de fluxo e elas podem ser lavadas. Se as bolhas forem maiores, aplique pressão suave na célula de fluxo PDMS, empurrando as bolhas em direção à entrada ou saída. |
| As células inicialmente aderem ao padrão, mas são removidas durante as lavagens, padronização de outros tipos de células ou a adição do precursor do hidrogel | As forças de tesoura de pipetar muito vigorosamente podem fazer com que as células se desprendem da superfície | Pipet mais suavemente durante lavagens subsequentes, rodadas de padronização celular ou adição de precursores de hidrogel. Como os precursores do hidrogel são viscosos, eles são mais propensos a fazer com que o padrão se desaloja, por isso tome cuidado extra. Estruturas multicamadas tendem a ser mais pesadas e são mais suscetíveis a serem desalojadas. |
| Tecidos deformados durante transferência 3D | Hidrogel gruda para deslizar | Confirme a hidroofobidade do slide usando medidas de ângulo de contato |
| Use lâmina de barbear para levantar PDMS totalmente em ambas as bordas, permitindo que o PBS flutue sob o tecido | ||
| Isso pode acontecer com hidrogéis de colágeno puros – considere ajustar a concentração de proteína ou a composição do hidrogel | ||
| As células não se transferem com o hidrogel e permanecem no escorregador | Aumente a concentração de Turbo DNAse ou aumente o tempo de incubação | |
| Hidrogel não é sólido o suficiente | Aumente o tempo de incubação e/ou o mecanismo de gelação para o hidrogel em questão (por exemplo, para colágeno, certifique-se de que o pH esteja correto) | |
| Hidrogel rasga ao remover PDMS | Faça células de fluxo PDMS hidrofílicas usando oxidação plasmática antes do início do experimento para que elas se desprendem facilmente ao adicionar mídia. Use fórceps muito suavemente para desprender o PDMS. |
Tabela 1: Um guia de solução de problemas para identificar e resolver possíveis falhas que possam surgir deste protocolo. Em particular, a má adesão das células ao padrão pode ter muitas causas básicas e este guia deve ajudar na identificação e resolução dessas questões.
Arquivo suplementar 1. Clique aqui para baixar este arquivo.
Arquivo suplementar 2. Clique aqui para baixar este arquivo.
Arquivo suplementar 3. Clique aqui para baixar este arquivo.
Arquivo suplementar 4. Clique aqui para baixar este arquivo.
Discussão
Neste artigo, apresentamos um protocolo detalhado para padronização de alta resolução de células em 2D e 3D para experimentos de cultura celular in vitro. Ao contrário das versões publicadas anteriormente deste método, o protocolo aqui apresentado foca na usabilidade: não requer equipamentos altamente especializados e todos os reagentes podem ser comprados de fornecedores em vez de exigir síntese personalizada. Ao contrário de outros métodos de micropattersão celular, este método é rápido e do tipo celular agnóstico: não requer adesão específica às proteínas da matriz extracelular15. As células padronizadas pelo CMO-DPAC podem ser incorporadas dentro de uma matriz extracelular, como Matrigel ou colágeno, resultando em culturas 3D com resolução espacial muito maior do que é atualmente possível com métodos baseados em impressão de extrusão22. O CMO-DPAC pode ser usado para criar centenas a milhares de recursos microscópicos por slide, permitindo que muitas réplicas sejam realizadas ao mesmo tempo.
Um dos parâmetros mais importantes no sucesso deste protocolo é a densidade de células adicionadas às células de fluxo em cima do slide padronizado. Idealmente, a densidade deve ser de pelo menos 25 milhões de células/mL. Quando carregada nas células de fluxo, essa densidade de células resulta em uma monocamada quase fechada de células acima do padrão(Figura Suplementar 2B). Essas altas densidades celulares maximizam a probabilidade de uma célula se estabelecer diretamente em cima de um ponto de DNA e aderir. Reduzir a densidade celular diminuirá a eficiência global de padronização. Outro passo crítico neste protocolo é suspender completamente as células em mídia PBS ou sem soro antes de adicionar a solução CMO. A partição cmos muito rapidamente em membranas celulares e adicionar a solução CMO diretamente a uma pelota celular resultará em rotulagem heterogênea de células. Depois de adicionar a solução CMO à suspensão da célula, é importante misturar-se completamente por pipetação para que as células sejam uniformemente rotuladas com os CMOs. Após as incubações, é necessário lavar completamente o excesso de CMOs através de múltiplas centrifugações e lavar passos. O CMO livre de excesso presente na suspensão celular se ligará ao DNA modificado por amina padronizado na lâmina de vidro, bloqueando a hibridização e a adesão das células modificadas pelo CMO em suspensão. O tempo também é uma consideração fundamental para este protocolo. É importante trabalhar o mais rápido possível ao usar CMOs e manter as células no gelo, a fim de minimizar a internalização dos CMOs e maximizar a viabilidade celular. Experimentos de citometria de fluxo mostraram que os CMOs não persistem tanto tempo na superfície celular quanto os LMOs, com perda de 25% dos complexos de CMO ao longo de duas horas de incubação no gelo36. Além disso, a viabilidade das células diminuirá à medida que o tempo de manuseio da célula aumenta. A viabilidade pode ser maximizada trabalhando rapidamente, mantendo células no gelo, usando reagentes gelados e usando mídia livre de soro para fornecer alguns nutrientes.
Embora o CMO-DPAC possa ser uma maneira poderosa de estudar biologia celular, padronizando células com alta precisão, ele tem suas limitações. Os experimentos do CMO-DPAC podem ser desafiadores, particularmente porque a complexidade experimental é adicionada com vários tipos de células, camadas ou cultura celular 3D(Arquivo Suplementar 1). Falhas experimentais podem ser comuns ao iniciar este protocolo, conforme descrito na Tabela 1. Por isso, recomendamos que os usuários instituam verificações de controle de qualidade (confirmando que o DNA está presente no slide, confirmando que as células são suficientemente rotuladas com DNA (Etapa 8), confirmando que o excesso de células foi completamente lavado, etc.) para garantir que o experimento tenha sucesso e identificar etapas que possam exigir maior otimização. Esperamos que as informações fornecidas neste manuscrito e seus arquivos suplementares ajudem a facilitar qualquer solução de problemas necessária.
O colesterol é uma molécula bioativa cuja internalização pode influenciar o metabolismo celular, a expressão genética e a fluidez da membrana37,38. Um estudo anterior comparou os efeitos na expressão genética de células rotuladas por CMO e LMO usando sequenciamento de RNA de célula única. As células HEK rotuladas por CMO alteraram a expressão genética em comparação com as células não rotuladas e rotuladas por LMO36. A rotulagem de células com CMOs resultou na expressão diferencial (> 1,5 vezes) de oito genes relativos a controles não rotulados, incluindo AP2B1, que tem sido ligado ao colesterol e ao transporte de sphingolipid (GeneCards), e MALAT1, um longo RNA não codificador que regula o acúmulo de colesterol39. Embora menores, essas respostas transcricionais podem, no entanto, ser preocupantes se o experimento em questão estiver estudando metabolismo, dinâmica de membrana ou outras vias associadas ao colesterol nas células.
Este protocolo é flexível e pode ser ajustado para atender às necessidades de cada experimento. Como o CMO se insere na membrana lipídica em vez de usar qualquer receptor específico, o método é agnóstico do tipo celular (HUVECs, MCF10As, HEKs e MDCKs foram demonstrados aqui). Embora o colesterol seja uma âncora hidrofóbica diferente dos nossos LMOs publicados anteriormente, até agora descobrimos que eles se comportam da mesma forma. Assim, esperamos que os CMOs trabalhem com qualquer uma das grandes variedades de tipos celulares que já publicamos anteriormente com LMOs, incluindo, mas não se limitando a células-tronco neurais, fibroblastos, células mononucleares de sangue periféricos, células tumorais e células epiteliais mamárias primárias6,23,27,29,36 . A rotulagem CMO não estimula o TLR9, sugerindo que o protocolo é compatível com células imunes. A incorporação da membrana do CMO é uma função do tamanho total da célula e do grau de carga negativa na célula glicocalyx35. Assim, incluímos um protocolo (Passo 8) para testar a extensão da incorporação da membrana que é favorável à rápida otimização. As características específicas de cada padrão celular inevitavelmente variam de acordo com o design experimental (consulte Arquivo Suplementar 1 para obter mais orientação). Embora o protocolo de fotopatterning descrito acima para padronização do DNA seja recomendado, qualquer método de confinar espacialmente gotículas de solução de DNA de amina deve funcionar, como o uso de impressoras de gotícula de alta resolução. A resolução do padrão e o espaçamento mínimo do recurso variam de acordo com o método utilizado. Também é teoricamente possível combinar as seções de fotopatterning de DNA deste protocolo com outros métodos que têm sido usados para rotular células com DNA, como com DNA hibridizado aos dedos de zinco expressos em membrana40,usando DNA conjugado pelo NHS41,e reagendo resíduos de ácido sálico na superfície celular com DNA conjugado por fosfina42 . O CMO-DPAC pode ser aplicado a uma variedade de experimentos que requerem controle rigoroso sobre o espaçamento celular-célula, incluindo estudos das interações entre pares de células, experimentos de co-cultura olhando para a transferência de sinais de células "remetentes" para células "receptoras" e investigações do efeito de pistas extracelulares próximas na diferenciação de células-tronco6,29 . O método também pode ser usado para criar microtissues que podem ser usados para estudar a migração celular em três dimensões, a auto-organização das células nos tecidos23,27, e a interação dinâmica entre as células e o ECM27. Esperamos que este protocolo forneça aos pesquisadores uma plataforma acessível para explorar novas aplicações de padronização celular baseada em DNA de alta resolução em seus próprios laboratórios.
Divulgações
Z.J.G. é conselheiro e detentor de patrimônio em Biociências de Provenance.
Agradecimentos
Os autores gostariam de agradecer a Jeremy Garcia por testar este protocolo e Bhushan Kharbikar por fornecer treinamento sobre os equipamentos no Núcleo de Micro e Nanotecnologia Biomédica da UCSF. Esta pesquisa foi apoiada em parte por doações do Programa de Pesquisa do Câncer de Mama do Departamento de Defesa (W81XWH-10-1-1023 e W81XWH-13-1-0221), NIH (U01CA199315, DP2 HD080351-01, 1R01CA190843-01, 1R21EB019181-01A, e 1R21CA182375-01A1), nsf (MCB1330864) e o Centro de Construção Celular da UCSF (DBI-1548297), um Centro de Ciência e Tecnologia da NSF. O.J.S foi financiado por uma Bolsa de Pesquisa de Pós-Graduação da NSF, uma bolsa de estudos da Siebel, e uma bolsa de estudos para P.E.O. Z.J.G e A.R.A. são investigadores do Chan-Zuckerberg BioHub.
Materiais
| Name | Company | Catalog Number | Comments |
| 2-well Chambered Coverglass w/ non-removable wells | Thermo Fisher Scientific | 155379 | |
| Acetic Acid | Sigma-Aldrich | A6283 | |
| Adapter with External SM1 Threads and Internal SM3 Thread | ThorLabs | SM3A1 | |
| Aldehyde Functionalized Slides | Schott | Nexterion Slide AL | Store under dry conditions after opening. |
| All Plastic Syringes, 1 mL | Fisher Scientific | 14-817-25 | |
| Amine-Modified DNA Oligo | IDT | n/a | See Supplemental File 1 for suggested sequences. |
| Aspheric Condenser Lens | ThorLabs | ACL7560 | |
| Borosilicate Disc, 6in Diameter X 1/2in Thick | Chemglass | CG-1906-23 | |
| Cell Culture Dishes 60x15 mm style | Corning | 353002 | |
| Cholesterol-Modified Oligo | IDT | n/a | See Supplemental File 1 for suggested sequences. |
| Diamond Scribe | Excelta | 475B | |
| DNA Oligonucleotide | IDT | n/a | See Supplemental File 1 for suggested sequences. |
| DPBS, no calcium, no magnesium | Thermo Fisher Scientific | 14190250 | |
| Isopropyl Alcohol | Sigma-Aldrich | 278475 | |
| Matrigel Matrix, Growth Factor Reduced | Corning | 354230 | |
| Methylene Chloride (Stabilized/Certified ACS) | Fisher Scientific | D37-4 | |
| MF-321 Developer | Kayaku Advanced Materials | n/a | |
| Microposit S1813 Positive Photoresist | Kayaku Advanced Materials | n/a | |
| Ø3" Adjustable Lens Tube, 0.81" Travel | ThorLabs | SM3V10 | |
| Oven | Thermo Scientific | 51-028-112H | |
| PE-50 Compact Benchtop Plasma Cleaning System | Plasma Etch | PE-50 | |
| Photomask (custom) | CAD/Art Services | n/a | Minimum feature size guaranteed by CAD/Art Services is 10 microns. |
| Razor Blades | Fisher Scientific | 12-640 | |
| RCT Basic Hot Plate | IKA | 3810001 | |
| Silicon Wafer (100 mm) | University Wafer | 590 | |
| Sodium Borohydride, 98%, granules | Acros Organics | 419471000 | |
| Spin Coater Kit | Instras | SCK-200 | This is a low cost option, but any spin coater that can maintain a speed of 3000 rpm will suffice. |
| SU-8 2075 | Microchem | Y111074 0500L1GL | |
| SU-8 Developer | Microchem | Y020100 4000L1PE | |
| Sylgard 184 Silicone Elastomer Kit | Dow | 2646340 | |
| Syringe Needles | Sigma-Aldrich | Z192341 | |
| T-Cube LED Driver, 1200 mA Max Drive Current | ThorLabs | LEDD1B | |
| Tridecafluoro-1,1,2,2-tetrahydrooctyl dimethylchlorosilane | Gelest | SIT8170.0 | |
| Triethylamine | Sigma-Aldrich | 90335 | |
| Turbo DNase | Thermo Fisher Scientific | AM2238 | |
| Tweezers Style N7 | VWR | 100488-324 | The curved shape of these tweezers is essential for delicately picking up the PDMS flow cells containing patterned tissues. |
| UV LED (365 nm, 190 mW (Min) Mounted LED, 700 mA) | ThorLabs | M365L2 | |
| Wafer Tweezers | Agar Scientific | T5063 | |
| WHEATON Dry-Seal vacuum desiccator | Millipore Sigma | W365885 |
Referências
- Kreeger, P. K., Strong, L. E., Masters, K. S. Engineering approaches to study cellular decision-making. Annual Review of Biomedical Engineering. , 49-72 (2018).
- Goubko, C. a., Cao, X. Patterning multiple cell types in co-cultures: A review. Materials Science and Engineering C. 29 (6), 1855 (2009).
- Sun, W., et al. The bioprinting roadmap. Biofabrication. 12 (2), 022002 (2020).
- Liu, W. F., Chen, C. S. Cellular and multicellular form and function. Advanced Drug Delivery Reviews. 59 (13), 1319-1328 (2007).
- Duffy, R. M., Sun, Y., Feinberg, A. W. Understanding the role of ECM protein composition and geometric micropatterning for engineering human skeletal muscle. Annals of Biomedical Engineering. 44 (6), 2076-2089 (2016).
- Chen, S., et al. Interrogating cellular fate decisions with high-throughput arrays of multiplexed cellular communities. Nature Communications. 7, 10309 (2016).
- Shaya, O., et al. Cell-cell contact area affects notch signaling and notch-dependent patterning. Developmental Cell. 40 (5), 505-511 (2017).
- Rao, N., et al. A co-culture device with a tunable stiffness to understand combinatorial cell-cell and cell-matrix interactions. Integrative Biology. 5 (11), 1344 (2013).
- Sriraghavan, V., Desai, R. A., Kwon, Y., Mrksich, M., Chen, C. S. Micropatterned dynamically adhesive substrates for cell migration. Langmuir. 26 (22), 17733-17738 (2010).
- Wong, L., Pegan, J. D., Gabela-Zuniga, B., Khine, M., McCloskey, K. E. Leaf-inspired microcontact printing vascular patterns. Biofabrication. 9 (2), 021001 (2017).
- Chen, T. H., et al. Directing tissue morphogenesis via self-assembly of vascular mesenchymal cells. Biomaterials. 33 (35), 9019-9026 (2012).
- Laurent, J., et al. Convergence of microengineering and cellular self-organization towards functional tissue manufacturing. Nature Biomedical Engineering. 1 (12), 939-956 (2017).
- Lin, C., Khetani, S. R. Micropatterned co-cultures of human hepatocytes and stromal cells for the assessment of drug clearance and drug-drug interactions. Current Protocols in Toxicology. 2017, 1-23 (2017).
- Hui, E. E., Bhatia, S. N. Micromechanical control of cell-cell interactions. Proceedings of the National Academy of Sciences of the United States of America. 104 (14), 5722-5726 (2007).
- D'Arcangelo, E., McGuigan, A. P. Micropatterning strategies to engineer controlled cell and tissue architecture in vitro. BioTechniques. 58 (1), 13-23 (2015).
- Martinez-Rivas, A., González-Quijano, G. K., Proa-Coronado, S., Séverac, C., Dague, E. Methods of micropatterning and manipulation of cells for biomedical applications. Micromachines. 8 (12), (2017).
- Lee, S., et al. Simple lithography-free single cell micropatterning using laser-cut stencils. Journal of Visualized Experiments. (158), e60888 (2020).
- Strale, P. O., et al. Multiprotein printing by light-induced molecular adsorption. Advanced Materials. 28 (10), 2024-2029 (2016).
- Melero, C., et al. Light-induced molecular adsorption of proteins using the primo system for micro-patterning to study cell responses to extracellular matrix proteins. Journal of Visualized Experiments. (152), e60092 (2019).
- Reid, J. A., Mollica, P. M., Bruno, R. D., Sachs, P. C. Consistent and reproducible cultures of large-scale 3D mammary epithelial structures using an accessible bioprinting platform. Breast Cancer Research. , 1-13 (2018).
- Wang, Z., Lee, S. J., Cheng, H. -. J., Yoo, J. J., Atala, A. 3D bioprinted functional and contractile cardiac tissue constructs. Acta Biomaterialia. 70, 48-56 (2018).
- Miri, A. K., et al. Effective bioprinting resolution in tissue model fabrication. Lab on a Chip. 19 (11), 2019-2037 (2019).
- Todhunter, M. E., et al. Programmed synthesis of three-dimensional tissues. Nature Methods. 12 (10), 975-981 (2015).
- Todhunter, M. E., Weber, R. J., Farlow, J., Jee, N. Y., Gartner, Z. J. Fabrication of 3D microtissue arrays by DNA programmed assembly of cells. Current Protocols in Chemical Biology. 8 (3), 147-178 (2016).
- Csizmar, C. M., Petersburg, J. R., Wagner, C. R. Programming cell-cell interactions through non-genetic membrane engineering. Cell Chemical Biology. 25 (8), 931-940 (2018).
- Weber, R. J., Liang, S. I., Selden, N. S., Desai, T. A., Gartner, Z. J. Efficient targeting of fatty-acid modified oligonucleotides to live cell membranes through stepwise assembly. Biomacromolecules. 15 (12), 4621-4626 (2014).
- Hughes, A. J., et al. Engineered tissue folding by mechanical compaction of the mesenchyme. Developmental Cell. 44 (2), 165-178 (2018).
- Weber, R. J., et al. Rapid organoid reconstitution by chemical micromolding. ACS Biomaterials Science & Engineering. 2 (11), 1851-1855 (2016).
- Scheideler, O. J., et al. Recapitulating complex biological signaling environments using a multiplexed, DNA-patterning approach. Science Advances. 6 (12), (2020).
- Viola, J. M., et al. Guiding cell network assembly using shape-morphing hydrogels. Advanced materials (Deerfield Beach, Fla.). , 2002195 (2020).
- Mohammad, A., Davis, M., Aprelev, A., Ferrone, F. A. Note: Professional grade microfluidics fabricated simply. Review of Scientific Instruments. 87 (10), 1-4 (2016).
- Lee, O. J., Chuah, H. S., Umar, R., Chen, S. K., Yusra, A. F. I. Construction of cost effective homebuilt spin coater for coating amylose-amylopectin thin films. Journal of Fundamental and Applied Sciences. 9 (2), 279 (2018).
- Webb, K., Hlady, V., Tresco, P. A. Relative importance of surface wettability and charged functional groups on NIH 3T3 fibroblast attachment, spreading, and cytoskeletal organization. Journal of Biomedical Materials Research. 41 (3), 422-430 (1998).
- Processing Guidelines for: SU-8 2025, SU-8 2035, SU-8 2050, SU-8 2075. Microchem SU-8 2000 Permanent Expoxy Negative Photoresist Available from: https://kayakuam.com/wp-content/uploads/2019/09/SU-82000DataSheet2025thru2075Ver4.pdf (2019)
- Palte, M. J., Raines, R. T. Interaction of nucleic acids with the glycocalyx. Journal of the American Chemical Society. 134 (14), 6218-6223 (2012).
- McGinnis, C. S., et al. MULTI-seq: sample multiplexing for single-cell RNA sequencing using lipid-tagged indices. Nature Methods. 16 (7), 619-626 (2019).
- Maxfield, F. R., van Meer, G. Cholesterol, the central lipid of mammalian cells. Current Opinion in Cell Biology. 22 (4), 422-429 (2010).
- Luo, J., Yang, H., Song, B. L. Mechanisms and regulation of cholesterol homeostasis. Nature Reviews Molecular Cell Biology. 21 (4), 225-245 (2020).
- Liu, L., Tan, L., Yao, J., Yang, L. Long non-coding RNA MALAT1 regulates cholesterol accumulation in ox-LDL-induced macrophages via the microRNA-17-5p/ABCA1 axis. Molecular Medicine Reports. 21 (4), 1761-1770 (2020).
- Mali, P., Aach, J., Lee, J. H., Levner, D., Nip, L., Church, G. M. Barcoding cells using cell-surface programmable DNA-binding domains. Nature Methods. 10 (5), 403-406 (2013).
- Hsiao, S. C., et al. Direct cell surface modification with DNA for the capture of primary cells and the investigation of myotube formation on defined patterns. Langmuir. 25 (12), 6985-6991 (2009).
- Gartner, Z. J., Bertozzi, C. R. Programmed assembly of 3-dimensional microtissues with defined cellular conductivity. Proceedings of the National Academy of Sciences. (17), 1-5 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados