Method Article
نموذج مورين أومايا زينوغرافت لدراسة العلاج المباشر المستهدف لمرض اللبتومينينجال
In This Article
Summary
هنا، ونحن نصف نموذج زينوغرافت مورين الذي يشبه وظيفيا خزان أومايا في المرضى. طورنا مورين أوميا لدراسة العلاجات الجديدة لمرض اللبتومينينيال القاتل عالميا.
Abstract
مرض اللبتومينينجال (LMD) هو نوع غير شائع من انبثاث الجهاز العصبي المركزي (CNS) إلى السائل الشوكي الدماغي (CSF). السرطانات الأكثر شيوعا التي تسبب LMD هي سرطان الثدي والرئة وسرطان الجلد. المرضى الذين تم تشخيصهم مع LMD لديهم تشخيص سيئة للغاية والبقاء على قيد الحياة عموما لبضعة أسابيع أو أشهر فقط. أحد الأسباب المحتملة لعدم فعالية العلاج الجهازي ضد LMD هو الفشل في تحقيق تركيزات فعالة علاجيا من المخدرات في CSF بسبب حاجز الدم الدماغي السليم وغير منفذ نسبيا (BBB) أو حاجز الدم CSF عبر الضفيرة المشيمية. لذلك، قد إدارة مباشرة المخدرات داخل الثكال أو intraventricularly التغلب على هذه الحواجز. وقد وضعت هذه المجموعة نموذجا يسمح لتقديم فعال للعلاجات (أي الأدوية والأجسام المضادة والعلاجات الخلوية) بشكل مزمن وأخذ عينات متكررة من CSF لتحديد تركيزات المخدرات والتحوير المستهدف في CSF (عندما يتم استهداف البيئة الدقيقة الورم في الفئران). النموذج هو ما يعادل مورين من خزان أومايا متوافق مع التصوير بالرنين المغناطيسي، والذي يستخدم سريريا. وقد تم تعيين هذا النموذج، الملصق على الجمجمة، باسم "مورين أومايا". كدليل علاجي على المفهوم ، تم تسليم مستقبلات عامل نمو البشرة البشرية 2 الأجسام المضادة (استنساخ 7.16.4) إلى CSF عبر Murine Ommaya لعلاج الفئران المصابة بال LMD من مستقبلات عامل نمو البشرة البشرية 2 إيجابية سرطان الثدي. وOmmaya مورين يزيد من كفاءة تسليم المخدرات باستخدام منفذ وصول مصغرة ويمنع هدر المخدرات الزائدة; لا تتداخل مع أخذ عينات CSF للدراسات الجزيئية والمناعية. وOmmaya مورين مفيد لاختبار العلاجات الرواية في النماذج التجريبية من LMD.
Introduction
مرض اللبتومينينجال (LMD) هو الانبثاث العدواني في مرحلة متأخرة من الجهاز العصبي المركزي ، حيث الخلايا السرطانية الوصول إلى CSF والتسلل إلى سطح الدماغ والحبل الشوكي1. وتشمل أنواع السرطان الأكثر شيوعا التي تسبب LMD تلك الثدي والرئة، فضلا عن سرطان الجلد2. ينتج عن LMD عدد من الأعراض والعلامات العصبية مثل الصداع والشلل العصبي القحفي وتصلب الرقبة وامراض الراديكولوباث. تشخيص المرضى الذين يعانون من LMD عموما سيئة جدا (يقاس متوسط البقاء على قيد الحياة في أسابيع) وقاتلة عالميا3,4,5,6,7. العلاج بالجراحة والإشعاع والعلاج الكيميائي الجهازي هو علاج ملطف. قد يفشل العلاج الجهازي لLMD بسبب عدم كفاية اختراق الدواء في CSF عبر BBB سليمة أو حاجز الدم CSF عبر الضفيرة المشيمية1.
لذلك ، قد إدارة علاجات السرطان (على سبيل المثال ، الأدوية والعلاجات القائمة على الأجسام المضادة بما في ذلك مثبطات نقاط التفتيش والعلاجات الخلوية) مباشرة في CSF التغلب على هذا القيد8. الوصول وأخذ العينات CSF من المرضى ممكن من خلال خزان أومايا التي يتم زرعها تحت فروة الرأس. يسمح هذا الجهاز بإدارة عوامل السرطان (على سبيل المثال، الميثوتريكسات و trastuzumab) وكذلك أخذ عينات من CSF للدراسات التشخيصية (على سبيل المثال، التشخيص الخلوي ل LMD لرصد الاستجابات للعلاج) دون إجراء نقرة في العمود الفقري. تم تصميم خزان مورين أومايا لمحاكاة تلك المستخدمة سريريا. يتطلب الخزان تجميع منفذ الوصول وقطع المسافة وتعديل تقنية قنية الماوس ، والتي تسمح للجهاز بالبقاء سليما بشكل دائم طوال مدة دراسة الدواء. وقد تم تعيين هذا الجهاز باسم "مورين أومايا".
على النقيض من تقنية مضخة ضخ التناضح ، والتي تتطلب إعداد كميات السائل الزائدة لملء المساحة الفارغة في الأنابيب والضخ المستمر على الحقنالمتكررة 9، يقلل Murine Ommaya من إهدار حلول الأدوية. وهو يسمح بالإدارة الفعالة لجرعات واحدة متعددة من العلاجات في أي وقت بكميات صغيرة (3-7 ميكرولتر) في CSF باستخدام حقنة هاملتون ، ومنفذ وصول مصغر ، وحقن تلقائي. في الوقت الحقيقي ، يمكن تحديد فعالية أدوية الاختبار ضد LMD عن طريق التصوير. باستخدام هذا النهج، يمكن اختبار مجموعة متنوعة من العلاج الكيميائي والأجسام المضادة والعلاجات المناعية للخلايا (كعوامل واحدة أو مجتمعة) ضد LMD لترجمة نتائج الجسم الحي إلى استراتيجيات علاج عقلانية للمرضى. لزيادة تحسين القدرة على التصوير لنموذج xenograft مشتق من المريض (PDX) من LMD ، تم التعاون مع الشركة المصنعة لتطوير نسخة متوافقة مع التصوير بالرنين المغناطيسي (MRI) من مورين أومايا ، والتي لا تتطلب أي تجميع وجاهزة للاستخدام. إن قدرة التصوير بالرنين المغناطيسي مفيدة ، خاصة بالنسبة لنماذج PDX التي تكون فيها كمية الخلايا السرطانية المتداولة (CTCs) من CSF هي في بعض الأحيان العامل المقيد ، وفي كثير من الأحيان عندما تكون CTCs السابقة للتشفير غير مجدية.
تصف هذه الورقة بروتوكول مفصل يبدأ بحقن CTCs لتقديم الفئران مع LMD . ثم يتم زرع مورين أومايا جراحيا، ويتم تنفيذ خطوات متعددة للعلاج من المخدرات عن طريق مورين أومايا. كدليل على مفهوم للمظاهرة، تم إجراء مقارنة في الجسم الحي جنبا إلى جنب، والتي تم تسليم مورين الإنسان مستقبلات عامل نمو البشرة 2 (Her2) الأجسام المضادة تسمى استنساخ 7.16.4 (المعادل البشري من trastuzumab)10. يستهدف الجسم المضاد Her2+ خلايا سرطان الثدي إما عن طريق مورين أومايا (العلاج المباشر المستهدف أو داخل الرحم) أو عن طريق الحقن داخل الصفاق (العلاج الجهازي). وأظهرت النتائج أن الفئران مع LMD التي تلقت العلاج المناعي داخل الثكال مباشرة عاش لفترة أطول بكثير من تلك التي عولجت مع نفس العلاج بشكل منهجي. وتراجعت الانبثاث CNS في الفئران المعالجة عن طريق أومايا مورين تماما تقريبا من الجرعة الثالثة من الأسبوع الثالث من العلاج، مما أدى إلى تحسين البقاء على قيد الحياة بشكل عام.
Protocol
تمت الموافقة على البروتوكول من قبل لجنة الرعاية والاستخدام المؤسسية للحيوانات في جامعة جنوب فلوريدا (IS00005974).
1. حقن CTCs في CSF لتوليد نموذج LMD الماوس
- إعداد لجان مكافحة الإرهاب
- حساب عدد CTCs اللازمة للحقن، وإعداد تعليق خلية واحدة في 1.0 × 104 خلايا / ميكرولتر في المالحة المعقمة الفوسفات المخزنة (PBS). ضع تعليق الخلية على الثلج أو عند درجة حرارة 4 درجات مئوية طوال العملية.
ملاحظة: عند استخدام خطوط الخلايا التي تتطلب المحاولة، تأكد من غسل الخلايا مرتين مع برنامج تلفزيوني عقيم لإزالة التريبسين. إجراء تعداد الخلايا باستخدام مقياس الدم أو عداد الخلايا الآلي. إذا تم استخدام مجموعة كبيرة (>50 فأرا)، قم بسرد الخلايا والتحقق من صلاحية الخلية بين الحقن لضمان إعطاء عدد ثابت من الخلايا لكل فأر.
- حساب عدد CTCs اللازمة للحقن، وإعداد تعليق خلية واحدة في 1.0 × 104 خلايا / ميكرولتر في المالحة المعقمة الفوسفات المخزنة (PBS). ضع تعليق الخلية على الثلج أو عند درجة حرارة 4 درجات مئوية طوال العملية.
- إجراء ما قبل الجراحة
- حقن الماوس تحت الجلد مع 1 ملغم/ كغ البوبرينورفين المستدامة الإفراج (Bup-SR).
ملاحظة: لا تحقن منطقة الشق المقترح. اختيار موقع الحقن بعيدا عن الكتف. - تخدير الماوس مع 2-3٪ isoflurane حتى أنه لا يظهر أي علامات على رد الفعل الحق. بالإضافة إلى ذلك، تحقق من وجود منعكس الذيل و/أو قرصة مخلب لتأكيد حالة التخدير.
- قم بإعداد الماوس لإجراء عملية جراحية في مكان بعيد عن منطقة التشغيل. قص موقع الجراحة (أي السطح الظهري للجمجمة) مع مساحة حدودية كافية لمنع الفراء من تلويث موقع الشق؛ ثم تشبع الموقع بمطهر الجلد المبيد للجراثيم ، وتعمل من مركز الموقع إلى المحيط ، ثم تسمح بالجفاف. ضعي إما ستارة معقمة أو مادة بلاستيكية معقمة تدعمها مادة لاصقة لحماية الموقع الجراحي من التلوث.
ملاحظة: يجب أن يتم تعقيم الأدوات تلقائيا مسبقا وإعادة تعقيم النصائح بين الحيوانات باستخدام معقم حبة زجاجية. - حلق الفراء من كامل سطح البطن من الرأس، وإعداد الجلد باستخدام تقنية معقمة.
- وضع الأنف مع تعديل مخروط الأنف على شكل حرف L من الجهاز المجسم، وضمان nares تبقى واضحة ومفتوحة. باستخدام الشريط عبر الأسطح البطنية لكل من pinnae، سحب الجلد بلطف إلى الأمام لتأمينه إلى مخروط الأنف، وثني الرقبة بزاوية 90 درجة تقريبا مرة واحدة المضمون. إدارة 1.5٪ isoflurane للحفاظ على التخدير.
ملاحظة: سيؤدي تحديد المواقع المناسبة إلى عرض منطقة الشق بطريقة تسمح بالتعرف بسهولة على الحافة الودودة للعظم القذالي. - وضع الجسم لضمان الحفاظ على مستوى العمود الفقري مع ماجنا cisterna، وبينما تطبيق الجر طفيف على الذيل، ووضع الشريط في قاعدة الذيل لتأمين.
- حقن الماوس تحت الجلد مع 1 ملغم/ كغ البوبرينورفين المستدامة الإفراج (Bup-SR).
- حقن ماجنا cisterna الجراحية
- مع الرقبة في التمديد الكامل، وتبدأ فقط بين بينا، تشغيل نصائح مقص الجراحية إلى أسفل مع ضغط طفيف عبر العظام القذالي.
ملاحظة: بينما في هذا الموقف خط الوسط، والاكتئاب الصغيرة ملحوظ عندما نصائح مقص تراجع في منطقة مقعرة على ماجنا cisterna. - جعل شق خط الوسط صغير 3-5 ملم فقط فوق الارتجاج palpated. رسم 5 ميكرولتر من تعليق الخلية في 1.0 × 104 خلايا / ميكرولتر (مجموع 5.0 × 104 خلايا) في حقنة هاميلتون 30 G.
- استخدام ملقط حادة الرؤوس مع نصائح 1-2 ملم للضغط بلطف إلى أسفل على ماجنا cisterna. تقديم نصائح في موقف مغلق وفتحها في حين تطبيق الضغط النزولي على دورا.
- كرر تشريح حادة وصفها في الخطوة السابقة حتى يتم التعرف بسهولة على الغشاء الجافي، والأوعية الدموية المرتبطة بها مرئية في المنطقة المعرضة.
ملاحظة: تضمن نافذة الحقن الناتجة عدم تعرض الأوعية الدموية للضرر أثناء إدخال الإبرة. - في حين عقد ملقط مفتوحة للتراجع عن العضلات المحيطة بها، وإدخال إبرة 30 G غير coring تحت دورا لتصور شطبة. تأكد من إدخال الإبرة فقط خارج شطبة نفسها. نشر ببطء المكبس حقنة، وتسليم الخلايا فقط تحت دورا.
- وضع بشكل صحيح شطبة لمراقبة الحقن تحت دورا. إدارة بعناية هذه التقنية، واستخدام إبرة 30 G غير اللصاق لمنع تلف الغشاء وضمان الحد الأدنى من التسرب. إذا لوحظ التسرب، وتطبيق ضغط لطيف مع قضيب القطن يميل.
- أغلق الجلد عن طريق وضع مقطع جرح أو قطرة صغيرة من لاصق الجلد. بمجرد إجراء الحقن بنجاح ، اسمح للفئران بالتعافي من التخدير على بطانية دافئة ، ومراقبتها باستمرار حتى تتمكن من الحفاظ على وضعية القص وإظهار حركة هادفة.
- مراقبة الفئران يوميا بعد الجراحة للأسبوع الأول. إذا كان الماوس يبدو أن في الألم أو الضيق, علاجه مع 10 ملغ / كغ حقن تحت الجلد من carprofen مرة واحدة كل 12 إلى 24 ساعة لمدة تصل إلى 5 أيام على أساس التشاور البيطري والتوجيه. السماح للفئران لاسترداد ورصدها لمدة 48 إلى 72 ساعة على الأقل قبل الشروع في الخطوة التالية.
ملاحظة: Bup-SR، نظرا وقائيا، وسوف تستمر حتى 72 ساعة، لذلك المسكنات إضافية ليست ضرورية عادة. ومع ذلك ، سيتم توفير مسكن إضافي للحيوانات حسب الضرورة (إذا كان الخمول ، وليس الأكل ، كشكش). إذا كان موقع جراحي يطور علامات العدوى بعد العملية الجراحية (أي احمرار، تورم، حنان، الوهن، فرط المسكنات، فرط الاعتلال، أو التحام)، أو إذا كان الماوس يحرس المنطقة المصابة، قتل الفأر. إذا تم حقن الخلايا السرطانية بنجاح في CSF، LMD وتطور الورم سوف تتطور في الجهاز العصبي المركزي في غضون 1 أو 2 أسابيع (اعتمادا على أنواع CTCs أو خط الخلية المستخدمة) (الشكل 1).
- مع الرقبة في التمديد الكامل، وتبدأ فقط بين بينا، تشغيل نصائح مقص الجراحية إلى أسفل مع ضغط طفيف عبر العظام القذالي.
2. مورين أومايا التجميع والزرع
- إعداد المحطة
- تطهير سطح المحطة. ضع غطاء أزرق فوق السطح، واستعد لجميع الأدوات والمستلزمات المعقمة المشار إليها في الشكل 2.
- إجراء ما قبل الجراحة
- تطبيق مسكن (Bup-SR)، والحفاظ على تقنية معقمة كما هو موضح في القسم 1.2.
- الزرع الجراحي لمورين أومايا
- تجميع جهاز حقن مورين أومايا باستخدام منفذ حقن مصغر 25 G (قطر خارجي 0.51 مم) وقرص فاصل 1 ملم. استخدام لاصقة معقمة سيانواكريلات لضمان اختراق ما يقرب من 2.5 مم من قنية معدنية في نصف الكرة الدماغي الأيمن(الشكل 3A-C).
ملاحظة: تم تطوير نموذج أولي ماوس أومايا متوافق مع التصوير بالرنين المغناطيسي في هذا المختبر ، والذي يحتوي بالفعل على كلا الجزءين (منفذ حقن مصغر ومتباعد) مطبوع ثلاثي الأبعاد معا كوحدة واحدة(الشكل 3D). تم اختبار إصدار وحدة واحدة عن طريق التصوير بالرنين المغناطيسي ويمكن توفير الوقت عن طريق القضاء على خطوة التجميع. - تخدير الماوس مع 2-3٪ isoflurane حتى لا تكون هناك علامات على رد الفعل الحق. علاوة على ذلك، تحقق من وجود منعكس الذيل و/ أو قرصة مخلب لتأكيد حالة التخدير.
- حلق كامل سطح البطن من رأس الفراء، وإعداد الجلد وفقا لتقنية معقمة، كما هو موضح سابقا في الخطوة 1.2.3. ضع الماوس في الجهاز المجسم مع مخروط الأنف لمواصلة إدارة isoflurane أثناء الإجراء. انخفاض ايزوفلوران إلى 1.5٪. قم بشد قضبان الأذن برفق لتأمين الرأس، وتطبيق مواد تشحيم العين لتغطية عيون الماوس.
- إجراء شق الجلد صغيرة (3 ملم)، تليها تشريح حادة من الأنسجة تحت الجلد الكامنة لفضح الجمجمة. جفف الجمجمة باستخدام عصي قضيب القطن المنقوعة ببيروكسيد الهيدروجين.
- حفر ثقب في الجمجمة 0.5 ملم الخلفي و 1.1 ملم الجانبية من bregma- النقطة التشريحية على الجمجمة حيث يتم تقاطع خياطة التاجي عموديا بواسطة خياطة القوس (الشكل 3A) - فضلا عن ثقب بور 0.9 ملم لفضح ماتر دورا. تحريك microdrill جانبا، ويسجل بلطف العظام المحيطة مباشرة ثقب بور قبل إدخال منفذ الحقن (عمق ما يقرب من 2.5 ملم)، الملصقة على الجمجمة باستخدام لاصقة معقمة سيانواكريلات. خياطة الدولة حول بقعة الحقن باستخدام 4-0 خياطة النايلون عدم امتصاص في نمط غرزة توقف أو خياطة سلسلة محفظة11.
- فئران ما بعد الجراحة في أقفاص فردية للتعافي من الجراحة.
ملاحظة: من الممكن أن تأتي Murine Ommaya عندما يتم إيواء فئران متعددة تم استردادها من الجراحة في نفس القفص ، ربما بسبب تفاعلات العبث المستمرة. من المستحسن أن يتم إيواء الفئران المزروعة في مورين أومايا بشكل فردي (أو ما لا يزيد عن فأرين لكل قفص) على مدار تجربة فعالية الدواء.
- تجميع جهاز حقن مورين أومايا باستخدام منفذ حقن مصغر 25 G (قطر خارجي 0.51 مم) وقرص فاصل 1 ملم. استخدام لاصقة معقمة سيانواكريلات لضمان اختراق ما يقرب من 2.5 مم من قنية معدنية في نصف الكرة الدماغي الأيمن(الشكل 3A-C).
3. علاج مورين أوميا
- الفئران الزين باستخدام مورين أومايا
- تخدير الماوس مع 2-3٪ isoflurane، حتى لا تكون هناك علامات على حق رد الفعل. علاوة على ذلك، تحقق من وجود منعكس الذيل و/أو قرصة مخلب لتأكيد صيانة التخدير.
- الوصول إلى مورين أومايا باستخدام محول حقن الميناء وحقنة هاملتون. باستخدام ملقط، عقد الجزء العلوي من منفذ حقن مصغرة وإدراج بلطف محول حاقن الميناء تماما في الحاجز الميناء.
ملاحظة: يخترق حاقن الميناء الحاجز في الميناء بطريقة تقلل المساحة الميتة إلى الحد الأدنى وتسمح بالحقن الخاضع للرقابة عن طريق مضخة حقنة آلية(الشكل 4A). يتم حقن العلاجات المستهدفة / الجديدة بمعدل تدفق 1 ميكرولتر / دقيقة أثناء التخدير. يجب إعطاء العلاج على فترات محددة (يومية / أسبوعية) لمدة محددة (أسابيع / أشهر) ، وفقا لتقدير الباحث.
حجم بين 3 و 7 ميكرولتر هو الأمثل، كما حجم < 3 ميكرولتر لا يمكن الاعتماد عليها، وحجم > 7 ميكرولتر قد يسبب الكثير من الضغط. يمكن أن يتراوح حجم حقنة هاملتون من 10 إلى 100 ميكرولتر ، اعتمادا على عدد الفئران في كل ذراع علاج. إن التحميل المسبق للحجم المناسب في حقنة هاملتون سيمنع الاستبدال المتكرر للمحقنة ، وبالتالي تقليل الأخطاء. فمن الأفضل لتكريس 1 حقنة هاملتون لكل ذراع العلاج. - بمجرد إجراء الحقن، فصل أومايا مورين من محول حقن الميناء باستخدام ملقط، والعودة الماوس إلى القفص للتعافي من التخدير، كما هو موضح أعلاه في الخطوة 1.3.7.
- القتل الرحيم
- قتل الفئران عن طريق استنشاق ثاني أكسيد الكربون (CO2)من مصدر خزان مضغوط. تعريض الفئران لتركيزات متزايدة منثاني أكسيد الكربون (أي أن معدل الإزاحة من 10٪ إلى 30٪ من حجم الغرفة / دقيقة هو أن تستخدم) لتجنب أو تقليل عدم الراحة أو الضيق. مراقبة الفئران حتى ضمان وقف حركات القلب والأوعية الدموية والجهاز التنفسي.
النتائج
في الفئران، يبلغ الحجم الإجمالي ل CSF حوالي 35-40 ميكرولتر ويتم إنتاجه بمعدل حوالي 350 nL/min؛ فإنه يتحول أكثر من 12-13 مرات في اليوم12. لغرض تصور مسار الحقن، تم حقن 2٪ إيفانز بلو عبر نموذج مورين أومايا، وبعد ذلك سمح 15 دقيقة و 30 دقيقة أن تنقضي قبل حصاد العقول للتحليل. نجحت الصبغة في اختراق البطينين والدماغ في 15 دقيقة. في غضون 30 دقيقة ، أصبحت الصبغة مرئية على الحبل الشوكي(الشكل 4).
كدليل على المفهوم ، تم حقن فئران BALB / c ب Her2 + TUBO المسمى Her2+ TUBO خط خلايا سرطان الثدي بشكل غير مباشر ، وتم زرع Murine Ommayas. بعد حوالي أسبوع واحد من حقن الخلايا السرطانية ، بدأت الفئران في تطوير LMD. تم علاج هذه الفئران مرة واحدة في الأسبوع لمدة تصل إلى 4 أسابيع مع العلاج المناعي Her2-antibody، إما عن طريق العلاج الجهازي عن طريق الحقن داخل الصفاق أو داخل العين عن طريق مورين أومايا (الشكل 5A).
على الرغم من أن الفئران غير المعالجة ماتت بحلول اليوم 19 ، إلا أن جميع الفئران التي تلقت العلاج داخل الثكال من خلال مورين أومايا نجت(P = 0.004). بحلول الأسبوع الرابع، لوحظ تراجع كامل للأورام. بالمقارنة مع الفئران المعالجة بالعلاج الجهازي ، والتي حققت نجاحا معتدلا في علاج LMD ، كان للفئران التي تلقت العلاج داخل الثكال بقاء عام أطول بكثير(الشكل 5B).
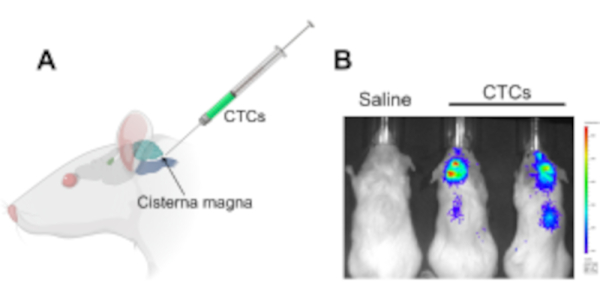
الشكل 1: حقن الخلايا السرطانية المتداولة في ماجنا cisterna في نموذج مورين xenograft لدراسة مرض اللبتومينينيال وانبثاث الجهاز العصبي المركزي. (أ) رسم توضيحي يظهر موقع ماجنا cisterna وموقع الوصول CSF، التي يتم حقن CTCs باستخدام حقنة هاملتون. (ب) صورة IVIS ممثل للفئران التي وضعت مرض اللبتومينينيال ونقائل الجهاز العصبي المركزي (الدماغ وعلى طول الحبل الشوكي) بعد 2 أسابيع من الحقن مع الخلايا السرطانية المتداولة. وصفت الخلايا مع جين مراسل لوسيفيراز. لم الحيوانات السيطرة حقن مع المالحة لم تتطور الأورام (ن = 3)، وتم إجراء التجربة في ثلاثية. المختصرات: CTCs = الخلايا السرطانية المتداولة. IVIS = في نظام التصوير في الجسم الحي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
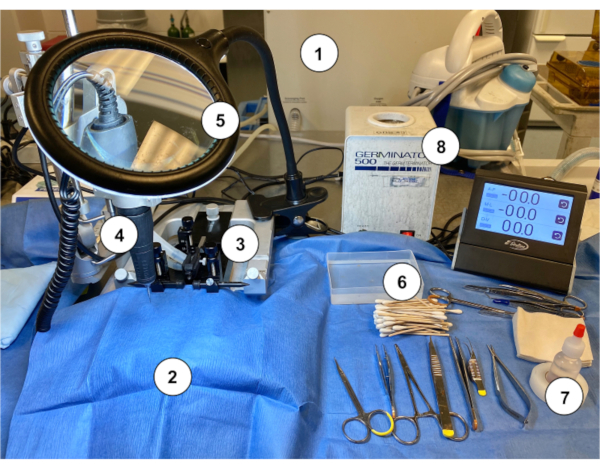
الشكل 2:مثال على إعداد محطة عمل لإجراء زرع مورين أومايا في الفئران. (1) آلة تخدير الغاز / المبخر. (2) العقيمة ورقة زرقاء الستائر تغطي موقف stereotaxic. (3) جهاز ستيريوتاكسيك (موقف / مرحلة، قضبان الأذن، مخروط الأنف). (4) ميكرودريل. (5) العدسة المكبرة مع الضوء. (6) القطن المعقم استغلالها العصي قضيب مع حاوية شطف المالحة المعقمة. (7) بيروكسيد الهيدروجين. (8) معقم الخرز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
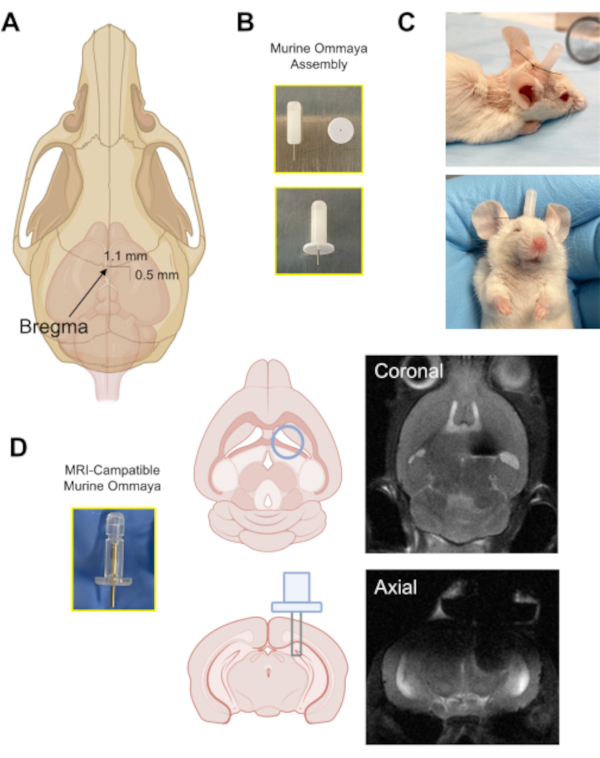
الشكل 3:زرع جهاز مورين أومايا. (أ) رسم توضيحي بسهم يشير إلى موقع البريغما على الجمجمة، والمسافة التقريبية التي يتم فيها حفر ثقب في الجمجمة (0.5 ملم خلفي/1.1 ملم الجانبي) من البريغما باستخدام ميكرودريل. (ب) يتم تجميع أومايا مورين عن طريق الجمع بين قنية معدنية ومتباعد 1 ملم كقاعدة لمرفق الغراء إلى الجمجمة. (ج) صور تمثيلية للفئران التي زرعت مورين أومياس؛ يتم مراقبة هذه الفئران للتأكد من أنها مشرقة، في حالة تأهب، ورد الفعل قبل تلقي أي حقن. (د)مثال على النموذج الأولي للتصوير بالرنين المغناطيسي المتوافق مع مورين أومايا وصور التصوير بالرنين المغناطيسي التمثيلي للدماغ لزراعة مورين أومايا. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
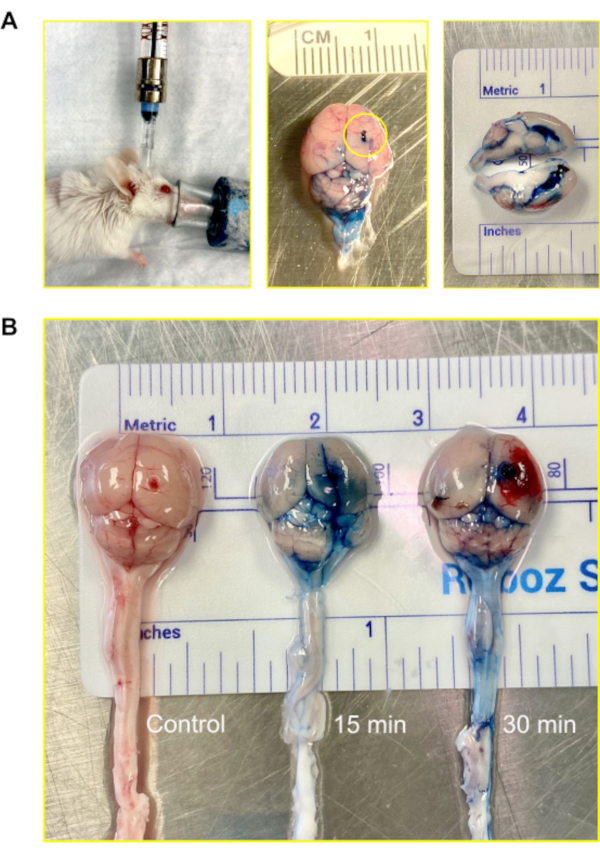
الشكل 4: الحقن داخل البطين (الجهاز العصبي المركزي) باستخدام مورين أومايا. (أ) صورة لحقن, الوصول إلى البطين والجهاز العصبي المركزي عن طريق أومايا مورين. الفئران لا تزال تحت التخدير أثناء الحقن. في المثال، يتم توصيل مورين أومايا بالمنفذ المصغر المرفق بحقنة هاملتون المعبأة مسبقا. يتم إجراء الحقن باستخدام حقنة أوتوماتيكية بمعدل ضخ 1 ميكرولتر /دقيقة وحجم 5-7 ميكرولتر. تظهر صورة لدماغ فأر حقن بإيفانز بلو. تظهر الدائرة المكان الذي تم فيه إرفاق مورين أوميا. لم يلاحظ أي تسرب للصبغة على السطح الخارجي للدماغ. يظهر مقطع عرضي من الدماغ أن البطينين الجانبيين كانا مملوءين بالصبغة. الصبغة لم تخترق الدماغ parenchyma. (ب) صور لأدمغة الفئران بعد 15 و 30 دقيقة بعد حقن ايفانز صبغة زرقاء. تسللت الصبغة إلى الدماغ (15 دقيقة) وبدأت في الدوران على الحبل الشوكي (30 دقيقة). من أصل 5 فئران، تلقى 4 صبغة للتصور، و1 بمثابة السيطرة. وتكررت التجربة في ثلاث نسخ. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
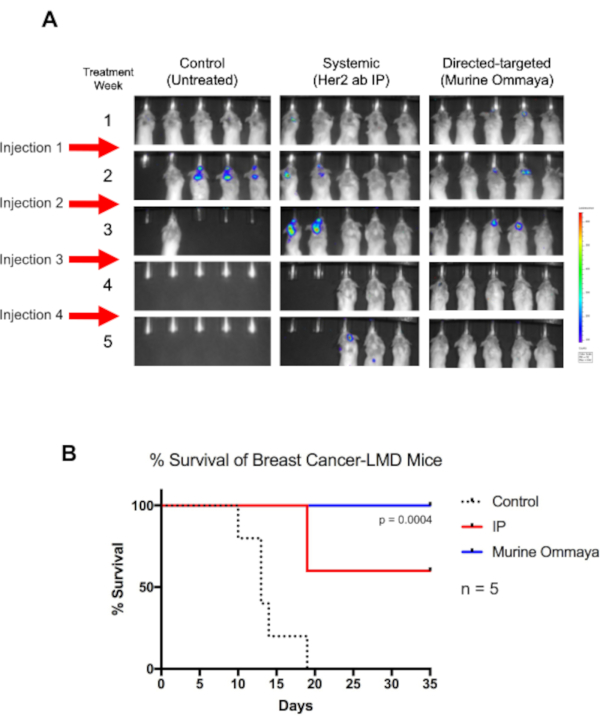
الشكل 5:العلاج المناعي المستهدف مباشرة باستخدام مورين أومايا يزيد من البقاء على قيد الحياة بشكل عام من الفئران مرض اللبتومينينيال المرتبطة بسرطان الثدي. (أ) تم حقن الفئران BALB / ج مع لوسيفيراز مراسل المسمى مستقبلات عامل نمو البشرة البشرية 2 إيجابية خلايا TUBO, خط خلايا سرطان الثدي مورين. بعد ثلاثة أيام من حقن السيسترنا ماجنا، تم زرع مورين أوماياس. بدأت الفئران لتطوير مرض اللبتومينينجال (LMD) 1 بعد أسبوع من الحقن. عولجت الفئران LMD إما مع الجسم المضاد مستقبلات عامل نمو البشرة البشرية بشكل منهجي عن طريق الحقن داخل الصفاق أو عن طريق داخل العين (مورين أومايا) كنهج موجه مباشرة. تعطى الحقن مرة واحدة في الأسبوع لمدة تصل إلى 4 أسابيع. بالمقارنة مع الفئران غير المعالجة ، نجت الفئران التي تتلقى العلاج المناعي لفترة أطول. وكان الفئران مورين أومايا تراجع المرض الكامل بحلول الأسبوع الرابع، وشفيت هذه الفئران في نهاية المطاف من المرض. (ب)هذه الفئران أيضا أفضل بكثير متوسط البقاء على قيد الحياة (مانتل كوكس اختبار; P = 0.004; ن = 5 الفئران لكل ذراع العلاج) والبقاء على قيد الحياة عموما أفضل من الفئران LMD تعامل بشكل منهجي. المختصرات: LMD = مرض اللبتومينينيال; IP = داخل الصفاق. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هنا، وقد وصفت مورين أومايا كنموذج موثوق بها، والذي يسمح للإدارة المتكررة للعوامل المضادة للسرطان في الفضاء CSF في نماذج ما قبل السريرية من LMD وغيرها من الأمراض المرتبطة CNS. تم أخذ عينات CSF من الفئران في حين كان الجهاز لا يزال متصلا دون انقطاع. هذا العلاج المستهدف مباشرة xenograft نموذج خطوة هامة في تطوير واختبار استراتيجيات العلاج العقلاني لLMD. الوقت من حقن ماجنا cisterna إلى العلامة الأولية للتنمية LMD يختلف تبعا لنوع الخلية السرطانية. تبدأ نقائل LMD وCNS في التشكل بعد حوالي أسبوع أو أسبوعين من تلقيح CTC. إذا تم استخدام خط خلايا سرطانية شديدة الانتشار، فمن الممكن أن يحدث الانبثاث في <7 أيام. في هذه الحالة، يمكن أن الأوعية الدموية بسبب نمو الورم في بعض الأحيان يجعل زرع أومايا مورين تحديا. أحد الحلول لهذا التحدي هو تقليل عدد الخلايا السرطانية للحقن في الفضاء CSF، مما يسمح لمزيد من الوقت قبل تطور الورم. وعلاوة على ذلك، تم تحسين هذا البروتوكول لزرع أومايا مورين في موعد لا يتجاوز 72 ساعة بعد حقن ماجنا cisterna لضمان ما يكفي من الوقت للفئران للتعافي من الجراحة قبل العلاج الأول. يجب على الباحثين حساب معدل نمو CTCs في نماذج xenograft قبل التخطيط لنظام العلاج.
على الرغم من أن هناك طرق أخرى مباشرة التسليم داخل البطين, مثل استخدام نظام مضخة التناضح أو حقن بولوس intracerebroventricular (ICV) , كما هو موضح سابقا9, هناك العديد من المزايا لاستخدام نموذج مورين أومايا. على سبيل المثال، يتم حقن البولوس ICV في ولادة واحدة، في حين أن مورين أومايا يسمح لجرعات متعددة من العلاج في أي وقت، سواء أعطيت كعامل واحد أو كعلاجات مجتمعة. تم تصميم المضخة التناضحية للحفاظ على ما يصل إلى 14 أو 28 أو 42 يوما قبل أن تحتاج المضخة إلى استبدال ، وفي بعض الأحيان أكثر إذا تم استخدام فأر أصغر مع مضخة أصغر. يتطلب تغيير المضخة التناضحية إجراء جراحيا ، مما يضيف إجهادا إلى الفئران الحاملة للورم. استبدال مورين أومايا ليس ضروريا للتجارب طويلة الأمد طالما بقي الجهاز سليما. كما أنه يقلل من التقلبات المحتملة التي تنتج عن تغيير المضخة9. ظلت مورين أوماياس المزروعة في الفئران التجريبية سليمة لأكثر من 42 يوما ، وسمحت هذه المدة بأنظمة علاج طويلة الأجل.
تشير النتائج السابقة إلى أن التعاطي المتقطع النابض في CSF له فعالية أفضل ضد LMD من عملية توصيل الأدوية المطولة عن طريق التسريب13. سيكون من المستحيل إجراء حقن جرعة واحدة متكررة باستخدام نظام المضخة التناضحية. لا توجد طريقة سهلة لطرد السائل المحاصر المتبقي بعد كل حقنة. وتقتصر المضخة التناضحية أيضا على تقديم خليط من الأدوية المتوافقة أو الفردية وعادة ما تتطلب كميات أكبر من إعداد الأدوية للتسريب المستمر. في المقابل، تم تصميم مورين أومايا للحقن الدقيقة الدقيقة التي لا يصل 3 إلى 7 ميكرولتر، دون الحاجة إلى حساب المساحة الميتة، وليس هناك قيود على نوع الأدوية التي يمكن للباحثين استخدامها، بما في ذلك العلاج بالخلايا المناعية. كما يقلل مورين أومايا من نفايات الكاشف إذا كانت عينة معينة ثمينة ويزيد من استخدام هذا المورد. بالنسبة لأي نظام علاجي يتطلب جرعات متعددة من العلاجات المضادة للسرطان ، فإن Murine Ommaya سهل الاستخدام ، وهناك الحد الأدنى من خطر العدوى أو المغامرة الجراحية ، مع النهج البديلة للوصول المتكرر إلى CSF جراحيا أو عن طريق الولادة المتكررة بإبرة. يوفر مورين أومايا للباحثين المرونة لضبط تركيزات الأدوية وترددات التعاطي وتقييم التشكيل المستهدف ومدة الدراسة وفقا لبحث الاهتمام.
أحد قيود مورين أومايا هو أن الباحثين قد يجدون صعوبة في زرع الجهاز في فئران أصغر. وبالتالي ، فمن الأفضل استخدام الفئران التي لا تقل أعمارهم عن 8 إلى 10 أسابيع. من الممكن أن يخرج مورين أومايا أثناء تجربة العلاج إذا لم يتم تأمين الجهاز على الجمجمة أثناء خطوات الزرع ويزول الغراء ، أو إذا كانت الفئران قد عبثت به بشكل جلخ. يحدث السيناريو الأخير بشكل أكثر تكرارا عندما تم إيواء فئران متعددة في نفس القفص. ومن ثم، فمن المستحسن أن إيواء ما لا يزيد عن اثنين من الفئران مورين أومايا زرع في قفص لمدة الجدول الزمني للعلاج. تم تعديل هذا البروتوكول لتطبيق لاصق معقم سيانواكريلات على المتباعد ، والذي وجد أنه الغراء الأكثر فعالية للحفاظ على المتباعد إلى سطح الجمجمة ومنع مورين أومايا من الخروج. وأظهرت النتائج أن الفئران LMD استفادت من العلاج المباشر داخل الثكال عن طريق أومايا مورين، مع زيادة البقاء على قيد الحياة عموما. ويمكن إعطاء أحجام ميكرولتر واحد بأمان، متجاوزا BBB، وبالتالي تقليل كمية إعداد المخدرات. والأهم من ذلك، ظلت الفئران التي شفيت من انبثاث الجهاز العصبي المركزي من دراسة العلاج المناعي Her2-antibody صحية.
يهدف التعاون مع الشركة المصنعة إلى تطوير نسخة متوافقة مع التصوير بالرنين المغناطيسي من مورين أومايا لنموذج PDX من LMD. لأن هذا الإصدار النموذج يحتوي على فاصل أدرجت، لا يلزم التجمع، مما يسمح للحفاظ على أفضل للجمجمة. أحد قيود هذا النموذج الأولي هو أنه على الرغم من أن الجهاز متوافق مع التصوير بالرنين المغناطيسي ، إلا أنه يولد ظلا يتم فيه إدخال الجهاز ، مما يقلل من رؤية الصورة لتحليلات القياس الكمي. النسخة المتوافقة مع التصوير بالرنين المغناطيسي هي أداة بديلة جيدة عندما يكون أخذ العينات من الجسم الحي السابق للجنة مكافحة الإرهاب عاملا مقيدا ، والخلايا التي تسبقها غير مجدية. مزيج من نموذج Xenograft LMD وتقنية مورين أومايا مفيد لدراسة فعالية الأدوية المستهدفة مباشرة تجاوز BBB. نتائج هذه الدراسات في الجسم الحي هي ذات الصلة سريريا لتصميم استراتيجيات علاجية عقلانية للمرضى الذين يعانون من LMD.
Disclosures
يعمل بيتر فورسايث في المجالس الاستشارية لشركة Abvie Inc. وباير وبريستول مايرز سكويب وBTG وInovio و Novocure و Tocagen وZiopharm خارج العمل المقدم. جميع المؤلفين الآخرين ليس لديهم ما يكشفون عنه.
Acknowledgements
نود أن نشكر ميشيل ل. دانيلسون، تريشيا تفضل واتسون، وبقية فريق الطب المقارن في جامعة جنوب فلوريدا لدعمهم التقني والحفاظ على حيواناتنا. نشكر مختبرات Instech على جهودهم في العمل معنا بناء على طلبنا لتطوير مورين أومايا المتوافقة مع التصوير بالرنين المغناطيسي. ويدعم هذا العمل من قبل المعاهد الوطنية للصحة (NIH) R21 CA216756 (إلى K.S.M. سمولي)، وزارة الدفاع (DOD) W81XWH1910675 (إلى B. Czerniecki وP. Kalinski)، وجوائز مركز موفيت للسرطان CBMM المبتكرة (إلى P. Forsyth و D. Duckett). وقدم المساعدة التحريرية مكتب الكتابة العلمية التابع لمركز موفيت للسرطان الدكتور بول فليتشر ودالي دراكر. ولم يقدم أي تعويض يتجاوز مرتباتهم العادية.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mm spacer disc | Alzet, Durect Corporation | #0008670 | Spacer disc only |
| 4-0 ethilon nylon suture | Any vendor | n/a | |
| Automatic syringe pumps | Harvard Syringe Pumps (or any vendor) | #70-4505 | Pump 11 Elite |
| Bead sterilizer | Braintree Scientific Inc. (or any vendor) | #GER 5287-120V | Germinator 500 |
| Buprenorphine Sustained-Release (Bup-SR) | Zoopharm | DEA controlled | |
| Cyanoacrylate sterile adhesive | Any vendor | ||
| Gas inhalation anestehsia system | VeteEquip | #901812 | COMPAC5 |
| Hamilton microliter syringes | Hamilton | 10, 25, 50, and 100 μL | 30 G for cisterna magna injection |
| Hydrogen peroxide | Any vendor | n/a | |
| IVIS 200 imaging system | Caliper Life Sciences | n/a | |
| Magnifying glass with light | Any vendor | n/a | |
| Microdrill | Stoelting (or any vendor) | #51555M | |
| MRI imaging | Bruker | BioSpec series | Optional |
| Murine Ommaya (MRI-compatible) prototype | Instech Laboratories, Inc. | #VAB620-25MRI-3.3 | |
| Phosphate-buffered saline (PBS) | Any vendor | n/a | 0.1 mm Sterile-Filtered |
| PinPort injector | Instech Laboratories, Inc. | #PNP3M-50 | |
| PinPort | Instech Laboratories, Inc. | #1-PNP3F28-50 | |
| Rodent Surgical Instruments (Scissors, Forceps) | Roboz Surgical Instrument (or any vendor) | ||
| Stereotaxic device | Stoelting (or any vendor) | #51730M | |
| Sterile blue paper/ drape covering | Any vendor | n/a | n/a |
| Sterile cotton sticks | Any vendor | n/a |
References
- Chamberlain, M. C. Leptomeningeal metastasis. Current Opinion in Neurology. 22 (6), 665-674 (2009).
- Nayar, G., et al. Leptomeningeal disease: current diagnostic and therapeutic strategies. Oncotarget. 8 (42), 73312-73328 (2017).
- Shapiro, W. R., Johanson, C. E., Boogerd, W. Treatment modalities for leptomeningeal metastases. Seminars in Oncology. 36 (4), 46-54 (2009).
- Davies, M. A., et al. Prognostic factors for survival in melanoma patients with brain metastases. Cancer. 117 (8), 1687-1696 (2011).
- Znidaric, T., et al. Breast cancer patients with brain metastases or leptomeningeal disease: 10-year results of a national cohort with validation of prognostic indexes. Breast Journal. 25 (6), 1117-1125 (2019).
- Glitza, I. C., et al. Leptomeningeal disease in melanoma patients: An update to treatment, challenges, and future directions. Pigment Cell & Melanoma Research. 33 (4), 527-541 (2020).
- Raizer, J. J., et al. Brain and leptomeningeal metastases from cutaneous melanoma: survival outcomes based on clinical features. Neuro-oncology. 10 (2), 199-207 (2008).
- Taillibert, S., et al. Leptomeningeal metastases from solid malignancy: a review. Journal of Neurooncology. 75 (1), 85-99 (2005).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments. (75), e50326 (2013).
- Kodumudi, K. N., et al. Sequential anti-PD1 therapy following dendritic cell vaccination improves survival in a HER2 mammary carcinoma model and identifies a critical role for CD4 T cells in mediating the response. Frontiers in Immunology. 10, 1939 (2019).
- Dunn, L., et al. Murine model of wound healing. Journal of Visualized Experiments. (75), e50265 (2013).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta. 1862 (3), 442-451 (2016).
- Shackleford, G. M., et al. Continuous and bolus intraventricular topotecan prolong survival in a mouse model of leptomeningeal medulloblastoma. PLoS One. 14 (1), 0206394 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved