Method Article
Ein murines Ommaya Xenograft-Modell zur Untersuchung der direkten zielgerichteten Therapie von Leptomeningealerkrankungen
In diesem Artikel
Zusammenfassung
Hier beschreiben wir ein murines Xenograft-Modell, das funktionell einem Ommaya-Reservoir bei Patienten ähnelt. Wir haben die Murine Ommaya entwickelt, um neuartige Therapeutika für die universell tödliche Leptomeningealerkrankung zu untersuchen.
Zusammenfassung
Die Leptomeningealerkrankung (LMD) ist eine seltene Art von Metastasen des zentralen Nervensystems (ZNS) in der zerebralen Rückenmarksflüssigkeit (CSF). Die häufigsten Krebsarten, die LMD verursachen, sind Brust- und Lungenkrebs und Melanom. Patienten, bei denen LMD diagnostiziert wurde, haben eine sehr schlechte Prognose und überleben in der Regel nur wenige Wochen oder Monate. Ein möglicher Grund für die mangelnde Wirksamkeit der systemischen Therapie gegen LMD ist das Versagen, therapeutisch wirksame Wirkstoffkonzentrationen im Liquor aufgrund einer intakten und relativ undurchlässigen Blut-Hirn-Schranke (BBB) oder Blut-Liquor-Schranke über den Aderhautplexus zu erreichen. Daher kann die direkte Intrathekal- oder Intraventrikel-Verabreichung von Medikamenten diese Barrieren überwinden. Diese Gruppe hat ein Modell entwickelt, das die effektive Verabreichung von Therapeutika (d. H. Medikamente, Antikörper und Zelltherapien) chronisch und die wiederholte Probenahme von Liquor ermöglicht, um Arzneimittelkonzentrationen und Zielmodulation im Liquor zu bestimmen (wenn die Tumormikroumgebung bei Mäusen anvisiert wird). Das Modell ist das murine Äquivalent eines magnetresonanztomographiekompatiblen Ommaya-Reservoirs, das klinisch eingesetzt wird. Dieses Modell, das am Schädel befestigt ist, wurde als "Murine Ommaya" bezeichnet. Als therapeutischer Proof of Concept wurden Humane epidermale Wachstumsfaktorrezeptor-2-Antikörper (Klon 7.16.4) über die Murine Ommaya in den Liquor abgegeben, um Mäuse mit LMD aus humanem epidermalem Wachstumsfaktorrezeptor 2-positivem Brustkrebs zu behandeln. Die Murine Ommaya erhöht die Effizienz der Medikamentenabgabe mit einem Miniatur-Zugangsport und verhindert die Verschwendung von überschüssigen Medikamenten; es stört nicht die Liquorprobenahme für molekulare und immunologische Studien. Die Murine Ommaya ist nützlich, um neuartige Therapeutika in experimentellen LmD-Modellen zu testen.
Einleitung
Die Leptomeningealkrankheit (LMD) ist eine aggressive Metastasierung des ZNS im Spätstadium, bei der Tumorzellen auf den Liquor zugreifen und die Oberfläche des Gehirns und des Rückenmarks infiltrieren1. Zu den häufigsten Krebsarten, die LMD verursachen, gehören die der Brust und Lunge sowie das Melanom2. LMD führt zu einer Reihe von neurologischen Symptomen und Anzeichen wie Kopfschmerzen, Hirnnervenlähmungen, steifem Nacken und Radikulopathien. Die Prognose für Patienten mit LMD ist im Allgemeinen sehr schlecht (durchschnittliches Überleben wird in Wochen gemessen) und ist universell tödlich3,4,5,6,7. Die Behandlung mit Operation, Bestrahlung und systemischer Chemotherapie ist palliativ. Die systemische Therapie für LMD kann aufgrund einer unzureichenden Penetration des Arzneimittels in den Liquor über eine intakte BBB- oder Blut-LIQUOR-Barriere über den Aderhautplexus1fehlschlagen.
Daher kann die Verabreichung von Krebstherapeutika (z. B. Medikamente und Antikörper-basierte Behandlungen einschließlich Checkpoint-Inhibitoren und Zelltherapien) direkt in den Liquor diese Einschränkung überwinden8. Der Zugang und die Probenahme von Liquor von Patienten ist über ein Ommaya-Reservoir möglich, das unter die Kopfhaut implantiert wird. Dieses Gerät ermöglicht die Verabreichung von Krebsmitteln (z. B. Methotrexat und Trastuzumab) sowie die Probenahme von Liquor für diagnostische Studien (z. B. die zytologische Diagnose von LMD zur Überwachung auf Das Ansprechen auf die Behandlung), ohne eine Wirbelsäulentippentapsung durchzuführen. Ein murines Ommaya-Reservoir wurde entwickelt, um die klinisch verwendeten nachzuahmen. Das Reservoir erfordert die Montage eines Zugangsanschlusses und Abstandshalterteile sowie eine Modifikation der Mauskannulationstechnik, die es dem Gerät ermöglicht, während der gesamten Dauer der Arzneimittelstudie dauerhaft intakt zu bleiben. Dieses Gerät wurde als "Murine Ommaya" bezeichnet.
Im Gegensatz zur osmotischen Infusionspumpentechnik, die die Vorbereitung überschüssiger Flüssigkeitsvolumina erfordert, um den leeren Raum im Schlauch und die kontinuierliche Infusion über häufige Injektionen9vorzufüllen, minimiert die Murine Ommaya die Verschwendung von Arzneimittellösungen. Es ermöglicht die effektive Verabreichung mehrerer Einzeldosen von Behandlungen zu einem bestimmten Zeitpunkt in kleinen Mengen (3-7 μL) in den Liquor mit einer Hamilton-Spritze, einem Miniatur-Zugangsport und einem automatischen Injektor. In Echtzeit kann die Wirksamkeit von Testmedikamenten gegen LMD durch Bildgebung bestimmt werden. Mit diesem Ansatz kann eine Vielzahl von Chemotherapien, Antikörpern und Zellimmuntherapien (als Einzel- oder Kombinationsmittel) gegen LMD getestet werden, um In-vivo-Ergebnisse in rationale Behandlungsstrategien für Patienten umzusetzen. Um die Bildgebungskapazität für ein patientenabgeleitetes Xenograft(PDX)-Modell von LMD weiter zu verbessern, wurde eine Zusammenarbeit mit einem Hersteller unternommen, um eine Magnetresonanztomographie (MRT)-kompatible Version des Murine Ommaya zu entwickeln, die keine Montage erfordert und einsatzbereit ist. Die MRT-Fähigkeit ist von Vorteil, insbesondere für PDX-Modelle, bei denen die Menge der zirkulierenden Tumorzellen (CTCs) aus csF manchmal der limitierende Faktor ist, und oft, wenn die Vormarkierung von CTCs nicht durchführbar ist.
Dieses Papier beschreibt ein detailliertes Protokoll, das mit der Injektion von CTCs beginnt, um Mäuse mit LMD zu rendern. Die Murine Ommaya wird dann chirurgisch implantiert und mehrere medikamentöse Behandlungsschritte über die Murine Ommaya werden durchgeführt. Als Proof of Concept zur Demonstration wurde ein In-vivo-Side-by-Side-Vergleich durchgeführt, bei dem der murine humane epidermale Wachstumsfaktorrezeptor 2 (Her2)-Antikörper namens Klon 7.16.4 (das menschliche Äquivalent von Trastuzumab)10abgegeben wurde. Der Antikörper zielt entweder über die Murine Ommaya (direkt- oder intrathekale Therapie) oder durch intraperitoneale Injektion (systemische Therapie) auf Her2+ Brustkrebszellen ab. Die Ergebnisse zeigten, dass Mäuse mit LMD, die eine direkte intrathekale Immuntherapie erhielten, signifikant länger lebten als diejenigen, die systemisch mit derselben Therapie behandelt wurden. Die ZNS-Metastasen bei Mäusen, die über die Murine Ommaya behandelt wurden, wurden durch die dritte Dosis der dritten Behandlungswoche fast vollständig regressiert, was zu einem verbesserten Gesamtüberleben führte.
Protokoll
Das Protokoll wurde vom Institutional Animal Care and Use Committee der University of South Florida (IS00005974) genehmigt.
1. Injektion von CTCs in CSF zur Erstellung eines Maus-LMD-Modells
- Vorbereitung von CTCs
- Berechnen Sie die Anzahl der ctCs, die für die Injektion benötigt werden, und bereiten Sie eine Einzelzellsuspension bei 1,0 × 104 Zellen / μL in steriler phosphatgepufferter Kochsalzlösung (PBS) vor. Legen Sie die Zellsuspension während des gesamten Verfahrens auf Eis oder bei 4 °C.
HINWEIS: Wenn Sie Zelllinien verwenden, die eine Trypsinisierung erfordern, achten Sie darauf, die Zellen zweimal mit sterilem PBS zu waschen, um Trypsin zu entfernen. Führen Sie die Zellzählung mit einem Hämozytometer oder einem automatisierten Zellzähler durch. Wenn eine große Kohorte (>50 Mäuse) verwendet wird, teilen Sie die Zellen nach und validieren Sie die Zelllebensfähigkeit zwischen den Injektionen, um sicherzustellen, dass eine konsistente Anzahl von Zellen pro Maus verabreicht wird.
- Berechnen Sie die Anzahl der ctCs, die für die Injektion benötigt werden, und bereiten Sie eine Einzelzellsuspension bei 1,0 × 104 Zellen / μL in steriler phosphatgepufferter Kochsalzlösung (PBS) vor. Legen Sie die Zellsuspension während des gesamten Verfahrens auf Eis oder bei 4 °C.
- Prächirurgisches Verfahren
- Injizieren Sie die Maus subkutan mit 1 mg/kg Buprenorphin Mit verzögerter Freisetzung (Bup-SR).
HINWEIS: Injizieren Sie nicht den Bereich des vorgeschlagenen Schnitts; Wählen Sie eine Injektionsstelle weit weg vom Schulterblatt. - Betäuben Sie die Maus mit 2-3% Isofluran, bis sie keine Anzeichen des Aufrscheinreflexes zeigt. Überprüfen Sie außerdem den Schwanz- und / oder Pfotenquetschreflex, um den Zustand der Anästhesie zu bestätigen.
- Bereiten Sie die Maus auf die Operation an einem Ort vor, der vom Operationsgebiet entfernt ist. Schneiden Sie die Operationsstelle (dh die dorsale Oberfläche des Schädels) mit genügend Randbereich ab, um zu verhindern, dass das Fell die Inzisionsstelle kontaminiert; Dann sättigen Sie die Stelle mit keimtötendem Hautantiseptikum, arbeiten Sie von der Mitte der Stelle bis zur Peripherie und lassen Sie sie dann trocknen. Tragen Sie entweder einen sterilen Vorhang oder ein steriles, klebstoffgestütztes Kunststoffvorhangmaterial auf, um die Operationsstelle vor Verunreinigungen zu schützen.
HINWEIS: Instrumente sind im Voraus zu autoklavieren und Spitzen zwischen Tieren mit einem Glasperlensterilisator erneut zu sterilisieren. - Rasieren Sie das Fell der gesamten ventralen Oberfläche des Kopfes und bereiten Sie die Haut mit steriler Technik vor.
- Die Nase wird mit einem modifizierten L-förmigen Nasenkegel des stereotaktischen Apparates angeordnet, um sicherzustellen, dass die Nares klar und offen bleiben. Ziehen Sie die Haut mit Klebeband über die ventralen Oberflächen beider Pinnae, ziehen Sie die Haut vorsichtig nach vorne, um sie am Nasenkegel zu befestigen, und biegen Sie den Hals nach der Sicherung in einem Winkel von etwa 90 °. Verabreichen Sie 1,5% Isofluran, um die Anästhesie aufrechtzuerhalten.
HINWEIS: Die richtige Positionierung führt dazu, dass der Schnittbereich so dargestellt wird, dass der Schwanzkamm des Hinterhauptknochens leicht zu identifizieren ist. - Positionieren Sie den Körper, um sicherzustellen, dass die Wirbelsäule auf Höhe der Cisterna Magna gehalten wird, und legen Sie bei leichter Traktion auf den Schwanz Klebeband an der Schwanzbasis, um sie zu sichern.
- Injizieren Sie die Maus subkutan mit 1 mg/kg Buprenorphin Mit verzögerter Freisetzung (Bup-SR).
- Chirurgische cisterna magna Injektion
- Mit dem Hals in voller Ausdehnung und beginnend direkt zwischen den Pinnae, führen Sie die chirurgischen Scherenspitzen mit leichtem Druck über den Hinterhauptknochen nach unten.
HINWEIS: In dieser Mittellinienposition macht sich eine kleine Vertiefung bemerkbar, wenn die Scherenspitzen in den konkaven Bereich über der Cisterna magna eintauchen. - Machen Sie einen kleinen 3-5 mm Mittellinienschnitt direkt über der palpierten Konkavität. 5 μL Zellsuspension bei 1,0 × 104 Zellen/μL (insgesamt 5,0 × 104 Zellen) in eine 30 G Hamilton Spritze ziehen.
- Verwenden Sie eine stumpfe Wendezette mit 1-2 mm Spitzen, um die Cisterna Magna sanft nach unten zu drücken. Führen Sie die Spitzen in einer geschlossenen Position ein und öffnen Sie sie, während Sie Druck auf die Dura ausüben.
- Wiederholen Sie die im vorherigen Schritt beschriebene stumpfe Dissektion, bis die Duralmembran leicht identifiziert werden kann und die zugehörigen Blutgefäße im exponierten Bereich sichtbar sind.
HINWEIS: Das resultierende Injektionsfenster stellt sicher, dass die Blutgefäße während des Einführens der Nadel unbeschädigt sind. - Während Sie die Zöge offen halten, um die umgebende Muskulatur zurückzuziehen, führen Sie eine 30 G nicht entkernende Nadel unter die Dura ein, um die Fase zu visualisieren. Stellen Sie sicher, dass die Nadel nur knapp hinter der Fase selbst eingeführt wird. Setzen Sie langsam einen Spritzenkolben ein und liefern Sie Zellen direkt unter der Dura.
- Platzieren Sie die Fase richtig, um die Injektion unter der Dura zu beobachten. Verabreichen Sie die Technik sorgfältig und verwenden Sie die 30 G nadelfreie Nadel, um Schäden an der Membran zu vermeiden und minimale Leckagen zu gewährleisten. Wenn eine Leckage festgestellt wird, drücken Sie sanften Druck mit einem Applikator mit Baumwollspitze aus.
- Schließen Sie die Haut, indem Sie einen Wundclip oder einen Mikrotropfen Hautkleber auftragen. Sobald die Injektion erfolgreich durchgeführt wurde, lassen Sie die Mäuse sich von der Anästhesie auf einer warmen Decke erholen und sie kontinuierlich beobachten, bis sie die Sternalposition beibehalten und eine gezielte Bewegung zeigen können.
- Überwachen Sie die Mäuse täglich nach der Operation für die erste Woche. Wenn eine Maus Schmerzen oder Leiden zu haben scheint, behandeln Sie sie mit 10 mg / kg subkutaner Injektion von Carprofen einmal alle 12 bis 24 Stunden für bis zu 5 Tage basierend auf tierärztlicher Konsultation und Anweisung. Lassen Sie die Mäuse sich erholen und überwachen Sie sie mindestens 48 bis 72 Stunden, bevor Sie mit dem nächsten Schritt fortfahren.
HINWEIS: Bup-SR, präventiv verabreicht, hält bis zu 72 h, so dass zusätzliche Analgetika normalerweise nicht erforderlich sind. Den Tieren wird jedoch bei Bedarf ein zusätzliches Analgetikum zur Verfügung gestellt (wenn lethargisch, nicht essend, gerüscht). Wenn eine Operationsstelle Anzeichen einer postoperativen Infektion entwickelt (z. B. Rötung, Schwellung, Zärtlichkeit, Allodynie, Hyperalgesie, Hyperpathie oder Eiterung) oder wenn die Maus den betroffenen Bereich bewacht, euthanasieren Sie die Maus. Wenn Krebszellen erfolgreich in den Liquor injiziert werden, entwickeln sich LMD und Tumorprogression im ZNS innerhalb von 1 oder 2 Wochen (abhängig von den Verwendeten CTCs oder Zelllinien) (Abbildung 1).
- Mit dem Hals in voller Ausdehnung und beginnend direkt zwischen den Pinnae, führen Sie die chirurgischen Scherenspitzen mit leichtem Druck über den Hinterhauptknochen nach unten.
2. Murine Ommaya Montage und Implantation
- Vorbereitung der Station
- Desinfizieren Sie die Stationsoberfläche. Legen Sie eine blaue Abdeckung über die Oberfläche und halten Sie alle in Abbildung 2angegebenen sterilisierten Werkzeuge und Verbrauchsmaterialien bereit.
- Prächirurgisches Verfahren
- Wenden Sie analgesie (Bup-SR) an und pflegen Sie die sterile Technik wie in Abschnitt 1.2 beschrieben.
- Chirurgische Implantation von Murine Ommaya
- Montieren Sie das Murine Ommaya Injektionsgerät mit einem 25 G (0,51 mm Außendurchmesser) Miniatur-Injektionsanschluss und einer 1 mm Abstandsscheibe. Verwenden Sie einen sterilen Cyanacrylat-Klebstoff, um das Eindringen von etwa 2,5 mm der Metallkanüle in die rechte Gehirnhemisphäre sicherzustellen (Abbildung 3A-C).
HINWEIS: In diesem Labor wurde ein MRT-kompatibler Maus-Ommaya-Prototyp entwickelt, der bereits beide Teile (Miniatur-Injektionsanschluss und Abstandhalter) als eine Einheit 3D-gedruckt hat (Abbildung 3D). Die Einzelgeräteversion wurde per MRT getestet und kann durch den Wegfall des Montageschritts Zeit sparen. - Betäuben Sie die Maus mit 2-3% Isofluran, bis keine Anzeichen des Aufrübenreflexes mehr vorhanden sind. Überprüfen Sie außerdem den Schwanz- und / oder Pfotenquetschreflex, um den Zustand der Anästhesie zu bestätigen.
- Rasieren Sie die gesamte ventrale Oberfläche des Fellkopfes und bereiten Sie die Haut nach der sterilen Technik vor, wie zuvor in Schritt 1.2.3 beschrieben. Legen Sie die Maus in den stereotaktischen Apparat mit einem Nasenkegel, um die Isofluran-Verabreichung während des Verfahrens fortzusetzen; das Isofluran auf 1,5% senken. Ziehen Sie die Ohrbügel vorsichtig an, um den Kopf zu sichern, und tragen Sie Augengleitmittel auf, um die Augen der Maus zu bedecken.
- Machen Sie einen kleinen Hautschnitt (3 mm), gefolgt von einer stumpfen Dissektion des darunter liegenden Unterhautgewebes, um den Schädel freizulegen. Trocknen Sie den Schädel mit wasserstoffperoxidgetränkten Applikatorstäben mit Baumwollspitze.
- Bohren Sie ein Gratloch in den Schädel 0,5 mm posterior und 1,1 mm seitlich der Bregma - dem anatomischen Punkt auf dem Schädel, wo die koronale Naht senkrecht durch die sagittale Naht durchschnitten wird (Abbildung 3A) - sowie ein 0,9 mm Gratloch, um die Dura mater freizulegen. Bewegen Sie den Mikrobohrer zur Seite und schlagen Sie vorsichtig den Knochen ab, der das Gratloch unmittelbar umgibt, bevor Sie einen Injektionsanschluss (Tiefe von ca. 2,5 mm) einführen, der mit einem sterilen Cyanacrylatkleber am Schädel befestigt wird. Zustandsnaht um die Injektionsstelle mit 4-0 nicht absorbierenden Nylonnähten in einem unterbrochenen Stichmuster oder einer Geldbörsennaht11.
- Beherbergen Sie mäuse nach der Operation in einzelnen Käfigen zur Genesung der Operation.
HINWEIS: Es ist möglich, dass sich die Murine Ommaya abtrünnigt, wenn mehrere operierte Mäuse im selben Käfig untergebracht sind, möglicherweise aufgrund ständiger Manipulationsinteraktionen. Es wird empfohlen, dass Murine Ommaya-implantierte Mäuse im Laufe der Arzneimittelwirksamkeitsstudie einzeln (oder nicht mehr als 2 Mäuse pro Käfig) untergebracht werden.
- Montieren Sie das Murine Ommaya Injektionsgerät mit einem 25 G (0,51 mm Außendurchmesser) Miniatur-Injektionsanschluss und einer 1 mm Abstandsscheibe. Verwenden Sie einen sterilen Cyanacrylat-Klebstoff, um das Eindringen von etwa 2,5 mm der Metallkanüle in die rechte Gehirnhemisphäre sicherzustellen (Abbildung 3A-C).
3. Murine Ommaya Behandlung
- Dosierung von Mäusen mit der Murine Ommaya
- Betäuben Sie die Maus mit 2-3% Isofluran, bis keine Anzeichen eines Aufrübenreflexes mehr vorhanden sind. Überprüfen Sie außerdem auf Schwanz- und / oder Pfotenquetschreflex, um die Aufrechterhaltung der Anästhesie zu bestätigen.
- Greifen Sie mit einem Port-Injektionsadapter und einer Hamilton-Spritze auf die Murine Ommaya zu. Halten Sie mit einer Zette die Oberseite des Miniatur-Injektionsanschlusses und führen Sie den Port-Injektoradapter vorsichtig vollständig in das Septum des Anschlusses ein.
HINWEIS: Der Port-Injektor durchbohrt das Septum des Ports in einer Weise, die den Totraum auf ein Minimum reduziert und eine kontrollierte Injektion über eine motorisierte Spritzenpumpe ermöglicht (Abbildung 4A). Gezielte/neuartige Behandlungen werden unter Betäubung mit einer Durchflussrate von 1 μL/min injiziert. Die Behandlung ist in festgelegten Intervallen (täglich/wöchentlich) für eine bestimmte Dauer (Wochen/Monate) nach Ermessen des Forschers durchzuführen.
Ein Volumen zwischen 3 und 7 μL ist optimal, da ein Volumen < 3 μL unzuverlässig ist und ein Volumen > 7 μL zu viel Druck verursachen kann. Die Größe der Hamilton-Spritze kann zwischen 10 und 100 μL liegen, abhängig von der Anzahl der Mäuse in jedem Behandlungsarm. Das Vorladen des entsprechenden Volumens in die Hamilton-Spritze verhindert einen wiederholten Austausch der Spritze und minimiert so Fehler. Es ist am besten, 1 Hamilton Spritze pro Behandlungsarm zu widmen. - Sobald die Injektion erfolgt ist, lösen Sie die Murine Ommaya mit einer Zette vom Port-Injektionsadapter und bringen Sie die Maus in den Käfig zurück, um sich von der Anästhesie zu erholen, wie oben in Schritt 1.3.7 beschrieben.
- Euthanasie
- Euthanasieren Sie die Mäuse durch Einatmen von Kohlendioxid (CO2)aus einer komprimierten Tankquelle. Setzen Sie die Mäuse steigenden CO2-Konzentrationen aus (d.h. es ist eine Verdrängungsrate von 10% bis 30% des Kammervolumens/min zu verwenden), um Beschwerden oder Ängste zu vermeiden oder zu minimieren. Überwachen Sie die Mäuse bis zur Gewissheit, dass die Herz-Kreislauf- und Atembewegungen aufhören.
Ergebnisse
Bei Mäusen beträgt das Gesamtvolumen des Liquors etwa 35-40 μL und wird mit einer Rate von etwa 350 nL / min produziert; es dreht sich 12-13 mal am Tag12. Um den Injektionsweg zu visualisieren, wurden 2% Evans Blue über das Murine Ommaya-Modell injiziert, woraufhin 15 Minuten und 30 Minuten verstreichen durften, bevor die Gehirne zur Analyse geerntet wurden. Der Farbstoff infiltrierte erfolgreich die Ventrikel und das Gehirn in 15 Minuten. Innerhalb von 30 min wurde der Farbstoff am Rückenmark sichtbar (Abbildung 4).
Als Proof of Concept wurden BALB/c-Mäusen intrastern eine Luciferase-markierte Her2+ TUBO-Brustkrebszelllinie injiziert und die Murine Ommayas implantiert. Etwa 1 Woche nach der Injektion von Krebszellen begannen die Mäuse LMD zu entwickeln. Diese Mäuse wurden einmal pro Woche bis zu 4 Wochen lang mit einer Her2-Antikörper-Immuntherapie behandelt, entweder durch systemische Therapie durch intraperitoneale Injektion oder intrathekal über die Murine Ommaya (Abbildung 5A).
Obwohl unbehandelte Mäuse am 19. Tag starben, überlebten alle Mäuse, die eine intrathekale Therapie durch die Murine Ommaya erhielten (P = 0,004). In Woche 4 wurde eine vollständige Regression von Tumoren beobachtet. Im Vergleich zu Mäusen, die mit systemischer Therapie behandelt wurden und einen mäßigen Erfolg bei der Behandlung von LMD hatten, hatten Mäuse, die eine intrathekale Therapie erhielten, ein viel längeres Gesamtüberleben (Abbildung 5B).
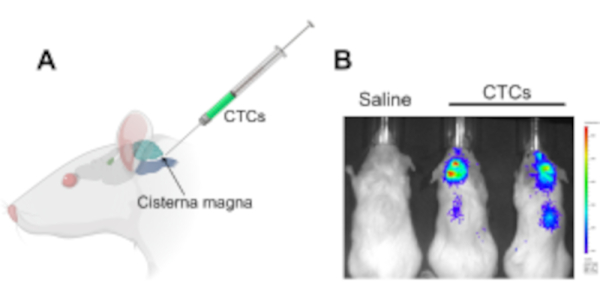
Abbildung 1: Injektion zirkulierender Tumorzellen in die Cisterna magna in einem murinen Xenograft-Modell zur Untersuchung von Leptomeningealerkrankungen und Metastasen des zentralen Nervensystems. (A) Eine Abbildung, die die Lage der Cisterna magna und die CSF-Zugangsstelle zeigt, in die CTCs mit einer Hamilton-Spritze injiziert werden. (B) Ein repräsentatives IVIS-Bild von Mäusen, die nach 2 Wochen Injektion mit zirkulierenden Tumorzellen eine Leptomeningealerkrankung und Metastasen des zentralen Nervensystems (Gehirn und entlang des Rückenmarks) entwickelt hatten. Die Zellen wurden mit einem Luciferase-Reporter-Gen markiert. Kontrolltiere, denen Kochsalzlösung injiziert wurde, entwickelten keine Tumore (n = 3), und das Experiment wurde in dreifacher Ausfertigung durchgeführt. Abkürzungen: CTCs = zirkulierende Tumorzellen; IVIS = in vivo Bildgebungssystem. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
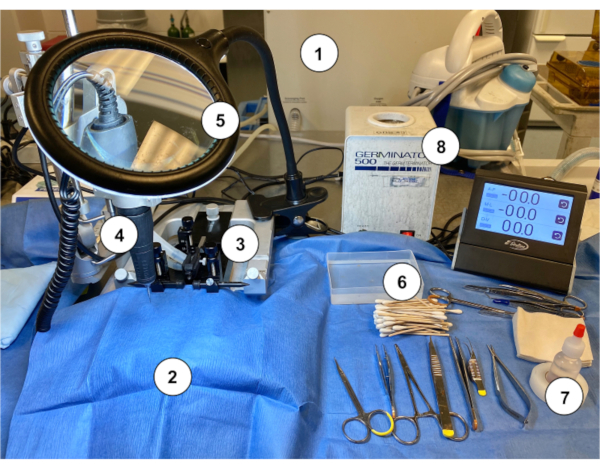
Abbildung 2: Ein Beispiel für eine Workstation-Einrichtung zur Durchführung der Murine Ommaya-Implantation bei Mäusen. (1) Gasanästhesiegerät/Vaporizer. (2) Steriler blauer Papiervorhang, der einen stereotaxischen Ständer bedeckt. (3) Stereotaxisches Gerät (Stand/Bühne, Ohrbügel, Nasenkegel). (4) Mikrodrill. (5) Lupe mit Licht. (6) Sterile Applikator-Applikator-Sticks aus Baumwolle mit sterilem Salzspülbehälter. (7) Wasserstoffperoxid. (8) Perlensterilisator. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
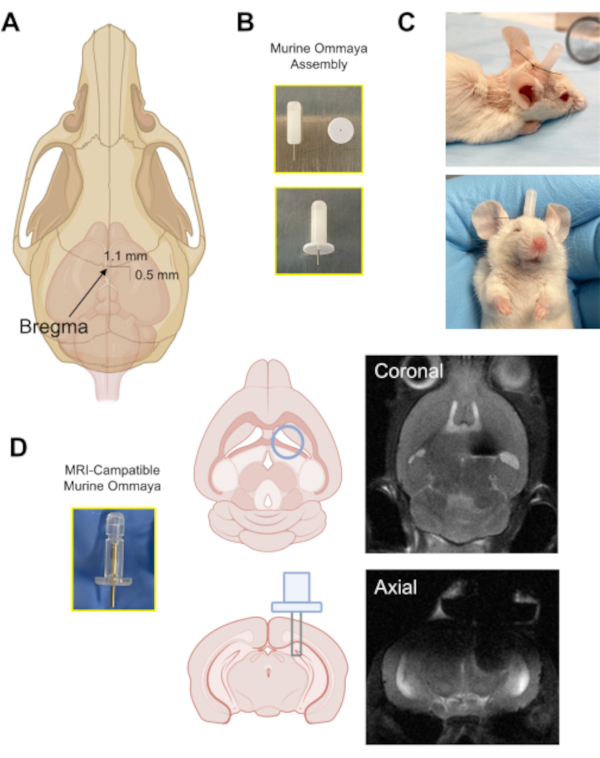
Abbildung 3: Die Implantation des Murine Ommaya-Geräts. (A) Eine Abbildung mit einem Pfeil, der auf die Position der Bregma auf dem Schädel zeigt, und dem ungefähren Abstand, in dem ein Gratloch in den Schädel (0,5 mm posterior/1,1 mm seitlich) vom Bregma mit einem Mikrobohrer gebohrt wird. (B) Eine Murine Ommaya wird durch Kombination einer Metallkanüle und eines 1 mm Abstandhalters als Basis für die Klebstoffbefestigung am Schädel zusammengebaut. (C) Repräsentative Bilder von Mäusen, denen Murine Ommayas implantiert wurde; Diese Mäuse werden überwacht, um sicherzustellen, dass sie hell, wachsam und reaktiv sind, bevor sie Injektionen erhalten. (D) Ein Beispiel für den Prototyp der Magnetresonanztomographie-kompatiblen Murine Ommaya und repräsentative Hirn-Magnetresonanztomographie-Bilder von Murine Ommaya Implantaten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
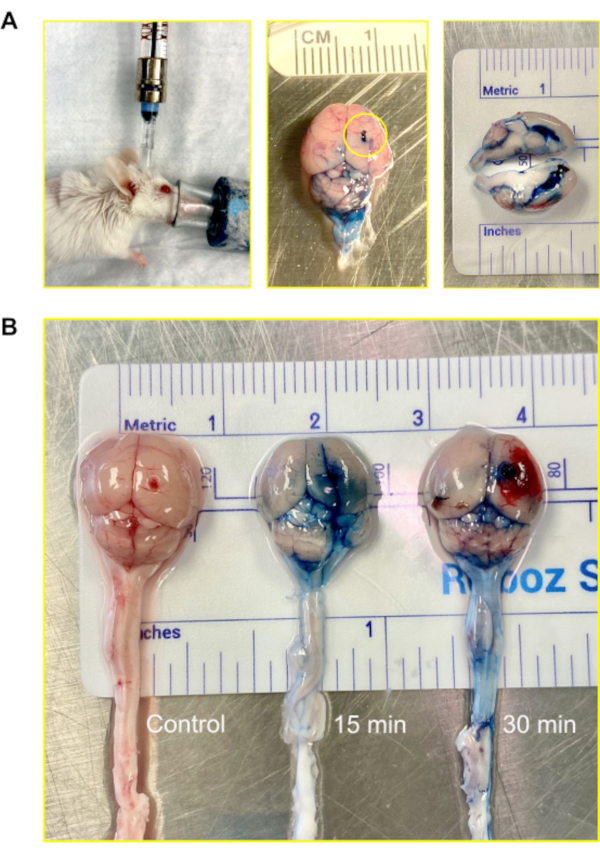
Abbildung 4: Intraventrikuläre Injektion (zentrales Nervensystem) mit der Murine Ommaya. (A) Ein Bild einer Injektion, die über die Murine Ommaya auf den Ventrikel und das zentrale Nervensystem zugreift. Mäuse bleiben während der Injektion unter Betäubung. Im Beispiel ist die Murine Ommaya mit dem Miniaturanschluss verbunden, der an einer vorgefüllten Hamilton-Spritze befestigt ist. Die Injektionen werden mit einem automatischen Injektionssatz mit einer Infusionsrate von 1 μL/min und einem Volumen von 5-7 μL durchgeführt. Ein Bild eines Mausgehirns, das mit Evans Blue injiziert wurde, wird gezeigt. Der Kreis zeigt, wo die Murine Ommaya angebracht war. An der Außenseite des Gehirns wurde kein Austreten des Farbstoffs beobachtet. Ein Querschnitt des Gehirns zeigt, dass die seitlichen Ventrikel mit dem Farbstoff gefüllt waren; der Farbstoff drang nicht in das Gehirnparenchym ein. (B) Bilder von Mausgehirnen nach 15 und 30 Minuten nach der Injektion von Evans Blue Farbstoff. Der Farbstoff infiltrierte das Gehirn (15 min) und begann auf dem Rückenmark zu zirkulieren (30 min). Von 5 Mäusen erhielten 4 Farbstoff zur Visualisierung und 1 diente als Kontrolle. Das Experiment wurde in dreifacher Ausfertigung wiederholt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
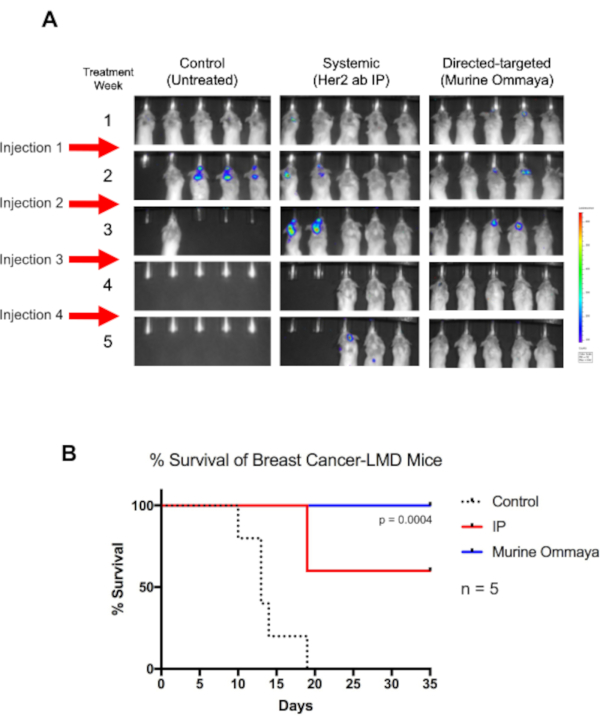
Abbildung 5: Direkte Immuntherapie mit dem Murine Ommaya erhöht das Gesamtüberleben von Mäusen mit Brustkrebs-assoziierter Leptomeningealerkrankung. (A) BALB/c-Mäusen wurden Luciferase-reportermarkierte humane epidermale Wachstumsfaktorrezeptor-2-positive TUBO-Zellen, eine murine Brustkrebszelllinie, injiziert. Drei Tage nach den Injektionen von Cisterna Magna wurden Murine Ommayas implantiert. Mäuse begannen 1 Woche nach der Injektion eine Leptomeningealerkrankung (LMD) zu entwickeln. LMD-Mäuse wurden entweder mit einem humanen epidermalen Wachstumsfaktorrezeptor-Antikörper systemisch über intraperitoneale Injektion oder über intrathekale (Murine Ommaya) als direkt-gezielten Ansatz behandelt. Injektionen wurden einmal pro Woche für bis zu 4 Wochen verabreicht. Im Vergleich zu unbehandelten Mäusen überlebten Mäuse, die eine Immuntherapie erhielten, viel länger. Murine Ommaya-Mäuse hatten in der vierten Woche eine vollständige Krankheitsregression, und diese Mäuse wurden schließlich von Krankheiten geheilt. (B) Diese Mäuse hatten auch ein signifikant besseres medianes Überleben (Mantel-Cox-Test; P = 0,004; n = 5 Mäuse pro Behandlungsarm) und besseres Gesamtüberleben als systematisch behandelte LMD-Mäuse. Abkürzungen: LMD = leptomeningeale Erkrankung; IP = intraperitoneal. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Hier wurde die Murine Ommaya als zuverlässiges Modell beschrieben, das eine wiederholte Verabreichung von Krebsmedikamenten in den Liquorraum in präklinischen Modellen von LMD und anderen ZNS-bedingten Erkrankungen ermöglicht. CSF wurde von Mäusen entnommen, während das Gerät noch ohne Unterbrechung angebracht war. Dieses direkt zielgerichtete Xenograft-Modell ist ein wichtiger Schritt bei der Entwicklung und Erprobung rationaler Behandlungsstrategien für LMD. Die Zeit von der Injektion von Cisterna Magna bis zum ersten Anzeichen der LMD-Entwicklung variiert je nach Krebszelltyp. LMD- und ZNS-Metastasen beginnen etwa 1 oder 2 Wochen nach der CTC-Impfung ihre Form anzunehmen. Wenn eine stark proliferative Krebszelllinie verwendet wird, ist es möglich, dass Metastasen in <7 Tagen auftreten können. In diesem Fall kann eine Vaskularisierung aufgrund von Tumorwachstum die Implantation der Murine Ommaya manchmal schwierig machen. Eine Lösung für diese Herausforderung besteht darin, die Anzahl der Krebszellen für die Injektion in den Liquorraum zu reduzieren, um mehr Zeit vor der Tumorentwicklung zu haben. Darüber hinaus wurde dieses Protokoll optimiert, um die Murine Ommaya spätestens 72 h nach der Cisterna Magna-Injektion zu implantieren, um sicherzustellen, dass sich die Mäuse vor der ersten Behandlung von der Operation erholen können. Forscher sollten die Wachstumsrate der CTCs in Xenograft-Modellen berechnen, bevor sie das Behandlungsschema planen.
Obwohl es andere direkte intraventrikuläre Verabreichungsmethoden gibt, wie z. B. die Verwendung eines osmotischen Pumpensystems oder einer intrazerebroventrikulären (ICV) Bolusinjektion, wie zuvor beschrieben9,gibt es mehrere Vorteile bei der Verwendung des Murine Ommaya-Modells. Zum Beispiel wird eine ICV-Bolus-Injektion in einer einzigen Verabreichung durchgeführt, während die Murine Ommaya jederzeit mehrere Dosen der Behandlung ermöglicht, unabhängig davon, ob sie als Einzelmittel oder als kombinierte Therapien verabreicht werden. Die osmotische Pumpe ist so konzipiert, dass sie bis zu 14, 28 oder 42 Tage hält, bevor die Pumpe ausgetauscht werden muss, und manchmal häufiger, wenn eine kleinere Maus mit einer kleineren Pumpe verwendet wird. Das Wechseln der osmotischen Pumpe erfordert einen chirurgischen Eingriff, der tumortragende Mäuse belastet. Ein Murine Ommaya Ersatz ist für Langzeitexperimente nicht notwendig, solange das Gerät intakt bleibt. Es minimiert auch die potenzielle Variabilität, die sich aus dem Wechsel derPumpe 9 ergibt. Implantierte Murine Ommayas in die experimentellen Mäuse blieb länger als 42 Tage intakt, und diese Dauer ermöglichte langlebige Behandlungsschemata.
Frühere Ergebnisse deuten darauf hin, dass eine pulsatile intermittierende Dosierung in den Liquor eine bessere Wirksamkeit gegen LMD hat als ein verlängerter Arzneimittelabgabeprozess durch Infusion13. Es wäre unmöglich, wiederholte Einzeldosis-Injektionen mit dem osmotischen Pumpensystem durchzuführen. Es gibt keine einfache Möglichkeit, die verbleibende eingeschlossene Flüssigkeit nach jeder Injektion auszuspülen. Die osmotische Pumpe ist auch auf die Abgabe von Mischungen kompatibler oder einzelner Medikamente beschränkt und erfordert typischerweise höhere Mengen an Arzneimittelzubereitung für die kontinuierliche Infusion. Im Gegensatz dazu ist die Murine Ommaya für genaue Mikroinjektionen von nur 3 bis 7 μL ausgelegt, ohne den toten Raum berücksichtigen zu müssen, und es gibt keine Begrenzung für die Art der Medikamente, die Forscher verwenden können, einschließlich der Immunzelltherapie. Die Murine Ommaya minimiert auch den Reagenzienabfall, wenn eine bestimmte Probe wertvoll ist, und maximiert die Nutzung dieser Ressource. Für jedes Behandlungsschema, das mehrere Dosen von Krebstherapien erfordert, ist die Murine Ommaya einfach zu bedienen, und es besteht ein minimales Risiko für Infektionen oder chirurgische Missgeschicke, mit den alternativen Ansätzen des wiederholten chirurgischen Zugriffs auf den Liquor oder durch wiederholte Entbindung mit einer Nadel. Die Murine Ommaya bietet Forschern die Flexibilität, Arzneimittelkonzentrationen und Dosierungsfrequenzen anzupassen und die Zielmodulation und Dauer der Studie entsprechend der interessierenden Forschung zu bewerten.
Eine Einschränkung der Murine Ommaya ist, dass Forscher es schwierig finden können, das Gerät in kleinere Mäuse zu implantieren. Daher ist es besser, Mäuse zu verwenden, die mindestens 8 bis 10 Wochen alt sind. Es ist möglich, dass sich die Murine Ommaya während des Behandlungsversuchs abtrichtert, wenn das Gerät während der Implantationsschritte nicht am Schädel befestigt ist und der Kleber abnutzt oder wenn die Mäuse ihn abrasiv manipuliert haben. Letzteres Szenario tritt häufiger auf, wenn mehrere Mäuse im selben Käfig untergebracht waren. Daher wird empfohlen, für die Dauer des Behandlungsplans nicht mehr als zwei Murine Ommaya-implantierte Mäuse pro Käfig unterzubringen. Dieses Protokoll wurde modifiziert, um sterilen Cyanacrylatkleber auf den Abstandhalter aufzutragen, der sich als der effektivste Klebstoff erwies, um den Abstandhalter an der Schädeloberfläche zu haften und zu verhindern, dass sich die Murine Ommaya abträcht. Die Ergebnisse zeigten, dass LMD-Mäuse von einer direkten intrathekalen Therapie über die Murine Ommaya mit erhöhtem Gesamtüberleben profitierten. Einzelne Mikrolitervolumina konnten sicher verabreicht werden, wobei die BBB umgangen wurde, wodurch die Menge der Arzneimittelzubereitung reduziert wurde. Am wichtigsten ist, dass die Mäuse, die von ZNS-Metastasen aus der Her2-Antikörper-Immuntherapie-Studie geheilt wurden, gesund geblieben sind.
Eine Zusammenarbeit mit einem Hersteller zielte darauf ab, eine MRT-kompatible Version der Murine Ommaya für das PDX-Modell von LMD zu entwickeln. Da diese Prototypversion einen Abstandhalter eingebaut hat, ist keine Montage erforderlich, was eine bessere Haftung am Schädel ermöglicht. Eine Einschränkung dieses Prototyps besteht darin, dass das Gerät zwar MRT-kompatibel ist, aber dort, wo das Gerät eingefügt wird, einen Schatten erzeugt, der die Sichtbarkeit des Bildes für Quantifizierungsanalysen verringert. Die MRT-kompatible Version ist ein gutes alternatives Werkzeug, wenn ex vivo CTC-Probenahme ein limitierender Faktor ist und eine Vormarkierung von Zellen nicht möglich ist. Die Kombination eines LMD-Xenograft-Modells und der Murine Ommaya-Technik ist vorteilhaft für die Untersuchung der direkt zielgerichteten Arzneimittelwirksamkeit unter Umgehung der BBB. Die Ergebnisse dieser In-vivo-Studien sind klinisch relevant, um rationale therapeutische Strategien für Patienten mit LMD zu entwickeln.
Offenlegungen
Peter Forsyth ist außerhalb der eingereichten Arbeiten Mitglied der Beiräte von Abvie Inc., Bayer, Bristol Meyers Squib, BTG, Inovio, Novocure, Tocagen und Ziopharm. Alle anderen Autoren haben nichts preiszugeben.
Danksagungen
Wir danken Michele L. Danielson, Tricia Favors-Watson und dem Rest des Comparative Medicine Teams an der University of South Florida für ihre technische Unterstützung und die Pflege unserer Tiere. Wir danken Instech Laboratories, Inc. für ihre Bemühungen, mit uns zusammenzuarbeiten, basierend auf unserer Anfrage, eine MRT-kompatible Murine Ommaya zu entwickeln. Diese Arbeit wird von den National Institutes of Health (NIH) R21 CA216756 (an K.S.M. Smalley), Department of Defense (DOD) W81XWH1910675 (an B. Czerniecki und P. Kalinski) und den Moffitt Cancer Center CBMM Innovative Awards (an P. Forsyth und D. Duckett) unterstützt. Redaktionelle Unterstützung leistete das Office of Scientific Writing des Moffitt Cancer Center von Dr. Paul Fletcher und Daley Drucker. Über ihre regulären Gehälter hinaus wurde keine Entschädigung gewährt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mm spacer disc | Alzet, Durect Corporation | #0008670 | Spacer disc only |
| 4-0 ethilon nylon suture | Any vendor | n/a | |
| Automatic syringe pumps | Harvard Syringe Pumps (or any vendor) | #70-4505 | Pump 11 Elite |
| Bead sterilizer | Braintree Scientific Inc. (or any vendor) | #GER 5287-120V | Germinator 500 |
| Buprenorphine Sustained-Release (Bup-SR) | Zoopharm | DEA controlled | |
| Cyanoacrylate sterile adhesive | Any vendor | ||
| Gas inhalation anestehsia system | VeteEquip | #901812 | COMPAC5 |
| Hamilton microliter syringes | Hamilton | 10, 25, 50, and 100 μL | 30 G for cisterna magna injection |
| Hydrogen peroxide | Any vendor | n/a | |
| IVIS 200 imaging system | Caliper Life Sciences | n/a | |
| Magnifying glass with light | Any vendor | n/a | |
| Microdrill | Stoelting (or any vendor) | #51555M | |
| MRI imaging | Bruker | BioSpec series | Optional |
| Murine Ommaya (MRI-compatible) prototype | Instech Laboratories, Inc. | #VAB620-25MRI-3.3 | |
| Phosphate-buffered saline (PBS) | Any vendor | n/a | 0.1 mm Sterile-Filtered |
| PinPort injector | Instech Laboratories, Inc. | #PNP3M-50 | |
| PinPort | Instech Laboratories, Inc. | #1-PNP3F28-50 | |
| Rodent Surgical Instruments (Scissors, Forceps) | Roboz Surgical Instrument (or any vendor) | ||
| Stereotaxic device | Stoelting (or any vendor) | #51730M | |
| Sterile blue paper/ drape covering | Any vendor | n/a | n/a |
| Sterile cotton sticks | Any vendor | n/a |
Referenzen
- Chamberlain, M. C. Leptomeningeal metastasis. Current Opinion in Neurology. 22 (6), 665-674 (2009).
- Nayar, G., et al. Leptomeningeal disease: current diagnostic and therapeutic strategies. Oncotarget. 8 (42), 73312-73328 (2017).
- Shapiro, W. R., Johanson, C. E., Boogerd, W. Treatment modalities for leptomeningeal metastases. Seminars in Oncology. 36 (4), 46-54 (2009).
- Davies, M. A., et al. Prognostic factors for survival in melanoma patients with brain metastases. Cancer. 117 (8), 1687-1696 (2011).
- Znidaric, T., et al. Breast cancer patients with brain metastases or leptomeningeal disease: 10-year results of a national cohort with validation of prognostic indexes. Breast Journal. 25 (6), 1117-1125 (2019).
- Glitza, I. C., et al. Leptomeningeal disease in melanoma patients: An update to treatment, challenges, and future directions. Pigment Cell & Melanoma Research. 33 (4), 527-541 (2020).
- Raizer, J. J., et al. Brain and leptomeningeal metastases from cutaneous melanoma: survival outcomes based on clinical features. Neuro-oncology. 10 (2), 199-207 (2008).
- Taillibert, S., et al. Leptomeningeal metastases from solid malignancy: a review. Journal of Neurooncology. 75 (1), 85-99 (2005).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments. (75), e50326 (2013).
- Kodumudi, K. N., et al. Sequential anti-PD1 therapy following dendritic cell vaccination improves survival in a HER2 mammary carcinoma model and identifies a critical role for CD4 T cells in mediating the response. Frontiers in Immunology. 10, 1939 (2019).
- Dunn, L., et al. Murine model of wound healing. Journal of Visualized Experiments. (75), e50265 (2013).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta. 1862 (3), 442-451 (2016).
- Shackleford, G. M., et al. Continuous and bolus intraventricular topotecan prolong survival in a mouse model of leptomeningeal medulloblastoma. PLoS One. 14 (1), 0206394 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten