Method Article
研究利普托梅宁格疾病直接靶向治疗的穆林·奥马亚异种格拉夫特模型
摘要
在这里,我们描述了一个穆林异种模型,其功能类似于患者的奥马亚水库。我们开发了穆林·奥马亚,以研究治疗普遍致命的瘦素病的新疗法。
摘要
瘦素疾病 (LMD) 是一种罕见的中枢神经系统 (CNS) 转移至脑脊髓液 (CSF)。导致LMD的最常见癌症是乳腺癌和肺癌以及黑色素瘤。被诊断为LMD的患者预后非常差,通常只能存活几个星期或几个月。对LMD缺乏系统治疗疗效的一个可能原因是,由于在胆囊丛中具有完整且相对不透水的血脑屏障(BBB)或血-CSF屏障,未能在CSF中达到治疗效果的药物浓度。因此,直接在心内或静脉注射药物可以克服这些障碍。该小组已经开发出一种模型,允许长期有效提供治疗(即药物、抗体和细胞疗法)和CSF的反复采样,以确定CSF中的药物浓度和目标调制(当肿瘤微环境以小鼠为目标时)。该模型相当于一个磁共振成像兼容的Ommaya储层,临床上使用。这个模型,这是贴在头骨,已被指定为"穆林奥玛亚"。作为概念的治疗证明,人类表皮生长因子受体2抗体(克隆7.16.4)通过Murine Ommaya被输送到CSF,以治疗来自人类表皮生长因子受体2阳性乳腺癌的LMD小鼠。Murine Ommaya利用微型接入端口提高了药物输送效率,防止了过量药物的浪费:它不干扰CSF采样的分子和免疫学研究。穆林奥玛亚是有用的测试新的治疗方法在LMD的实验模型。
引言
瘦素疾病(LMD)是CCS的一种侵略性晚期转移,其中肿瘤细胞进入CSF并渗透到大脑和脊髓1的表面。导致LMD的最常见癌症包括乳腺癌和肺癌以及黑色素瘤2。LMD 会导致许多神经症状和症状,如头痛、颅神经麻痹、颈部僵硬和放射病变。LMD患者的预后通常非常差(平均存活率以周为单位衡量),并且是普遍致命的3,4,5,6,7。手术、放疗和全身化疗的治疗是姑息的。LMD的系统治疗可能会失败,因为药物渗透到CSF在完整的BBB或血液CSF屏障穿过胆囊丛1。
因此,直接在CSF中施用癌症治疗(例如药物和抗体治疗,包括检查点抑制剂和细胞疗法)可以克服这一限制。通过植入头皮下方的 Ommaya 水库,可以从患者身上获取和采样 CSF。该设备允许对癌症制剂(如甲氨蝶酯和链球菌)进行管理,并用于诊断研究(例如,LMD 的细胞学诊断以监测对治疗的反应)的 CSF 采样,而无需进行脊柱水龙头。穆林奥马亚水库被设计成模仿那些临床上使用。储层需要组装一个接入端口和隔膜部件,并修改鼠标罐装技术,使设备在整个药物研究期间保持永久完整。此设备已被指定为"穆林奥玛亚"。
与渗透输液泵技术不同,该技术要求制备多余的液体体积,以预先填充管子中的空位,并在频繁注射9时连续输液,Murine Ommaya将药物溶液的浪费降到最低。它允许使用汉密尔顿注射器、微型接入端口和自动喷油器在任何给定时间使用少量(3-7 μL)有效施用多种单剂量治疗。实时测试药物对LMD的疗效可以通过成像来确定。使用这种方法,各种化疗、抗体和细胞免疫疗法(作为单一或组合剂)可以针对LMD进行测试,将体内发现转化为患者的合理治疗策略。为了进一步提高LMD患者衍生异种移植(PDX)模型的成像能力,与制造商合作开发与Mryine Ommaya兼容的磁共振成像(MRI)版本,无需组装即可使用。MRI 功能是有益的,特别是对于 PDX 模型,其中来自 CSF 的循环肿瘤细胞 (CTC) 的数量有时是限制因素,而且通常当预贴标签的 CTC 不可行时。
本文描述了一个详细的协议,从注射CTC开始,使小鼠与LMD。然后,通过手术植入穆林奥马亚,并通过穆林奥马亚进行多个药物治疗步骤。作为演示概念的证明,进行了体内并排比较,其中穆林人类表皮生长因子受体2(Her2)抗体称为克隆7.16.4(人类相当于特拉斯塔祖马布)被交付10。抗体通过Murine Ommaya(直接靶向或院内治疗)或腹内注射(系统疗法)瞄准Her2- 乳腺癌细胞。结果表明,接受直接体内免疫治疗的LMD小鼠比接受同一疗法的老鼠存活时间要长得多。通过Murine Ommaya治疗的小鼠的CNS转移几乎在第三周治疗的第三剂中完全倒退,从而改善了整体存活率。
研究方案
该协议得到了南佛罗里达大学机构动物护理和使用委员会(IS00005974)的批准。
1. 将CTC注入CSF,生成鼠标LMD模型
- CTC 的准备工作
- 计算注射所需的CTC数量,在无菌磷酸盐缓冲盐(PBS)中,在1.0×104 细胞/μL下制备单细胞悬浮。在整个过程中将细胞悬浮在冰上或在 4 °C 下。
注意:当使用需要尝试的细胞系时,请务必用无菌 PBS 清洗细胞两次以去除试用素。使用血细胞计或自动细胞计数器执行细胞计数。如果使用大群(>50只小鼠),在注射之间重新计算细胞并验证细胞的生存能力,以确保每只小鼠管理一致数量的细胞。
- 计算注射所需的CTC数量,在无菌磷酸盐缓冲盐(PBS)中,在1.0×104 细胞/μL下制备单细胞悬浮。在整个过程中将细胞悬浮在冰上或在 4 °C 下。
- 术前手术
- 用1毫克/千克丁丙诺啡皮下注射小鼠持续释放(Bup-SR)。
注:不要注入拟切口的面积:选择远离肩骨的注射部位。 - 用2-3%异黄素麻醉鼠标,直到它没有表现出正确的反射迹象。此外,检查尾巴和/或爪捏反射,以确认麻醉状态。
- 在远离手术区域的位置为小鼠准备手术。将手术部位(即头骨的正部表面)夹上足够的边界区域,以防止毛皮污染切口部位;然后,用抗腐剂使部位饱和,从部位中心工作到周围,然后允许干燥。应用无菌窗帘或无菌胶粘剂支持的塑料窗帘材料,以保护手术现场免受污染。
注:仪器应提前自动封存,并用玻璃珠消毒器在动物之间重新消毒。 - 剃掉头部整个腹腔表面的毛皮,并使用无菌技术准备皮肤。
- 用立体定向装置的改装 L 形鼻锥定位鼻子,确保鼻孔保持清晰和开放。使用胶带穿过两个针眼的腹腔表面,轻轻地将皮肤向前拉,将其固定在鼻锥上,并在固定后以大约 90° 角弯曲颈部。管理1.5%异黄素以维持麻醉。
注:适当的定位将导致切口区域以便于识别腹骨的烧灼脊的方式呈现。 - 将身体定位以确保脊柱与西斯特纳巨无霸保持水平,同时对尾部施加轻微牵引力,将胶带放在尾部底部以固定。
- 用1毫克/千克丁丙诺啡皮下注射小鼠持续释放(Bup-SR)。
- 手术西斯特纳麦格纳注射
- 随着颈部的完全延伸,并开始只是之间的针刺,运行手术剪刀尖向下与轻微的压力穿过腹腔骨。
注:虽然在这个中线位置,当剪刀尖浸入西斯特纳巨无霸的凹面区域时,一个小的凹陷是明显的。 - 在苍白的凹面上方做一个3-5毫米的中线切口。将 5 μL 的细胞悬浮在 1.0 × 104 细胞/μL(总计 5.0 ×10 4 个细胞)中绘制成 30 G Hamilton 注射器。
- 使用具有 1-2 mm 尖端的钝尖钳子轻轻按压西斯特纳巨无霸。在封闭式位置引入提示,并在对 dura 施加向下压力时打开提示。
- 重复前一步描述的钝解剖,直到杜拉尔膜很容易识别,相关血管在暴露区域可见。
注:由此产生的注射窗口确保血管在插入针头时未受损。 - 当将钳子打开以收回周围的肌肉时,在杜拉下引入一根30G的非结扎针,以可视化斜面。确保针头只引入斜面本身之外。慢慢地部署注射器柱塞,并在杜拉正下方输送细胞。
- 正确放置斜面,观察杜拉下方的注射。小心管理该技术,并使用30G非胸针,以防止对膜的损害,并确保最小的泄漏。如果注意到泄漏,请使用棉尖施用器施加温和的压力。
- 通过涂抹伤口夹或皮肤粘合剂的微滴来关闭皮肤。注射成功后,让小鼠在温暖的毯子上从麻醉中恢复过来,持续观察它们,直到它们能够保持胸骨位置并表现出有目的的运动。
- 手术后第一周每天监测小鼠。如果小鼠似乎处于疼痛或痛苦之中,根据兽医咨询和指示,每12至24小时注射10毫克/千克皮下注射一次卡洛芬,最长达5天。让小鼠恢复并监测它们至少48至72小时,然后再进入下一步。
注意:Bup-SR,先发制人,将持续长达72小时,所以额外的镇痛药通常是没有必要的。然而,动物将根据需要提供额外的镇痛药(如果昏昏欲睡,不吃,皱褶)。如果手术部位出现术后感染迹象(即发红、肿胀、发嫩、同位素、高镇痛、超病或脓肿),或者如果小鼠在守卫受影响区域,则对小鼠实施安乐死。如果癌细胞成功注射到CSF中,LMD和肿瘤进展将在1或2周内在CNS中发展(取决于使用的CTC或细胞系的类型)(图1)。
- 随着颈部的完全延伸,并开始只是之间的针刺,运行手术剪刀尖向下与轻微的压力穿过腹腔骨。
2. 穆林·奥马亚组装和植入
- 车站准备
- 消毒站面。将蓝色覆盖物覆盖在表面上,并准备好 图2中指示的所有消毒工具和用品。
- 术前手术
- 应用镇痛 (Bup-SR), 并保持第 1.2 节中描述的无菌技术。
- 穆林·奥马亚的手术植入
- 使用 25 G(0.51 mm 外径)微型喷射端口和 1 mm 隔膜盘组装 Murine Ommaya 喷射装置。使用氰丙烯酸酯无菌粘合剂,确保约2.5毫米的金属管进入右脑半球(图3A-C)。
注:该实验室开发了一个与MRI兼容的鼠标Ommaya原型,该实验室已经将两个部件(微型喷射端口和隔膜)3D打印成一个单元(图3D)。单个单元版本由 MRI 测试,可以通过消除装配步骤节省时间。 - 用 2-3% 异黄素麻醉鼠标,直到没有右反射的迹象。此外,检查尾巴和/或爪捏反射,以确认麻醉状态。
- 剃掉毛皮头部的整个腹腔表面,并根据无菌技术准备皮肤,如先前在第1.2.3步中所述。将鼠标放在带有鼻锥的立体定向装置中,以便在手术过程中继续异黄素管理:将异黄素降至1.5%。轻轻地拧紧耳塞以固定头部,并涂抹眼部润滑剂以遮盖鼠标的眼睛。
- 做一个小的皮肤切口(3毫米),然后钝解剖底层皮下组织,以暴露头骨。使用过氧化氢浸泡棉尖施用棒干燥头骨。
- 在头骨 0.5 mm 后部和 1.1 mm 侧向的胸腔中钻一个毛刺孔 - 头骨上的解剖点,其中冠状缝合线被下垂缝合线 (图 3A)垂直交叉 - 以及一个 0.9 毫米毛刺孔,以暴露杜拉母体。将微褶皱移到一边,在插入注射端口(深度约 2.5 mm)之前,轻轻地在毛刺孔周围给骨头打分,然后使用氰化物无菌粘合剂贴在头骨上。注射点周围的国家缝合使用4-0无吸收尼龙缝合在中断的缝合模式或钱包字符串缝合11。
- 将手术后的小鼠关在单独的笼子里进行手术恢复。
注:当多个手术康复的老鼠被安置在同一个笼子里时,Murine Ommaya可能会脱落,可能是由于不断的篡改相互作用。建议在药物疗效试验过程中,将植入的Murine Ommaya植入的小鼠单独安置(或每个笼子不超过2只小鼠)。
- 使用 25 G(0.51 mm 外径)微型喷射端口和 1 mm 隔膜盘组装 Murine Ommaya 喷射装置。使用氰丙烯酸酯无菌粘合剂,确保约2.5毫米的金属管进入右脑半球(图3A-C)。
3. 穆林·奥马亚治疗
- 使用穆林奥马亚剂量小鼠
- 用2-3%异黄素麻醉鼠标,直到没有纠正反射的迹象。此外,检查尾巴和/或爪捏反射,以确认麻醉的维护。
- 使用端口注射适配器和汉密尔顿注射器访问穆林奥马亚。使用钳子,握住微型喷射端口的顶部,轻轻地将端口喷射器适配器完全插入端口的隔膜中。
注:端口喷油器穿透端口隔膜的方式,将死空间减少到最低限度,并允许通过电动注射器泵进行受控注射(图4A)。在麻醉期间,以1微升/分钟的流动速度注射靶向/新疗法。根据研究人员的判断,治疗将按指定的时间间隔(每日/每周)进行,持续时间为固定时间(周/月)。
3 到 7 μL 之间的音量是最佳的,因为 3 μL <体积不可靠,7 μL >体积可能会造成太大的压力。Hamilton 注射器的大小范围从 10 到 100 μL 不等,具体取决于每个治疗臂中的鼠标数量。将适当的音量预装到汉密尔顿注射器中将防止重复更换注射器,从而最大限度地减少错误。最好每个治疗手臂奉献 1 个汉密尔顿注射器。 - 注射后,使用钳子将 Murine Ommaya 从端口注射适配器中分离出来,并将鼠标放回笼中,从麻醉中恢复过来,如上文第 1.3.7 步所述。
- 安乐死
- 通过从压缩的水箱源中吸入二氧化碳(CO2),使老鼠安乐死。让小鼠暴露在二氧化碳 浓度增加的状态(即使用室积/分钟 10% 到 30% 的位移速率),以避免或尽量减少不适或苦恼。监测小鼠,直到保证停止心血管和呼吸运动。
结果
在小鼠中,CSF 的总体积约为 35-40 μL,以大约 350 nL/分钟的速度产生:它每天翻12-13次12。为了可视化注射的路线,2%的埃文斯蓝通过穆林Ommaya模型注射,然后15分钟和30分钟被允许过去之前收获的大脑进行分析。染料在15分钟内成功渗透到心室和大脑。在30分钟内,染料在脊髓上变得可见(图4)。
作为概念的证明,BALB/c小鼠被注射了带有荧光酶标签的Her2+TUBO 乳腺癌细胞系,并植入了穆林奥马亚斯。注射癌细胞大约1周后,小鼠开始发展LMD。这些小鼠每周接受一次长达4周的Her2抗体免疫治疗,无论是通过腹内注射进行全身治疗,还是通过Murine Ommaya(图5A)进行内科治疗。
虽然未经治疗的小鼠在第19天死亡,但所有通过穆林·奥马亚接受内科治疗的小鼠都幸存了下来(P = 0.004)。到第4周,观察到肿瘤的完全回归。与接受全身治疗的小鼠相比,接受体内治疗的小鼠总体存活时间要长得多(图5B)。
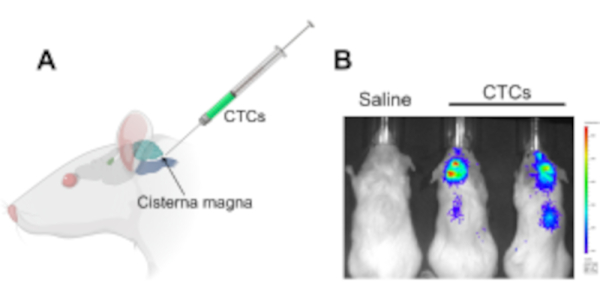
图1:将循环肿瘤细胞注射到血清异种模型中的西斯特纳巨无霸中,以研究瘦子病和中枢神经系统转移。 (A) 一个图示,显示西斯特纳巨无霸和CSF访问部位的位置,其中使用汉密尔顿注射器注射CTC。(B) 与循环肿瘤细胞注射2周后,患上瘦小板疾病和中枢神经系统转移(大脑和脊髓沿)的小鼠的代表性IVIS图像。细胞被标记为荧光素酶的记者基因。注射盐水的对照动物没有发展成肿瘤(n = 3),实验是在三重体中进行的。缩写:CTC = 循环肿瘤细胞;IVIS = 体内成像系统。 请单击此处查看此图的较大版本。
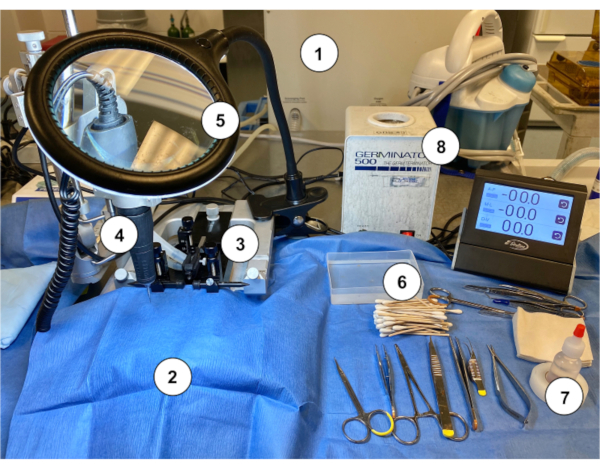
图2:在小鼠中进行穆林·奥马亚植入的工作站设置示例。(1) 气体麻醉机/蒸发器。(2) 无菌蓝纸窗帘覆盖立体式支架。(3) 立体定型音响设备(支架/舞台、耳塞、鼻锥)。(4) 微钻。(5) 带光的放大镜。(6) 无菌棉敲击施用棒与无菌盐水冲洗容器。(7) 过氧化氢。(8) 珠消毒器。请单击此处查看此图的较大版本。
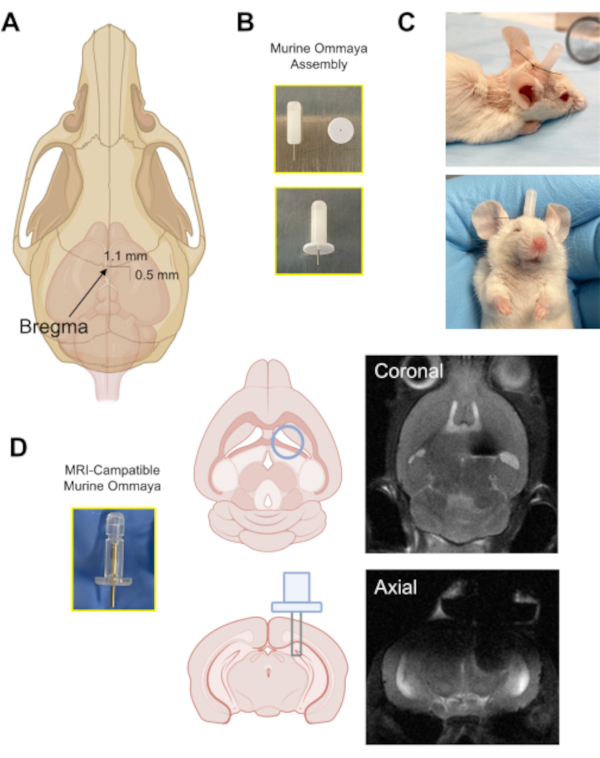
图3:穆林·奥马亚装置的植入(A) 一个箭头指向头骨上的布雷格玛位置的插图,以及用微缩钻头在头骨(0.5毫米后/1.1毫米横向)中钻毛刺孔的大致距离。(B) 木林奥玛亚是结合一个金属管和一个1毫米的垫片作为粘合头骨的基础组装。(C) 植入穆林·奥马亚斯的小鼠代表图像:这些小鼠在接受任何注射前都受到监测,以确保它们明亮、警觉和反应。(D) 原型磁共振成像兼容的穆林奥马亚和代表脑磁共振成像图像的穆林奥玛亚植入物的例子。请单击此处查看此图的较大版本。
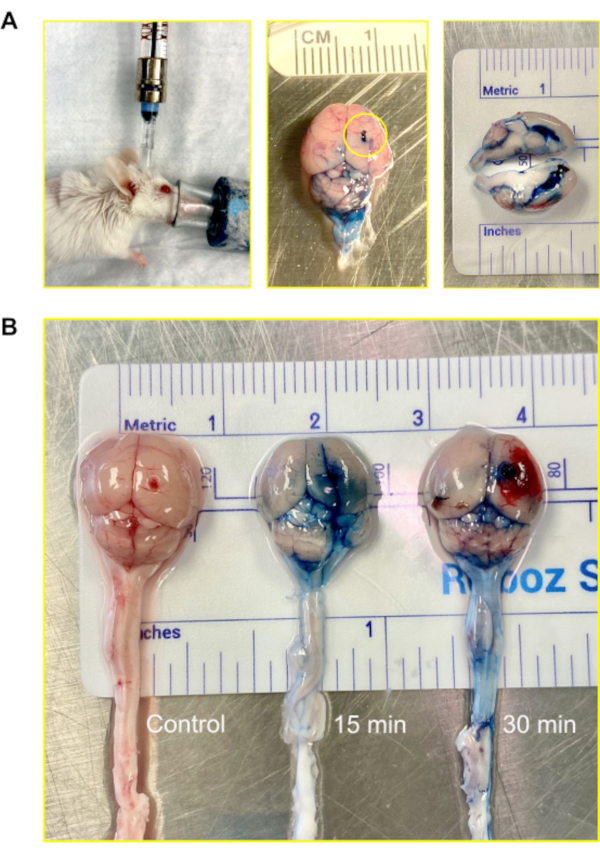
图4:使用穆林·奥马亚(A)注射静脉注射,通过穆林·奥马亚进入心室和中枢神经系统。小鼠在注射期间仍然处于麻醉状态。在示例中,Murine Ommaya 连接到连接到预填充汉密尔顿注射器的微型端口。注射使用自动注射集,输液速率为 1 μL/分钟,体积为 5-7 μL。显示的是注入埃文斯蓝的老鼠大脑的图像。圆圈显示穆林·奥马亚的依附位置。在大脑的外部没有发现染料的泄漏。大脑的横截面显示横向心室充满了染料:染料没有穿透大脑的帕伦奇马。(B) 注射埃文斯蓝染料后15分钟和30分钟后老鼠大脑的图像。染料渗入大脑(15分钟),开始在脊髓上循环(30分钟)。在5只小鼠中,4只接受染料进行可视化,1只用作对照。实验在三重中重复。请单击此处查看此图的较大版本。
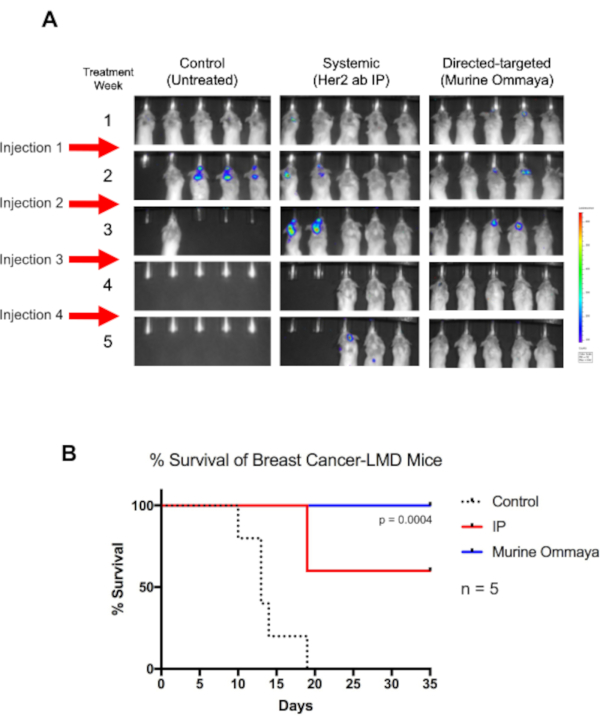
图5:使用Murine Ommaya的直接靶向免疫疗法可增加乳腺癌相关瘦肉病小鼠的整体存活率。 (A) BALB/c小鼠被注射了由红斑狼菌标记的人类表皮生长因子受体2阳性TUBO细胞,一种穆林乳腺癌细胞系。在西斯特纳大麦格纳注射三天后,穆林·奥马亚斯被植入。小鼠在注射1周后开始发展瘦身病(LMD)。LMD小鼠通过腹内注射或通过内膜(Murine Ommaya)系统地使用人类表皮生长因子受体抗体进行治疗,作为直接靶向方法。每周注射一次,最长达4周。与未经治疗的小鼠相比,接受免疫治疗的小鼠存活的时间要长得多。穆林·奥马亚小鼠在第四周就完全疾病复发,这些小鼠最终治愈了疾病。(B) 这些小鼠的存活率中位数也显著提高(曼特尔-考克斯测试: P = 0.004;n = 每个治疗手臂 5 只小鼠), 整体存活率高于系统治疗的 LMD 小鼠。缩写: LMD = 瘦身病;IP = 开胃内。请单击此处查看此图的较大版本。
讨论
在这里,Murine Ommaya被描述为一个可靠的模型,它允许在LMD和其他CNS相关疾病的临床前模型中反复将抗癌剂管理到CSF空间。CSF是从小鼠身上取样的,而设备仍然不间断地连接。这种直接靶向治疗异种模式是开发和测试LMD合理治疗策略的重要一步。从西斯特纳巨无霸注射到LMD发展的初始迹象的时间因癌细胞类型而异。LMD 和 CNS 转移在 CTC 接种后大约 1 或 2 周开始形成。如果使用高增殖性癌细胞系,则有可能在<7天内发生转移。在这种情况下,由于肿瘤生长的血管化有时可以使植入穆林奥玛亚具有挑战性。应对这一挑战的一个解决方案是减少注射到CSF空间的癌细胞数量,在肿瘤发育之前留有更多的时间。此外,该协议已优化,以植入穆林Ommaya不迟于72小时后,西斯特纳巨无霸注射,以确保有足够的时间让小鼠从手术恢复之前的第一次治疗。研究人员应在规划治疗方案之前,先计算异种取种模型中CTC的生长速度。
虽然还有其他直接的静脉内输送方法,如使用渗透泵系统或内腹腔(ICV)玻利瓦尔注射,如前所述9,有几个优点,使用穆林Ommaya模型。例如,ICV bolus 注射是在一次分娩中完成的,而 Murine Ommaya 允许在任何时候进行多种剂量的治疗,无论是作为单个剂还是作为联合疗法给予。渗透泵设计用于在泵需要更换之前维持长达 14、28 或 42 天,有时如果使用带有较小泵的较小鼠标,则更频繁。更换渗透泵需要外科手术,这给携带肿瘤的小鼠增加了压力。只要设备完好无损,长期实验就不需要更换木林奥马亚。它还最大限度地减少了更换泵9所带来的潜在变异性。在实验鼠体内植入的Murine Ommayas保持完整时间超过42天,这一持续时间允许长期治疗方案。
先前的发现表明,与输液13的长时间药物输送过程相比,脉动间歇性剂量进入CSF对LMD有更好的疗效。使用渗透泵系统进行重复单剂量注射是不可能的。每次注射后,没有简单的方法可以冲洗出剩余的滞留液体。渗透泵也仅限于提供兼容或单一药物的混合物,通常需要更高的药物制剂量才能持续输液。相比之下,Murine Ommaya 设计用于精确的微注射,只需 3 到 7 μL,无需考虑死空间,而且研究人员可以使用的药物类型没有限制,包括免疫细胞治疗。如果特定样品是珍贵的,并且最大限度地利用该资源,Murine Ommaya 还会最大限度地减少试剂浪费。对于任何需要多种抗癌疗法的治疗方案,Murine Ommaya 易于使用,感染或手术不幸的风险极小,采用其他方法重复通过手术或用针头重复分娩获得 CSF。Murine Ommaya为研究人员提供了调整药物浓度和剂量频率的灵活性,并根据感兴趣的研究评估研究的目标调制和持续时间。
Murine Ommaya的一个局限性是,研究人员可能发现很难将设备植入较小的小鼠体内。因此,最好使用至少8至10周大的小鼠。如果在植入步骤期间设备没有固定在头骨上,胶水磨损,或者如果小鼠磨蚀性地篡改了头骨,Murine Ommaya 就有可能在治疗试验中脱落。后一种情况更频繁地发生,当多个老鼠被安置在同一个笼子里。因此,建议在治疗计划期间,每个笼子内容纳不超过两只穆林·奥马亚植入的小鼠。此协议经过修改,可在垫片上涂抹氰丙烯酸酯无菌粘合剂,这被认为是将垫片粘附在头骨表面并防止 Murine Ommaya 脱落的最有效的胶水。结果表明,LMD小鼠通过穆林奥马亚直接接受体内治疗,整体存活率有所提高。单个微升体积可以安全地管理,绕过BBB,从而减少药物制剂量。最重要的是,从Her2抗体免疫治疗研究中治愈的CNS转移的小鼠保持健康。
与制造商的合作旨在为 LMD 的 PDX 模型开发与 MRI 兼容的 Murine Ommaya 版本。由于此原型版本包含了隔板,因此无需组装,从而更好地粘合头骨。此原型的一个局限性是,尽管设备与 MRI 兼容,但它会在插入设备时生成阴影,从而降低图像的可见性以进行量化分析。当前体内CTC采样是一个限制因素,并且预贴标签细胞不可行时,与MRI兼容的版本是一个很好的替代工具。LMD 异种格拉夫特模型和穆林奥马亚技术的结合有利于研究绕过 BBB 的直接靶向药物疗效。这些活体研究的结果在临床上与为LMD患者设计合理的治疗策略有关。
披露声明
彼得·福赛斯在提交的作品之外,担任Abvie公司、拜耳、布里斯托尔·迈耶斯·斯奎布、BTG、伊诺维奥、诺沃卡雷、托卡根和齐奥法姆的顾问委员会成员。所有其他作者都没有什么可透露的。
致谢
我们要感谢米歇尔·丹尼尔森,特里西娅·法沃斯-沃特森,以及南佛罗里达大学比较医学团队的其他成员,感谢他们的技术支持和维护我们的动物。我们感谢 Instech 实验室公司根据我们开发与 MRI 兼容的 Murine Ommaya 的要求与我们合作的努力。这项工作得到国家卫生研究院(NIH)R21 CA216756(致K.S..M斯莫利)、国防部(DOD)W81XWH1910675(致B.切尼茨基和P.卡林斯基)以及莫菲特癌症中心CBMM创新奖(授予P.福西斯和D.达克特)的支持。编辑协助由莫菲特癌症中心的科学写作办公室由保罗·弗莱彻博士和戴利·德鲁克博士提供。除了他们的正常工资外,没有给予任何补偿。
材料
| Name | Company | Catalog Number | Comments |
| 1 mm spacer disc | Alzet, Durect Corporation | #0008670 | Spacer disc only |
| 4-0 ethilon nylon suture | Any vendor | n/a | |
| Automatic syringe pumps | Harvard Syringe Pumps (or any vendor) | #70-4505 | Pump 11 Elite |
| Bead sterilizer | Braintree Scientific Inc. (or any vendor) | #GER 5287-120V | Germinator 500 |
| Buprenorphine Sustained-Release (Bup-SR) | Zoopharm | DEA controlled | |
| Cyanoacrylate sterile adhesive | Any vendor | ||
| Gas inhalation anestehsia system | VeteEquip | #901812 | COMPAC5 |
| Hamilton microliter syringes | Hamilton | 10, 25, 50, and 100 μL | 30 G for cisterna magna injection |
| Hydrogen peroxide | Any vendor | n/a | |
| IVIS 200 imaging system | Caliper Life Sciences | n/a | |
| Magnifying glass with light | Any vendor | n/a | |
| Microdrill | Stoelting (or any vendor) | #51555M | |
| MRI imaging | Bruker | BioSpec series | Optional |
| Murine Ommaya (MRI-compatible) prototype | Instech Laboratories, Inc. | #VAB620-25MRI-3.3 | |
| Phosphate-buffered saline (PBS) | Any vendor | n/a | 0.1 mm Sterile-Filtered |
| PinPort injector | Instech Laboratories, Inc. | #PNP3M-50 | |
| PinPort | Instech Laboratories, Inc. | #1-PNP3F28-50 | |
| Rodent Surgical Instruments (Scissors, Forceps) | Roboz Surgical Instrument (or any vendor) | ||
| Stereotaxic device | Stoelting (or any vendor) | #51730M | |
| Sterile blue paper/ drape covering | Any vendor | n/a | n/a |
| Sterile cotton sticks | Any vendor | n/a |
参考文献
- Chamberlain, M. C. Leptomeningeal metastasis. Current Opinion in Neurology. 22 (6), 665-674 (2009).
- Nayar, G., et al. Leptomeningeal disease: current diagnostic and therapeutic strategies. Oncotarget. 8 (42), 73312-73328 (2017).
- Shapiro, W. R., Johanson, C. E., Boogerd, W. Treatment modalities for leptomeningeal metastases. Seminars in Oncology. 36 (4), 46-54 (2009).
- Davies, M. A., et al. Prognostic factors for survival in melanoma patients with brain metastases. Cancer. 117 (8), 1687-1696 (2011).
- Znidaric, T., et al. Breast cancer patients with brain metastases or leptomeningeal disease: 10-year results of a national cohort with validation of prognostic indexes. Breast Journal. 25 (6), 1117-1125 (2019).
- Glitza, I. C., et al. Leptomeningeal disease in melanoma patients: An update to treatment, challenges, and future directions. Pigment Cell & Melanoma Research. 33 (4), 527-541 (2020).
- Raizer, J. J., et al. Brain and leptomeningeal metastases from cutaneous melanoma: survival outcomes based on clinical features. Neuro-oncology. 10 (2), 199-207 (2008).
- Taillibert, S., et al. Leptomeningeal metastases from solid malignancy: a review. Journal of Neurooncology. 75 (1), 85-99 (2005).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments. (75), e50326 (2013).
- Kodumudi, K. N., et al. Sequential anti-PD1 therapy following dendritic cell vaccination improves survival in a HER2 mammary carcinoma model and identifies a critical role for CD4 T cells in mediating the response. Frontiers in Immunology. 10, 1939 (2019).
- Dunn, L., et al. Murine model of wound healing. Journal of Visualized Experiments. (75), e50265 (2013).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta. 1862 (3), 442-451 (2016).
- Shackleford, G. M., et al. Continuous and bolus intraventricular topotecan prolong survival in a mouse model of leptomeningeal medulloblastoma. PLoS One. 14 (1), 0206394 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。