Method Article
Um modelo de xenoenxerto Murine Ommaya para estudar terapia direta da doença leptomeningeal
Neste Artigo
Resumo
Aqui, descrevemos um modelo de xenoenxerto de murina que se assemelha funcionalmente a um reservatório de Ommaya em pacientes. Desenvolvemos a Murine Ommaya para estudar novas terapêuticas para a doença leptomeningeal universalmente fatal.
Resumo
A doença leptomeningeal (LMD) é um tipo incomum de metástase do sistema nervoso central (SNC) ao fluido espinhal cerebral (CSF). Os cânceres mais comuns que causam LMD são cânceres de mama e pulmão e melanoma. Pacientes diagnosticados com LMD têm um prognóstico muito ruim e geralmente sobrevivem por apenas algumas semanas ou meses. Uma possível razão para a falta de eficácia da terapia sistêmica contra lMD é a falha em alcançar concentrações terapêuticamente eficazes de droga no CSF devido a uma barreira hematoencefálica intacta e relativamente impermeável (BBB) ou barreira sanguínea-CSF através do plexo coroide. Portanto, administrar diretamente drogas intratecally ou intraventricularmente pode superar essas barreiras. Esse grupo desenvolveu um modelo que permite a entrega efetiva de terapêuticas (ou seja, drogas, anticorpos e terapias celulares) cronicamente e a amostragem repetida de CSF para determinar concentrações de medicamentos e modulação de alvo no CSF (quando o microambiente tumoral é direcionado em camundongos). O modelo é o equivalente murino de um reservatório Ommaya compatível com ressonância magnética, que é usado clinicamente. Este modelo, que é afixado no crânio, foi designado como o "Murine Ommaya". Como prova terapêutica de conceito, o receptor do fator de crescimento epidérmico humano 2 anticorpos (clone 7.16.4) foram entregues no CSF através do Murine Ommaya para tratar camundongos com LMD do receptor de fator de crescimento epidérmico humano 2-positivo câncer de mama. O Murine Ommaya aumenta a eficiência da entrega de medicamentos usando um porto de acesso em miniatura e previne o desperdício de excesso de droga; não interfere na amostragem de CSF para estudos moleculares e imunológicos. O Murine Ommaya é útil para testar novas terapêuticas em modelos experimentais de LMD.
Introdução
A doença leptomeningeal (LMD) é uma metástase agressiva em estágio avançado do SNC, na qual as células tumorais acessam o CSF e se infiltram na superfície do cérebro e da medulaespinhal 1. Os cânceres mais comuns que causam LMD incluem os da mama e do pulmão, bem como o melanoma2. A LMD resulta em uma série de sintomas neurológicos e sinais como dores de cabeça, paralisias nervosas cranianas, pescoço duro e radiculopatias. O prognóstico para pacientes com LMD é geralmente muito ruim (a sobrevida média é medida em semanas) e é universalmente fatal3,4,5,6,7. O tratamento com cirurgia, radiação e quimioterapia sistêmica é paliativo. A terapia sistêmica para LMD pode falhar devido à penetração inadequada de drogas no CSF através de uma barreira BBB intacta ou sangue-CSF através do plexo coroide1.
Portanto, a administração terapêutica do câncer (por exemplo, medicamentos e tratamentos à base de anticorpos, incluindo inibidores de checkpoint e terapias celulares) diretamente no CSF pode superar essa limitação8. O acesso e amostragem de CSF de pacientes é possível através de um reservatório de Ommaya que é implantado sob o couro cabeludo. Este dispositivo permite a administração de agentes oncológicos (por exemplo, metotrexato e trastuzumab) bem como a amostragem de CSF para estudos diagnósticos (por exemplo, o diagnóstico citológico da LMD para monitorar as respostas ao tratamento) sem realizar uma punção espinhal. Um reservatório de Murine Ommaya foi projetado para imitar aqueles usados clinicamente. O reservatório requer a montagem de uma porta de acesso e partes espaçadoras e uma modificação da técnica de cannulação do rato, que permite que o dispositivo permaneça permanentemente intacto durante toda a duração do estudo da droga. Este dispositivo foi designado como o "Murine Ommaya".
Em contraste com a técnica da bomba de infusão osmótica, que requer a preparação de volumes líquidos excedentes para pré-encher o espaço vazio na tubulação e infusão contínua sobre injeções frequentes9, o Murine Ommaya minimiza o desperdício de soluções medicamentosas. Permite a administração efetiva de múltiplas doses únicas de tratamentos a qualquer momento em pequenas quantidades (3-7 μL) no CSF usando uma seringa Hamilton, uma porta de acesso em miniatura e um injetor automático. Em tempo real, a eficácia dos medicamentos de teste contra LMD pode ser determinada por imagem. Usando essa abordagem, uma variedade de quimoterapias, anticorpos e imunoterápicos celulares (como agentes únicos ou combinados) pode ser testada contra LMD para traduzir achados in vivo em estratégias de tratamento racional para os pacientes. Para melhorar ainda mais a capacidade de imagem de um modelo de Xenerx (PDX) derivado do paciente ( PDX), uma colaboração foi realizada com um fabricante para desenvolver uma versão compatível com ressonância magnética (MRI) do Murine Ommaya, que não requer montagem e está pronta para uso. A capacidade de ressonância magnética é benéfica, especialmente para modelos de PDX em que a quantidade de células tumorais circulantes (CTCs) de CSF é às vezes o fator limitante, e muitas vezes quando os CTCs pré-rotulantes são inviáveis.
Este artigo descreve um protocolo detalhado que começa com a injeção de CTCs para renderizar camundongos com LMD . O Murine Ommaya é então implantado cirurgicamente, e várias etapas de tratamento medicamentoso através do Murine Ommaya são realizadas. Como prova de conceito para demonstração, foi realizada uma comparação in vivo lado a lado, na qual foi entregue o anticorpo 2 (Her2) do fator de crescimento humano murino chamado clone 7.16.4 (o equivalente humano de trastuzumab)10. O anticorpo tem como alvo as células cancerígenas de mama Her2+ através da Murine Ommaya (terapia direta ou intratecal) ou por injeção intraperitoneal (terapia sistêmica). Os resultados mostraram que camundongos com LMD que receberam imunoterapia intratecal direta viveram significativamente mais tempo do que aqueles tratados com a mesma terapia sistematicamente. As metástases cns em camundongos tratados através do Murine Ommaya foram quase completamente regredidas pela terceira dose da terceira semana de tratamento, resultando em melhor sobrevida geral.
Protocolo
O protocolo foi aprovado pelo Comitê institucional de Cuidados e Uso de Animais da Universidade do Sul da Flórida (IS00005974).
1. Injeção de CTCs em CSF para gerar um modelo LMD do mouse
- Preparação de CTCs
- Calcule o número de CTCs necessários para a injeção e prepare uma suspensão unicelular a 1,0 × 104 células/μL em solução salina tamponada com fosfato estéril (PBS). Coloque a suspensão celular no gelo ou a 4 °C durante todo o procedimento.
NOTA: Ao usar linhas celulares que requerem trippsinização, certifique-se de lavar as células duas vezes com PBS estéril para remover a trippsina. Realize a contagem de células usando um hemocitômetro ou um contador automatizado de células. Se uma grande coorte (>50 camundongos) for usada, reconta as células e valide a viabilidade celular entre as injeções para garantir que um número consistente de células seja administrada por rato.
- Calcule o número de CTCs necessários para a injeção e prepare uma suspensão unicelular a 1,0 × 104 células/μL em solução salina tamponada com fosfato estéril (PBS). Coloque a suspensão celular no gelo ou a 4 °C durante todo o procedimento.
- Procedimento pré-cirúrgico
- Injete subcutâneamente o mouse com 1 mg/kg de buprenorfina (Bup-SR).
NOTA: Não injete a área de incisão proposta; escolha um local de injeção bem longe da escápula. - Anestesiar o rato com isoflurane de 2-3% até que não mostre sinais do reflexo de direita. Além disso, verifique se há reflexo de aperto de cauda e/ou pata para confirmar o estado da anestesia.
- Prepare o mouse para cirurgia em um local remoto da área de operação. Corte o local cirúrgico (ou seja, a superfície dorsal do crânio) com área de borda suficiente para evitar que a pele contamine o local da incisão; em seguida, saturar o local com antisséptico da pele germicidal, trabalhando do centro do local até a periferia, e depois deixe secar. Aplique uma cortina de plástico estéril ou um material de cortina de plástico estéril apoiado por adesivo para proteger o local cirúrgico da contaminação.
NOTA: Os instrumentos devem ser autoclavados com antecedência e pontas reesteremissuadas entre os animais usando um esterilizador de contas de vidro. - Raspe a pele de toda a superfície ventral da cabeça, e prepare a pele usando técnica estéril.
- Desloque o nariz com um cone de nariz modificado em forma de L do aparelho estereotático, garantindo que as nares permaneçam claras e abertas. Usando fita adesiva através das superfícies ventral de ambos os pinnae, puxe suavemente a pele para a frente para fixá-la ao cone do nariz, e dobre o pescoço em um ângulo de aproximadamente 90° uma vez fixado. Administrar 1,5% de isoflurane para manter a anestesia.
NOTA: O posicionamento adequado resultará na apresentação da área de incisão de forma a permitir a fácil identificação da crista caudal do osso occipital. - Posicione o corpo para garantir que a coluna seja mantida nivelada com a cisterna magna, e ao aplicar ligeira tração na cauda, coloque fita na base traseira para fixar.
- Injete subcutâneamente o mouse com 1 mg/kg de buprenorfina (Bup-SR).
- Injeção cirúrgica de cisterna magna
- Com o pescoço em plena extensão, e começando apenas entre o pinnae, execute as pontas da tesoura cirúrgica para baixo com leve pressão através do osso occipital.
NOTA: Enquanto nesta posição de linha média, uma pequena depressão é perceptível quando as pontas da tesoura mergulham na área côncava sobre a cisterna magna. - Faça uma pequena incisão de 3-5 mm de linha média logo acima da concavidade palpada. Desenhe 5 μL de suspensão celular a 1,0 × 104 células/μL (total de 5,0 × 104 células) em uma seringa Hamilton de 30 G.
- Use fórceps de ponta sem corte com pontas de 1-2 mm para pressionar suavemente a cisterna magna. Introduza dicas em posição fechada e abra-as enquanto aplica pressão para baixo na dura.
- Repetição de dissecção contundente descrita na etapa anterior até que a membrana dural seja facilmente identificada, e os vasos sanguíneos associados sejam visíveis na área exposta.
NOTA: A janela de injeção resultante garante que os vasos sanguíneos não estejam danificados durante a inserção da agulha. - Enquanto segura os fórceps abertos para retrair a musculatura circundante, introduza uma agulha de 30 G sem cor sob a dura para visualizar o bisel. Certifique-se de que a agulha só é introduzida um pouco além do próprio chanfrado. Implante lentamente um êmbolo de seringa e entregue células logo abaixo da dura.
- Coloque corretamente o bisel para observar a injeção sob a dura. Administre cuidadosamente a técnica e use a agulha de 30 G não coring para evitar danos à membrana e garantir um vazamento mínimo. Se for observado vazamento, aplique pressão suave com um aplicador de ponta de algodão.
- Feche a pele aplicando um clipe de ferida ou micro-gota de adesivo de pele. Uma vez que a injeção é realizada com sucesso, permita que os camundongos se recuperem da anestesia em um cobertor quente, observando-os continuamente até que eles possam manter a posição severa e demonstrar movimento proposital.
- Monitore os ratos diariamente após a cirurgia durante a primeira semana. Se um rato parece estar com dor ou angústia, trate-o com injeção subcutânea de 10 mg/kg de carprofeno uma vez a cada 12 a 24 horas por até 5 dias com base em consulta veterinária e diretiva. Permita que os ratos os recuperem e monitorem-nos por pelo menos 48 a 72 h antes de prosseguir para a próxima etapa.
NOTA: Bup-SR, dado preventivamente, durará até 72 h, de modo que analgésicos adicionais normalmente não são necessários. No entanto, os animais serão fornecidos analgésicos adicionais conforme necessário (se letárgico, não comer, babado). Se um local cirúrgico desenvolve sinais de infecção pós-operatória (ou seja, vermelhidão, inchaço, ternura, alodiánia, hiperalgesia, hiperalgesia ou suppuração), ou se o rato estiver protegendo a área afetada, eutanize o camundongo. Se as células cancerígenas forem injetadas com sucesso no CSF, a LMD e a progressão do tumor se desenvolverão no SNC dentro de 1 ou 2 semanas (dependendo dos tipos de CTCs ou linha celular utilizada)(Figura 1).
- Com o pescoço em plena extensão, e começando apenas entre o pinnae, execute as pontas da tesoura cirúrgica para baixo com leve pressão através do osso occipital.
2. Montagem e implantação de Murine Ommaya
- Preparação da estação
- Desinfete a superfície da estação. Coloque uma cobertura azul sobre a superfície e mantenha pronta todas as ferramentas e suprimentos esterilizados indicados na Figura 2.
- Procedimento pré-cirúrgico
- Aplique analgesia (Bup-SR) e mantenha a técnica estéril conforme descrito na seção 1.2.
- Implantação cirúrgica de Murine Ommaya
- Monte o dispositivo de injeção Murine Ommaya usando uma porta de injeção em miniatura de 25 G (0,51 mm de diâmetro exterior) e um disco espaçador de 1 mm. Use um adesivo estéril cianoacrilato para garantir a penetração de aproximadamente 2,5 mm da cânula metálica no hemisfério cerebral direito(Figura 3A-C).
NOTA: Um protótipo de Mouse Ommaya compatível com ressonância magnética foi desenvolvido neste laboratório, que já possui ambas as peças (porta de injeção em miniatura e espaçador) impressas em 3D juntas como uma única unidade(Figura 3D). A versão de unidade única foi testada por ressonância magnética e pode economizar tempo eliminando a etapa de montagem. - Anestesiar o rato com isoflurane de 2-3% até que não haja sinais do reflexo de direito. Além disso, verifique se há reflexo de aperto de cauda e/ou pata para confirmar o estado da anestesia.
- Raspe toda a superfície ventral da cabeça de pele, e prepare a pele de acordo com a técnica estéril, como descrito anteriormente na etapa 1.2.3. Coloque o mouse no aparelho estereotático com um cone de nariz para continuar a administração isoflurane durante o procedimento; diminuir o isoflurane para 1,5%. Aperte suavemente as barras de ouvido para fixar a cabeça e aplique lubrificante ocular para cobrir os olhos do mouse.
- Faça uma pequena incisão cutânea (3 mm), seguida de dissecção contundente dos tecidos subcutâneos subjacentes para expor o crânio. Seque o crânio usando varas aplicadora de algodão encharcadas de peróxido de hidrogênio.
- Faça um orifício no crânio 0,5 mm posterior e 1,1 mm lateral do bregma-o ponto anatômico no crânio onde a sutura coronal é intersetorialmente pela sutura sagital (Figura 3A)-bem como um orifício de rebarba de 0,9 mm para expor a dura mater. Mova o microdrill de lado, e marque suavemente o osso imediatamente ao redor do orifício da rebarba antes de inserir uma porta de injeção (profundidade de aproximadamente 2,5 mm), afixada no crânio usando um adesivo estéril cianoacrilato. Sutura estatal ao redor do local de injeção usando suturas de nylon sem absorção 4-0 em um padrão de ponto interrompido ou sutura de corda da bolsa11.
- Casa pós-cirurgia ratos em gaiolas individuais para recuperação de cirurgia.
NOTA: É possível que o Murine Ommaya possa sair quando vários camundongos recuperados por cirurgia são alojados na mesma gaiola, possivelmente devido a interações de adulteração constantes. Recomenda-se que os camundongos implantados em Murine Ommaya sejam alojados individualmente (ou não mais do que 2 ratos por gaiola) ao longo do teste de eficácia da droga.
- Monte o dispositivo de injeção Murine Ommaya usando uma porta de injeção em miniatura de 25 G (0,51 mm de diâmetro exterior) e um disco espaçador de 1 mm. Use um adesivo estéril cianoacrilato para garantir a penetração de aproximadamente 2,5 mm da cânula metálica no hemisfério cerebral direito(Figura 3A-C).
3. Tratamento murine ommaya
- Ratos de dosagem usando o Murine Ommaya
- Anestesiar o rato com isoflurane de 2-3%, até que não haja sinais de reflexo de direita. Além disso, verifique se há reflexo de pinça de cauda e/ou pata para confirmar a manutenção da anestesia.
- Acesse o Murine Ommaya usando um adaptador de injeção de porta e uma seringa Hamilton. Usando fórceps, segure a parte superior da porta de injeção em miniatura e insira suavemente o adaptador do injetor da porta totalmente no septo da porta.
NOTA: O injetor de porta perfura o septo da porta de forma a reduzir o espaço morto ao mínimo e permite a injeção controlada através de uma bomba de seringa motorizada(Figura 4A). Os tratamentos direcionados/novos são injetados a uma vazão de 1 μL/min enquanto sob anestesia. O tratamento deve ser dado em intervalos especificados (diariamente/semanalmente) por uma duração definida (semanas/meses), de acordo com a discrição do pesquisador.
Um volume entre 3 e 7 μL é ótimo, pois um volume < 3 μL não é confiável, e um volume > 7 μL pode causar muita pressão. O tamanho da seringa Hamilton pode variar de 10 a 100 μL, dependendo do número de ratos em cada braço de tratamento. A pré-carga do volume apropriado na seringa Hamilton evitará a substituição repetida da seringa, minimizando assim os erros. É melhor dedicar 1 seringa Hamilton por braço de tratamento. - Uma vez feita a injeção, retire o Murine Ommaya do adaptador de injeção de porta usando fórceps, e devolva o mouse à gaiola para se recuperar da anestesia, conforme descrito acima no passo 1.3.7.
- Eutanásia
- Eutanize os camundongos por inalação de dióxido de carbono (CO2) de uma fonte de tanque comprimido. Expor os camundongos a concentrações crescentes de CO2 (ou seja, uma taxa de deslocamento de 10% a 30% do volume/min da câmara é para ser usado) para evitar ou minimizar o desconforto ou angústia. Monitore os camundongos até a garantia de cessação dos movimentos cardiovasculares e respiratórios.
Resultados
Em camundongos, o volume total de CSF é de aproximadamente 35-40 μL e é produzido a uma taxa de cerca de 350 nL/min; ele gira mais de 12-13 vezes por dia12. Para visualizar a rota da injeção, 2% Evans Blue foi injetado através do modelo Murine Ommaya, seguindo o qual 15 min e 30 min foram autorizados a passar antes de colher os cérebros para análise. O corante se infiltrou com sucesso nos ventrículos e no cérebro em 15 minutos. Dentro de 30 min, o corante tornou-se visível na medulaespinhal (Figura 4).
Como prova de conceito, os camundongos BALB/c foram injetados com uma linha de células cancerígenas de mama Her2+ TUBO com a luciferase intracisternamente, e os Ommayas Murine foram implantados. Aproximadamente 1 semana após a injeção de células cancerosas, os camundongos começaram a desenvolver LMD. Estes camundongos foram tratados uma vez por semana por até 4 semanas com imunoterapia de 2 corpos her2, seja através de terapia sistêmica via injeção intraperitoneal ou intratecally através do Murine Ommaya (Figura 5A).
Embora os camundongos não tratados tenham morrido até o dia 19, todos os camundongos que receberam terapia intratecal através da Murine Ommaya sobreviveram(P = 0,004). Na semana 4, observou-se uma regressão completa dos tumores. Em comparação com camundongos tratados com terapia sistêmica, que tiveram sucesso moderado no tratamento da LMD, os camundongos que receberam terapia intratecal tiveram uma sobrevida geral muito maior(Figura 5B).
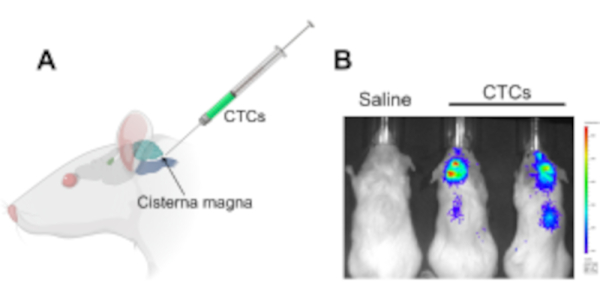
Figura 1: Injeção de células tumorais circulantes na cisterna magna em um modelo de xenoenxerto de murina para estudar doença leptomeningeal e metástases do sistema nervoso central. (A) Uma ilustração mostrando a localização da cisterna magna e do local de acesso csf, no qual os CTCs são injetados usando uma seringa Hamilton. (B) Uma imagem representativa do IVIS de camundongos que desenvolveram doença leptomeningeal e metástases do sistema nervoso central (cérebro e ao longo da medula espinhal) após 2 semanas de injeção com células tumorais circulantes. As células foram rotuladas com um gene repórter de luciferase. Os animais de controle injetados com soro fisiológico não desenvolveram tumores (n = 3), e o experimento foi realizado em triplicado. Abreviaturas: CTCs = células tumorais circulantes; IVIS = sistema de imagem in vivo. Clique aqui para ver uma versão maior desta figura.
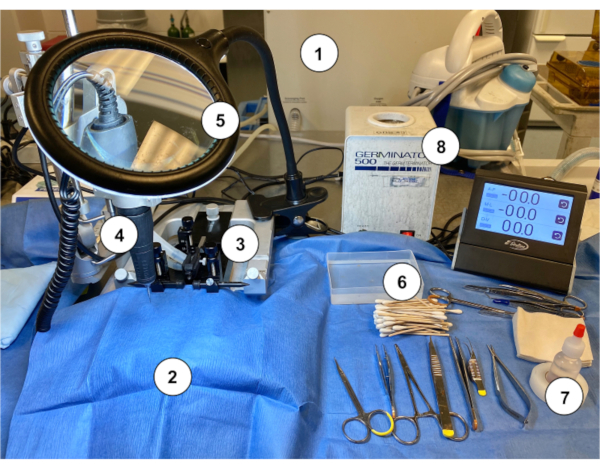
Figura 2: Um exemplo de configuração de estação de trabalho para a realização da implantação de Murine Ommaya em camundongos. (1) Máquina/vaporizador de anestesia a gás. (2) Cortina de papel azul estéril cobrindo um suporte estereotaxico. (3) Dispositivo estereotaxic (stand/estágio, barras de ouvido, cone de nariz). (4) Microdrill. (5) Lupa com luz. (6) Adlavra de algodão estéril com recipiente de enxágüe salino estéril. (7) Peróxido de hidrogênio. (8) Esterilizador de contas. Clique aqui para ver uma versão maior desta figura.
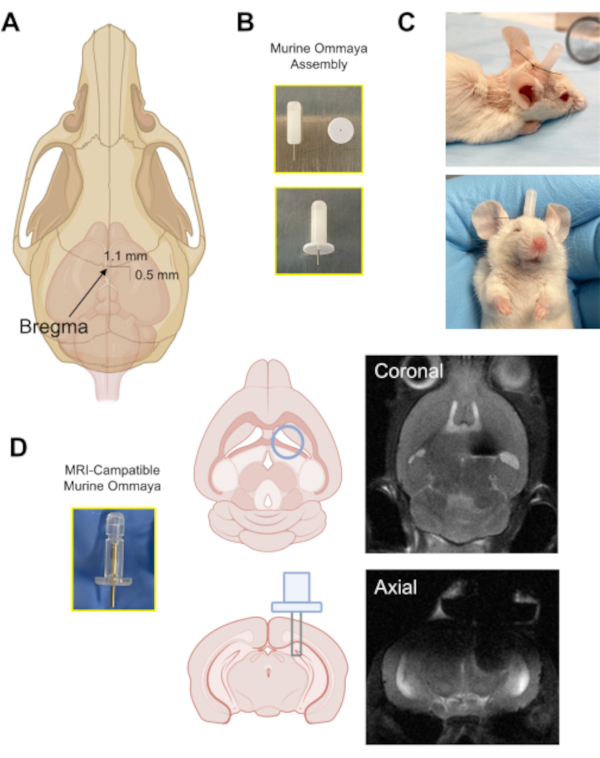
Figura 3: A implantação do dispositivo Murine Ommaya. (A) Uma ilustração com uma seta apontando para a localização da bregma no crânio, e a distância aproximada na qual um orifício de rebarba é perfurado no crânio (0,5 mm posterior/1,1 mm lateral) do bregma usando um microdrill. (B) A Murine Ommaya é montada combinando uma cânula metálica e um espaçador de 1 mm como base para fixação de cola ao crânio. (C) Imagens representativas de camundongos que tiveram Murine Ommayas implantada; esses camundongos são monitorados para garantir que sejam brilhantes, alertas e reativos antes de receber qualquer injeção. (D) Um exemplo do protótipo de ressonância magnética compatível com a ressonância magnética Murine Ommaya e imagens representativas de ressonância magnética cerebral dos implantes de Murine Ommaya. Clique aqui para ver uma versão maior desta figura.
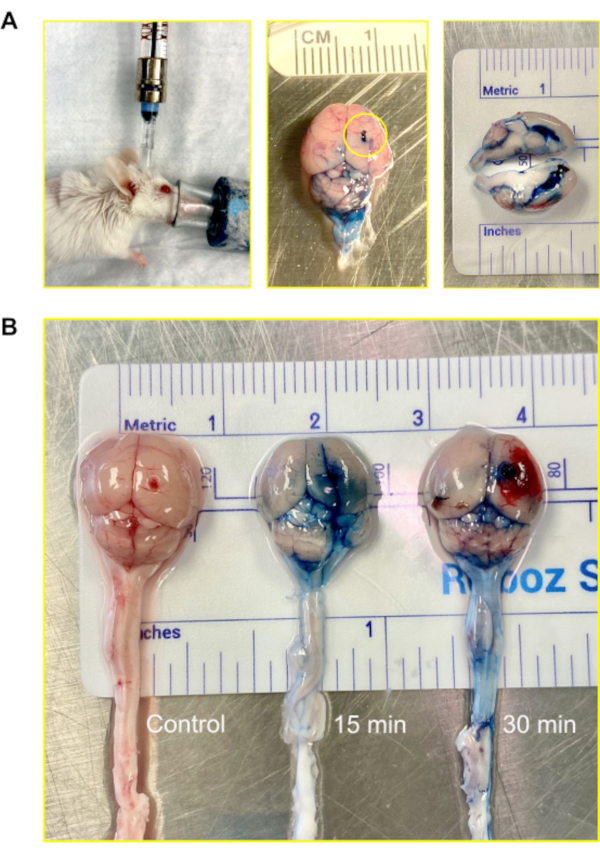
Figura 4: Injeção intraventricular (sistema nervoso central) utilizando a Murine Ommaya. (A) Uma imagem de uma injeção, acessando o ventrículo e o sistema nervoso central através do Murine Ommaya. Os camundongos permanecem sob anestesia durante a injeção. No exemplo, o Murine Ommaya está conectado à porta em miniatura que está ligada a uma seringa Hamilton pré-enchida. As injeções são realizadas utilizando um conjunto automático de injeção a uma taxa de infusão de 1 μL/min e um volume de 5-7 μL. Uma imagem de um cérebro de rato injetado com Evans Blue é mostrada. O círculo mostra onde o Murine Ommaya estava ligado. Nenhum vazamento do corante foi observado no exterior do cérebro. Uma seção transversal do cérebro mostra que os ventrículos laterais estavam cheios de corante; o corante não penetrou o cérebro parenchyma. (B) Imagens de cérebros de camundongos após 15 e 30 minutos após a injeção de corante Evans Blue. O corante se infiltrou no cérebro (15 min) e começou a circular na medula espinhal (30 min). Dos 5 camundongos, 4 receberam corante para visualização, e 1 serviu de controle. O experimento foi repetido em triplicado. Clique aqui para ver uma versão maior desta figura.
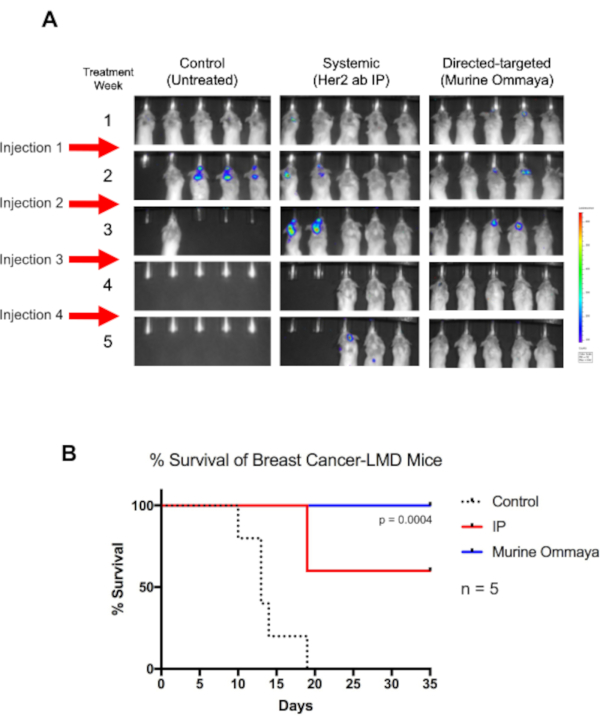
Figura 5: A imunoterapia direcionada direta usando o Murine Ommaya aumenta a sobrevida global de camundongos associados ao câncer de mama. (A) Os camundongos BALB/c foram injetados com o receptor de fator de crescimento epidérmico humano 2-TUBO positivo, uma linha de células cancerígenas de mama murina. Três dias após as injeções de cisterna magna, Murine Ommayas foi implantada. Camundongos começaram a desenvolver doença leptomeningeal (LMD) 1 semana após a injeção. Os camundongos LMD foram tratados com um receptor de fator de crescimento epidérmico humano anticorpos sistêmicos através de injeção intraperitoneal ou via intratecal (Murine Ommaya) como uma abordagem direcionada direta. As injeções eram dadas uma vez por semana por até 4 semanas. Em comparação com camundongos não tratados, os camundongos que receberam imunoterapia sobreviveram por muito mais tempo. Os camundongos Murine Ommaya tiveram regressão completa da doença na quarta semana, e esses camundongos foram eventualmente curados da doença. (B) Estes camundongos também apresentaram uma sobrevida mediana significativamente melhor (teste de Mantel-Cox; P = 0,004; n = 5 camundongos por braço de tratamento) e melhor sobrevida geral do que os camundongos LMD tratados sistematicamente. Abreviaturas: LMD = doença leptomeningeal; IP = intraperitoneal. Clique aqui para ver uma versão maior desta figura.
Discussão
Aqui, o Murine Ommaya foi descrito como um modelo confiável, que permite a administração repetida de agentes anticâncer no espaço CSF em modelos pré-clínicos de LMD e outras doenças relacionadas ao CNS. CSF foi amostrado de camundongos enquanto o dispositivo ainda estava conectado sem interrupção. Este modelo de xenoenxerto de terapia direcionada é um passo importante no desenvolvimento e teste de estratégias de tratamento racional para LMD. O tempo desde as injeções de cisterna magna até o sinal inicial do desenvolvimento de LMD varia dependendo do tipo de célula cancerígena. Metástases LMD e CNS começam a tomar forma cerca de 1 ou 2 semanas após a inoculação do CTC. Se uma linha de células cancerígenas altamente proliferativa for usada, é possível que a metástase possa ocorrer em <7 dias. Neste caso, a vascularização devido ao crescimento do tumor pode, por vezes, tornar a implantação do Murine Ommaya desafiadora. Uma solução para este desafio é reduzir o número de células cancerígenas para injeção no espaço CSF, permitindo mais tempo antes do desenvolvimento do tumor. Além disso, este protocolo foi otimizado para implantar o Murine Ommaya no máximo 72 h após a injeção cisterna magna para garantir tempo suficiente para os camundongos se recuperarem da cirurgia antes do primeiro tratamento. Os pesquisadores devem calcular a taxa de crescimento dos CTCs em modelos de xenoenxerto antes de planejar o regime de tratamento.
Embora existam outros métodos de entrega intraventricular direto, como o uso de um sistema de bomba osmótica ou uma injeção de bolus intracerebroventricular (ICV), como descrito anteriormente9, existem várias vantagens em usar o modelo Murine Ommaya. Por exemplo, uma injeção de bolus ICV é feita em uma única entrega, enquanto a Murine Ommaya permite múltiplas doses de tratamento a qualquer momento, seja dada como um único agente ou como terapias combinadas. A bomba osmótica foi projetada para sustentar por até 14, 28 ou 42 dias antes que a bomba precise ser reposição, e às vezes com mais frequência se um rato menor com uma bomba menor for usado. Mudar a bomba osmótica requer um procedimento cirúrgico, que adiciona estresse aos camundongos portadores de tumor. Uma substituição murine ommaya não é necessária para experimentos de longa duração, desde que o dispositivo permaneça intacto. Também minimiza a variabilidade potencial que resulta da alteração da bomba9. Murine Ommayas implantada nos camundongos experimentais permaneceu intacta por mais de 42 dias, e essa duração permitiu regimes de tratamento de longa duração.
Achados anteriores sugerem que uma dosagem intermitente pulsante no CSF tem melhor eficácia contra a LMD do que um processo prolongado de entrega de medicamentos por infusão13. Seria impossível realizar repetidas injeções de dose única usando o sistema de bomba osmótica. Não há uma maneira fácil de limpar o líquido preso restante após cada injeção. A bomba osmótica também se limita a fornecer misturas de drogas compatíveis ou únicas e normalmente requer maiores volumes de preparação de medicamentos para infusão contínua. Em contraste, o Murine Ommaya foi projetado para microinjeções precisas de apenas 3 a 7 μL, sem ter que explicar o espaço morto, e não há limitação sobre o tipo de drogas que os pesquisadores podem usar, incluindo a terapia de células imunes. O Murine Ommaya também minimiza o desperdício de reagentes se uma determinada amostra for preciosa e maximizar o uso desse recurso. Para qualquer regime de tratamento que exija múltiplas doses de terapias anticâncer, o Murine Ommaya é fácil de usar, e há um risco mínimo de infecção ou desventura cirúrgica, com as abordagens alternativas de acessar repetidamente o CSF cirurgicamente ou através de parto repetido com uma agulha. O Murine Ommaya fornece aos pesquisadores a flexibilidade para ajustar concentrações de medicamentos e frequências de dosagem e avaliar a modulação e duração do objetivo do estudo de acordo com a pesquisa de interesse.
Uma limitação do Murine Ommaya é que os pesquisadores podem achar difícil implantar o dispositivo em camundongos menores. Portanto, é melhor usar camundongos com pelo menos 8 a 10 semanas de idade. É possível que a Murine Ommaya saia durante o teste de tratamento se o dispositivo não estiver preso ao crânio durante as etapas de implantação e a cola passar, ou se os ratos tiverem adulterado abrasivamente. Este último cenário ocorre com mais frequência quando vários camundongos foram alojados na mesma gaiola. Assim, recomenda-se abrigar não mais do que dois camundongos implantados por gaiola murine ommaya durante a duração do cronograma de tratamento. Este protocolo foi modificado para aplicar o adesivo estéril cianoacrilato no espaçador, que foi encontrado como a cola mais eficaz para aderir o espaçador à superfície do crânio e impedir que o Murine Ommaya saia. Os resultados mostraram que os camundongos com LMD se beneficiaram da terapia intratecal direta através do Murine Ommaya, com maior sobrevida geral. Volumes de microliter únicos poderiam ser administrados com segurança, contornando o BBB, reduzindo assim a quantidade de preparação de medicamentos. Mais importante, os camundongos que foram curados de metástases CNS do estudo de imunoterapia de anticorpos Her2 permaneceram saudáveis.
Uma colaboração com um fabricante teve como objetivo desenvolver uma versão compatível com ressonância magnética do Murine Ommaya para o modelo PDX de LMD. Como esta versão protótipo tem um espaçador incorporado, nenhum conjunto é necessário, permitindo uma melhor adesão ao crânio. Uma limitação deste protótipo é que, embora o dispositivo seja compatível com ressonância magnética, ele gera uma sombra onde o dispositivo está inserido, o que diminui a visibilidade da imagem para análises de quantificação. A versão compatível com ressonância magnética é uma boa ferramenta alternativa quando a amostragem ex vivo CTC é um fator limitante, e células de pré-rotulagem não são viáveis. A combinação de um modelo de xenoenxerto LMD e a técnica Murine Ommaya é benéfica para estudar a eficácia da droga direta contornando o BBB. Os resultados desses estudos in vivo são clinicamente relevantes para a concepção de estratégias terapêuticas racionais para pacientes com LMD.
Divulgações
Peter Forsyth atua em Conselhos Consultivos para Abvie Inc., Bayer, Bristol Meyers Squib, BTG, Inovio, Novocure, Tocagen e Ziopharm, fora do trabalho apresentado. Todos os outros autores não têm nada a revelar.
Agradecimentos
Gostaríamos de agradecer a Michele L. Danielson, Tricia Favors-Watson, e ao resto da equipe de Medicina Comparada da Universidade do Sul da Flórida por seu apoio técnico e manutenção de nossos animais. Agradecemos à Instech Laboratories, Inc. por seu esforço trabalhando conosco com base em nosso pedido para desenvolver uma Murine Ommaya compatível com ressonância magnética. Este trabalho é apoiado pelos Institutos Nacionais de Saúde (NIH) R21 CA216756 (para K.S.M. Smalley), Departamento de Defesa (DOD) W81XWH1910675 (para B. Czerniecki e P. Kalinski), e pelo Moffitt Cancer Center CBMM Innovative Awards (para P. Forsyth e D. Duckett). A assistência editorial foi prestada pelo Escritório de Escrita Científica do Moffitt Cancer Center pelo Dr. Paul Fletcher e Daley Drucker. Nenhuma compensação foi dada além de seus salários regulares.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 mm spacer disc | Alzet, Durect Corporation | #0008670 | Spacer disc only |
| 4-0 ethilon nylon suture | Any vendor | n/a | |
| Automatic syringe pumps | Harvard Syringe Pumps (or any vendor) | #70-4505 | Pump 11 Elite |
| Bead sterilizer | Braintree Scientific Inc. (or any vendor) | #GER 5287-120V | Germinator 500 |
| Buprenorphine Sustained-Release (Bup-SR) | Zoopharm | DEA controlled | |
| Cyanoacrylate sterile adhesive | Any vendor | ||
| Gas inhalation anestehsia system | VeteEquip | #901812 | COMPAC5 |
| Hamilton microliter syringes | Hamilton | 10, 25, 50, and 100 μL | 30 G for cisterna magna injection |
| Hydrogen peroxide | Any vendor | n/a | |
| IVIS 200 imaging system | Caliper Life Sciences | n/a | |
| Magnifying glass with light | Any vendor | n/a | |
| Microdrill | Stoelting (or any vendor) | #51555M | |
| MRI imaging | Bruker | BioSpec series | Optional |
| Murine Ommaya (MRI-compatible) prototype | Instech Laboratories, Inc. | #VAB620-25MRI-3.3 | |
| Phosphate-buffered saline (PBS) | Any vendor | n/a | 0.1 mm Sterile-Filtered |
| PinPort injector | Instech Laboratories, Inc. | #PNP3M-50 | |
| PinPort | Instech Laboratories, Inc. | #1-PNP3F28-50 | |
| Rodent Surgical Instruments (Scissors, Forceps) | Roboz Surgical Instrument (or any vendor) | ||
| Stereotaxic device | Stoelting (or any vendor) | #51730M | |
| Sterile blue paper/ drape covering | Any vendor | n/a | n/a |
| Sterile cotton sticks | Any vendor | n/a |
Referências
- Chamberlain, M. C. Leptomeningeal metastasis. Current Opinion in Neurology. 22 (6), 665-674 (2009).
- Nayar, G., et al. Leptomeningeal disease: current diagnostic and therapeutic strategies. Oncotarget. 8 (42), 73312-73328 (2017).
- Shapiro, W. R., Johanson, C. E., Boogerd, W. Treatment modalities for leptomeningeal metastases. Seminars in Oncology. 36 (4), Suppl 2 46-54 (2009).
- Davies, M. A., et al. Prognostic factors for survival in melanoma patients with brain metastases. Cancer. 117 (8), 1687-1696 (2011).
- Znidaric, T., et al. Breast cancer patients with brain metastases or leptomeningeal disease: 10-year results of a national cohort with validation of prognostic indexes. Breast Journal. 25 (6), 1117-1125 (2019).
- Glitza, I. C., et al. Leptomeningeal disease in melanoma patients: An update to treatment, challenges, and future directions. Pigment Cell & Melanoma Research. 33 (4), 527-541 (2020).
- Raizer, J. J., et al. Brain and leptomeningeal metastases from cutaneous melanoma: survival outcomes based on clinical features. Neuro-oncology. 10 (2), 199-207 (2008).
- Taillibert, S., et al. Leptomeningeal metastases from solid malignancy: a review. Journal of Neurooncology. 75 (1), 85-99 (2005).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments. (75), e50326(2013).
- Kodumudi, K. N., et al. Sequential anti-PD1 therapy following dendritic cell vaccination improves survival in a HER2 mammary carcinoma model and identifies a critical role for CD4 T cells in mediating the response. Frontiers in Immunology. 10, 1939(2019).
- Dunn, L., et al. Murine model of wound healing. Journal of Visualized Experiments. (75), e50265(2013).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta. 1862 (3), 442-451 (2016).
- Shackleford, G. M., et al. Continuous and bolus intraventricular topotecan prolong survival in a mouse model of leptomeningeal medulloblastoma. PLoS One. 14 (1), 0206394(2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados