Method Article
Un modèle murin de xénogreffe d’Ommaya pour étudier le traitement ciblé direct de la maladie leptoméningée
Dans cet article
Résumé
Ici, nous décrivons un modèle de xénogreffe murine qui ressemble fonctionnellement à un réservoir ommaya chez les patients. Nous avons développé le Murine Ommaya pour étudier de nouvelles thérapies pour la maladie leptoméningée universellement mortelle.
Résumé
La maladie leptoméningée (MLL) est un type rare de métastases du système nerveux central (SNC) au liquide céphalorachidien (LCR). Les cancers les plus courants qui causent la MMF sont les cancers du sein et du poumon et le mélanome. Les patients diagnostiqués avec LMD ont un très mauvais pronostic et ne survivent généralement que quelques semaines ou quelques mois. L’une des raisons possibles du manque d’efficacité du traitement systémique contre la LMD est l’incapacité à atteindre des concentrations thérapeutiquement efficaces de médicament dans le LCR en raison d’une barrière hémato-encéphalique (BHE) intacte et relativement imperméable ou d’une barrière hémato-CSF à travers le plexus choroïde. Par conséquent, l’administration directe de médicaments par voie intrathécale ou intraventriculaire peut surmonter ces barrières. Ce groupe a développé un modèle qui permet l’administration efficace de traitements (c.-à-d. médicaments, anticorps et thérapies cellulaires) de manière chronique et l’échantillonnage répété de LCR pour déterminer les concentrations de médicaments et la modulation cible dans le LCR (lorsque le microenvironnement tumoral est ciblé chez la souris). Le modèle est l’équivalent murin d’un réservoir Ommaya compatible avec l’imagerie par résonance magnétique, qui est utilisé cliniquement. Ce modèle, qui est apposé sur le crâne, a été désigné comme le « Murine Ommaya ». Comme preuve de concept thérapeutique, des anticorps du récepteur 2 du facteur de croissance épidermique humain (clone 7.16.4) ont été administrés dans le LCR via l’Ommaya murin pour traiter les souris atteintes de LMD du cancer du sein positif au récepteur 2 du facteur de croissance épidermique humain. Le Murine Ommaya augmente l’efficacité de l’administration de médicaments à l’aide d’un port d’accès miniature et empêche le gaspillage de médicaments en excès; il n’interfère pas avec l’échantillonnage du LCR pour les études moléculaires et immunologiques. L’Ommaya murin est utile pour tester de nouvelles thérapies dans des modèles expérimentaux de LMD.
Introduction
La maladie leptoméningée (LMD) est une métastase agressive à un stade avancé du SNC, dans laquelle les cellules tumorales accèdent au LCR et s’infiltrent à la surface du cerveau et de la moelleépinière 1. Les cancers les plus courants qui causent la LMD comprennent ceux du sein et du poumon ainsi que le mélanome2. La LMD entraîne un certain nombre de symptômes et de signes neurologiques tels que des maux de tête, des paralysies du nerf crânien, une raideur du cou et des radiculopathies. Le pronostic pour les patients atteints de LMD est généralement très mauvais (la survie moyenne est mesurée en semaines) et est universellement fatal3,4,5,6,7. Le traitement par chirurgie, radiothérapie et chimiothérapie systémique est palliatif. Le traitement systémique de la LMD peut échouer en raison d’une pénétration inadéquate du médicament dans le LCR à travers une barrière intacte de BHE ou de LCR sanguin à travers le plexus choroïde1.
Par conséquent, l’administration de traitements anticancéreux (p. ex., médicaments et traitements à base d’anticorps, y compris les inhibiteurs de point de contrôle et les thérapies cellulaires) directement dans le LCR peut surmonter cette limitation8. L’accès et le prélèvement du LCR chez les patients sont possibles grâce à un réservoir Ommaya implanté sous le cuir chevelu. Cet appareil permet l’administration d’agents cancéreux (p. ex., méthotrexate et trastuzumab) ainsi que l’échantillonnage de LCR pour des études diagnostiques (p. ex., le diagnostic cytologique de la LMD pour surveiller les réponses au traitement) sans effectuer de ponction lombaire. Un réservoir murin Ommaya a été conçu pour imiter ceux utilisés cliniquement. Le réservoir nécessite l’assemblage d’un port d’accès et de pièces d’espacement et une modification de la technique de canulation de la souris, ce qui permet à l’appareil de rester intact en permanence pendant toute la durée de l’étude du médicament. Cet appareil a été désigné comme le « Murine Ommaya ».
Contrairement à la technique de la pompe à perfusion osmotique, qui nécessite la préparation de volumes de liquide en excès pour préremplir l’espace vide dans le tube et la perfusion continue sur des injections fréquentes9, l’Ommaya murin minimise le gaspillage de solutions médicamenteuses. Il permet l’administration efficace de plusieurs doses uniques de traitements à tout moment en petites quantités (3-7 μL) dans le LCR à l’aide d’une seringue Hamilton, d’un port d’accès miniature et d’un injecteur automatique. En temps réel, l’efficacité des médicaments d’essai contre la LMD peut être déterminée par imagerie. En utilisant cette approche, une variété de chimiothérapies, d’anticorps et d’immunothérapies cellulaires (en tant qu’agents uniques ou combinés) peuvent être testés contre la LMD afin de traduire les résultats in vivo en stratégies de traitement rationnelles pour les patients. Afin d’améliorer encore la capacité d’imagerie d’un modèle de Xoglagret dérivé du patient (PDX) de LMD, une collaboration a été entreprise avec un fabricant pour développer une version compatible avec l’imagerie par résonance magnétique (IRM) du Murine Ommaya, qui ne nécessite aucun assemblage et est prête à l’emploi. La capacité d’IRM est bénéfique, en particulier pour les modèles PDX dans lesquels la quantité de cellules tumorales circulantes (CCC) du LCR est parfois le facteur limitant, et souvent lorsque le prémarquage des CTCC est impossible.
Cet article décrit un protocole détaillé qui commence par l’injection de CTCC pour rendre les souris atteintes de LMD. L’Ommaya Murin est ensuite implanté chirurgicalement, et plusieurs étapes de traitement médicamenteux via l’Ommaya Murin sont effectuées. Comme preuve de concept pour la démonstration, une comparaison côte à côte in vivo a été effectuée, dans laquelle l’anticorps murin du récepteur 2 du facteur de croissance épidermique humain (Her2) appelé clone 7.16.4 (l’équivalent humain du trastuzumab) a été délivré10. L’anticorps cible les cellules cancéreuses du sein Her2+ soit via l’Ommaya murin (traitement ciblé direct ou intrathécal) soit par injection intrapéritonéale (traitement systémique). Les résultats ont montré que les souris atteintes de LMD qui ont reçu une immunothérapie intrathécale directe ont vécu significativement plus longtemps que celles traitées avec le même traitement par voie systémique. Les métastases du SNC chez les souris traitées par l’Ommaya murin ont été presque complètement régressées à la troisième dose de la troisième semaine de traitement, ce qui a entraîné une amélioration de la survie globale.
Protocole
Le protocole a été approuvé par le Comité institutionnel de soins et d’utilisation des animaux de l’Université de Floride du Sud (IS00005974).
1. Injection de CTCC dans CSF pour générer un modèle LMD de souris
- Préparation des CTCC
- Calculer le nombre de CCC nécessaires à l’injection et préparer une suspension monocellulaire à 1,0 × 104 cellules/μL dans une solution saline stérile tamponnée au phosphate (PBS). Placez la suspension cellulaire sur de la glace ou à 4 °C tout au long de la procédure.
REMARQUE: Lorsque vous utilisez des lignées cellulaires nécessitant une trypsinisation, assurez-vous de laver les cellules deux fois avec du PBS stérile pour éliminer la trypsine. Effectuez le comptage cellulaire à l’aide d’un hémocytomètre ou d’un compteur cellulaire automatisé. Si une grande cohorte (>50 souris) est utilisée, recomptez les cellules et validez la viabilité cellulaire entre les injections pour vous assurer qu’un nombre constant de cellules sont administrées par souris.
- Calculer le nombre de CCC nécessaires à l’injection et préparer une suspension monocellulaire à 1,0 × 104 cellules/μL dans une solution saline stérile tamponnée au phosphate (PBS). Placez la suspension cellulaire sur de la glace ou à 4 °C tout au long de la procédure.
- Procédure préchirurgicale
- Injecter à la souris par voie sous-cutanée 1 mg/kg de buprénorphine à libération prolongée (Bup-SR).
REMARQUE: Ne pas injecter la zone d’incision proposée; choisissez un site d’injection bien éloigné de l’omoplate. - Anesthésiez la souris avec 2-3% d’isoflurane jusqu’à ce qu’elle ne montre aucun signe du réflexe de redressement. De plus, vérifiez le réflexe de pincement de la queue et / ou de la patte pour confirmer l’état d’anesthésie.
- Préparez la souris pour la chirurgie dans un endroit éloigné de la zone d’opération. Couper le site chirurgical (c.-à-d. la surface dorsale du crâne) avec suffisamment de bordure pour empêcher la fourrure de contaminer le site d’incision; ensuite, saturez le site avec un antiseptique cutané germicide, en travaillant du centre du site à la périphérie, puis laissez sécher. Appliquez un drapé stérile ou un drapé en plastique stérile à dos adhésif pour protéger le site chirurgical de la contamination.
REMARQUE: Les instruments doivent être autoclavés à l’avance et les pointes stérilisées à nouveau entre les animaux à l’aide d’un stérilisateur de perles de verre. - Rasez la fourrure de toute la surface ventrale de la tête et préparez la peau en utilisant une technique stérile.
- Situez le nez avec un cône de nez modifié en forme de L de l’appareil stéréotaxique, en veillant à ce que les narines restent claires et ouvertes. À l’aide de ruban adhésif sur les surfaces ventrales des deux pennes, tirez doucement la peau vers l’avant pour la fixer au cône du nez et pliez le cou à un angle d’environ 90 ° une fois fixé. Administrer 1,5 % d’isoflurane pour maintenir l’anesthésie.
REMARQUE: Un bon positionnement entraînera la présentation de la zone d’incision d’une manière qui permet d’identifier facilement la crête caudale de l’os occipital. - Positionnez le corps pour vous assurer que la colonne vertébrale est maintenue au niveau de la cisterna magna et, tout en appliquant une légère traction sur la queue, placez du ruban adhésif à la base de la queue pour la sécuriser.
- Injecter à la souris par voie sous-cutanée 1 mg/kg de buprénorphine à libération prolongée (Bup-SR).
- Injection chirurgicale de cisterna magna
- Avec le cou en pleine extension, et en commençant juste entre les pennes, faites couler les pointes de ciseaux chirurgicaux vers le bas avec une légère pression sur l’os occipital.
REMARQUE: Dans cette position médiane, une petite dépression est perceptible lorsque les pointes de ciseaux plongent dans la zone concave au-dessus de la cisterna magna. - Faites une petite incision médiane de 3 à 5 mm juste au-dessus de la concavité palpée. Aspirer 5 μL de suspension cellulaire à 1,0 × 104 cellules/μL (total 5,0 × 104 cellules) dans une seringue Hamilton de 30 G.
- Utilisez des pinces à pointe émoussée avec des pointes de 1 à 2 mm pour appuyer doucement sur la cisterna magna. Introduisez des embouts en position fermée et ouvrez-les tout en appliquant une pression vers le bas sur la dura.
- Répétez la dissection contondante décrite à l’étape précédente jusqu’à ce que la membrane durale soit facilement identifiée et que les vaisseaux sanguins associés soient visibles dans la zone exposée.
REMARQUE: La fenêtre d’injection résultante garantit que les vaisseaux sanguins ne sont pas endommagés lors de l’insertion de l’aiguille. - Tout en maintenant la pince ouverte pour rétracter la musculature environnante, introduisez une aiguille non carottante de 30 G sous la dura pour visualiser le biseau. Assurez-vous que l’aiguille n’est introduite que juste au-delà du biseau lui-même. Déployez lentement un piston de seringue et délivrez des cellules juste en dessous de la dura.
- Placez correctement le biseau pour observer l’injection sous la dura. Administrez soigneusement la technique et utilisez l’aiguille non carottée de 30 G pour éviter d’endommager la membrane et assurer une fuite minimale. Si une fuite est constatée, appliquez une légère pression avec un applicateur à pointe de coton.
- Fermez la peau en appliquant un clip de plaie ou une micro-goutte d’adhésif pour la peau. Une fois l’injection effectuée avec succès, laissez les souris se remettre de l’anesthésie sur une couverture chaude, en les observant continuellement jusqu’à ce qu’elles puissent maintenir la position sternale et démontrer un mouvement délibéré.
- Surveillez les souris quotidiennement après la chirurgie pendant la première semaine. Si une souris semble souffrir ou souffrir, traitez-la avec une injection sous-cutanée de carprofène de 10 mg / kg une fois toutes les 12 à 24 heures pendant 5 jours sur la base d’une consultation et d’une directive vétérinaires. Laissez les souris les récupérer et surveillez-les pendant au moins 48 à 72 h avant de passer à l’étape suivante.
REMARQUE: Bup-SR, administré de manière préventive, durera jusqu’à 72 h, de sorte que des analgésiques supplémentaires ne sont normalement pas nécessaires. Cependant, les animaux recevront un analgésique supplémentaire si nécessaire (s’ils sont léthargiques, ne mangent pas, ébouriffés). Si un site chirurgical développe des signes d’infection postopératoire (c.-à-d. rougeur, gonflement, sensibilité, allodynie, hyperalgésie, hyperpathie ou suppuration), ou si la souris protège la zone touchée, euthanasier la souris. Si des cellules cancéreuses sont injectées avec succès dans le LCR, la LMD et la progression tumorale se développeront dans le SNC dans les 1 ou 2 semaines (selon les types de CTC ou de lignée cellulaire utilisés)(Figure 1).
- Avec le cou en pleine extension, et en commençant juste entre les pennes, faites couler les pointes de ciseaux chirurgicaux vers le bas avec une légère pression sur l’os occipital.
2. Assemblage et implantation de Murine Ommaya
- Préparation de la station
- Désinfectez la surface de la station. Placez un revêtement bleu sur la surface et gardez à portée de main tous les outils et fournitures stérilisés indiqués à la figure 2.
- Procédure préchirurgicale
- Appliquer l’analgésie (Bup-SR) et maintenir la technique stérile décrite à la section 1.2.
- Implantation chirurgicale de Murine Ommaya
- Assemblez le dispositif d’injection Murine Ommaya à l’aide d’un port d’injection miniature de 25 G (0,51 mm de diamètre extérieur) et d’un disque d’espacement de 1 mm. Utiliser un adhésif stérile cyanoacrylate pour assurer la pénétration d’environ 2,5 mm de la canule métallique dans l’hémisphère cérébral droit(Figure 3A-C).
REMARQUE: Un prototype de souris Ommaya compatible IRM a été développé dans ce laboratoire, qui a déjà les deux parties (port d’injection miniature et entretoise) imprimées en 3D ensemble en une seule unité(Figure 3D). La version à unité unique a été testée par IRM et peut faire gagner du temps en éliminant l’étape d’assemblage. - Anesthésiez la souris avec 2-3% d’isoflurane jusqu’à ce qu’il n’y ait aucun signe du réflexe de redressement. De plus, vérifiez le réflexe de pincement de la queue et / ou de la patte pour confirmer l’état de l’anesthésie.
- Raser toute la surface ventrale de la tête de fourrure et préparer la peau selon la technique stérile, comme décrit précédemment à l’étape 1.2.3. Placez la souris dans l’appareil stéréotaxique avec un cône de nez pour continuer l’administration d’isoflurane pendant la procédure; diminuer l’isoflurane à 1,5%. Serrez doucement les barres auriculaires pour fixer la tête et appliquez du lubrifiant pour les yeux pour couvrir les yeux de la souris.
- Faites une petite incision cutanée (3 mm), suivie d’une dissection émoussée des tissus sous-cutanés sous-jacents pour exposer le crâne. Séchez le crâne à l’aide de bâtonnets applicateurs à pointe de coton imbibés de peroxyde d’hydrogène.
- Percer un trou de bavure dans le crâne de 0,5 mm postérieur et 1,1 mm latéral du bregma - le point anatomique du crâne où la suture coronale est recoupée perpendiculairement par la suture sagittale (Figure 3A) - ainsi qu’un trou de bavure de 0,9 mm pour exposer la dure-mère. Écartez le micropercille et marquez doucement l’os entourant immédiatement le trou de bavure avant d’insérer un orifice d’injection (profondeur d’environ 2,5 mm) fixé au crâne à l’aide d’un adhésif stérile au cyanoacrylate. Suture d’état autour du point d’injection à l’aide de sutures en nylon 4-0 sans absorbance dans un motif de point interrompu ou suture de cordon de bourse11.
- Hébergez des souris post-opératoires dans des cages individuelles pour la récupération chirurgicale.
REMARQUE: Il est possible que l’Ommaya murin se détache lorsque plusieurs souris récupérées chirurgicalement sont logées dans la même cage, peut-être en raison d’interactions de falsification constantes. Il est recommandé que les souris implantées par Murine Ommaya soient logées individuellement (ou pas plus de 2 souris par cage) au cours de l’essai d’efficacité du médicament.
- Assemblez le dispositif d’injection Murine Ommaya à l’aide d’un port d’injection miniature de 25 G (0,51 mm de diamètre extérieur) et d’un disque d’espacement de 1 mm. Utiliser un adhésif stérile cyanoacrylate pour assurer la pénétration d’environ 2,5 mm de la canule métallique dans l’hémisphère cérébral droit(Figure 3A-C).
3. Traitement Murine Ommaya
- Dosage de souris à l’aide de l’Ommaya Murin
- Anesthésiez la souris avec 2-3% d’isoflurane, jusqu’à ce qu’il n’y ait aucun signe de réflexe de redressement. De plus, vérifiez le réflexe de pincement de la queue et / ou de la patte pour confirmer le maintien de l’anesthésie.
- Accédez à l’Ommaya Murin à l’aide d’un adaptateur d’injection à port et d’une seringue Hamilton. À l’aide d’une pince, maintenez le haut de l’aisselle d’injection miniature et insérez doucement l’adaptateur d’injecteur de port complètement dans le septum du port.
REMARQUE: L’injecteur à bâbord perce le septum du port d’une manière qui réduit au minimum l’espace mort et permet une injection contrôlée via une pompe à seringue motorisée (Figure 4A). Les traitements ciblés/nouveaux sont injectés à un débit de 1 μL/min sous anesthésie. Le traitement doit être administré à des intervalles spécifiés (quotidien / hebdomadaire) pour une durée définie (semaines / mois), selon la discrétion du chercheur.
Un volume compris entre 3 et 7 μL est optimal, car un volume < 3 μL n’est pas fiable et un volume > 7 μL peut provoquer une pression trop importante. La taille de la seringue Hamilton peut varier de 10 à 100 μL, selon le nombre de souris dans chaque bras de traitement. Le préchargement du volume approprié dans la seringue Hamilton empêchera le remplacement répété de la seringue, minimisant ainsi les erreurs. Il est préférable de dédier 1 seringue Hamilton par bras de traitement. - Une fois l’injection effectuée, détachez l’Ommaya Murin de l’adaptateur d’injection à orifice à l’aide d’une pince et ramenez la souris dans la cage pour récupérer de l’anesthésie, comme décrit ci-dessus à l’étape 1.3.7.
- Euthanasie
- Euthanasier les souris par inhalation de dioxyde de carbone (CO2)provenant d’une source de réservoir comprimé. Exposer les souris à des concentrations croissantes de CO2 (c.-à-d. un taux de déplacement de 10 % à 30 % du volume de la chambre/min doit être utilisé) pour éviter ou minimiser l’inconfort ou la détresse. Surveiller les souris jusqu’à l’assurance de l’arrêt des mouvements cardiovasculaires et respiratoires.
Résultats
Chez la souris, le volume total de LCR est d’environ 35-40 μL et est produit à un taux d’environ 350 nL / min; il se retourne 12-13 fois par jour12. Dans le but de visualiser la voie de l’injection, 2% Evans Blue a été injecté via le modèle Murine Ommaya, après quoi 15 min et 30 min ont été laissées s’écouler avant de récolter les cerveaux pour analyse. Le colorant a réussi à infiltrer les ventricules et le cerveau en 15 minutes. En 30 minutes, le colorant est devenu visible sur la moelle épinière(Figure 4).
Comme preuve de concept, des souris BALB/c ont été injectées avec une lignée cellulaire de cancer du sein Her2+ TUBO étiquetée luciférase de manière intratracisternale, et les Ommayas murins ont été implantés. Environ 1 semaine après l’injection de cellules cancéreuses, les souris ont commencé à développer une LMD. Ces souris ont été traitées une fois par semaine jusqu’à 4 semaines avec l’immunothérapie Her2-anticorps, soit par un traitement systémique par injection intrapéritonéale, soit par voie intrathécale via l’Ommaya murin(Figure 5A).
Bien que les souris non traitées soient mortes au jour 19, toutes les souris ayant reçu un traitement intrathécal par l’intermédiaire de l’Ommaya murin ont survécu (P = 0,004). À la semaine 4, une régression complète des tumeurs a été observée. Par rapport aux souris traitées par traitement systémique, qui ont eu un succès modéré dans le traitement de la LMD, les souris qui ont reçu un traitement intrathécal ont eu une survie globale beaucoup plus longue (Figure 5B).
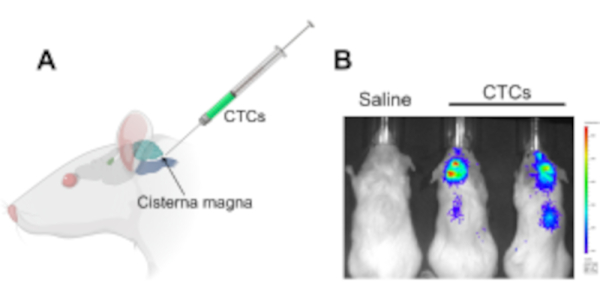
Figure 1: Injection de cellules tumorales circulantes dans la cisterna magna dans un modèle murin de xénogreffe pour étudier la maladie leptoméningée et les métastases du système nerveux central. (A) Une illustration montrant l’emplacement de la cisterna magna et du site d’accès au LCR, dans lequel les CTCC sont injectés à l’aide d’une seringue Hamilton. (B) Une image IVIS représentative de souris qui avaient développé une maladie leptoméningée et des métastases du système nerveux central (cerveau et le long de la moelle épinière) après 2 semaines d’injection de cellules tumorales circulantes. Les cellules ont été étiquetées avec un gène rapporteur de luciférase. Les animaux témoins injectés avec une solution saline n’ont pas développé de tumeurs (n = 3), et l’expérience a été réalisée en trois exemplaires. Abréviations: CTC = cellules tumorales circulantes; IVIS = système d’imagerie in vivo. Veuillez cliquer ici pour voir une version agrandie de cette figure.
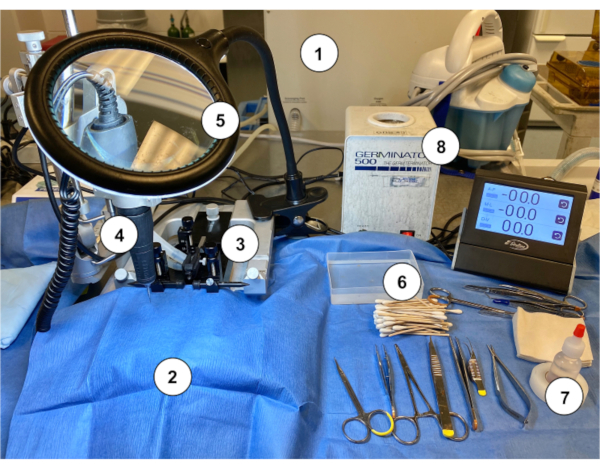
Figure 2: Exemple de configuration d’un poste de travail pour effectuer l’implantation d’Ommaya murin chez la souris. (1) Appareil d’anesthésie au gaz/vaporisateur. (2) Drapé de papier bleu stérile recouvrant un support stéréotaxique. (3) Dispositif stéréotaxique (support/scène, barres d’oreille, cône de nez). (4) Micropercrill. (5) Loupe avec lumière. (6) Bâtonnets d’applicateur taraudés en coton stérile avec récipient de rinçage salin stérile. (7) Peroxyde d’hydrogène. (8) Stérilisateur de perles. Veuillez cliquer ici pour voir une version agrandie de cette figure.
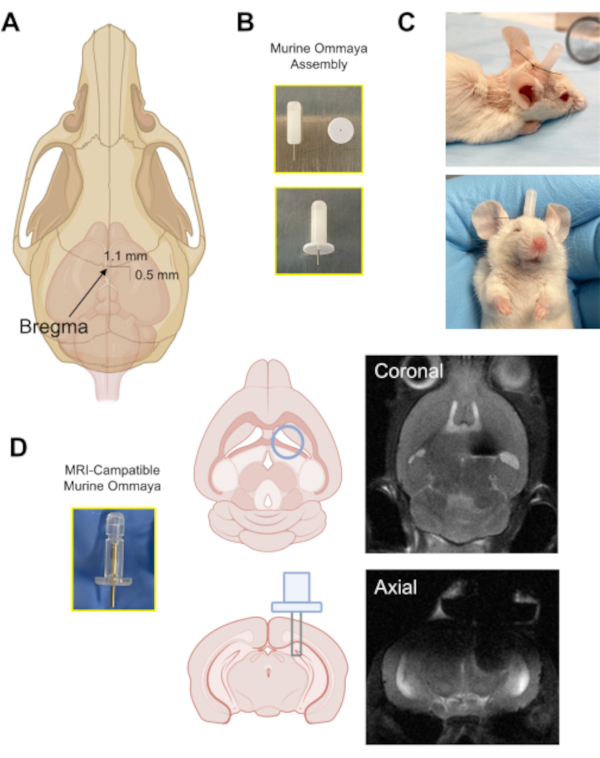
Figure 3: L’implantation du dispositif Murine Ommaya. (A) Illustration avec une flèche pointant vers l’emplacement de la bregma sur le crâne, et la distance approximative à laquelle un trou de bavure est percé dans le crâne (0,5 mm postérieur/1,1 mm latéral) du bregma à l’aide d’une microperte. (B) Un Murine Ommaya est assemblé en combinant une canule métallique et une entretoise de 1 mm comme base pour la fixation de la colle au crâne. (C) Images représentatives de souris ayant été implantées par Murine Ommayas; ces souris sont surveillées pour s’assurer qu’elles sont brillantes, alertes et réactives avant de recevoir des injections. (D) Un exemple du prototype d’Ommaya Murin compatible avec l’imagerie par résonance magnétique magnétique du cerveau et des images représentatives de l’imagerie par résonance magnétique cérébrale des implants Murine Ommaya. Veuillez cliquer ici pour voir une version agrandie de cette figure.
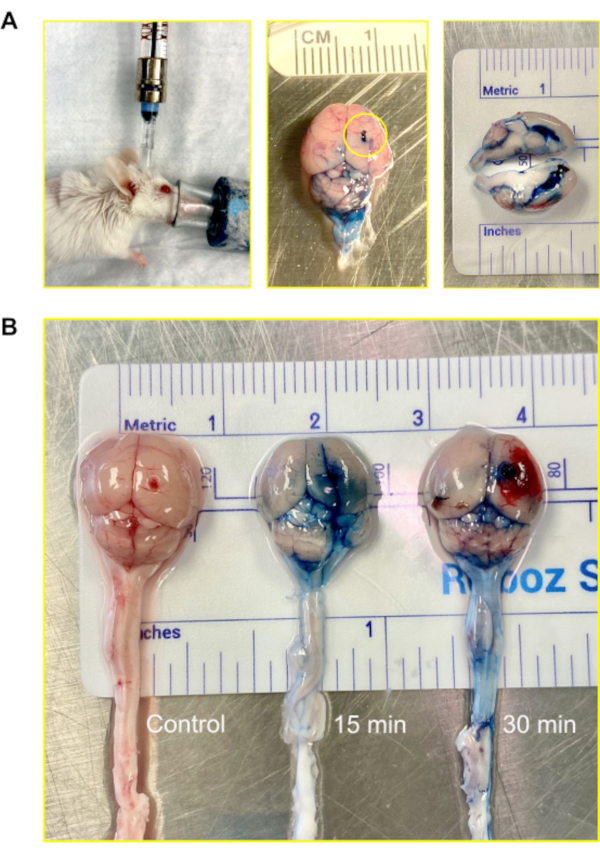
Figure 4: Injection intraventriculaire (système nerveux central) à l’aide de l’Ommaya murin. (A) Image d’une injection, accédant au ventricule et au système nerveux central via l’Ommaya murin. Les souris restent sous anesthésie pendant l’injection. Dans l’exemple, le Murine Ommaya est connecté au port miniature qui est attaché à une seringue Hamilton préremplie. Les injections sont effectuées à l’aide d’un ensemble d’injection automatique à un débit de perfusion de 1 μL / min et un volume de 5-7 μL. Une image d’un cerveau de souris injecté avec Evans Blue est montrée. Le cercle montre où l’Ommaya murin était attaché. Aucune fuite du colorant n’a été observée à l’extérieur du cerveau. Une section transversale du cerveau montre que les ventricules latéraux ont été remplis avec le colorant; le colorant n’a pas pénétré dans le parenchyme cérébral. (B) Images de cerveaux de souris après 15 et 30 minutes suite à l’injection de colorant Evans Blue. Le colorant s’est infiltré dans le cerveau (15 min) et a commencé à circuler sur la moelle épinière (30 min). Sur 5 souris, 4 ont reçu du colorant pour la visualisation et 1 a servi de contrôle. L’expérience a été répétée en trois exemplaires. Veuillez cliquer ici pour voir une version agrandie de cette figure.
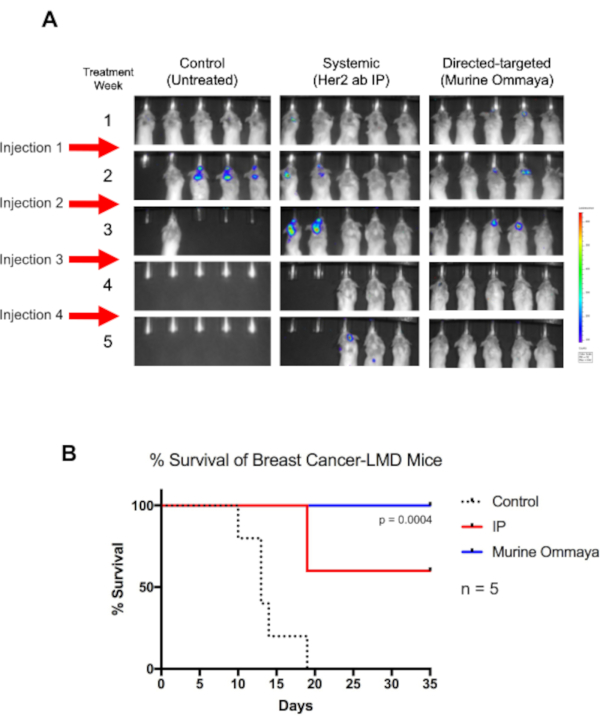
Figure 5: L’immunothérapie ciblée directe à l’aide de l’Ommaya murin augmente la survie globale des souris atteintes de maladie leptoméningée associées au cancer du sein. (A) Des souris BALB/c ont été injectées avec des cellules TUBO du récepteur 2-positif du facteur de croissance épidermique humain marqué par la luciférase, une lignée cellulaire de cancer du sein murin. Trois jours après les injections de cisterna magna, Murine Ommayas a été implanté. Les souris ont commencé à développer une maladie leptoméningée (LMD) 1 semaine après l’injection. Les souris LMD ont été traitées avec un anticorps du récepteur du facteur de croissance épidermique humain par voie systémique par injection intrapéritonéale ou par voie intrathécale (Murine Ommaya) comme approche ciblée directe. Les injections ont été administrées une fois par semaine pendant une semaine pouvant aller jusqu’à 4 semaines. Par rapport aux souris non traitées, les souris recevant une immunothérapie ont survécu beaucoup plus longtemps. Les souris murines Ommaya avaient une régression complète de la maladie à la quatrième semaine, et ces souris ont finalement été guéries de la maladie. (B) Ces souris avaient également une survie médiane significativement meilleure (test de Mantel-Cox; P = 0,004; n = 5 souris par groupe de traitement) et une meilleure survie globale que les souris LMD systématiquement traitées. Abréviations : LMD = maladie leptoméningée; IP = intrapéritonéal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ici, l’Ommaya murin a été décrit comme un modèle fiable, qui permet l’administration répétée d’agents anticancéreux dans l’espace du LCR dans des modèles précliniques de LMD et d’autres maladies liées au SNC. Le LCR a été prélevé sur des souris alors que l’appareil était encore attaché sans interruption. Ce modèle de xénogreffe thérapeutique ciblée directement est une étape importante dans l’élaboration et la mise à l’essai de stratégies de traitement rationnelles de la MTM. Le temps entre les injections de cisterna magna et le signe initial du développement de la LMD varie en fonction du type de cellule cancéreuse. Les métastases LMD et SNC commencent à se former environ 1 ou 2 semaines après l’inoculation CTC. Si une lignée cellulaire cancéreuse hautement proliférative est utilisée, il est possible que des métastases se produisent dans <7 jours. Dans ce cas, la vascularisation due à la croissance tumorale peut parfois rendre l’implantation de l’Ommaya murin difficile. Une solution à ce défi consiste à réduire le nombre de cellules cancéreuses à injecter dans l’espace du LCR, ce qui permet de prévoir plus de temps avant le développement de la tumeur. De plus, ce protocole a été optimisé pour implanter l’Ommaya Murin au plus tard 72 h après l’injection de cisterna magna afin de garantir suffisamment de temps aux souris pour se remettre de la chirurgie avant le premier traitement. Les chercheurs devraient calculer le taux de croissance des CCC dans les modèles de xénogreffe avant de planifier le schéma thérapeutique.
Bien qu’il existe d’autres méthodes d’administration intraventriculaire directe, telles que l’utilisation d’un système de pompe osmotique ou d’une injection de bolus incérébroventriculaire (ICV), comme décrit précédemment9, l’utilisation du modèle Murine Ommaya présente plusieurs avantages. Par exemple, une injection de bolus ICV est effectuée en une seule livraison, tandis que le Murine Ommaya permet plusieurs doses de traitement à tout moment, qu’elles soient administrées en un seul agent ou en thérapies combinées. La pompe osmotique est conçue pour durer jusqu’à 14, 28 ou 42 jours avant que la pompe n’ait besoin d’être remplacée, et parfois plus fréquemment si une souris plus petite avec une pompe plus petite est utilisée. Changer la pompe osmotique nécessite une intervention chirurgicale, ce qui ajoute du stress aux souris porteuses de tumeurs. Un remplacement murin ommaya n’est pas nécessaire pour les expériences de longue durée tant que l’appareil reste intact. Il minimise également la variabilité potentielle résultant du changement de la pompe9. Les Ommayas murins implantés chez les souris expérimentales sont restés intacts pendant plus de 42 jours, et cette durée a permis des schémas thérapeutiques de longue durée.
Des résultats antérieurs suggèrent qu’une dose intermittente pulsatile dans le LCR a une meilleure efficacité contre la LMD qu’un processus prolongé d’administration de médicaments par perfusion13. Il serait impossible d’effectuer des injections répétées à dose unique à l’aide du système de pompe osmotique. Il n’y a pas de moyen facile de débusquer le liquide piégé restant après chaque injection. La pompe osmotique est également limitée à l’administration de mélanges de médicaments compatibles ou uniques et nécessite généralement des volumes plus élevés de préparation de médicaments pour perfusion continue. En revanche, le Murine Ommaya est conçu pour des micro-injections précises aussi peu que 3 à 7 μL, sans avoir à tenir compte de l’espace mort, et il n’y a aucune limitation sur le type de médicaments que les chercheurs peuvent utiliser, y compris la thérapie cellulaire immunitaire. Le Murine Ommaya minimise également les déchets de réactifs si un échantillon particulier est précieux et maximise l’utilisation de cette ressource. Pour tout schéma thérapeutique nécessitant plusieurs doses de thérapies anticancéreuses, l’Ommaya murin est facile à utiliser et le risque d’infection ou de mésaventure chirurgicale est minime, avec les approches alternatives d’accès répété au LCR chirurgicalement ou par administration répétée avec une aiguille. Le Murine Ommaya offre aux chercheurs la flexibilité d’ajuster les concentrations de médicaments et les fréquences de dosage et d’évaluer la modulation cible et la durée de l’étude en fonction de la recherche d’intérêt.
Une limitation de l’Ommaya murin est que les chercheurs peuvent avoir du mal à implanter le dispositif chez des souris plus petites. Par conséquent, il est préférable d’utiliser des souris âgées d’au moins 8 à 10 semaines. Il est possible que l’Ommaya murin se détache pendant l’essai de traitement si le dispositif n’est pas fixé au crâne pendant les étapes d’implantation et que la colle s’use, ou si les souris l’ont altéré de manière abrasive. Ce dernier scénario se produit plus fréquemment lorsque plusieurs souris ont été logées dans la même cage. Par conséquent, il est recommandé de ne pas loger plus de deux souris murines implantées Ommaya par cage pendant la durée du programme de traitement. Ce protocole a été modifié pour appliquer de l’adhésif stérile cyanoacrylate sur l’entretoise, qui s’est avérée être la colle la plus efficace pour adhérer à l’espaceur à la surface du crâne et empêcher l’Ommaya murin de se détacher. Les résultats ont montré que les souris LMD bénéficiaient d’un traitement intrathécal direct via l’Ommaya murin, avec une survie globale accrue. Des volumes uniques de microlitres pourraient être administrés en toute sécurité, en contournant le BBB, réduisant ainsi la quantité de préparation de médicaments. Plus important encore, les souris qui ont été guéries des métastases du SNC de l’étude d’immunothérapie Her2-anticorps sont restées en bonne santé.
Une collaboration avec un fabricant visait à développer une version compatible IRM du Murine Ommaya pour le modèle PDX de LMD. Parce que cette version prototype a une entretoise incorporée, aucun assemblage n’est nécessaire, ce qui permet une meilleure adhérence au crâne. Une limitation de ce prototype est que, bien que l’appareil soit compatible avec l’IRM, il génère une ombre à l’endroit où l’appareil est inséré, ce qui diminue la visibilité de l’image pour les analyses de quantification. La version compatible avec l’IRM est un bon outil alternatif lorsque l’échantillonnage ex vivo CTC est un facteur limitant et que le prémarquage des cellules n’est pas réalisable. La combinaison d’un modèle de xénogreffe LMD et de la technique Murine Ommaya est bénéfique pour étudier l’efficacité des médicaments ciblés directement en contournant le BBB. Les résultats de ces études in vivo sont cliniquement pertinents pour concevoir des stratégies thérapeutiques rationnelles pour les patients atteints de LMD.
Déclarations de divulgation
Peter Forsyth siège aux conseils consultatifs d’Abvie Inc., Bayer, Bristol Meyers Squib, BTG, Inovio, Novocure, Tocagen et Ziopharm, en dehors des travaux soumis. Tous les autres auteurs n’ont rien à divulguer.
Remerciements
Nous tenons à remercier Michele L. Danielson, Tricia Favors-Watson et le reste de l’équipe de médecine comparée de l’Université de Floride du Sud pour leur soutien technique et l’entretien de nos animaux. Nous remercions Instech Laboratories, Inc. pour les efforts qu’ils ont déployés en travaillant avec nous sur la base de notre demande de développer un Murine Ommaya compatible avec l’IRM. Ce travail est soutenu par les National Institutes of Health (NIH) R21 CA216756 (à K.S.M. Smalley), le Ministère de la Défense (DOD) W81XWH1910675 (à B. Czerniecki et P. Kalinski), et les Moffitt Cancer Center CBMM Innovative Awards (à P. Forsyth et D. Duckett). L’assistance éditoriale a été fournie par le Bureau de la rédaction scientifique du Moffitt Cancer Center par le Dr Paul Fletcher et Daley Drucker. Aucune compensation n’a été accordée au-delà de leur salaire régulier.
matériels
| Name | Company | Catalog Number | Comments |
| 1 mm spacer disc | Alzet, Durect Corporation | #0008670 | Spacer disc only |
| 4-0 ethilon nylon suture | Any vendor | n/a | |
| Automatic syringe pumps | Harvard Syringe Pumps (or any vendor) | #70-4505 | Pump 11 Elite |
| Bead sterilizer | Braintree Scientific Inc. (or any vendor) | #GER 5287-120V | Germinator 500 |
| Buprenorphine Sustained-Release (Bup-SR) | Zoopharm | DEA controlled | |
| Cyanoacrylate sterile adhesive | Any vendor | ||
| Gas inhalation anestehsia system | VeteEquip | #901812 | COMPAC5 |
| Hamilton microliter syringes | Hamilton | 10, 25, 50, and 100 μL | 30 G for cisterna magna injection |
| Hydrogen peroxide | Any vendor | n/a | |
| IVIS 200 imaging system | Caliper Life Sciences | n/a | |
| Magnifying glass with light | Any vendor | n/a | |
| Microdrill | Stoelting (or any vendor) | #51555M | |
| MRI imaging | Bruker | BioSpec series | Optional |
| Murine Ommaya (MRI-compatible) prototype | Instech Laboratories, Inc. | #VAB620-25MRI-3.3 | |
| Phosphate-buffered saline (PBS) | Any vendor | n/a | 0.1 mm Sterile-Filtered |
| PinPort injector | Instech Laboratories, Inc. | #PNP3M-50 | |
| PinPort | Instech Laboratories, Inc. | #1-PNP3F28-50 | |
| Rodent Surgical Instruments (Scissors, Forceps) | Roboz Surgical Instrument (or any vendor) | ||
| Stereotaxic device | Stoelting (or any vendor) | #51730M | |
| Sterile blue paper/ drape covering | Any vendor | n/a | n/a |
| Sterile cotton sticks | Any vendor | n/a |
Références
- Chamberlain, M. C. Leptomeningeal metastasis. Current Opinion in Neurology. 22 (6), 665-674 (2009).
- Nayar, G., et al. Leptomeningeal disease: current diagnostic and therapeutic strategies. Oncotarget. 8 (42), 73312-73328 (2017).
- Shapiro, W. R., Johanson, C. E., Boogerd, W. Treatment modalities for leptomeningeal metastases. Seminars in Oncology. 36 (4), 46-54 (2009).
- Davies, M. A., et al. Prognostic factors for survival in melanoma patients with brain metastases. Cancer. 117 (8), 1687-1696 (2011).
- Znidaric, T., et al. Breast cancer patients with brain metastases or leptomeningeal disease: 10-year results of a national cohort with validation of prognostic indexes. Breast Journal. 25 (6), 1117-1125 (2019).
- Glitza, I. C., et al. Leptomeningeal disease in melanoma patients: An update to treatment, challenges, and future directions. Pigment Cell & Melanoma Research. 33 (4), 527-541 (2020).
- Raizer, J. J., et al. Brain and leptomeningeal metastases from cutaneous melanoma: survival outcomes based on clinical features. Neuro-oncology. 10 (2), 199-207 (2008).
- Taillibert, S., et al. Leptomeningeal metastases from solid malignancy: a review. Journal of Neurooncology. 75 (1), 85-99 (2005).
- DeVos, S. L., Miller, T. M. Direct intraventricular delivery of drugs to the rodent central nervous system. Journal of Visualized Experiments. (75), e50326 (2013).
- Kodumudi, K. N., et al. Sequential anti-PD1 therapy following dendritic cell vaccination improves survival in a HER2 mammary carcinoma model and identifies a critical role for CD4 T cells in mediating the response. Frontiers in Immunology. 10, 1939 (2019).
- Dunn, L., et al. Murine model of wound healing. Journal of Visualized Experiments. (75), e50265 (2013).
- Simon, M. J., Iliff, J. J. Regulation of cerebrospinal fluid (CSF) flow in neurodegenerative, neurovascular and neuroinflammatory disease. Biochimica et Biophysica Acta. 1862 (3), 442-451 (2016).
- Shackleford, G. M., et al. Continuous and bolus intraventricular topotecan prolong survival in a mouse model of leptomeningeal medulloblastoma. PLoS One. 14 (1), 0206394 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon