Method Article
4-التصوير الأبعاد من زيبرافيش كأس البصرية Morphogenesis
In This Article
Summary
يصف هذا البروتوكول نهجا لوضع العلامات في توتو والتصوير متعدد الأبعاد لسمك الحمار الوحشي في وقت مبكر من نمو العين. نحن نصف وضع العلامات والتضمين والتصوير رباعي الأبعاد (4D) باستخدام المجهر confocal المسح بالليزر ، واعتبارات لتحسين الحصول على مجموعات البيانات لتشريح آليات مورفوجينيسيس كوب البصرية.
Abstract
تتطلب وظيفة النظام البصري إنشاء هياكل دقيقة للأنسجة والأعضاء. في العين الفقارية ، والعيوب الهيكلية هي سبب شائع لضعف البصر ، ولكن آليات تكوين العين لا تزال غير مفهومة بشكل جيد. يتم الحفاظ على التنظيم الأساسي للعين الجنينية في جميع أنحاء الفقاريات ، وبالتالي أصبح التصوير الحي لأجنة حمار وحشي نهجا قويا لمراقبة نمو العين مباشرة في الوقت الحقيقي في ظل الظروف الطبيعية والمرضية. يمكن تصور عمليات الخلايا الديناميكية بما في ذلك الحركات والمورفولوجيا والتفاعلات والانقسام والموت في الجنين. لقد طورنا أساليب لوضع علامات موحدة على الهياكل دون الخلوية والمجهر الكونفوجال الفاصل زمنيا لتطور العين المبكر في سمك الحمار الوحشي. يحدد هذا البروتوكول طريقة توليد الحمض النووي الريبي المتوج للحقن في جنين حمار وحشي مكون من خلية واحدة ، وتركيب الأجنة في مرحلة الحويكل البصري (~ 12 ساعة بعد الإخصاب ، hpf) ، وإجراء تصوير متعدد الأبعاد لخلايا الزمن لتشريب تكوين كوب البصري على مجهر كونفولوجي للمسح بالليزر ، بحيث يتم الحصول على مجموعات بيانات متعددة بشكل متسلسل في نفس جلسة التصوير. ينتج عن مثل هذا النهج بيانات يمكن استخدامها لمجموعة متنوعة من الأغراض، بما في ذلك تتبع الخلايا، وقياسات الحجم، والتجسيد ثلاثي الأبعاد (ثلاثي الأبعاد)، والتصور. تسمح لنا مقارباتنا بتحديد الآليات الخلوية والجزيئية التي تقود تطوير الكأس البصرية ، في كل من النوع البري وظروف المتحولة الوراثية. يمكن استخدام هذه الطرق مباشرة من قبل مجموعات أخرى أو تكييفها لتصور العديد من الجوانب الإضافية لتطوير العين حمار وحشي.
Introduction
يبدأ تطور العين الفقارية بظهور الحويصلات البصرية من الظهارة العصبية الدماغية المحتملة، أو التشنج. الحويصلات البصرية ثم الخضوع لسلسلة من التغييرات شكل الأنسجة، وإطالة ومن ثم التجهم لتوليد الكأس البصرية. في الكأس البصري، تقوم شبكية العين العصبية وظهارة صبغة الشبكية، وكلاهما مشتق من الظهارة العصبية، بتغليف العدسة الوليدة، المشتقة من ectoderm السطح. تتطلب العملية بأكملها سلسلة معقدة من حركات الخلايا والأنسجة والإشارات الجزيئية ، منسقة بين الظهارة العصبية ، ectoderm ، وتجمعات الخلايا الميكنشيمالية. هذه الأحداث الأولية إنشاء الهيكل الأساسي للعين، والخطوات اللاحقة لتطوير العين، بما في ذلك القزحية وتشكيل القرنية، هي تفاصيل عن التنظيم المبكر. اضطرابات في نمو العين في وقت مبكر و morphogenesis تكمن وراء العديد من ظروف ضعف البصر في البشر، بما في ذلك الأنوفثالميا، ميكروفثالميا، و coloboma. فتح الآليات الخلوية والجزيئية التي تحكم مورفوجينيسيس كأس البصرية أمر بالغ الأهمية لمزيد من فهم تطوير النظام البصري والظروف المرضية التي تنتج عندما تذهب هذه العمليات منحرف.
وقد انبثق فهمنا لتطور العين الفقارية والمورفوجين من كمية هائلة من العمل تمتد الدراسات النسيجية الكلاسيكية إلى النهج الجنينية والجينية في مجموعة متنوعة من الكائنات الحية النموذجية بما في ذلك الماوس والفرخ والضفدع والأسماك1و2و3و4و5. في حين أن هذا الجسم من العمل أنشأت الآليات الجزيئية التي تنظم نمو العين في وقت مبكر، تاريخيا هناك فهم ضعيف لمورفوجينيس العين: ظهور هيكلها 3D. وقد جاء الجزء الأكبر من هذه النتائج من الأجنة المقطعية التصوير في نقاط زمنية منفصلة. في حين أن هذا يكفي لتوفير رؤية لمورفولوجيا الأنسجة في بعدين ، فإن مورفوجينيسيس هي عملية ديناميكية ثلاثية الأبعاد. من أجل تحديد كيفية تغير شكل الأنسجة في 3 أبعاد مع مرور الوقت ، وكيف تتصرف الخلايا المفردة ، وكيف تساهم هذه السلوكيات في التغيرات في شكل الأنسجة ثلاثية الأبعاد ، من الضروري اتباع نهج مختلفة.
أحد الحلول لمعالجة هذه الفجوة الكبيرة في المعرفة هو التصوير الحي ، والذي يتيح المراقبة الديناميكية للخلايا والأنسجة في الوقت الحقيقي مع تشكيل العضو. لسوء الحظ، هذا ليس ممكنا بسهولة في العديد من الكائنات النموذجية بسبب قيود النمو الجنيني. على سبيل المثال، لا يمكن الوصول بسهولة إلى أجنة الفئران والفراخ (التي تتطور في الرحم أو داخل قشر البيض)، والعديد من الأجنة الحية ليست شفافة بصريا، مما يسبب تشتتا خفيفا كبيرا ويحد من العمق الذي يمكن الحصول على الصور إليه. Zebrafish، مع التنمية الخارجية والأجنة شفافة، وتوفير فرصة فريدة للقيام بالتصوير الحي للعيون morphogenesis6،7،8،9،10،11،12،13،14،15،16،17،18،19. كما تتوفر خطوط واسعة المعدلة وراثيا ومتحولة، فضلا عن أدوات لتوليد المعدلات الجديدة والمسوخ20،21،22،23،24. وعلاوة على ذلك، يحدث شكل التشكل للكوب البصري بسرعة في سمك الحمار الوحشي، على مدى 12 ساعة (12-24 ساعة بعد الإخصاب، hpf)، مما يجعل تصوير العملية برمتها ممكنا.
وقد تسارعت جهود التصوير الحي من خلال توسيع وتحسين عائلة البروتينات الفلورية ، والتي تسمح بوضع علامات حيوية مشفرة وراثيا للهياكل دون الخلوية ، فضلا عن التحسينات والابتكارات في طرق المجهر. يستخدم البروتوكول الموصوف هنا المجهر الكونفوجال المسح بالليزر ، بدلا من النهج الحالية الأخرى لتصوير تكوين جنين حمار وحشي ، بما في ذلك المجهر الكونفوجال القرص الغزل ، المجهر إضاءة الطائرة الانتقائية (SPIM ومتغيراتها) ، وغيرها من أساليب المجهر أكثر تخصصا. بالنسبة لعين حمار وحشي النامية ، وجدنا أن المجهر الكونفوجال القرص الغزل لم يكن كافيا للتصوير أعمق في الأنسجة. على الرغم من أن SPIM تفتخر بوقت تصوير سريع للغاية وأصبحت تستخدم على نطاق أوسع ، إلا أن التعامل مع مجموعات البيانات الكبيرة للتصور والتحليل لا يزال يمثل تحديا. وعلى النقيض من ذلك، يمكن الوصول بسهولة إلى المجهر البؤري بالليزر، وخاصة بالنسبة للأفراد الذين يفتقرون إلى الخبرة في تجميع الأجهزة البصرية. نأمل أن التوافر الواسع للفحص بالليزر المجهري confocal سيجعل بروتوكولنا مفيدا للعديد من المختبرات.
هنا، ونحن نصف طريقتنا لالتقاط مجموعات البيانات 4D من مورفوجينيسيس كأس البصرية، وذلك باستخدام في توتو وضع العلامات على الجنين للأغشية والكروماتين، والمجهر confocal المسح بالليزر للحصول على صورة (مخطط في الشكل 1). البروتينات الفلورية المستخدمة هنا (EGFP-CAAX و H2A. تم اختيار F/Z-mCherry) لتوفير وضع العلامات على الأنسجة بدقة خلية واحدة. نحن نستخدم مجموعات البيانات التي تم إنشاؤها باستخدام هذا البروتوكول لمجموعة متنوعة من وظائف تحليل الصور والتصور. يمكن تكييف هذا البروتوكول بسهولة إذا كانت هناك رغبة في هياكل فرعية أخرى. تم اختيار وضع العلامات غشاء البلازما لتصور شكل الخلية: نحن نستخدم EGFP-CAAX، حيث يتم دمج الأحماض الأمينية ال 21 الأخيرة من H-ras، بمثابة تسلسل إشارة ما قبلنيليشن، إلى C-terminus من EGFP13. غشاء البلازما الأخرى المستهدفة البروتينات الفلورية (على سبيل المثال، الانصهار عبر الميمبران أو myristoylated) من المرجح أن تعمل فقط كذلك. للاحتفال النوى، اخترنا H2A. F / Z-mCherry، الذي يتم دمج mCherry إلى بروتين الهستون13. وهذا يضمن أن تقسيم الخلية، بما في ذلك اتجاه المغزل ميتوتيك، هو تصور بسهولة.
مع أي نهج التصوير الحي ، يجب على المرء أن تنظر المفاضلة بين زيادة سرعة التصوير مع تعظيم نسبة الإشارة إلى الضوضاء ، والقرار المحوري ، والحفاظ على العينة. لقد قمنا بتحسين أساليبنا لتحقيق أقصى قدر من جودة الصورة وعدد الأجنة التي يمكن تصويرها في شوط واحد. في كثير من الأحيان ، فإن الهدف هو تصوير تكوين الكوب البصري في جنين متحول متجانس ، والذي قد لا يمكن تمييزه بشكل غير عادي عن النوع البري في بداية تكوين الكوب البصري وذرية تقاطع heterozygous (25٪ من الأجنة هي النمط الجيني المطلوب). من خلال تحسين ، ومن ثم الحصول على صورة متعددة ، هناك احتمال متزايد لالتقاط مجموعة بيانات من جنين متحول متجانس.
الدقة الزمنية، أو عدد المرات التي يتم فيها الحصول على بيانات الحجم (Z-stacks)، هو جانب رئيسي من التصوير الفاصل الزمني. اعتمادا على الغرض من مجموعات البيانات هذه، هناك متطلبات مختلفة للسرعة. في البداية تم تطوير هذا البروتوكول لتتبع الخلايا 4D اليدوي. يتطلب تتبع الخلايا الفردية داخل نسيج يحمل علامة موحدة دقة زمنية عالية بما يكفي لتوفير الثقة في أن أي خلية واحدة يتم تعقبها باستمرار بمرور الوقت. وجدنا أن Z-مداخن من حمار وحشي كأس البصرية مورفوجينيسيس يجب الحصول على الأقل كل 3.1 دقيقة على مدى 12 ساعة; هنا، قمنا بتحسين استحواذنا على مجهر كونفوجكال ليزر بحيث يمكننا الحصول على Z-مداخن من 4-5 أجنة كل 2.5 دقيقة.
كان إنشاء حجم Z-step خطوة حاسمة في تحسين البروتوكول: بالنسبة للعرض والتصور ثلاثي الأبعاد ، تعد البيانات متساوية الخواص مثالية ، حيث يساوي حجم Z-step بعد بكسل XY. في الواقع ، من الصعب للغاية الحصول على بيانات الفاصل الزمني هذه مع عينات حية ، نظرا للقيود مع وقت التصوير وphotobleaching. ولذلك، تحديد حجم Z-الخطوة كافية مهم لتقديم والتصور احتياجات التجربة، وعلى وجه التحديد، ما X:Y:Z نسبة voxel مطلوب لتحقيق أقصى قدر من المعلومات المحورية مع الحفاظ على السرعة ومنع photobleaching. بالنسبة لهذا البروتوكول، كانت نسبة voxel المنشأة 1:1:3.5 (0.6 ميكرومتر × 0.6 ميكرومتر × 2.1 ميكرومتر من حجم الخطوة Z باستخدام هدف غمر المياه لمسافات العمل الطويلة 40x). عند الحصول على عمق Z من 130-140 ميكرومتر ، وهذا يعطي بيانات حجم مع دقة زمنية مناسبة والقليل من photobleaching.
كما نوقش أعلاه، هذا البروتوكول هو محدد للتصوير 4D من مورفوجينيسيس كأس الحمار الوحشي البصرية، وذلك باستخدام الأجنة في توتو المسمى لغشاء البلازما والكروماتين، والمجهر confocal المسح بالليزر. يمكن تكييف البروتوكول أدناه بسهولة لمجموعة متنوعة من التجارب والاحتياجات. أولا، فيما يتعلق بالهياكل دون الخلوية، يمكن تصوير أي بنية توجد لها علامة خلية حية. بعد ذلك ، على الرغم من أن التركيز هنا يقتصر على تكوين الأكواب البصرية ، إلا أنه يمكن تكييف تصوير الفاصل الزمني للمراحل الأخرى من تطور العين ، على سبيل المثال ، تكوين الأعصاب25،26،27،28،29،30،31،32،33. للتصوير في وقت لاحق التنمية، قد تحتاج إلى النظر في شل الجنين (كما يبدأ نشاط العضلات العفوية حوالي 24 حصان)، تصبغ (الذي يبدأ في الظهور حوالي 24 حصان)، وحجم الأنسجة (العين ينمو بشكل كبير في حجم أثناء تكوين الأعصاب)، وسرعة التصوير (والتي ينبغي تعديلها اعتمادا على سرعة عملية الاهتمام). ويمكن إدارة جميع هذه الاعتبارات بسهولة. البروتوكول مرن جدا؛ بالإضافة إلى تفاصيل البروتوكول المحدد هنا ، هناك مبادئ عامة من شأنها أن تساعد المهتمين في التصوير الحي جوانب أخرى من تطور العين.
Protocol
جميع الأساليب الموصوفة هنا باستخدام حمار وحشي مشمولة ببروتوكول الدكتور كريستين كوان الحيواني ، "الآليات الخلوية والجزيئية لتطوير النظام البصري في Zebrafish" ، ووافقت عليها اللجنة المؤسسية لرعاية الحيوان واستخدامه (IACUC) في جامعة يوتا.
1. توج التوليف الجيش الملكي النيبالي
- إنشاء قالب الحمض النووي للنسخ في المختبر.
- خطي قالب الحمض النووي عن طريق هضم 10 ميكروغرام من الحمض النووي في حجم 100 ميكرولتر من خليط التفاعل. يتم تجميع رد فعل نموذجي على النحو التالي: هضم الحمض النووي 10 ميكروغرام باستخدام 3 ميكرولتر من الانزيم و 10 ميكرولتر من العازلة، وبذلك حجم التفاعل إلى 100 ميكرولتر مع الماء.
ملاحظة: قالب نموذجي للهضم هو ناقل pCS2، على سبيل المثال، pCS2-EGFP-CAAX أو pCS2FA-H2A.F/Z-mCherry للغشاء وسم الكروماتين الموصوفة هنا. في هذه الحالة، يتم هضم كل من plasmid DNAs باستخدام إنزيم NotI. يجب على المستخدمين توخي الحذر من نشاط النجوم؛ في هذه الحالة ، يوصى بأنزيم عالي الدقة ومتاح تجاريا. - احتضان رد الفعل عند 37 درجة مئوية بين عشية وضحاها لضمان هضم الحمض النووي حتى الانتهاء.
- تنظيف ملخص التقييد باستخدام عدة تنقية PCR باتباع بروتوكول الشركة المصنعة. Elute الحمض النووي مع 30 ميكرولتر ddH2O. تخزين الحمض النووي خطي في -20 درجة مئوية واستخدامها حسب الحاجة.
ملاحظة: كمية الحمض النووي المهضوم وحجم الغضوء ينتجان حوالي 0.3 ميكروغرام/ميكرولتر؛ هذا يكفي ل ~ 5 جولات من النسخ في المختبر ، كل جولة باستخدام ~ 2 ميكروغرام من الحمض النووي كقالب.
- خطي قالب الحمض النووي عن طريق هضم 10 ميكروغرام من الحمض النووي في حجم 100 ميكرولتر من خليط التفاعل. يتم تجميع رد فعل نموذجي على النحو التالي: هضم الحمض النووي 10 ميكروغرام باستخدام 3 ميكرولتر من الانزيم و 10 ميكرولتر من العازلة، وبذلك حجم التفاعل إلى 100 ميكرولتر مع الماء.
- في المختبر transcribe توج الجيش الملكي النيبالي باستخدام عدة النسخ في المختبر. بالنسبة لقوالب pCS2 (كما هو موضح هنا)، استخدم مجموعة SP6.
- تجميع رد فعل النسخ في المختبر، على النحو التالي: خلاصة 2 ميكروغرام من قالب الحمض النووي أو ما يصل إلى 6 ميكرولتر مع 2 ميكرولتر من 10x رد فعل العازلة، 10 ميكرولتر من 2x ريبونوكليوتيد ميكس، و 2 ميكرولتر من 10x مزيج الإنزيم.
- حضانة في 37 درجة مئوية لمدة 2-4 ساعة أو أكثر (أوقات أطول سيؤدي إلى زيادة الغلة). إذا رغبت في ذلك، يمكن تكملة 1 ميكرولتر من إنزيم ميكس في منتصف فترة الحضانة.
- هضم قالب الحمض النووي بإضافة 1 ميكرولتر من DNase خالية من RNase واحتضان لمدة 15 دقيقة في 37 درجة مئوية.
- تنقية RNA توج باستخدام عدة تنقية الحمض النووي الريبي بعد بروتوكول الشركة المصنعة (انظر جدول المواد). Elute مع 100 ميكرولتر من RNase خالية H2O.
ملاحظة: إضافة β-ميركابتوثانول غير ضروري لهذا التطبيق. في حين أن الطريقة الموصوفة في هذا البروتوكول واضحة ، يمكن أيضا استخدام الكواشف البديلة لتنقية الحمض النووي الريبي. - عجل الجيش الملكي النيبالي.
- إضافة 10 ميكرولتر من 3 M RNase خالية NaOAc و 2.5 مجلدات (~ 275 ميكرولتر) من الجليد الباردة RNase خالية 100٪ EtOH إلى الحمض النووي الريبي eluted.
- احتضان رد الفعل في -20 درجة مئوية لمدة 15-30 دقيقة. تدور لمدة 15 دقيقة بسرعة عالية في 4 درجة مئوية بيليه الجيش الملكي النيبالي.
ملاحظة: يجب أن تكون بيليه مرئية ضد جدار الأنبوب. من المفيد ملاحظة كيفية محاذاة الأنبوب في جهاز الطرد المركزي في هذه الخطوة ، من أجل التنبؤ بمكان بيليه في نهاية الدوران. - إزالة EtOH بعناية مع حقنة، مع الحرص على تجنب التدفئة، والإفراط في التجفيف، أو إزاحة بيليه. Resuspend بيليه في 20 ميكرولتر من RNase خالية H2O.
- تحقق من الحمض النووي الريبي لضمان نجاح عملية التركيب. استخدم 1 ميكرولتر لقياس التركيز على مطياف وتشغيل 0.5 ميكرولتر على هلام الآغاروز بنسبة 1٪ للتحقق من وجود شريط أو شريطين منفصلين، بدلا من تشويه الوزن الجزيئي المنخفض. يجب أن يكون العائد من رد فعل النسخ في المختبر ~ 1 ميكروغرام / μL.
- Aliquot وتخزين الحمض النووي الريبي في -20 درجة مئوية أو -80 درجة مئوية. لا يتم تخفيف الحمض النووي الريبي حتى قبل الحقن مباشرة.
2. الميكرويكشن من 1 خلية أجنة حمار وحشي
ملاحظة: حقن 200-300 pg لكل RNA للحصول على التعبير في كل مكان من الكروماتين وأغشية الخلايا في جميع أنحاء مورفوجينيسيس كوب البصرية. إعداد 5-10 ميكرولتر من تخفيف الحمض النووي الريبي، وتحميل 2.5-5 ميكرولتر / إبرة. خطة لمزيد من في حالة فواصل الإبرة.
- الاستعدادات المسبقة للحقن.
- إعداد طبق قالب الحقن لتسهيل محاذاة واتجاه الأجنة ذات الخلية واحدة لإجراء الحقن المجهري. تذوب 2٪ agarose في E3 (متوسط الجنين القياسية) وتصب في طبق بيتري. تطفو بعناية قالب الحقن (انظر جدول المواد)على الجزء العلوي من agarose الساخنة لتوليد بصمة أحواض في agarose كما أنه يقوي. بمجرد أن يتماسك الآغاروز، قم بإزالة قالب الحقن.
ملاحظة: يمكن استخدام أطباق قالب الحقن لعدة أشهر. تغطية في E3 وتخزينها في 4 درجة مئوية عندما لا تكون قيد الاستخدام. - سحب إبر الحقن المجهري. سحب الشعيرات الدموية الزجاج إلى تفتق طويلة لجعل الإبر microinjection باستخدام آلة سحب إبرة. برمجة الجهاز الخاص بنوع الشعيرات الدموية المستخدمة. ل1.0 × 0.78 مم البوروسيليكات الشعيرات الدموية استخدام البرنامج التالي: الحرارة = 546 درجة مئوية، سحب = 130، السرعة = 70، والوقت = 90 (الشكل 2F). تخزين الإبر في طبق بيتري وتأمينه مع الطين النمذجة.
ملاحظة: تختلف وصفة السحب، اعتمادا على الجهاز والخيوط، وينبغي دائما معايرة خيوط جديدة. كل جولة من سحب تنتج اثنين من الإبر (الشكل 2G); القيام بذلك عدة مرات لإنتاج الإبر بما فيه الكفاية في حالة فواصل عرضية والتجارب المستقبلية. - تمييع الحمض النووي الريبي المتوج للحقن. تمييع كل من EGFP-CAAX و H2A-mCherry RNAs إلى تركيز 200-300 نانوغرام /ميكرولتر باستخدام تركيز RNase-freeH 2O و 1 ميكرولتر من الفينول الأحمر في حجم إجمالي قدره 5 ميكرولتر (التركيز النهائي للأحمر الفينول هو 0.1٪). نفض الغبار الخليط وتدور لفترة وجيزة إلى أسفل لجمع الحجم الإجمالي. الحفاظ على الحمض النووي الريبي المخفف على الجليد قبل الحقن.
- إعداد طبق قالب الحقن لتسهيل محاذاة واتجاه الأجنة ذات الخلية واحدة لإجراء الحقن المجهري. تذوب 2٪ agarose في E3 (متوسط الجنين القياسية) وتصب في طبق بيتري. تطفو بعناية قالب الحقن (انظر جدول المواد)على الجزء العلوي من agarose الساخنة لتوليد بصمة أحواض في agarose كما أنه يقوي. بمجرد أن يتماسك الآغاروز، قم بإزالة قالب الحقن.
- حقن أجنة ذات خلية واحدة
- بمجرد أن تبدأ الأسماك في التكاثر، اسمح ل ~15-20 دقيقة بضمان أن تصبح البويضات مخصبة. خلال هذا الوقت، تحميل الإبرة مع 2.5-5 ميكرولتر من تخفيف الحمض النووي الريبي باستخدام نصائح P10 و P10 محمل صغير.
- باستخدام picoinjector، معايرة الإبرة باستخدام الشبكية العدسة (شريحة معايرة ميكرومتر كافية أيضا) لقياس حجم قطرة (حجم الكرة = (4/3) * pi * نصف قطر ^ 3). ضبط وقت الحقن والضغط بحيث حجم الحقن هو 1 nL (الشكل 2I).
- مع بكرة / نقل ماصة، وتحميل البيض بعناية في قالب الحقن (الشكل 2J). إذا كان مفيدا، استخدم ملقط للفة الأجنة بحيث تكون الخلية الواحدة مرئية، إما قبل أو أثناء الحقن. ومن تفضيل المستخدم لاستخدام micromanipulator.
- حقن الأجنة في مرحلة 1 خلية، واستهداف الخلية وليس صفار (الشكل 2M). وهذا سيضمن وضع علامات موحدة على الجنين النامي.
- رفع الأجنة إلى المرحلة المطلوبة (قبل 12 حصان، وفقا لمعيارالتدريج 34). الأجنة المحقونة سيكون لها تطور متأخر ، لذلك رفعها في درجة حرارة أعلى قليلا (29.0-29.5 درجة مئوية) لتعويض الوقت. خلال فترة ما بعد الظهر، تحقق من الأجنة وإزالة تلك التي هي ميتة للحفاظ على صحة مخلب.
3. تركيب الحويطب البصري مرحلة أجنة حمار وحشي لتصوير الفاصل الزمني
- قبل التركيب، قم بإعداد 1.6٪ من الآغاروز منخفض الذوبان في E3. إذا كنت تخطط لتجارب تصوير متعددة، فعد ~20 مل من الآغاروز المنخفض الذوبان وخزنه في درجة حرارة الغرفة. في يوم تصاعد الجنين، تذوب هذه لتوليد aliquot جديدة (1-5 مل) في أنبوب التي يمكن وضعها في كتلة الحرارة 42 درجة مئوية قبل تصاعد.
- فحص الأجنة للحقن الناجح والسطوع العام للفلورسينس باستخدام مجهر مضان قبل التركيب. عينة مثالية سيكون لها EGFP قوية و mCherry مضان ويكون في مرحلة النمو الصحيح(الشكل 3B - B'').
- فحص الأجنة باستخدام مجهر مضان. حدد الأجنة التي تعبر بقوة عن كل من EGFP و mCherry فلورية لتركيب.
- حدد الأجنة التي هي 11 حصان. عدد somites لمرحلة بشكل صحيح الأجنة34; في 11 حصان يجب أن يكون هناك 3 somites، وبحلول 12 hpf هناك 6 somites.
ملاحظة: بواسطة الأجنة المتصاعدة قبل 12 حصان (عند 11 حصان)، سيتم تنظيم العينات بشكل مناسب عند 12 حصان عند بدء الفاصل الزمني.
- الأجنة dechorionate قبل تصاعد. القيام بذلك إما يدويا مع ملقط ناعم أو كيميائيا باستخدام pronase (2 ملغ / مل). مع الأجنة هذا الشباب، فمن الضروري أن يتم إجراء dechorionation داخل طبق مغلفة أجار وأن الأجنة لا تتصل واجهة الهواء والماء.
- باستخدام ماصة الأسطوانة الزجاجية ، تمتص جنينا وإخراج أكبر قدر ممكن من E3 بحيث يجلس الجنين في طرف ماصة باستور الزجاج.
- إسقاط الجنين في أنبوب agarose من كتلة الحرارة. السماح لها بالغرق في agarose لبضع ثوان، ثم تمتص بعض agarose أولا ثم الجنين، والتأكد من أن الجنين لا يزال في غيض من ماصة(الشكل 3C - C').
- ضع طبق زجاجي لأسفل للتصوير تحت نطاق تشريح. إخراج الجنين وأغاروز في قطرة agarose في طبق الزجاج القاع. استخدام ملقط لتوجيه بسرعة كبيرة، بحيث الجنين هو الظهرية إلى أسفل (أعلى الرأس على الجزء السفلي الزجاج). السماح للقطرات agarose لتصلب (الشكل 3D - D '). ويجب أن تتم هذه الخطوة بسرعة ولكن بعناية، لأن الأجنة في هذه المرحلة هشة. الأجنة التالفة لن تنجو من عملية تصوير الفاصل الزمني.
ملاحظة: من المهم توجيه جميع الأجنة باستمرار لهذه التجربة. عند إجراء الفاصل الزمني ، يجب أن تتناسب الأجنة مع مجال الرؤية المخصص مع الحفاظ على مساحة إضافية لنمو الحويكل البصري. التوجه الأمثل هو محاذاة المحور الأمامي الخلفي لجميع الأجنة "عموديا" أو على طول الساعة 12 و 6 على وجه الساعة(الشكل 3G). - جبل بين 10-12 الأجنة، وهو أكثر من ضعف عدد التي سيتم تصويرها، بحيث يمكن اختيار أفضل العينات مرة واحدة تقييمها على كونفوجكال(الشكل 3E - E'). سيتم تقييم العينات حسب العمر، وتوحيد وضع العلامات الفلورية، ودقة الاتجاه المتصاعد.
- بعد تركيب الأجنة، ماصة أكثر agarose لتغطية تماما الجزء السفلي من الطبق، وبالتالي يغلف كل من قطرات agarose منفصلة في قرص واحد agarose كبيرة (الشكل 3F - F '). وهناك كمية كافية من الآغاروز ضمان أن قطرات الجنين الفردية أو القرص بأكمله لا يرفع من أسفل الطبق وتطفو بعيدا عن الأنظار.
- بمجرد تصلبها ، قم بتراكب الآغاروز مع E3 للحفاظ على رطوبة العينات طوال مدة تجربة التصوير الفاصل الزمني (وهو مصدر قلق اعتمادا على رطوبة المبنى وفي البيئة).
ملاحظة: Tricaine ليست ضرورية لهذه التجارب التصوير الفاصل الزمني محددة, كما هذه الأجنة هي صغيرة بما فيه الكفاية; ومع ذلك، إذا رغبت في ذلك، وإذا كان العمل مع المراحل القديمة من الأجنة، يمكن إضافة tricaine في agarose نفسها ومتراكبة في وسائل الإعلام. - على الورق، ارسم خريطة للأجنة لتسهيل الرجوع إليها أثناء إعداد الفاصل الزمني. وهذا أمر حاسم لربط الموقف في وقت لاحق مع النمط الجيني لكل عينة.
4. موقف متعددة الفاصل الزمني confocal مع المجهر confocal المسح بالليزر
ملاحظة: تم تصميم بروتوكول التصوير الفاصل الزمني هذا لاستخدامه مع مجهر كونفوجكال ليزر مجهز ببرنامج الشركة المصنعة (انظر جدول المواد). وقد تم تجهيز هذا النظام مع جهاز بيزو Z المرحلة التي تسمح الحصول السريع على Z-مداخن. خطوط الليزر المستخدمة في هذا البروتوكول هي ليزر 488 نانومتر أرجون أيون وليزر DPSS 561 نانومتر. الليزر 561 نانومتر هو مناسبة تماما لتصوير الفلوروفور mCherry: أنها قريبة بما فيه الكفاية إلى ذروة الإثارة mCherry (587 نانومتر) و تعمل بالطاقة بشكل جيد.
- إعداد الكونفوجال.
- الطاقة على confocal وتسجيل الدخول إلى الكمبيوتر المكتبي.
- تثبيت إدراج بيزو Z-المرحلة (الشكل 4B)، ثم بدء تشغيل برنامج الاستحواذ.
- في البرنامج داخل وضع الاستحواذ، قم بتشغيل الليزر 488 و 561 باستخدام القائمة المنسدلة(الشكل 4F). الليزر يستغرق عدة دقائق للاحماء، لذلك يتم تنفيذ هذه الخطوة في وقت مبكر لتوفير الوقت.
ملاحظة: معلمات الاستحواذ كما يلي: تحقق من مربعات Z-المكدس و "سلسلة الوقت"و "موضع". تعيين حجم الإطار إلى 512 (X) × 384 (ص)، سرعة المسح الضوئي إلى 9، وضع المسح الضوئي إلى ثنائي الاتجاه، التكبير إلى 0.7، الثقب إلى 60.2 (1.63 وحدات متجدد الهواء ~= 1.6 مقطع ميكرومتر)، وZ-الفاصل الزمني إلى 2.1 ميكرومتر. سيؤدي ذلك إلى إنتاج حجم صورة 303.6 ميكرومتر × 227.7 ميكرومتر، وحجم بكسل 0.59 ميكرومتر. وينبغي فحص الليزر 488 و 561 وتعيينها إلى نفس المسار؛ نطاق الكشف EGFP هو 494-545 نانومتر ونطاق الكشف mCherry هو 598-679 (الشكل 4F). - معطف بتحرر الجزء السفلي من طبق زجاجي مع الغمر المتوسطة مطابقة مؤشر الانكسار من الماء، مع الحرص على تجنب فقاعات الهواء(الشكل 4C). حدد هدف المياه 40x وتطبيق قطرة صغيرة من الغمر المتوسطة إلى الهدف(الشكل 4D). تأمين طبق الزجاج القاع في إدراج المرحلة، وتطبيق E3 للحفاظ على الأجنة رطبة بين عشية وضحاها، ثم استخدام الطين النمذجة لختم الغطاء البلاستيكي على الطبق(الشكل 4E). رفع الهدف لإجراء اتصال مع الطبق.
- عينات الشاشة والاستعداد ل timelapse.
- قم بالتبديل من علامة التبويب Acquisition إلى علامة التبويب Locate وانقر على رمز المصباح لتشغيل الضوء المرسل. مع الضوء المنقول، حدد موقع العينة الأولى مع عصا التحكم: عن طريق العين، أولا نقل العينة إلى شعاع الضوء، ثم استخدام العدسة إلى المركز والتركيز على الحويص البصري.
- العودة إلى علامة التبويب اكتساب. تأكد من أن Z-المكدس، سلسلة زمنية، ومربعات المواقف يتم فحصها ، ويتم تسخين الليزر للاستخدام.
- تعيين حجم الإطار إلى 512 (X) × 384 (ص) ، سرعة المسح الضوئي إلى 9 ، وضع المسح الضوئي إلى ثنائي الاتجاه ، وتعيين التكبير إلى 0.7.
- تحت عنوان القنوات، ابدأ بتعيين الليزر 488 و 561 إلى Power 2.0 و Gain 550 (يمكن تعديل هذا لاحقا). تعيين الثقب إلى 60.2 (1.63 وحدات متجدد الهواء ~ = 1.6 مقطع ميكرومتر).
- ابدأ المسح الضوئي باستخدام الزر "مستمر". مع مقبض التركيز الدقيق، حدد موقع العينة في المحور Z ووضع محور X-Y في الإطار. توقف عن المسح.
- تحت عنوان المناصب، انقر على إضافة لحفظ معلومات XYZ على العينة الأولى(الشكل 4F). القيام بذلك فقط للعينات التي يتم timelapsed. حدد عينات لفلورسينس قوية وتصاعد الأمثل.
- التبديل إلى علامة التبويب تحديد موقع الانتقال إلى النموذج التالي ثم كرر الخطوات 4.2.5-4.2.6، يتم انتقائية حول اختيار عينات.
- وضع اللمسات الأخيرة على نماذج المواضع وتعيين نطاق z ثم بدء الفاصل الزمني. بمجرد اختيار جميع العينات (من الممكن تصوير عينات 4-5 ضمن الفاصل الزمني الإجمالي لمدة 2.5 دقيقة) ويتم حفظ المواضع ، انتقل من خلال كل عينة وضبط موضع XYZ داخل إطار العرض.
- قم بتمييز الموضع الأول وانقر على الانتقال إلى. أثناء المسح الضوئي باستمرار، اصطف الحويكل البصري داخل الإطار. اترك مساحة واسعة في المناطق الأمامية وال البعيدة نسبة إلى الحويقعة البصرية والدماغ.
- بعد ذلك، قم بتعيين شرائح Z الأولى والأخيرة عن طريق تحديد تعيين أولا وتعيين الأخير أثناء التحرك من خلال اتجاه Z مع مقبض التركيز الدقيق. الحفاظ على عدد شريحة إجمالية من ~ 63، وهذا سوف تستوعب نمو الكأس البصرية. توفير مساحة إضافية على الجانب البطني من الحويزل البصري للسماح مجالا للنمو.
- مرة واحدة وقد تم تعيين شرائح Z الأولى والأخيرة، انقر على زر C للانتقال إلى وسط المكدس Z. ضبط قوة الليزر وكسب لكلا الليزر. إذا كان ذلك ممكنا، والحفاظ على طاقة الليزر أقل من 5 واستخدام مكاسب أعلى، إذا لزم الأمر. توقف عن المسح. تحديث معلومات الموضع بالنقر فوق تحديث.
- الانتقال إلى الموضع التالي من خلال النقر على الموضع 2. كرر الخطوات 4.3.1-4.3.3 لكل موضع معين. وينبغي تعيين قوة الليزر وكسب بحيث تكون جميع العينات مضيئة بما فيه الكفاية.
- بمجرد الانتهاء من كل من معلومات الموضع وإعدادات الليزر، قم بتعيين إعدادات السلسلة الزمنية. تحت عنوان السلسلة الزمنية، قم بتعيين الفاصل الزمني إلى 2.5 دقيقة، والدورات إلى 300(الشكل 4F). يتم حساب عدد الدورات بحيث يمضي الفاصل الزمني بعد مرحلة 24 hpf ، عند اكتمال تطوير الكأس البصرية.
- لبدء الفاصل الزمني، انقر على ابدأ. مراقبة الدورة الكاملة الأولى: استخدم جهاز ضبط وقت لضمان أن تكون دورة واحدة كاملة (تصوير جميع المواضع) أقل من 2.5 دقيقة والتحقق من أن كل موضع يبدو صحيحا. يعمل المجهر بشكل مستقل بين عشية وضحاها ولا يحتاج إلى مراقبة.
ملاحظة: على الرغم من أن يتم التحكم في درجة حرارة الغرفة confocal، ودرجة حرارة الغرفة هو 20-25 درجة مئوية. مع تشغيل المعدات ومسح الليزر ، يبدو أن درجة الحرارة على المسرح أقرب إلى 28.5 درجة مئوية ، لأن التطور الجنيني يستمر بهذا المعدل المتوقع ، كما تم فحصه بصريا مع المعالم المورفولوجية. - مع هذه الإعدادات، سوف تستمر الفاصل الزمني 12.5 ساعة. حفظ الملف بمجرد اكتمال الفاصل الزمني. وسوف تكون كبيرة (~ 40 غيغابايت) ويمكن فصلها إلى مواقف فردية بعد حفظها باستخدام برنامج الاستحواذ.
النتائج
حقن الرناس الفلورية تمكن وضع العلامات دون الخلوية
يتم حقن الرنانات التي تسمي غشاء البلازما في الخلية والهستونات من أجل التقاط مورفولوجيا الخلايا الفردية والحركات التي تكمن وراء تكوين كوب البصري. يوضح الشكل 2 كل خطوة من عملية تخريج أجنة حمار وحشي في مرحلة الخلية الأولى. لفترة وجيزة، يتم تزاوج حمار وحشي (الشكل 2E)،ويتم جمع الأجنة وتحميلها في قالب الحقن (الشكل 2J). يتم ملء إبرة microinjection(الشكل 2H)،ويتم حقن الأجنة مباشرة في خلية واحدة (الشكل 2K-M)، وهو أمر ضروري للحصول على وضع العلامات موحدة ( الشكل2M، الشكل 4I-أنا'''، فيلم1). بالإضافة إلى وضع العلامات الموحدة ، لوحظ تفلور قوية والتنمية العائدات دون عائق(الشكل 3B--باء'').
تركيب فعال ضروري لتصوير الفاصل الزمني OCM من 12-24 حصان
لتصوير تكوين الكوب البصري ، والذي يحدث على مدى فترة طويلة من الزمن ، من المهم تحديد الأجنة المثالية ووضع كل عينة بشكل صحيح أثناء التضمين. ويبين الشكل 3 وصفا مفصلا لنجاح تركيب 11 جنينا من قوة حصانية. يتم فحص الأجنة المحقونة لأول مرة للحصول على مضان كاف (الشكل 3B'، B'،F''، F'''). يتم غمر الأجنة الفردية في agarose (الشكل 3C، C ') وشنت الظهر في قطرة فردية من الآجروز ( الشكل3D، D '). يتم تركيب جميع العينات في قرص جماعي من الآغاروز (الشكل 3E-F'). عندما يتم تنظيم الأجنة بشكل صحيح ، الفلورسنت بما فيه الكفاية ، وشنت بشكل كاف (الشكل 3G) ، فإن العينات تبقى في إطار التصوير خلال الفاصل الزمني مما يسمح لتصوير الجهاز بأكمله(الشكل 4G-G''،I--أنا''، فيلم1). سيؤدي الفشل في إنجاز أي من هذه الخطوات إلى جنين مثبت ليس عينة مثالية للتصوير الفاصل الزمني. سيكون أدنى اختلاف في درجة الدوران له تأثير كبير على اتجاه نمو الجنين خلال الفاصل الزمني. تظهر عمليات الدوران دون المستوى الأمثل في الشكل 3، بما في ذلك الجنين الذي يتم تدويره بشكل مفرط(الشكل 3I)، والذي سيؤدي إلى مزيد من الفاصل الزمني الخلفي ، وجنين أقل استدارة(الشكل 3J)حيث يمكن ملاحظة الأنسجة الأمامية فقط. بالإضافة إلى التناوب السليم أثناء التركيب ، والعينات التي شنت فيما يتعلق اتجاه الإطار هي أكثر عرضة لتسفر عن timelapse ناجحة (الشكل 4G--G''،أنا--أنا''، فيلم1). العينات المثلى هي تلك التي توجه عموديا على الطبق، مع محور الأمامي الخلفي تمشيا مع 12 و 6:00 على وجه الساعة(الشكل 3G). العينات دون المستوى الأمثل هي تلك التي لا توجه على هذا المحور، مثل تلك التي هي أفقية أو قطرية(الشكل 3H). هذه العينات سوف تنمو من إطار التصوير كما يمضي الفاصل الزمني ولا يمكن استخدامها لمزيد من التحليل (الشكل 4H-H''، J--J'').
الحصول على مجموعة بيانات الفاصل الزمني التي تناسب التحليل المستقبلي
الأجنة التي يتم حقنها بدقة، ورفعها، وشنت سيجعل لعينات ناجحة صورة confocal. ويبين الشكل 4 عينة مثالية للوقت: بل إن هناك مضان، والعينة هي 12 حصان. يتم تعيين z-كومة للتصوير بحيث الشريحة الأولى هو الظهري فقط إلى الحويزل البصري، في حين أن الشريحة الأخيرة يترك عدة شرائح خارج الحدود البطنية للحجشة البصرية 12 حصان (الشكل 4G-G''). هذا التحيز نحو الجانب البطني يوفر مساحة زائدة لنمو الأنسجة في الاتجاه البطني. هذه العوامل، عندما اجتمع، يؤدي إلى الفاصل الزمني الأمثل (الشكل 4I-أنا'''، فيلم 1). عينة دون المستوى الأمثل لديه فسيفساء أو مضان خافت، وقد وضعت بالفعل الماضي 12 حصان (عندما كأس البصرية morphogenesis جارية)، أو يتم وضعها بشكل سيئ في المكدس Z أو الإطار XY (الشكل 4H-H''). عندما لا يتم استيفاء هذه المعايير، فإن الفاصل الزمني لم يعد التقاط حجم كامل 3D من الأنسجة كما يتطور ولا يمكن استخدامها لمزيد من التحليل(الشكل 4J-J'').
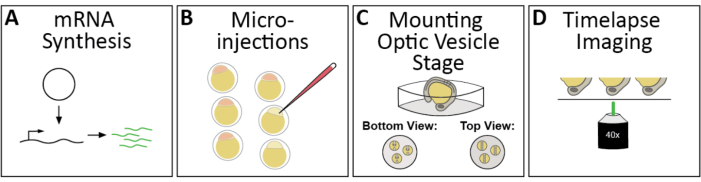
الشكل 1: سير العمل من التصوير الفاصل الزمني 4D من شكل كوب optic حمار وحشي. (A) لتسمية الهياكل دون الخلوية ذات الاهتمام الفلوري ، توليف mRNAs المتوج المناسب. (ب)ميكرونجيكت مرنا (ق) في أجنة حمار وحشي في مرحلة 1 خلية. (ج)يتم تركيب الأجنة الظهرية، أو الرأس لأسفل لمجهر كونفوجال مقلوب، في مرحلة الحويص البصري، ~ 11 ساعة بعد الإخصاب أو 3 مرحلة سوميت. (د)يمكن تصوير أجنة متعددة بشكل تسلسلي خلال جلسة تصوير واحدة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: دليل مرئي لتصغير أجنة حمار وحشي من خلية واحدة. (أ) العناصر التي يجب تضمينها في عدة الحقن (في اتجاه عقارب الساعة): صندوق متوسط الحجم يمكنه حمل المجموعة بأكملها بقفازات نتريل يمكن التخلص منها؛ طبق يحتوي على إبر حقن دقيق؛ ملقط; أ أكوت من النفط المعدني وقطع المربعات من البارافيلم; نصائح تحميل الميكرولو. الحمض النووي الريبي المخفف على الجليد; agarose حقن العفن; علامة; الأسطوانة / نقل ماصة؛ وP10 ماصة. (ب) إعداد الميكرويكشن: مجهر تشريحي بجوار محاقن بيكو متصل بمصدر غاز مضغوط خارجي. يتم إرفاق دواسة القدم وmicromanipulator إلى بيكو حاقن. وقد تم تجهيز micromanipulator مع حامل إبرة ووضعها في مكان فوق مرحلة المجهر. ج)قالب حقن agarose يحتوي على ستة صفوف من الأخادير مع زاوية 90 درجة على جانب واحد وزاوية 45 درجة على الجانب الآخر. (د) لوحة بيكو حاقن الأمامية. عرض الضغط يقرأ 7.8 PSI; ويمكن تعديل هذا مع مقبض الباب المسمى Pحقن. تحت, هناك pushbuttons لتحريك الضغط يدويا لحقن, لتغيير وقت الحقن, أو لمسح, ملء, أو عقد السائل في الإبرة. يتم تعيين وقت الحقن إلى 08 (ما يعادل 8 × 10 msec). يتم توصيل خرطوم الإخراج إلى Pخارج وتعلق على إبرة الحقن. يتم تعيين مفتاح مصدر مقياس الضغطلحقن P أثناء ضبط ضغط الحقن ، ويمكن تحويله إلىتوازن P لضبط الضغط القاعدي المطبق على الإبرة عندما لا يتم إجراء الحقن. منظمالرصيد P بجوار منظمحقن P. زر الطاقة مضاء للإشارة إلى تشغيل الجهاز. (E) يتم تزاوج حمار وحشي الكبار في خزانات تربية صغيرة تحتوي على خزان متداخلة مع قاع شبكة يفصل الأسماك الكبار من البيض المخصب ويسمح بسهولة جمع. يتم خفض مستوى المياه لمحاكاة ظروف المياه الضحلة ويتم إزالة فواصل الخزانات لبدء سلوك التزاوج. (F) لوحة مجهرية (إبرة) بكرة الأمامية: يحتوي على عرض الذي يظهر الشروط المحددة المستخدمة لسحب الإبر. إعداد الضغط هو P = 500، متبوعا بالتاريخ والوقت الأخيرين تحرير البرنامج، رقم البرنامج، HEAT = 546، PULL = 130، VEL = 70، والوقت = 90. (G) يتم إدخال واحد الشعيرات الدموية الزجاج في سحب micropipette (إبرة) وتأمينها في مكانها. كل سحب المبرمجة نتائج تشغيل في اثنين من الإبر مدبب طويلة (رؤوس الأسهم الحمراء). (H) يتم تحميل تخفيف الحمض النووي الريبي مرة أخرى في إبرة. فينول صبغ أحمر يسمح التصور السهل للحل. (I)بعد كسر غيض من الإبرة، يتم قياس بولوس من الجيش الملكي النيبالي باستخدام الشبكية العدسة على نطاق تشريح. لهذا المنظار المجسم، في 30x مجموع التكبير 6 علامات التجزئة يساوي حجم 1 nL. (J) يتم تحميل البيض المخصب في قالب حقن الآغروز ويتم توزيعها على طول أحواض القالب باستخدام ماصة الأسطوانة. (ك) يتم وضع قالب الحقن الذي يحتوي على أجنة مرحلة من خلية واحدة تحت المجهر ويتم حقن الأجنة بشكل تسلسلي. (L) يتم إدخال إبرة الحقن في كل جنين يستهدف الخلية الواحدة. (M) مرة واحدة في الخلية، يتم استخدام دواسة القدم لتحريك كمية منظم من الضغط والإفراج عن 1 nL من الحمض النووي الريبي في خلية الجنين (كما تصور من قبل فينول الأحمر). أشرطة المقياس: I = 0.1 مم؛ L, M = 0.5 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: دليل مرئي لتركيب الأجنة للتصوير. (أ) تركيب إعداد (من اليسار إلى اليمين): كتلة الحرارة المبرمجة إلى 42 درجة مئوية، وأنابيب التدفئة من الآجروز منخفضة الذوبان؛ ماصة الأسطوانة; زوج من ملقط; طبق مغلف بالأغاروز يحتوي على أجنة مهتبسة؛ وتشريح مجسم متصل بمصباح فلوري هاليد معدني. (B, B', B'') جنين 11 حصان حقن مع EGFP-CAAX مرنا و mCherry-H2A مرنا, يظهر تحت برايتفيلد, GFP مضان و mCherry مضان, على التوالي. (C, C ') ماصة بستر زجاجي تحتوي على الآغاروز وجنين يجلس في الطرف؛ C' هو عرض مكبرة. (D, D ') جنين واحد محمول في قطرة من الآغاروز منخفض الذوبان على طبق زجاجي القاع ، ينظر إليه من مرحلة المجهر ومن خلال العدس المجهر. (E, E ') 12 الأجنة التي شنت في قطرات الفردية من agarose منخفضة ذوبان على طبق الزجاج القاع, ينظر إليها على حد سواء من مرحلة المجهر ومن خلال العدس المجهر. (F,F',F',F'' '' يتم تراكب جميع الأجنة المثبتة بطبقة كاملة من الآجروز لملء الجزء السفلي من الطبق ، وينظر إليها من مرحلة المجهر ومن العدس المجهر هو مبين في مجال مشرق ؛ واو ' GFP مضان; وفلورسينس مشيري. (G)يتم تركيب عينة مثالية في 12 حصان بشكل دوري وموجهة عموديا بما يتماشى مع الساعة 12 و 6 مع كل من الحويصلات البصرية في نفس المستوى. (H)عينة دون المستوى الأمثل: على الرغم من أن الحويصلات الظهرية والبصرية المثبتة في مستوى مع بعضها البعض ، فإن هذه العينة موجهة على محور قطري وستنمو من حجم الإطار مع تقدم التطوير. (I)عينة دون المستوى الأمثل: هذه العينة هي أكثر من تدويرها وليس جبل الظهرية، ونتيجة لذلك، فإن الجزء الأمامي من الحويزل البصري لا يتم التقاطها في الفاصل الزمني. (J)عينة دون المستوى الأمثل: هذه العينة هي تحت استدارة وليس جبل الظهرية، ونتيجة لذلك لن يتم التقاط الجزء الخلفي من الحويصة البصرية في الفاصل الزمني. تشير الخطوط المنقطة إلى كل الحويكل البصري. أشرطة المقياس: B = 0.1 مم؛ D ' = 1.5 مم؛ E', F ' = 2.5 مم; G = 0.1 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
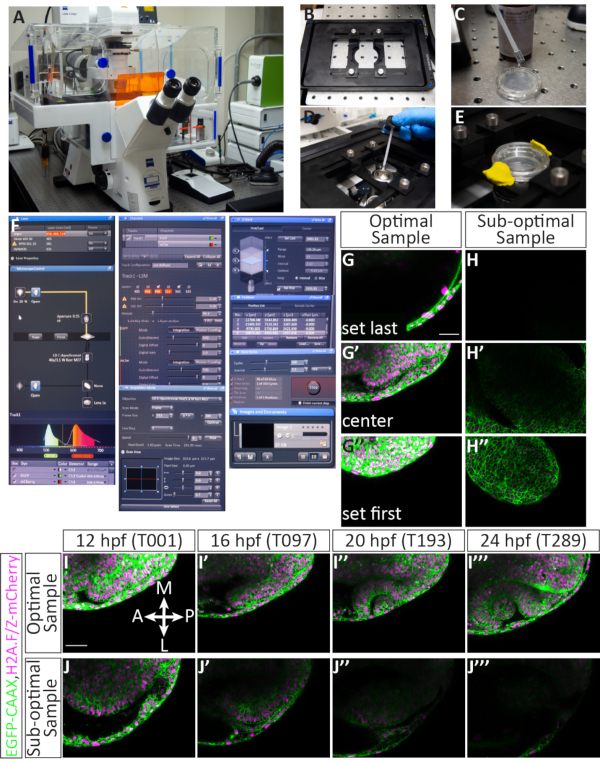
الشكل 4إعداد الفاصل الزمني متعددة موضع والنتائج المحتملة. (A) المجهر confocal المسح بالليزر. (B) بيزو Z-المرحلة إدراج. (C) الجزء السفلي من طبق قاع زجاجي يحتوي على أجنة مضمنة في الآغروز مغلفة في متوسط الغمر مطابقة لمؤشر الانكسار للمياه. (D) يتم وضع قطرة من الغمر المتوسطة على الهدف 40x W (مسافة عمل طويلة). (E) يتم الاحتفاظ الطبق في مكان مع إدراج المرحلة، يتم إضافة E3 على رأس طبقة agarose، ويتم تأمين الغطاء مع الطين النمذجة. (F) إعدادات برامج الاستحواذ: يتم تشغيل خطوط الليزر المطلوبة من القائمة المنسدلة. بالنسبة للأجنة التي يتم حقنها باستخدام EGFP-CAAX RNA و H2A-mCherry RNA، يتم تشغيل الليزر Argon وDPSS 561-10. تسليط الضوء الأحمر يشير إلى أن الليزر أرجون هو الاحماء. لتحديد موقع العينة على الهدف، يتم تشغيل الضوء المرسل من خلال لوحة التحكم بالمجهر. يتم تعيين كل من EGFP و mCherry إلى المسار 1 (للتصوير المتزامن) ويتم تعيين نطاق كل كاشف. هنا، يتم تعيين مجموعة EGFP إلى 494-545 نانومتر، ويتم تعيين نطاق mCherry إلى 598-679 نانومتر. تحت القنوات القائمة، يمكن تعيين طاقة الليزر. بعد أن يتم تسخين الليزر ، يمكن زيادة الطاقة حتى 5.0 ، ويمكن تعديل الكسب (الرئيسي). يتم تعيين الثقب في 60.2، وهو ما يعادل 1.63 وحدات متجدد الهواء أو 1.6 ميكرومتر القسم. تحت اقتناء القائمة ، يتم تعيين حجم الإطار إلى 512 × 384 ، وسرعة المسح الضوئي هو 9.0 ، في المتوسط ثنائي الاتجاه ، ويتم تعيين التكبير إلى 0.7. تحت Z-ستاك القائمة، يتم تعيين الموضع الأول والأخير في المحور Z أثناء كونفوجكال هو المسح الضوئي. يتم تعيين الفاصل الزمني (حجم الخطوة) إلى 2.1 ميكرومتر. في حين أن اختيار أول وآخر Z-الموقف، يتم الحفاظ على عدد قياسي من 63 شرائح عموما؛ وهذا يستوعب النمو العام للعين. يتم تحديد الخيار "استخدام بيزو". تحت مناصب القائمة، يتم سرد كل موضع محدد بما في ذلك عدد معين و س، ص، و Z الموقف. هناك أزرار إضافية للتحكم في عدد الأجنة (المواضع المنفصلة) للصورة، بما في ذلك إضافة أو تحديث أو إزالة. تحت سلسلة زمنية القائمة، يتم تعيين دورة إلى 300 (عدد من Z-المداخن التي سيتم الحصول عليها) ويتم تعيين الفاصل الزمني (خطوة الوقت) إلى 2.5 دقيقة. بمجرد الانتهاء من الإعدادات، يبدأ اكتساب الفاصل الزمني عن طريق الضغط على البداية. سوف يعرض البرنامج شريحة المكدس Z والدورة والموضع الذي يتم مسحه ضوئيا حاليا. عند اكتمال الفاصل الزمني، يتم حفظ الملف بالنقر فوق رمز القرص المرن في الصور والمستندات خشب. (G-J) أغشية الخلايا (green) وصفت مع EGFP-CAAX ونوى الخلية (الكروماتين، magenta) وصفت مع H2A-mCherry RNAs. (G,G',G'') مثال على تعيين شريحة Z الأولى والأخيرة لعينة محملة بشكل أمثل. أول Z-شريحة (في الجانب الظهري) يأتي على حساب ectoderm الظهرية، في حين أن آخر Z-شريحة (في الجانب البطني) هو أقل بكثير من الحويزل البصري، لاستيعاب نموها في الاتجاه البطني. (H,H',H'') مثال على تعيين شريحة Z الأولى والأخيرة من عينة دون المستوى الأمثل. العينة لديها مضان mCherry ضعيفة ويتم تركيبها قطريا، بحيث كوب البصرية النامية من غير المرجح أن تبقى في الإطار لمدة الفاصل الزمني. (أنا، أنا، أنا، أنا') مثال على الفاصل الزمني من عينة مثالية. يتم أخذ صور شريحة واحدة من منتصف المكدس Z من حجم شريحة 63 بأكمله في 4 نقاط زمنية (قيمة T). Br, الدماغ; NR, الشبكية العصبية; RPE, ظهارة الشبكية المصطبغة; لو، عدسة. (J',J',J', J'') مثال على الفاصل الزمني من عينة دون المستوى الأمثل. في هذه الحالة، انتقلت العينة من الطائرة Z وتم التقاط جزء مائل فقط من الكأس البصري الأمامي. أشرطة المقياس: G، I = 50 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الفيلم 1: الفاصل الزمني للكوب البصري مورفوجينيسيس في جنين من النوع البري الأمثل. منظر ظهري لجنين من النوع البري يحمل اسم EGFP-CAAX (أغشية البلازما والأخضر)وH2A. F/Z-mCherry (كروماتين، أرجواني). الفاصل الزمني هو من ~ 12-24 حصان ويحتوي على مقطع confocal واحد من مجموعة بيانات 4D بأكملها. الفاصل الزمني هو 2.5 دقيقة بين z-stacks ويظهر في 22.5 إطار في الثانية. الرجاء الضغط هنا لتحميل هذا الفيلم.
Discussion
هنا، ونحن نصف بروتوكول لوضع العلامات في توتو والتصوير الفاصل الزمني 4D من مورفوجينيسيس كأس البصرية. نحن خطوة من خلال عملية توليد توج الحمض النووي الريبي ترميز البروتينات الفلورية لوضع علامة على مقصورات فرعية مختلفة; حقن حمار وحشي 1-خلية الأجنة; تضمين 11 جنين hpf في agarose للتصوير متعدد المضاعفات؛ والحصول على مجموعات بيانات رباعية الأبعاد لأجنة متعددة طوال مدة تكوين الكوب البصري (12-24 حصان).
يمكن الإجابة على عدد لا يحصى من الأسئلة من خلال مجموعات البيانات الكثيفة المعلومات هذه. يمكن تصور البيانات 4D وتحليلها كميا في مجموعة متنوعة من الطرق. على الرغم من أن خارج نطاق هذا البروتوكول، ونحن تشمل هنا بعض أهدافنا والتطبيقات القياسية كمثال على أنواع الأشياء التي يمكن تحقيقها. وبطبيعة الحال، يجري باستمرار تطوير أساليب تحليل الصور الكمية، ويمكن استخدام الأدوات المتاحة تجاريا والمصطنة خصيصا على حد سواء. وإذا لم يستخدم المرء هذه الأساليب من قبل، فينبغي أن يكون مستعدا للعمل من خلال بعض التحسين لضمان أن تكون مجموعات البيانات المكتسبة كافية لنهج التحليل الكمي الذي يختاره.
يمكن أن يكون تصور مجموعات البيانات ذات الأبعاد الرابعة وتقييمها كميا أمرا صعبا ، نظرا لحجم الملفات. يمكن استخدام برنامج الاستحواذ لفصل مجموعات البيانات إلى أجنة فردية ، ويمكن استخدام ImageJ / Fiji لتحويل الملفات الكونفوجال من الأشكال التجارية إلى أكوام tif قياسية أكثر ، حيث يتم حفظ كل نقطة زمنية كملف منفصل. سيؤدي ذلك إلى تقليل أحجام الملفات وتوحيد تنسيقات الملفات. يمكن تجميع المقاطع البصرية الفردية من كل نقطة زمنية لفترة زمنية 2D (XY) باستخدام ImageJ / Fiji ، مما يتيح التصور السريع 2D وتقييم البيانات. الفيلم 1 هو مثال على هذا على وجه التحديد: مقطع بصري واحد مع مرور الوقت تجميعها فترة زمنية للعينة الأمثل هو مبين في الشكل 4I-I''. من هناك ، لتصور 3D و 4D ، ونحن عادة استخدام FluoRender35،36، وهو متاح بحرية ولكن لديه متطلبات محددة بطاقة الرسومات. باستخدام FluoRender ، يمكن للمرء تدوير البيانات المقدمة ثلاثية الأبعاد في أي محور ، وتصور مجموعة البيانات في 4D بمرور الوقت ، وتوليد cutaways في أي مستوى ، وحفظ التناوب والتصورات كفيلم أو سلسلة من الصور tif.
وفيما يتعلق بالتحليل الكمي، هناك العديد من الأسئلة التي يتعين الإجابة عليها. لقد قمنا بتطوير برامج داخلية لمساعدة أهدافنا المحددة الخاصة لفهم سلوكيات الخلية الكامنة وراء تكوين الكوب البصري. برنامجنا، LongTracker، يستخدم إشارة النووية كوكيل لموقف لتتبع الخلايا13. مع هذه البيانات، يمكننا تحديد متى وأين وكيف تتحرك الخلايا. مدى سرعة ومدى تحرك الخلايا؛ ومدى تكرار انقسام الخلايا. بالإضافة إلى برامجنا الخاصة، هناك العديد من الخيارات المتاحة تجاريا والمصناة خصيصا لتتبع الخلايا 4D. كما قمنا بتطوير برنامج LongAxis لتنفيذ تجزئة الخلية وتحديد شكل الخلية وتنظيمها داخل شبكية العين العصبية37. ومع ذلك، فإن مجموعات البيانات التي يتم إدخالها في LongAxis هي مداخن Z واحدة، يتم التقاطها بدقة عالية. كان التحدي المستمر هو توليد مجموعات بيانات الفاصل الزمني بدقة عالية بما يكفي بحيث يمكن تقسيم الخلايا بثقة واستقراء مورفولوجيا لها. بديل واحد هو الفسيفساء (متفرق) وضع العلامات باستخدام الفلوروفورية القابلة للعكس الضوئي مثل Kaede للتصور المباشر لشكل الخلية ، كما قمنا نحن وآخرون في العينالنامية 8،11،13. هذا يبسط مشكلة تقسيم الخلية ، ويمكن بسهولة تحديد شكل الخلية وحجمها من خلال تقديم ثلاثي الأبعاد في FluoRender.
تم تحسين كل خطوة من هذا البروتوكول خصيصا لأغراضنا. خصوصية هذا البروتوكول يؤدي إلى عدة قيود: البروتوكول، كما هو مكتوب، ليست الأمثل لتصوير جوانب أخرى من تطور العين حمار وحشي (مثل تكوين الشبكية العصبي)، وهياكل العين الأخرى، ومراحل النمو الأخرى، أو المقصورات دون الخلوية الأخرى. تم تصميم اتجاه التضمين وسرعة التصوير والتسميات للسماح لنا بالإجابة على أسئلتنا البيولوجية. من أجل تصوير تكوين الشبكية العصبي ، على سبيل المثال ، قد لا يسمح التوجه الظهري للجنين كما هو موضح هنا بتصور ميزات محددة ذات أهمية ، وقد لا تكون سرعة التصوير مناسبة. ويمكن تكييف العديد من جوانب البروتوكول وتعديلها لتلبية مجموعة متنوعة من الاحتياجات، تبعا لمصالح وأهداف معينة. أولا، استخدام حقن الحمض النووي الريبي يجعل عملية وضع العلامات مرنة للغاية. يمكن استخدام تركيبات دمج البروتين الفلوري لتسمية الهياكل دون الخلوية ذات الاهتمام ، ويمكن تنوع كمية حقن الحمض النووي الريبي لتحسين وضع العلامات. استنادا إلى عملنا مع الفلوروفوري Kaede القابلة للعكس الضوئي، يبدو أن حقن الحمض النووي الريبي تدعم دفعة من الترجمة التي انتهت بمقدار 12 حصان11،13. مستويات عالية من التعبير عن البروتين الفلوري من حقن الحمض النووي الريبي يمكن مكافحة photobleaching، ولكن مثل هذا النهج لا يدعم التعبير المستمر عن التسمية الفلورية من الاهتمام. إذا كان التعبير المستدام ضروريا ، كما هو الحال عند تصوير الأجنة في مراحل لاحقة ، فإن الخطوط المعدلة وراثيا هي خيار ، وبناء خطوط جديدة في حمار وحشي هوواضح 24.
بعد ذلك، يمكن تكييف البروتوكول للمراحل اللاحقة من التطوير. لأن الصباغ قد يعوق التصوير في مراحل لاحقة، يمكن علاج الأجنة مع الفينيلثيوريا (PTU) لمنع تكوين الصباغ، أو يمكن استخدام المسوخ الوراثية لتخليق الصباغ. لمنع ارتعاش الجنين، يمكن إضافة tricaine إلى حلول تراكب وسائط الآغاروز والجنين، ويمكن تعديل النسبة المئوية للأغاروز حسب الضرورة. كما ينمو العين, قد يكون من الضروري تغيير اتجاه تصاعد; هنا، ونحن جبل الأجنة الظهرية، ولكن في مراحل لاحقة، قد يكون أكثر منطقية لجبل أفقيا أو الأمامي، اعتمادا على هيكل الفائدة. لأن عمليات مختلفة تحدث على نطاقات مختلفة المكانية والزمنية ، يمكن للمرء أيضا تحسين خطوة Z وخطوة الوقت من اكتساب الصورة. هذه الميزات يمكن حقا فقط أن تحدد تجريبيا لاحتياجات كل مختبر.
وأخيرا، تم تطوير هذا البروتوكول خصيصا لمجهر كونفوجكال المسح بالليزر، مع الأجنة جزءا لا يتجزأ من نسبة عالية نسبيا من الآغروز في مرحلة مبكرة من نمو العين. إذا كان أحد التصوير في أوقات مختلفة أو مواقع مختلفة أثناء تطوير العين، وهذا البروتوكول سوف تحتاج إلى تكييفها لعملية الاهتمام. العديد من نهج التصوير المختلفة ممكنة حاليا ، مع المزيد من التطوير من قبل المهندسين البصريين. كل نهج يجلب مجموعة خاصة به من التحديات، من طرق مختلفة لتضمين وتركيب الأجنة للتصوير، إلى أحجام الملفات المختلفة والأشكال. نحن نحدد الاعتبارات في المقدمة لتوجيه عملية التحسين ، حيث يتم موازنة الدقة المكانية والزمنية القصوى مع photobleaching ، والسمية الضوئية ، وأحجام الملفات الهائلة. نأمل أن تساعد هذه المبادئ العامة ، بالإضافة إلى المعلومات العملية المذكورة أعلاه ، الآخرين في إنشاء نهج التصوير الفاصل الزمني لدراسة العديد من الأسئلة المفتوحة في تطوير العين.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
ونحن ممتنون لأعضاء مختبر كوان السابقين والحاليين على العمل على نهج الفاصل الزمني ومناقشات هذا البروتوكول. وقد تم دعم هذا العمل من قبل المعاهد القومية للصحة (R01 EY025378 وR01 EY025780 إلى KMK؛ F31 EY030758 إلى SL; و T32 GM007464 إلى لجنة الهدنة العسكرية).
Materials
| Name | Company | Catalog Number | Comments |
| Delta TPG Dish 0.17mm clear | Bioptechs | 0420041500C | coverglass bottom for optical compatibility |
| Disposable Pasteur Pipettes | VWR | 14672-608 | overall length 14.6 cm (53/4") |
| Dumont #5, #55, or #5SF Forceps | Fine Science Tools | 11254-20 | For style #5: straight tip, 0.05 x 0.01 mm tip, inox, 11 cm long |
| Flaming/Brown Micropipette Puller | Sutter | P-97 | |
| Immersol W | Carl Zeiss Microscopy | 4449690000000 | immersion fluid for water-emission objectives, halogen-free, low fluorescence |
| Microinjection Mold | Adaptive Science Tools | TU-1 | Six ramps, one 90 degree and one 45 degree beveled side. |
| Microloader Tips | Eppendorf | 930001007 | Microloader, tip for filling glass microcapillaries, 0.5 – 20 µL |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | contains SP6 Enzyme Mix, 10X Reaction Buffer, 2XNTP⁄CAP Solution, GTP Solution, pTRI-Xef, TURBO DNase, Ammonium Acetate Stop Solution, Lithium Chloride Precipitation Solution, and Gel Loading Buffer and are all stored at –20°C. Nuclease-free Water may be stored at any temperature. |
| Nikon SMZ645 Stereo Microscope | Nikon | SMZ645 | used for injecting embryos (see Fig. 2B) |
| NotI-HF enzyme | NEB | R3189S | comes with Gel Loading Dye, Purple (6X) |
| NuSieve GTG Agarose | Lonza | 50081 | fine resolution, low melt agarose |
| Objective LD "C-Apochromat" 40x/1.1 W Korr M27 | Carl Zeiss Microscopy | 421867-9970-000 | |
| Olympus SZX16 Stereo Microscope | Olympus | SZX2-ZB16 | used for screening, embedding embryos (see Fig. 3A) |
| Phenol red solution | Sigma-Aldrich | P0290 | 0.5% in DPBS, sterile filtered, endotoxin tested, cell culture tested |
| Pico-liter Microinjector | Harvard Apparatus | PLI-100 | Femtoliter to microliter injections; digital readouts for injection count, time, and pressure; contains 5 pressures including inject, balance, clear, fill, and hold |
| Pipette Pump Pipettor | SP Bel-Art | F37898 | fits a disposable pasteur pipette, contains thumbwheel on side for aspirating or dispensing and plunger for quick emptying |
| Premium Thin Wall Borosilicate Glass Capillaries | Warner Instruments | G100T-4 | 1.0 x 0.78 mm |
| QIAquick PCR Purification Kit | Qiagen | 28106 | contains QIAquick Spin Columns, Buffers, Collection Tubes (2 ml) |
| RNase-free H2O | Invitrogen | AM9906 | DNase-Free, Molecular Biology Grade, RNase-Free |
| RNeasy Mini Kit | Qiagen | 74104 | contains RNeasy Mini Spin Columns, Collection Tubes (1.5 ml and 2 ml), RNase-free Reagents and Buffers |
| Stage Attachment Z PIEZO WSB 500 | Carl Zeiss Microscopy | 432339-9000-000 | |
| Stage Insert Z PIEZO WSB Universal | Carl Zeiss Microscopy | 432339-9030-000 | |
| Zeiss LSM 880 with Airyscan | Carl Zeiss Microscopy | N/A | inverted Axio Observer microscope |
| Zen Black 2.3 SP1 software | Carl Zeiss Microscopy | N/A | Zeiss Efficient Navigation (ZEN) controls all light microscope systems from Zeiss |
References
- Adler, R., Canto-Soler, M. V. Molecular mechanisms of optic vesicle development: complexities, ambiguities and controversies. Developmental Biology. 305 (1), 1-13 (2007).
- Chow, R. L., Lang, R. A. Early eye development in vertebrates. Annual Review of Cell and Developmental Biology. 17, 255-296 (2001).
- Fuhrmann, S. Eye morphogenesis and patterning of the optic vesicle. Current Topics in Developmental Biology. 93, 61-84 (2010).
- Martinez-Morales, J. R., Wittbrodt, J. Shaping the vertebrate eye. Current Opinion in Genetics and Development. 19 (5), 511-517 (2009).
- Yang, X. J. Roles of cell-extrinsic growth factors in vertebrate eye pattern formation and retinogenesis. Seminars in Cell & Developmental Biology. 15 (1), 91-103 (2004).
- Bogdanovic, O., et al. Numb/Numbl-Opo antagonism controls retinal epithelium morphogenesis by regulating integrin endocytosis. Developmental Cell. 23 (4), 782-795 (2012).
- Bryan, C. D., Casey, M. A., Pfeiffer, R. L., Jones, B. W., Kwan, K. M. Optic cup morphogenesis requires neural crest-mediated basement membrane assembly. Development. 147 (4), (2020).
- Bryan, C. D., Chien, C. B., Kwan, K. M. Loss of laminin alpha 1 results in multiple structural defects and divergent effects on adhesion during vertebrate optic cup morphogenesis. Developmental Biology. 416 (2), 324-337 (2016).
- Cavodeassi, F., Ivanovitch, K., Wilson, S. W. Eph/Ephrin signalling maintains eye field segregation from adjacent neural plate territories during forebrain morphogenesis. Development. 140 (20), 4193-4202 (2013).
- England, S. J., Blanchard, G. B., Mahadevan, L., Adams, R. J. A dynamic fate map of the forebrain shows how vertebrate eyes form and explains two causes of cyclopia. Development. 133 (23), 4613-4617 (2006).
- Gordon, H. B., et al. Hedgehog signaling regulates cell motility and optic fissure and stalk formation during vertebrate eye morphogenesis. Development. 145 (22), (2018).
- Ivanovitch, K., Cavodeassi, F., Wilson, S. W. Precocious acquisition of neuroepithelial character in the eye field underlies the onset of eye morphogenesis. Developmental Cell. 27 (3), 293-305 (2013).
- Kwan, K. M., et al. A complex choreography of cell movements shapes the vertebrate eye. Development. 139 (2), 359-372 (2012).
- Martinez-Morales, J. R., et al. Ojoplano-mediated basal constriction is essential for optic cup morphogenesis. Development. 136 (13), 2165-2175 (2009).
- Miesfeld, J. B., et al. Yap and Taz regulate retinal pigment epithelial cell fate. Development. 142 (17), 3021-3032 (2015).
- Nicolas-Perez, M., et al. Analysis of cellular behavior and cytoskeletal dynamics reveal a constriction mechanism driving optic cup morphogenesis. eLife. 5, (2016).
- Picker, A., et al. Dynamic coupling of pattern formation and morphogenesis in the developing vertebrate retina. PLoS Biology. 7 (10), e1000214 (2009).
- Rembold, M., Loosli, F., Adams, R. J., Wittbrodt, J. Individual cell migration serves as the driving force for optic vesicle evagination. Science. 313 (5790), 1130-1134 (2006).
- Sidhaye, J., Norden, C. Concerted action of neuroepithelial basal shrinkage and active epithelial migration ensures efficient optic cup morphogenesis. eLife. 6, (2017).
- Driever, W., et al. A genetic screen for mutations affecting embryogenesis in zebrafish. Development. 123, 37-46 (1996).
- Haffter, P., et al. The identification of genes with unique and essential functions in the development of the zebrafish, Danio rerio. Development. 123, 1-36 (1996).
- Nusslein-Volhard, C. The zebrafish issue of Development. Development. 139 (22), 4099-4103 (2012).
- Hoshijima, K., et al. Highly efficient CRISPR-Cas9-based methods for generating deletion mutations and F0 embryos that lack gene function in zebrafish. Developmental Cell. 51 (5), 645-657 (2019).
- Kwan, K. M., et al. The Tol2kit: a multisite gateway-based construction kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).
- Almeida, A. D., et al. Spectrum of Fates: a new approach to the study of the developing zebrafish retina. Development. 141 (9), 1971-1980 (2014).
- Baye, L. M., Link, B. A. Interkinetic nuclear migration and the selection of neurogenic cell divisions during vertebrate retinogenesis. The Journal of Neuroscience. 27 (38), 10143-10152 (2007).
- Clark, B. S., et al. Loss of Llgl1 in retinal neuroepithelia reveals links between apical domain size, Notch activity and neurogenesis. Development. 139 (9), 1599-1610 (2012).
- Das, T., Payer, B., Cayouette, M., Harris, W. A. In vivo time-lapse imaging of cell divisions during neurogenesis in the developing zebrafish retina. Neuron. 37 (4), 597-609 (2003).
- Kay, J. N., et al. Transient requirement for ganglion cells during assembly of retinal synaptic layers. Development. 131 (6), 1331-1342 (2004).
- Norden, C., Young, S., Link, B. A., Harris, W. A. Actomyosin is the main driver of interkinetic nuclear migration in the retina. Cell. 138 (6), 1195-1208 (2009).
- Suzuki, S. C., et al. Cone photoreceptor types in zebrafish are generated by symmetric terminal divisions of dedicated precursors. Proceedings of the National Academy of Sciences of the United States of America. 110 (37), 15109-15114 (2013).
- Wan, Y., et al. The ciliary marginal zone of the zebrafish retina: clonal and time-lapse analysis of a continuously growing tissue. Development. 143 (7), 1099-1107 (2016).
- Yoshimatsu, T., et al. Presynaptic partner selection during retinal circuit reassembly varies with timing of neuronal regeneration in vivo. Nature Communications. 7, 10590 (2016).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Wan, Y., Otsuna, H., Chien, C. B., Hansen, C. An interactive visualization tool for multi-channel confocal microscopy data in neurobiology research. IEEE Transactions on Visualization and Computer Graphics. 15 (6), 1489-1496 (2009).
- Wan, Y., Otsuna, H., Chien, C. B., Hansen, C. FluoRender: an application of 2D image space methods for 3D and 4D confocal microscopy data visualization in neurobiology research. IEEE Pacific Visualization Symposium. , 201-208 (2012).
- Carney, K. R., Bryan, C. D., Gordon, H. B., Kwan, K. M. LongAxis: a MATLAB-based program for 3D quantitative analysis of epithelial cell shape and orientation. Developmental Biology. 458 (1), 1-11 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved