Method Article
הדמיה תלת מימדית של מורפוגנזה של גביע זברה אופטי
In This Article
Summary
פרוטוקול זה מתאר גישה לתיוג תותוג טומוטו והדמיה רב ממדית של התפתחות עיניים מוקדמות של דגי זברה. אנו מתארים תיוג, הטמעה והדמיה בארבעה ממדים (4D) באמצעות מיקרוסקופיה קונפוקלית לסריקת לייזר, ושיקולים למיטוב רכישת ערכות נתונים לניתוח מנגנונים של מורפוגנזה של אופטית.
Abstract
פונקציית מערכת הראייה דורשת הקמת מבנים מדויקים של רקמות ואיברים. בעין החולייתית, פגמים מבניים הם סיבה נפוצה לליקוי ראייה, אך מנגנונים של מורפוגנזה בעיניים עדיין מובנים היטב. הארגון הבסיסי של העין העוברית נשמר בכל בעלי החוליות, ולכן הדמיה חיה של עוברים דגי זברה הפכה לגישה רבת עוצמה להתבוננות ישירה בהתפתחות העין בזמן אמת בתנאים נורמליים ופתולוגיים. תהליכי תאים דינמיים כולל תנועות, מורפורוגיות, אינטראקציות, חלוקה ומוות יכולים להיות חזותיים בעובר. פיתחנו שיטות לתיוג אחיד של מבנים תת-תאיים ומיקרוסקופיה קונפוקלית של timelapse של התפתחות עיניים מוקדמת בדגי זברה. פרוטוקול זה מתאר את השיטה ליצירת mRNA כתרים להזרקה לעובר דג זברה בן תא אחד, הרכבת עוברים בשלב צעיפים אופטיים (~ 12 שעות לאחר ההפריה, HPF), וביצוע הדמיה רב-ממדית של מורפוגנזה של אופטית על מיקרוסקופ קונפוקלי סורק לייזר, כך שערכות נתונים מרובות נרכשות ברצף באותה הפעלת הדמיה. גישה כזו מניבה נתונים שניתן להשתמש בהם למגוון מטרות, כולל מעקב אחר תאים, מדידות נפח, עיבוד תלת-ממדי (תלת-ממד) והדמיה חזותית. הגישות שלנו מאפשרות לנו לאתר במדויק את המנגנונים התאיים והמולקולריים המניעים את פיתוח הכוס האופטית, הן בסוג הפרא והן בתנאי מוטציה גנטית. שיטות אלה יכולות להיות מועסקות ישירות על ידי קבוצות אחרות או מותאמות לדמיין היבטים רבים נוספים של התפתחות העין דג זברה.
Introduction
התפתחות העין החולייתית מתחילה עם הופעתה, או התחמקות, של שלפוחיות אופטיות מן נוירופיליום המוח הפוטנציאלי. שלל אופטי לאחר מכן לעבור סדרה של שינויים בצורת רקמות, מוארך ולאחר מכן פולשניות כדי ליצור את הכוס האופטית. בכוס האופטית, הרשתית העצבית ואפיתל הפיגמנט ברשתית, שניהם נגזרים מהנוירו-אפיתליום, עוטפים את העדשה המתהווה, הנגזרת מהקטודרם של פני השטח. התהליך כולו דורש סדרה מורכבת של תנועות תאים ורקמות ואיתות מולקולרי, המתואם בין נוירופיליום, ectoderm, ואוכלוסיות תאים מזנכימליים. אירועים ראשוניים אלה קובעים את המבנה הבסיסי של העין, וצעדים מאוחרים יותר של התפתחות העין, כולל היווצרות קשתית וקורנית, הם פירוט על ארגון מוקדם. הפרעות בהתפתחות עיניים מוקדמת ומורפוגנזה עומדות בבסיס תנאי ליקוי ראייה רבים בבני אדם, כולל אנופותלמיה, מיקרופתלמיה וקולובומה. פתיחת המנגנונים התאיים והמולקולריים השולטים במורפוגנזה של אופטית חיונית להבנת התפתחות מערכת הראייה והתנאים הפתולוגיים הנובעים מכך שתהליכים אלה משתהים.
ההבנה שלנו של התפתחות העין החולייתית ומורפוגנזה צמחה מכמות עצומה של עבודה המשתרעת על פני מחקרים היסטולוגיים קלאסיים לגישות עובריות וגנטיות במגוון אורגניזמים מודל כולל עכבר, אפרוח, צפרדע, ודגים1,2,3,4,5. בעוד גוף עבודה זה הקים מנגנונים מולקולריים המסדירים את התפתחות העין המוקדמת, מבחינה היסטורית קיימת הבנה לקויה של המורפוגנזה של העין: הופעתו של מבנה תלת-ממד שלה. עיקר הממצאים הללו הגיעו מעוברים חלקי הדמיה בנקודות זמן נפרדות. אמנם זה מספיק כדי לספק תצוגה של מורפולוגיה של רקמות ב 2 ממדים, מורפוגנזה הוא דינמי, תהליך 3D. על מנת לקבוע כיצד צורת הרקמה משתנה ב -3 ממדים לאורך זמן, כיצד תאים בודדים מתנהגים, וכיצד התנהגויות אלה תורמות לשינויים בצורת רקמה תלת-ממדית, יש צורך בגישות שונות.
פתרון אחד לטיפול בפער משמעותי זה בידע הוא הדמיה חיה, המאפשרת תצפית דינמית של תאים ורקמות בזמן אמת עם עיצוב האיבר. למרבה הצער, זה לא אפשרי בקלות באורגניזמים מודל רבים בשל האילוצים של התפתחות עוברית. לדוגמה, עוברים עכבר וגוזל (המתפתחים ברחם או בתוך קליפת ביצה) אינם נגישים בקלות, ועוברים חיים רבים אינם שקופים אופטית, מה שגורם לפיזור אור משמעותי ומגביל את העומק שאליו ניתן לרכוש תמונות. דגי זברה, עם התפתחות חיצונית ועוברים שקופים, מספקים הזדמנות ייחודית לבצע הדמיה חיה של מורפוגנזה בעיניים6,7,8,9,10,11,12,13,14,15,16,17,18,19. קווים מהונדסים ומוטנטים בשפע זמינים גם כן, כמו גם כלים ליצירת טרנסגנים ומוטנטים חדשים20,21,22,23,24. יתר על כן, מורפוגנזה אופטית מתרחשת במהירות דג זברה, על פני מסגרת זמן של 12 שעות (12-24 שעות לאחר ההפריה, HPF), מה שהופך את ההדמיה של התהליך כולו ריאלית.
מאמצי ההדמיה החיה הואצו על ידי התרחבות ואופטימיזציה של משפחת החלבונים הפלואורסצנטיים, המאפשרים תיוג חיוני מקודד גנטית של מבנים תת-תאיים, כמו גם שיפורים וחידושים בשיטות מיקרוסקופיה. הפרוטוקול המתואר כאן משתמש במיקרוסקופיה קונפוקלית לסריקת לייזר, ולא בגישות עכשוויות אחרות להדמיית עוברי דגי זברה, כולל מיקרוסקופיה קונפוקלית של דיסק ספינינג, מיקרוסקופיה סלקטיבית של תאורת מטוס (SPIM וגרסאותיה), ושיטות מיקרוסקופיות מיוחדות אחרות. עבור עין דג הזברה המתפתחת, מצאנו כי מיקרוסקופיה קונפוקלית דיסק ספינינג לא היה מספיק להדמיה עמוקה יותר ברקמה. למרות ש-SPIM מתגאה בזמן הדמיה מהיר ביותר ונעשה בשימוש נרחב יותר, הטיפול ערכות הנתונים הגדולות להדמיה וניתוח נותר אתגר. לעומת זאת, מיקרוסקופיה קונפוקלית לסריקת לייזר נגישה בקלות, במיוחד עבור אנשים חסרי מומחיות בהרכבת חומרה אופטית. אנו מקווים כי הזמינות הרחבה של מיקרוסקופיה קונפוקלית סריקת לייזר תהפוך את הפרוטוקול שלנו שימושי עבור מעבדות רבות.
כאן, אנו מתארים את השיטה שלנו ללכידת ערכות נתונים 4D של מורפוגנזה אופטית, באמצעות תיוג טוטו של העובר עבור ממברנות וכרומטין, ומיקרוסקופ קונפוקלי סריקת לייזר לרכישת תמונה (סכמטי באיור 1). החלבונים הפלואורסצנטיים המשמשים כאן (EGFP-CAAX ו- H2A). F/Z-mCherry) נבחרו לספק תיוג רקמות ברזולוציה של תא בודד. אנו משתמשים בערכות נתונים שנוצרו באמצעות פרוטוקול זה עבור מגוון פונקציות ניתוח תמונה ופריטים חזותיים. פרוטוקול זה יכול להיות מותאם בקלות אם מבנים תת-תאיים אחרים רצויים. תיוג קרום פלזמה נבחר להדמיה של צורת התא: אנו משתמשים EGFP-CAAX, שבו 21 חומצות האמינו האחרונות של H-ras, המשמשות כרצף אות פרנילציה, מותכות ל- C-terminus של EGFP13. חלבונים פלואורסצנטיים ממוקדים אחרים של קרום פלזמה (למשל, היתוך טרנס-מברן או מיריסטוילציה) צפויים לעבוד באותה מידה. כדי לסמן גרעינים, בחרנו H2A. F / Z-mCherry, שבו mcherry מותך חלבון histone13. פעולה זו מבטיחה כי חלוקת התא, כולל כיוון ציר מיטוטי, הוא הדמיה בקלות.
עם כל גישה של הדמיה חיה, יש לשקול פשרות בין הגברת מהירות ההדמיה תוך מקסום יחס האות לרעש, רזולוציה צירית ושימור מדגם. מיטבנו את השיטות שלנו כדי למקסם את איכות התמונה ואת מספר העוברים שניתן לדמיין בריצה אחת. לעתים קרובות, המטרה היא לדמיין מורפוגנזה אופטית בעובר מוטנטי הומוזיגוס, אשר עשוי להיות פנוטיפי להבחין מן הסוג הפראי בתחילת מורפוגנזה אופטית וצאצאים של פולש הטרוזיגוס (25% מהעוברים הם הסוג הרצוי). על ידי אופטימיזציה, ולאחר מכן רכישת תמונה multiplexing, יש סבירות מוגברת של לכידת קבוצת נתונים של עובר מוטציה הומוזיגוס.
רזולוציית זמן, או התדירות שבה נרכשים נתוני נפח (ערימות Z), היא היבט מרכזי של הדמיית timelapse. בהתאם למטרה עבור ערכות נתונים כאלה, קיימות דרישות שונות למהירות. בתחילה פותח פרוטוקול זה למעקב ידני אחר תאי 4D. מעקב אחר תאים בודדים בתוך רקמה המסומנת באופן אחיד דורש רזולוציה טמפורלית גבוהה מספיק כדי לספק ביטחון כי כל תא אחד נמצא במעקב רציף לאורך זמן. מצאנו כי Z-ערימות של מורפוגנזה דגי זברה אופטיים חייבים להיות נרכשים לפחות כל 3.1 דקות מעל 12 שעות; כאן, יש לנו אופטימיזציה הרכישה שלנו על מיקרוסקופ קונפוקלי סריקת לייזר כך שנוכל לרכוש Z-ערימות של 4-5 עוברים כל 2.5 דקות.
יצירת גודל שלב Z הייתה שלב מכריע באופטימיזציה של הפרוטוקול: עבור עיבוד ופריטים חזותיים תלת-ממדיים, נתונים איזוטרופיים הם אידיאליים, שבהם גודל שלב Z שווה לממד הפיקסלים XY. במציאות, קשה מאוד להשיג נתונים כאלה timelapse עם דגימות חיות, בהתחשב באילוצים עם זמן הדמיה והלבנה. לכן, קביעת גודל Z-step נאות חשובה לצרכי העיבוד וההדמיה של הניסוי, ובאופן ספציפי, מה יחס X:Y:Z voxel נדרש כדי למקסם את המידע צירי תוך שמירה על מהירות ומניעת הלבנת תמונות. עבור פרוטוקול זה, יחס voxel שנקבע היה 1:1:3.5 (0.6 מיקרומטר x 0.6 מיקרומטר x 2.1 מיקרומטר Z-צעד גודל באמצעות 40x מרחק עבודה ארוך טבילת מים מטרה). בעת רכישת עומק Z של 130-140 מיקרומטר, זה מניב נתוני נפח עם רזולוציה זמנית מתאימה והלבנת פוטו קטן.
כפי שנדון לעיל, פרוטוקול זה הוא ספציפי עבור הדמיה 4D של מורפוגנזה אופטית דג זברה, באמצעות עוברים טוטו שכותרתו עבור קרום פלזמה כרומטין, ומיקרוסקופ קונפוקלי סריקת לייזר. הפרוטוקול שלהלן ניתן להתאים בקלות עבור מגוון של ניסויים וצרכים. ראשית, ביחס למבנים תת-תאיים, ניתן לדמיין כל מבנה שעבורו קיים סמן תא חי. לאחר מכן, למרות שההתמקדות כאן היא אך ורק על מורפוגנזה אופטית, הדמיית timelapse ניתן להתאים לשלבים אחרים של התפתחות העין, למשל, neurogenesis25,26,27,28,29,30,31,32,33. להדמיה בשלב מאוחר יותר, ייתכן שיהיה צורך לשקול אימוביליזציה של העובר (כאשר פעילות השרירים הספונטנית מתחילה בסביבות 24 כ"ס), פיגמנטציה (שמתחילה להגיח סביב 24 כ"ס), גודל הרקמה (העין גדלה באופן משמעותי בנפח במהלך נוירוגנזה) ומהירות הדמיה (שיש להתאים בהתאם למהירות תהליך העניין). ניתן לנהל בקלות את כל השיקולים הללו. הפרוטוקול גמיש למדי; בנוסף לפרטי הפרוטוקול הספציפי כאן, ישנם עקרונות כלליים שיסייעו למעוניינים בהדמיה חיה היבטים אחרים של התפתחות העין.
Protocol
כל השיטות המתוארות כאן באמצעות דגי זברה מכוסות תחת הפרוטוקול החייתי של ד"ר קריסטן קוואן, "מנגנונים תאיים ומולקולריים של התפתחות מערכת הראייה בדגי זברה", ואושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) של אוניברסיטת יוטה.
1. סינתזת RNA כתרים
- צור את תבנית הדנ"א עבור תמלול במבחנה.
- ליניאריזציה תבנית ה- DNA על ידי עיכול 10 מיקרוגרם של DNA בנפח 100 μL של תערובת התגובה. תגובה טיפוסית מורכבת כדלקמן: לעכל 10 מיקרוגרם DNA באמצעות 3 μL של אנזים ו 10 μL של חוצץ, להביא את נפח התגובה ל 100 μL עם מים.
הערה: תבנית טיפוסית לעיכול היא וקטור pCS2, לדוגמה, pCS2-EGFP-CAAX או pCS2FA-H2A.F/Z-mCherry עבור תיוג הממברנה והכרומטין המתואר כאן. במקרה זה, DNAs plasmid מתעכלים כל באמצעות האנזים NotI. משתמשים צריכים להיות זהירים בפעילות הכוכבים; במקרה זה, אנזים בעל נאמנות גבוהה מומלץ וזמין מסחרית. - לדגור את התגובה ב 37 °C (50 °F) לילה כדי להבטיח כי ה- DNA מתעכל עד ההשלמה.
- נקה את תקציר ההגבלה באמצעות ערכת טיהור PCR בהתאם לפרוטוקול היצרן. יש לאחסן את הדנ"א עם 30 μL ddH2O. לאחסן את ה- DNA הליניארי ב -20 °C (50 °F) ולהשתמש לפי הצורך.
הערה: כמות ה- DNA מתעכל ונפח ההעמקה מניבים כ 0.3 מיקרוגרם / μL; זה מספיק עבור ~ 5 סיבובים של תמלול במבחנה, כל סיבוב באמצעות ~ 2 מיקרוגרם של DNA כתבנית.
- ליניאריזציה תבנית ה- DNA על ידי עיכול 10 מיקרוגרם של DNA בנפח 100 μL של תערובת התגובה. תגובה טיפוסית מורכבת כדלקמן: לעכל 10 מיקרוגרם DNA באמצעות 3 μL של אנזים ו 10 μL של חוצץ, להביא את נפח התגובה ל 100 μL עם מים.
- אין ויטרו לתמלל RNA עם כתרים באמצעות ערכת תמלול במבחנה. עבור תבניות pCS2 (כמתואר כאן), השתמש בערכת SP6.
- להרכיב את תגובת תמלול במבחנה, כדלקמן: תקציר 2 מיקרוגרם של תבנית DNA או עד 6 μL עם 2 μL של 10x חיץ תגובה, 10 μL של 2x ריבונוקלאוטיד לערבב, ו 2 μL של תערובת אנזימים 10x.
- דגירה ב 37 °C (2-4 שעות או יותר (פעמים ארוכות יותר יובילו לתשואה גבוהה יותר). אם תרצה, 1 μL של תערובת אנזימים ניתן להשלים באמצע תקופת הדגירה.
- לעכל את תבנית ה- DNA על ידי הוספת 1 μL של DNase ללא RNase ודגרה במשך 15 דקות ב 37 °C (7 °F).
- טיהור ה- RNA עם ה- כתרים באמצעות ערכת טיהור RNA בהתאם לפרוטוקול היצרן (ראה טבלת חומרים). Elute עם 100 μL של RNase חינם H2O.
הערה: התוספת של β-mercaptoethanol אינו הכרחי עבור יישום זה. בעוד שהשיטה המתוארת בפרוטוקול זה היא פשוטה, ריאגנטים חלופיים יכולים לשמש גם לטיהור RNA. - לזרז את הרנ"א.
- הוסף 10 μL של 3 M ללא RNase NaOAc ו 2.5 כרכים (~ 275 μL) של 100% EtOH ללא RNase קר כקרח לרנ"א הנבהר.
- לדגור על התגובה ב -20 °C (55°F) למשך 15-30 דקות. ספין במשך 15 דקות במהירות גבוהה ב 4 °C (70 °F) כדי כדורי RNA.
הערה: הכדור צריך להיות גלוי על הקיר של הצינור. כדאי לציין כיצד הצינור מיושר בצנטריפוגה בשלב זה, על מנת לחזות היכן הכדור צריך להיות בסוף הסיבוב. - הסר EtOH בזהירות עם מזרק, נזהר כדי למנוע חימום, ייבוש יתר, או פירוק הכדור. resuspend הכדור ב 20 μL של RNase חינם H2O.
- בדוק את ה- RNA כדי לוודא שהסינתזה מצליחה. השתמש 1 μL כדי לבדוק ריכוז על ספקטרופוטומטר ולהפעיל 0.5 μL על ג'ל אגרוז 1% כדי לבדוק עבור רצועה נפרדת אחת או שתיים, ולא מריחת משקל מולקולרי נמוך. התשואה של תגובת תמלול במבחנה צריכה להיות ~ 1 מיקרוגרם / μL.
- Aliquot ולאחסן RNA ב -20 °C (50 °F) או -80 °C (70 °F). ה-RNA לא מדולל עד מיד לפני הזריקות.
2. מיקרו-שיתוף של עוברים דגי זברה של תא אחד
הערה: הזריק 200-300 pg לכל RNA כדי לקבל ביטוי בכל מקום של כרומטין וקרום התא לאורך כל מורפוגנזה אופטית. הכן 5-10 μL של דילול RNA, ולטעון 2.5-5 μL / מחט; תכנן תוספת במקרה המחט נשברת.
- הכנות מראש לזריקות.
- הכן צלחת עובש הזרקה כדי להקל על יישור וכיוון של עוברים 1-cell עבור microinjection. ממיסים 2% אגרוז ב-E3 (מדיום עובר סטנדרטי) ויוצקים לצלחת פטרי. בזהירות לצוף עובש הזרקה (ראה טבלה של חומרים) על החלק העליון של agarose חם כדי ליצור את החותם של שוקת agarose כפי שהוא מתמצק. ברגע שאגורז מתמצק, להסיר את תבנית ההזרקה.
הערה: הזרקת כלים עובש ניתן להשתמש במשך מספר חודשים; לכסות ב- E3 ולאחסן ב 4 °C (7 °F) כאשר לא בשימוש. - משוך מחטי מיקרו-ג'ק-סיים. משכו נימי זכוכית לשטיח ארוך כדי ליצור מחטי מיקרו-ג'ק-סי באמצעות מכונת משיכת מחטים. תכנת את המכונה ספציפית לסוג הנימים בהם נעשה שימוש. עבור נימי בורוסיליקט 1.0 x 0.78 מ"מ השתמש בתוכנית הבאה: חום = 546 °C , משיכה = 130, מהירות = 70, זמן = 90 (איור 2F). לאחסן את המחטים בצלחת פטרי ולאבטח אותו עם חימר דוגמנות.
הערה: מתכון המשיכה ישתנה, בהתאם למכונה ולסיבים, ויש תמיד לכייל סיבים חדשים. כל סבב משיכה מייצר שתי מחטים (איור 2G); לעשות זאת מספר פעמים כדי לייצר מספיק מחטים במקרה של הפסקות מקריות וניסויים עתידיים. - לדלל את RNA capped להזרקה. לדלל הן EGFP-CAAX ו H2A-mCherry RNAs לריכוז 200-300 ng/μL באמצעות RNase חינם H2O ו 1 μL של פנול אדום בנפח כולל של 5 μL (ריכוז סופי של פנול אדום הוא 0.1%). מזיזים את התערובת ומסובבים בקצרה כדי לאסוף את הנפח הכולל. שמור את הרנ"א מדולל על קרח לפני ההזרקה.
- הכן צלחת עובש הזרקה כדי להקל על יישור וכיוון של עוברים 1-cell עבור microinjection. ממיסים 2% אגרוז ב-E3 (מדיום עובר סטנדרטי) ויוצקים לצלחת פטרי. בזהירות לצוף עובש הזרקה (ראה טבלה של חומרים) על החלק העליון של agarose חם כדי ליצור את החותם של שוקת agarose כפי שהוא מתמצק. ברגע שאגורז מתמצק, להסיר את תבנית ההזרקה.
- הזרקת עוברים בעלי תא אחד
- ברגע שהדגים מתחילים להתרבות, אפשרו ~15-20 דקות כדי להבטיח שהביצים מופרות. במהלך תקופה זו, גב לטעון את המחט עם 2.5-5 μL של דילול RNA באמצעות P10 ו P10 מיקרו מטעין טיפים.
- באמצעות picoinjector, כייל את המחט באמצעות רticle העין (שקופית כיול מיקרומטר מספיק גם) כדי למדוד את עוצמת הטיפה (נפח של כדור = (4/3) * pi * רדיוס^3). התאם את זמן ההזרקה ואת הלחץ כך שנפח ההזרקה הוא 1 nL (איור 2I).
- בעזרת מקטרת גליל/העברה, העמיסו בזהירות ביצים לתבנית ההזרקה(איור 2J). אם זה מועיל, השתמש במלקחיים כדי לגלגל עוברים כך שהתא הבודד יהיה גלוי, לפני ההזרקה או במהלכה. זוהי העדפת המשתמש להשתמש במיקרו-מניפולטור.
- הזריקו עוברים בשלב של תא אחד, והתמקדו בתא ולא בחלמון(איור 2M). זה יבטיח תיוג אחיד של העובר המתפתח.
- העלו את העוברים לשלב הרצוי (לפני 12 כ"ס, לפי תקן34). לעוברים מוזרקים תהיה התפתחות מאוחרת, אז להעלות אותם בטמפרטורה מעט גבוהה יותר (29.0-29 °C (29 °F) כדי לפצות על הזמן. בשעות אחר הצהריים, בדוק את העוברים ולהסיר את אלה שמתו כדי לשמור על בריאות המצמד.
3. הרכבה של עוברים של דגי זברה בשלב ההצטברות
- לפני הרכבה, להכין 1.6% אגורוז נמוך להמיס ב- E3. אם אתם מתכננים ניסויי הדמיה מרובים, הכינו ~20 מ"ל של אגורוז נמוך נמס ולאחסנו בטמפרטורת החדר. ביום הרכבה עוברית, להמיס את זה כדי ליצור aliquot טרי (1-5 מ"ל) בצינור שניתן להציב בלוק חום 42 °C לפני הרכבה.
- עוברי מסך להזרקה מוצלחת ובהירות כללית של פלואורסצנטיות באמצעות מיקרוסקופ פלואורסצנטי לפני ההרכבה. מדגם אידיאלי יהיה EGFP חזק ו mCherry פלואורסצנטיות ולהיות בשלב ההתפתחותי הנכון(איור 3B - B').
- עוברי מסך באמצעות מיקרוסקופ פלואורסצנטי. בחר עוברים המבטאים בחוזקה הן EGFP והן פלואורסצנטיות mCherry להרכבה.
- בחר עוברים עם 11 כ"ס. ספירת סומיטים כדי לביים כראוי את העוברים34; ב 11 כ"ס צריך להיות 3 סומיטים, ועל ידי 12 כ"ס יש 6 סומות.
הערה: על ידי הרכבה עוברים לפני 12 כ"ס (ב 11 כ"ס), הדגימות יהיו מבוימות כראוי ב 12 כ"ס כאשר timelapse מתחיל.
- עוברים dechorionate לפני הרכבה. לעשות את זה באופן ידני עם מלקחיים עדינים או כימי באמצעות פרונאז (2 מ"ג / מ"ל). עם עוברים כל כך צעירים, זה חיוני כי dechorionation מבוצע בתוך צלחת מצופה אגר וכי עוברים לא ליצור קשר עם ממשק מי האוויר.
- באמצעות פיפטה גליל זכוכית, למצוץ עובר ולהיפלט כמה שיותר E3, כך העובר יושב בקצה זכוכית פסטר pipette.
- זרוק את העובר לתוך הצינור של אגרוז מבלוק החום. תן לו לשקוע לתוך האגורוז לכמה שניות, ואז למצוץ קצת אגרוז ראשון ולאחר מכן את העובר, לוודא כי העובר נשאר בקצה הפיפטה (איור 3C - C).
- מניחים צלחת בתחתית זכוכית להדמיה תחת היקף ניתוח. להוציא את העובר ואת agarose לתוך טיפת אגרוז בצלחת זכוכית תחתון. השתמש במלקחיים כדי לכוון מהר מאוד, כך העובר הוא גבי למטה (החלק העליון של הראש בתחתית הזכוכית). אפשרו לטיפה של אגרוז להתקשות(איור 3D - D). צעד זה חייב להיעשות במהירות אך בזהירות, כמו עוברים בשלב זה הם שבירים. עוברים פגומים לא ישרדו את תהליך הדמיית הזמן.
הערה: חשוב לכוון את כל העוברים באופן עקבי לניסוי זה. בעת ביצוע timelapse, העוברים חייבים להתאים בתוך שדה הראייה שהוקצה תוך שמירה על מקום נוסף עבור צעיפית הראייה לגדול לתוך. כיוון אופטימלי הוא ליישר את הציר הקדמי-אחורי של כל העוברים "אנכית" או לאורך השעה 12 ו-6 על פנישעון (איור 3G). - הר בין 10-12 עוברים, שזה יותר מכפליים כי יהיה בתמונה, כך הדגימות הטובות ביותר ניתן לבחור פעם להעריך על confocal (איור 3E - E'). דגימות ייבחנו לגיל, אחידות של תיוג פלואורסצנטי ודיוק של כיוון הרכבה.
- לאחר הרכבת העוברים, פיפטה יותר אגה כדי לכסות לחלוטין את החלק התחתון של המנה, ובכך לעטוף את כל טיפות האגרוז הנפרדות בדיסק אגרוז גדול אחד (איור 3F - F'). כמות מספקת של אגרוז תבטיח כי טיפות העובר הבודד או הדיסק כולו לא להרים מתחתית המנה לצוף מחוץ לעין.
- לאחר התקשות, לכסות את agarose עם E3 כדי לשמור על הדגימות hydrated למשך ניסוי הדמיית timelapse (דאגה בהתאם ללחות של הבניין ובסביבה).
הערה: Tricaine אינו הכרחי עבור ניסויי הדמיה ספציפיים אלה timelapse, כמו עוברים אלה הם צעירים מספיק; עם זאת, אם תרצה, ואם עובד עם שלבים ישנים יותר של עוברים, tricaine ניתן להוסיף לתוך agarose עצמו ו overlaid בתקשורת. - על הנייר, צייר מפה של העוברים לעיון קל במהלך הגדרת הזמן. זה חיוני כדי לשייך מאוחר יותר את המיקום עם הגנוטיפ של כל מדגם.
4. זמן קונפוקלי במיקום מרובה עם מיקרוסקופ קונפוקלי לסריקת לייזר
הערה: פרוטוקול הדמיה timelapse זה תוכנן לשמש עם מיקרוסקופ קונפוקלי סריקת לייזר המצויד בתוכנת היצרן (ראה טבלת חומרים). מערכת זו מצוידת בהתקן פיזו Z-stage המאפשר רכישה מהירה של ערימות Z. קווי הלייזר המשמשים בפרוטוקול זה הם לייזר יון ארגון 488 ננומטר ולייזר DPSS 561 ננומטר. לייזר 561 ננומטר מתאים היטב להדמיית הפלורופור mCherry: הוא קרוב מספיק לשיא העירור mCherry (587 ננומטר) ומופעל היטב.
- תארגן את הקונפוקלי.
- הפעלה בקונפוקל והיכנס למחשב השולחני.
- התקן את התוספת שלב Z של piezo (איור 4B), ולאחר מכן הפעל את תוכנת הרכישה.
- בתוכנה הנמצאת במצב רכישה, הפעל את הלייזרים 488 ו-561 באמצעות התפריט הנפתח(איור 4F). הלייזרים לוקחים כמה דקות כדי להתחמם, ולכן שלב זה מבוצע מוקדם כדי לחסוך זמן.
הערה: פרמטרי הרכישה הם כדלקמן: בדוק את תיבות Z-stack, סידרת זמן ומיקום. הגדר את גודל המסגרת ל- 512 (X) x 384 (Y), מהירות סריקה ל- 9, מצב סריקה לדו-כיווני, זום ל- 0.7, חור פין ל- 60.2 (1.63 יחידות אוורירי ~ = מקטע 1.6 מיקרומטר) ומרווח Z-מרווח ל- 2.1 מיקרומטר. פעולה זו תניב גודל תמונה של 303.6 מיקרומטר x 227.7 מיקרומטר, וגודל פיקסלים של 0.59 מיקרומטר. יש לבדוק את הלייזרים 488 ו-561 ולהקצות אותם למסלול; טווח הזיהוי של EGFP הוא 494-545 ננומטר וטווח הזיהוי של mCherry הוא 598-679(איור 4F). - מצפים בנדיבות את תחתית צלחת הזכוכית במדיום טבילה התואם את אינדקס השבירה של המים, תוך הקפדה על הימנעות מבועות אוויר(איור 4C). בחר את המטרה 40x מים ולהחיל טיפה קטנה של טבילה מדיום על המטרה (איור 4D). אבטחו את המנה עם תחתית הזכוכית בהכנסת הבמה, מרחו E3 כדי לשמור על העוברים לחים למשך הלילה, ואז השתמשו בחימר דוגמנות כדי לאטום את מכסה הפלסטיק מעל המנה(איור 4E). העלו את המטרה ליצירת קשר עם המנה.
- דוגמאות מסך והתכוננו לתקופת זמן.
- עבור מהכרטיסיה רכישה לכרטיסיה איתור ולחץ על סמל הנורה כדי להדליק אור משודר. עם האור המשודר, אתר את המדגם הראשון עם הג'ויסטיק: בעין, תחילה להזיז את המדגם לתוך קרן האור, ולאחר מכן להשתמש בעין למרכז ולהתמקד מצעית אופטית.
- חזור לכרטיסיה רכישה. ודא שהתיבות Z-stack, Time Series ומיקומים מסומנות והלייזרים מתחממים לשימוש.
- הגדר את גודל המסגרת ל- 512 (X) x 384 (Y), מהירות סריקה ל- 9, מצב סריקה לדו-כיווני והגדר את גודל התצוגה ל- 0.7.
- תחת הכותרת ערוצים, התחל על ידי הקצאת הלייזרים 488 ו- 561 ל- Power 2.0 ו- Gain 550 (ניתן לכוונן זאת מאוחר יותר). הגדר את חור הסיכה ל- 60.2 (1.63 יחידות אוורייר ~= מקטע 1.6 מיקרומטר).
- התחל לסרוק באמצעות לחצן רציף. בעזרת ידית המיקוד העדינות, אתר את הדגימה בציר Z ומיקם את ציר X-Y במסגרת. תפסיק לסרוק.
- תחת הכותרת מיקומים, לחץ על הוסף כדי לשמור את מידע XYZ במדגם הראשון (איור 4F). עשה זאת רק כדי שדגימות יוזמנו. בחר דוגמאות עבור פלואורסצנטיות חזקה שלהם הרכבה אופטימלית.
- עבור לכרטיסיה איתור, עבור לדוגמה הבאה וחזור על שלבים 4.2.5-4.2.6, בהיותך בררני לגבי בחירת דוגמאות.
- סיים מיקומי דגימה, הקצה טווח z ולאחר מכן התחל לוח זמנים. לאחר בחירת כל הדגימות (ניתן לדמיין 4-5 דוגמאות בתוך מרווח הזמן הכולל של 2.5 דקות) ומיקומים נשמרים, עבור דרך כל דגימה ולהתאים את מיקום XYZ במסגרת הצפייה.
- סמן את המיקום הראשון ולחץ על העבר אל. תוך כדי סריקה רציפה, מסדרים את ההקלה האופטית בתוך המסגרת. השאר מקום בשפע באזורים הנעשים והדיסטליים ביחס לזרבובית הראייה והמוח.
- לאחר מכן, הקצו את פרוסת Z הראשונה והאחרונה על-ידי בחירה באפשרות קבעו תחילה וקבעו אחרונים תוך כדי מעבר דרך כיוון Z עם ידית המיקוד העדינה. לשמור על מספר פרוסה כולל של ~ 63, כמו זה יתאים את הצמיחה של אופטיקה. ספק מקום נוסף בצד הגחון של ארסיית הראייה כדי לאפשר מקום לצמיחה.
- לאחר הגדרת פרוסות Z ראשונות ואחרונות, לחץ על לחצן C כדי לעבור למרכז מחסנית Z. כוונון כוח לייזר ורווח עבור שני הלייזרים; במידת האפשר, לשמור על כוח הלייזר מתחת 5 ולהשתמש רווח גבוה יותר, במידת הצורך. תפסיק לסרוק. עדכן את פרטי המיקום על-ידי לחיצה על עדכן.
- עבור למיקום הבא על-ידי לחיצה על מיקום 2. חזור על שלבים 4.3.1-4.3.3 עבור כל מיקום שהוקצה. כוח הלייזר והרווח צריכים להיות מוגדרים כך שכל הדגימות מוארות מספיק.
- לאחר השלמת מידע המיקום והגדרות הלייזר, הקצה הגדרות סידרת זמן. תחת הכותרת סידרת זמן, הקצה מרווח זמן ל- 2.5 דקות ומחזורים ל- 300 (איור 4F). מספר המחזורים מחושב כך שהזמן עובר את שלב 24 ה-hpf, עם השלמת פיתוח הגביע האופטי.
- כדי להתחיל את לוח הזמנים, לחץ על התחל. נטר את המחזור המלא הראשון: השתמש בטיימר כדי להבטיח מחזור שלם אחד (הדמיית כל המיקומים) הוא פחות מ- 2.5 דקות ולוודא שכל מיקום נראה נכון. המיקרוסקופ פועל באופן עצמאי בן לילה ואין צורך לפקח עליו.
הערה: למרות שחדר הקונפוקלי מבוקר בטמפרטורה, טמפרטורת החדר היא 20-25 מעלות צלזיוס. עם הציוד פועל ואת לייזרים סריקה, הטמפרטורה על הבמה נראה קרוב יותר ל 28 °C (5 °F), מאז התפתחות עוברית ממשיכה בקצב צפוי זה, כפי שנחשב חזותית עם ציוני דרך מורפולוגיים. - עם הגדרות אלה, timelapse יימשך 12.5 שעות. שמור את הקובץ לאחר השלמת הזמן. הוא יהיה גדול (~ 40 GB) וניתן להפרידו לעמדות בודדות לאחר שמירתו באמצעות תוכנת הרכישה.
תוצאות
הזרקת RNAs פלואורסצנטי מאפשר תיוג תת-תאי
RNAs המתייגים את קרום הפלזמה וההיסטונים של התא מוזרקים על מנת ללכוד את מורפוגוגיות התאים הבודדים ותנועות העומדות בבסיס מורפוגנזה אופטית. איור 2 מדגים כל שלב בתהליך של מיקרו-ריט של עוברים של דגי זברה בשלב של תא אחד. בקצרה, דגי זברה מזדווגים (איור 2E), ועוברים נאספים ונטענים לתוך תבנית ההזרקה(איור 2J). מחט מיקרו-אינטג'ק ממולאת מאחור (איור 2H),ועוברים מוזרקים ישירות לתא הבודד (איור 2K-M),הנחוץ כדי להשיג תיוג אחיד (איור 2M, איור 4I-I''',סרט 1). בנוסף לתיוג אחיד, נצפתה פלואורסצנטיות חזקה והפיתוח ממשיך ללא השגחה (איור 3B-B').
הרכבה יעילה חיונית להדמיית זמן OCM מ- 12-24 כ"ס
כדי תמונה אופטית morphogenesis, אשר מתרחשת על פני תקופה ממושכת של זמן, זה קריטי הן לבחור עוברים אידיאליים מיקום כראוי כל מדגם בעת ההטבעה. איור 3 מציג תיאור מפורט של הרכבה מוצלחת של 11 כ"ס עוברים. עוברים מוזרקים נבדקים לראשונה לפלואורסצנטיות מספקת (איור 3B',B'', F'', F'''). עוברים בודדים שקועים באגרוז(איור 3C, C') ומורכבים על גרוס בטיפת אגרוז בודדת(איור 3D, D). כל הדגימות מותקנות בדיסק קולקטיבי של אגרוז (איור 3E-F'). כאשר העוברים מבוימים כראוי, פלואורסצנטיים מספיק, ומורכבים כראוי(איור 3G),הדגימות יישארו במסגרת ההדמיה במהלך timelapse ומאפשר את כל האיבר להיות בתמונה (איור 4G-G'", אני-אני''', סרט 1). אי ביצוע כל אחד מהצעדים הללו יגרום לעובר רכוב שאינו מדגם אופטימלי להדמיית timelapse. לשינוי הקל ביותר במידת הסיבוב תהיה השפעה דרמטית על כיוון צמיחת העובר במהלך הזמן. סיבובים תת-אופטימליים מוצגים באיור 3, כולל עובר המסובב יתר על המידה (איור 3I), אשר יביא לתקופת זמן אחורית יותר, ועובר שאינו מסובף פחות (איור 3J) שבו ניתן לצפות רק את הרקמה הקדמית ביותר. בנוסף לסיבוב נכון במהלך הרכבה, דגימות המותקנות ביחס לכיוון המסגרת נוטות יותר להניב זמן מוצלח (איור 4G-G'', אני-אני'',סרט 1). דגימות אופטימליות הן אלה המכווונות אנכית על המנה, כאשר הציר הקדמי-אחורי בשורה אחת עם השעה 12 ו-6 על פנישעון (איור 3G). דגימות תת-אופטימליות הן אלה שאינן מכוונות על ציר זה, כגון דגימות אופקיות או אלכסוניות (איור 3H). דגימות אלה יגדלו מתוך מסגרת ההדמיה ככל שהזמן יתקדם ולא ניתן יהיה להשתמש בהן לניתוח נוסף(איור 4H-H'',J-J'').
רכישת ערכת נתונים של timelapse המתאימה לניתוח עתידי
עוברים המוזרקים במדויק, מורמים ומורכבים יהפכו לדגימות מוצלחות עם תמונה קונפוקלית. איור 4 מראה מדגם אופטימלי ל-timelapse: יש אפילו פלואורסצנטיות, והדגימה היא 12 כ"ס. מחסנית z להדמיה מוקצית כך שהפרוסה הראשונה היא רק גב לזרמית הראייה, ואילו הפרוסה האחרונה משאירה כמה פרוסות מעבר לגבול הגחון של ארסית אופטית 12 כ"ס(איור 4G-G'). הטיה זו כלפי הצד הגחון מספקת עודף מקום לצמיחת רקמות בכיוון הגחון. גורמים אלה, כאשר הם נפגשים, גורמים לתקופת זמן אופטימלית (איור 4I-I''',סרט 1). מדגם תת-אופטימלי כולל פלואורסצנטיות פסיפס או עמום, כבר פיתח בעבר 12 כס (כאשר מורפוגנזה אופטית נמצא בעיצומו), או ממוקם בצורה גרועה בערימת Z או במסגרת XY (איור 4H-H''). כאשר קריטריונים אלה אינם מתקיימים, timelapse כבר לא ללכוד את כל נפח התלת-ממד של הרקמה כפי שהוא מתפתח ולא ניתן להשתמש בו לניתוח נוסף (איור 4J-J'').
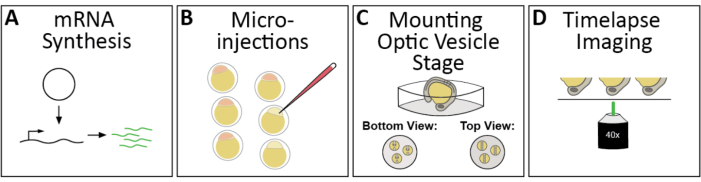
איור 1: זרימת עבודה של הדמיית timelapse 4D של מורפוגנזה אופטית דג זברה. (A)כדי לתייג באופן פלואורסצנטי מבנים תת-תאיים של עניין, לסנתז את mRNAs capped המתאים. (B)מיקרו-רנ"א לעוברים של דגי זברה בשלב של תא אחד. (C)עוברים מותקנים על ידי גדוש, או עם הראש כלפי מטה למיקרוסקופ קונפוקלי הפוך, בשלב ההבשלה האופטית, ~ 11 שעות לאחר ההפריה או 3 שלבים סומיים. (D)ניתן לדמיין עוברים מרובים ברצף במהלך מפגש הדמיה אחד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: מדריך חזותי למיקרו-ריט של עוברים של דגי זברה בעלי תא אחד. (A)פריטים לכלול בערכת הזרקה (בכיוון השעון): תיבה בגודל בינוני שיכולה להכיל את כל הערכה עם כפפות ניטריל חד פעמיות; צלחת המכילה מחטי מיקרו-ינון; מלקחיים; עליקוט של שמן מינרלי וחיתוך ריבועים של parafilm; טיפים לטעינה מיקרו; RNA מדולל על קרח; עובש הזרקת אגרוז; סמן; רולר / העברה pipette; ופיפטה P10. (B)הגדרת מיקרו-ערך: מיקרוסקופ מנתח ליד מזרק פיקו המחובר למקור גז דחוס חיצוני. דוושת רגל ומיקרו-מניפולטור מחוברים לפיקו-מזרק. המיקרו-מניפולטור מצויד במחזיק מחט ומוצב במקום מעל שלב המיקרוסקופ. (C)תבנית הזרקת אגרוז המכילה שש שורות של חריצים עם זווית של 90 מעלות בצד אחד וזווית של 45 מעלות בצד השני. (ד)הלוח הקדמי של מזרק הפיקו. תצוגת הלחץ קוראת 7.8 PSI; זה יכול להיות מותאם עם הידית שכותרתו Pלהזריק. מתחת, יש כפתורים להפעיל לחץ באופן ידני להזריק, לשנות את זמן ההזרקה, או לנקות, למלא או להחזיק את הנוזל במחט. זמן ההזרקה מוגדר ל- 08 (שווה ערך ל- 8 x 10 msec). צינור פלט מחובר ל- Pהחוצה ומחובר למחט ההזרקה. מתג מקור מד הלחץ מוגדר Pלהזריק בעת הגדרת לחץ ההזרקה, וזה יכול להיות מועברלאיזון P כדי להתאים את הלחץ הבזלי המופעל על המחט כאשר זריקות אינן נעשות. הרגולטוראיזון P נמצא ליד הרגולטורלהזרקת P. לחצן ההפעלה מואר כדי לציין שהמכונה מופעלת. (ה)דגי זברה בוגרים מזדווגים במיכלי רבייה קטנים המכילים מיכל מקונן עם תחתית רשת המפרידה בין דגים בוגרים לביצים מופרות ומאפשרת איסוף קל. מפלס המים יורד כדי לחקות תנאי מים רדודים ומפרידי טנקים מוסרים כדי ליזום התנהגות הזדווגות. (ו)הפאנל הקדמי של המיקרופיט (מחט): מכיל תצוגה המציגה את התנאים הספציפיים המשמשים למשיכת מחטים. הגדרת הלחץ היא P = 500, ואחריה התאריך והשעה האחרונים של התוכנית נערכה, מספר התוכנית, חום = 546, PULL = 130, VEL = 70, ו- TIME = 90. (ז)נימי זכוכית אחד מוכנס לתוך המיקרופיט (מחט) מושך ומאובטח למקומו. כל ריצת משיכה מתוכנתת גורמת לשתי מחטים מחודדות ארוכות (ראשי חץ אדומים). (H)דילול הרנ"א נטען לאחור לתוך מחט; צבע אדום פנול מאפשר הדמיה קלה של הפתרון. (I)לאחר שבירת קצה המחט, בולוס של RNA נמדד באמצעות רתול העין על היקף הניתוח. עבור סטריאומיקוסקופ זה, בהגדלה כוללת של 30x 6 סימוני Hash שווים לאמצעי אחסון של 1 nL. (J)ביצים מופרות נטענות בתבנית הזרקת אגרוז ומופצות לאורך שוקת התבנית באמצעות פיפטה רולר. (K)תבנית ההזרקה המכילה עוברים בשלב של תא אחד ממוקמת מתחת למיקרוסקופ והעוברים מוזרקים ברצף. (L)מחט ההזרקה מוכנסת לכל עובר המתמקד בתא הבודד. (M)פעם אחת בתא, דוושת כף הרגל משמשת כדי לעורר כמות מווסתת של לחץ ושחרור של 1 nL של RNA לתוך התא של העובר (כפי שניתן לדמיין על ידי פנול אדום). מוטות קנה מידה: I = 0.1 מ"מ; L, M = 0.5 מ"מ. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: מדריך חזותי להרכבה של עוברים להדמיה. (A)הרכבה מוגדרת (משמאל לימין): בלוק חום המתוכנת ל-42 מעלות צלזיוס, צינורות חימום של אגארוז נמוך-נמס; פיפטה רולר; זוג מלקחיים; צלחת מצופה אגרוז המכילה עוברים dechorionated; וסטריאומיקוסקופ ניתוח המחובר למנורת פלואורסצנטית של חליד מתכת. (ב,ב', ב') עובר 11 כ"ס שהוזרק עם EGFP-CAAX mRNA ו mCherry-H2A mRNA, המוצג תחת ברייטפילד, פלואורסצנטיות GFP ופלואורסצנטיות mCherry, בהתאמה. (C, C') פיפטת פסטר מזכוכית המכילה אגרוז ועובר היושב בקצה; C' הוא תצוגה מוגדלת. (D,D') עובר אחד רכוב בטיפת אגז נמוכה על צלחת מכוסכת מזכוכית, הנראית הן משלב המיקרוסקופ והן דרך עיני המיקרוסקופ. 12עוברים המותקנים בטיפות בודדות של אגזרוז נמוך נמס על צלחת מכוסכת מזכוכית, הנראים הן משלב המיקרוסקופ והן דרך עיני המיקרוסקופ. (פ', פ', פ'') כל העוברים המותקנים הם על כיסוי עם שכבה שלמה של אגרוז כדי למלא את החלק התחתון של המנה, לראות הן משלב המיקרוסקופ והן מן עיני המיקרוסקופ המוצגות בשדה בהיר; פ' פלואורסצנטיות GFP; ופלואורסצנטיות של צ'ארי. (G)מדגם אופטימלי ב 12 כ"ס מותקן בגב ומכוון אנכית בקנה אחד עם 12 ו 6 עם שתי שלל אופטי באותו מישור. (H)מדגם תת-אופטימלי: למרות שלל גבי וגפי רכוב נמצאים זה בזה, מדגם זה מכוון על ציר אלכסוני ויצמח מתוך גודל המסגרת ככל שהפיתוח יתקדם. (I)מדגם תת-אופטימלי: מדגם זה מסובב יתר על המידה ולא הרכבה על גבי, וכתוצאה מכך, החלק הימני של ההקלה האופטית לא יילכד בזמן. (J)מדגם תת-אופטימלי: מדגם זה אינו מסובב ולא הרה אחורית, וכתוצאה מכך החלק האחורי של הזרם האופטי לא יילכד בזמן. קווים מנוקדים מציינים כל עיגול אופטי. מוטות קנה מידה: B = 0.1 מ"מ; D' = 1.5 מ"מ; E', F' = 2.5 מ"מ; G = 0.1 מ"מ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
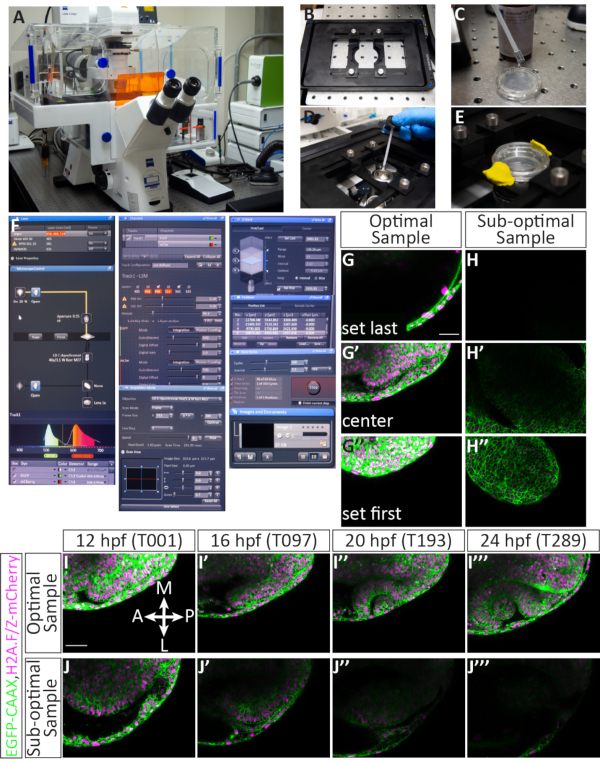
איור 4הגדרת לוח זמנים מרובה של מיקום ותוצאות פוטנציאליות.: (A) מיקרוסקופ קונפוקלי סריקת לייזר. (B) תוספת שלב פיזו Z. (C) תחתית צלחת תחתונה מזכוכית המכילה עוברים המוטבעים באגרוז מצופה במדיום טבילה התואם את אינדקס השבירה של המים. (D) טיפה של מדיום טבילה ממוקמת על המטרה 40x W (מרחק עבודה ארוך). (Eהמנה מוחזקת במקום עם תוספת הבמה, E3 מתווסף על גבי שכבת אגרוז, ואת המכסה מאובטח עם חימר דוגמנות. (F) הגדרות תוכנת רכישה: קווי הלייזר הרצויים מופעלים מהתפריט הנפתח. עבור עוברים מוזרקים עם EGFP-CAAX RNA ו- H2A-mCherry RNA, לייזרים ארגון ו- DPSS 561-10 מופעלים. הדגש האדום מציין שלייזר ארגון מתחמם. כדי לאתר את המדגם מעל המטרה, האור המועבר מופעל דרך לוח הבקרה של המיקרוסקופ. הן EGFP והן mCherry מוקצים למסלול 1 (להדמיה סימולטנית) והטווח של כל גלאי מוגדר. כאן, טווח EGFP מוגדר 494-545 ננומטר, וטווח mCherry מוגדר 598-679 ננומטר. תחת ערוצי ניתן להגדיר כוח לייזר. לאחר הלייזרים התחממו, הכוח יכול להיות מוגבר עד 5.0, ורווח (מאסטר) ניתן להתאים. חור הסיכה מוגדר על 60.2, השווה ל- 1.63 יחידות אווריי או מקטע 1.6 מיקרומטר. תחת רכישה גודל המסגרת מוגדר ל- 512 x 384, מהירות הסריקה היא 9.0, ממוצע הוא דו-כיווני וזום מוגדר ל- 0.7. תחת Z-Stack המיקום הראשון והאחרון בציר Z מוגדרים בזמן שהקונפוקאלי סורק. מרווח הזמן (גודל שלב) מוגדר ל- 2.1 מיקרומטר. בעת בחירת מיקום Z ראשון ואחרון, מספר סטנדרטי של 63 פרוסות נשמר בדרך כלל; זה מתאים לצמיחה הכוללת של העין. האפשרות "השתמש בפיזו" נבחרה. תחת תפקידים כל מיקום שנבחר מופיע ברשימה כולל מספר מוקצה ומיקום X, Y ו- Z. ישנם לחצנים נוספים לשליטה במספר העוברים (מיקומים נפרדים) לתמונה, כולל הוספה, עדכון או הסרה. תחת סדרת זמן התפריט, המחזור מוגדר ל- 300 (מספר ערימות Z שנרכשו) ומרווח הזמן (שלב הזמן) מוגדר ל- 2.5 דקות. לאחר השלמת ההגדרות, רכישת timelapse מופעלת על-ידי לחיצה על start. התוכנה תציג את פרוסת מחסנית Z, המחזור והמיקום שסורק כעת. לאחר השלמת timelapse, הקובץ נשמר על-ידי לחיצה על סמל התקליטון ב תמונות ומסמכים החלונית '. (G-J) קרום התא (green) מסומנים עם EGFP-CAAX וגרעיני תא (כרומטין, magenta) מסומנים עם H2A-mCherry RNAs. (ג'י, ג'י, ג'י) דוגמה להגדרת פרוסת Z הראשונה והאחרונה עבור דגימה שנטענה בצורה אופטימלית. פרוסת Z הראשונה (בצד הגרם) באה על חשבון ectoderm גדור, בעוד Z-פרוסה האחרונה (בצד הגחון) הוא הרבה מתחת vesicle אופטי, כדי להתאים את הצמיחה שלה בכיוון הגחון. (ח', ה', ה'') דוגמה להגדרת פרוסת Z הראשונה והאחרונה של מדגם תת-אופטימלי. המדגם יש פלואורסצנטיות mcherry חלשה והוא רכוב באלכסון, כך אופטית מתפתחת לא סביר להישאר במסגרת למשך הזמן. (אני, אני, אני, אני) דוגמה של timelapse מדגם אופטימלי. תמונות פרוסה בודדת מאמצע מחסנית Z נלקחות מכל עוצמת הקול של 63 פרוסות ב-4 נקודות זמן (ערך T). בר, מוח; NR, רשתית עצבית; RPE, אפיתל פיגמנטי ברשתית; לה, עדשה. (ג'יי, ג'יי, ג'יי, ג'יי.) דוגמה לתקופת זמן מדגם תת-אופטימלי. במקרה זה, המדגם יצא ממטוס Z ורק חלק אלפי של אופטיקה צפונית נלכד. מוטות קנה מידה: G, I = 50 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
סרט 1: Timelapse של מורפוגנזה אופטית בעובר מסוג בר אופטימלי. מבט על גפי של עובר מסוג בר המסומן עם EGFP-CAAX (קרום פלזמה, ירוק)ו- H2A. F/Z-mcherry (כרומטין, מגנטה). timelapse הוא מ ~ 12-24 כ"ס ומכיל קטע קונפוקלי יחיד מתוך ערכת נתונים 4D שלמה. מרווח הזמן הוא 2.5 דקות בין ערימות z ומוצג ב- 22.5 פריימים לשניה. אנא לחץ כאן כדי להוריד את הסרט הזה.
Discussion
כאן, אנו מתארים פרוטוקול עבור תיוג הטוטו והדמיה 4D timelapse של מורפוגנזה אופטית. אנו עוברים את התהליך של יצירת חלבונים פלואורסצנטיים קידוד RNA capped כדי לסמן תאים תת-תאיים שונים; הזרקת עוברי דג זברה 1-תא; הטמעת עוברים של 11 כ"ס באגרוז להדמיה מרובת-קס; ורכישת ערכות נתונים 4D של עוברים מרובים למשך מורפוגנזה אופטית (12-24 כס).
ניתן לענות על מספר רב של שאלות עם ערכות נתונים צפופות מידע אלה. ניתן לדמיין נתונים 4D ולנתח כמותית במגוון דרכים. למרות שמחוץ להיקף פרוטוקול זה, אנו כוללים כאן כמה מהמטרות והיישומים הסטנדרטיים שלנו כדוגמה לסוגי הדברים שניתן להשיג. כמובן, שיטות ניתוח תמונה כמותית מפותחות כל הזמן, וניתן להשתמש בכלים מסחריים ובנויים בהתאמה אישית. אם אחד לא השתמש בשיטות כאלה לפני, אחד צריך להיות מוכן לעבוד דרך אופטימיזציה מסוימת כדי להבטיח כי ערכות הנתונים שנרכשו מתאימים לגישת הניתוח הכמותי של בחירה.
הדמיה והערכה כמותית של ערכות הנתונים 4D יכולות להיות מאתגרות, בשל גודל הקבצים. ניתן להשתמש בתוכנת הרכישה כדי להפריד את ערכות הנתונים לעוברים בודדים, ו- ImageJ/Fiji יכול לשמש להמרת קבצי קונפוקל מתבניות מסחריות לערימות tif סטנדרטיות יותר, שבהן כל נקודת זמן נשמרת כקובץ נפרד. פעולה זו תקטין את גדלי הקבצים ותתקן את תבניות הקובץ. ניתן להרכיב מקטעים אופטיים בודדים מכל נקודת זמן כ- timelapse 2D (XY) באמצעות ImageJ/Fiji, המאפשרים הדמיה והערכה מהירה של הנתונים. סרט 1 הוא דוגמה בדיוק לכך: קטע אופטי יחיד לאורך זמן שהורכב כזמן של המדגם האופטימלי המוצג באיור 4I'''. משם, להדמיה תלת-ממדית ו-4D, אנו משתמשים בדרך כלל ב- FluoRender35,36, הזמינה באופן חופשי אך יש לה דרישות ספציפיות לכרטיס גרפי. באמצעות FluoRender, ניתן לסובב נתונים מעובדים בתלת-ממד בכל ציר, לדמיין את ערכת הנתונים ב- 4D לאורך זמן, ליצור חתכים בכל מישור ולשמור את הסיבובים והפריטים החזותיים כסרט או כסדרה של תמונות tif.
במונחים של ניתוח כמותי, ישנן שאלות רבות שיש לענות עליהן. פיתחנו תוכנה בתוך הבית כדי לסייע המטרות הספציפיות שלנו של הבנת התנהגויות התא שבבסיס מורפוגנזה אופטית. התוכנית שלנו, LongTracker, משתמשת באות הגרעיני כנציג למיקום למעקב אחר תאים13. עם נתונים אלה, אנו יכולים לקבוע מתי, היכן וכיצד תאים נעים; כמה מהר וכמה רחוק תאים נעים; ותדירות חלוקת התאים. בנוסף לתוכנה שלנו, ישנן מספר אפשרויות זמינות מסחרית ובנוי מותאם אישית למעקב אחר תאים 4D. פיתחנו גם את התוכנית LongAxis כדי לבצע פילוח תאים ולכומת את צורת התא ואת הארגון בתוך הרשתית העצבית37. עם זאת, קלט ערכות הנתונים ל- LongAxis הן ערימות Z בודדות, הנלקחות ברזולוציה גבוהה. אתגר מתמשך כבר יצירת ערכות נתונים timelapse עם רזולוציה גבוהה מספיק כי תאים ניתן לפלח בביטחון ואת המורפולוגיה שלהם אקסטרפולציה. חלופה אחת היא תיוג פסיפס (דליל) באמצעות פלואורופור פוטו-קונברלי כמו Kaede להדמיה ישירה של צורת התא, כפי שאנו ואחרים ביצענו בעין המתפתחת8,11,13. פעולה זו מפשטת את בעיית פילוח התא, וניתן לכמת בקלות את צורת התא ואת גודלו באמצעות עיבוד תלת-ממדי ב- FluoRender.
כל שלב בפרוטוקול זה היה מותאם במיוחד למטרות שלנו. הספציפיות של פרוטוקול זה גורמת למספר מגבלות: הפרוטוקול, כפי שנכתב, אינו מותאם להדמיית היבטים אחרים של התפתחות העיניים של דגי הזברה (כגון נוירוגנזה ברשתית), מבני עיניים אחרים, שלבים התפתחותיים אחרים או תאים תת-תאיים אחרים. הכיוון של הטבעה, מהירות ההדמיה והתוויות נועדו כולם לאפשר לנו לענות על השאלות הביולוגיות שלנו. על מנת לדמיין נוירוגנזה רשתית, למשל, הכיוון העושי של העובר כמתואר כאן לא יכול לאפשר הדמיה של תכונות ספציפיות של עניין, ואת מהירות ההדמיה לא יכול להיות מתאים. היבטים רבים של הפרוטוקול ניתן להתאים ולשנות עבור מגוון רחב של צרכים, בהתאם לאינטרסים הספציפיים של האדם ומטרות. ראשית, שימוש בזריקות RNA הופך את תהליך התיוג לגמיש מאוד. ניתן להשתמש במבנים של היתוך חלבון פלואורסצנטי כדי לסמן מבנים תת-תאיים בעלי עניין, וניתן לשנות את כמות הזרקת הרנ"א כדי לייעל את התיוג. בהתבסס על העבודה שלנו עם פלואורופור Kaede photoconver, זריקות RNA נראה לתמוך פרץ של תרגום כי הוא מעל על ידי 12 hpf11,13. רמות גבוהות של ביטוי חלבון פלואורסצנטי מהזרקת RNA יכולות להילחם להלבנה פוטו, אך גישה כזו אינה תומכת בביטוי מתמשך של תווית הפלואורסצנטית של עניין. אם יש צורך בביטוי מתמשך, כגון כאשר עוברים הדמיה בשלבים מאוחרים יותר, קווים מהונדסים הם אופציה, ובניית קווים חדשים בדגי זברה היא פשוטה24.
לאחר מכן, הפרוטוקול יכול להיות מותאם לשלבים מאוחרים יותר של פיתוח. מכיוון פיגמנט עלול לעכב הדמיה בשלבים מאוחרים יותר, עוברים ניתן לטפל עם phenylthiourea (PTU) כדי לעכב היווצרות פיגמנט, או מוטציות גנטיות עבור סינתזת פיגמנטים ניתן להשתמש. כדי למנוע עוויתות עובר, ניתן להוסיף טריקיין לפתרונות כיסוי אגרוז ושכבת-על של אמצעי התקשורת של העובר, וניתן להתאים את אחוז האגורוז לפי הצורך. ככל שהעין גדלה, ייתכן שיהיה צורך לשנות את כיוון ההרכבה; כאן, אנו הר עוברים דורי, אבל בשלבים מאוחרים יותר, זה עשוי להיות הגיוני יותר לעלות לרוחב או לפני העניין, בהתאם למבנה העניין. מכיוון ותהליכים שונים מתרחשים על פני סולמות מרחביים וטמפורליים שונים, ניתן גם למטב את שלב Z ואת שלב הזמן של רכישת תמונה. תכונות אלה יכולות להיקבע רק אמפירית לצרכי כל מעבדה.
לבסוף, פרוטוקול זה פותח במיוחד עבור מיקרוסקופ קונפוקלי סריקת לייזר, עם עוברים מוטבעים באחוז גבוה יחסית של אגרוז בשלב מוקדם של התפתחות העין. אם אחד הוא הדמיה בזמנים שונים או במקומות שונים במהלך פיתוח העין, פרוטוקול זה יצטרך להיות מותאם לתהליך העניין. גישות הדמיה רבות ושונות אפשריות כיום, כאשר יותר מפותחות על ידי מהנדסים אופטיים. כל גישה מביאה מערכת אתגרים משלה, החל מדרכים שונות להטמיע ולהרכיב עוברים להדמיה, ועד לגדלי קבצים ופורמטים שונים. אנו מתארים שיקולים במבוא להנחות את תהליך האופטימיזציה, שבו רזולוציה מרחבית וטמפורלית מקסימלית מאוזנת עם ליבנה, פוטוטוקסיות וגדלי קבצים עצומים. אנו מקווים כי עקרונות כלליים אלה, בנוסף למידע המעשי המתואר לעיל, יסייעו לאחרים בקביעת גישות הדמיה timelapse ללמוד את השאלות הפתוחות הרבות בהתפתחות העין.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לחברי מעבדת קוואן בעבר ובהווה על עבודה על גישות ודיונים על גישות ודיונים על פרוטוקול זה. עבודה זו נתמכה על ידי NIH (R01 EY025378 ו- R01 EY025780 ל- KMK; F31 EY030758 ל- SL; ו-T32 GM007464 ל-MAC).
Materials
| Name | Company | Catalog Number | Comments |
| Delta TPG Dish 0.17mm clear | Bioptechs | 0420041500C | coverglass bottom for optical compatibility |
| Disposable Pasteur Pipettes | VWR | 14672-608 | overall length 14.6 cm (53/4") |
| Dumont #5, #55, or #5SF Forceps | Fine Science Tools | 11254-20 | For style #5: straight tip, 0.05 x 0.01 mm tip, inox, 11 cm long |
| Flaming/Brown Micropipette Puller | Sutter | P-97 | |
| Immersol W | Carl Zeiss Microscopy | 4449690000000 | immersion fluid for water-emission objectives, halogen-free, low fluorescence |
| Microinjection Mold | Adaptive Science Tools | TU-1 | Six ramps, one 90 degree and one 45 degree beveled side. |
| Microloader Tips | Eppendorf | 930001007 | Microloader, tip for filling glass microcapillaries, 0.5 – 20 µL |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | contains SP6 Enzyme Mix, 10X Reaction Buffer, 2XNTP⁄CAP Solution, GTP Solution, pTRI-Xef, TURBO DNase, Ammonium Acetate Stop Solution, Lithium Chloride Precipitation Solution, and Gel Loading Buffer and are all stored at –20°C. Nuclease-free Water may be stored at any temperature. |
| Nikon SMZ645 Stereo Microscope | Nikon | SMZ645 | used for injecting embryos (see Fig. 2B) |
| NotI-HF enzyme | NEB | R3189S | comes with Gel Loading Dye, Purple (6X) |
| NuSieve GTG Agarose | Lonza | 50081 | fine resolution, low melt agarose |
| Objective LD "C-Apochromat" 40x/1.1 W Korr M27 | Carl Zeiss Microscopy | 421867-9970-000 | |
| Olympus SZX16 Stereo Microscope | Olympus | SZX2-ZB16 | used for screening, embedding embryos (see Fig. 3A) |
| Phenol red solution | Sigma-Aldrich | P0290 | 0.5% in DPBS, sterile filtered, endotoxin tested, cell culture tested |
| Pico-liter Microinjector | Harvard Apparatus | PLI-100 | Femtoliter to microliter injections; digital readouts for injection count, time, and pressure; contains 5 pressures including inject, balance, clear, fill, and hold |
| Pipette Pump Pipettor | SP Bel-Art | F37898 | fits a disposable pasteur pipette, contains thumbwheel on side for aspirating or dispensing and plunger for quick emptying |
| Premium Thin Wall Borosilicate Glass Capillaries | Warner Instruments | G100T-4 | 1.0 x 0.78 mm |
| QIAquick PCR Purification Kit | Qiagen | 28106 | contains QIAquick Spin Columns, Buffers, Collection Tubes (2 ml) |
| RNase-free H2O | Invitrogen | AM9906 | DNase-Free, Molecular Biology Grade, RNase-Free |
| RNeasy Mini Kit | Qiagen | 74104 | contains RNeasy Mini Spin Columns, Collection Tubes (1.5 ml and 2 ml), RNase-free Reagents and Buffers |
| Stage Attachment Z PIEZO WSB 500 | Carl Zeiss Microscopy | 432339-9000-000 | |
| Stage Insert Z PIEZO WSB Universal | Carl Zeiss Microscopy | 432339-9030-000 | |
| Zeiss LSM 880 with Airyscan | Carl Zeiss Microscopy | N/A | inverted Axio Observer microscope |
| Zen Black 2.3 SP1 software | Carl Zeiss Microscopy | N/A | Zeiss Efficient Navigation (ZEN) controls all light microscope systems from Zeiss |
References
- Adler, R., Canto-Soler, M. V. Molecular mechanisms of optic vesicle development: complexities, ambiguities and controversies. Developmental Biology. 305 (1), 1-13 (2007).
- Chow, R. L., Lang, R. A. Early eye development in vertebrates. Annual Review of Cell and Developmental Biology. 17, 255-296 (2001).
- Fuhrmann, S. Eye morphogenesis and patterning of the optic vesicle. Current Topics in Developmental Biology. 93, 61-84 (2010).
- Martinez-Morales, J. R., Wittbrodt, J. Shaping the vertebrate eye. Current Opinion in Genetics and Development. 19 (5), 511-517 (2009).
- Yang, X. J. Roles of cell-extrinsic growth factors in vertebrate eye pattern formation and retinogenesis. Seminars in Cell & Developmental Biology. 15 (1), 91-103 (2004).
- Bogdanovic, O., et al. Numb/Numbl-Opo antagonism controls retinal epithelium morphogenesis by regulating integrin endocytosis. Developmental Cell. 23 (4), 782-795 (2012).
- Bryan, C. D., Casey, M. A., Pfeiffer, R. L., Jones, B. W., Kwan, K. M. Optic cup morphogenesis requires neural crest-mediated basement membrane assembly. Development. 147 (4), (2020).
- Bryan, C. D., Chien, C. B., Kwan, K. M. Loss of laminin alpha 1 results in multiple structural defects and divergent effects on adhesion during vertebrate optic cup morphogenesis. Developmental Biology. 416 (2), 324-337 (2016).
- Cavodeassi, F., Ivanovitch, K., Wilson, S. W. Eph/Ephrin signalling maintains eye field segregation from adjacent neural plate territories during forebrain morphogenesis. Development. 140 (20), 4193-4202 (2013).
- England, S. J., Blanchard, G. B., Mahadevan, L., Adams, R. J. A dynamic fate map of the forebrain shows how vertebrate eyes form and explains two causes of cyclopia. Development. 133 (23), 4613-4617 (2006).
- Gordon, H. B., et al. Hedgehog signaling regulates cell motility and optic fissure and stalk formation during vertebrate eye morphogenesis. Development. 145 (22), (2018).
- Ivanovitch, K., Cavodeassi, F., Wilson, S. W. Precocious acquisition of neuroepithelial character in the eye field underlies the onset of eye morphogenesis. Developmental Cell. 27 (3), 293-305 (2013).
- Kwan, K. M., et al. A complex choreography of cell movements shapes the vertebrate eye. Development. 139 (2), 359-372 (2012).
- Martinez-Morales, J. R., et al. Ojoplano-mediated basal constriction is essential for optic cup morphogenesis. Development. 136 (13), 2165-2175 (2009).
- Miesfeld, J. B., et al. Yap and Taz regulate retinal pigment epithelial cell fate. Development. 142 (17), 3021-3032 (2015).
- Nicolas-Perez, M., et al. Analysis of cellular behavior and cytoskeletal dynamics reveal a constriction mechanism driving optic cup morphogenesis. eLife. 5, (2016).
- Picker, A., et al. Dynamic coupling of pattern formation and morphogenesis in the developing vertebrate retina. PLoS Biology. 7 (10), e1000214 (2009).
- Rembold, M., Loosli, F., Adams, R. J., Wittbrodt, J. Individual cell migration serves as the driving force for optic vesicle evagination. Science. 313 (5790), 1130-1134 (2006).
- Sidhaye, J., Norden, C. Concerted action of neuroepithelial basal shrinkage and active epithelial migration ensures efficient optic cup morphogenesis. eLife. 6, (2017).
- Driever, W., et al. A genetic screen for mutations affecting embryogenesis in zebrafish. Development. 123, 37-46 (1996).
- Haffter, P., et al. The identification of genes with unique and essential functions in the development of the zebrafish, Danio rerio. Development. 123, 1-36 (1996).
- Nusslein-Volhard, C. The zebrafish issue of Development. Development. 139 (22), 4099-4103 (2012).
- Hoshijima, K., et al. Highly efficient CRISPR-Cas9-based methods for generating deletion mutations and F0 embryos that lack gene function in zebrafish. Developmental Cell. 51 (5), 645-657 (2019).
- Kwan, K. M., et al. The Tol2kit: a multisite gateway-based construction kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).
- Almeida, A. D., et al. Spectrum of Fates: a new approach to the study of the developing zebrafish retina. Development. 141 (9), 1971-1980 (2014).
- Baye, L. M., Link, B. A. Interkinetic nuclear migration and the selection of neurogenic cell divisions during vertebrate retinogenesis. The Journal of Neuroscience. 27 (38), 10143-10152 (2007).
- Clark, B. S., et al. Loss of Llgl1 in retinal neuroepithelia reveals links between apical domain size, Notch activity and neurogenesis. Development. 139 (9), 1599-1610 (2012).
- Das, T., Payer, B., Cayouette, M., Harris, W. A. In vivo time-lapse imaging of cell divisions during neurogenesis in the developing zebrafish retina. Neuron. 37 (4), 597-609 (2003).
- Kay, J. N., et al. Transient requirement for ganglion cells during assembly of retinal synaptic layers. Development. 131 (6), 1331-1342 (2004).
- Norden, C., Young, S., Link, B. A., Harris, W. A. Actomyosin is the main driver of interkinetic nuclear migration in the retina. Cell. 138 (6), 1195-1208 (2009).
- Suzuki, S. C., et al. Cone photoreceptor types in zebrafish are generated by symmetric terminal divisions of dedicated precursors. Proceedings of the National Academy of Sciences of the United States of America. 110 (37), 15109-15114 (2013).
- Wan, Y., et al. The ciliary marginal zone of the zebrafish retina: clonal and time-lapse analysis of a continuously growing tissue. Development. 143 (7), 1099-1107 (2016).
- Yoshimatsu, T., et al. Presynaptic partner selection during retinal circuit reassembly varies with timing of neuronal regeneration in vivo. Nature Communications. 7, 10590 (2016).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Developmental Dynamics. 203 (3), 253-310 (1995).
- Wan, Y., Otsuna, H., Chien, C. B., Hansen, C. An interactive visualization tool for multi-channel confocal microscopy data in neurobiology research. IEEE Transactions on Visualization and Computer Graphics. 15 (6), 1489-1496 (2009).
- Wan, Y., Otsuna, H., Chien, C. B., Hansen, C. FluoRender: an application of 2D image space methods for 3D and 4D confocal microscopy data visualization in neurobiology research. IEEE Pacific Visualization Symposium. , 201-208 (2012).
- Carney, K. R., Bryan, C. D., Gordon, H. B., Kwan, K. M. LongAxis: a MATLAB-based program for 3D quantitative analysis of epithelial cell shape and orientation. Developmental Biology. 458 (1), 1-11 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved