A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
استخراج وتصور مجاميع البروتين بعد علاج الإشريكية القولونية مع الإجهاد البروتيوكسي
In This Article
Summary
يصف هذا البروتوكول استخراج وتصور البروتينات المجمعة والذوبانة من الإشريكية القولونية بعد العلاج بمضادات الميكروبات البروتوتوكسية. بعد هذا الإجراء يسمح مقارنة نوعية من البروتين تشكيل الكلي في الجسم الحي في سلالات بكتيرية مختلفة و / أو بين العلاجات.
Abstract
وكثيرا ما يتسبب تعرض الكائنات الحية للضغوط البيئية والخلوية في اضطرابات في التوازن البروتيني ويمكن أن يؤدي إلى تجميع البروتين. تراكم مجاميع البروتين في الخلايا البكتيرية يمكن أن يؤدي إلى تغييرات كبيرة في السلوك الظاهري الخلوي، بما في ذلك انخفاض في معدلات النمو، ومقاومة الإجهاد، والفوعة. توجد عدة إجراءات تجريبية لفحص هذه الأنماط الظاهرية بوساطة الإجهاد. تصف هذه الورقة المقايسة المثلى لاستخراج وتصور البروتينات المجمعة والذوبانة من سلالات الإشريكية القولونية المختلفة بعد العلاج بمضادات الميكروبات المحتوية على الفضة الروثينيوم. ومن المعروف أن هذا المركب لتوليد أنواع الأكسجين التفاعلي ويسبب تجميع البروتين على نطاق واسع.
تجمع هذه الطريقة بين الفصل القائم على الطرد المركزي بين مجاميع البروتين والبروتينات القابلة للذوبان من الخلايا المعالجة وغير المعالجة مع الفصل والتصور اللاحقين بواسطة تلطيخ كبريتات الصوديوم -البولي أكريلاميد هلام (SDS-PAGE) وتلطيخ Coomassie. هذا النهج بسيط وسريع ويسمح بإجراء مقارنة نوعية لتشكيل البروتين الكلي في سلالات الإشريكية القولونية المختلفة. المنهجية لديها مجموعة واسعة من التطبيقات، بما في ذلك إمكانية التحقيق في تأثير مضادات الميكروبات البروتيتوكسية الأخرى على تجميع البروتين في الجسم الحي في مجموعة واسعة من البكتيريا. وعلاوة على ذلك، يمكن استخدام البروتوكول لتحديد الجينات التي تسهم في زيادة مقاومة المواد السامة للبروتيتوس. يمكن استخدام نطاقات الجل لتحديد البروتينات اللاحقة المعرضة بشكل خاص للتراكم.
Introduction
البكتيريا تتعرض حتما لعدد لا يحصى من الضغوط البيئية، بما في ذلك انخفاض درجة الحموضة (على سبيل المثال، في معدة الثدييات)1،2، الأكسجين التفاعلي وأنواع الكلور (ROS / RCS) (على سبيل المثال ، أثناء الانفجار التأكسدي في الخلايا الأكسدية)3،4،5، درجات حرارة مرتفعة (على سبيل المثال ، في الينابيع الساخنة أو أثناء الصدمة الحرارية)6،7، والعديد من مضادات الميكروبات القوية (على سبيل المثال ، AGXX المستخدمة في هذا البروتوكول)8. البروتينات هي عرضة بشكل خاص لأي من هذه الضغوطات، والتعرض يمكن أن تثير البروتين الامم المتحدة / طيها ثم تجميع البذور. جميع الكائنات الحية تستخدم أنظمة الحماية التي تسمح لهم للتعامل مع البروتين طي9. ومع ذلك، يمكن أن تطغى الضغوط الشديدة على آلات مراقبة جودة البروتين وتعطيل البنية الثانوية و/أو الثالثة للبروتينات، والتي تؤدي في نهاية المطاف إلى تعطيل البروتينات. ونتيجة لذلك، يمكن أن تضعف مجاميع البروتين بشدة الوظائف الخلوية الحرجة المطلوبة للنمو البكتيري والبقاء على قيد الحياة، ومقاومة الإجهاد، والفوعة10. لذلك ، فإن الأبحاث التي تركز على تجميع البروتين وعواقبه في البكتيريا هي موضوع مهم بسبب تأثيره المحتمل على مكافحة الأمراض المعدية.
البروتين الناجم عن الحرارة تتكشف والتجميع وغالبا ما تكون عكسها7. في المقابل، يمكن أن تسبب الضغوط البروتيوكسية الأخرى، مثل الإجهاد التأكسدي، تعديلات بروتينية لا رجعة فيها من خلال أكسدة سلاسل جانبية محددة من الأحماض الأمينية مما يؤدي إلى البروتين un-/misfolding، وفي نهاية المطاف، تجميع البروتين4. وقد درس تشكيل الإجهاد الناجم عن المجاميع البروتين غير قابل للذوبان على نطاق واسع في سياق المرافقين الجزيئية ووظائفها الوقائية في الخميرة والبكتيريا11،12،13. وقد تم نشر العديد من البروتوكولات التي تستخدم مجموعة متنوعة من التقنيات الكيميائية الحيوية لعزل وتحليل المجاميع البروتين غير القابلة للذوبان14،15،16،17. وقد استخدمت البروتوكولات القائمة أساسا لدراسة تجميع البروتين البكتيري عند الصدمة الحرارية و / أو تحديد المرافقين الجزيئية. في حين أن هذه البروتوكولات كانت بالتأكيد تقدما في هذا المجال ، هناك بعض المضايقات الرئيسية في الإجراءات التجريبية لأنها تتطلب (1) حجم ثقافة بكتيرية كبيرة تصل إلى 10 L14،17، (ii) عمليات التعطيل المادي المعقدة ، بما في ذلك استخدام أجهزة تعطيل الخلايا ، والصحافة الفرنسية ، و / أو سونيكيشن14،15،17، أو (3) تستغرق وقتا طويلا غسل واحتضان الخطوات15،16،17.
تصف هذه الورقة بروتوكولا معدلا يهدف إلى معالجة قيود النهج السابقة ويسمح بتحليل كمية مجاميع البروتين التي تشكلت في نوعين مختلفين من سلالات الإشريكية القولونية بعد العلاج بطلاء سطح مضاد للميكروبات بروتيتيوكسي. يتكون الطلاء من الفضة المعدنية (Ag) والروثينيوم (Ru) مكيفة بحمض الأسكوربيك ، ويتحقق نشاطها المضاد للميكروبات من خلال توليد أنواع الأكسجينالتفاعلية 8،18. هنا هو وصف مفصل لإعداد الثقافة البكتيرية بعد العلاج مع مركب مضاد للميكروبات ومقارنة حالة تجميع البروتين عند التعرض لسلالات كولاي اثنين مع ملامح قابلية متميزة لزيادة تركيز مضادات الميكروبات. الطريقة الموصوفة غير مكلفة وسريعة وقابلة للاستنساخ ويمكن استخدامها لدراسة تجميع البروتين في وجود مركبات بروتوتوكسية أخرى. بالإضافة إلى ذلك، يمكن تعديل البروتوكول لتحليل تأثير حذف الجينات المحددة على تجميع البروتين في مجموعة متنوعة من البكتيريا المختلفة.
Protocol
1. علاج الإجهاد من سلالات الإشريكية القولونية MG1655 و CFT073
- تلقيح 5 مل من مرق الليوجيني (LB) المتوسطة مع مستعمرة واحدة من commensal E. القولونية سلالة MG1655 وuropathogenic E. القولونية (UPEC) سلالة CFT073، على التوالي، واحتضان لمدة 14-16 ساعة (بين عشية وضحاها) في 37 درجة مئوية و 300 دورة في الدقيقة.
ملاحظة: إيشريشيا كولاي CFT073 هو ممرض الإنسان. يجب أن يتم التعامل مع CFT073 مع تدابير السلامة البيولوجية المناسبة في مختبر معتمد من المستوى 2 للسلامة البيولوجية. - تمييع كل سلالة في قارورة 500 مل تحتوي على 70 مل من 3-(N-morpholino) حمض البروبانسولفونيك (MOPS) - الجلوكوز (MOPS-g) (الجدول 1) متوسطة إلى كثافة بصرية في 600 نانومتر (OD600) قيمة 0.1. حضانة عند 37 درجة مئوية و 300 دورة في الدقيقة حتى منتصف مرحلة السجل يتم التوصل (OD600 = 0.5-0.55).
- نقل 20 مل من كل ثقافة إلى ثلاث قوارير 125 مل قبل الحرب واحتضانها عند 37 درجة مئوية و300 دورة في الدقيقة لمدة دقيقتين.
ملاحظة: كما هو مطلوب معالجة العينات في الوقت المناسب معالجة لا يزيد عن 6 cultures في كل مرة. - إعداد محلول مركب مضاد للميكروبات في المتوسط MOPS-g بتركيز 2 ملغم/مل. إضافة مضادات الميكروبات إلى كل ثقافة للوصول إلى التركيزات المشار إليها. للتحكم غير المعالج، أضف الحجم المطلوب من وسيط MOPS-g.
ملاحظة: دوامة محلول مضاد للميكروبات 2 ملغم/مل للسماح بتوزيع متساو للجسيمات المركبة وتجنب الترسيب. - احتضان الثقافات لمدة 45 دقيقة عند 37 درجة مئوية و 300 دورة في الدقيقة.
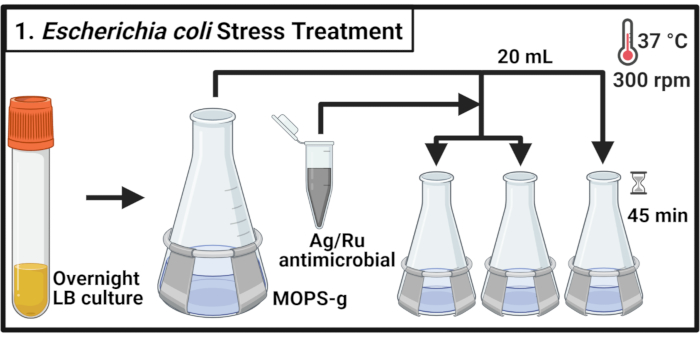
الشكل 1: علاج الإجهاد الإشريكية القولونية. تزرع الثقافات البكتيرية في MOPS-g وتعالج بتركيزات المشار إليها من مضادات الميكروبات المحتوية على الفضة الروثينيوم عند الوصول إلى مرحلة منتصف السجل. الاختصارات: LB = مرق الليوجيني؛ Ag-Ru = الفضة الروثينيوم; MOPS-g = 3-(N-morpholino) حمض البروبانسولفونيك (MOPS) - الجلوكوز. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. جمع عينات الخلايا البكتيرية
- بعد 45 دقيقة من علاج الإجهاد، حدد OD600 من كل ثقافة. وبالنسبة لكل عينة، تحصد الخلايا ما يعادل 4 مل من الأوزون600 = 1 في 15 مل من أنابيب الطرد المركزي عن طريق الطرد المركزي لمدة 15 دقيقة عند 3000 × غرام و4 درجات مئوية.
- إزالة تماما supernatant وإعادة إنفاق الكريات الخلية في 50 ميكرولتر من الجليد الباردة تحلل العازلة (الجدول 1). احتضان العينات لمدة 30 دقيقة على الجليد.
ملاحظة: هذه الخطوة تحلل طبقة بيبتيدوغليكان. استخدم دائما مخزن تحلل حديث الإعداد. - نقل العينات إلى أنابيب 1.7 مل من أجهزة الطرد المركزي الدقيق. تجميد عند -80 درجة مئوية حتى مزيد من الاستخدام.
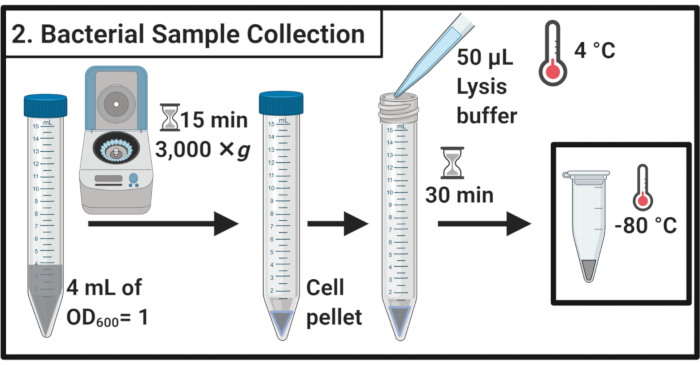
الشكل 2: جمع عينات بكتيرية. يتم حصاد عينات الخلايا عن طريق الطرد المركزي وإعادة إنفاقها في مخزن تحلل متبوعا بالتخزين عند -80 درجة مئوية.
3. استخراج المجاميع البروتين غير قابل للذوبان
- تذوب العينات على الجليد.
ملاحظة: دورة التجميد-ذوبان يساهم في تحلل الخلية. - إضافة 360 ميكرولتر من الجليد الباردة العازلة A (الجدول 1) وتخلط بلطف عن طريق pipetting.
ملاحظة: سوف تسهم الصدمة التناضحية أيضا في تحلل الخلية. - نقل العينة إلى أنبوب 2 مل من أجهزة الطرد المركزي الدقيقة التي تحتوي على ~ 200 ميكرولتر من الخرز الزجاجي 0.5 ملم. احتضان لمدة 30 دقيقة في 8 درجة مئوية في thermomixer مع اهتزاز في 1400 دورة في الدقيقة.
ملاحظة: هذه الخطوة ينتج عن تعطيل فعلي للخلية. يمكن استخدام مثبط البروتيز لتقليل تدهور البروتين. يمكن إجراء التعطيل عند 4 درجات مئوية. لاحظ أنه تم الإبلاغ عن استخدام الخرز الزجاجي للحث على تجميع مجموعة فرعية صغيرة من البروتينات في الخميرة19. - احتضان لمدة 5 دقائق على الجليد دون اهتزاز لتسوية الخرز الزجاجي. نقل 200 ميكرولتر من lysate الخلية إلى أنابيب الطرد المركزي الدقيق 1.7 مل.
ملاحظة: تجنب نقل الخرز الزجاجي. - جهاز طرد مركزي عند 16,000 × غرام و4 درجات مئوية لمدة 20 دقيقة. جمع supernatant، الذي يحتوي على البروتينات القابلة للذوبان، والمضي قدما إلى القسم 4.
- Resuspend بيليه في 200 ميكرولتر من الجليد الباردة العازلة A (الجدول 1) باستخدام ماصة. جهاز طرد مركزي عند 16,000 × غرام و4 درجات مئوية لمدة 20 دقيقة. إزالة بعناية فائقة تماما.
- إضافة 200 ميكرولتر من الجليد الباردة العازلة B (انظر الجدول 1 وجدول المواد)وإعادة إنفاق بعناية بيليه عن طريق pipetting.
ملاحظة: المنظفات غير الأيونية تعمل على تليين بروتين الغشاء. - كرر جهاز الطرد المركزي عند 16000 × غرام و 4 درجات مئوية لمدة 20 دقيقة. إزالة بعناية فائقة.
- Resuspend بيليه في 200 ميكرولتر من العازلة الباردة A (الجدول 1) عن طريق pipetting. جهاز طرد مركزي عند 16,000 × غرام و4 درجات مئوية لمدة 20 دقيقة. إزالة تماما supernatant.
- Resuspend بيليه في 100 ميكرولتر من 1x الحد من التخزين المؤقت عينة SDS (الجدول 1) ويغلي لمدة 5 دقائق في 95 درجة مئوية في thermomixer.
- تخزين العينة في -20 درجة مئوية للمتابعة في وقت لاحق أو تحميل فورا على هلام البولي أكريلاميد SDS لفصل.
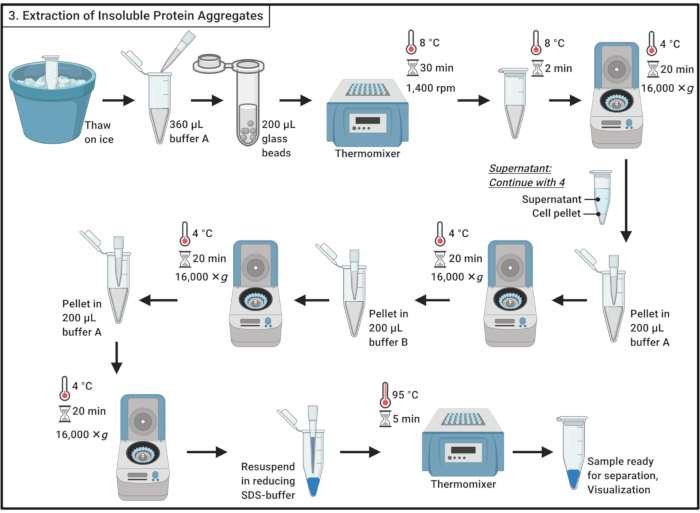
الشكل 3:استخراج مجاميع البروتين غير القابلة للذوبان. استخراج المجاميع البروتين ينطوي على سلسلة من الخطوات بما في ذلك تعطيل الخلايا، وفصل المجاميع البروتين من البروتينات القابلة للذوبان، وذوبان البروتينات الغشائية، والغسيل. اختصار: SDS = كبريتات دودسيل الصوديوم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. إعداد عينة البروتين القابل للذوبان
- مزيج 1 حجم 100٪ حمض ثلاثي الكلور (TCA) مع 4 مجلدات من عينة البروتين القابل للذوبان من الخطوة 3.6.
ملاحظة: يتطلب التعامل مع TCA غطاء الدخان ومعدات الحماية الشخصية وإجراء التخلص من النفايات المعتمدة. - احتضان لمدة 10 دقيقة في 4 درجة مئوية للسماح لهطول الأمطار البروتين.
ملاحظة: سوف تظهر الترسب الأبيض قريبا جدا. - الطرد المركزي للتعجيل في 21،000 × غرام و 4 درجة مئوية لمدة 5 دقائق وإزالة supernatant. غسل بيليه مع 200 ميكرولتر من الأسيتون الجليد الباردة لإزالة الحطام الخلوي. جهاز الطرد المركزي في 21،000 × غرام و 4 درجة مئوية لمدة 5 دقائق وإزالة supernatant. كرر هذه الإجراءات في الخطوة 4.3 ما مجموعه ثلاث مرات.
- ضع أنابيب الطرد المركزي الدقيق ذات الأغطية المفتوحة في ثيرموميكسير عند 37 درجة مئوية لإزالة الأسيتون المتبقي من الكريات.
ملاحظة: حضانة أكثر من 5 دقائق قد يقلل من قابلية الذوبان من بيليه البروتين. - إضافة 100 ميكرولتر من 1x الحد من المخزن المؤقت SDS (الجدول 1) وحل تماما بيليه. غلي العينة لمدة 5 دقائق في 95 درجة مئوية.
- تخزين عينة في -20 درجة مئوية للمتابعة في وقت لاحق أو تحميل فورا على هلام بولياكريلاميد SDS لفصل.
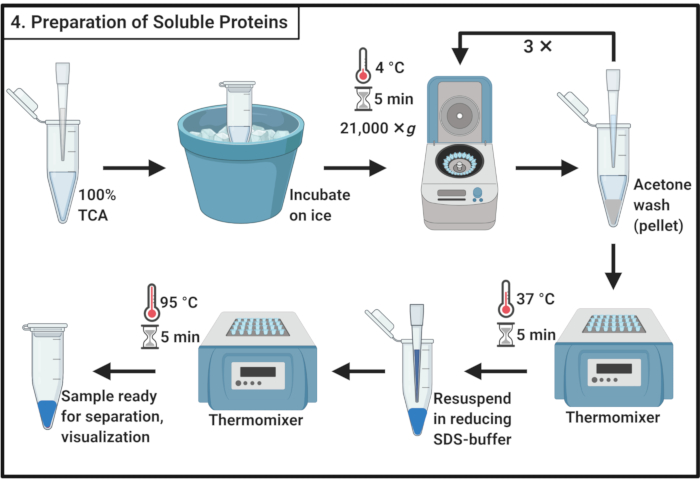
الشكل 4:إعداد البروتينات القابلة للذوبان. إعداد البروتين القابل للذوبان ينطوي على خطوة هطول الأمطار مع حمض ثلاثي الكلور والغسيل المتكرر مع الأسيتون الجليد الباردة. المختصرات: TCA = حمض ثلاثي الكلور؛ SDS = كبريتات دودسيل الصوديوم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. الفصل والتصور من المجاميع البروتين المستخرج باستخدام SDS-PAGE
- إعداد هلام SDS-polyacrylamide 12٪.
- لاثنين من المواد الهلامية فصل، ماصة 5.1 مل من الماء المقطر المزدوج (ddH2O)، 3.75 مل من تريس-HCl (درجة الحموضة 8.8)، 7.5 مل من 20٪ (ث / v) SDS، 6 مل من 30٪ من مادة الأكريلاميد/بيساكريلاميد (29:1) محلول، و75 مل من 10٪ ث/v الأمونيوم كبريتات، و10 مل من رباعي ميثيل إيثيلينديامين (TEMED) في أنبوب طرد مركزي سعة 15 مل وخلطه برفق دون إدخال فقاعات الهواء. صب هلام باستخدام ماصة 1 مل داخل لوحات زجاجية، وترك العليا 2 سم خالية من الخليط. إضافة الإيثانول 70٪ على الجزء العلوي من هلام فصل والسماح لواجهة حتى بين الطبقتين.
- بعد بلمرة من هلام فصل، وإعداد هلام التراص عن طريق الأنابيب 1.535 مل من ddH2O، 625 مل من تريس-HCl (pH 6.8)، 12.5 مل من 20٪ (ث / v) SDS، 335 مل من 30٪ من الأكريلاميد / بيساكريلاميد (29:1) الحل، 12.5 مل من 10٪ ث / v كبريتات الأمونيوم، و 2.5 مل من TEMED. إزالة الإيثانول من المواد الهلامية فصل وإضافة محلول هلام التراص. أدخل مشطا مع العدد المطلوب من الجيوب دون إدخال فقاعات الهواء. السماح البلمرة لمدة 20-30 دقيقة.
- تحميل 4 ميكرولتر من كل عينة وسلم البروتين في آبار منفصلة وتشغيل هلام (ق) في تريس الجليسين تشغيل العازلة (الجدول 1) في 144 V لمدة 45 دقيقة في درجة حرارة الغرفة.
ملاحظة: إيقاف الجل عندما الفرقة بروموفينول على وشك الهجرة من هلام. - وصمة عار الجل (ق) في حل فيربانكس قبل الحرب ألف (الجدول 1) لمدة 30 دقيقة على الروك.
- Decolor الجل (ق) في حل فيربانكس قبل الحرب D (الجدول 1) حتى الخلفية المطلوبة (على سبيل المثال، بين عشية وضحاها) على الروك.
الشكل 5: فصل البروتين والتصور. يتم فصل العينات من قبل SDS-PAGE وتصورها تلطيخ Coomassie. اختصار: SDS-PAGE = الصوديوم دودسيل كبريتات البولي أكريلاميد هلام الكهربائي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
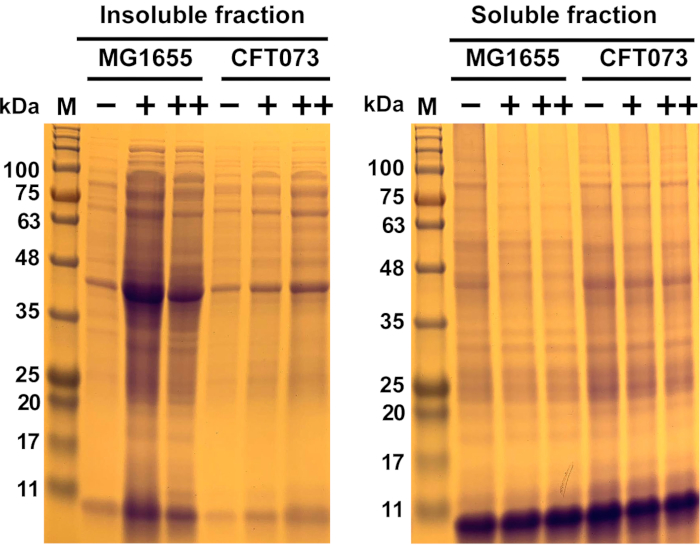
الشكل 6:النتائج التمثيلية لتجميع البروتين الناجم عن مضادات الميكروبات في سلالة الإشريكية القولونية COMMENSAL Escherichia MG1655 وسلالة UPEC CFT073. سلالات الإشريكية القولونية MG1655 وCFT073 نمت عند 37 درجة مئوية ?...
Discussion
يصف هذا البروتوكول منهجية محسنة لتحليل التكوين الكلي للبروتين بعد علاج سلالات الإشريكية القولونية المختلفة بمضادات الميكروبات البروتوتوكسية. يسمح البروتوكول بالاستخراج المتزامن لكسور البروتين غير القابلة للذوبان والذوبان من خلايا الإشريكية القولونية المعالجة وغير المعالج?...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
تم دعم هذا العمل من قبل صناديق بدء تشغيل كلية العلوم البيولوجية بجامعة ولاية إلينوي ، ومنحة مبادرة كلية ولاية إلينوي الجديدة ، ومنحة NIAID R15AI164585 (إلى J.-U. D.). G.M.A. كان مدعوما من قبل جامعة ولاية إلينوي برنامج دعم البحوث الجامعية (إلى G.M.A.). 10- وتحظى ك. ب. ه. بدعم من زمالة RISE التي قدمتها دائرة التبادل الأكاديمي الألمانية .. يشكر المؤلفان الدكتور أوي لانداو والدكتور كارستن ماير من Largentech Vertriebs GmbH على توفير مسحوق AGXX. تم إنشاء الأرقام 1 ، الشكل 2، الشكل 3، الشكل 4، والشكل 5 مع Biorender.
Materials
| Name | Company | Catalog Number | Comments |
| Chemicals/Reagents | |||
| Acetone | Fisher Scientific | 67-64-1 | |
| 30% Acrylamide/Bisacrylamide solution 29:1 | Bio-Rad | 1610156 | |
| Ammonium persulfate | Millipore Sigma | A3678-100G | |
| Benzonase nuclease | Sigma | E1014-5KU | |
| Bluestain 2 Protein ladder, 5-245 kDa | GoldBio | P008-500 | |
| β-mercaptoethanol | Millipore Sigma | M6250-100ML | |
| Bromophenol blue | GoldBio | B-092-25 | |
| Coomassie Brilliant Blue R-250 | MP Biomedicals LLC | 821616 | |
| D-Glucose | Millipore Sigma | G8270-1KG | |
| D-Sucrose | Acros Organics | 57-50-1 | |
| Ethylenediamine tetra acetic acid (EDTA) | Sigma-Aldrich | SLBT9686 | |
| Glacial Acetic acid | Millipore Sigma | ARK2183-1L | |
| Glycerol, 99% | Sigma-Aldrich | G5516-1L | |
| Glycine | GoldBio | G-630-1 | |
| Hydrochloric acid, ACS reagent | Sigma-Aldrich | 320331-2.5L | |
| Isopropanol (2-Propanol) | Sigma | 402893-2.5L | |
| LB broth (Miller) | Millipore Sigma | L3522-1KG | |
| LB broth with agar (Miller) | Millipore Sigma | L2897-1KG | |
| Lysozyme | GoldBio | L-040-25 | |
| 10x MOPS Buffer | Teknova | M2101 | |
| Nonidet P-40 | Thomas Scientific | 9036-19-5 | |
| Potassium phosphate, dibasic | Sigma-Aldrich | P3786-1KG | |
| Potassium phosphate, monobasic | Acros Organics | 7778-77-0 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771-500G | |
| Tetramethylethylenediamine (TEMED) | Millipore Sigma | T9281-50ML | |
| Thiamine | Sigma-Aldrich | T4625-100G | |
| 100% Trichloroacetic acid | Millipore Sigma | T6399-100G | |
| Tris base | GoldBio | T-400-1 | |
| Material/Equipment | |||
| Centrifuge tubes (15 mL) | Alkali Scientific | JABG-1019 | |
| Erlenmeyer flask (125 mL) | Carolina | 726686 | |
| Erlenmeyer flask (500 mL) | Carolina | 726694 | |
| Freezer: -80 °C | Fisher Scientific | ||
| Glass beads (0.5 mm) | BioSpec Products | 1107-9105 | |
| Microcentrifuge | Hermle | Z216MK | |
| Microcentriguge tubes (1.7 mL) | VWR International | 87003-294 | |
| Microcentriguge tubes (2.0 mL) | Axygen Maxiclear Microtubes | MCT-200-C | |
| Plastic cuvettes | Fischer Scientific | 14-377-012 | |
| Power supply | ThermoFisher Scientific | EC105 | |
| Rocker | Alkali Scientific | RS7235 | |
| Shaking incubator (37 °C) | Benchmark Scientific | ||
| Small glass plate | Bio-Rad | 1653311 | |
| Spacer plates (1 mm) | Bio-Rad | 1653308 | |
| Spectrophotometer | Thermoscientific | 3339053 | |
| Tabletop centrifuge for 15 mL centrifuge tubes | Beckman-Coulter | ||
| Vertical gel electrophoresis chamber | Bio-Rad | 1658004 | |
| Vortexer | Fisher Vortex Genie 2 | 12-812 | |
| Thermomixer | Benchmark Scientific | H5000-HC | |
| 10 well comb | Bio-Rad | 1653359 |
References
- Dahl, J. -. U., et al. HdeB functions as an acid-protective chaperone in bacteria. Journal of Biological Chemistry. 290 (1), 65-75 (2015).
- Foit, L., George, J. S., Zhang, B. W., Brooks, C. L., Bardwell, J. C. A. Chaperone activation by unfolding. Proceedings of the National Academy of Sciences of the United States of America. 110 (14), 1254-1262 (2013).
- Sultana, S., Foti, A., Dahl, J. -. U. Bacterial defense systems against the neutrophilic oxidant hypochlorous acid. Infection and Immunity. 88 (7), 00964 (2020).
- Dahl, J. -. U., Gray, M. J., Jakob, U. Protein quality control under oxidative stress conditions. Journal of Molecular Biology. 427 (7), 1549-1563 (2015).
- Groitl, B., Dahl, J. -. U., Schroeder, J. W., Jakob, U. Pseudomonas aeruginosa defense systems against microbicidal oxidants. Molecular Microbiology. 106 (3), 335-350 (2017).
- Casadevall, A. Thermal restriction as an antimicrobial function of fever. PLoS Pathogens. 12 (5), 1005577 (2016).
- Richter, K., Haslbeck, M., Buchner, J. The heat shock response: life on the verge of death. Molecular Cell. 40 (2), 253-266 (2010).
- Van Loi, V., Busche, T., Preuß, T., Kalinowski, J., Bernhardt, J. The AGXX ® antimicrobial coating causes a thiol-specific oxidative stress response and protein S-bacillithiolation in Staphylococcus aureus. Frontiers in Microbiology. 9, 3037 (2018).
- Anfinsen, C. B., Scheraga, H. A. Experimental and theoretical aspects of protein folding. Advances in Protein Chemistry. 29, 205-300 (1975).
- Schramm, F. D., Schroeder, K., Jonas, K. Protein aggregation in bacteria. FEMS Microbiology Reviews. 44 (1), 54-72 (2020).
- Tomoyasu, T., Mogk, A., Langen, H., Goloubinoff, P., Bukau, B. Genetic dissection of the roles of chaperones and proteases in protein folding and degradation in the Escherichia coli cytosol. Molecular Microbiology. 40 (2), 397-413 (2001).
- Gray, M. J., et al. Polyphosphate is a primordial chaperone. Molecular Cell. 53 (5), 689-699 (2014).
- Weids, A. J., Ibstedt, S., Tamás, M. J., Grant, C. M. Distinct stress conditions result in aggregation of proteins with similar properties. Scientific Reports. 6, 24554 (2016).
- Mogk, A., et al. Identification of thermolabile Escherichia coli proteins: prevention and reversion of aggregation by DnaK and ClpB. EMBO Journal. 18 (24), 6934-6949 (1999).
- Fay, A., Glickman, M. S. An essential nonredundant role for mycobacterial DnaK in native protein folding. PLoS Genetics. 10 (7), 1004516 (2014).
- Schramm, F. D., Heinrich, K., Thüring, M., Bernhardt, J., Jonas, K. An essential regulatory function of the DnaK chaperone dictates the decision between proliferation and maintenance in Caulobacter crescentus. PLoS Genetics. 13 (12), 1007148 (2017).
- Maisonneuve, E., Fraysse, L., Moinier, D., Dukan, S. Existence of abnormal protein aggregates in healthy Escherichia coli cells. Journal of Bacteriology. 190 (3), 887-893 (2008).
- Heiss, A., Freisinger, B., Held-Föhn, E. Enhanced antibacterial activity of silver-ruthenium coated hollow microparticles. Biointerphases. 12 (5), (2017).
- Papnayotou, I., Sun, B., Roth, A. F., Davis, N. G. Protein aggregation induced during glass bead lysis of yeast. Yeast. 27 (10), 801-816 (2010).
- Chuang, S. E., Blattner, F. R. Characterization of twenty-six new heat shock genes of Escherichia coli. Journal of Bacteriology. 175 (16), 5242-5252 (1993).
- Imlay, J. A. The molecular mechanisms and physiological consequences of oxidative stress: Lessons from a model bacterium. Nature Reviews Microbiology. 11 (7), 443-454 (2013).
- Mühlhofer, M., et al. The heat shock response in yeast maintains protein homeostasis by chaperoning and replenishing proteins. Cell Reports. 29 (13), 4593-4607 (2019).
- Chandrangsu, P., Rensing, C., Helmann, J. D. Metal homeostasis and resistance in bacteria. Nature Reviews Microbiology. 15, 338-350 (2017).
- Stevens, M., et al. HSP60/10 chaperonin systems are inhibited by a variety of approved drugs, natural products, and known bioactive molecules. Bioorganic and Medicinal Chemistry Letters. 29 (9), 1106-1112 (2019).
- Schramm, F. D., Schroeder, K., Alvelid, J., Testa, I., Jonas, K. Growth-driven displacement of protein aggregates along the cell length ensures partitioning to both daughter cells in Caulobacter crescentus. Molecular Microbiology. 111 (6), 1430-1448 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved