Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Экстракция и визуализация белковых агрегатов после лечения кишечной палочки протеотоксическим стрессором
В этой статье
Резюме
Этот протокол описывает экстракцию и визуализацию агрегированных и растворимых белков из кишечной палочки после лечения протеотоксическим противомикробным средством. Следование этой процедуре позволяет качественно сравнивать образование белковой агрегированности in vivo в различных бактериальных штаммах и/или между обработками.
Аннотация
Воздействие на живые организмы экологических и клеточных стрессов часто вызывает нарушения гомеостаза белка и может привести к агрегации белка. Накопление белковых агрегатов в бактериальных клетках может привести к значительным изменениям в клеточном фенотипической поведения, включая снижение темпов роста, стрессоустойчивости и вирулентности. Существует несколько экспериментальных процедур для изучения этих фенотипов, опосредованных стрессорами. В данной работе описан оптимизированный анализ для экстракции и визуализации агрегированных и растворимых белков из различных штаммов кишечной палочки после обработки серебристо-рутениемсодержащим антимикробным средством. Известно, что это соединение генерирует активные формы кислорода и вызывает широко распространенную агрегацию белка.
Метод сочетает в себе центрифугирование на основе разделения белковых агрегатов и растворимых белков из обработанных и необработанных клеток с последующим разделением и визуализацией путем электрофореза додецилсульфат-полиакриламидного геля натрия (SDS-PAGE) и окрашивания Coomassie. Такой подход прост, быстр и позволяет качественно сравнить образование белкового агрегата у разных штаммов E. coli. Методика имеет широкий спектр применения, включая возможность исследования влияния других протеотоксических противомикробных препаратов на агрегацию белка in vivo в широком спектре бактерий. Более того, протокол может быть использован для выявления генов, способствующих повышению устойчивости к протеотоксическим веществам. Гелевые полосы могут быть использованы для последующей идентификации белков, которые особенно склонны к агрегации.
Введение
Бактерии неизбежно подвергаются воздействию множества экологических стрессов, включая низкий рН (например, в желудке млекопитающих)1,2,активные формы кислорода и хлора (ROS / RCS) (например, во время окислительного всплеска в фагоцитах)3,4,5, повышенные температуры (например, в горячих источниках или во время теплового шока)6,7и несколько мощных противомикробных препаратов (например, AGXX, используемый в этом протоколе)8. Белки особенно уязвимы к любому из этих стрессоров, и воздействие может спровоцировать несложение белка, которое затем сеет агрегацию. Все организмы используют защитные системы, которые позволяют им справляться с неправильным свораскиванием белка9. Однако сильный стресс может перегрузить механизм контроля качества белка и нарушить вторичную и /или третичную структуру белков, что в конечном итоге инактивирует белки. Как следствие, белковые агрегаты могут серьезно ухудшить критические клеточные функции, необходимые для роста и выживания бактерий, стрессоустойчивости и вирулентности10. Поэтому исследования, посвященные агрегации белка и ее последствиям у бактерий, является актуальной темой из-за ее потенциального влияния на борьбу с инфекционными заболеваниями.
Тепловое развертывание и агрегация белка часто обратимы7. Напротив, другие протеотоксические стрессы, такие как окислительный стресс, могут вызывать необратимые модификации белка путем окисления определенных аминокислотных боковых цепей, что приводит к разложению белка и, в конечном итоге, агрегации белка4. Стресс-индуцированное образование нерастворимых белковых агрегатов широко изучено в контексте молекулярных шаперонов и их защитных функций у дрожжей и бактерий11,12,13. Было опубликовано несколько протоколов, которые используют различные биохимические методы для выделения и анализа нерастворимых белковых агрегатов14,15,16,17. Существующие протоколы в основном использовались для изучения агрегации бактериального белка при тепловом шоке и/или идентификации молекулярных шаперонов. Хотя эти протоколы, безусловно, были продвижением в этой области, в экспериментальных процедурах есть некоторые серьезные неудобства, поскольку они требуют (i) большого объема бактериальной культуры до 10 л14,17, (ii) сложных процессов физического разрушения, включая использование разрушителей клеток, френч-пресса и / или ультразвуковойобработка 14,15,17или (iii) трудоемкие повторяющиеся этапы промывки и инкубации15,16,17.
В данной работе описывается модифицированный протокол, направленный на устранение ограничений предыдущих подходов и позволяющий анализировать количество белковых агрегатов, образующихся в двух различных штаммах кишечной палочки после обработки протеотоксичным антимикробным поверхностным покрытием. Покрытие состоит из металл-серебра (Ag) и рутения (Ru)-кондиционированного аскорбиновой кислотой, а его антимикробная активность достигается за счет генерации активных форм кислорода8,18. Приведено подробное описание получения бактериальной культуры после обработки антимикробным соединением и сравнение состояния агрегации белка при воздействии двух штаммов E. coli с различными профилями восприимчивости к повышению концентрации противомикробного препарата. Описанный способ является недорогим, быстрым и воспроизводимым и может быть использован для изучения агрегации белка в присутствии других протеотоксических соединений. Кроме того, протокол может быть модифицирован для анализа влияния, которое конкретные делеции генов оказывают на агрегацию белка у множества различных бактерий.
протокол
1. Стресс-лечение штаммов E. coli MG1655 и CFT073
- Инокулируют 5 мл среды лизогенезного бульона (ЛБ) одной колонией комменсального штамма E. coli MG1655 и уропатогенного штамма E. coli (УПЭК) CFT073 соответственно и инкубируют в течение 14-16 ч (ночью) при 37 °C и 300 об/мин.
ПРИМЕЧАНИЕ: Escherichia coli CFT073 является патогеном человека. Обработка CFT073 должна осуществляться с соответствующими мерами биобезопасности в лаборатории, сертифицированной уровнем биобезопасности 2. - Разбавляют каждый штамм в колбу 500 мл, содержащую70 мл 3-(N-морфолино)пропансульфоновой кислоты (MOPS)-глюкозы (MOPS-g)(таблица 1)среды до оптической плотности при значении 600 нм (OD600)0,1. Инкубировать при 37 °C и 300 об/мин до достижения средней фазы (OD600 = 0,5-0,55).
- Переложить 20 мл каждой культуры в три предварительно высушенные колбы по 125 мл и инкубировать при 37 °C и 300 об/мин в течение 2 мин.
ПРИМЕЧАНИЕ: Поскольку требуется своевременная обработка образцов, обрабатывайте не более 6 культур одновременно. - Готовят раствор антимикробного соединения в среде MOPS-g в концентрации 2 мг/мл. Добавляют противомикробное противомикробное средстве в каждую культуру для достижения указанных концентраций. Для необработанных элементов управления добавьте необходимый объем среды MOPS-g.
ПРИМЕЧАНИЕ: Вихрь антимикробного раствора 2 мг/мл, чтобы обеспечить равномерное распределение частиц соединения и избежать осаждения. - Инкубировать культуры в течение 45 мин при 37 °C и 300 об/мин.
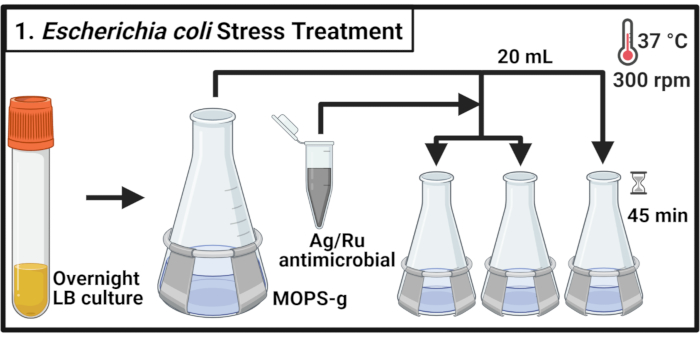
Рисунок 1:Лечение стресса Escherichia coli. Бактериальные культуры выращивают в МОПС-г и обрабатывают указанными концентрациями серебро-рутений-содержащего противомикробного препарата при достижении средней фазы. Сокращения: LB = лизогенный бульон; Ag-Ru = серебро-рутениевый; MOPS-g = 3-(N-морфолино)пропансульфоновая кислота (MOPS)-глюкоза. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Сбор образцов бактериальных клеток
- После 45 мин лечения стрессом определяют ОД600 каждой культуры. Для каждого образца собирают клетки, эквивалентные 4 мл ОД600 = 1 в 15 мл центрифужных трубок путем центрифугирования в течение 15 мин при 3000 × г и 4 °C.
- Полностью удалить супернатант и повторно суспендируют клеточные гранулы в 50 мкл ледяного лизисного буфера(таблица 1). Инкубировать образцы в течение 30 мин на льду.
ПРИМЕЧАНИЕ: Этот этап лизиса ухудшает слой пептидо сликана. Всегда используйте свежеприготовленный буфер лизиса. - Перенесите образцы в микроцентрифужные трубки по 1,7 мл. Заморозить при -80 °C до дальнейшего использования.
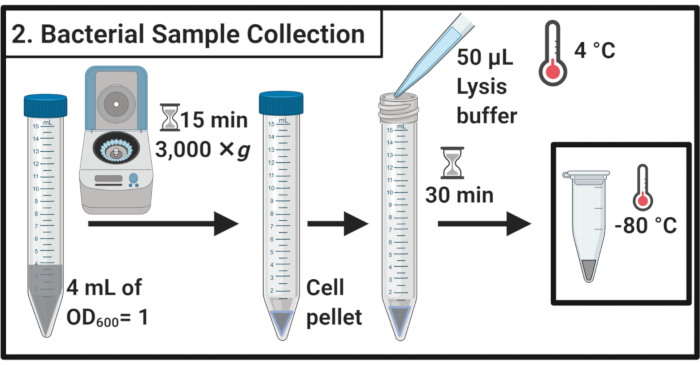
Рисунок 2:Забор образцов бактерий. Образцы клеток собираются путем центрифугирования и повторно суспендируются в буфере лизиса с последующим хранением при -80 °C. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Извлечение нерастворимых белковых агрегатов
- Оттаивать образцы на льду.
ПРИМЕЧАНИЕ: Цикл замораживания-оттаивания способствует лизису клеток. - Добавьте 360 мкл ледяного буфера А(таблица 1)и аккуратно перемешайте путем пипетки.
ПРИМЕЧАНИЕ: Осмотический шок также будет способствовать лизису клеток. - Перенесите образец в микроцентрифужную трубку размером 2 мл, содержащую ~200 мкл стеклянных шариков толщиной 0,5 мм. Инкубировать в течение 30 мин при 8 °C в термомиксаторе с встряхиванием при 1 400 об/мин.
ПРИМЕЧАНИЕ: Этот шаг приводит к физическому нарушению работы клетки. Ингибитор протеазы может быть использован для минимизации деградации белка. Разрушение может быть выполнено при 4 °C. Обратите внимание, что использование стеклянных шариков, как сообщается, вызывает агрегацию небольшого подмножества белков в дрожжах19. - Инкубировать в течение 5 мин на льду без встряхивания, чтобы осесть стеклянные шарики. Перенесите 200 мкл клеточного лизата в микроцентрифужные трубки 1,7 мл.
ПРИМЕЧАНИЕ: Избегайте переноса стеклянных бусин. - Центрифуга при 16 000 × г и 4 °C в течение 20 мин. Соберите супернатант, который содержит растворимые белки, и переходите к разделу 4.
- Повторно суспендируют гранулу в 200 мкл ледяного буфера А(таблица 1)с помощью пипетки. Центрифуга при 16 000 × г и 4 °C в течение 20 мин. Осторожно удалите супернатант вообще.
- Добавьте 200 мкл ледяного буфера B (см. Таблицу 1 и Таблицу материалов)и осторожно повторно суспендирование гранул путем пипетки.
ПРИМЕЧАНИЕ: Неионное моющее средство солюбилизирует мембранный белок. - Центрифугирование повторяют при 16 000 × г и 4 °C в течение 20 мин. Осторожно удалите супернатант.
- Повторно суспендируют гранулу в 200 мкл холодного буфера А(таблица 1)путем пипетирования. Центрифуга при 16 000 × г и 4 °C в течение 20 мин. Полностью удалить супернатант.
- Повторно суспендируют гранулу в 100 мкл 1x восстанавливающего буфера образца SDS(таблица 1)и кипятят в течение 5 мин при 95 °C в термомиксаторе.
- Храните образец при -20 °C, чтобы продолжить позже или немедленно загрузить полиакриламидный гель SDS для разделения.
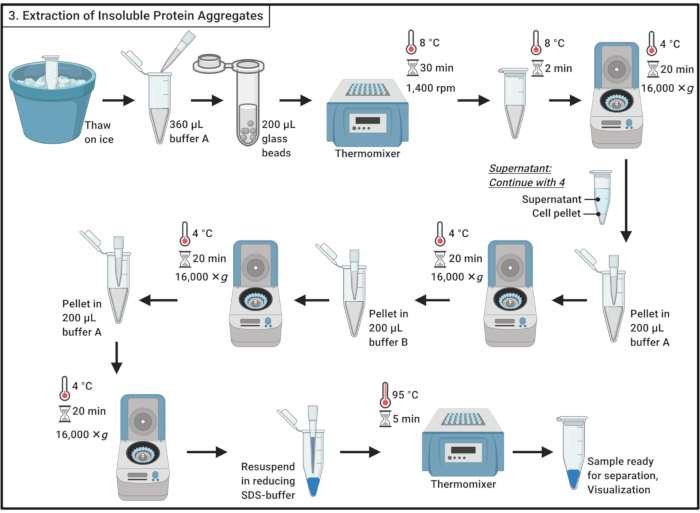
Рисунок 3:Экстракция нерастворимых белковых агрегатов. Экстракция белковых агрегатов включает в себя ряд этапов, включая разрушение клеток, отделение белковых агрегатов от растворимых белков, солюбилизацию мембранных белков и промывку. Аббревиатура: SDS = додецилсульфат натрия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Пробоподготовка растворимого белка
- Смешайте 1 объем 100% трихлоруксусной кислоты (ТЦА) с 4 объемами образца растворимого белка из шага 3.6.
ПРИМЕЧАНИЕ: Для обработки TCA требуется вытяжной капюшон и средства индивидуальной защиты, а также утвержденная процедура удаления отходов. - Инкубировать в течение 10 мин при 4 °C, чтобы обеспечить осаждение белка.
ПРИМЕЧАНИЕ: Белый осадок появится очень скоро. - Центрифуга выпадает в осадок при 21 000 × г и 4 °C в течение 5 мин и удаляет супернатант. Промыть гранулу 200 мкл ледяного ацетона для удаления клеточного мусора. Центрифуга при 21 000 × г и 4 °C в течение 5 мин и удаление супернатанта. Повторите эти действия на шаге 4.3 в общей сложности три раза.
- Поместите микроцентрифужные трубки с открытыми крышками в термомикшер при 37 °C, чтобы удалить оставшийся ацетон из гранулы.
ПРИМЕЧАНИЕ: Инкубация более 5 мин может снизить растворимость белковой гранулы. - Добавьте 100 мкл 1x восстанавливающего буфера SDS(таблица 1)и полностью растворите гранулу. Вскипятите образец в течение 5 мин при 95 °C.
- Храните образец при -20 °C, чтобы продолжить позже или немедленно загрузить полиакриламидный гель SDS для разделения.
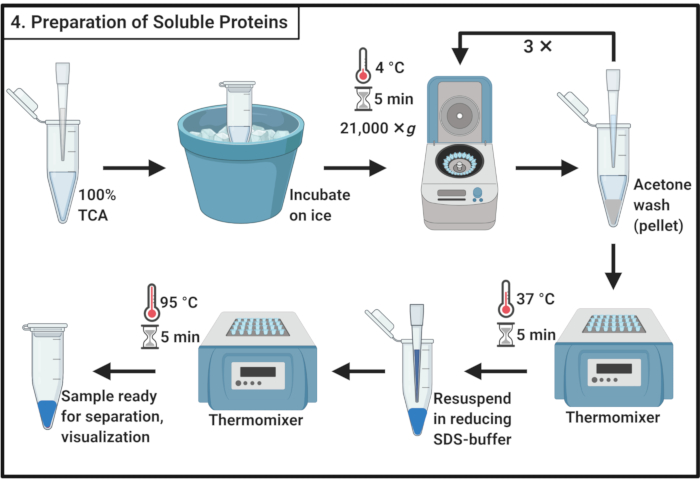
Рисунок 4:Получение растворимых белков. Приготовление растворимого белка включает стадию осаждения трихлоруксусной кислотой и многократное промывание ледяным ацетоном. Сокращения: TCA = трихлоруксусная кислота; SDS = додецилсульфат натрия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Разделение и визуализация экстрагированных белковых агрегатов с помощью SDS-PAGE
- Приготовьте 12% SDS-полиакриламидный гель.
- Для двух разделяющих гелей пипетка 5,1 мл двойной дистиллированной воды (ddH2O), 3,75 мл Tris-HCl (рН 8,8), 7,5 мл 20% (мас./об.) SDS, 6 мл 30% раствора акриламида/бисакриламида (29:1), 75 мл 10% мас./v персульфата аммония и 10 мл тетраметилэтилендиамина (TEMED) в 15 мл центрифужной трубки и аккуратно перемешайте без введения пузырьков воздуха. Залейте гель, используя пипетку 1 мл, в стеклянные пластины, оставив верхние 2 см свободными от смеси. Добавьте 70% этанола в верхнюю часть разделяющего геля и обеспечьте равномерное сопряжение между двумя слоями.
- После полимеризации сепарационного геля готовят укладочный гель путем пипетирования 1,535 мл ddH2O, 625 мл Tris-HCl (pH 6,8), 12,5 мл 20% (мас./об.) SDS, 335 мл 30% раствора акриламида/бисакриламида (29:1), 12,5 мл 10% мас./об.персульфата аммония и 2,5 мл TEMED. Удалите этанол из разделительных гелей и добавьте раствор геля для укладки. Вставьте расческу с нужным количеством карманов без введения пузырьков воздуха. Опустить полимеризацию в течение 20-30 мин.
- Загрузите 4 мкл каждого образца и белковую лестницу в отдельные скважины и запустите гель (гели) в буфере работы Трис-Глицина(Таблица 1)при 144 В в течение 45 мин при комнатной температуре.
ПРИМЕЧАНИЕ: Остановите гель, когда бромфенольный бандаж собирается мигрировать из геля. - Окрашивают гель(ы) в предварительно выплавленный раствор Фэрбенкса А(таблица 1)в течение 30 мин на коромысле.
- Отклейте гель(ы) в предварительно распаленном растворе Фэрбенкса D(таблица 1)до желаемого фона (например, на ночь) на коромысле.
Рисунок 5:Разделение и визуализация белков. Образцы разделены SDS-PAGE и визуализируются окрашиванием Coomassie. Аббревиатура: SDS-PAGE = электрофорез додецилсульфат-полиакриламидного геля натрия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
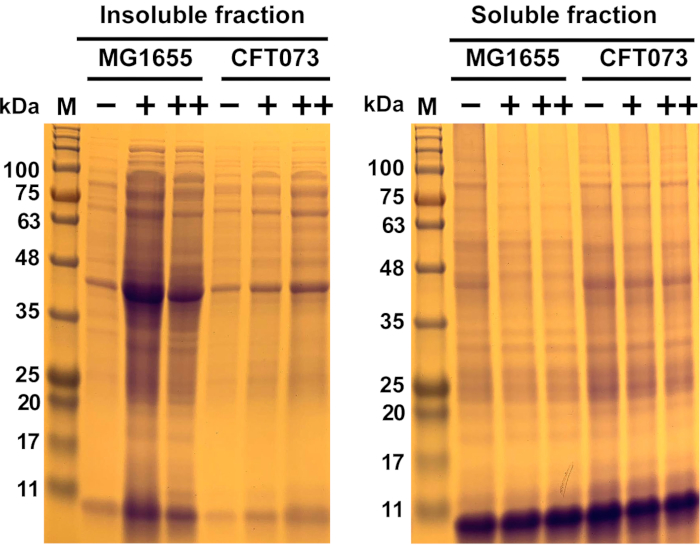
Рисунок 6:Репрезентативные результаты антимикробной агрегации белка в комменсальном штамме Escherichia coli MG1655 и штамме UPEC CFT073. Штаммы E. coli MG1655 и CFT073 выращивали при 37 °C и 300 об/мин до OD600= 0,5-...
Обсуждение
Данный протокол описывает оптимизированную методологию анализа образования белковых агрегатов после обработки различных штаммов E. coli протеотоксическим противомикробным средством. Протокол допускает одновременную экстракцию нерастворимых и растворимых белковых фракций из об...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана стартовыми фондами Школы биологических наук Университета штата Иллинойс, грантом Инициативы нового факультета Университета штата Иллинойс и грантом NIAID R15AI164585 (для J.-U. D.). G.M.A. был поддержан Программой поддержки исследований бакалавриата Университета штата Иллинойс (G.M.A.). K.P.H. была поддержана стипендией RISE, предоставленной Германской службой академических обменов (DAAD). Авторы благодарят д-ра Уве Ландау и д-ра Карстена Мейера из Largentech Vertriebs GmbH за предоставление порошка AGXX. Рисунки 1, Рисунок 2, Рисунок 3, Рисунок 4и Рисунок 5 были сгенерированы с помощью Biorender.
Материалы
| Name | Company | Catalog Number | Comments |
| Chemicals/Reagents | |||
| Acetone | Fisher Scientific | 67-64-1 | |
| 30% Acrylamide/Bisacrylamide solution 29:1 | Bio-Rad | 1610156 | |
| Ammonium persulfate | Millipore Sigma | A3678-100G | |
| Benzonase nuclease | Sigma | E1014-5KU | |
| Bluestain 2 Protein ladder, 5-245 kDa | GoldBio | P008-500 | |
| β-mercaptoethanol | Millipore Sigma | M6250-100ML | |
| Bromophenol blue | GoldBio | B-092-25 | |
| Coomassie Brilliant Blue R-250 | MP Biomedicals LLC | 821616 | |
| D-Glucose | Millipore Sigma | G8270-1KG | |
| D-Sucrose | Acros Organics | 57-50-1 | |
| Ethylenediamine tetra acetic acid (EDTA) | Sigma-Aldrich | SLBT9686 | |
| Glacial Acetic acid | Millipore Sigma | ARK2183-1L | |
| Glycerol, 99% | Sigma-Aldrich | G5516-1L | |
| Glycine | GoldBio | G-630-1 | |
| Hydrochloric acid, ACS reagent | Sigma-Aldrich | 320331-2.5L | |
| Isopropanol (2-Propanol) | Sigma | 402893-2.5L | |
| LB broth (Miller) | Millipore Sigma | L3522-1KG | |
| LB broth with agar (Miller) | Millipore Sigma | L2897-1KG | |
| Lysozyme | GoldBio | L-040-25 | |
| 10x MOPS Buffer | Teknova | M2101 | |
| Nonidet P-40 | Thomas Scientific | 9036-19-5 | |
| Potassium phosphate, dibasic | Sigma-Aldrich | P3786-1KG | |
| Potassium phosphate, monobasic | Acros Organics | 7778-77-0 | |
| Sodium dodecyl sulfate (SDS) | Sigma-Aldrich | L3771-500G | |
| Tetramethylethylenediamine (TEMED) | Millipore Sigma | T9281-50ML | |
| Thiamine | Sigma-Aldrich | T4625-100G | |
| 100% Trichloroacetic acid | Millipore Sigma | T6399-100G | |
| Tris base | GoldBio | T-400-1 | |
| Material/Equipment | |||
| Centrifuge tubes (15 mL) | Alkali Scientific | JABG-1019 | |
| Erlenmeyer flask (125 mL) | Carolina | 726686 | |
| Erlenmeyer flask (500 mL) | Carolina | 726694 | |
| Freezer: -80 °C | Fisher Scientific | ||
| Glass beads (0.5 mm) | BioSpec Products | 1107-9105 | |
| Microcentrifuge | Hermle | Z216MK | |
| Microcentriguge tubes (1.7 mL) | VWR International | 87003-294 | |
| Microcentriguge tubes (2.0 mL) | Axygen Maxiclear Microtubes | MCT-200-C | |
| Plastic cuvettes | Fischer Scientific | 14-377-012 | |
| Power supply | ThermoFisher Scientific | EC105 | |
| Rocker | Alkali Scientific | RS7235 | |
| Shaking incubator (37 °C) | Benchmark Scientific | ||
| Small glass plate | Bio-Rad | 1653311 | |
| Spacer plates (1 mm) | Bio-Rad | 1653308 | |
| Spectrophotometer | Thermoscientific | 3339053 | |
| Tabletop centrifuge for 15 mL centrifuge tubes | Beckman-Coulter | ||
| Vertical gel electrophoresis chamber | Bio-Rad | 1658004 | |
| Vortexer | Fisher Vortex Genie 2 | 12-812 | |
| Thermomixer | Benchmark Scientific | H5000-HC | |
| 10 well comb | Bio-Rad | 1653359 |
Ссылки
- Dahl, J. -. U., et al. HdeB functions as an acid-protective chaperone in bacteria. Journal of Biological Chemistry. 290 (1), 65-75 (2015).
- Foit, L., George, J. S., Zhang, B. W., Brooks, C. L., Bardwell, J. C. A. Chaperone activation by unfolding. Proceedings of the National Academy of Sciences of the United States of America. 110 (14), 1254-1262 (2013).
- Sultana, S., Foti, A., Dahl, J. -. U. Bacterial defense systems against the neutrophilic oxidant hypochlorous acid. Infection and Immunity. 88 (7), 00964 (2020).
- Dahl, J. -. U., Gray, M. J., Jakob, U. Protein quality control under oxidative stress conditions. Journal of Molecular Biology. 427 (7), 1549-1563 (2015).
- Groitl, B., Dahl, J. -. U., Schroeder, J. W., Jakob, U. Pseudomonas aeruginosa defense systems against microbicidal oxidants. Molecular Microbiology. 106 (3), 335-350 (2017).
- Casadevall, A. Thermal restriction as an antimicrobial function of fever. PLoS Pathogens. 12 (5), 1005577 (2016).
- Richter, K., Haslbeck, M., Buchner, J. The heat shock response: life on the verge of death. Molecular Cell. 40 (2), 253-266 (2010).
- Van Loi, V., Busche, T., Preuß, T., Kalinowski, J., Bernhardt, J. The AGXX ® antimicrobial coating causes a thiol-specific oxidative stress response and protein S-bacillithiolation in Staphylococcus aureus. Frontiers in Microbiology. 9, 3037 (2018).
- Anfinsen, C. B., Scheraga, H. A. Experimental and theoretical aspects of protein folding. Advances in Protein Chemistry. 29, 205-300 (1975).
- Schramm, F. D., Schroeder, K., Jonas, K. Protein aggregation in bacteria. FEMS Microbiology Reviews. 44 (1), 54-72 (2020).
- Tomoyasu, T., Mogk, A., Langen, H., Goloubinoff, P., Bukau, B. Genetic dissection of the roles of chaperones and proteases in protein folding and degradation in the Escherichia coli cytosol. Molecular Microbiology. 40 (2), 397-413 (2001).
- Gray, M. J., et al. Polyphosphate is a primordial chaperone. Molecular Cell. 53 (5), 689-699 (2014).
- Weids, A. J., Ibstedt, S., Tamás, M. J., Grant, C. M. Distinct stress conditions result in aggregation of proteins with similar properties. Scientific Reports. 6, 24554 (2016).
- Mogk, A., et al. Identification of thermolabile Escherichia coli proteins: prevention and reversion of aggregation by DnaK and ClpB. EMBO Journal. 18 (24), 6934-6949 (1999).
- Fay, A., Glickman, M. S. An essential nonredundant role for mycobacterial DnaK in native protein folding. PLoS Genetics. 10 (7), 1004516 (2014).
- Schramm, F. D., Heinrich, K., Thüring, M., Bernhardt, J., Jonas, K. An essential regulatory function of the DnaK chaperone dictates the decision between proliferation and maintenance in Caulobacter crescentus. PLoS Genetics. 13 (12), 1007148 (2017).
- Maisonneuve, E., Fraysse, L., Moinier, D., Dukan, S. Existence of abnormal protein aggregates in healthy Escherichia coli cells. Journal of Bacteriology. 190 (3), 887-893 (2008).
- Heiss, A., Freisinger, B., Held-Föhn, E. Enhanced antibacterial activity of silver-ruthenium coated hollow microparticles. Biointerphases. 12 (5), (2017).
- Papnayotou, I., Sun, B., Roth, A. F., Davis, N. G. Protein aggregation induced during glass bead lysis of yeast. Yeast. 27 (10), 801-816 (2010).
- Chuang, S. E., Blattner, F. R. Characterization of twenty-six new heat shock genes of Escherichia coli. Journal of Bacteriology. 175 (16), 5242-5252 (1993).
- Imlay, J. A. The molecular mechanisms and physiological consequences of oxidative stress: Lessons from a model bacterium. Nature Reviews Microbiology. 11 (7), 443-454 (2013).
- Mühlhofer, M., et al. The heat shock response in yeast maintains protein homeostasis by chaperoning and replenishing proteins. Cell Reports. 29 (13), 4593-4607 (2019).
- Chandrangsu, P., Rensing, C., Helmann, J. D. Metal homeostasis and resistance in bacteria. Nature Reviews Microbiology. 15, 338-350 (2017).
- Stevens, M., et al. HSP60/10 chaperonin systems are inhibited by a variety of approved drugs, natural products, and known bioactive molecules. Bioorganic and Medicinal Chemistry Letters. 29 (9), 1106-1112 (2019).
- Schramm, F. D., Schroeder, K., Alvelid, J., Testa, I., Jonas, K. Growth-driven displacement of protein aggregates along the cell length ensures partitioning to both daughter cells in Caulobacter crescentus. Molecular Microbiology. 111 (6), 1430-1448 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены