Method Article
عزل الخلايا اللمفاوية الفطرية الرحمية للتحليل عن طريق قياس التدفق الخلوي
* These authors contributed equally
In This Article
Summary
هذه طريقة لعزل الخلايا اللمفاوية الرحمية عن الفئران الحامل وغير الحامل على حد سواء. يمكن استخدام هذه الطريقة لتطبيقات المصب متعددة مثل phenotyping FACS، وفرز الخلايا، والمقاايسات الوظيفية، RNA-seq، وبروتيوميكس. يوضح البروتوكول هنا كيفية النمط الظاهري للمجموعة 1 خلايا الرحم اللمفاوية الفطرية عن طريق قياس التدفق الخلوي.
Abstract
وصف هنا هو وسيلة بسيطة لعزل والنمط الظاهري مجموعة الماوس 1 الرحم الخلايا اللمفاوية الفطرية (g1 uILCs) من الرحم الحامل الفردية عن طريق قياس التدفق الخلوي. يصف البروتوكول كيفية إعداد التزاوج الزمني للحصول على سدود متزامنة متعددة ، والهضم الميكانيكي والإنزيمي للرحم الحامل ، وتلطيخ تعليق الخلية الواحدة ، واستراتيجية FACS لظاهرة والتمييز g1 uILCs. على الرغم من أن هذه الطريقة تفقد حتما المعلومات المكانية للتوزيع الخلوي داخل الأنسجة ، فقد تم تطبيق البروتوكول بنجاح لتحديد عدم التجانس uILC ، واستجابتها لعوامل الأم والجنين التي تؤثر على الحمل ، وملف التعبير الجيني ، ووظائفها.
Introduction
وصف هنا هو وسيلة بسيطة للحصول على غلة عالية من الخلايا الليمفاوية الفطرية الرحم من الرحم الحامل الفردية. تحافظ هذه الطريقة على التعبير السطحي البروتيني ووظائف الخلايا الليمفاوية الفطرية الرحمية وهي مناسبة للتطبيقات اللاحقة مثل PHCS phenotyping أو RNAseq أو proteomics أو المقايسات الوظيفية. هنا ، يتم التركيز على phenotyping من uILCs المجموعة 1 عن طريق قياس التدفق الخلوي.
يتكون الرحم من ثلاث طبقات: بطانة الرحم، والميوميتريوم، والقبة المحيطة (الشكل 1). بطانة الرحم هي الغشاء المخاطي ، بطانة تجويف الرحم. البروجسترون، التي تنتجها اللوتيوم كوربوس، يحول بطانة الرحم إلى decidua. ويتكون الميومتريوم من طبقتين من العضلات الملساء التي تشكل جدار الرحم. وperpermetrium هو serosa الذي يلف الرحم ويربطه إلى الصفاق من خلال الرباط العريض يسمى mesometrium. في مقطع عرضي من الرحم ، يسمى الجزء المقابل للتشحيم الجانب الماوسومي ، في حين يسمى الجزء القريب من التجويف الجانب المضاد للسموم الصناعي. مجموعة متنوعة من الكريات البيض الأمومية تملأ بطانة الرحم والبت، بما في ذلك عدة أنواع من الخلايا، حيث تمثل الخلايا المناعية الفطرية الغالبية العظمى من الخلايا. الخلايا اللمفاوية الفطرية (ILCs) ، الضامة ، الخلايا التشعبية (DC) ، وكذلك الخلايا الليمفاوية CD4 + و CD8 + T ، الخلايا التائية التنظيمية (Tregs) ، والخلايا B النادرة ، قد تلعب جميعها أدوارا مهمة في تنظيم بيئة الرحم طوال فترة الحمل1،2. توجد ILCs في الرحم ليس فقط في الغشاء المخاطي ، ولكن أيضا في الميوميتريوم في الفئران. بما في ذلك جميع المجموعات الثلاث من ILCs ، الرحم هو في الواقع الجهاز الأكثر كثافة سكانية من قبل المجموعة 1 ILCs. ومع التحول الهيكلي لأنسجة الرحم طوال فترة الحمل، يتغير أيضا عدد ونسبة الكريات البيض الرحمية (انظر الشكل 2 ألف للحصول على مثال على الاختلافات في النسبة المئوية للمجموعة 1 من مجموعات UILC الفرعية)3،4.
عندما يشار إلى الفئران في هذه الورقة ، فإن سلالة C57BL/6 من فئران المختبر الأصيلة مقصودة. وغالبا ما تستخدم الفئران الأصيلة (مثل فئران NMRI) في البحوث الإنجابية بسبب ارتفاع معدل الإنجاب. ومع ذلك ، فإن استخدام السلالات الأصيلة ضروري لتوليد نتائج متسقة ، والخلفية الوراثية المفضلة لدى أخصائي المناعة هي C57BL /6 ، المعروفة أيضا باسم B6.
ما يقرب من 30٪ من الكريات البيض الرحمية في سدود B6 في منتصف الحمل هي g1 uILCs، والتي يتم تعريفها عن طريق قياس التدفق الخلوي على أنها قابلة للحياة CD45 + CD3-CD19-NK1.1 + NKp46 + الخلايا (الشكل 2B): NK المؤيدة للأنسجة الوعائية (trNK)، IFN-g المنتجة التقليدية NK (cNK)، وuILC14،5. النسبة المئوية لخلايا uNK أعلى من ذلك في البشر ، لتصل إلى حوالي 70٪ في الثلث الأول من الحمل6. هناك أوجه تشابه أكثر من الاختلافات بين uNK الإنسان والفأر وuILC7،8. على الرغم من أنه من المهم أن نضع الاختلافات في الاعتبار، فمن المفيد دمج المعلومات المتاحة عن هذين النوعين. عندما يجمع المرء بين المعلومات التي تم الحصول عليها من التحقيق uILC في البشر والقوارض المختبرية، فمن الواضح أن خلايا NK تساعد في التغيرات الهلوسة ضرورية لبيولوجيا الرحم، بما في ذلك الحفاظ على سلامة الشرايين9 وإعادة عرض الشرايين الحلزونية10، فضلا عن غزو الأرومة التروبوست11،12. كما أنها تلعب أدوارا محددة في الدفاع ضد مسببات الأمراض13,14. في الفئران والجرذان ، إلى جانب ملء decidua حول موقع الزرع ، تتراكم خلايا NK بين طبقتي العضلات في عضلة السدود في بنية عابرة تعرف باسم مجموع الليمفاوية الميكومياضية للحمل (MLAp)15 (الشكل 1B) ، المعروف أيضا في الماضي باسم الغدة الأذينية ، والتي لم يتم اكتشاف وظيفتها بعد.
وصف هنا هو بروتوكول مفصل للطريقة المستخدمة في المختبر لعزل الخلايا الليمفاوية من رحم الفئران الحامل باستخدام مزيج من التصنيف الميكانيكي والهضم الأنزيمي. كما يتم استخدام الرحم كله في هذه الطريقة، الخلايا الليمفاوية معزولة عن الرحم أثناء الحمل هي مزيج من الخلايا العضلية والبتية. مزيد من تشريح decidua من جدار الرحم وMLAp لها من الممكن، وقد وصفت قبل16. تم تطوير الطريقة الموصوفة هنا للحصول على الخلايا الليمفاوية الرحمية مع الحفاظ على التعبير السطحي البروتيني ، والوظائف الخلوية ، والجدوى. والنتيجة هي تعليق خلية واحدة مع الحد الأدنى من الحطام الخلوي المتبقي وعائد يتراوح عادة بين 1-5 ملايين خلية في منتصف الحمل (10.5 أيام) للرحم الحامل. وتشمل تطبيقات هذه الطريقة phenotyping عن طريق قياس التدفق الخلوي، وفرز الخلايا للدراسات النسخية اللاحقة أو البروتيوميك، والدراسات الوظيفية مثل إنتاج السيتوكين داخل الخلايا، والتخلص من التخثر، ELISPOT أو المقايسات السامة للخلايا. ويركز البروتوكول المعروض هنا على تحديد مجموعات 1 ILCs ولكن يمكن تكييفها لأنواع الخلايا الأخرى مثل ILCs الأخرى، والخلايا التائية، والخلايا B، والعاصمة، أو الضامة مع تعديلات طفيفة على لوحة الأجسام المضادة المستخدمة لتحليل FACS. ويمكن أيضا أن يستخدم البروتوكول لعزل الخلايا من الأنسجة الأخرى وتجمع الرحم غير الحوامل.
Protocol
أجريت جميع التجارب الحيوانية الموصوفة في هذه الورقة وفقا لقانون الحيوانات (الإجراءات العلمية) لعام 1986 بموجب PP2363781 الصادر عن وزارة الداخلية البريطانية. يتكون البروتوكول أدناه من عدة أقسام تبدأ من تربية الفئران وتنتهي مع تلطيخ لتحليل FACS. 11 - يعكس الشكل 3 الخطوات الرئيسية للبروتوكول. المواد المستخدمة في البروتوكول مدرجة في جدول المواد.
1. تربية الفئران العامة، والتزاوج، وتشريح
- الحفاظ على الفئران الإناث 7-14 الأسبوع من العمر تحت ظروف محددة خالية من مسببات الأمراض (SPF) والمجموعة التي تقع (عادة 4-6 الإناث وفقا لحجم القفص ووزن الحيوان)، لمدة 10-14 يوما لتحريك تأثير لي التمهيد، مما يؤدي إلى تزامن estrus17.
- الحفاظ على الذكور مسمار في ظروف SPF، واحد يسكن، وراحة لمدة 48 ساعة على الأقل بين كل التزاوج (الوقت لتجديد الحيوانات المنوية). فمن الأفضل لاستخدام ذوي الخبرة ثبت 3-4 أشهر من العمر مسمار الذكور كما أنها عادة ما تكون أكثر أداء من الصغار.
- لزيادة احتمال أن تصبح الإناث حوامل، أدخل الفراش المتسخ من قفص الذكور في قفص الإناث قبل 3 أيام من التزاوج. وهذا يؤدي إلى تأثير وايتن18 عن طريق التعرض لفيرومونات البول الذكور، ويؤدي إلى استروس متزامنة، فضلا عن تعزيز القبول للتزاوج.
- في اليوم 0 (D0) ، قم بإعداد الفئران للتزاوج باستخدام ذكر واحد لكل أنثى ؛ النظر في معدل المكونات من حوالي 20 ٪ - 25 ٪.
ملاحظة: من المرجح أن يحدث التزاوج في الليل لأن الفئران ليلية. - في الصباح التالي للتزاوج (D0.5)، تحقق من وجود قابس مهبلي، وهو مؤشر على الجماع (الشكل 4). المكونات المهبلية هي مجموع السائل المنوي الذكري وتستمر عادة لمدة تصل إلى 8-24 ساعة بعد التزاوج. تحقق من المقابس في الصباح الباكر.
- دمج الإناث موصول في قفص جديد وتخصيصها. أعيدوا الذكور إلى أقفاصهم للراحة
- عند التزاوج D9.5 أو 10.5-after، قم بإعداد أنابيب 5 مل مع 1 مل من HBSS 1x المعقم (مع Mg2+ و Ca2+) لجمع الأنسجة ووضعها على الجليد.
- انتقل إلى القتل الرحيم الحيواني عن طريق خلع عنق الرحم ، يليه الاستئصال لتأكيد الوفاة.
- العمل في بيئة معقمة إذا كان التطبيق المصب يتطلب القيام بذلك. مباشرة بعد القتل الرحيم، امسح جسم الفأر بالإيثانول بنسبة 70٪ وشرع في تشريحه تحت خزانة تدفق صفيحة بأدوات معقمة.
- تشريح الرحم الحامل خالية من الدهون الميكوسوماتية (الشكل 5) ووضع الرحم كله في أنبوب أعدت ووصفت بشكل مناسب 5 مل. أبقي الأنابيب على الثلج
2. الهضم الميكانيكي والهضمي للرحم
- لإعداد محلول الهضم الأنزيمي، اخلط 3 مل لكل رحم من HBSS 1x مع 30 ميكروغرام/مل من DNAse و0.1 وحدة Wünsch (WU) / مل من Liberase DH أو 0.52 WU/mL من Liberase TM. وضع الحل في حمام مائي عند 37 درجة مئوية.
ملاحظة: يمكن استخدام كل من Liberase TM وLiberase DH. يجب أن يسترشد اختيار أحدهما على الآخر بتأثيره المحتمل على الأسطح المعترف بها من قبل الأجسام المضادة المستخدمة لتحليل قياس التدفق الخلوي اللاحق.
تنبيه: إذا كنت تستخدم الإنزيمات الليوفيلية، فاعمل تحت غطاء محرك السيارة. - إعداد 20 مل من EDTA 5 mM في برنامج تلفزيوني (لا Ca2 +/Mg2+). ضع نصف الحل عند 37 درجة مئوية في حمام مائي والنصف الآخر على الجليد.
- تحت خزانة تدفق صفح، قم بإزالة الدهون المحيطة بالرحم الحامل بأدوات معقمة بلطف في طبق بيتري معقم. لا تسمح للأنسجة بالجفاف.
- تشريح كل موقع زرع مع أدوات معقمة لإزالة الأجنة (هيكل متحول على شكل حصان البحر، حوالي 1 ملم في الطول) (الشكل 6A). تجاهل الأجنة.
- أعد الرحم إلى مجموعته الأصلية 5 مل أنبوب و فرم الأنسجة باستخدام مقص مباشرة في أنبوب 5 مل وجمع المتوسطة. إبقاء الأنابيب على الجليد في كل وقت بين الإجراءات.
- ضع أنابيب 5 مل التي تحتوي على الأنسجة المفرومة في حمام مائي عند 37 درجة مئوية.
- أضف 3 مل من مزيج الهضم الأنزيمي الدافئ إلى كل عينة بحيث يكون الحجم الإجمالي للسائل في الأنبوب 4 مل (1 مل من وسيط التجميع مع الرحم المفروم و3 مل من محلول الهضم الأنزيمي). احتضان أنابيب 5 مل لمدة 30 دقيقة في 37 درجة مئوية مع التحريض لتعزيز نشاط الهضم الأنزيمي.
- دوامة أنابيب 5 مل ووضعها على الجليد لمنع عمل الإنزيمات. ثم، في وقت لاحق، نقل محتويات إلى أنابيب الطرد المركزي 15 مل المسمى بشكل صحيح.
- طرد كل شيء من أنابيب 5 مل في أنابيب الطرد المركزي 15 مل باستخدام 10 مل من الجليد الباردة 5 M EDTA PBS الحل.
- طرد مركزي أنابيب الطرد المركزي 15 مل التي تحتوي على الأنسجة المهضومة لمدة 10 دقائق في 400 × ز.
- تجاهل supernatant، نفض الغبار بلطف بيليه، ومن ثم إعادة إنفاقه في 10 مل من الحارة (37 درجة مئوية) 5 M M EDTA PBS الحل.
- احتضان العينات في أنابيب الطرد المركزي 15 مل في 37 درجة مئوية مع التحريض لمدة 15 دقيقة لإزالة وسيط الهضم المتبقي والحد من تكتل الخلية.
- دوامة العينات على ارتفاع لمدة 10 ق لمزيد من تسهيل تفكك الأنسجة.
3. معالجة الرحم إلى تعليق خلية واحدة
- باستخدام المكبس من حقنة معقمة 1 مل، يجبر الأنسجة المهضومة من خلال مصفاة 70 ميكرومتر على أنبوب طرد مركزي 50 مل وصفت بشكل صحيح ومعقمة لإزالة كتل الخلية والأنسجة غير المرتبطة بها.
- غسل مصفاة عدة مرات مع ما مجموعه 10 مل من برنامج تلفزيوني الباردة لجمع جميع الخلايا.
- قم بتدفير أنبوب الطرد المركزي سعة 50 مل لمدة 10 دقائق عند 400 × ز.
ملاحظة: تنفيذ خطوات أخرى باستخدام الخيار أ أو الخيار ب. الخيار أ يسمح إثراء أفضل من الخلايا الليمفاوية مع أقل الحطام وتلوث الخلايا السترومية من الخيار باء. ومع ذلك، الخيار B يعطي أعلى العائد الخلايا المناعية بسبب فقدان الخلايا أقل وأقل تقلبا من إنتاجية الخلية بين العينات. الخيار ب هو أيضا أسهل لأداء من الناحية الفنية. لذلك، استنادا إلى الأفضلية، تابع الخيار A أو الخيار ب.- الخطوات للخيار أ كما يلي.
- تسمية واحدة عقيمة 15 مل أنبوب الطرد المركزي لكل عينة تحتوي على 5 مل من 80٪ (v/v) بيرول متساوي التوتر المخفف في برنامج تلفزيوني.
- بعد الدوران، تخلص من الناطور الفائق من أنبوب الطرد المركزي الذي تبلغ قدرته 50 مل. استخدام صبي ماصة لإعادة إنفاق كل بيليه في 8 مل من 40٪ (v/v) بيرول متساوي التوتر في برنامج تلفزيوني.
- استخدام صبي ماصة على سرعة بطيئة لتراكب بعناية بيليه resuspended في حل Percoll 40٪ على حل Percoll 80٪. ماصة ببطء وباستمرار; عقد أنبوب 15 مل بزاوية 45 درجة (الشكل 6B).
- دون إزعاج التراكب، طارد مركزي أنابيب الطرد المركزي 15 مل لمدة 20 دقيقة في 850 × ز، في درجة حرارة الغرفة (تسارع متوسط والحد الأدنى للكسر).
- إزالة أنابيب بعناية من الطرد المركزي دون إزعاج طبقات Percoll (الشكل 6C).
- دون إزعاج حلقة الكريات البيض في واجهة اثنين من حلول Percoll، استخدم باستور Pipette عقيمة لتجاهل جميع باستثناء ما يقرب من 0.5-1 مل من الطبقة العليا Percoll.
- بينما تحاول امتصاص الحد الأدنى من محلول Percoll (ما يصل إلى 4-5 مل المجموع)، وجمع بعناية حلقة من الكريات البيض ونقل الخلايا إلى أنبوب طرد مركزي جديد المسمى 15 مل.
- أعلى كل عينة مع 10 مل من RMPI-1640 المتوسطة المعقمة تكملها مع 10٪ من FBS الحرارة المعطلة.
- جهاز طرد مركزي لمدة 5 دقائق عند 500 × ز عند 4 درجات مئوية.
- تجاهل supernatant والمضي قدما إلى تحلل RBC.
- الخطوات للخيار ب كما يلي.
- تسمية أنبوب طرد مركزي معقم واحد سعة 15 مل لكل عينة.
- بعد الدوران، تخلص من الناطور الفائق من أنبوب الطرد المركزي الذي تبلغ قدرته 50 مل. استخدام صبي ماصة لإعادة إنفاق كل بيليه مع 8 مل من 35٪ (v/v) بيرول متساوي التوتر في RPMI-1640 المتوسطة.
- نقل العينات إلى أنابيب الطرد المركزي 15 مل.
- طرد مركزي العينات في 940 × ز لمدة 10 دقيقة في درجة حرارة الغرفة مع تسارع متوسط والحد الأدنى من كسر.
- يستنشق supernatant بعناية باستخدام الطامح أو صبي ماصة (وليس عن طريق عكس الأنبوب).
- Resuspend بيليه في 14 مل من RPMI-1640 المتوسطة تكملها مع 10٪ FBS الحرارة المعطلة ومن ثم الطرد المركزي العينة في 500 × ز لمدة 5 دقائق في 4 درجة مئوية.
- تجاهل supernatant عن طريق الطموح والمضي قدما في تحلل RBC.
- الخطوات للخيار أ كما يلي.
4.RBC تحلل
- lyse RBCs، resuspend العينات في 3 مل من محلول lysing RBC 1x واحتضان لمدة 3 دقائق في درجة حرارة الغرفة.
- إضافة 10 مل من برنامج تلفزيوني في العينات لوقف رد الفعل.
- طرد مركزي الأنابيب في 400 × ز لمدة 5 دقائق والتخلص من supernatant.
- إضافة 10 مل من برنامج تلفزيوني وتكرار الخطوة 4.3.
- Resuspend كل بيليه في 1 مل من RPMI-1640 المتوسطة تكملها مع 10٪ من FBS الحرارة المعطلة.
- تمرير العينات من خلال 70 ميكرومتر خلية مصافي العقيمة.
- إجراء عدد الخلايا باستخدام تريبان الأزرق وغرفة نيوباور وفقا لتعليمات الشركة المصنعة.
- ضبط تركيز تعليق الخلية إلى 1-2 مليون خلية في 100 ميكرولتر من برنامج تلفزيوني أو متوسط.
5. استراتيجية تصميم لوحة والضوابط
ملاحظة: الفريق المذكور في هذه الورقة مناسب للتمييز بين خلايا uILC1 وtrNK وcNK وقد تم تصميمه لاستخدامه على BD LSRFortessa 5 ليزر. يمكن إجراء تعديلات طفيفة لدراسة مجموعات الخلايا المختلفة واستخدام الفلوروشروم البديل. من المستحسن التحقق من تكوين الجهاز ، باستخدام الأجسام المضادة المهجنة للفصل الأمثل ، والتشاور مع مؤشر سطوع الشركة المصنعة واستخدام ألمع الأصباغ للمستضدات منخفضة التعبير مثل NKp46 ، واتباع المبادئ التوجيهية العامة19. من المستحسن أن تشمل فلورسينس ناقص واحد (FMO) التحكم لNKp46.
6. الفطرية تلطيخ الخلايا اللمفاوية لPHENOTYPING FACS
- نقل 1-2 مليون خلية لكل بئر في لوحة مستديرة القاع 96 جيدا.
- تدور لوحة في 400 × ز لمدة 3 دقائق في 4 درجة مئوية وتجاهل supernatant عن طريق النقر عليه في بالوعة.
- Resuspend الكريات الخلية في 100 ميكرولتر من برنامج تلفزيوني (البروتين وخالية من الأزيد) باستخدام ماصة متعددة القنوات.
ملاحظة: تأكد من أن برنامج تلفزيوني يحتوي على أي azide الصوديوم، لا تريس، أو أي بروتينات للخطوة اللاحقة. - كرر الخطوة 6.2.
- Resuspend الخلايا في 50 ميكرولتر من صبغة قابلة للإصلاح قابلة للإصلاح المخفف في برنامج تلفزيوني (البروتين وخالية من الأزيد) (1:1,000). احتضان الخلايا في درجة حرارة الغرفة لمدة 30 دقيقة في الظلام.
ملاحظة: تأكد من أن برنامج تلفزيوني يحتوي على أي azide الصوديوم، لا تريس، أو أي بروتينات مثل FBS أو BSA لأن هذا قد يؤدي إلى انخفاض كثافة تلطيخ الخلايا الميتة و / أو زيادة تلطيخ الخلفية للخلايا الحية.
تنبيه: إذا تم مسحوق صبغة البقاء، واستخدامها تحت غطاء محرك السيارة. - إضافة 150 ميكرولتر من برنامج تلفزيوني، وإعادة إنفاق الخلايا مع ماصة متعددة القنوات، ثم كرر الخطوة 6.2.
- إعادة إنفاق الخلايا في 25 ميكرولتر من FACS العازلة (برنامج تلفزيوني تكملها مع 1٪ BSA أو 2٪ FBS) التي تحتوي على مستقبلات FC حجب الكاشف. احتضان الخلايا لمدة 5 دقائق في 4 درجة مئوية.
- أضف 25 ميكرولتر من كوكتيل الأجسام المضادة السطحية.
ملاحظة: قم دائما بتكدير الأجسام المضادة وتحسين لوحة الأجسام المضادة قبل التجربة. - احتضان العينات في درجة حرارة الغرفة لمدة 20 دقيقة في الظلام.
- إضافة 150 ميكرولتر من FACS المخزن المؤقت لكل بئر، مزيج جيدا، ثم كرر الخطوة 6.2.
- كرر الخطوة 6.10.
ملاحظة: تنفيذ خطوات إضافية باستخدام الخيار A أو الخيار B. استخدم الخيار A لتلطيخ الخلايا بعلامات السطح. استخدم الخيار B لدراسة العلامات داخل الخلايا عن طريق قياس التدفق الخلوي.- الخطوات للخيار أ كما يلي.
- إعادة إنفاق العينات في 100 ميكرولتر من 4٪ بارافورمالديهايد (PFA) لكل بئر واحتضان لمدة 20 دقيقة في درجة حرارة الغرفة.
تنبيه: استخدم PFA تحت غطاء محرك السيارة. يرجى الرجوع إلى ورقة الأمان الخاصة بالتخلص من نفايات/كائنات PFA التي احتكت ب PFA (مثل ماصة) بأمان. - كرر الخطوة 6.2، مرتين.
تنبيه: لا تجاهل عن طريق النقر في الحوض هنا لأنه يحتوي على PFA. يستنشق مع ماصة والتخلص من النفايات وفقا لصحيفة السلامة. - إعادة إنفاق العينات في 200 ميكرولتر من برنامج تلفزيوني.
- نقل العينات إلى أنابيب FACS المسمى وأعلى مع 100 ميكرولتر من برنامج تلفزيوني. احتفظ بالأنابيب على الثلج أو في الثلاجة حتى المعالجة بتحليل FACS. الحصول على عينات على مقياس التدفق الخلوي في غضون 24 ساعة.
- إعادة إنفاق العينات في 100 ميكرولتر من 4٪ بارافورمالديهايد (PFA) لكل بئر واحتضان لمدة 20 دقيقة في درجة حرارة الغرفة.
- الخطوات للخيار ب كما يلي.
- Resuspend العينات في 100 ميكرولتر من التثبيت / permeabilization الحل لكل بئر (التي تحتوي على paraformaldehyde) واحتضان لمدة 20 دقيقة في 4 درجة مئوية.
تنبيه: استخدم PFA تحت غطاء محرك السيارة. يرجى الرجوع إلى ورقة الأمان الخاصة بالتخلص من نفايات/كائنات PFA التي احتكت ب PFA (مثل ماصة) بأمان. - كرر الخطوة 6.2.
تنبيه: لا تجاهل عن طريق النقر في الحوض هنا لأنه يحتوي على PFA. يستنشق مع ماصة والتخلص من النفايات وفقا لصحيفة السلامة. - إضافة 200 ميكرولتر من 1x permeabilization / غسل العازلة، مزيج جيدا، ثم كرر الخطوة 6.2.
- كرر الخطوة 6.11.2.3.
- إعادة تثبيت الخلايا الثابتة والخلايا permeabilized في 50 ميكرولتر من 1x permeabilization / الغسيل العازلة التي تحتوي على مزيج الأجسام المضادة للتلطيخ داخل الخلايا.
- احتضان العينات في 4 درجة مئوية لمدة 30 دقيقة في الظلام.
- إضافة 200 ميكرولتر من 1x permeabilization / حل الغسيل، مزيج جيدا، ثم كرر الخطوة 6.2.
- كرر الخطوة 6.11.2.7.
- إعادة إنفاق العينات في 200 ميكرولتر من برنامج تلفزيوني.
- نقل العينات إلى أنابيب FACS المسمى وأعلى مع 100 ميكرولتر من برنامج تلفزيوني. احتفظ بالأنابيب على الثلج أو في الثلاجة حتى المعالجة بتحليل FACS. الحصول على عينات على مقياس التدفق الخلوي في غضون 24 ساعة.
ملاحظة: بعد تنفيذ هذا البروتوكول، تعليق الخلية decidual جاهزة لتحليل FACS. يوصى بتسجيل أكبر عدد ممكن من الأحداث لكل عينة؛ ويتعين الحصول على ما لا يقل عن 000 1 إلى 000 3 حدث من أحداث السكان الآباء لتحقيق نتائج موثوقة.
- Resuspend العينات في 100 ميكرولتر من التثبيت / permeabilization الحل لكل بئر (التي تحتوي على paraformaldehyde) واحتضان لمدة 20 دقيقة في 4 درجة مئوية.
- الخطوات للخيار أ كما يلي.
النتائج
الخطوات الرئيسية للطريقة التي يتم وصفها للحصول على تعليق خلية واحدة من الكريات البيض الرحمية هي تلخيصها في الشكل 3. موضح في الشكل 2B هي استراتيجية FACS الأساسية المستخدمة لتحديد ثلاث مجموعات فرعية من G1 ILCs في الفئران B6: uILC1 (CD49a + Eomes-) ، trNK (CD49a + Eomes +) ، وcNK (CD49a-Eomes +). ويمكن إجراء مزيد من التحليل لهذه المجموعات السكانية لدراسة مختلف العلامات السطحية وداخل الخلايا لمركبات الكربون الهيدروفلورية G1. على سبيل المثال، يمكن تقييم التعبير المشترك عن مستقبلات IFN-ɣ وMHC الذاتية في خلايا uILC1 وtrNK وcNK بعد التحفيز مع الأجسام المضادة ل NK1.1 (الشكل 7).
اعتمادا على مسألة البحث، يمكن تكييف كل من البروتوكول (الشكل 3) ولوحة الأجسام المضادة. والأهم من ذلك، يوصى باستخدام كل من الأجسام المضادة للNK1.1 والأجسام المضادة NKp46 في لوحة واحدة من مركبات الكربون الهيدروفلورية من أجل g1 ILC gating (الشكل 2B والجدول 1). وتجدر الإشارة إلى أن المركبات البولية الهيدروفلورية G1 التي تم الحصول عليها من الدم أو الطحال أو الكبد لديها تعبير أعلى عن NKp46 على سطحها من نظيرتها الرحمية (الشكل 8). تلطيخ السطح لNK1.1 يعطي فصل أفضل ويمكن الرحم G1 ILCs أن تكون بوابات بسهولة (الشكل 8). في حين يتم التعبير عن NKp46 من قبل جميع سلالات الماوس، يتم التعبير عن مستضد NKR-P1C المعترف بها من قبل الأجسام المضادة NK1.1 PK136 فقط من قبل بعض سلالات الماوس، بما في ذلك C57BL/6 (أي B6)، FVB/N، وNZB، ولكن ليس في AKR، BALB/c، CBA/J، C3H، DBA/1، DBA/2، NOD، SJL، أو 129. بالإضافة إلى ذلك ، إذا كان المحقق ينوي دراسة مستقبلات خلايا NK الحاسمة مثل مستقبلات MHC Ly49 ، فمن المهم أن تكون على بينة من الاختلافات الالية في سلالات الفئران المختبرية ، والتي تلخص التباين العالي لمستقبلات الإنسان القاتل الخلية المناعية الشبيهة (KIR). وعلاوة على ذلك، إذا كان للخلايا أن تحفز مع NK1.1 لإجراء فحص وظيفي، كما هو موضح في كيم، S. وآخرون.20، قد يكون من المستحسن أن وصمة عار الخلايا مع المضادة NKp46 بدلا من المضادة NK1.1، كما قد تكون المحتلة مستضد NKR-P1C من قبل NK1.1 المضادة للربط أو مستقبلات التنظيم الهابط قد تتبع التحفيز. إما إشغال المستقبلات أو التنظيم السفلي يمكن أن يعوق تلطيخ مع نفس الأجسام المضادة المستخدمة لتحفيز.
مشكلة شائعة مع تفكك الأنسجة الأنزيمية هو تغيير epitopes السطح على الخلايا عن طريق الإنزيمات المستخدمة لوسط الهضم. على سبيل المثال، تلطيخ لمستقبلات CD94:NKG2A MHC ضعيف إذا تم استخدام Liberase TM. ومع ذلك، فإن الهضم باستخدام Liberase DH يحافظ على التعرف على NKG2A بواسطة استنساخ الأجسام المضادة 16A11 (الشكل 9). فمن المستحسن للتحقق من تأثير الانزيمات على جميع epitopes في لوحة FACS واحد. لهذا الغرض، استخدم تعليق الطحال الماوس التي تم الحصول عليها عن طريق التفكك الميكانيكية (تمرير الطحال كله من خلال مصفاة 70 ميكرومتر). ثم تنقسم العينة إلى جزأين أو أكثر يتبعها حضانة مع وسيط مع أو بدون إنزيم (ق).
كما ذكر من قبل، الخلايا المشتقة من الدم موجودة في عينات الأنسجة المشتتة. إذا لزم الأمر، يمكن استبعاد ملوثات الدم باستخدام طريقة تلطيخ داخل الأوعية الدموية كما تم تطويرها في مختبر Masopust21. ويبين الشكل 10 أن حوالي 6.5 في المائة من المركبات البولية الهيدروفلورية G1 الموجودة في عينات أنسجة الرحم في يوم الحمل 8.5 هي مشتقة من الدم. يمكن اقتران الأجسام المضادة CD45 المستخدمة في تلطيخ الأوعية الدموية بفلوروشروم يستخدم في قناة تفريغ؛ وهذا يستبعد ملوثات الدم دون استخدام قناة مضان إضافية. 10 - وتعرض في الجدول 2 أكثر المشاكل شيوعا وحلولها.

الشكل 1: مقطع عرضي من رحم الفأر. (أ) مقطع عرضي من رحم الفأر (غير حامل) يشير إلى مجموعة متنوعة من الكريات البيض الأمومية التي تملأ الرحم. (ب) الرحم الماوس المقطع العرضي (يوم الحمل 8.5). (ج) شريحة الرحم الفأري (يوم الحمل 13.5). (د) مقارنة بين الماوس وتشكيل المشيمة البشرية من مرحلة الكيسة الأريمية فصاعدا. الصور التي تم إنشاؤها باستخدام BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
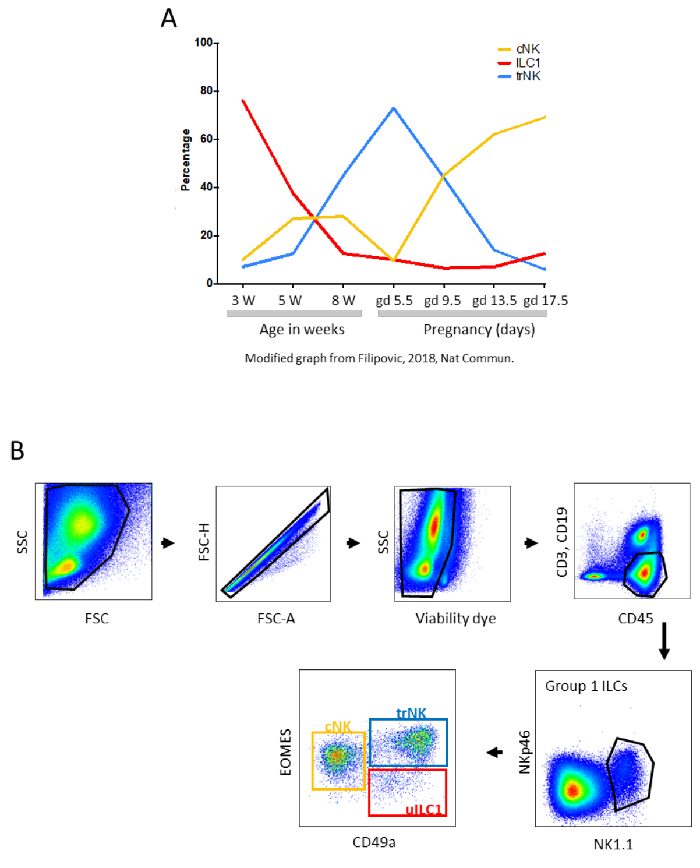
الشكل 2: الاكتظاظ السكاني الفرعي للرحم G1 ILC1. (أ) النسب المئوية ل CNK الرحمية و ILC1 وtrNK في الفئران خلال الحياة المبكرة والحمل. W - أسابيع، GD - يوم الحمل. الرسم البياني المعدل من فيليبوفيتش، I. et al.4. (ب) استراتيجية غاتينغ لتحليل مجموعات الرحم الفرعية 1 ILC حسب قياس التدفق الخلوي. تم عزل الخلايا الليمفاوية من أنسجة الرحم في يوم الحمل 10.5. تم إجراء عملية هضم الأنسجة باستخدام وسيط هضم يحتوي على Liberase TM. تم بوابة الخلايا على أساس قدرتها على تشتت الضوء. تم استبعاد Doublets باستخدام مؤامرة FSC-A مقابل FSC-H ، وتم تحليل خلايا CD45 + CD3-CD19 القابلة للحياة فقط. ضمن الخلايا القابلة للتطبيق CD45+CD3-CD19، تم التعرف على بوابة ILC المجموعة 1 كخلايا NK1.1+ NKp46+. ضمن المجموعة 1 ILCs، يمكن تحديد ثلاث مجموعات فرعية: CD49a-Eomes + خلايا NK التقليدية (cNK)، CD49a + Eomes + خلايا NK المقيمة في الأنسجة (trNK)، وCD49a + Eomes- uILC1. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
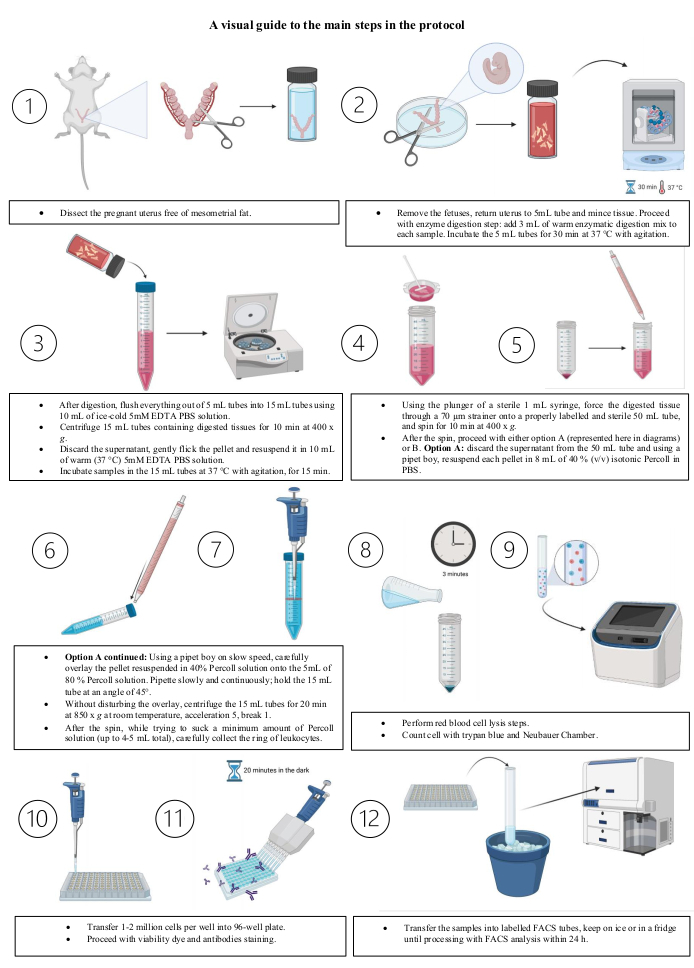
الشكل 3: دليل مرئي للخطوات الرئيسية للبروتوكول. (1) تشريح الرحم الحامل خالية من الدهون الميكوسومية. (2) إزالة الأجنة؛ إعادة الرحم إلى أنبوب 5 مل و فرم الأنسجة. المضي قدما في خطوة الهضم انزيم: إضافة 3 مل من مزيج الهضم الأنزيمي الدافئ إلى كل عينة. احتضان أنابيب 5 مل لمدة 30 دقيقة في 37 درجة مئوية مع التحريض. (3) (1) بعد الهضم، طرد كل شيء من أنابيب 5 مل في أنابيب 15 مل باستخدام 10 مل من الجليد الباردة 5 mM EDTA PBS الحل. '2' أجهزة الطرد المركزي 15 مل أنابيب تحتوي على أنسجة مهضومة لمدة 10 دقائق عند 400 × غرام. '3' التخلص من الناسخ الفائق؛ نفض الغبار بلطف بيليه وإعادة إنفاقه في 10 مل من الحارة (37 درجة مئوية) 5 MM EDTA PBS الحل. '4' احتضان عينات في أنابيب 15 مل عند درجة حرارة 37 درجة مئوية مع الهياج، لمدة 15 دقيقة (4) باستخدام المكبس من حقنة معقمة 1 مل، وإجبار الأنسجة المهضومة من خلال مصفاة 70 ميكرومتر على أنبوب 50 مل المسمى بشكل صحيح ومعقمة، وتدور لمدة 10 دقائق في 400 × ز. (5) بعد الدوران، انتقل إما الخيار A (ممثلة هنا في الرسوم البيانية) أو B. الخيار A: تجاهل supernatant من أنبوب 50 مل، وباستخدام صبي ماصة، resuspend كل بيليه في 8 مل من 40٪ (v/v) بيرول متساوي التوتر في برنامج تلفزيوني. (6) (1) الخيار A تابع: باستخدام صبي ماصة على سرعة بطيئة، تراكب بعناية بيليه resuspended في حل Percoll 40٪ على 5 مل من 80٪ Percoll الحل. ماصة ببطء وباستمرار; عقد أنبوب 15 مل بزاوية 45 درجة. '2' دون إزعاج التراكب، تقوم أجهزة الطرد المركزي بأنابيب 15 مل بسرعة 850 x غرام لمدة 20 دقيقة في درجة حرارة الغرفة، مع تسارع متوسط وبطء في الكسر. (7) بعد الدوران ، بينما تحاول امتصاص الحد الأدنى من محلول Percoll (ما يصل إلى 4-5 مل الإجمالي) ، اجمع بعناية حلقة الكريات البيض. (8) تنفيذ خطوات تحلل خلايا الدم الحمراء. (9) عدد الخلايا باستخدام تريبان الأزرق وغرفة نيوباور. (10) نقل 1-2 مليون خلية لكل بئر في لوحة مستديرة القاع 96 جيدا. (11) المضي قدما في صبغة البقاء والأجسام المضادة تلطيخ. (12) وأخيرا، نقل العينات إلى أنابيب FACS المسمى. احتفظ بالأنابيب على الثلج أو في الثلاجة حتى المعالجة مع تحليل FACS في غضون 24 ساعة. الصور التي تم إنشاؤها باستخدام BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
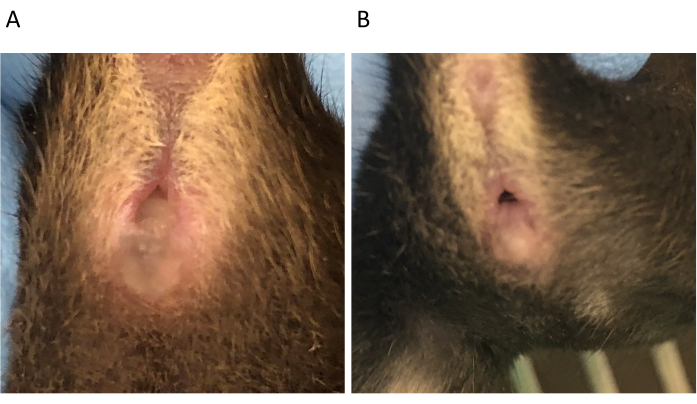
الشكل 4: المكونات المهبلية (A) وعدم وجودها (B) في C57BL/6 الإناث في 0.5 يوم آخر التزاوج. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: تشريح لاستخراج الرحم من فأر حامل. (أ) يتم تثبيت السد مع الإبر على لوحة لينة لمسح الجسم مع الإيثانول 70٪. يتم إجراء شقين عموديين ، كما هو مبين في الخطوط الزرقاء المنقطة. (ب) يتم رفع الجلد لكشف الأعضاء الداخلية. يتم تحريك الحلقات المعوية بلطف لتصور الرحم. (ج) يتم أخذ عينات من الرحم عن طريق القطع عند ثلاث نقاط: بجانب المبيضين وفي عنق الرحم، كما هو مبين في الخطين الأزرق المنقط والسهم الأزرق، على التوالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
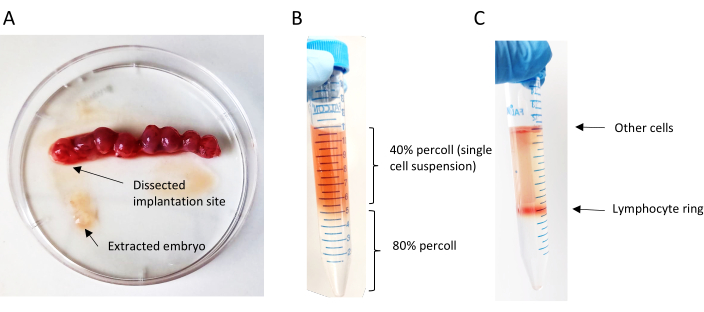
الشكل 6: إعداد تعليق الخلية الواحدة. (أ) الإزالة الميكانيكية للأجنة من موقع زرعها. (ب) تراكب تدرج Percoll؛ الطبقة العليا تحتوي على تعليق خلية واحدة في 40٪ من Percoll والطبقة السفلية 80٪ من Percoll. (ج) تشكيل حلقة الخلايا الليمفاوية بعد الطرد المركزي من التدرج percoll. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
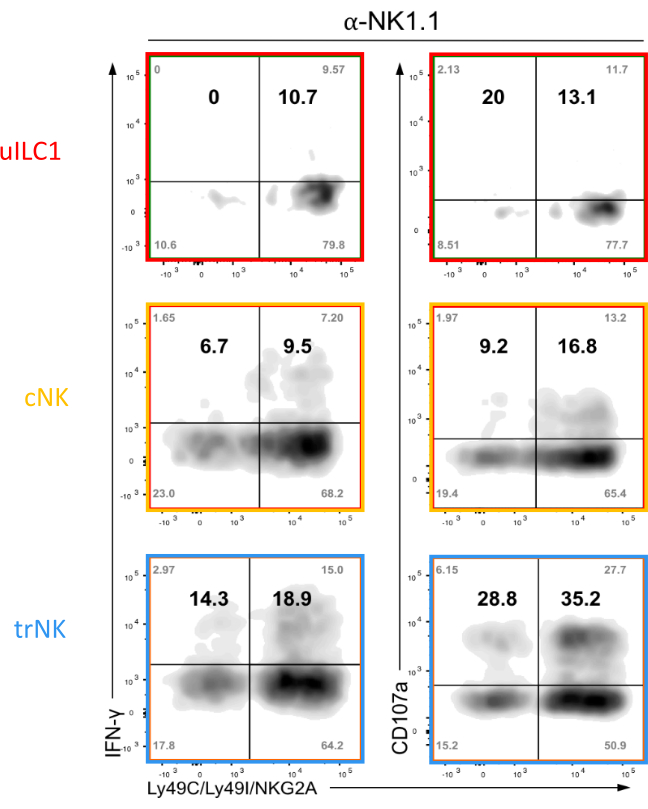
الشكل 7: تحليل الممثل FACS للآساءة الوظيفية مع المجموعة 1 ILCs. الكشف عن CD107a داخل الخلايا IFN-ɣ والسطح في المجموعة 1 ILCs التعبير عن مستقبلات NK لMHC الذاتي (Ly49C, Ly49I, وNKG2A) بالمقارنة مع تلك التي لا, بعد ربط NK1.1 مع الأجسام المضادة لوحة ملزمة. تم عزل الخلايا من أنسجة الرحم في يوم الحمل 9.5. تم إجراء عملية هضم الأنسجة باستخدام وسيط هضم يحتوي على Liberase DH. تظهر القيم الخام لجميع الأرباع الأربعة (الزوايا) وكذلك النسبة المئوية النسبية للمستجيبين بين الخلايا التي تعبر عن مستقبلات الذات والمستجيبين الذين ليس لديهم مستقبلات ذاتية (أرقام جريئة). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
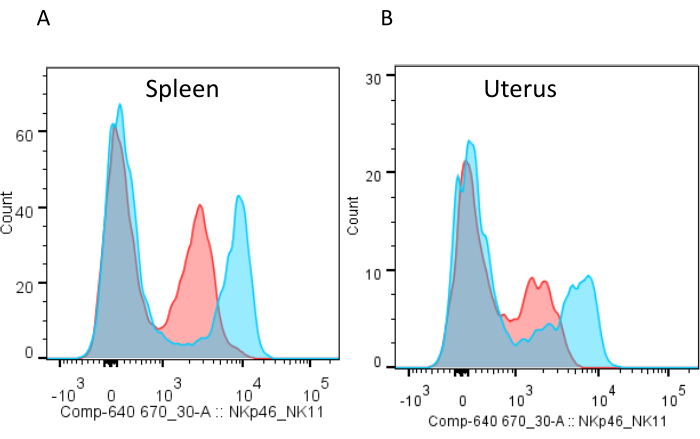
الشكل 8: تلطيخ الخلايا اللمفاوية الجنبية والرحمية مع الأجسام المضادة NKp46 والأجسام المضادة NK1.1. (أ) فصل تعليق الخلايا المحصل عليه من طحال الفأر والرحم (ب) في يوم الحمل 10.5 إلى جزأين؛ وكان جزء واحد ملطخة NKp46 - APC (الأحمر) والآخر مع NK1.1 - APC (الأزرق). لاحظ أن تلطيخ NKp46 من الخلايا الليمفاوية الرحمية لا يفصل NKp46 + و NKp46 - الخلايا بدقة مثل الخلايا الليمفاوية الجنبية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
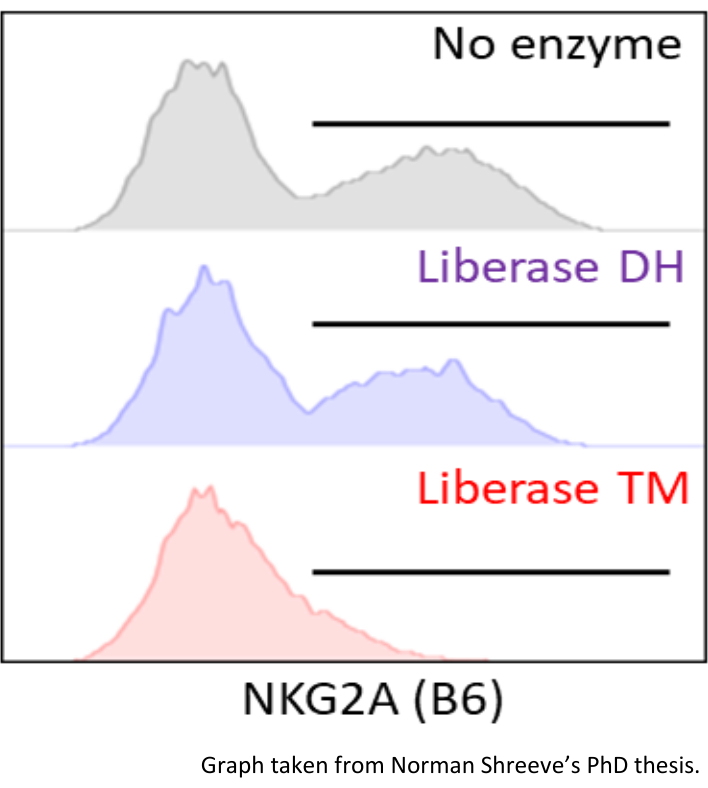
الشكل 9: انخفاض NKG2A MFI (استنساخ الأجسام المضادة: 16A11) عن طريق الحضانة مع وسيطة الهضم. تم تقسيم تعليق الخلية من الطحال الماوس C56BL/6 إلى ثلاثة أجزاء. تم احتضان جزء واحد في وسيط الهضم Liberase DH (HBSS يحتوي على 0.13 WU / mL Liberase DH و 30 ميكروغرام / مل من DNAse) ، وتم احتضان جزء آخر مع وسيط الهضم Liberase TM (HBSS يحتوي على 0.52 WU / mL Liberase TM و 30 ميكروغرام / مل من DNAse). وعولج الجزء الثالث مع HBSS أنيق لمدة 30 دقيقة في 37 درجة مئوية. تم تقييم التعبير عن علامة NKG2A على G1 ILCs عن طريق قياس التدفق الخلوي. رسم بياني مأخوذ من شريف ن. دور الرحم NK-خلية تثبيط في الحمل (أطروحة); المشرف: كولوتشي إف، 2020. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
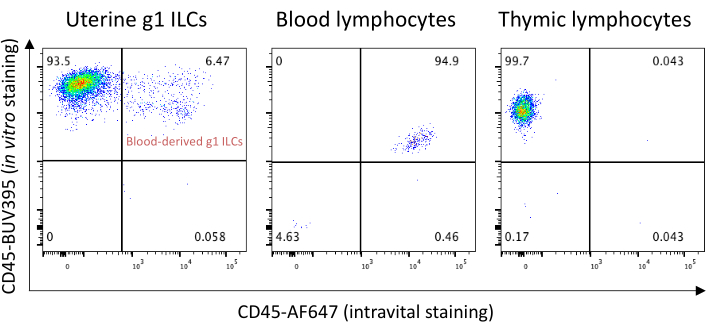
الشكل 10: التلطيخ داخل الجسم بالأجسام المضادة CD45 لاستبعاد المركبات النيئة المشتقة من الدم G1. تم إعدام فأر السد C57BL/6 في يوم الحمل 8.5 بعد 3 دقائق من الحقن الوريدي مع 3 ميكروغرام من CD45-AF647. الرحم والدم كله، والثعوس تم حصادها ومعالجتها لتحليل FACS. يظهر المحور X الإشارة من التلطيخ الوريدي مع CD45-AF647، ويوضح محور Y إشارة من CD45-BUV395 الملطخة في المختبر . وتظهر النسب المئوية للاكتظاظ السكاني الفرعي في أرباع السكان. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الأجسام المضادة / صبغ | استنساخ | فلوروشروم | ليزر | |
| 1 (قناة تفريغ) | غيبوبة البنفسجي صالحة للتثبيت صبغة الجدوى | بنفسج | ||
| CD19 | 1D3 | BV421 | ||
| CD3 | 145-2C11 | BV421 | ||
| 2 | CD45 | 30-F11 | FITC | أزرق |
| 3 | NK1.1 | PK136 | BV605 | بنفسج |
| 4 | NKp46 | 29A1.4 | APC | أحمر |
| 5 | CD49a | ها31/8 | BUV395 | فوق البنفسجي |
| 6 | إيوميس | دان11ماغ | PE | أخضر |
الجدول 1: مثال على لوحة FACS لقياس الخلايا التقليدي 5-lasers.
| مشكلة | السبب المحتمل | اقتراح |
| حلقة الخلية غير مرئية في واجهة حلين percoll | طبقات ضعيفة من محلول percoll أو خلط طبقتين أثناء معالجة العينة | اتخاذ مزيد من الحذر لعدم كسر وسادة percoll 80٪ أثناء تراكب. إيلاء الاهتمام أثناء التعامل مع العينة: لا تزعج واجهة percoll |
| انخفاض عدد الكريات البيض (على سبيل المثال، عند استخدام الرحم غير الحامل) | يمكن رؤية الواجهة حتى عندما يكون رقم الخلية في الواجهة منخفضا جدا. حتى لو كان الخاتم غير مرئي، اجمع السائل بنسبة تتراوح بين 40٪ و80٪ من حلول البيركول، حيث قد لا تزال هناك خلايا كافية لمزيد من المعالجة | |
| تحلل RBC غير مكتمل | لم يتم إعادة إنفاق الخلايا بشكل صحيح في المخزن المؤقت للسهد | خلايا ماصة صعودا وهبوطا لكسر كتل وإعادة إنفاق الخلايا بالكامل في عازلة lysing |
| حل الهسة بارد | إعادة توازن محلول السحج لدرجة حرارة الغرفة قبل الاستخدام | |
| إطالة فترة الحضانة مع حل السحوص حتى 15 دقيقة | ||
| يمكن تكرار خطوة تحلل RBC | ||
| انخفاض إنتاجية الخلية | ضعف الهضم الأنزيمي | تحقق مما إذا كانت الإنزيمات غير قديمة وتم تخزينها وفقا لكتيباتها |
| فقدان الخلايا أثناء خطوات الغسيل | فحص بيليه الخلية بعد كل خطوة الغسيل: بيليه مبهمة في الجزء السفلي من البئر بعد تدور. باستخدام V-bottom بدلا من لوحات U-bottom، جهاز طرد مركزي دوار متأرجح، قد يقلل وقت الطرد المركزي الأطول من فقدان الخلية | |
| عينة الأنسجة تحتوي على أعداد منخفضة من الخلايا الليمفاوية (على سبيل المثال، عند استخدام الرحم غير الحوامل) | تجمع الرحم عدة للحصول على ما يكفي من الأحداث للتحليل. النظر في استخدام الخيار ب من البروتوكول لعزل الخلايا | |
| تباين كبير في أعداد الكريات البيض المطلقة التي تم الحصول عليها من الفئران من نفس المجموعة | مجموعة غير متناسقة من الخلايا في واجهة حلول 40٪ و 80٪ percoll | تأكد من تجميع جزء الخلية بأكمله على واجهة percoll. النظر في استخدام الخيار ب من البروتوكول لعزل الخلايا |
| غير قادر على الكشف عن الخلايا الليمفاوية المتوقعة subpopulations / علامات أو MFI منخفضة بشكل غير عادي لبعض علامات سطح الخلية | الهضم الأنزيمي يؤثر على التعبير السطحي لبعض الأسطح أو تدهورها | تحسين الهضم الأنزيمي عن طريق التغيير: الإنزيم (على سبيل المثال إلى نوع مختلف من ليبراز أو كولاجيناز) و / أو طول الحضانة و / أو تركيز الإنزيم |
| ضوضاء خلفية عالية في مقياس التدفق الخلوي | نسبة عالية من حطام الخلية أو تلوث RBC | ضبط المعلمة عتبة FSC. النظر في استخدام الخيار أ من البروتوكول لعزل الخلايا |
الجدول 2: دليل استكشاف الأخطاء وإصلاحها.
Discussion
يحتوي الأسلوب على عدة خطوات هامة تمت مناقشتها فيما بعد. الخطوة الحرجة الأولى هي الحصول على حالات حمل متزامنة متعددة مع تغير التردد النسبي لتجمعات الكريات البيض من خلال الحمل. وجود سدود متعددة في نفس اليوم الحملي يسمح إما بتكرار البيولوجية في نفس التجارب أو تجميع الخلايا الليمفاوية من السدود الفردية للحصول على أعداد أكبر المطلوبة لتطبيقات المصب. يسمح التزاوج الميزن للباحث بتحديد الحمل في غضون فترة 24 ساعة. على الرغم من أن الفئران تعيش لمدة 2.5 سنة تقريبا ، إلا أنها ستكون في سن الإنجاب من 4-7 أسابيع حتى 6-8 أشهر. وبما أن الفئران الأصغر سنا تنتج عادة جروا أصغر ، فإن الفئران الأنثوية لا تتزاوج بشكل عام حتى تتراوح بين 6-8 أسابيع ، والفئران الذكور حتى تتراوح أعمارهم بين 8-10 أسابيع. وبالنظر إلى أن estrus يستمر حوالي 15 ساعة في الفئران ويحدث كل 4-5 أيام، ومعدل التزاوج نموذجية (كشفت عن طريق المكونات المهبلية، انظر الشكل 4) حوالي 25٪. ولذلك من المهم استخدام الفئران في estrus والتخطيط لأعداد كافية للحصول على العدد المطلوب من السدود لتجربة معينة. يمكن تحديد مرحلة دورة استروس عن طريق مسحة المهبل cytology22. يمكن تحسين معدل التوصيل عن طريق راحة الذكور 48 ساعة قبل التزاوج والاستفادة من تأثير وايتن18. بدلا من ذلك، يمكن للمرء أن يدير مصل الفرس الحوامل، الذي يحاكي تأثير هرمون تحفيز الجريبات الذاتية، مما يؤدي إلى نضوج البويضات، وبعد 42-50 ساعة، gonadotropin المشيمي البشري، الذي يحاكي تأثير هرمون اللوتين الذاتية، مما أدى إلى الإباضة. هذا العلاج الهرموني يتجاوز شرط استروس ويجعل تقريبا جميع الإناث المعالجة تقبلا.
وخطوة حاسمة ثانية هي ضمان جودة تلطيخ FACS. يجب دائما أن يتم تهزيم الأجسام المضادة المستخدمة في قياس التدفق الخلوي واستخدامها في التركيز الأمثل ، ومن الضروري التحقق من أن الهضم الأنزيمي لا يشق الأسطح المضادة الحيوية. لتقييم ما إذا كان الإنزيم سيلتصق بسطح الظهارة ، يمكن للمرء أن يلطخ جزأين من نفس العينة بالتوازي ، أحدهما يخضع للهضم الأنزيمي والآخر ميكانيكي. وبالمثل، فإن استخدام الضوابط المناسبة والبقع المفردة أمر بالغ الأهمية للحصول على بيانات موثوقة. بالنسبة للأحداث النادرة ، يمكن استخدام الخرز لتوليد عينات وصمة عار واحدة. من المستحسن عدم استخدام الخرز لإعداد الفولتية ولكن بدلا من ذلك مجموعة من الخلايا التي تحتوي على الخلايا الليمفاوية وغيرها من الكريات البيض، مثل الخلايا الطحال. إذا تم استخدام الخرز ، فمن الضروري إعادة تنقية الأجسام المضادة لتلطيخ الخرز ، وبالتالي فإن كثافة الفلورية من الخرز الملون ستكون مماثلة لكثافة الفلورية للخلايا. في حالة وجود صعوبة في فصل الخلايا الإيجابية عن الخلايا السلبية لعلامة معينة ، يمكن أيضا استخدام عنصر تحكم FMO لتسهيل الإصابة بعلامة محددة. في حالة العلامات داخل الخلايا ، يجب استخدام عنصر تحكم متساوي النمط حيث قد يؤدي التلطيخ داخل الخلايا إلى أجسام مضادة متبقية غير منضمة ، والتي قد تكون موجودة داخل الخلايا بعد خطوات الغسيل وبالتالي تزيد من إشارة الخلفية. فمن المستحسن لتشغيل العينات في غضون 24 ساعة من تحديد الخلايا للحصول على أفضل النتائج في phenotyping بواسطة تحليل FACS، كما autofluorescence يزيد بشكل ملحوظ مع مرور الوقت وكثافة الفلورية لبعض الأجسام المضادة قد تنخفض مع مرور الوقت.
وثمة عامل حاسم آخر ينبغي النظر فيه هو التطبيق النهائي لتعليق الخلية الواحدة الذي تم الحصول عليه مع البروتوكول. بالنسبة للمقاايسات الوظيفية ، من الضروري العمل في ظروف معقمة. وبالمثل، لدراسات omics اللاحقة، من المهم أن تعمل في العقيمة وRNase، DNase وخالية من البروتياز.
البروتوكول المعروض هنا يركز على مجموعة phenotyping 1 ILCs ولكن يمكن تكييفها لphenotyping أنواع الخلايا الأخرى عن طريق تعديل لوحة الأجسام المضادة. من المستحسن أن يتم اختبار جميع الأجسام المضادة ضد هضم وتعليق الخلايا غير المهضومة للكشف عن فقدان / تغيير epitopes السطح عن طريق العلاج الأنزيمي. وبالمثل، يمكن استخدام إنزيمات مختلفة لهضم الأنسجة وزيادة إنتاجية الخلايا، ولكن يجب دراسة تأثيرها على الأسطح المضادة للجينات الحاسمة بعناية. في حين أن NKp46 هو علامة جيدة لخلايا NK الجنبي ويعمل في جميع سلالات الفئران المختبرية ، فإن التعبير عن NKp46 على خلايا uNK في فئران C57BL/6 أقل بكثير من خلايا NK الطحال. فمن الأفضل أن وصمة عار لكل من NK1.1 و NKp46 في وقت واحد. إذا كان يجب مقارنة أعضاء متعددة مباشرة ، فمن المستحسن علاج جميع العينات على قدم المساواة ، حتى لو لم يكن الهضم الأنزيمي مطلوبا للأنسجة مثل الطحال أو نخاع العظم. على الرغم من أن الطريقة المعروضة هنا تنطبق على الرحم غير الحامل ، فإن عزل حلقة الخلايا الليمفاوية بواسطة تدرج Percoll على مرحلتين سيكون صعبا ، وقد يكون عائد الخلايا المعزولة منخفضا جدا لتحليل FACS الموثوق به ، وبالتالي سيتطلب تجميع الخلايا المعزولة عن رحم الفئران الفردية غير الحامل23.
هناك قيود على البروتوكول للنظر في تفسير البيانات. كما هو الحال بالنسبة لجميع الأنسجة ، سيتم عزل الخلايا الليمفاوية المتداولة القادمة من الدم إلى جانب الخلايا المقيمة في الأنسجة. إذا كان استبعاد الخلايا الليمفاوية المتداولة ضروريا لتفسير البيانات ، فيمكن إجراء تلطيخ داخل الفيتية لتسمية الخلايا المتداولة. وعلاوة على ذلك، فإن القيد الثاني على البروتوكول هو أن بعض الخلايا سوف تضيع حيث لا يمكن استخراج جميع الخلايا من الأنسجة. يتم عرض المشاكل الأكثر شيوعا واستكشاف الأخطاء وإصلاحها في الجدول 2.
تاريخيا، اعتمدت دراسة الخلايا في الأنسجة على الفحص النسيجي لأقسام الأنسجة. يلخص استعراض ساندرا بيل الممتاز24 العمل المنجز على مدى أكثر من 100 عام حتى أواخر الثمانينيات. تظهر أوصاف الخلايا المعروفة فيما بعد باسم خلايا UNK في المخطوطات المنشورة قبل أكثر من نصف قرن من اكتشاف الخلايا الليمفاوية. لذلك، قبل اكتشاف خلايا NK في عام 1975، وقد أشير إلى خلايا UNK كخلايا الجليكوجين الأم أو خلايا الغدة الأذينية الحبيبية. قدمت آن كروي مساهمات كبيرة في هذا المجال25 وتكرمت بتعليم الفريق التشريح الذي قامت بتحسينه3 ، ويستخدم حاليا. على الرغم من أنه مفيد في وصف مورفولوجيا وموقع الأنسجة لخلايا UNK ، إلا أن الفحص النسيجي الكلاسيكي يقتصر على اكتشاف عدد قليل فقط من العلامات على الخلايا ذات الاهتمام. في عام 2008، وصفت طريقة تعتمد على قياس التدفق الخلوي للكشف في وقت واحد علامات متعددة على الخلايا الليمفاوية الرحمية26. هذا هو أساسا الأسلوب الذي تم وصفه في هذه الورقة. التكنولوجيات الحديثة مثل علم النسخ المكاني والتصوير عن طريق القياس الخلوي الشامل تجمع بين قوة علم الأنسجة وقياس التدفق الخلوي ، مما يسمح بالكشف المتزامن عن جينات أو بروتينات متعددة ، على التوالي ، والحفاظ على بنية الأنسجة الطبيعية.
تطبيقات الطريقة الموصوفة هنا متعددة وتشمل PHCS phenotyping ، المقايسة الوظيفية (مثل ELISPOT ، إزالة الرعي أو المقايسات السامة للخلايا) ، وفرز الخلايا ، وstoteomics اللاحقة أو البروتيوميات. وتشمل التطبيقات الأخرى التي يمكن تطويرها على أساس هذه الطريقة ثقافة وتوسيع خلايا NK البتية بعد فرز الخلايا أو التخصيب عن طريق الاستنفاد السلبي. حاليا، لا يوجد بروتوكول لثقافة وتوسيع خلايا UNK الماوس والحفاظ على صلاحيتها ووظائفها لفترة طويلة، بطريقة مماثلة لخلايا NK الإنسان التي يمكن زراعتها وتوسيعها لمدة 7-14 يوما بإضافة IL-2 أو مزيج IL-12 و IL-15. ومن شأن تحسين طريقة من هذا القبيل لخلايا uNK الماوس توفير المزيد من المرونة عند إجراء المقايسات الوظيفية والسماح لظروف متعددة لاختبار مع عدد أكبر من الخلايا. من ناحية أخرى ، من المعروف أن ظروف الثقافة تعدل النمط الظاهري الفريد من الخلايا الليمفاوية وربما وظيفتها أيضا.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه ولا تضارب في المصالح.
Acknowledgements
نشكر أعضاء الفريق السابقين والحاليين الذين ساعدوا في تطوير هذه الطريقة، بما في ذلك جان مارك دوسين ونورمان شريف وإيفا فيليبوفيتش وأنيتا كوالس. تم تمويل هذا البحث من قبل صندوق ويلكوم الاستئماني [رقم المنحة 200841/Z/16/Z] ومجلس البحوث الطبية (MR/P001092/1). ولغرض النفاذ المفتوح، طبق المؤلف ترخيصا عاما لحق المؤلف CC BY على أي نسخة مخطوطة مقبولة من المؤلف ناشئة عن هذا التقديم.
Materials
| Name | Company | Catalog Number | Comments |
| 70 µm cell strainers | Falcon | 352350 | |
| BSA | Sigma | A9647-100G | |
| CD19 antibody | BD | 562701 | |
| CD3 antibody | BD | 562600 | |
| CD45 antibody | BioLegend | 103108 | |
| CD49a antibody | BD | 740262 | |
| DNase I | Roche (Sigma) | 10104159001 | |
| EOMES antibody | eBioscience | 12-4875-82 | |
| Fc block Trustain fcx | BioLegend | 101320 | |
| Fetal Bovine Serum | Gibco | 10217-106 | |
| Fix/Perm buffer (part of BD Cytofix/Cytoperm Fixation/Permeabilization Kit) | BD | 554714 | |
| HBSS, calcium, magnesium, no phenol red | Gibco | 14025092 | |
| Liberase DH | Roche (Sigma) | 5401089001 | |
| Lysis buffer Pharmlyse | BD | 555899 | |
| NK1.1 antibody | BioLegend | 108739 | |
| NKp46 antibody | BioLegend | 137608 | |
| Paraformaldehyde 16% Solution (methanol-free) | Agar Scientific | AGR1026 | |
| PBS 10x | Gibco | 14030-048 | |
| PBS 1x (no Ca2+ or Mg2+) | Thermo Scientific | 14190144 | |
| Percoll | VWR international | 17-0891-01 | |
| Phosphate buffered saline | Sigma-Aldrich | P5368-10PAK | |
| Pre-Separation filters | Miltenyi | 130-095-823 | |
| RMPI-1640 medium + GlutaMAX | Gibco | 61870-010 | |
| UltraPure 0.5M EDTA, pH 8.0 | Thermo Scientific | 15575020 | |
| Zombie Violet Fixable Viability dye | BioLegend | 423113 |
References
- Colucci, F. The immunological code of pregnancy. Science. 365 (6456), 862-863 (2019).
- Mor, G., Aldo, P., Alvero, A. B. The unique immunological and microbial aspects of pregnancy. Nature reviews. Immunology. 17 (8), 469-482 (2017).
- Croy, A., Yamada, A., DeMayo, F., Adamson, S. L. . The Guide to Investigation of Mouse Pregnancy. , (2014).
- Filipovic, I., et al. Molecular definition of group 1 innate lymphoid cells in the mouse uterus. Nature Communications. 9 (1), 4492 (2018).
- Chen, Z., et al. DBA-lectin reactivity defines mouse uterine natural killer cell subsets with biased gene expression. Biology of Reproduction. 87 (4), 81 (2012).
- Moffett, A., Colucci, F. Uterine NK cells: active regulators at the maternal-fetal interface. The Journal of Clinical Investigation. 124 (5), 1872-1879 (2014).
- Gaynor, L. M., Colucci, F. Uterine natural killer cells: Functional distinctions and influence on pregnancy in humans and mice. Frontiers in Immunology. 8, 467 (2017).
- Sojka, D. K., Yang, L., Yokoyama, W. M. Uterine natural killer cells. Frontiers in immunology. 10, 960 (2019).
- Wilkens, J., et al. Uterine NK cells regulate endometrial bleeding in women and are suppressed by the progesterone receptor modulator asoprisnil. The Journal of Immunology. 191 (5), 2226-2235 (2013).
- Ashkar, A. A., Di Santo, J. P., Croy, B. A. Interferon γ contributes to initiation of uterine vascular modification, decidual integrity, and uterine natural killer cell maturation during normal murine pregnancy. Journal of Experimental Medicine. 192 (2), 259-270 (2000).
- Hanna, J., et al. Decidual NK cells regulate key developmental processes at the human fetal-maternal interface. Nature Medicine. 12 (9), 1065-1074 (2006).
- Chakraborty, D., Rumi, M. A. K., Konno, T., Soares, M. J. Natural killer cells direct hemochorial placentation by regulating hypoxia-inducible factor dependent trophoblast lineage decisions. Proceedings of the National Academy of Sciences of the United States of America. 108 (39), 16295-16300 (2011).
- Crespo, &. #. 1. 9. 4. ;. C., et al. Decidual NK cells transfer granulysin to selectively kill bacteria in trophoblasts. Cell. 182 (5), 1125-1139 (2020).
- Shmeleva, E. V., Colucci, F. Maternal natural killer cells at the intersection between reproduction and mucosal immunity. Mucosal Immunology. , 1-15 (2020).
- Kather, A., et al. Neither lymphotoxin alpha nor lymphotoxin beta receptor expression is required for biogenesis of lymphoid aggregates or differentiation of natural killer cells in the pregnant mouse uterus. Immunology. 108 (3), 338-345 (2003).
- Croy, B. A., et al. Analysis of uterine natural killer cells in mice. Methods in Molecular Biology. 612, 465-503 (2010).
- Vander lee, S., Boot, L. M. Spontaneous pseudopregnancy in mice. II. Acta Physiologica et Pharmacologica Neerlandica. 5 (2), 213-215 (1956).
- Whitten, W. K. Modification of the oestrous cycle of the mouse by external stimuli associated with the male. The Journal of Endocrinology. 13 (4), 399-404 (1956).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (second edition). European Journal of Immunology. 49 (10), 1457 (2019).
- Kim, S., et al. Licensing of natural killer cells by host major histocompatibility complex class I molecules. Nature. 436 (7051), 709-713 (2005).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nature Protocols. 9 (1), 209-222 (2014).
- Caligioni, C. S. Assessing reproductive status/stages in mice. Current Protocols in Neuroscience. , (2009).
- Doisne, J. -. M., et al. Composition, development, and function of uterine innate lymphoid cells. Journal of Immunology. 195 (8), 3937-3945 (2015).
- Peel, S. Fate of GMG Cells. Granulated Metrial Gland Cells Advances in Anatomy, Embryology and Cell Biology. 115, (1989).
- Croy, B. A., vanden Heuvel, M. J., Borzychowski, A. M., Tayade, C. Uterine natural killer cells: a specialized differentiation regulated by ovarian hormones. Immunological Reviews. 214, 161-185 (2006).
- Yadi, H., Burke, S., Madeja, Z., Hemberger, M., Moffett, A., Colucci, F. Unique receptor repertoire in mouse uterine NK cells. Journal of Immunology. 181 (9), 6140-6147 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved