Method Article
分离子宫先天淋巴细胞,用于流式细胞术分析
* 这些作者具有相同的贡献
摘要
这是一种从怀孕和非怀孕小鼠中分离子宫淋巴细胞的方法。该方法可用于多种下游应用,如FACS表型分析,细胞分选,功能测定,RNA-seq和蛋白质组学。这里的方案演示了如何通过流式细胞术对1组子宫先天淋巴细胞进行表型分析。
摘要
这里描述的是通过流式细胞术从个体妊娠子宫中分离小鼠组1子宫先天淋巴细胞(g1 uILCs)并对其进行表型的简单方法。该协议描述了如何设置时间交配以获得多个同步水坝,怀孕子宫的机械和酶消化,单细胞悬浮液的染色以及表型和区分g1 uILCs的FACS策略。尽管这种方法不可避免地会丢失组织内细胞分布的空间信息,但该协议已成功应用于确定uILC异质性,它们对影响妊娠的母体和胎儿因子的反应,它们的基因表达谱及其功能。
引言
这里描述的是一种从个体怀孕子宫中获得高产率的子宫先天淋巴细胞的简单方法。该方法保留了子宫先天淋巴细胞的蛋白质表面表达和功能,适用于FACS表型,RNAseq,蛋白质组学或功能测定等后续应用。这里的重点是通过流式细胞术对1组uILCs进行表型分析。
子宫由三层组成:子宫内膜,子宫肌层和子宫周(图1)。子宫内膜是粘膜,衬里在子宫腔内。黄体酮由黄体产生,将子宫内膜转化为蜕膜。子宫肌膜由构成子宫壁的两层平滑肌组成。子宫周是包裹子宫并通过称为膜的宽韧带将其连接到腹膜的血清。在子宫的横截面中,与腔相反的部分称为介体侧,而靠近腔的部分称为反膜侧。各种母体白细胞填充子宫内膜和蜕膜,包括几种类型的细胞,其中先天免疫细胞代表绝大多数细胞。先天性淋巴细胞(ILCs)、巨噬细胞、树突状细胞(DC)以及CD4+ 和CD8+ T淋巴细胞、调节性T细胞(Tregs)和稀有B细胞,都可能在整个妊娠期间对子宫环境的调节中发挥重要作用1,2。子宫中的ILCs不仅存在于粘膜中,还存在于小鼠的子宫肌层中。包括所有三组ILC在内,子宫确实是1组ILCs最密集的器官。随着整个妊娠期间子宫组织的结构转变,子宫白细胞的数量和比例也发生了变化(参见 图2A ,了解第1组uILC亚群百分比变化的示例)3,4。
当本文中提到小鼠时,是指近交实验室小鼠的C57BL / 6菌株。异种小鼠(例如NMRI小鼠)通常用于生殖研究,因为它们的繁殖率很高。然而,使用近交系菌株对于产生一致的结果是必要的,免疫学家最喜欢的遗传背景是C57BL / 6,也称为B6。
妊娠中期B6坝中约30%的子宫白细胞是g1 uILCs,通过流式细胞术将其定义为活的CD45 + CD3-CD19-NK1.1 + NKp46 +细胞(图2B):促血管生成组织驻留NK(trNK),产生常规NK(cNK)的IFN-g和uILC14,5。uNK细胞的比例在人类中甚至更高,在妊娠早期达到约70%6。人类和小鼠 uNK 和 uILC7,8 之间的相似之处多于差异。虽然牢记差异很重要,但整合有关这两个物种的现有信息是有用的。当结合从研究人类和实验室啮齿动物中的uILC中获得的信息时,很明显NK细胞有助于子宫生物学所必需的稳态变化,包括维持动脉完整性9和螺旋动脉重塑10,以及滋养层侵袭11,12。它们在防御病原体方面也发挥特定作用13,14。在小鼠和大鼠中,除了填充植入部位周围的蜕膜外,NK细胞还以称为妊娠膜淋巴结聚集体(MLAp)15的瞬态结构在坝子宫肌膜的两个肌肉层之间积聚(图1B),过去也称为子宫腺,其功能尚未被发现。
这里描述的是实验室中使用的方法的详细方案,该方法使用机械分解和酶消化的组合从怀孕小鼠的子宫中分离淋巴细胞。由于该方法使用整个子宫,因此在妊娠期间从子宫中分离的淋巴细胞是蜕膜细胞和子宫肌细胞的混合物。从子宫壁进一步解剖蜕膜及其MLAp是可能的,并且之前已经描述过16。这里描述的方法是为了获得子宫淋巴细胞,同时保持蛋白质表面表达,细胞功能和活力而开发的。结果是单细胞悬浮液,残留的细胞碎片最少,怀孕子宫在妊娠中期(10.5天)的产量通常在100万至500万个细胞之间。该方法的应用包括流式细胞术的表型分析,用于后续转录组学或蛋白质组学研究的细胞分选,功能研究,如细胞内细胞因子产生,脱颗粒,ELISPOT或细胞毒性测定。这里介绍的方案侧重于鉴定第1组ILCs,但可以适用于其他细胞类型,例如其他ILCs,T细胞,B细胞,DC或巨噬细胞,并对用于FACS分析的抗体面板进行微小修改。该协议还可用于从其他组织中分离细胞和用于混合的非妊娠子宫。
研究方案
本文中描述的所有动物实验均根据英国内政部发布的PP2363781根据1986年动物(科学程序)法进行。下面的方案包括几个部分,从小鼠饲养开始,最后进行染色以进行FACS分析。 图 3 反映了该协议的主要步骤。协议中使用的材料列在 材料表中。
1. 一般小鼠饲养、交配、解剖
- 将7-14周龄的雌性小鼠保持在特定的无病原体(SPF)条件下并分组饲养(根据笼子大小和动物体重通常为4-6只雌性),持续10-14天,以触发Lee-Boot效应,从而产生发情同步17。
- 将雄性种马保持在SPF条件下,单胎,并在每次交配之间休息至少48小时(精子再生时间)。最好使用经验丰富的经过验证的3-4个月大的种马雄性,因为它们通常比年轻种马更具表现力。
- 为了增加雌性怀孕的可能性,在交配前3天将雄性笼子中的雄性笼子中引入脏的垫料。这通过暴露于雄性尿液信息素触发惠顿效应18 ,并导致同步发情以及增强的交配接受度。
- 在第0天(D0),设置小鼠进行交配,每两只雌性使用一只雄性;考虑大约20%-25%的插头率。
注意:交配可能会在夜间发生,因为小鼠是夜间活动的动物。 - 在交配后的早晨(D0.5),检查是否存在阴道塞,这是交配的指标(图4)。阴道塞是男性射精的集合体,通常在交配后持续长达8-24小时。清晨检查插头。
- 将插入的雌性将它们整合到新的笼子中并指定它们。将雄性放回笼子休息。
- 在D9.5或10.5-配接后,准备5 mL管与1 mL无菌HBSS 1x(含Mg2 + 和Ca2 +)进行组织收集,并将它们放在冰上。
- 通过宫颈脱位进行动物安乐死,然后进行血化以确认死亡。
- 如果下游应用需要,请在无菌环境中工作。安乐死后,立即用70%乙醇擦拭小鼠身体,然后用无菌器械在层流通量柜下进行解剖。
- 解剖没有介心间脂肪的怀孕子宫(图5),并将整个子宫置于准备好并适当标记的5 mL管中。将管子放在冰上。
2. 子宫的机械和酶消化
- 为了制备酶消化液,将无菌HBSS 1x的每个子宫3mL与30μg/ mL的DNA酶和0.1 Wünsch单位(WU)/ mL的Liberase DH或0.52 WU / mL Liberase TM混合。将溶液置于37°C的水浴中。
注意:可以使用Liberase TM和Liberase DH。选择一种而不是另一种必须以它们对用于后续流式细胞术分析的抗体识别的表位的潜在影响为指导。
注意:如果使用冻干酶,请在引擎盖下工作。 - 在PBS中准备20毫升5 mM EDTA(无Ca2 + / Mg 2 +)。将一半溶液在37°C的水浴中,另一半放在冰上。
- 在层流通量柜下,在无菌培养皿中用无菌器械轻轻去除怀孕子宫周围的脂肪。不要让纸巾变干。
- 用无菌器械解剖每个着床部位以去除胎儿(海马形半透明结构,长约1毫米)(图6A)。丢弃胎儿。
- 将子宫返回到原来的收集5 mL管,并使用剪刀直接在5 mL管和收集培养基中切碎组织。在手术之间始终将管子放在冰上。
- 将含有切碎组织的5mL管置于37°C的水浴中。
- 向每个样品中加入3mL温酶消化混合物,使管中液体的总体积为4mL(1mL收集培养基与切碎的子宫和3mL酶消化溶液)。在37°C下搅拌5 mL管30分钟,以增强酶消化活性。
- 涡旋5 mL管并将其放在冰上以抑制酶的作用。然后,随后,将内容物转移到正确标记的15 mL离心管中。
- 使用 10 mL 冰冷的 5 mM EDTA PBS 溶液将 5 mL 离心管中的所有东西冲洗到 15 mL 离心管中。
- 将含有消化组织的15mL离心管以400× g离心10分钟。
- 弃去上清液,轻轻轻地轻拂沉淀,然后将其重悬于10mL温热(37°C)5mM EDTA PBS溶液中。
- 将样品在37°C的15mL离心管中孵育15分钟,以除去剩余的消化培养基并减少细胞结块。
- 将样品在高处涡旋10秒,以进一步促进组织解离。
3. 将子宫加工成单细胞悬浮液
- 使用无菌1 mL注射器的柱塞,将消化的组织通过70μm过滤器强制到正确标记且无菌的50mL离心管上,以除去细胞团块和未解离的组织。
- 用总共10 mL冷PBS洗涤过滤器几次以收集所有细胞。
- 将50 mL离心管在400× g下旋转10分钟。
注意:使用选项A或选项B执行进一步的步骤,选项A允许比选项B更好地富集淋巴细胞,碎片和基质细胞污染更少。然而,选项B由于细胞损失少,样品间细胞产量变异性较小,免疫细胞产量更高。选项B在技术上也更容易执行。因此,根据首选项,继续使用选项 A 或选项 B。- 选项 A 的步骤如下。
- 每个样品标记一个无菌的15 mL离心管,其中含有5 mL在PBS中稀释的80%(v / v)等渗Percoll。
- 旋转后,从50mL离心管中丢弃上清液。使用移液器男孩将每个沉淀重悬于PBS中8 mL的40%(v / v)等渗Percoll中。
- 使用移液器男孩以低速小心地将重悬于40%Percoll溶液中的沉淀物覆盖到80%Percoll溶液上。缓慢而连续地移液;以45°的角度握住15 mL管(图6B)。
- 在不干扰覆盖层的情况下,在室温下(中等加速度和最小断裂)下,在850× g下离心15mL离心管20分钟。
- 小心地从离心机中取出试管,不要干扰Percoll层(图6C)。
- 在不干扰两个Percoll溶液界面处的白细胞环的情况下,使用无菌巴斯德移液器丢弃除约0.5-1 mL顶部Percoll层之外的所有白细胞环。
- 在尝试吸入最少量的Percoll溶液(总共高达4-5mL)时,小心地收集白细胞环并将细胞转移到新标记的15mL离心管中。
- 在每个样品中加入 10 mL 无菌 RMPI-1640 培养基,并辅以 10% 的热灭活 FBS。
- 在4°C下在500× g 下离心5分钟。
- 弃去上清液并进行红细胞裂解。
- 选项 B 的步骤如下。
- 每个样品标记一个无菌的15 mL离心管。
- 旋转后,从50mL离心管中丢弃上清液。使用移液器男孩在RPMI-1640培养基中用8 mL的35%(v / v)等渗Percoll重悬每个沉淀。
- 将样品转移到15 mL离心管中。
- 在室温下以940× g 离心样品10分钟,具有中等加速度和最小断裂。
- 使用吸气器或移液器男孩小心地吸出上清液(而不是通过倒置管)。
- 将沉淀重悬于14mL的RPMI-1640培养基中,补充有10%热灭活FBS,然后在4°C下以500× g 离心样品5分钟。
- 通过抽吸丢弃上清液,然后进行红细胞裂解。
- 选项 A 的步骤如下。
4.红细胞裂解
- 为了裂解红细胞,将样品重悬于3mL的1x红细胞裂解溶液中,并在室温下孵育3分钟。
- 向样品中加入10 mL PBS以停止反应。
- 将试管以400× g 离心5分钟并弃去上清液。
- 加入 10 mL PBS 并重复步骤 4.3。
- 将每个沉淀重悬于1 mLRPI-1640培养基中,并补充10%的热灭活FBS。
- 将样品通过无菌的70μm细胞过滤器。
- 根据制造商的说明,使用台盼蓝和Neubauer腔室进行细胞计数。
- 将细胞悬浮液的浓度调节至100μLPBS或培养基中的1-2百万个细胞。
5. 面板设计策略和控制
注:本文中描述的面板适用于uILC1,trNK和cNK细胞的鉴别,并且设计用于5激光BD LSRFortessa。可以进行微小的修改以研究不同的细胞群并使用替代荧光染料。建议检查仪器的配置,使用滴定抗体以获得最佳分离效果,咨询制造商的亮度指数,并使用最亮的染料来检测低表达抗原,如NKp46,并遵循一般指南19。建议包括用于 NKp46 的荧光减一 (FMO) 对照。
6. 先天淋巴细胞染色用于 FACS 表型分析
- 将每孔1-2百万个细胞转移到圆底96孔板中。
- 在4°C下以400× g 旋转板3分钟,并通过将其轻拂到水槽中来丢弃上清液。
- 使用多通道移液器将细胞沉淀重悬到100μLPBS(无蛋白质和叠氮化物)中。
注意:确保PBS不含叠氮化钠,没有Tris或任何蛋白质,用于后续步骤。 - 重复步骤 6.2。
- 将细胞重悬于50μL可固定的活性染料中,稀释在PBS(无蛋白质和叠氮化物)(1:1,000)中。在黑暗中在室温下孵育细胞30分钟。
注意:确保PBS不含叠氮化钠,Tris或任何蛋白质,如FBS或BSA,因为这可能导致死细胞的染色强度降低和/或活细胞的背景染色增加。
注意:如果活性染料是粉末状的,请在罩下使用。 - 加入150μLPBS,用多通道移液器重悬细胞,然后重复步骤6.2。
- 将细胞重悬于含有Fc受体阻断试剂的25μL FACS缓冲液(补充有1%BSA或2%FBS的PBS)中。将细胞在4°C下孵育5分钟。
- 加入25μL表面抗体混合物。
注意:在实验前,始终滴定抗体并优化抗体组合。 - 在黑暗中将样品在室温下孵育20分钟。
- 向每个孔中加入150μLFACS缓冲液,充分混合,然后重复步骤6.2。
- 重复步骤 6.10。
注意:使用选项 A 或选项 B 执行进一步的步骤。使用选项 A 用表面标记物染色细胞。使用选项 B 通过流式细胞术研究细胞内标志物。- 选项 A 的步骤如下。
- 将样品重悬于每孔100μL4%多聚甲醛(PFA)中,并在室温下孵育20分钟。
注意:在引擎盖下使用PFA。请参阅安全表,以安全丢弃PFA废物/与PFA接触的物品(例如移液器)。 - 重复步骤 6.2 两次。
注意:请勿在此处轻拂到水槽中丢弃,因为它包含 PFA。用移液器吸出,并按照安全表丢弃废物。 - 将样品重悬于200μLPBS中。
- 将样品转移到标记的FACS管中,并补充100μLPBS。将管子放在冰上或冰箱中,直到使用FACS分析进行处理。在24小时内在流式细胞仪上采集样品。
- 将样品重悬于每孔100μL4%多聚甲醛(PFA)中,并在室温下孵育20分钟。
- 选项 B 的步骤如下。
- 将样品重悬在每孔100μL固定/透化溶液(含有多聚甲醛)中,并在4°C下孵育20分钟。
注意:在引擎盖下使用PFA。请参阅安全表,以安全丢弃PFA废物/与PFA接触的物品(例如移液器)。 - 重复步骤 6.2。
注意:请勿在此处轻拂到水槽中丢弃,因为它包含 PFA。用移液器吸出,并按照安全表丢弃废物。 - 加入200μL1x透化/洗涤缓冲液,充分混合,然后重复步骤6.2。
- 重复步骤 6.11.2.3。
- 将固定和透化的细胞重悬于50μL含有抗体混合物的1x透化/洗涤缓冲液中,用于细胞内染色。
- 在黑暗中将样品在4°C孵育30分钟。
- 加入200μL1x透化/洗涤溶液,充分混合,然后重复步骤6.2。
- 重复步骤 6.11.2.7。
- 将样品重悬于200μLPBS中。
- 将样品转移到标记的FACS管中,并补充100μLPBS。将管子放在冰上或冰箱中,直到使用FACS分析进行处理。在24小时内在流式细胞仪上采集样品。
注意:执行该方案后,蜕膜细胞悬浮液已准备好进行FACS分析。建议每个样本记录尽可能多的事件;必须获得至少1,000-3,000个父母群体的事件才能获得可靠的结果。
- 将样品重悬在每孔100μL固定/透化溶液(含有多聚甲醛)中,并在4°C下孵育20分钟。
- 选项 A 的步骤如下。
结果
图3总结了描述获得子宫白细胞单细胞悬浮液的方法的主要步骤。图2B中演示的是用于鉴定B6小鼠中g1 ILCs的三个亚群的基本FACS门控策略:uILC1(CD49a + Eomes-),trNK(CD49a + Eomes +)和cNK(CD49a-Eomes +)细胞。可以对这些群体进行进一步分析,以研究g1 ILCs的各种表面和细胞内标志物。例如,在用抗NK1.1抗体刺激后,可以在uILC1,trNK和cNK细胞中评估IFN-ɣ和自身MHC受体的共表达(图7)。
根据研究问题,可以调整方案(图3)和抗体检测组。重要的是,建议在一个FACS面板中使用抗NK1.1和抗NKp46抗体,用于g1 ILC门控(图2B 和 表1)。应该注意的是,从血液,脾脏或肝脏获得的g1 ILCs在其表面上的NKp46表达高于子宫对应物(图8)。NK1.1的表面染色可以更好地分离,并使子宫g1 ILC易于门控(图8)。虽然NKp46由所有小鼠品系表达,但抗NK1.1抗体PK136识别的NKR-P1C抗原仅由某些小鼠品系表达,包括C57BL / 6(即B6),FVB / N和NZB,但不包括AKR,BALB / C,CBA / J,C3H,DBA / 1,DBA / 2,NOD,SJL或129。此外,如果研究人员打算研究关键的NK细胞受体,如MHC受体Ly49,重要的是要了解实验室小鼠品系中的等位基因变异,这概括了人类杀伤细胞免疫球蛋白样受体(KIR)的高变异性。此外,如果要用NK1.1刺激细胞进行功能测定,如Kim,S.等人.20所述,可能希望用抗NKp46而不是抗NK1.1染色细胞,因为NKR-P1C抗原可能被交联抗NK1.1占据,或者受体下调可能跟随刺激。受体占用或下调都可能阻碍使用用于刺激的相同抗体进行染色。
酶解组织的一个常见问题是用于消化培养基的酶改变细胞上的表面表位。例如,如果使用Liberase TM,则MHC CD94:NKG2A受体的染色效果较差。然而,用Liberase DH消化可以保留16A11抗体克隆对NKG2A的识别(图9)。建议检查酶对FACS面板中所有表位的影响。为此,使用通过机械解离获得的小鼠脾细胞的悬浮液(通过70μm过滤器使整个脾脏)。然后将样品分成两个或多个部分,然后用含有或不含酶的培养基孵育。
如前所述,血液来源的细胞存在于组织解离的样品中。如果需要,可以使用Masopust实验室开发的血管内染色方法排除血液污染物21。 图10 显示,妊娠第8.5天子宫组织样本中存在的g1 ILCs中约有6.5%是血液来源的。用于血管内染色的抗CD45抗体可以与用于转储通道的荧光染料偶联;这将排除血液污染物,而无需使用额外的荧光通道。最常见的问题及其解决方案如 表 2 所示。

图1:小鼠子宫的横截面。 (A)小鼠子宫横截面(非妊娠)表明存在多种母体白细胞,这些 白细胞填充子宫。(C)小鼠子宫横截面(妊娠第13.5天)。(D)从囊胚期开始小鼠与人胎盘形成的比较。使用 BioRender.com 创建的图像。 请点击此处查看此图的放大版本。
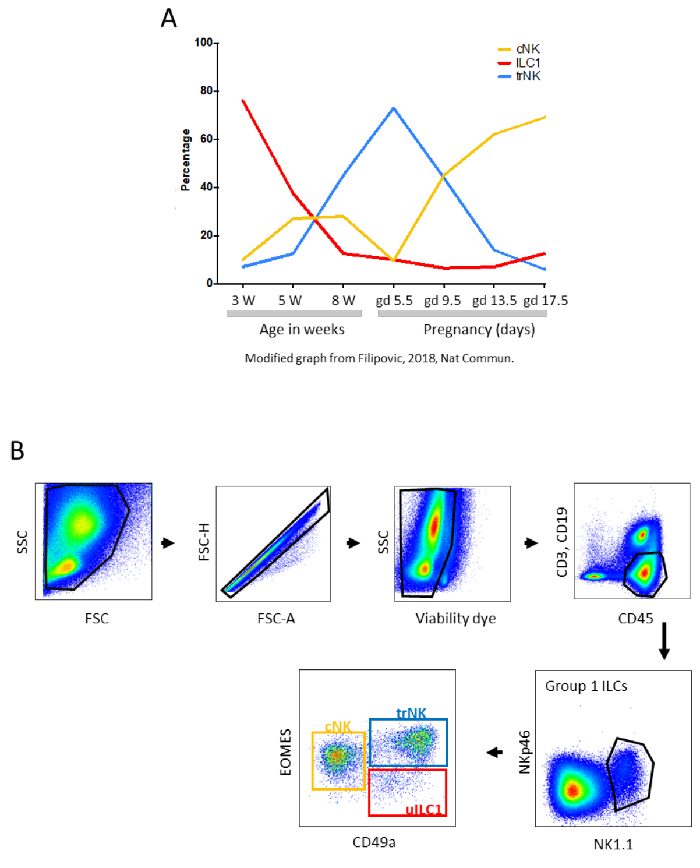
图2:子宫g1 ILC1的亚群(A)早期和怀孕期间小鼠中子宫cNK,ILC1和trNK的百分比。W - 周,gd - 妊娠日。来自Filipovic,I.等人的修改图。(B)通过流式细胞术分析子宫组1 ILC亚群的门控策略。淋巴细胞在妊娠第10.5天从子宫组织中分离出来。使用含有Liberase TM的消化培养基进行组织消化。细胞根据其散射光的能力进行门控。使用FSC-A与FSC-H图排除双联细胞,仅进一步分析CD45 + CD3-CD19-活细胞。在CD45 + CD3-CD19-活细胞内,第1组ILC门被鉴定为NK1.1 + NKp46 +细胞。在第1组ILCs中,可以鉴定出三个亚群:CD49a-Eomes +常规NK细胞(cNK),CD49a + Eomes +组织驻留NK细胞(trNK)和CD49a + Eomes- uILC1。请点击此处查看此图的放大版本。
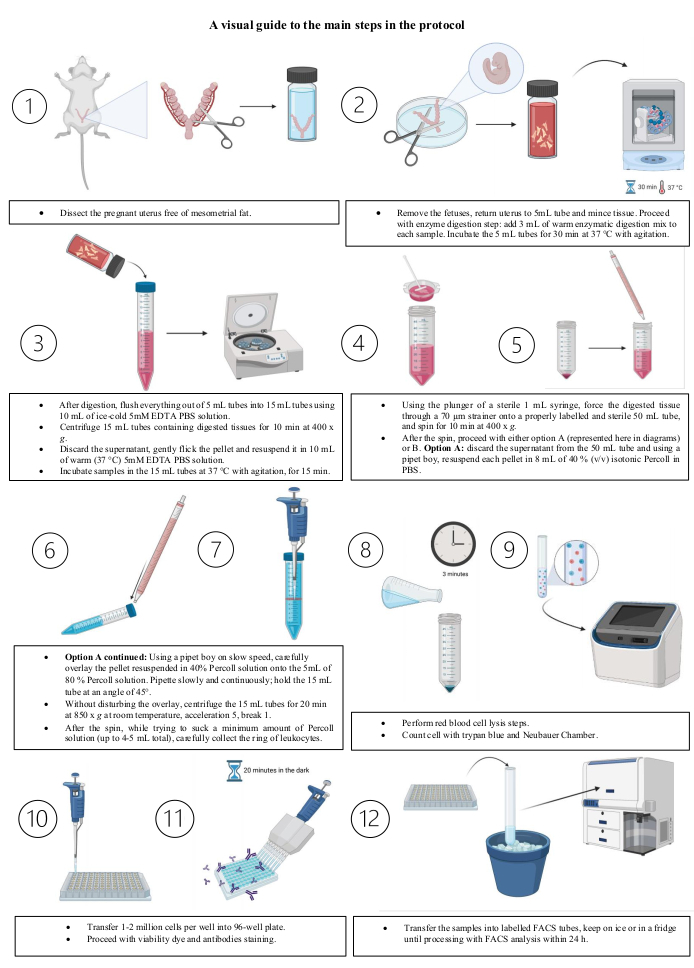
图 3:协议主要步骤的可视化指南。 (1)解剖没有膜状脂肪的怀孕子宫。(2)取出胎儿;将子宫放回5 mL管中并切碎组织。继续酶消化步骤:向每个样品中加入3 mL温酶消化混合物。搅拌在37°C下孵育5 mL管30分钟。(3) (i) 消解后,使用 10 mL 冰冷 5 mM EDTA PBS 溶液将 5 mL 管中的所有内容冲洗到 15 mL 管中。(ii)在400× g下离心含有消化组织的15mL管10分钟。(三) 丢弃上清液;轻轻轻地轻拂沉淀并将其重悬于10 mL温热(37°C)5mM EDTA PBS溶液中。(iv)将样品在37°C下搅拌的15 mL管中孵育15分钟(4)使用无菌1 mL注射器的柱塞,迫使消化组织通过70μm过滤器到正确标记和无菌的50 mL管上,并在400× g下旋转10分钟。(5)旋转后,继续使用选项A(如图所示)或B. 选项A: 从50 mL管中丢弃上清液,并使用移液器男孩将每个沉淀重悬于PBS中的8 mL 40%(v / v)等渗Percoll中。(6)(i) 选项A继续: 使用移液器男孩以低速,小心地将沉淀重悬于40%Percoll溶液中,覆盖在5 mL的80%Percoll溶液上。缓慢而连续地移液;以 45° 的角度握住 15 mL 离心管。(ii) 在不干扰覆盖层的情况下,在室温下以850× g 离心15毫升管20分钟,中等加速度和缓慢断裂。(7)旋转后,在尝试吸入最少量的Percoll溶液(总共高达4-5mL)的同时,小心地收集白细胞环。(8)执行红细胞裂解步骤。(9)使用台盼蓝和Neubauer室计数细胞。(10)将每孔1-2百万个细胞转移到圆底96孔板中。(11)继续进行活性染料和抗体染色。(12)最后,将样品转移到标记的FACS管中。将管子放在冰上或冰箱中,直到在24小时内用FACS分析处理。使用 BioRender.com 创建的图像。 请点击此处查看此图的放大版本。
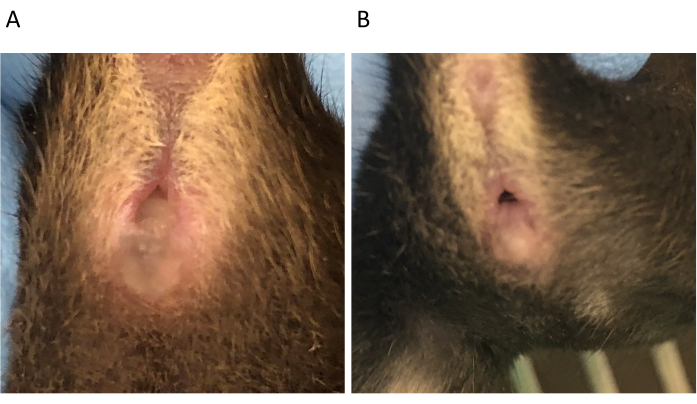
图 4:C57BL/6 雌性在交配后 0.5 天时阴道塞 (A) 和没有阴道塞 (B)。请单击此处查看此图的放大版本。

图5:解剖以从怀孕的小鼠中提取子宫 (A)用针将大坝固定在软板上,用70%乙醇擦拭身体。做两个垂直切口,如蓝色虚线所示。(B)皮肤被抬起以暴露内脏。肠袢被轻轻地向上移动以可视化子宫。(C)子宫通过在三个点处切割来采样:卵巢旁边和子宫颈处,分别由两条蓝色虚线和蓝色箭头表示。 请点击此处查看此图的放大版本。
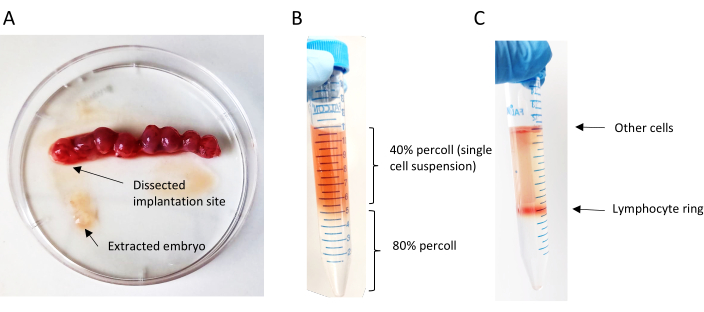
图6:单细胞悬浮液的制备(A)机械地将胚胎从其植入部位移除。(B) 佩尔科尔梯度叠加层;顶层包含Percoll的40%的单细胞悬浮液,底层含有Percoll的80%。(C)离心后淋巴细胞环形成的percoll梯度。请点击此处查看此图的放大版本。
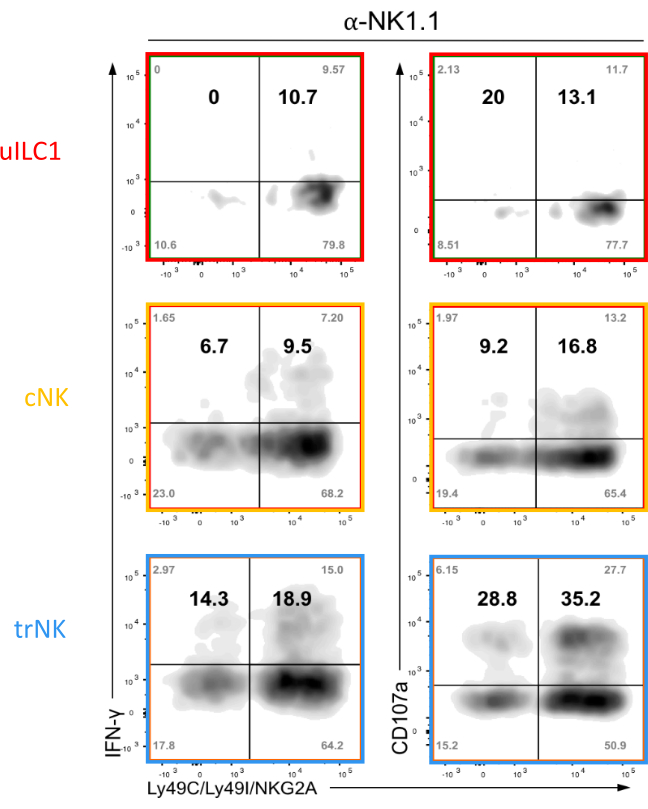
图7:使用第1组ILCs进行功能测定的代表性FACS分析。 在NK1.1与板结合抗体交联后,在表达自身MHC(Ly49C,Ly49I和NKG2A)的NK受体的1组ILCs中细胞内IFN-ɣ和表面CD107a检测与不表达NKC的ILC进行比较。在妊娠第9.5天从子宫组织中分离细胞。使用含有Liberase DH的消化培养基进行组织消化。显示的是所有四个象限(角)的原始值,以及表达自我受体的细胞和没有自我受体的响应者之间响应者的相对百分比(粗体数字)。 请点击此处查看此图的放大版本。
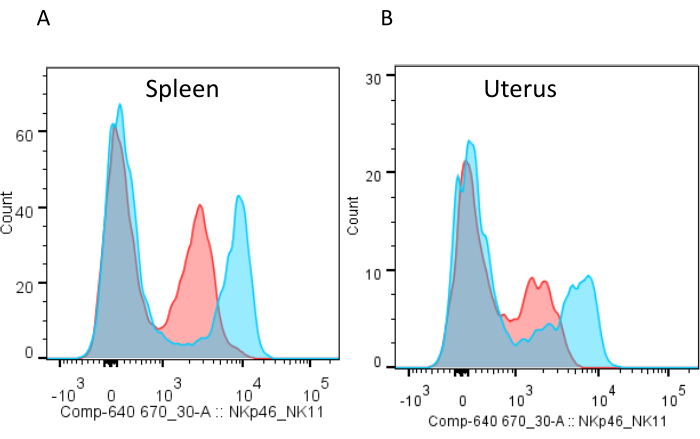
图8:用抗NKp46和抗NK1.1抗体染色脾脏和子宫淋巴细胞。 (A)妊娠第10.5天从小鼠脾脏和(B)子宫获得的细胞悬浮液一分为二;一部分染有NKp46-APC(红色),另一部分染有NK1.1-APC(蓝色)。请注意,子宫淋巴细胞的NKp46染色不会像脾淋巴细胞那样整齐地分离NKp46 + 和NKp46- 细胞。 请点击此处查看此图的放大版本。
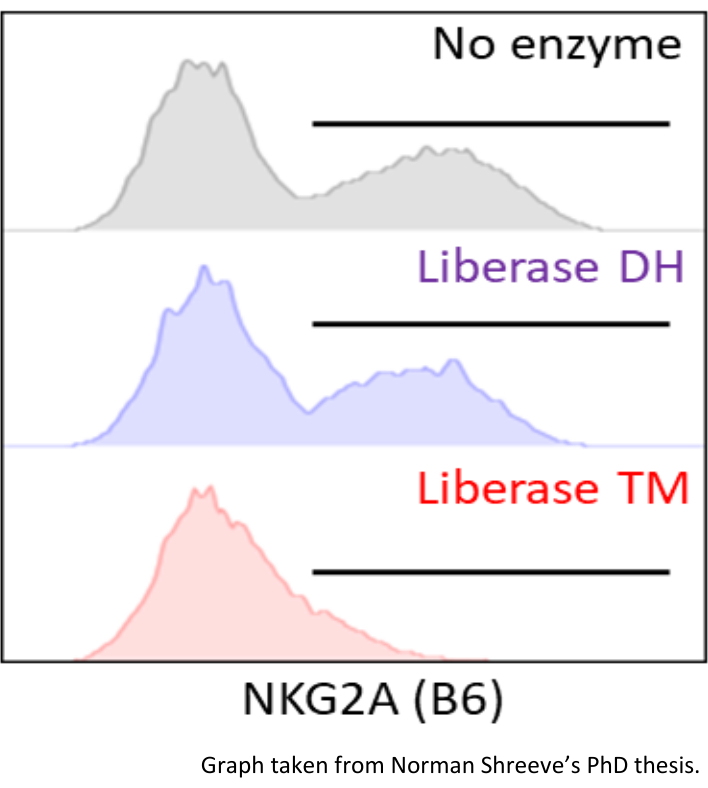
图9:通过与消化培养基孵育NKG2A MFI(抗体克隆:16A11)的减少。 将C56BL/6小鼠脾细胞的细胞悬浮液分为三部分。一部分在Liberase DH消化培养基(HBSS含有0.13 WU / mL Liberase DH和30μg/ mL DNAse)中孵育,另一部分与Liberase TM消化培养基(HBSS含有0.52 WU / mL Liberase TM和30μg/ mL DNAse)孵育。第三部分在37°C下用纯HBS处理30分钟。 通过流式细胞术评估ng1 ILCs上NKG2A标记物的表达。图表取自Shreeeve N。子宫NK细胞抑制在怀孕中的作用(论文);主管:科鲁奇F,2020年。 请点击此处查看此图的放大版本。
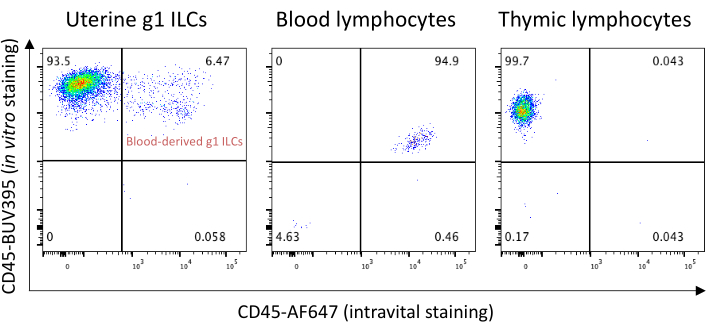
图 10:使用抗 CD45 抗体进行活体细胞内染色,以排除血源性 g1 ILC。在静脉注射后3 min用3 μgCD45-AF647在妊娠第8.5天扑杀C57BL / 6坝鼠。收获子宫,全血和胸腺并进行FACS分析。X轴显示CD45-AF647静脉染色的信号,Y轴显示体 外 染色CD45-BUV395的信号。亚群的百分比以象限显示。 请点击此处查看此图的放大版本。
| 抗体/染料 | 克隆 | 荧光染料 | 激光 | |
| 1(转储通道) | 僵尸紫罗兰可修复活性染料 | 紫 | ||
| 光盘19 | 1D3 | BV421系列 | ||
| 光盘3 | 145-2C11 | BV421系列 | ||
| 2 | CD45 | 30-F11 | 菲克 | 蓝 |
| 3 | NK1.1 | PK136 | BV605系列 | 紫 |
| 4 | NKp46 | 29A1.4 | 阿卡 | 红 |
| 5 | CD49a | Ha31/8 | 宝马395 | 紫外线的 |
| 6 | 断续器 | 丹11磁 | 体育 | 绿 |
表1:传统5激光细胞仪的FACS面板示例。
| 问题 | 可能的原因 | 建议 |
| 细胞环在两个percoll溶液的界面上不可见 | 在样品处理过程中,percoll溶液的分层不良或混合两层 | 在叠加过程中,要格外小心,不要破坏80%的percoll垫。样品处理过程中要注意:不要干扰percoll接口 |
| 白细胞数量少(例如,使用非妊娠子宫时) | 即使接口处的像元数非常低,也可以看到接口。即使环不可见,也要收集40%至80%的溶液中的液体,因为可能仍然有足够的细胞用于进一步处理 | |
| 不完全性红细胞裂解 | 细胞未正确重悬于裂解缓冲液中 | 上下移液细胞以分解团块并将细胞完全重悬于裂解缓冲液中 |
| 裂解液是冷的 | 使用前将裂解液平衡至室温 | |
| 使用裂解液延长孵育时间长达 15 分钟 | ||
| 红细胞裂解步骤可重复 | ||
| 细胞产量低 | 酶消化不良 | 检查酶是否未过期,是否已根据其手册储存 |
| 洗涤步骤期间的细胞损失 | 在每个洗涤步骤后检查细胞沉淀:旋转后将不透明的沉淀物放在孔的底部。采用V型底代替U型底板,摆转旋翼离心机,离心时间更长可减少细胞损失 | |
| 组织样本含有少量淋巴细胞(例如,使用非妊娠子宫时) | 汇集几个子宫以获得足够的事件进行分析。考虑使用方案的选项B进行细胞分离 | |
| 从同组小鼠获得的绝对白细胞数的高变异性 | 在40%和80%的溶液界面处的细胞收集不一致 | 确保在percoll界面上收集整个细胞部分。考虑使用方案的选项B进行细胞分离 |
| 无法检测预期的淋巴细胞亚群/标志物或某些细胞表面标志物的MFI异常低 | 酶消化影响某些表位的表面表达或其降解 | 通过改变酶(例如,不同类型的自由酶或胶原酶)和/或孵育时间和/或酶浓度来优化酶消化 |
| 流式细胞仪中的背景噪音高 | 高比例的细胞碎片或红细胞污染 | 调整 FSC 阈值参数。考虑使用方案的选项A进行细胞分离 |
表 2:故障排除指南。
讨论
该方法包含下文讨论的几个关键步骤。第一个关键步骤是获得多次同步妊娠,因为白细胞群体的相对频率在妊娠期间发生变化。在同一妊娠日拥有多个水坝允许在相同的实验中进行生物重复或从单个水坝中汇集淋巴细胞以获得下游应用所需的更大数量。定时交配使研究人员能够在24小时内精确定位受孕。虽然小鼠的寿命约为2.5年,但它们的育龄期为4-7周,直到6-8个月大。由于较年轻的小鼠通常产生较小的幼崽,雌性小鼠通常直到6-8周之间才交配,雄性小鼠直到8-10周之间。鉴于发情在小鼠中持续约15小时,每4-5天发生一次,典型的交配率(通过阴道塞显示,见 图4)约为25%。因此,重要的是在发情期使用小鼠并计划足够的数量以获得给定实验所需的水坝数量。发情周期阶段可通过阴道涂片细胞学检查确定22。插拔率可以通过在交配前48小时休息雄性并利用惠顿效应来提高18。或者,可以施用模仿内源性卵泡刺激素作用的妊娠母马血清,诱导卵母细胞成熟,并在42-50小时后施用人绒毛膜促性腺激素,其模仿内源性黄体生成素的作用,诱导排卵。这种荷尔蒙治疗绕过了发情的要求,使几乎所有接受治疗的女性都能接受。
第二个关键步骤是确保FACS染色的质量。流式细胞术中使用的抗体必须始终滴定并以最佳浓度使用,并且有必要检查酶消化不会切割关键的抗原表位。为了评估一种酶是否会切割表位,可以同时染色同一样品的两个部分,一个进行酶促,另一个进行机械消化。同样,使用适当的对照和单一染色剂对于获得可靠的数据至关重要。对于罕见的事件,珠子可用于生成单个染色样品。建议不要使用珠子来设置电压,而是使用含有淋巴细胞和其他白细胞(如脾细胞)的细胞群。如果使用磁珠,则需要滴定抗体以进行磁珠染色,因此染色磁珠的荧光强度将与细胞的荧光强度相当。如果难以分离特定标记物的阳性细胞和阴性细胞,FMO对照也可用于促进特定标记物的门控。在细胞内标志物的情况下,必须使用同种型对照,因为细胞内染色可能导致残留的未结合抗体,这些抗体在洗涤步骤后可能仍存在于细胞内,因此会增加背景信号。建议在固定细胞后24小时内运行样品,以通过FACS分析获得最佳表型结果,因为自发荧光随时间显着增加,并且某些抗体的荧光强度可能会随着时间的推移而下降。
另一个需要考虑的关键因素是用该协议获得的单细胞悬浮液的下游应用。对于功能检测,必须在无菌条件下工作。同样,对于随后的组学研究,重要的是在无菌和RNase,DNase和无蛋白酶中工作。
这里介绍的方案侧重于表型组1 ILCs,但可以通过修饰抗体面板来适应其他细胞类型的表型。建议针对消化和非消化的细胞悬浮液测试所有抗体,以检测酶处理对表面表位的损失/改变。同样,可以使用不同的酶来消化组织和增加细胞产量,但必须仔细研究其对关键抗原表位的影响。虽然NKp46是脾NK细胞的良好标志物,并且适用于所有实验室小鼠品系,但NKp46在C57BL / 6小鼠uNK细胞上的表达显着低于脾脏NK细胞。最好同时染色NK1.1和NKp46。如果要直接比较多个器官,建议平等对待所有样品,即使脾脏或骨髓等组织不需要酶消化。尽管这里介绍的方法适用于非妊娠子宫,但通过两相Percoll梯度分离淋巴细胞环将具有挑战性,并且分离的细胞的产量可能太低而无法进行可靠的FACS分析,因此需要将从单个非妊娠小鼠的子宫中分离的细胞汇集在一起23。
在解释数据时需要考虑的协议存在局限性。与所有组织的情况一样,来自血液的循环淋巴细胞将与组织驻留细胞一起分离。如果排除循环淋巴细胞对于数据解释至关重要,则可以进行活体内染色以标记循环细胞。此外,该协议的第二个限制是一些细胞会丢失,因为并非所有细胞都可以从组织中提取。最常见的问题及其故障排除如 表 2 所示。
从历史上看,对组织中细胞的研究依赖于组织切片的组织学检查。桑德拉·皮尔(Sandra Peel)的优秀评论24 总结了直到80年代末的100多年所做的工作。后来被称为uNK细胞的细胞的描述确实出现在淋巴细胞被发现前半个多世纪发表的手稿中。所以,在1975年NK细胞被发现之前,uNK细胞已经被指示为母体糖原细胞或颗粒状的子宫腺细胞。安妮·克罗伊(Anne Croy)在该领域做出了重大贡献25 ,并亲切地向团队传授了她优化的解剖3,并且目前正在使用。虽然它有助于描述uNK细胞的形态和组织位置,但经典的组织学检查仅限于检测目标细胞上的少数标记。2008年,描述了一种基于流式细胞术的方法,用于同时检测子宫淋巴细胞上的多个标记物26。这基本上是本文中描述的方法。空间转录组学和质量细胞术成像等最新技术结合了组织学和流式细胞术的强大功能,允许分别同时检测多个基因或蛋白质,并保存正常组织结构。
这里描述的方法的应用是多种,包括FACS表型,功能测定(例如ELISPOT,脱颗粒或细胞毒性测定),细胞分选以及随后的转录组学或蛋白质组学。基于该方法可以开发的进一步应用包括在细胞分选或通过负消耗富集后培养和扩增蜕膜NK细胞。目前,没有方案可以培养和扩增小鼠uNK细胞并长时间保持其活力和功能,其方式与人类NK细胞类似,可以通过添加IL-2或IL-12和IL-15的组合来培养和扩增7-14天。对小鼠uNK细胞的这种方法的优化将在执行功能测定时提供更大的灵活性,并允许使用更高的细胞数测试多种条件。另一方面,已知培养条件会改变淋巴细胞的独特表型及其功能。
披露声明
作者无需披露任何内容,也不存在利益冲突。
致谢
我们感谢帮助开发这种方法的前任和现任团队成员,包括Jean-Marc Doisne,Norman Shreeve,Iva Filipovic和Anita Qualls。这项研究由惠康信托基金会[批准号200841/Z/16/Z]和医学研究委员会(MR/P001092/1)资助。出于开放获取的目的,作者已对因提交而产生的任何作者接受的稿件版本应用了CC BY公共版权许可。
材料
| Name | Company | Catalog Number | Comments |
| 70 µm cell strainers | Falcon | 352350 | |
| BSA | Sigma | A9647-100G | |
| CD19 antibody | BD | 562701 | |
| CD3 antibody | BD | 562600 | |
| CD45 antibody | BioLegend | 103108 | |
| CD49a antibody | BD | 740262 | |
| DNase I | Roche (Sigma) | 10104159001 | |
| EOMES antibody | eBioscience | 12-4875-82 | |
| Fc block Trustain fcx | BioLegend | 101320 | |
| Fetal Bovine Serum | Gibco | 10217-106 | |
| Fix/Perm buffer (part of BD Cytofix/Cytoperm Fixation/Permeabilization Kit) | BD | 554714 | |
| HBSS, calcium, magnesium, no phenol red | Gibco | 14025092 | |
| Liberase DH | Roche (Sigma) | 5401089001 | |
| Lysis buffer Pharmlyse | BD | 555899 | |
| NK1.1 antibody | BioLegend | 108739 | |
| NKp46 antibody | BioLegend | 137608 | |
| Paraformaldehyde 16% Solution (methanol-free) | Agar Scientific | AGR1026 | |
| PBS 10x | Gibco | 14030-048 | |
| PBS 1x (no Ca2+ or Mg2+) | Thermo Scientific | 14190144 | |
| Percoll | VWR international | 17-0891-01 | |
| Phosphate buffered saline | Sigma-Aldrich | P5368-10PAK | |
| Pre-Separation filters | Miltenyi | 130-095-823 | |
| RMPI-1640 medium + GlutaMAX | Gibco | 61870-010 | |
| UltraPure 0.5M EDTA, pH 8.0 | Thermo Scientific | 15575020 | |
| Zombie Violet Fixable Viability dye | BioLegend | 423113 |
参考文献
- Colucci, F. The immunological code of pregnancy. Science. 365 (6456), 862-863 (2019).
- Mor, G., Aldo, P., Alvero, A. B. The unique immunological and microbial aspects of pregnancy. Nature reviews. Immunology. 17 (8), 469-482 (2017).
- Croy, A., Yamada, A., DeMayo, F., Adamson, S. L. . The Guide to Investigation of Mouse Pregnancy. , (2014).
- Filipovic, I., et al. Molecular definition of group 1 innate lymphoid cells in the mouse uterus. Nature Communications. 9 (1), 4492 (2018).
- Chen, Z., et al. DBA-lectin reactivity defines mouse uterine natural killer cell subsets with biased gene expression. Biology of Reproduction. 87 (4), 81 (2012).
- Moffett, A., Colucci, F. Uterine NK cells: active regulators at the maternal-fetal interface. The Journal of Clinical Investigation. 124 (5), 1872-1879 (2014).
- Gaynor, L. M., Colucci, F. Uterine natural killer cells: Functional distinctions and influence on pregnancy in humans and mice. Frontiers in Immunology. 8, 467 (2017).
- Sojka, D. K., Yang, L., Yokoyama, W. M. Uterine natural killer cells. Frontiers in immunology. 10, 960 (2019).
- Wilkens, J., et al. Uterine NK cells regulate endometrial bleeding in women and are suppressed by the progesterone receptor modulator asoprisnil. The Journal of Immunology. 191 (5), 2226-2235 (2013).
- Ashkar, A. A., Di Santo, J. P., Croy, B. A. Interferon γ contributes to initiation of uterine vascular modification, decidual integrity, and uterine natural killer cell maturation during normal murine pregnancy. Journal of Experimental Medicine. 192 (2), 259-270 (2000).
- Hanna, J., et al. Decidual NK cells regulate key developmental processes at the human fetal-maternal interface. Nature Medicine. 12 (9), 1065-1074 (2006).
- Chakraborty, D., Rumi, M. A. K., Konno, T., Soares, M. J. Natural killer cells direct hemochorial placentation by regulating hypoxia-inducible factor dependent trophoblast lineage decisions. Proceedings of the National Academy of Sciences of the United States of America. 108 (39), 16295-16300 (2011).
- Crespo, &. #. 1. 9. 4. ;. C., et al. Decidual NK cells transfer granulysin to selectively kill bacteria in trophoblasts. Cell. 182 (5), 1125-1139 (2020).
- Shmeleva, E. V., Colucci, F. Maternal natural killer cells at the intersection between reproduction and mucosal immunity. Mucosal Immunology. , 1-15 (2020).
- Kather, A., et al. Neither lymphotoxin alpha nor lymphotoxin beta receptor expression is required for biogenesis of lymphoid aggregates or differentiation of natural killer cells in the pregnant mouse uterus. Immunology. 108 (3), 338-345 (2003).
- Croy, B. A., et al. Analysis of uterine natural killer cells in mice. Methods in Molecular Biology. 612, 465-503 (2010).
- Vander lee, S., Boot, L. M. Spontaneous pseudopregnancy in mice. II. Acta Physiologica et Pharmacologica Neerlandica. 5 (2), 213-215 (1956).
- Whitten, W. K. Modification of the oestrous cycle of the mouse by external stimuli associated with the male. The Journal of Endocrinology. 13 (4), 399-404 (1956).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (second edition). European Journal of Immunology. 49 (10), 1457 (2019).
- Kim, S., et al. Licensing of natural killer cells by host major histocompatibility complex class I molecules. Nature. 436 (7051), 709-713 (2005).
- Anderson, K. G., et al. Intravascular staining for discrimination of vascular and tissue leukocytes. Nature Protocols. 9 (1), 209-222 (2014).
- Caligioni, C. S. Assessing reproductive status/stages in mice. Current Protocols in Neuroscience. , (2009).
- Doisne, J. -. M., et al. Composition, development, and function of uterine innate lymphoid cells. Journal of Immunology. 195 (8), 3937-3945 (2015).
- Peel, S. Fate of GMG Cells. Granulated Metrial Gland Cells Advances in Anatomy, Embryology and Cell Biology. 115, (1989).
- Croy, B. A., vanden Heuvel, M. J., Borzychowski, A. M., Tayade, C. Uterine natural killer cells: a specialized differentiation regulated by ovarian hormones. Immunological Reviews. 214, 161-185 (2006).
- Yadi, H., Burke, S., Madeja, Z., Hemberger, M., Moffett, A., Colucci, F. Unique receptor repertoire in mouse uterine NK cells. Journal of Immunology. 181 (9), 6140-6147 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。