A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الخلايا الليفية المشتقة من النسيج الضام البشري المهندسة لتطبيقات الفحص
In This Article
Summary
يقدم هنا بروتوكول لتوليد الأنسجة الضامة المهندسة لثقافة موازية من 48 أنسجة في لوحة متعددة الآبار مع أعمدة مزدوجة ، ومناسبة للدراسات الميكانيكية ، ونمذجة الأمراض ، وتطبيقات الفحص. البروتوكول متوافق مع الخلايا الليفية من مختلف الأعضاء والأنواع ويتجلى هنا مع الخلايا الليفية القلبية الأولية البشرية.
Abstract
الخلايا الليفية هي خلايا ديناميكية للغاية بشكل حيوي ، والتي تتحول بسرعة إلى الخلايا العضلية الليفية استجابة للمحفزات الكيميائية الحيوية والميكاناميكية الحيوية. الفهم الحالي للعمليات الليفية، بما في ذلك التليف القلبي، لا يزال ضعيفا، مما يعوق تطوير علاجات جديدة مضادة للأورام الليفية. نظم نموذج الإنسان يمكن التحكم فيها وموثوق بها حاسمة لفهم أفضل لعلم الأمراض التليف. هذا بروتوكول قابل للاستنساخ وقابل للتطوير للغاية لتوليد الأنسجة الضامة المهندسة (ECT) في لوحة صب 48 جيدا لتسهيل دراسات الخلايا الليفية والفيزيولوجيا المرضية للأنسجة الليفية في بيئة ثلاثية الأبعاد (ثلاثية الأبعاد). يتم إنشاء العلاج بالصدمات الكهربائية حول القطبين مع صلابة غير قادرة، مما يسمح للدراسات تحت حمولة ميكانيكية حيوية محددة. في ظل ظروف التحميل المحددة ، يمكن دراسة التعديلات الظاهرية التي تسيطر عليها تفاعلات مصفوفة الخلية. الاختبار الموازي ممكن في شكل 48 جيدا مع فرصة لتحليل المسار الزمني لمعلمات متعددة ، مثل ضغط الأنسجة والانكماش ضد الحمل. من هذه المعلمات، يمكن دراسة الخصائص الميكانيكية الحيوية مثل تصلب الأنسجة والمرونة.
Introduction
عقبة رئيسية في دراسة الأمراض الليفية هو عدم وجود نماذج الأنسجة ثلاثية الأبعاد البشرية التمثيلية التي توفر نظرة ثاقبة على سلوك الخلايا الليفية ومشتقاتها المرضية. لدراسة العمليات الليفية، نظم الثقافة 2D القياسية هي دون المستوى الأمثل منذ الخلايا الليفية المعزولة عبر بسرعة إلى α السلس العضلات actin (SMA) التعبير عن الخلايا العضلية الليفية عندما مثقف على الركائز 2D غير متوافق1،2،3. وهكذا، فإن الخلايا الليفية في الثقافة 2D القياسية لا تعكس النمط الظاهري الأنسجة "صحية" العادية3،4،5،6. وقد أدخلت الثقافات على الركائز مرنة لمحاكاة غير الليفية (10 كيلو باسكال) والألياف (35 كيلو باسكال) بيئات الأنسجة7، ولكن هذه تفتقر إلى البعد الثالث، وهو أمر مهم جدا فيما يتعلق بالفيزيولوجيا المرضية. توفر هندسة الأنسجة الفرصة للتغلب على هذا القيد من خلال السماح بزراعة الخلايا الليفية في مصفوفة خارج الخلية محددة وغير قادرة تجريبيا (ECM) - السياق ، على سبيل المثال ، عن طريق التعديلات في الخلوية ، وتكوين ECM ، وتركيز ECM ، وكلها يمكن أن تحدد الميكانيكا الحيوية للأنسجة.
وقد تم إنشاء نماذج ثلاثية الأبعاد مختلفة باستخدام الخلايا الليفية. كانت الأقراص العائمة والميكروسفيرات من بين الأقراص الأولى وتبين أن الكولاجين يتم تجديده وضغطه بطريقة تعتمد على الوقت. الخلايا الليفية تمارس قوى الجر على الفيبريلات الكولاجين، وهي عملية يمكن تسهيلها بإضافة عوامل مؤيدة للألياف مثل تحويل عامل النمو بيتا 1 (TGF-β1)8,9,10,11,12,13,14,15,16. ومع ذلك، لا تسمح الثقافات العائمة بحرية بالتحميل الخارجي الخاضع للرقابة، وبالتالي تشكل نماذج انكماش أو ضغط مستمرة. فتحت الأنسجة المهندسة الشبيهة بالصفائح إمكانية دراسة التنظيم المنزلي للخصائص الميكانيكية الحيوية للأنسجة ، أي من خلال اختبار الإجهاد الأحادي أو ثنائي أو متعدد الaxial أو الدوري17,18,19,20. وقد استخدمت هذه النماذج، على سبيل المثال، لإثبات تأثير عدد الخلايا على تصلب الأنسجة، والتي تبين أن ترتبط بشكل إيجابي مع سلامة الهيكل الخلوي وانقباض الهيكل الخلوي actomyosin18,19. ومع ذلك ، من المهم ملاحظة أن التحويلات من القوة إلى السلالة معقدة بسبب تشوه الأنسجة غير الموحد حول نقاط المشبك من محولات القوة ونقاط الإرساء. يمكن تجاوز هذا القيد المتأصل من قبل الأنسجة على شكل عظم الكلب أو الحلقة ، مما يوفر بعض إنفاذ الأنسجة في نقاط الإرساء21,22,23. يمكن إعداد الأنسجة على شكل حلقة عن طريق توزيع هيدروجيل الكولاجين الخلية في قوالب على شكل حلقة. كما المضغوطة هيدروجيل، تشكل الأنسجة حول قضيب الداخلية غير قابلة للضغط من القالب، والذي يوفر مقاومة لمزيد من انكماش الأنسجة24,25,26,27. بعد الضغط الأولي والأقصى عادة ، يمكن أيضا نقل الأنسجة إلى الفواصل القابلة للتعديل لزيادة تقييد العلاج بالصدمات الكهربائية الدائرية بطول نسيج محدد3,24,25,26,27,28,29,30. يمكن تقييم الخصائص الفيزيائية الحيوية في أجهزة الإجهاد الإجهاد الأفقي أو الرأسي القياسية مع خلايا الحمل المناسبة تحت سلالة أحادية الاتجاه أو ديناميكية3. كما الأنسجة لديها هيكل دائري موحد إلى حد كبير ويمكن أن تعقد على القضبان / السنانير (نقاط مرسى و / أو محولات القوة)، على الرغم من أن هذه قد لا تزال ترفق مناطق الضغط حول أشرطة التحميل، وهذا الشكل يسمح للاختلاف سلالة أكثر اتساقا بالمقارنة مع لقط3. وعلاوة على ذلك، الأنسجة الراسية تثير شكل خلية ثنائي القطب، والخلايا تتكيف مع قوى الأنسجة عن طريق الاستطالة على طول خطوط القوة تعزيز الجر النظائري31,32,33,34,35,36. لقد طبقنا سابقا العلاج بالصدمات الكهربائية على شكل حلقة من الخلايا الليفية القلبية الجرذة والبشرية (CF) حول قطب واحد متصلب في تجارب إجهاد الإجهاد الوظيفية وأجرينا دراسات اكتساب وفقدان الوظائف باستخدام الخلايا الليفية المنقولة فيروسيا24,25,26 والدراسات الدوائية37. علاوة على ذلك ، يمكننا تحديد الاختلافات الجنسية في التليف بوساطة CF في نموذج العلاج بالصدمات الكهربائية27.
البروتوكول التالي لتوليد العلاج بالصدمات الكهربائية البشرية ، وتجسدت مع CF الإنسان الأولية التي تم الحصول عليها كشهادة كريوبريخدم CF من البائعين التجاريين (انظر جدول المواد) ، يجمع بين مزايا الأنسجة على شكل حلقة مع طريقة سهلة وسريعة لإنتاج الأنسجة العيانية لمنصة 48 جيدا مصممة لاختبار المحتوى العالي الموازي.
الأهم من ذلك، لا يقتصر نموذج العلاج بالصدمات الكهربائية على نوع معين من الخلايا الليفية، مع الاستخدام الموثق في التحقيق في الخلايا الليفية الأخرى، على سبيل المثال، الخلايا الليفية الجلدية38،39. وعلاوة على ذلك ، فإن الخلايا الليفية من خزعات المريض تعمل بشكل جيد على قدم المساواة ، واختيار الخلايا الليفية يعتمد في نهاية المطاف على المسألة العلمية التي سيتم معالجتها.
المنصة المستخدمة لتوليد العلاج بالصدمات الكهربائية الموصوفة في هذا البروتوكول هي لوحة زراعة خلايا/أنسجة ثلاثية الأبعاد متاحة تجاريا 48 جيدا (الشكل 1A). يتم وصف طرق إعداد وزراعة ورصد تكوين العلاج بالصدمات الكهربائية ووظيفتها تحت هندسة محددة والحمل الميكانيكي بمساعدة لوحة 48 بئرا. يتم عقد العلاج بالصدمات الكهربائية شكلت من قبل أعمدة مرنة متكاملة ويمكن ضبطها الحمل الميكانيكي وفقا للغرض النهائي باستخدام أعمدة مع صلابة مختلفة (الشاطئ قيمة 36-89)، مما يؤثر على صلابة الانحناء. ينصح البولنديين مع الشاطئ قيمة 46. البروتوكول هو، بالإضافة إلى ذلك، متوافقة مع قالب دائري مخصص وصفها سابقا، حيث يقام العلاج بالصدمات الكهربائية حول قضيب واحد قاسية37. يتم إعطاء أبعاد هذا القالب في الشكل 1B.
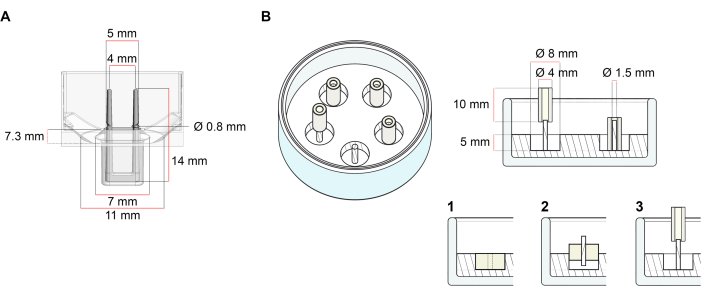
الشكل 1: التمثيل التخطيطي للقوالب الصب. (أ) الرسم الفني وأبعاد قالب الصب مع اثنين من أعمدة مرنة. يتكون القالب من محيط داخلي محدد بجدار قصير يحمل أعمدة احتفاظ مزدوجة في الجسم الرئيسي للقالب. القطبين مرنة لديها مسافة أفقية حرة إلى بعضها البعض ومتصلة في القاعدة. يسمح القالب لحجم الصب 180 ميكرولتر. بئر كل قالب يسمح قدرة حجم ما لا يقل عن 600 ميكرولتر من وسائل الإعلام الثقافية. يمكن استخدام تركيبات مواد مختلفة لإنتاج أعمدة ذات صلابة محددة (على سبيل المثال، TM5MED-TM9MED). (ب) الرسم الفني وأبعاد قالب على شكل حلقة مع قضيب واحد قاسية. هذا هو قالب بديل مع الهندسة المتميزة والبيئة الميكانيكية، والتي يمكن استخدامها مع بروتوكول الصب ECT37. تم تكييف طريقة تجميع العفن على شكل حلقة من الأشكال الأكبر المنشورة28,41. باختصار، تتضمن الطريقة (1) بصمة الفواصل البوليتيترافلوروإيثيلين (PTFE) (قطرها 8 مم) في البوليديميثيلسيلوكسيان (PDMS، السيليكون) سكب في أطباق زجاجية (قطرها 60 ملم)، و (2) تحديد حامل القطب PDMS (قطر 1.5 ملم) متحدة المركز داخل تجويف مجوف شكلت، والذي يعمل على (3) عقد قطب قابلة للإزالة (4 مم قطر أنبوب السيليكون). المساحة المجوفة الناتجة تسمح ل180 ميكرولتر من حجم الصب. يمكن لكل طبق زجاجي أن يغلف قوالب مطبوعة متعددة (تظهر بشكل مثالي مع 5 قوالب) ولديه القدرة على ما يصل إلى 5 مل من متوسط الثقافة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Access restricted. Please log in or start a trial to view this content.
Protocol
ويجب اتخاذ جميع الخطوات في أغطية السلامة البيولوجية من الفئة الثانية المثبتة في المختبرات تحت مستوى الاحتواء 1. واعتمادا على اللوائح المحلية ونوع التلاعبات التي يتعين القيام بها، مثل نقل الجينات بوساطة فيروسية، يجب زيادة مستوى الاحتواء إلى مستوى السلامة البيولوجية 2 أو 3. يتم الحفاظ على جميع الثقافات عند 37 درجة مئوية في حاضنة زراعة الخلايا مع جو رطب من 5 ٪ ثاني أكسيد الكربون في الهواء. لاحظ أن وحدات التخزين (الخطوتين 1 و 2) يتم توفيرها لقارورة ثقافة الخلية T75. ضبط وحدات التخزين إلى تنسيقات الثقافة المختلفة وفقا لتوصيات ثقافة الخلية القياسية.
1. ذوبان وقبل الطلاء الأولية القلب الليفية (CF) لثقافة أحادية الطبقة (5-12 يوما)
ملاحظة: كبديل، يمكن استخدام خلايا HFF-1 باتباع بروتوكول الثقافة الفرعية القياسي كما نصح المورد.
- إعداد وسيط نمو الخلايا الليفية (ختان الإناث) وفقا لتعليمات الشركة المصنعة. اختياريا، إضافة المضادات الحيوية مثل 100 U/mL البنسلين و 100 ملغم / مل ستربتومايسين. السماح لخلط كامل لجميع المكونات قبل الاستخدام. يخزن عند درجة حرارة 4 درجات مئوية لمدة تصل إلى 14 يوما.
- تشويه الأعضاء التناسلية الأنثوية الدافئ إلى 20-25 درجة مئوية.
- إذابة الخلايا المبردة CF (التي تحتوي بشكل مثالي على 1 × 106 إلى 2 × 106 / مل لكل خلية مبردة) في حمام مائي عند 37 درجة مئوية لمدة دقيقتين تقريبا ، حتى يتم ترك كمية صغيرة فقط من الثلج في القارورة.
- باستخدام ماصة مصلية سعة 2 مل، قم بنقل تعليق الخلية بشكل إسقاطي إلى أنبوب طرد مركزي معقم مناسب يحتوي على 10 مل من تشويه الأعضاء التناسلية الأنثوية. للحصول على أفضل استرجاع للخلايا، اشطفي المبرد ب 1 مل من تشويه الأعضاء التناسلية الأنثوية ونقله إلى أنبوب الطرد المركزي. كما الخلايا حساسة جدا في هذه المرحلة، resuspend باستخدام ماصة المصلية مع طرف تتحمل للحد من تلف الخلايا عن طريق الإجهاد القص.
ملاحظة: إذا كانت وسيلة إعادة التبريد تحتوي على نسبة عالية من DMSO، تأكد من أنه بعد إعادة تثبيت الخلية في تشويه الأعضاء التناسلية الأنثوية، فإن محتوى DMSO أقل من 1٪. بدلا من ذلك، طرد الخلايا التي أعيد إنفاقها في 300 × ز لمدة 5 دقائق في 20-25 درجة مئوية للتبادل المتوسط. ثم، يستنشق فائقة بعناية، دوامة أنبوب لطرد الخلايا بيليه، وإعادة إنفاقها في الحجم المطلوب من تشويه الأعضاء التناسلية الأنثوية للبذر. - البذور 0.5 × 106 خلايا في 12 مل من تشويه الأعضاء التناسلية الأنثوية في قارورة ثقافة الخلية T75. إذا تم استخدام برامج معملية أخرى، فاضبط رقم الخلية للحفاظ على كثافة بذر تبلغ 6.7 × 103/cm2.
- استبدل تشويه الأعضاء التناسلية الأنثوية كل يومين لمدة 5 أيام أو حتى تصل الخلايا إلى نسبة التقاء 80٪.
ملاحظة: تعتمد نسبة إنتاج الخلية بعد التمدد بشكل أساسي على حجم الخلية ومعدل الانتشار، والتي قد تختلف بين الجهات المانحة للخلايا. عادة، يسمح هذا الإجراء القياسي للثقافة باسترداد 4 × 106 إلى 5 × 106 CF من قارورة ثقافة الخلية T75 بعد 5 أيام من الثقافة.
2. التشتت الأنزيمي للقوات المسلحة التقليدية البشرية (10-20 دقيقة)
ملاحظة: تهدف هذه الخطوة إلى إنشاء تعليق خلية واحدة من CF الإنسان لكل من الخلايا أحادية الطبقة sub-culturing وإعداد العلاج بالصدمات الكهربائية. وقد تم تحسين هذا البروتوكول لثقافات طبقة واحدة CF الإنسان في مقاطع 3-4. من أجل التوحيد الأمثل، يوصى بزراعة CF في طبقة أحادية، مرة واحدة على الأقل قبل إعداد العلاج بالصدمات الكهربائية. يجب تحسين هذا البروتوكول للخلايا الليفية التي تنشأ من مختلف الجهات المانحة والبائعين. قد تتضمن بروتوكولات الانفصال البديلة استبدال كاشفات التفكك المؤتلفة القائمة على سيرين بروتياز، على سبيل المثال، تلك التي تحتوي على إنزيمات بروتيوليتيك والكولاجينولاليك.
- تشويه الأعضاء التناسلية الأنثوية الدافئ، وبرنامج تلفزيوني (Ca2+/Mg2+-free)، وكشف فصيلة الخلايا إلى 20-25 درجة مئوية.
- يستنشق الوسط من الخلايا المستزرعة.
- غسل الخلايا مع 6 مل من برنامج تلفزيوني و أسبيرات.
- أضف 6 مل من كاشف فص الخلايا إلى الخلايا واحتضن لمدة 3 دقائق عند 20-25 درجة مئوية حتى تبدأ الخلايا في الانفصال بشكل واضح.
ملاحظة: اعتمادا على مصدر CF قد يستغرق هذا عدة دقائق أطول. بدلا من ذلك، إذا كانت الخلايا لا تنفصل في درجة حرارة الغرفة، واحتضان في 37 درجة مئوية لتحسين نشاط الإنزيمات. لضمان صلاحية الخلية المثلى، مراقبة انفصال الخلايا تحت المجهر. - تحييد النشاط الأنزيمي بإضافة 6-12 مل من تشويه الأعضاء التناسلية الأنثوية إلى الخلايا المطرودة في كاشف فصيلة الخلية. ماصة بلطف صعودا وهبوطا 4-8 مرات باستخدام ماصة المصلية 10 مل لضمان تعليق خلية واحدة ونقل الخلايا إلى أنبوب جمع 50 مل جديدة. تحقق من الغلة بمساعدة المجهر ومقياس الدم أو عداد الخلايا الآلي وفقا لتعليمات الشركة المصنعة.
- الطرد المركزي تعليق الخلية في 300 × ز لمدة 5 دقائق في 20-25 درجة مئوية.
ملاحظة: من أجل الوصول إلى غلة الخلايا كافية لتوليد الكمية المطلوبة من العلاج بالصدمات الكهربائية، يمكن أن تكون الخلايا الفرعية المستزرعة في تخفيف ما يصل إلى 1:6 لمزيد من التوسع. السماح للخلايا تنمو حتى يتم التوصل إلى التقاء 80 ٪ (حوالي 5-6 أيام) ، مع تغيير المتوسطة كل يومين. ثم كرر التشتت الأنزيمي والمضي قدما في الخطوة 2.7. لمواصلة التحضير العلاج بالصدمات الكهربائية. - يستنشق supernatant ونفض الغبار عن أنبوب لطرد بيليه. إعادة تعليق الخلايا في تشويه الأعضاء التناسلية الأنثوية عند 20-25 درجة مئوية للحصول على تعليق للخلايا ≥ 15 × 106/مل (حوالي 40٪ خلايا أكثر مما هو مطلوب للخطوة 3.3). وهذا يفسر فقدان الخلية بسبب إجهاد في الخطوة التالية.
- سلالة تعليق الخلية من خلال مصفاة خلية شبكة 40 ميكرومتر.
تنبيه: الخلايا المغلوميرات ضارة بالتشكيل الأمثل للكات. عند استخدام التشتت الأنزيمي لبروتوكول CF البشري للصب مباشرة العلاج بالصدمات الكهربائية، وإجهاد تعليق الخلية يضمن عدم وجود كتل الخلية الرئيسية التي تتداخل مع تشكيل الأنسجة متجانسة. وسوف تعرض التغايريات التحليلات الموثوقة لسلالة الإجهاد للخطر. - سرد عدد الخلايا وتقييم صلاحية الخلية لضمان رقم خلية موثوق بها في تعليق مع ≥80 ٪ صلاحية المضي قدما في إعداد العلاج بالصدمات الكهربائية.
- استخدم عداد خلايا مؤتمت لتقييم عدد الخلايا وقابليتها للاستمرار عن طريق استبعاد التيار الكهربائي.
- بدلا من ذلك، استخدم اختبار استبعاد الصبغة الأزرق المثقب (المسرطن، الفئة الخطرة 2 - اتخاذ تدابير وقائية)، بمساعدة المجهر ومقياس الدم لتحديد تعداد مباشر للخلايا الحية (أغشية الخلايا السليمة التي تستبعد الصبغة) والخلايا الميتة (أغشية الخلايا المعرضة للخطر التي تسمح بربط الصبغة بالبروتينات داخل الخلايا).
- حجز أنبوب جمع مع تعليق الخلية في 20-25 درجة مئوية والمضي قدما على الفور مع الخطوة 3.
3. إعداد العلاج بالصدمات الكهربائية (1 ساعة)
ملاحظة: يتم وصف نظرة عامة تخطيطية من إنشاء العلاج بالصدمات الكهربائية في الشكل 2.
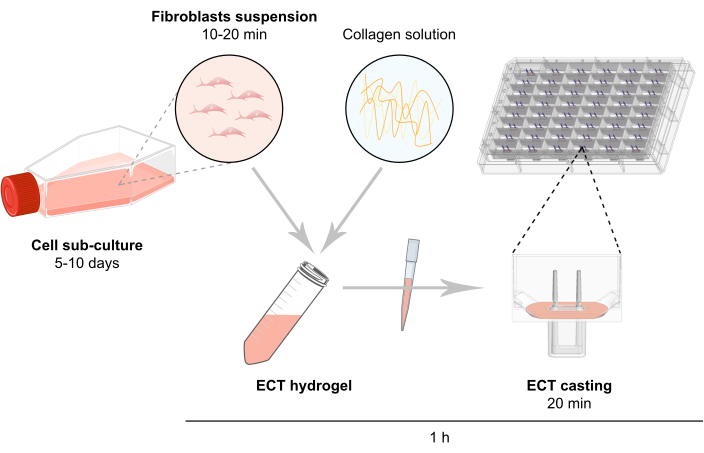
الشكل 2: نظرة عامة تخطيطية على توليد العلاج بالصدمات الكهربائية. يتم توسيع الخلايا الليفية في الثقافة 2D قبل استخدامها في توليد العلاج بالصدمات الكهربائية. بعد 5-10 أيام، يتم تفريق الخلايا بشكل أنزيمي وإعادة تشكيل تعليق الخلية في خليط مخزن يحتوي على الكولاجين البقري من النوع 1. يتم ضخ خليط هيدروجيل الكولاجين الخلوي في آبار فردية في لوحة 48 جيدا زراعة الأنسجة المهندسة ثلاثية الأبعاد ، والمصممة كصب قوالب مع عمودين مرنين لتمكين تعليق العلاج بالصدمات الكهربائية بطول وتحميل محددين. عادة ما يتم استزراع العلاج بالصدمات الكهربائية لمدة 1 إلى 20 يوما قبل القياسات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- إعداد محلول مخزون DMEM 10x عن طريق حل مسحوق DMEM في ddH2O (134 ملغم / مل للصياغة المحددة في جدول المواد) تحت دوران مستمر عند 37 درجة مئوية لمدة ساعة واحدة. تعقيم عن طريق الترشيح. المخزون مستقر لمدة تصل إلى 14 يوما عند درجة حرارة 4 درجات مئوية أو -20 درجة مئوية لمدة تصل إلى 12 شهرا.
- إعداد طازجة 2x DMEM عن طريق تمييع محلول الأسهم DMEM 10x وإضافة 20 ٪ (v / v) FCS في ddH2O العقيمة. راجع الجدول 1 لوحدات تخزين ماسورة. المخزون مستقر لمدة تصل إلى 14 يوما عند 4 °C.
ملاحظة: تنفيذ الخطوات 3.1. و 3.2. قبل البدء في التشتت الأنزيمي للخلايا (الخطوة 2.) لإعداد العلاج بالصدمات الكهربائية.
| الكاشف | التركيز النهائي | وحدة التخزين (مل) |
| 10× DMEM | ن/أ | 2 |
| FCS | 20 ٪ (v/v) | 2 |
| بنسلين | 200 U/mL | 0.2 |
| ستريبتومايسين | 200 ملغم/مل | 0.2 |
| ddH2O | ن/أ | 5.6 |
| مجموع | ن/أ | 10 |
الجدول 1: تكوين 2x DMEM.
تنبيه: يجب الاحتفاظ بجميع مكونات خليط هيدروجيل الكولاجين الخلوي وأنابيب الطرد المركزي على الجليد قبل الاستخدام. وهذا سوف يساعد على منع الكولاجين التجمع الذاتي من الحدوث قبل توزيع خليط هيدروجيل الكولاجين الخلية في جميع أنحاء قوالب الصب.
- واستنادا إلى الجدول 2، قم بتعديل تعليق الخلية إلى كثافة 8.88 × 106 خلايا/مل بإضافة تشويه الأعضاء التناسلية الأنثوية عند 20-25 درجة مئوية إلى تعليق الخلية من الخطوة 2.10. ثم، نقل أنبوب جمع مع تعليق الخلية إلى الجليد.
- لإعداد خليط هيدروجيل ECT، قم بتبريد أنبوب طرد مركزي سعة 50 مل على الجليد وأضف إليه المكونات المختلفة المدرجة في الجدول 2 بالترتيب التالي، وتجنب تكوين فقاعة الهواء.
ملاحظة: يعتمد الحد الأقصى لعدد العلاج بالصدمات الكهربائية التي يجب إعدادها على إجمالي عدد الخلايا المحدد في الخطوة 2.9. استخدام 0.3 ملغ من الكولاجين لكل العلاج بالصدمات الكهربائية, تم الحصول عليها من محلول الأسهم التي تحتوي على 6-7 ملغ / مل. تركيز محلول مخزون الكولاجين يحدد الحجم اللازم للحصول على محتوى الكولاجين الأمثل ECT. يجب تكييف أحجام مكونات الهيدروجيل ECT الأخرى وفقا لذلك. انظر الجدول 2 للكميات المعدلة وفقا لمحلول مخزون الكولاجين 6.49 ملغم/مل. تستخدم وحدات التخزين الموضحة في الجدول 2 في هذا البروتوكول كمبدأ توجيهي نموذجي.- ماصة حمض للذوبان الكولاجين نوع 1 هيدروجيل باستخدام ماصة المصلية مع طرف تتحمل واسعة.
- ضبط محتوى الملح من محلول الكولاجين عن طريق إضافة DMEM 2x في حين خلط بلطف عن طريق تدوير الأنبوب.
- تحييد الحموضة بإضافة 0.2 M NaOH في حين خلط بلطف عن طريق دوامة الأنبوب. سوف يتحول مؤشر فينول الأحمر من الأصفر إلى الأحمر.
ملاحظة: يجب أن يكون حجم NaOH مهزوا لكل دفعة كولاجين فردية لتحييد درجة الحموضة الأمثل. يعتمد الإبطال على عوامل مثل نوع العازلة وإعدادها، وكذلك تركيز الكولاجين المطلق، ويؤثر على تجميع مصفوفة الكولاجين وقابلية بقاء الخلية23,40. بمجرد زيادة المحتوى الأيوني بإضافة DMEM وتحييد pH ، يتبع التجميع الذاتي للكولاجين ويجب ألا يتعطل. لذلك، تنفيذ ما يلي بسرعة وبدون فواصل. - إضافة تعليق الخلية (من الخطوة 3.3) دروبوايز بينما خلط بلطف عن طريق دوامة الأنبوب.
| رقم العلاج بالصدمات الكهربائية: | 1 | 6 | 24 | 48 | |
| بما في ذلك 10 ٪ فائض | |||||
| مكونات هيدروجيل الكولاجين الخلية: | (ميكرولتر) | (ميكرولتر) | (ميكرولتر) | (ميكرولتر) | |
| مخزون الكولاجين (6.49 ملغم/مل) | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 2× DMEM | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 0.2 م ناوه | 3.1 | 20.5 | 81.8 | 163.7 | |
| مزيج الخلايا في تشويه الأعضاء التناسلية الأنثوية (8.88×106 خلية/مل) | 84.5 | 557.4 | 2229.7 | 4459.5 | |
| إجمالي الحجم (ميكرولتر) | 180.0 | 1188.0 | 4752.0 | 9504.0 | |
| هذا هو جدول مثالي لإعداد حجم الصب من 180 ميكرولتر لكل العلاج بالصدمات الكهربائية، تحتوي على ما مجموعه 750،000 الخلايا و 0.3 ملغ من الكولاجين لكل العلاج بالصدمات الكهربائية. | |||||
الجدول 2: إعداد هيدروجيل العلاج بالصدمات الكهربائية (بما في ذلك فائض بنسبة 10٪ يمثل أخطاء الأنابيب).
- خلط تعليق كامل عن طريق الأنابيب بلطف صعودا وهبوطا مرة واحدة فقط، وذلك باستخدام ماصة المصلية مع طرف تتحمل واسعة لتجنب تشكيل فقاعة وتقليل الإجهاد القص. تأكد من الخليط الكامل عن طريق تدوير الأنبوب برفق 10 مرات والحفاظ على أنبوب الطرد المركزي 50 مل الذي يحتوي على خليط هيدروجيل ECT على الجليد طوال عملية الصب.
- قبل الرطب تلميح ماصة 1 مل مع خليط هيدروجيل ECT وتوزيع 180 ميكرولتر منه بالتساوي في كل قالب من لوحة الصب 48 جيدا، وتجنب قوى القص المفرطة التي قد تؤثر على سلامة تجميع مصفوفة الكولاجين وضمان أن يتم لوحة كاملة في 15-20 دقيقة.
ملاحظة: حجم الصب الموصى به هو 180 ميكرولتر، ولكن يمكن تمديده إلى 200 ميكرولتر38. لذلك، عندما يفضل، يمكن تكييف الأحجام في الجدول 2 إلى 200 ميكرولتر بطريقة تحافظ على نفس التركيزات والنسبة بين الخلايا والكولاجين.- تأكد من تشكيل حلقة كاملة داخل القالب (الشكل 3A). إذا تم تطبيق خليط هيدروجيل ECT بشكل متقطع، سيتم منع تشكيل حلقة ECT كاملة (الشكل 3B).
- تجنب الأنابيب في البئر الداخلية (الشكل 3C) وتشكيل فقاعات أثناء الأنابيب (الشكل 3D) ، لضمان تشكيل الأنسجة متجانسة ووظيفية.
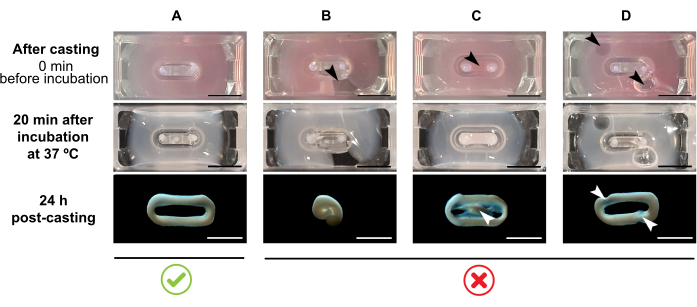
الشكل 3: الصب، تشكيل الهيدروجيل، وتكثيف العلاج بالصدمات الكهربائية في شكل متعدد الآبار. اللوحات العلوية تجسد مظهر العلاج بالصدمات الكهربائية مباشرة بعد الصب. تمثل الألواح الوسطى مظهر العلاج بالصدمات الكهربائية بعد الحضانة لمدة 20 دقيقة عند 37 درجة مئوية. لوحات أسفل مثال على حالة الضغط من ECT 24 ساعة بعد التحضير, إزالتها من القطبين. (أ) تشكيل العلاج بالصدمات الكهربائية السليم بين قطبين خلال أول 24 ساعة (B-D) أمثلة على أخطاء ماصة التي تمنع تشكيل العلاج بالصدمات الكهربائية السليم. تشير الأسهم البيضاء والسوداء إلى عيوب هيكلية في العلاج بالصدمات الكهربائية بسبب الصب غير السليم. شريط المقياس: 5 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
- ضع بعناية لوحة الصب 48 جيدا داخل حاضنة ثقافة الخلية والسماح للخليط هيدروجيل العلاج بالصدمات الكهربائية إعادة تشكيل لمدة 15-30 دقيقة. بعد الحضانة، وسوف تظهر هلام مثل ومبهم (الشكل 3، لوحة الأوسط).
- إضافة 600 ميكرولتر من 37 درجة مئوية تشويه الأعضاء التناسلية الأنثوية الدافئة لكل بئر، دون الأنابيب المتوسطة الثقافة مباشرة على تشكيل العلاج بالصدمات الكهربائية لأن هذا يمكن أن يؤدي إلى اضطراب الأنسجة. أضف بلطف وسيط الثقافة على طول جدار البئر ، كما هو الحال في هذه المرحلة ، يجب أيضا عدم فصل العلاج بالصدمات الكهربائية عن القاع (الشكل 4).
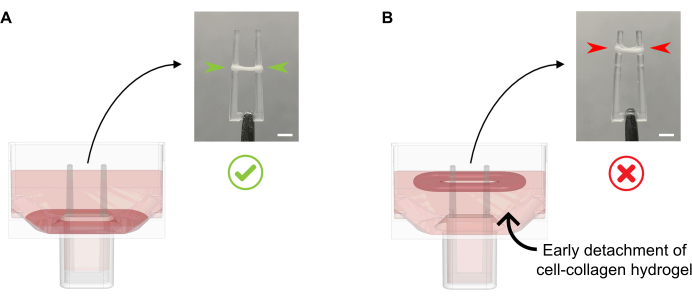
الشكل 4: إضافة السليم وغير لائق من الثقافة المتوسطة إلى العلاج بالصدمات الكهربائية يلقي حديثا. (أ) مع إضافة وسيط الثقافة بعد التصلب الأولي في العلاج بالصدمات الكهربائية (20 دقيقة بعد الصب)، يجب ترك العلاج بالصدمات الكهربائية المكثف دون إزعاج في الجزء السفلي من البئر. خلال 24 ساعة القادمة، سوف ضغط مصفوفة الخلية يحركها جعل ECT الشريحة حتى المنحدر. يتم التحكم في الموضع النهائي العلاج بالصدمات الكهربائية بواسطة تجاويف مقعرة في ارتفاع قطب محدد; وهذا يضمن أن جميع العلاج بالصدمات الكهربائية تسوية في نفس الموقف للسماح للمقارنة بين نشاط الانحناء القطب في ثقافة العلاج بالصدمات الكهربائية موازية. (ب) تشكيل العلاج بالصدمات الكهربائية منفصلة عن القاع مع إضافة متوسط الثقافة بسرعة كبيرة جدا. سوف ECT العائمة ضغط على المستوى المتوسط الثقافة العليا. ولن تكون القوات المتعاقدة مع القطب قابلة للمقارنة مباشرة إذا استقرت القوات الكهربائية الكهربائية في مواقع مختلفة. شريط المقياس: 2 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
- حضانة لمدة 24 ساعة.
- استبدل الوسط كل يوم بعد ذلك ب 500 ميكرولتر من تشويه الأعضاء التناسلية الأنثوية حتى التحليل.
ملاحظة: بعد المرحلة الأولى من الهلام المستقل عن الخلية، يبدأ CF البشري في ضغط خليط هيدروجيل ECT بشكل أكبر. وفي غضون 24 ساعة، ينبغي أن يظهر العلاج بالصدمات الكهربائية مضغوطا بشكل ملحوظ ويرفع إلى المستوى الذي يقام فيه على القطبين المرنين (الشكل 3 والشكل 4 ألف).
4. تقييم ضغط العلاج بالصدمات الكهربائية عن طريق قياس المنطقة المقطعية (CSA) (5 دقائق لكل ECT).
ملاحظة: يبدأ ضغط الأنسجة مباشرة بعد تجميع الكولاجين وهو مهم بشكل خاص خلال الساعات الأولى. يصف الضغط التغييرات الناجمة بشكل رئيسي عن طريق الضغط القائم على الخلية للمصفوفة عموديا على المحور الطويل للأنسجة. يتم تقييم هذه المعلمة من خلال تحديد المنطقة المقطعية (CSA) من العلاج بالصدمات الكهربائية.
- في النقاط الزمنية المطلوبة، استخدم مجهرا مجسما لتسجيل الصور العيانية للمناظر العلوية والجانبية ل ECT (الشكل 5C).
ملاحظة: يمكن تصوير العلاج بالصدمات الكهربائية داخل آبار زراعة اللوحة الصب 48 جيدا. بدلا من ذلك، نقل العلاج بالصدمات الكهربائية إلى لوحة صافية أسفل متعددة الآبار للتصوير. ينصح بتصوير العلاج بالصدمات الكهربائية على القطبين على أنه يزيل تلك التي تؤدي إلى فقدان التحميل المسبق ، وبالتالي ، في غضون فترة قصيرة ، يمكن للأنسجة أن تتقلص أكثر مع التواء في نهاية المطاف بسبب إطلاق التوتر ، مما قد يعوق التصوير المناسب لتحليلات الأبعاد. - استخدم برنامج معالجة الصور لإجراء تحليل مسح خطي. قم بتعيين مقياس واستخدم أداة الخط المستقيم لتتبع وقياس أقطار العلاج بالصدمات الكهربائية بحد أدنى 6 مواقع لكل ذراع في كل طائرة تصوير (الشكل 5B، C).
- حساب متوسط القطر من أعلى وجانب عرض الطائرات وحساب CSA وفقا لمعادلة منطقة بيضاوية:


الشكل 5: رصد ضغط العلاج بالصدمات الكهربائية على مر الزمن حسب تحليل المنطقة المقطعية الشاملة. تم إنشاء العلاج بالصدمات الكهربائية باستخدام CF الإنسان والكولاجين نوع الأول ومثقف حول عمودين مرنة لمدة 5 أيام. (أ) يتم عرض صور تمثيلية للتحكم في العلاج بالصدمات الكهربائية وضعت في قوالب مرنة على مدى 5 أيام. شريط المقياس = 5 مم. ويمكن أيضا أن تستخدم هذه الصور ذات المجال الساطع لتحديد تباين انحراف القطب لتقدير تقلص الأنسجة. (ب) تمثيل تخطيطي للمنطقة المقطعية العرضية من العلاج بالصدمات الكهربائية (قطر الرؤية العليا في قطر الرؤية الخضراء والجانبية باللون الوردي). (ج) صور العيان من أعلى وجانب وجهات النظر من العلاج بالصدمات الكهربائية التي تم الحصول عليها مع مجسمة ومثال مراسل لتحليل خط مسح أقطار الأنسجة باستخدام برنامج معالجة الصور. شريط المقياس = 2 مم. يتم حساب متوسط الأقطار من متوسط جميع أطوال الأسطر التي تقاس على كل خطة عرض. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. رصد انكماش العلاج بالصدمات الكهربائية عن طريق تحليل انحراف القطب (15 دقيقة لكل لوحة الصب 48 جيدا).
ملاحظة: عادة ما يتم تنفيذ ثقافة العلاج بالصدمات الكهربائية لمدة 5 أيام، ولكن يمكن تمديدها لمدة تصل إلى 20 يوما على الأقل. يحدث انحراف القطب بسبب تقلص الأنسجة مدفوعا بقوة تقلص الخلية في اتجاه التوتر على طول المحور الطويل للأنسجة. يمكن إجراء تقييم تقلص العلاج بالصدمات الكهربائية عن طريق التصوير في أي يوم أثناء الثقافة.
- صورة لوحة الصب 48 جيدا تحت جهاز تسجيل مع كاميرا مسح منطقة متكاملة وضعت على مسافة ثابتة، ومجهزة عالية الدقة (≥ 5 ميجا بكسل) مستشعر صورة أحادية اللون.
- استخدام شبه الأشعة فوق البنفسجية (~ 390 نانومتر) مصدر الضوء لتحقيق أقصى قدر من التباين، وبالتالي تسهيل الكشف الآلي للنصائح القطبين لأنها تحتوي على صبغة الفلورسنت (الشكل 6A، C). إذا كانت متوفرة، يوصى باستخدام العدسات عن بعد للتصوير لأنها تقلل من تشوهات الصورة.
ملاحظة: بدلا من ذلك، يمكن استخدام صور المجال الساطع العياني من آبار مفردة أو للوحة كاملة مصحوبة بشريط مقياس للتحليل (الشكل 5A).
- استخدام شبه الأشعة فوق البنفسجية (~ 390 نانومتر) مصدر الضوء لتحقيق أقصى قدر من التباين، وبالتالي تسهيل الكشف الآلي للنصائح القطبين لأنها تحتوي على صبغة الفلورسنت (الشكل 6A، C). إذا كانت متوفرة، يوصى باستخدام العدسات عن بعد للتصوير لأنها تقلل من تشوهات الصورة.
- قياس المسافة بين القطبين من السجلات اليومية (الشكل 6C، D) باستخدام برنامج معالجة الصور أو التحليل الآلي عن طريق تشغيل الصور المسجلة على البرمجيات قادرة على الكشف عن بكسل عالية التباين مشرق على خلفية مظلمة.
- حساب انحراف القطب من خلال الاختلاف من مسافة القطبين بالمقارنة مع المسافة الأولية في اليوم صفر.
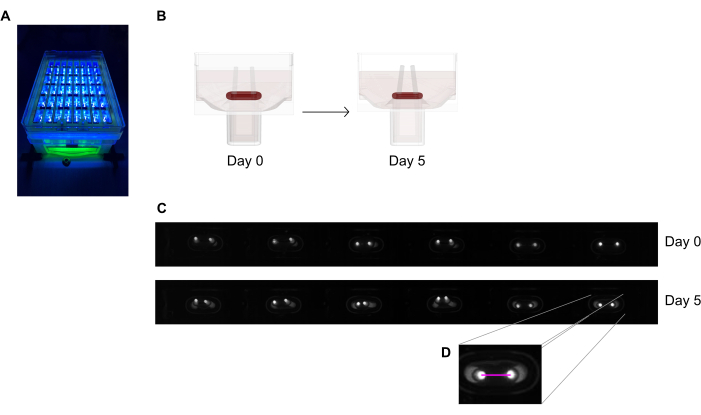
الشكل 6: نظرة عامة تخطيطية لتقييم تقلص الأنسجة وفقا لانحراف القطب. (أ) تسجيل مثالي عالي الدقة لأعمدة الفلورسنت في لوحة الصب 48 جيدا تحت الإثارة الخفيفة القريبة من الأشعة فوق البنفسجية. ويفضل هذا الأسلوب على الصور ذات المجال الساطع لتتبع طرف القطب الآلي أكثر دقة. (ب) توضح الرسومات التخطيطية كيف يؤدي ضغط وتقلص العلاج بالصدمات الكهربائية إلى انحناء القطب. (ج) صف مثالي من نفس لوحة السجلات في اليوم 0 واليوم 5 بعد الصب. د- يظهر عن قرب كيفية قياس المسافة (الخط الوردي) بين القطبين باستخدام برنامج معالجة الصور. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
ملاحظة: النظر في أن انحراف القطب تقاس صورة تلميح مشرق هو مجرد تقدير تقلص الأنسجة بسبب الفرق في طائرات التصوير. أيضا، لاحظ أن تطبيق المواد الموالية للورم الليفي مثل TGF-β1 أثناء زراعة الأنسجة يعزز ضغطECT وانكماش ويمكن أن يؤدي في نهاية المطاف إلى اضطراب الأنسجة في وقت مبكر.
6. تقييم صلابة وخصائص البيوميكانيكال الأخرى من العلاج بالصدمات الكهربائية عن طريق قياس الشد المدمرة وتحليل الإجهاد الإجهاد (20 دقيقة لكل العلاج بالصدمات الكهربائية)
ملاحظة: يمكن أن يعرض منحنى الإجهاد الإجهاد الأمثل ثلاث مناطق: منطقة إصبع القدم، والمنطقة المرنة، ومنطقة البلاستيك. يظهر مثال منحنى الإجهاد الإجهاد ECT في الشكل 7. تحليل منحنى الإجهاد الإجهاد يسمح استخراج المعلمات الحيوية الهامة للأنسجة مثل، صلابة، أقصى قدر من القوة، مرونة، اللدونة، والتمدد، والمرونة، والصلابة.
- حصاد العلاج بالصدمات الكهربائية عن طريق سحب أول نقالة، بما في ذلك العلاج بالصدمات الكهربائية، من بئرها، وذلك باستخدام ملقط. يمكن بعد ذلك عقد نقالة على قاعدتها، وتراجع العلاج بالصدمات الكهربائية على نصائح نقالة باستخدام هوك غرامة أو تلميح ماصة.
- نقل العلاج بالصدمات الكهربائية على اثنين من السنانير فرضت على الذراع الثابتة وذراع محول التحليل الميكانيكي الديناميكي التمديدي (DMA) الريمتر مجهزة 37 درجة مئوية حمام الجهاز خفف (حسب الطلب) مليئة PBS (الشكل 7A).
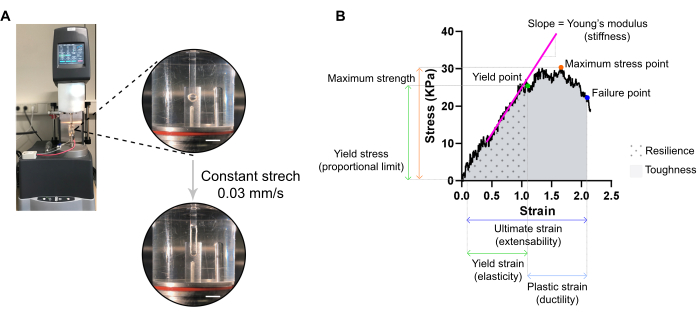
الشكل 7: تحليل قياس الشد المدمرة ECT. (أ) قياس الشد المدمر الريولوجي على مقياس الريمتر الميكانيكي الديناميكي الإرشادي (DMA). عرض الطاقة العالية العليا: العلاج بالصدمات الكهربائية بعد تركيبه في L0 في غرفة بيئية وتوصيله بعمود علوي وسفلي لتحليل الإجهاد. عرض الطاقة العالية السفلي: ECT متوتر بمعدل ثابت 0.03 مم / ثانية حتى نقطة الفشل في سلالة النهائي. أشرطة المقياس = 5 مم (B) رسم تخطيطي لسلالة الإجهاد ل ECT يظهر المعلمات الرئيسية المقاسة. الحد الأعلى للمنطقة المرنة يتوافق مع نقطة الغلة وتتألف المنطقة البلاستيكية بين نقطة الغلة ونقطة الفشل (ليونة). يتوافق منحدر المرحلة الخطية للمنطقة المرنة مع معامل الشباب الذي يعكس تصلب الأنسجة. القوة القصوى تتوافق مع الحد الأقصى من الإجهاد الشد يمكن للأنسجة تحمل. بسبب الألياف microfracturing، والإجهاد يقلل حتى يصل النسيج إلى نقطة الفشل. يحدث هذا في سلالة النهائي (القابلية للتوسعة) حيث لوحظ انخفاض مفاجئ في الإجهاد بسبب تمزق الأنسجة. المرونة يتوافق مع الطاقة (kJ/m3) التي يمتصها النسيج قبل تشوه دائم (حتى نقطة الغلة) وتعطى من قبل المنطقة تحت منحنى (AUC) تصل إلى سلالة نقطة العائد. الصلابة يتوافق مع مجموع الطاقة (kJ/m3) النسيج يمكن أن تمتص حتى تمزق ويعطى من قبل AUC تصل إلى سلالة في نهاية المطاف. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تعيين الريمتر لتطبيق التوتر أحادية الجنس بمعدل خطي ثابت من حوالي 1 ٪ من المسافة الأولية بين السنانير في الثانية الواحدة. يمكن استخدام معدل تمدد ثابت يبلغ 0.03 مم/ثانية مع أبعاد العلاج بالصدمات الكهربائية النموذجية. تاري محول، بدء تمتد وتسجيل حتى نقطة تمزق العلاج بالصدمات الكهربائية.
تنبيه: يجب تسجيل الصور العيانية ل ECT (الخطوة 4.1.) قبل اختبار الشد، حيث أن CSA مطلوب لتطبيع البيانات.
ملاحظة: تحليل الإجهاد-سلالة، بما في ذلك حساب CSA، يمكن معالجتها في وقت لاحق في الوقت المناسب عند اختبار الشد. استخدم برنامج جدول بيانات وبرنامج تحليل إحصائي لتحليل البيانات. - تطبيع قيم القوة المقاسة (mN) لكل ECT بواسطة CSA (mm2) للحصول على قيم الإجهاد (kPa).
- رسم قيم الإجهاد ضد سلالة (مقياس هندسي لتشوه الأنسجة التي قدمها المسافة النسبية بين هوك العلوي والسفلي) على الرسم البياني XY.
ملاحظة: يجب تعديل الطول الأولي للأنسجة (المسافة بين الخطاف العلوي والسفلي) مباشرة قبل أن يترتب على التمدد L0 يدويا ويتوافق مع بداية منطقة إصبع القدم (يمكن أن تكون منطقة إصبع القدم غائبة اعتمادا على خصائص الأنسجة). يجب حساب كل قيمة نقطة إجهاد وفقا للمعادلة، حيث يكون Ltotal هو الفجوة الإجمالية في كل نقطة قياس: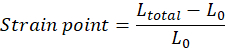
عند رسم البيانات، استخدم قيمة الإجهاد في L0 المحدد للطرح الخلفية. - تحديد معلمات الميكانيكا الحيوية المختلفة من منحنى الإجهاد الإجهاد (استخدام الشكل 7B كمثال).
ملاحظة: يمكن أن يعرض منحنى الإجهاد الإجهاد ثلاث مناطق: إصبع القدم، ومرونة، والمناطق البلاستيكية. الحد الأعلى للمنطقة المرنة ، قبل أن يبدأ النسيج في التكبر الدقيق ، يتوافق مع نقطة الغلة ، وسلالته هي مقياس لمرونة الأنسجة. وتتألف المنطقة البلاستيكية بين نقطة الغلة ونقطة الفشل. النقطة اللاحقة يتوافق مع انخفاض مفاجئ في الإجهاد بسبب تمزق الأنسجة، وتحديد وصمة عار في نهاية المطاف، وهو مقياس لتمدد الأنسجة. تتوافق نقطة القياس الثالثة مع أقصى قوة ، والتي يتم تعريفها بأعلى إجهاد يمكن أن يتحمله النسيج دون كسر أثناء التمدد. المرونة والصلابة، التي تعطى من قبل المنطقة تحت المنحنى، يتوافق مع الطاقة التي يمتصها النسيج حتى نقطة الغلة ونقطة الفشل، على التوالي. لكل منحنى تم الحصول عليه ، يتوافق منحدر الجزء الخطي من المنطقة المرنة مع معامل الشباب ، المعروف أيضا باسم المغير المرن ، وهو خاصية ميكانيكية تقيس صلابة الأنسجة.- استخراج من كل منحنى قيم XY (الإجهاد والإجهاد، على التوالي) من نقطة العائد، نقطة الفشل، ونقطة الإجهاد القصوى.
- تقييم معامل الشباب (صلابة في kPa = mN·mm-2) من كل العلاج بالصدمات الكهربائية من منحدر الجزء الخطي من المنطقة المرنة عن طريق رسم الانحدار الخطي لتلك المنطقة.
- استخدم برنامجا إحصائيا لحساب المنطقة تحت المنحنى (AUC) لتحديد كل من المرونة والصلابة ، حتى نقطة العائد ونقطة الفشل ، على التوالي. حساب AUC بواسطة الأسلوب شبه المنحرف. تعيين خط الأساس إلى الصفر والنظر فقط في القمم فوق خط الأساس، والتي لا تقل عن 10 ٪ من المسافة من الحد الأدنى إلى القيمة القصوى في المحور ص.
ملاحظة: يتم إعطاء معامل المرونة والصلابة من قبل σ × ε، حيث σ هو الإجهاد (kPa) ε هو السلالة (L/ΔL، مم/مم). وهكذا، فإن المرونة والصلابة هما الطاقة في kJ/m3 (kPa = kN·m-2 = kN·m·m-3 = kJ/m·m·m-3 = kJ/m3) التي يمتصها النسيج قبل التشوه الدائم وحتى التمزق، على التوالي.
Access restricted. Please log in or start a trial to view this content.
النتائج
تصل ECT إلى حوالي 95 ٪ ضغط مقارنة بحجم هيدروجيل الكولاجين الخلوي الأولي خلال أول 24 ساعة. ضغط الأنسجة والانكماش تحت ظروف السيطرة وفي وجود FCS تستتبعه بضع ساعات بعد الصب ويزيد بشكل ملحوظ حتى اليوم 5 (الشكل 5A). وقد يزداد انحراف القطب خلال الأيام ال 15 التالية (20 يوما هي أطول فترة تم اخ...
Access restricted. Please log in or start a trial to view this content.
Discussion
يصف البروتوكول المقدم توليد العلاج بالصدمات الكهربائية من CF البشري الأساسي ، والذي يسمح بدراسة التأثير الميكانيكي لهذه الخلايا على بيئة المصفوفة خارج الخلية والعكس بالعكس.
تحتاج الخلايا الليفية إلى توسيعها لتسفر عن خلايا كافية لتجارب العلاج بالصدمات الكهربائية المخطط ل?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
صاغت GLS وSL المخطوطة. ساهم جميع المؤلفين في تطوير البروتوكول وحرروا المخطوطة. TM، MT، وWHZ هي المستشارين العلميين لmgM. Myriamed WHZ هو مؤسس ومساهم في ميرياميد GmbH.
Acknowledgements
وقد تم دعم هذا العمل من قبل الجمعية الألمانية لأمراض القلب (زمالة أبحاث DGK ل GLS) ومؤسسة الأبحاث الألمانية (DFG من خلال مشروع IRTG 1816 ل GLS و AD؛ DFG 417880571 وDFG TI 956/1-1 لMT; SFB 1002 TP C04 ل MT و WHZ; SFB 1002 TP S01 لWHZ; و EXC 2067/1-390729940J لWHZ). WHZ مدعوم من قبل الوزارة الاتحادية الألمانية للعلوم والتعليم (BMBF من خلال مشروع IndiHEART)، ومؤسسة Leducq (20CVD04). MT، WHZ و SL مدعومة من قبل المركز الألماني لأبحاث القلب والأوعية الدموية (DZHK).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
References
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095(2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), Maywood. 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force--Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519(2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Developmental Biology. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved