È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Tessuto connettivo ingegnerizzato umano derivato da fibroblasti per applicazioni di screening
In questo articolo
Riepilogo
Qui viene presentato un protocollo per generare tessuti connettivi ingegnerizzati per una coltura parallela di 48 tessuti in una piastra multi-pozzo con doppi poli, adatto per studi meccanicistici, modellazione di malattie e applicazioni di screening. Il protocollo è compatibile con fibroblasti di diversi organi e specie ed è esemplificato qui con fibroblasti cardiaci primari umani.
Abstract
I fibroblasti sono cellule fenotipicamente altamente dinamiche, che si trasdifferentizzano rapidamente in miofibroblasti in risposta a stimoli biochimici e biomeccanici. L'attuale comprensione dei processi fibrotici, compresa la fibrosi cardiaca, rimane scarsa, il che ostacola lo sviluppo di nuove terapie anti-fibrotiche. Sistemi modello umano controllabili e affidabili sono fondamentali per una migliore comprensione della patologia fibrosa. Si tratta di un protocollo altamente riproducibile e scalabile per generare tessuti connettivi ingegnerizzati (ECT) in una piastra di colata a 48 pozzetti per facilitare gli studi sui fibroblasti e la fisiopatologia del tessuto fibrotico in un ambiente tridimensionale (3D). Gli ECT sono generati attorno ai poli con rigidità sintonizzabile, consentendo studi sotto un carico biomeccanico definito. Nelle condizioni di carico definite, possono essere studiati adattamenti fenotipici controllati dalle interazioni cellula-matrice. Il test parallelo è fattibile nel formato a 48 pozzetti con l'opportunità per l'analisi del percorso temporale di più parametri, come la compattazione e la contrazione dei tessuti contro il carico. Da questi parametri è possibile studiare le proprietà biomeccaniche come la rigidità e l'elasticità dei tessuti.
Introduzione
Uno dei principali ostacoli nello studio delle malattie fibrotiche è la mancanza di modelli di tessuto 3D umano rappresentativi che forniscano informazioni sul comportamento dei fibroblasti e dei loro derivati patologici. Per studiare i processi fibrotici, i sistemi di coltura 2D standard sono sub-ottimali poiché i fibroblasti isolati si transdifferenziano rapidamente in miofibroblasti che esprimono α-liscia di actina muscolare (SMA) quando coltivati su substrati 2D non conformi1,2,3. Pertanto, i fibroblasti nella coltura 2D standard non riflettono un fenotipo tissutale "sano" regolare3,4,5,6. Sono state introdotte colture su substrati flessibili per simulare ambienti tissutali non fibrotici (10 kPa) e fibrotici (35 kPa)7, ma questi mancano della terza dimensione, che è molto importante per quanto riguarda la fisiopatologia. L'ingegneria tissutale offre l'opportunità di superare questa limitazione consentendo la coltura di fibroblasti in un contesto di matrice extracellulare (ECM) definito e sperimentalmente sintonizzabile, ad esempio mediante alterazioni della cellularità, della composizione ECM e della concentrazione di ECM, che possono determinare la biomeccanica tissutale.
Vari modelli 3D sono stati generati utilizzando fibroblasti. I dischi galleggianti e le microsfere sono stati tra i primi e dimostrano che il collagene viene rimodellato e compattato in modo dipendente dal tempo. I fibroblasti esercitano forze di trazione sulle fibrille di collagene, un processo che può essere facilitato dall'aggiunta di agenti pro-fibrotici come il fattore di crescita trasformante-beta 1 (TGF-β1)8,9,10,11,12,13,14,15,16. Tuttavia, le colture liberamente fluttuanti non consentono il carico esterno controllato e, pertanto, costituiscono modelli in continua contrazione o compattazione. I tessuti ingegnerizzati simili a fogli hanno aperto la possibilità di studiare la regolazione omeostatica delle proprietà biomeccaniche dei tessuti, in particolare attraverso test di deformazione uni, bi, multiassiale o ciclica17,18,19,20. Questi modelli sono stati utilizzati, ad esempio, per dimostrare l'influenza del numero di cellule sulla rigidità del tessuto, che è risultata correlata positivamente con l'integrità del citoscheletro e la contrattilità del citoscheletro dell'actomiosina.18,19. Tuttavia, è importante notare che le conversioni forza-deformazione sono complicate dalla deformazione tissutale non uniforme attorno ai punti di serraggio dei trasduttori di forza e dei punti di ancoraggio. Questa limitazione intrinseca può essere aggirata da ossa di cane o tessuti a forma di anello, offrendo una certa applicazione dei tessuti nei punti di ancoraggio21,22,23. I tessuti a forma di anello possono essere preparati distribuendo un idrogel di collagene cellulare in stampi a forma di anello. Mentre l'idrogel si compatta, un tessuto si forma attorno all'asta interna incomprimibile dello stampo, che offre resistenza per un'ulteriore contrazione del tessuto24,25,26,27. Dopo la compattazione iniziale e tipicamente massima, i tessuti possono anche essere trasferiti a distanziali regolabili per trattenere ulteriormente l'ECT circolare a una lunghezza di tessuto definita.3,24,25,26,27,28,29,30. Le proprietà biofisiche possono essere valutate in dispositivi standard orizzontali o verticali di deformazione-sollecitazione con celle di carico appropriate sotto deformazione unidirezionale o dinamica3. Poiché i tessuti hanno una struttura circolare ampiamente uniforme e possono essere tenuti su barre/ganci (punti di ancoraggio e/o trasduttori di forza), sebbene questi possano ancora racchiudere aree di compressione attorno alle barre di carico, questo formato consente una variazione di deformazione più uniforme rispetto al serraggio3. Inoltre, i tessuti ancorati suscitano una forma cellulare bipolare e le cellule si adattano alle forze tissutali per allungamento lungo le linee di forza promuovendo la trazione anisotropica.31,32,33,34,35,36. In precedenza abbiamo applicato ECT a forma di anello da fibroblasti cardiaci (CF) di ratto e umani attorno a un singolo polo rigido in esperimenti di stress funzionale e abbiamo eseguito studi di guadagno e perdita di funzione utilizzando fibroblasti trasdotti viralmente24,25,26 e studi farmacologici37. Inoltre, potremmo identificare le differenze sessuali nella fibrosi cf-mediata nel modello ECT27.
Il seguente protocollo per la generazione di ECT umano, esemplificato con CF umano primario ottenuto come CF crioconservato da fornitori commerciali (vedi Tabella dei materiali), combina i vantaggi dei tessuti a forma di anello con un modo semplice e veloce di produrre tessuti macroscopici per una piattaforma a 48 pozzi progettata per test paralleli ad alto contenuto.
È importante sottolineare che il modello ECT non è limitato a un tipo specifico di fibroblasti, con l'uso documentato nello studio di altri fibroblasti, ad esempio fibroblasti cutanei38,39. Inoltre, i fibroblasti delle biopsie del paziente funzionano altrettanto bene e la scelta dei fibroblasti dipende in ultima analisi dalla questione scientifica da affrontare.
La piattaforma utilizzata per la generazione di ECT descritta in questo protocollo è una piastra di coltura cellulare/tissutale 3D a 48 pozzetti disponibile in commercio (Figura 1A). Vengono descritti i metodi per la preparazione, la coltivazione e il monitoraggio della formazione e della funzione dell'ECT sotto una geometria definita e un carico meccanico con l'aiuto della piastra a 48 pozzetti. Gli ECT formati sono tenuti da pali flessibili integrati e il carico meccanico può essere messo a punto in base allo scopo finale utilizzando pali con diversa durezza (shore A valore 36-89), influenzandone le rigidità di flessione. Si raccomandano pali con una riva Un valore di 46. Il protocollo è, inoltre, compatibile con uno stampo circolare personalizzato precedentemente descritto, in cui l'ECT è tenuto attorno a una singola asta rigida37. Le dimensioni di questo stampo sono indicate nella Figura 1B.
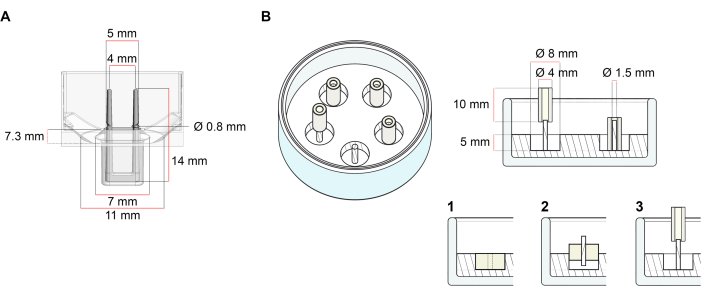
Figura 1: Rappresentazione schematica degli stampi di fusione. (A) Disegno tecnico e dimensioni di uno stampo di colata con due poli flessibili. Lo stampo comprende una circonferenza interna delimitata da una parete corta che contiene doppi pali di ritenzione sul corpo principale dello stampo. I poli flessibili hanno una distanza orizzontale libera l'uno dall'altro e sono collegati alla base. Lo stampo consente un volume di fusione di 180 μL. Il pozzetto di ogni stampo consente una capacità volumetrica di almeno 600 μL di terreno di coltura. Diverse composizioni di materiali possono essere utilizzate per produrre pali con rigidità specifiche (ad esempio, TM5MED-TM9MED). (B) Disegno tecnico e dimensioni di uno stampo a forma di anello con una singola asta rigida. Si tratta di uno stampo alternativo con geometria e ambiente meccanico distinti, che può essere utilizzato con il protocollo di fusione ECT37. Il metodo di assemblaggio dello stampo a forma di anello è stato adattato dai formati più grandi pubblicati28,41. In breve, il metodo include (1) l'imprinting di distanziali di stampaggio in politetrafluoroetilene (PTFE) (diametro 8 mm) in polidimetilsilossano (PDMS, silicone) versato in piatti di vetro (diametro 60 mm) e (2) il fissaggio di un supporto per palo PDMS (diametro 1,5 mm) concentricamente all'interno della cavità cava formata, che serve a (3) tenere un palo rimovibile (tubo in silicone di 4 mm di diametro). Lo spazio vuoto risultante consente 180 μL di volume di colata. Ogni piatto di vetro può contenere più stampi impressi (mostrati in modo esemplare con 5 stampi) e ha la capacità di raggiungere fino a 5 ml di terreno di coltura. Fare clic qui per visualizzare una versione più grande di questa figura.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutte le fasi devono essere intraprese in cappe di biosicurezza di classe II installate in laboratori di livello di contenimento 1. A seconda delle normative locali e del tipo di manipolazioni da eseguire, come il trasferimento genico mediato da virus, il livello di contenimento deve essere aumentato al livello di biosicurezza 2 o 3. Tutte le colture sono mantenute a 37 °C in un incubatore di colture cellulari con un'atmosfera umidificata del 5 % di CO2 nell'aria. Si noti che i volumi (passaggi 1 e 2) sono forniti per un pallone di coltura cellulare T75. Regolare i volumi in diversi formati di coltura in base alle raccomandazioni standard di coltura cellulare.
1. Scongelamento e pre-placcatura del fibroblasto cardiaco primario (CF) per la coltura monostrato (5-12 giorni)
NOTA: In alternativa, le celle HFF-1 possono essere utilizzate seguendo il protocollo di sottocoltura standard come consigliato dal fornitore.
- Preparare il mezzo di crescita dei fibroblasti (MGF) secondo le istruzioni del produttore. Facoltativamente, aggiungere antibiotici come 100 U / mL di penicillina e 100 mg / mL di streptomicina. Consentire la miscelazione completa di tutti i componenti prima dell'uso. Conservare a 4 °C per un massimo di 14 giorni.
- MGF caldo a 20-25 °C.
- Scongelare la FC crioconservata (contenente idealmente da 1 x 106 a 2 x 106/mL di cellule per crioviale) a bagnomaria a 37 °C per circa 2 minuti, fino a quando non rimane solo una piccola quantità di ghiaccio nel flaconcino.
- Utilizzando una pipetta sierologica da 2 ml, trasferire la sospensione cellulare a goccia in un tubo centrifugo sterile appropriato contenente 10 mL di MGF. Per un recupero cellulare ottimale, sciacquare la crioviale con 1 mL di MGF e trasferirla nel tubo della centrifuga. Poiché le cellule sono molto sensibili in questa fase, risospesso utilizzando una pipetta sierologica con una punta del foro per ridurre al minimo il danno cellulare dovuto allo sforzo di taglio.
NOTA: se il mezzo di crioconservazione contiene un'alta percentuale di DMSO, assicurarsi che dopo la risospensione cellulare nelle MGF, il contenuto di DMSO sia inferiore all'1 %. In alternativa, centrifugare le celle risospese a 300 x g per 5 minuti a 20-25 °C per lo scambio del mezzo. Quindi, aspirare accuratamente il surnatante, ruotare il tubo per rimuovere le cellule pellettate e risospesce nel volume desiderato di MGF per la semina. - Semina 0,5 x 106 cellule in 12 mL di MGF in un pallone di coltura cellulare T75. Se si utilizzano altri articoli da laboratorio, regolare il numero di cella per mantenere una densità di semina di 6,7 x 103/cm2.
- Sostituire le MGF a giorni alterni per 5 giorni o fino a quando le cellule raggiungono l'80% di confluenza.
NOTA: La resa cellulare dopo l'espansione dipende principalmente dalle dimensioni delle cellule e dal tasso di proliferazione, che possono differire tra i donatori di cellule. Tipicamente, questa procedura di coltura standard consente il recupero di 4 x 106 a 5 x 106 CF da un pallone di coltura cellulare T75 dopo 5 giorni di coltura.
2. Dispersione enzimatica della FC umana (10-20 min)
NOTA: Questa fase mira a stabilire una sospensione monocellulare di FC umana sia per le cellule monostrato sub-coltura che per la preparazione di ECT. Questo protocollo è stato ottimizzato per colture monostrato CF umane nei passaggi 3-4. Per una standardizzazione ottimale, si raccomanda la sottocoltura di CF in monostrato, almeno una volta prima della preparazione dell'ECT. Questo protocollo deve essere ottimizzato per i fibroblasti provenienti da diversi donatori e fornitori. Protocolli di distacco alternativi possono comportare la sostituzione di reagenti di dissociazione a base di serina proteasi ricombinante con, ad esempio, quelli contenenti enzimi proteolitici e collagenolitici.
- FGM caldo, PBS (Ca2+/Mg2+-free) e reagente di dissociazione cellulare a 20-25 °C.
- Aspirare il mezzo dalle cellule coltivate.
- Lavare le celle con 6 ml di PBS e aspirare.
- Aggiungere 6 mL del reagente di dissociazione cellulare alle cellule e incubare per 3 minuti a 20-25 °C fino a quando le cellule iniziano a staccarsi visibilmente.
NOTA: a seconda della fonte CF, questa operazione potrebbe richiedere alcuni minuti in più. In alternativa, se le cellule non si staccano a temperatura ambiente, incubare a 37 °C per migliorare l'attività degli enzimi. Per garantire una vitalità cellulare ottimale, monitorare il distacco cellulare al microscopio. - Neutralizzare l'attività enzimatica aggiungendo 6-12 ml di MGF alle cellule spostate nel reagente di dissociazione cellulare. Pipettare delicatamente su e giù 4-8 volte utilizzando una pipetta sierologica da 10 mL per garantire una sospensione a cella singola e trasferire le celle in un tubo di raccolta fresco da 50 mL. Verificare la resa con l'aiuto di un microscopio e di un emocitometro o di un contatore di cellule automatizzato secondo le istruzioni del produttore.
- Centrifugare la sospensione cellulare a 300 x g per 5 min a 20-25 °C.
NOTA: Al fine di raggiungere una resa di cellule sufficiente per la generazione della quantità desiderata di ECT, le cellule possono essere sottocolturate in una diluizione fino a 1:6 per un'ulteriore espansione. Lasciare che le cellule crescano fino a raggiungere l'80% di confluenza (circa 5-6 giorni), con il mezzo che cambia a giorni alterni. Quindi ripetere la dispersione enzimatica e procedere con il passaggio 2.7. per continuare con la preparazione ECT. - Aspirare il surnatante e far scorrere il tubo per rimuovere il pellet. Risospese le cellule nelle MGF a 20-25 °C per ottenere una sospensione cellulare di ≥ 15 x 106/mL (circa il 40 % in più di cellule rispetto a quanto richiesto per il passaggio 3.3.). Questo spiega la perdita di cellule dovuta allo sforzo nel passaggio successivo.
- Filtrare la sospensione cellulare attraverso un filtro cellulare a rete da 40 μm.
ATTENZIONE: Gli agglomerati cellulari sono dannosi per la formazione ottimale di ECT. Quando si utilizza la dispersione enzimatica del protocollo CF umano per la fusione diretta dell'ECT, lo sforzo della sospensione cellulare garantisce l'assenza di grandi grumi cellulari che interferiscono con la formazione di tessuti omogenei. Le eterogeneità comprometteranno analisi affidabili della deformazione dello stress. - Riconteggiare il numero di cellule e valutare la vitalità cellulare per garantire un numero di cellule affidabile in una sospensione con ≥80 % di vitalità per procedere con la preparazione dell'ECT.
- Utilizzare un contatore di celle automatizzato per valutare il numero di celle e la fattibilità mediante esclusione di corrente elettrica.
- In alternativa, utilizzare il test di esclusione del colorante tripano blu (cancerogeno, categoria di pericolo 2 - prendere misure precauzionali), con l'aiuto di un microscopio e di un emocitometro per l'identificazione diretta e l'enumerazione di cellule vive (membrane cellulari intatte che escludono il colorante) e morte (membrane cellulari compromesse che consentono il legame del colorante alle proteine intracellulari).
- Riservare il tubo di raccolta con sospensione cellulare a 20-25 °C e procedere immediatamente con il passaggio 3.
3. Preparazione ECT (1 h)
NOTA: la panoramica schematica della generazione di ECT è descritta nella Figura 2.
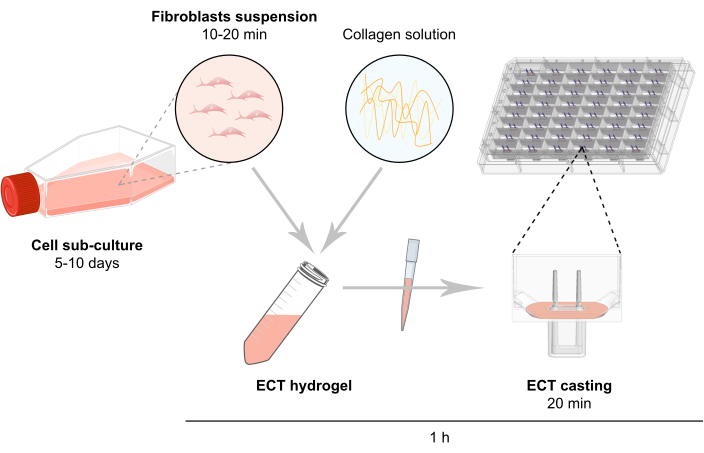
Figura 2: Panoramica schematica della generazione di ECT. I fibroblasti vengono espansi in coltura 2D prima dell'uso nella generazione ECT. Dopo 5-10 giorni, le cellule vengono disperse enzimaticamente e la sospensione cellulare viene ricostituita in una miscela tamponata contenente collagene bovino di tipo 1. La miscela di idrogel di collagene cellulare viene pipettata in singoli pozzetti in una piastra a 48 pozzetti per la coltura di tessuti ingegnerizzati in 3D, progettata come stampi di fusione con due poli flessibili per consentire la sospensione dell'ECT a una lunghezza e un carico definiti. Gli ECT sono in genere coltivati da 1 a 20 giorni prima delle misurazioni. Fare clic qui per visualizzare una versione più grande di questa figura.
- Preparare una soluzione madre DMEM 10x sciogliendo la polvere dmEM in ddH2O (134 mg/mL per la formulazione specificata nella Tabella dei materiali) sotto una rotazione costante a 37 °C per 1 ora. Sterilizzare per filtrazione. Lo stock è stabile fino a 14 giorni a 4 °C o -20 °C per un massimo di 12 mesi.
- Preparare al momento 2x DMEM diluendo una soluzione madre DMEM 10x e aggiungendo il 20% (v/v) fcs in ddH2O sterile. Facoltativamente, utilizzare antibiotici come 200 U/mL di penicillina e 200 mg/mL di streptomicina. Consultare la Tabella 1 per i volumi di pipettaggio. Lo stock è stabile fino a 14 giorni a 4 °C.
NOTA: eseguire i passaggi 3.1. e 3.2. prima di iniziare la dispersione enzimatica delle cellule (fase 2.) per la preparazione dell'ECT.
| Reagente | Concentrazione finale | Volume (mL) |
| 10× DMEM | n/d | 2 |
| FCS | 20 % (v/v) | 2 |
| Penicillina | 200 U/mL | 0.2 |
| Streptomicina | 200 mg/ml | 0.2 |
| ddH2O | n/d | 5.6 |
| Totale | n/d | 10 |
Tabella 1: Composizione di 2x DMEM.
ATTENZIONE: Tutti i componenti della miscela idrogel cellula-collagene e dei tubi della centrifuga devono essere mantenuti sul ghiaccio prima dell'uso. Ciò contribuirà a prevenire l'autoassemblaggio del collagene prima di distribuire la miscela di idrogel cellula-collagene in tutti gli stampi di fusione.
- Sulla base della Tabella 2, regolare la sospensione cellulare a una densità di 8,88 x 106 celle/ml aggiungendo MGF a 20-25 °C alla sospensione cellulare dal passaggio 2.10. Quindi, spostare il tubo di raccolta con sospensione cellulare sul ghiaccio.
- Per preparare la miscela di idrogel ECT, pre-raffreddare un tubo di centrifuga da 50 ml su ghiaccio e aggiungere ad esso i diversi componenti elencati nella Tabella 2 nell'ordine seguente, evitando la formazione di bolle d'aria.
NOTA: il numero massimo di ECT da preparare dipende dal numero totale di celle determinato nel passaggio 2.9. Utilizzare 0,3 mg di collagene per ECT, ottenuti da una soluzione madre contenente 6-7 mg/ml. La concentrazione della soluzione madre di collagene determina il volume necessario per ottenere un contenuto ottimale di collagene ECT. I volumi degli altri componenti dell'idrogel ECT devono essere adattati di conseguenza. Vedere Tabella 2 per i volumi aggiustati in base a una soluzione madre di collagene di 6,49 mg/ml. I volumi descritti nella Tabella 2 sono utilizzati in questo protocollo come linea guida esemplare.- Pipettare l'idrogel acido solubile-collagene di tipo 1 utilizzando una pipetta sierologica con una punta a foro largo.
- Regolare il contenuto di sale della soluzione di collagene aggiungendo il DMEM 2x mescolando delicatamente facendo roteare il tubo.
- Neutralizzare il pH aggiungendo 0,2 M NaOH mentre si mescola delicatamente facendo roteare il tubo. L'indicatore rosso fenolo passerà dal giallo al rosso.
NOTA: Il volume di NaOH deve essere titolato per ogni singolo lotto di collagene per la neutralizzazione ottimale del pH. La neutralizzazione dipende da fattori quali il tipo di tampone e la preparazione, nonché la concentrazione assoluta di collagene, e influenza l'assemblaggio della matrice di collagene e la vitalità cellulare23,40. Una volta che il contenuto ionico è aumentato dall'aggiunta di DMEM e il pH è neutralizzato, l'autoassemblaggio del collagene segue e non deve essere interrotto. Pertanto, eseguire quanto segue rapidamente e senza interruzioni. - Aggiungere la sospensione cellulare (dal punto 3.3) a goccia mescolando delicatamente ruotando il tubo.
| Numero ECT: | 1 | 6 | 24 | 48 | |
| di cui l'eccedenza del 10 % | |||||
| Componenti idrogel di collagene cellulare: | (μL) | (μL) | (μL) | (μL) | |
| Collagene (6,49 mg/ml) | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 2× DMEM | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 0,2 m Naoh | 3.1 | 20.5 | 81.8 | 163.7 | |
| Miscela cellulare in MGF (8.88×106 cell/mL) | 84.5 | 557.4 | 2229.7 | 4459.5 | |
| Volume totale (μL) | 180.0 | 1188.0 | 4752.0 | 9504.0 | |
| Questa è una tabella esemplare per preparare un volume di fusione di 180 μL per ECT, contenente un totale di 750.000 cellule e 0,3 mg di collagene per ECT. | |||||
Tabella 2: Preparazione dell'idrogel ECT (compresa un'eccedenza del 10 % che tiene conto degli errori di pipettaggio).
- Mescolare l'intera sospensione tubando delicatamente su e giù una sola volta, utilizzando una pipetta sierologica con una punta a foro largo per evitare la formazione di bolle e ridurre al minimo lo stress da taglio. Garantire la miscela completa facendo ruotare delicatamente il tubo 10 volte e mantenere il tubo centrifugo da 50 ml contenente miscela di idrogel ECT su ghiaccio durante tutto il processo di fusione.
- Pre-bagnare una punta di pipetta da 1 mL con miscela di idrogel ECT e distribuirne 180 μL in modo uniforme in ogni stampo della piastra di colata a 48 pozzetti, evitando eccessive forze di taglio che potrebbero influire sull'integrità dell'assemblaggio della matrice di collagene e assicurando che l'intera piastra sia eseguita in 15-20 minuti.
NOTA: il volume di colata consigliato è di 180 μL, ma può essere esteso a 200 μL38. Pertanto, quando si preferisce, i volumi nella Tabella 2 possono essere adattati a 200 μL in modo da mantenere le stesse concentrazioni e gli stessi rapporti tra cellule e collagene.- Assicuratevi che all'interno dello stampo si formi un loop completo (Figura 3A). Se la miscela di idrogel ECT viene applicata in modo discontinuo, verrà impedita una formazione completa di anelli ECT (Figura 3B).
- Evitare il pipettaggio nel pozzo interno (Figura 3C) e la formazione di bolle durante il pipettaggio (Figura 3D), per garantire una formazione tissutale omogenea e funzionale.
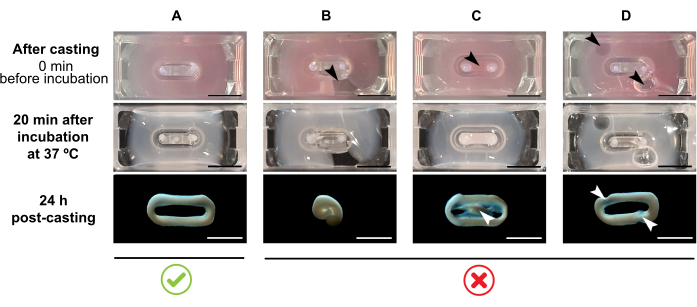
Figura 3: Fusione, formazione di idrogel e condensazione ECT in formato multi-pozzo. I pannelli superiori esemplificano l'aspetto dell'ECT direttamente dopo la fusione. I pannelli centrali esemplificano l'aspetto dell'ECT dopo l'incubazione per 20 minuti a 37 °C. I pannelli inferiori esemplificano lo stato di compattazione dell'ECT 24 ore dopo la preparazione, rimosso dai poli. (A) Corretta formazione di ECT tra due poli durante le prime 24 ore. (B-D) Esempi di errori di pipettaggio che impediscono una corretta formazione di ECT. Le frecce bianche e nere indicano difetti strutturali dell'ECT dovuti a una fusione impropria. Barra della scala: 5 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
- Posizionare con attenzione la piastra di colata a 48 pozzetti all'interno dell'incubatore di colture cellulari e lasciare che la miscela di idrogel ECT si ricostituisca per 15-30 minuti. Dopo l'incubazione, apparirà simile al gel e opaco (Figura 3, pannello centrale).
- Aggiungere 600 μL di MGF calda a 37 °C per pozzetto, senza pipettare il terreno di coltura direttamente sull'ECT di formazione in quanto ciò può causare la distruzione dei tessuti. Aggiungere delicatamente il terreno di coltura lungo la parete del pozzo, poiché a questo punto anche l'ECT non deve essere staccato dal fondo (Figura 4).
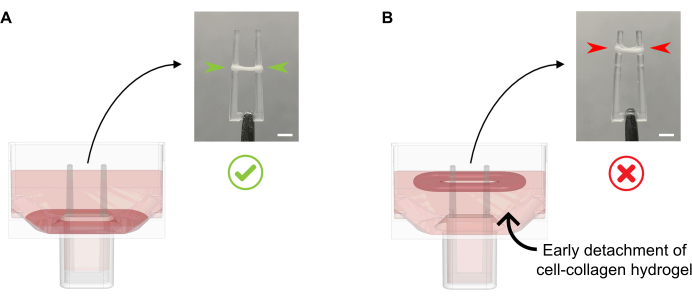
Figura 4: Aggiunta corretta e impropria del terreno di coltura all'ECT appena fuso. (A) Durante l'aggiunta del terreno di coltura dopo la solidificazione iniziale dell'ECT (20 minuti dopo la colata), l'ECT di condensazione deve essere lasciato indisturbato sul fondo del pozzo. Durante le prossime 24 ore, la compattazione della matrice guidata da celle farà scorrere l'ECT sulla rampa. La posizione finale dell'ECT è controllata da cavità concave ad un'altezza del polo definita; ciò garantisce che tutti gli ECT si depositino nella stessa posizione per consentire un confronto dell'attività di flessione dei poli nella coltura ECT parallela. (B) Formare ECT staccato dal basso aggiungendo il terreno di coltura troppo rapidamente. L'ECT flottante si compatterà al livello medio di coltura superiore. Le forze di contrazione dei poli non saranno direttamente comparabili se l'ECT si assesta in posizioni diverse. Barra della scala: 2 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
- Incubare per 24 ore.
- Sostituire il mezzo ogni giorno in seguito, con 500 μL di MGF fino all'analisi.
NOTA: Dopo la fase iniziale di gelificazione indipendente dalle cellule, la FC umana inizia a compattare ulteriormente la miscela di idrogel ECT. Entro 24 ore, l'ECT dovrebbe apparire notevolmente compattato e sollevato al livello in cui è tenuto sui poli flessibili (Figura 3 e Figura 4A).
4. Valutazione della compattazione ECT misurando l'area della sezione trasversale (CSA) (5 minuti per ECT).
NOTA: La compattazione dei tessuti inizia immediatamente dopo l'assemblaggio del collagene ed è particolarmente significativa durante le prime ore. La compattazione descrive i cambiamenti innescati principalmente dalla compressione cellulare della matrice perpendicolarmente all'asse lungo del tessuto. Questo parametro viene valutato determinando l'area della sezione trasversale (CSA) dell'ECT.
- Nei punti temporali desiderati, utilizzare uno stereomicroscopio per registrare immagini macroscopiche delle viste superiori e laterali dell'ECT (Figura 5C).
NOTA: L'ECT può essere ripreso all'interno dei pozzetti di coltivazione della piastra di colata a 48 pozzetti. In alternativa, trasferire l'ECT su una piastra multi-pozzetto inferiore trasparente per l'imaging. Si consiglia di visualizzare l'ECT sui poli in quanto la rimozione di questi porta alla perdita di precarico e, di conseguenza, in un breve periodo, il tessuto può contrarsi ulteriormente con un'eventuale torsione dovuta al rilascio di tensione, che può ostacolare la corretta imaging per le analisi dimensionali. - Utilizzare un programma di elaborazione delle immagini per eseguire un'analisi di scansione della linea. Impostate una scala e utilizzate lo strumento Linea retta per tracciare e misurare i diametri ECT ad un minimo di 6 posizioni per braccio in ciascun piano di imaging (Figura 5B,C).
- Calcola il diametro medio dai piani di visualizzazione superiore e laterale e calcola CSA in base a un'equazione di area ellittica:


Figura 5: Monitoraggio della compattazione ECT nel tempo mediante analisi CSA (Cross-Sectional Area). Gli ECT sono stati generati utilizzando CF umano e collagene di tipo I e coltivati attorno a due poli flessibili per 5 giorni. (A) Vengono presentate immagini rappresentative dell'ECT di controllo collocato in stampi flessibili per un tempo di 5 giorni. Barra scala = 5 mm. Tali immagini in campo luminoso possono anche essere utilizzate per determinare la variazione della deflessione del polo per stimare la contrazione del tessuto. (B) Rappresentazione schematica dell'area della sezione trasversale di un ECT (diametro della vista dall'alto in verde e diametro della vista laterale in rosa). (C) Immagini macroscopiche di viste superiori e laterali di un ECT ottenute con uno stereomicroscopio e corrispondente esempio di analisi a scansione lineare dei diametri dei tessuti utilizzando un programma di elaborazione delle immagini. Barra scala = 2 mm. I diametri medi vengono calcolati in base alla media di tutte le lunghezze di linea misurate su ciascun piano di visualizzazione. Fare clic qui per visualizzare una versione più grande di questa figura.
5. Monitoraggio della contrazione ECT mediante analisi di deflessione del polo (15 minuti per piastra di colata a 48 pozzetti).
NOTA: la coltura ECT viene in genere eseguita per 5 giorni, ma può essere ulteriormente estesa almeno fino a 20 giorni. La deflessione del polo si verifica a causa della contrazione del tessuto guidata dalla forza di contrazione cellulare nella direzione della tensione lungo l'asse lungo del tessuto. La valutazione della contrazione dell'ECT può essere eseguita mediante imaging in qualsiasi giorno durante la coltura.
- Immagine della piastra di fusione a 48 pozzetti sotto un dispositivo di registrazione con una telecamera di scansione dell'area integrata posizionata a una distanza fissa, dotata di un sensore di immagine monocromatico ad alta risoluzione (≥ 5 mega-pixel).
- Utilizzare una sorgente luminosa quasi UV (~ 390 nm) per massimizzare il contrasto e facilitare così il rilevamento automatico delle punte dei poli in quanto contengono un colorante fluorescente (Figura 6A, C). Se disponibili, gli obiettivi telecentrici sono consigliati per l'imaging in quanto riducono al minimo le distorsioni dell'immagine.
NOTA: In alternativa, per l'analisi possono essere utilizzate immagini macroscopiche a campo luminoso provenienti da singoli pozzetti o della piastra completa accompagnate da una barra di scala (Figura 5A).
- Utilizzare una sorgente luminosa quasi UV (~ 390 nm) per massimizzare il contrasto e facilitare così il rilevamento automatico delle punte dei poli in quanto contengono un colorante fluorescente (Figura 6A, C). Se disponibili, gli obiettivi telecentrici sono consigliati per l'imaging in quanto riducono al minimo le distorsioni dell'immagine.
- Misurare la distanza tra i poli dai record giornalieri (Figura 6C,D) utilizzando un programma di elaborazione delle immagini o un'analisi automatizzata eseguendo immagini registrate su software in grado di rilevare pixel luminosi ad alto contrasto su uno sfondo scuro.
- Calcola la deflessione dei poli attraverso la variazione della distanza dei poli rispetto alla distanza iniziale al giorno zero.
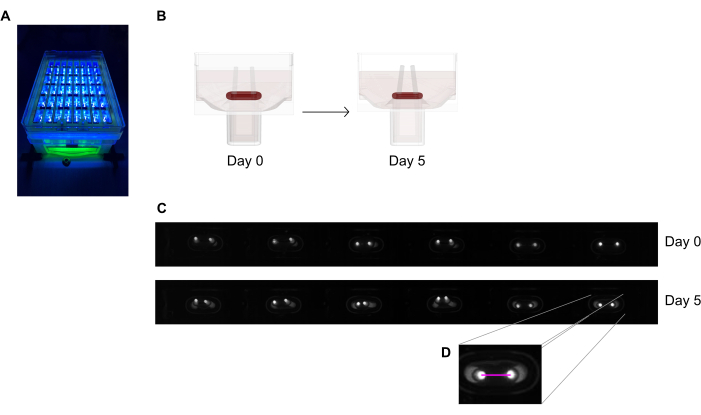
Figura 6: Panoramica schematica della valutazione della contrazione tissutale in base alla deflessione dei poli. (A) Registrazione esemplare ad alta risoluzione di poli fluorescenti nella piastra di colata a 48 pozzetti sotto eccitazione a luce quasi UV. Questo metodo è preferito rispetto alle immagini in campo luminoso per un tracciamento automatizzato della punta del polo più preciso. (B) I disegni schematici dimostrano come la compattazione e la contrazione dell'ECT portino alla flessione dei poli. (C) Una fila esemplare della stessa targa registra al giorno 0 e al giorno 5 dopo la fusione. D. Il primo piano mostra come misurare la distanza (linea rosa) tra i poli utilizzando un programma di elaborazione delle immagini. Fare clic qui per visualizzare una versione più grande di questa figura.
NOTA: Si consideri che la deflessione del polo misurata dall'immagine della punta luminosa è solo una stima della contrazione del tessuto a causa della differenza nei piani di imaging. Inoltre, si noti che l'applicazione di sostanze pro-fibrotiche come TGF-β1 durante la coltura tissutale migliora la compattazione e la contrazione dell'ECT e può infine portare a un'interruzione precoce dei tessuti.
6. Valutazione della rigidità e di altre proprietà biomeccaniche dell'ECT mediante misurazione distruttiva della trazione e analisi stress-deformazione (20 min per ECT)
NOTA: una curva stress-deformazione ottimale può visualizzare tre regioni: regione della punta, regione elastica e regione della plastica. Un esempio di curva stress-deformazione ECT è mostrato nella Figura 7. L'analisi di una curva stress-deformazione consente di estrarre importanti parametri biomeccanici del tessuto come ad esempio rigidità, massima resistenza, elasticità, plasticità, estensibilità, resilienza e tenacità.
- Raccogli eCT prima tirando la barella, incluso eCT, fuori dal suo pozzo, usando una pinza. La barella può quindi essere tenuta sulla sua base e l'ECT scivola sulle punte della barella usando un gancio sottile o una punta della pipetta.
- Trasferire l'ECT su due ganci bloccati al braccio fisso e al braccio trasduttore di un reometro ad analisi meccanica dinamica estensiva (DMA) dotato di un bagno per organi temperati a 37 °C (su misura) riempito con PBS (Figura 7A).
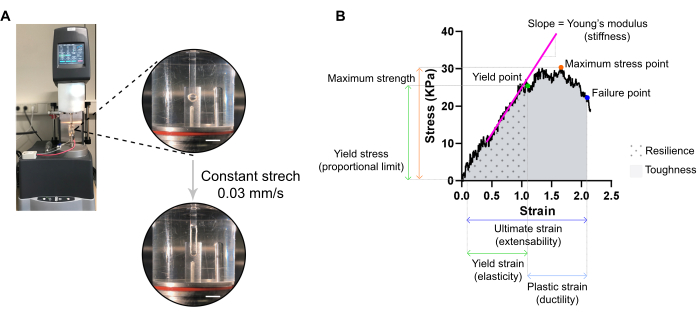
Figura 7: Analisi della misura distruttiva della trazione ECT. (A) Misura della trazione distruttiva reologica su un reometro ad analisi meccanica dinamica estensiva (DMA). Vista superiore ad alta potenza: ECT dopo il montaggio a L0 in una camera ambientale e collegato a un polo superiore e inferiore per analisi stress-deformazione. Vista inferiore ad alta potenza: ECT teso a una velocità costante di 0,03 mm / s fino al punto di guasto alla massima deformazione. Barre di scala = 5 mm. (B) Diagramma stress-deformazione di un ECT che mostra i principali parametri misurati. Il limite superiore della regione elastica corrisponde al punto di snervamento e la regione plastica è compresa tra il punto di snervamento e il punto di guasto (duttilità). La pendenza della fase lineare della regione elastica corrisponde al modulo di Young che riflette la rigidità del tessuto. La resistenza massima corrisponde alla massima tensione di trazione che un tessuto può sopportare. A causa della microfratturazione delle fibre, lo stress diminuisce fino a quando il tessuto raggiunge il punto di fallimento. Ciò si verifica alla tensione finale (estensibilità) in cui si osserva un improvviso calo dello stress a causa della rottura del tessuto. La resilienza corrisponde all'energia (kJ/m3) assorbita dal tessuto prima della deformazione permanente (fino al punto di snervamento) ed è data dall'area sotto la curva (AUC) fino alla deformazione del punto di snervamento. La tenacità corrisponde all'energia totale (kJ/m3) che il tessuto può assorbire fino alla rottura ed è data dall'AUC fino alla deformazione finale. Fare clic qui per visualizzare una versione più grande di questa figura.
- Impostare il reometro per applicare la tensione uniassiale ad una velocità lineare costante di circa l'1 % della distanza iniziale tra i ganci al secondo. È possibile utilizzare una velocità di allungamento costante di 0,03 mm/s con le dimensioni ECT tipiche. Tarare il trasduttore, avviare l'allungamento e registrare fino al punto di rottura dell'ECT.
ATTENZIONE: le immagini macroscopiche dell'ECT (punto 4.1.) devono essere registrate prima della prova di trazione, poiché il CSA è necessario per la normalizzazione dei dati.
NOTA: L'analisi stress-deformazione, incluso il calcolo CSA, può essere elaborata più tardi nel tempo dopo prove di trazione. Utilizzare un software per fogli di calcolo e un software di analisi statistica per analizzare i dati. - Normalizzare i valori di forza misurati (mN) per ECT con il suo CSA (mm2) per ottenere valori di sollecitazione (kPa).
- Tracciare i valori di sollecitazione contro la deformazione (una misura geometrica della deformazione del tessuto data dalla distanza relativa tra il gancio superiore e inferiore) su un grafico XY.
NOTA: La lunghezza iniziale del tessuto (distanza tra il gancio superiore e inferiore) immediatamente prima che segua l'allungamento, L0, deve essere regolata manualmente e corrisponde all'inizio della regione della punta (la regione della punta può essere assente a seconda delle proprietà del tessuto). Ogni valore del punto di deformazione deve essere calcolato secondo l'equazione, in cui Ltotal è il gap totale in ogni punto di misura: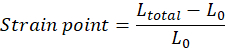
Quando tracciate i dati, utilizzate il valore di sollecitazione in corrispondenza di L0 selezionato per la sottrazione dello sfondo. - Determinare diversi parametri biomeccanici dalla curva stress-deformazione (utilizzare la Figura 7B come esempio).
NOTA: una curva stress-deformazione può visualizzare tre regioni: punta, elastica e plastica. Il limite superiore della regione elastica, prima che il tessuto inizi la microfratturazione, corrisponde al punto di snervamento e la sua deformazione è una misura dell'elasticità del tessuto. La regione di plastica è compresa tra il punto di snervamento e il punto di guasto. Il punto successivo corrisponde a un improvviso calo di stress dovuto alla rottura del tessuto, definendo la macchia finale, che è una misura dell'estensibilità del tessuto. Il terzo punto di misura corrisponde alla massima resistenza, che è definita dalla più alta sollecitazione che il tessuto può sopportare senza rompersi durante l'allungamento. La resilienza e la tenacità, date dall'area sotto la curva, corrispondono all'energia assorbita dal tessuto fino al punto di snervamento e al punto di guasto, rispettivamente. Per ogni curva ottenuta, la pendenza della parte lineare della regione elastica corrisponde al modulo di Young, noto anche come modulo elastico, ed è una proprietà meccanica che misura la rigidità del tessuto.- Estraete da ogni curva i valori XY (rispettivamente deformazione e sollecitazione) del punto di snervamento, del punto di guasto e del punto di sollecitazione massima.
- Valutare il modulo di Young (rigidità in kPa = mN·mm-2) di ciascun ECT dalla pendenza della parte lineare della regione elastica tracciando una regressione lineare di quella regione.
- Utilizzare un programma statistico per calcolare l'area sotto la curva (AUC) per determinare sia la resilienza che la tenacità, rispettivamente fino al punto di rendimento e al punto di guasto. Calcolare l'AUC con il metodo trapezoidale. Impostare la linea di base su zero e considerare solo i picchi al di sopra della linea di base, che sono almeno il 10 % della distanza dal valore minimo al valore massimo nell'asse Y.
NOTA: I moduli di resilienza e tenacità sono dati da σ × ε, dove σ è la sollecitazione (kPa) e ε è la deformazione (L/ΔL, mm/mm). Pertanto, la resilienza e la tenacità sono l'energia in kJ / m3 (kPa = kN·m-2 = kN·m·m-3 = kJ / m·m·m-3 = kJ / m3) assorbita dal tessuto prima della deformazione permanente e fino alla rottura, rispettivamente.
Access restricted. Please log in or start a trial to view this content.
Risultati
L'ECT raggiunge circa il 95% di compattazione rispetto al volume iniziale di idrogel di collagene cellulare entro le prime 24 ore. La compattazione e la contrazione tissutale in condizioni di controllo e in presenza di FCS si verificano poche ore dopo la colata e aumentano notevolmente fino al giorno 5 (Figura 5A). La deflessione del polo può aumentare ulteriormente durante i successivi 15 giorni (20 giorni è stato il tempo più lungo testato). L'entità della deflessione del polo dipende ...
Access restricted. Please log in or start a trial to view this content.
Discussione
Il protocollo presentato descrive la generazione di ECT da CF umano primario, che consente di studiare l'impatto meccanico di queste cellule sul loro ambiente di matrice extracellulare e viceversa.
I fibroblasti devono essere espansi per produrre cellule sufficienti per gli esperimenti ECT pianificati (0,75 x 106 cellule / ECT). Per la migliore riproducibilità, si consiglia di pre-coltivare fibroblasti congelati o derivati da tessuti in coltura monostrato 2D per una durata standard...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
GLS e SL hanno redatto il manoscritto. Tutti gli autori hanno contribuito allo sviluppo del protocollo e hanno curato il manoscritto. TM, MT e WHZ sono consulenti scientifici di myriamed GmbH. WHZ è il fondatore e azionista di myriamed GmbH.
Riconoscimenti
Questo lavoro è stato sostenuto dalla German Cardiac Society (DGK Research Fellowship for GLS) e dalla German Research Foundation (DFG attraverso il progetto IRTG 1816 per GLS e AD; DFG 417880571 e DFG TI 956/1-1 per MT; SFB 1002 TP C04 per MT e WHZ; SFB 1002 TP S01 per WHZ; e EXC 2067/1-390729940J per WHZ). WHZ è sostenuto dal Ministero federale tedesco per la scienza e l'istruzione (BMBF attraverso il progetto IndiHEART) e dalla Fondation Leducq (20CVD04). MT, WHZ e SL sono supportati dal Centro tedesco per la ricerca cardiovascolare (DZHK).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
Riferimenti
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095(2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), Maywood. 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force--Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519(2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Developmental Biology. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon