Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Fibroblasten-abgeleitetes Human Engineered Connective Tissue für Screening-Anwendungen
In diesem Artikel
Zusammenfassung
Hier wird ein Protokoll zur Erzeugung von künstlichem Bindegewebe für eine Parallelkultur von 48 Geweben in einer Multi-Well-Platte mit Doppelpolen vorgestellt, die für mechanistische Studien, Krankheitsmodellierung und Screening-Anwendungen geeignet ist. Das Protokoll ist kompatibel mit Fibroblasten aus verschiedenen Organen und Spezies und wird hier mit menschlichen primären kardialen Fibroblasten veranschaulicht.
Zusammenfassung
Fibroblasten sind phänotypisch hochdynamische Zellen, die als Reaktion auf biochemische und biomechanische Reize schnell in Myofibroblasten transdifferenzieren. Das derzeitige Verständnis der fibrotischen Prozesse, einschließlich der Herzfibrose, ist nach wie vor schlecht, was die Entwicklung neuer antifibrotischer Therapien behindert. Kontrollierbare und zuverlässige menschliche Modellsysteme sind entscheidend für ein besseres Verständnis der Fibrosepathologie. Dies ist ein hochgradig reproduzierbares und skalierbares Protokoll zur Erzeugung von künstlichem Bindegewebe (ECT) in einer 48-Well-Gießplatte, um Studien von Fibroblasten und die Pathophysiologie von fibrotischem Gewebe in einer dreidimensionalen (3D) Umgebung zu erleichtern. ECT werden um die Pole mit abstimmbarer Steifigkeit erzeugt, was Studien unter einer definierten biomechanischen Belastung ermöglicht. Unter den definierten Belastungsbedingungen können phänotypische Anpassungen, die durch Zell-Matrix-Wechselwirkungen gesteuert werden, untersucht werden. Parallele Tests sind im 48-Well-Format mit der Möglichkeit der Zeitverlaufsanalyse mehrerer Parameter wie Gewebeverdichtung und -kontraktion gegen die Belastung möglich. Aus diesen Parametern können biomechanische Eigenschaften wie Gewebesteifigkeit und Elastizität untersucht werden.
Einleitung
Ein großes Hindernis bei der Untersuchung fibrotischer Erkrankungen ist das Fehlen repräsentativer menschlicher 3D-Gewebemodelle, die Einen einblick in das Verhalten von Fibroblasten und ihren pathologischen Derivaten geben. Um fibrotische Prozesse zu untersuchen, sind Standard-2D-Kultursysteme suboptimal, da isolierte Fibroblasten schnell in α-Glattmuskel-Aktin (SMA)-exprimierende Myofibroblasten transdifferenzieren, wenn sie auf nicht konformen 2D-Substraten kultiviert werden1,2,3. Somit spiegeln Fibroblasten in der Standard-2D-Kultur keinen regulären "gesunden" Gewebephänotyp wider3,4,5,6. Kulturen auf biegsamen Substraten wurden eingeführt, um nicht-fibrotische (10 kPa) und fibrotische (35 kPa) Gewebeumgebungen zu simulieren7, aber diesen fehlt die dritte Dimension, die in Bezug auf die Pathophysiologie sehr wichtig ist. Tissue Engineering bietet die Möglichkeit, diese Einschränkung zu überwinden, indem es die Fibroblastenkultur in einem definierten und experimentell abstimmbaren extrazellulären Matrix (ECM)-Kontext ermöglicht, beispielsweise durch Veränderungen der Zellularität, der ECM-Zusammensetzung und der ECM-Konzentration, die alle die Gewebebiomechanik bestimmen können.
Verschiedene 3D-Modelle wurden mit Fibroblasten erzeugt. Schwimmende Scheiben und Mikrosphären gehörten zu den ersten und zeigen, dass Kollagen zeitabhängig umgebaut und verdichtet wird. Fibroblasten üben Zugkräfte auf Kollagenfibrillen aus, ein Prozess, der durch die Zugabe von profibrotischen Wirkstoffen wie transformierendem Wachstumsfaktor-beta 1 (TGF-β1) erleichtert werden kann.8,9,10,11,12,13,14,15,16. Frei schwebende Kulturen erlauben jedoch nicht die kontrollierte äußere Belastung und stellen daher kontinuierlich schrumpfende oder verdichtende Modelle dar. Sheet-like engineered tissues eröffneten die Möglichkeit, die homöostatische Regulation der biomechanischen Eigenschaften von Geweben zu untersuchen, nämlich durch uni-, bi-, multiaxiale oder zyklische Dehnungstests17,18,19,20. Diese Modelle wurden z.B. verwendet, um den Einfluss der Zellzahl auf die Gewebesteifigkeit zu demonstrieren, die positiv mit der Integrität des Zytoskeletts und der Kontraktilität des Actomyosin-Zytoskeletts korreliert.18,19. Es ist jedoch wichtig zu beachten, dass Kraft-zu-Dehnungs-Umwandlungen durch die ungleichmäßige Gewebeverformung um Klemmpunkte von Kraftaufnehmern und Ankerpunkten erschwert werden. Diese inhärente Einschränkung kann durch Hundeknochen- oder ringförmige Gewebe umgangen werden, was eine gewisse Gewebeverstärkung an Ankerpunkten bietet21,22,23. Ringförmige Gewebe können hergestellt werden, indem ein Zell-Kollagen-Hydrogel in ringförmige Formen verteilt wird. Wenn sich das Hydrogel verdichtet, bildet sich um den unkompressiblen inneren Stab der Form ein Gewebe, das Widerstand für eine weitere Gewebekontraktion bietet24,25,26,27. Nach anfänglicher und typischerweise maximaler Verdichtung können Gewebe auch auf verstellbare Abstandshalter übertragen werden, um die kreisförmige EKT bei einer definierten Gewebelänge weiter zurückzuhalten.3,24,25,26,27,28,29,30. Biophysikalische Eigenschaften können in horizontalen oder vertikalen Standard-Dehnungs-Vorrichtungen mit geeigneten Wägezellen unter unidirektionaler oder dynamischer Dehnung bewertet werden3. Da die Gewebe eine weitgehend gleichmäßige kreisförmige Struktur aufweisen und an Stangen/Haken (Verankerungspunkte und/oder Kraftaufnehmer) gehalten werden können, obwohl diese immer noch Kompressionsbereiche um die Ladestäbe herum einschließen können, ermöglicht dieses Format eine gleichmäßigere Dehnungsvariation im Vergleich zur Klemmung.3. Darüber hinaus lösen verankerte Gewebe eine bipolare Zellform aus, und Zellen passen sich den Gewebekräften an, indem sie entlang von Kraftlinien verlängert werden, um die anisotrope Traktion zu fördern.31,32,33,34,35,36. Wir haben zuvor ringförmige EKT von ratten- und humanen Herzfibroblasten (CF) um einen einzigen steifen Pol in funktionellen Stressstammexperimenten angewendet und Studien zum Gewinn und Verlust von Funktionen unter Verwendung viral transduzierter Fibroblasten durchgeführt24,25,26 und pharmakologische Studien37. Darüber hinaus konnten wir Geschlechtsunterschiede bei CF-vermittelter Fibrose im ECT-Modell identifizieren27.
Das folgende Protokoll für die Erzeugung menschlicher EKT, veranschaulicht durch primäre menschliche CF, die als kryokonservierte CF von kommerziellen Anbietern gewonnen wurde (siehe Materialtabelle), kombiniert die Vorteile ringförmiger Gewebe mit einer einfachen und schnellen Möglichkeit, makroskopisches Gewebe für eine 48-Well-Plattform herzustellen, die für parallele High-Content-Tests entwickelt wurde.
Wichtig ist, dass das ECT-Modell nicht auf einen bestimmten Fibroblastentyp beschränkt ist, mit der dokumentierten Verwendung bei der Untersuchung anderer Fibroblasten, z. B. Hautfibroblasten38,39. Darüber hinaus funktionieren Fibroblasten aus Patientenbiopsien gleich gut, und die Wahl der Fibroblasten hängt letztendlich von der zu behandelnden wissenschaftlichen Fragestellung ab.
Die Plattform, die für die in diesem Protokoll beschriebene ECT-Generierung verwendet wird, ist eine kommerziell erhältliche 48-Well-3D-Zell-/Gewebekulturplatte (Abbildung 1A). Die Methoden zur Vorbereitung, Kultivierung und Überwachung der ECT-Bildung und -Funktion unter definierter Geometrie und mechanischer Belastung mit Hilfe der 48-Well-Platte werden beschrieben. Die geformten ECT werden von integrierten flexiblen Polen gehalten und die mechanische Belastung kann entsprechend dem endgültigen Zweck fein abgestimmt werden, indem Stangen mit unterschiedlicher Härte (Shore A-Wert 36-89) verwendet werden, die ihre Biegesteifigkeiten beeinflussen. Pfähle mit Ufer Ein Wert von 46 wird empfohlen. Das Protokoll ist außerdem kompatibel mit einer zuvor beschriebenen benutzerdefinierten kreisförmigen Form, bei der die EKT um eine einzige steife Stange gehalten wird37. Die Abmessungen dieser Form sind in Abbildung 1B dargestellt.
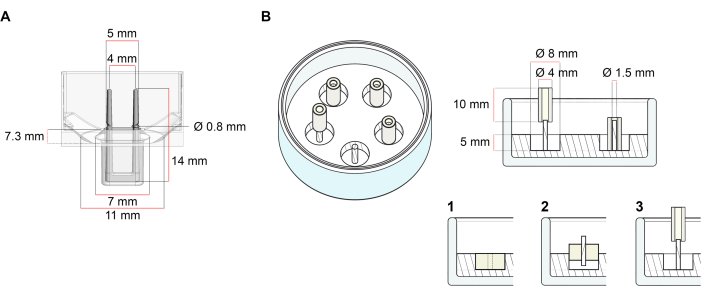
Abbildung 1: Schematische Darstellung von Gussformen. (A) Technische Zeichnung und Abmessungen einer Gießform mit zwei flexiblen Stangen. Die Form besteht aus einem inneren Umfang, der durch eine kurze Wand begrenzt wird, die doppelte Haltestangen am Hauptkörper der Form hält. Die flexiblen Pole haben einen freien horizontalen Abstand zueinander und sind an der Basis miteinander verbunden. Die Form ermöglicht 180 μL Gießvolumen. Die Vertiefung jeder Form ermöglicht eine Volumenkapazität von mindestens 600 μL Nährmedien. Verschiedene Materialzusammensetzungen können verwendet werden, um Pole mit spezifischen Steifigkeiten herzustellen (z. B. TM5MED-TM9MED). (B) Technische Zeichnung und Abmessungen einer ringförmigen Form mit einer einzigen steifen Stange. Dies ist eine alternative Form mit unterschiedlicher Geometrie und mechanischer Umgebung, die mit dem ECT-Gießprotokoll37 verwendet werden kann. Das ringförmige Formmontageverfahren wurde aus veröffentlichten größeren Formaten angepasst28,41. Kurz gesagt, das Verfahren umfasst (1) das Bedrucken von Polytetrafluorethylen (PTFE) -Formabstandhaltern (8 mm Durchmesser) in Polydimethylsiloxan (PDMS, Silikon), das in Glasschalen (Durchmesser 60 mm) gegossen wird, und (2) die konzentrische Befestigung eines PDMS-Polhalters (1,5 mm Durchmesser) innerhalb des geformten Hohlraums, der dazu dient, (3) eine abnehmbare Stange (Silikonschlauch mit 4 mm Durchmesser) zu halten. Der resultierende Hohlraum ermöglicht 180 μL Gießvolumen. Jede Glasschale kann mehrere bedruckte Formen aufnehmen (exemplarisch dargestellt mit 5 Formen) und hat die Kapazität für bis zu 5 ml Kulturmedium. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Access restricted. Please log in or start a trial to view this content.
Protokoll
Alle Schritte müssen in einer Biosicherheitshaube der Klasse II durchgeführt werden, die in Laboratorien der Sicherheitsstufe 1 installiert ist. Abhängig von den lokalen Vorschriften und der Art der durchzuführenden Manipulationen, wie z. B. der viral vermittelte Gentransfer, muss der Containment-Level auf die Biosicherheitsstufe 2 oder 3 erhöht werden. Alle Kulturen werden bei 37 °C in einem Zellkulturinkubator mit einer befeuchteten Atmosphäre von 5 % CO2 in der Luft gehalten. Beachten Sie, dass die Volumina (Schritte 1 und 2) für einen T75-Zellkulturkolben vorgesehen sind. Passen Sie die Volumina an verschiedene Kulturformate gemäß den Standard-Zellkulturempfehlungen an.
1. Auftauen und Vorplattieren des primären kardialen Fibroblasten (CF) für Monolayer-Kultur (5-12 Tage)
HINWEIS: Alternativ können HFF-1-Zellen nach dem vom Lieferanten empfohlenen Standard-Subkulturprotokoll verwendet werden.
- Bereiten Sie das Fibroblasten-Wachstumsmedium (FGM) gemäß den Anweisungen des Herstellers vor. Optional fügen Sie Antibiotika wie 100 U / ml Penicillin und 100 mg / ml Streptomycin hinzu. Ermöglichen Sie das vollständige Mischen aller Komponenten vor dem Gebrauch. Bei 4 °C bis zu 14 Tage lagern.
- FGM auf 20-25 °C erwärmen.
- Tauen Sie die kryokonservierte CF (idealerweise mit 1 x 106 bis 2 x 106/ml Zellen pro Kryovial) in einem Wasserbad bei 37 °C für ca. 2 min auf, bis nur noch eine geringe Menge Eis in der Durchstechflasche verbleibt.
- Mit einer 2 ml serologischen Pipette wird die Zellsuspension tropfenweise in ein geeignetes steriles Zentrifugenröhrchen mit 10 ml FGM überführt. Für eine optimale Zellentnahme spülen Sie das Kryovial mit 1 ml FGM aus und übertragen Sie es in das Zentrifugenröhrchen. Da die Zellen in diesem Stadium sehr empfindlich sind, resuspend mit einer serologischen Pipette mit einer Bohrungsspitze, um Zellschäden durch Scherstress zu minimieren.
HINWEIS: Wenn das Kryokonservierungsmedium einen hohen Anteil an DMSO enthält, stellen Sie sicher, dass der DMSO-Gehalt nach Zellwiederholung in FGM weniger als 1 % beträgt. Alternativ werden die resuspendierten Zellen bei 300 x g für 5 min bei 20-25 °C für den Medienaustausch zentrifugiert. Dann den Überstand vorsichtig absaugen, das Röhrchen schwenken, um die pelletierten Zellen zu entfernen, und sie in der gewünschten Menge FGM für die Aussaat resuspendieren. - Säen Sie 0,5 x 106 Zellen in 12 ml FGM in einen T75-Zellkulturkolben. Wenn andere Laborgeräte verwendet werden, passen Sie die Zellzahl an, um eine Seeding-Dichte von 6,7 x 103/cm2 aufrechtzuerhalten.
- Ersetzen Sie FGM jeden zweiten Tag für 5 Tage oder bis die Zellen 80 % Konfluenz erreichen.
HINWEIS: Die Zellausbeute nach der Expansion hängt hauptsächlich von der Zellgröße und der Proliferationsrate ab, die sich zwischen den Zellspendern unterscheiden kann. Typischerweise ermöglicht dieses Standardkulturverfahren das Abrufen von 4 x 106 bis 5 x 106 CF aus einem T75-Zellkulturkolben nach 5 Tagen Kultur.
2. Enzymatische Dispersion der humanen Mukoviszidose (10-20 min)
HINWEIS: Dieser Schritt zielt darauf ab, eine Einzelzellsuspension der menschlichen CF sowohl für subkulturierende Monolayer-Zellen als auch für die Herstellung von ECT zu etablieren. Dieses Protokoll wurde für menschliche CF-Monolayer-Kulturen in den Abschnitten 3-4 optimiert. Für eine optimale Standardisierung wird empfohlen, CF in Monolayer mindestens einmal vor der ECT-Vorbereitung zu subkulturieren. Dieses Protokoll muss für Fibroblasten optimiert werden, die von verschiedenen Spendern und Anbietern stammen. Alternative Ablösungsprotokolle können darin bestehen, rekombinante Serinprotease-basierte Dissoziationsreagenziationsreagenzien durch z. B. solche zu ersetzen, die proteolytische und kollagennolytische Enzyme enthalten.
- Warmes FGM, PBS (Ca2+/Mg2+-frei) und Zelldissoziationsreagenz auf 20-25 °C.
- Aspirieren Sie das Medium aus den kultivierten Zellen.
- Zellen mit 6 ml PBS und Aspirat waschen.
- 6 ml des Zelldissoziationsreagenzes zu den Zellen geben und 3 min bei 20-25 °C inkubieren, bis sich die Zellen sichtbar zu lösen beginnen.
HINWEIS: Je nach CF-Quelle kann dies einige Minuten länger dauern. Alternativ, wenn sich die Zellen bei Raumtemperatur nicht lösen, bei 37 °C inkubieren, um die Aktivität der Enzyme zu verbessern. Um eine optimale Zelllebensfähigkeit zu gewährleisten, überwachen Sie die Zellablösung unter dem Mikroskop. - Neutralisieren Sie die enzymatische Aktivität, indem Sie 6-12 ml FGM zu den gelösten Zellen im Zelldissoziationsreagenz hinzufügen. Pipettieren Sie vorsichtig 4-8 Mal mit einer 10 ml serologischen Pipette, um eine Einzelzellsuspension zu gewährleisten, und übertragen Sie die Zellen in ein frisches 50 ml Sammelröhrchen. Überprüfen Sie die Ausbeute mit Hilfe eines Mikroskops und eines Hämozytometers oder eines automatisierten Zellzählers gemäß den Anweisungen des Herstellers.
- Zentrifugieren Sie die Zellsuspension bei 300 x g für 5 min bei 20-25 °C.
HINWEIS: Um eine Ausbeute an Zellen zu erreichen, die für die Erzeugung der gewünschten Menge an EKT ausreicht, können Zellen in einer bis zu 1:6-Verdünnung zur weiteren Expansion subkulturiert werden. Lassen Sie die Zellen wachsen, bis 80% Konfluenz erreicht ist (ca. 5-6 Tage), wobei sich das Medium jeden zweiten Tag ändert. Wiederholen Sie dann die enzymatische Dispersion und fahren Sie mit Schritt 2.7 fort. um mit der ECT-Vorbereitung fortzufahren. - Aspirieren Sie den Überstand und streichen Sie das Rohr, um das Pellet zu entfernen. Resuspendieren Sie die Zellen in FGM bei 20-25 °C, um eine Zellsuspension von ≥ 15 x 106/ml zu erhalten (ca. 40 % mehr Zellen als für Schritt 3.3 erforderlich). Dies erklärt den Zellverlust aufgrund von Anstrengung im folgenden Schritt.
- Die Zellsuspension durch ein 40 μm Mesh-Zellsieb abseihen.
VORSICHT: Zellagglomerate sind schädlich für die optimale Bildung von ECT. Bei Verwendung der enzymatischen Dispersion des menschlichen CF-Protokolls für den direkten Guss von ECT stellt die Belastung der Zellsuspension sicher, dass keine großen Zellklumpen vorhanden sind, die die homogene Gewebebildung beeinträchtigen. Heterogenitäten beeinträchtigen zuverlässige Spannungs-Dehnungs-Analysen. - Neuauszählung der Zellzahl und Beurteilung der Zelllebensfähigkeit, um eine zuverlässige Zellzahl in einer Suspension mit ≥80 % Lebensfähigkeit für die ECT-Vorbereitung zu gewährleisten.
- Verwenden Sie einen automatisierten Zellzähler, um die Anzahl und Lebensfähigkeit der Zelle durch Ausschluss elektrischen Stroms zu bewerten.
- Alternativ können Sie den Trypanblau(karzinogen, Gefahrenkategorie 2 - Vorsichtsmaßnahmen ergreifen) Farbstoffausschlusstest mit Hilfe eines Mikroskops und eines Hämozytometers zur direkten Identifizierung und Zählung von lebenden (intakte Zellmembranen, die den Farbstoff ausschließen) und toten (kompromittierte Zellmembranen, die die Bindung des Farbstoffs an intrazelluläre Proteine ermöglichen) Zellen verwenden.
- Reservieren Sie das Auffangröhrchen mit Zellsuspension bei 20-25 °C und fahren Sie sofort mit Schritt 3 fort.
3. ECT-Vorbereitung (1 h)
HINWEIS: Ein schematischer Überblick über die ECT-Generierung ist in Abbildung 2 beschrieben.
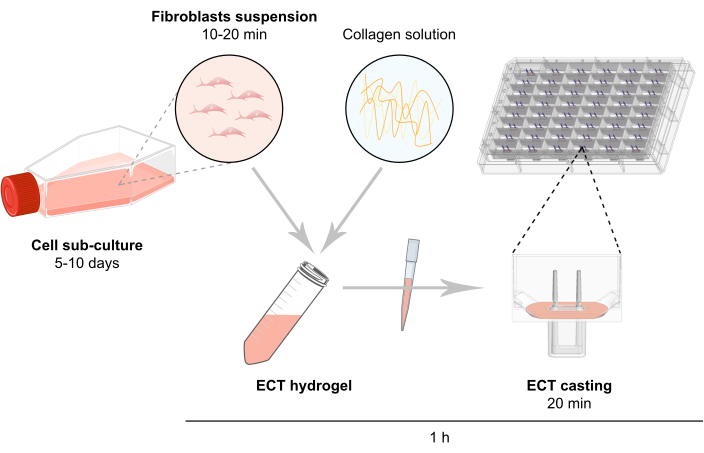
Abbildung 2: Schematische Übersicht über die ECT-Generierung. Fibroblasten werden in 2D-Kultur expandiert, bevor sie in der ECT-Generierung verwendet werden. Nach 5-10 Tagen werden die Zellen enzymatisch dispergiert und die Zellsuspension in einer gepufferten Mischung rekonstituiert, die Rinderkollagen Typ 1 enthält. Die Zell-Kollagen-Hydrogel-Mischung wird in einzelne Vertiefungen in einer 48-Well-Platte für 3D-Gewebekulturen pipettiert, die als Gussformen mit zwei flexiblen Polen konzipiert sind, um eine ECT-Suspension bei einer definierten Länge und Last zu ermöglichen. ECT werden in der Regel für 1 bis 20 Tage vor den Messungen kultiviert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Bereiten Sie eine 10x DMEM-Stammlösung vor, indem Sie DMEM-Pulver in ddH2O (134 mg/ml für die in der Materialtabelle angegebene Formulierung) unter einer konstanten Rotation bei 37 °C für 1 h auflösen. Sterilisieren durch Filtration. Der Bestand ist bis zu 14 Tage bei 4 °C oder -20 °C für bis zu 12 Monate stabil.
- 2x DMEM frisch zubereiten, indem sie eine 10x DMEM-Stammlösung verdünnen und 20 % (v/v) FCS in steriles ddH2O geben. Verwenden Sie gegebenenfalls Antibiotika wie 200 U/ml Penicillin und 200 mg/ml Streptomycin. Siehe Tabelle 1 für Pipettiervolumina. Der Bestand ist bis zu 14 Tage bei 4 °C stabil.
HINWEIS: Führen Sie die Schritte 3.1 aus. und 3.2. vor Beginn der enzymatischen Dispersion von Zellen (Schritt 2.) zur Herstellung von ECT.
| Reagenz | Endgültige Konzentration | Volumen (ml) |
| 10× DMEM | n/a | 2 |
| FCS | 20 % (v/v) | 2 |
| Penizillin | 200 U/ml | 0.2 |
| Streptomycin | 200 mg/ml | 0.2 |
| ddH2O | n/a | 5.6 |
| Gesamt | n/a | 10 |
Tabelle 1: Zusammensetzung von 2x DMEM.
ACHTUNG: Alle Komponenten für das Zell-Kollagen-Hydrogel-Gemisch und die Zentrifugenröhrchen müssen vor der Anwendung auf Eis aufbewahrt werden. Dies wird dazu beitragen, die Kollagen-Selbstorganisation zu verhindern, bevor die Zell-Kollagen-Hydrogel-Mischung in den Gießformen verteilt wird.
- Anhand von Tabelle 2 wird die Zellsuspension auf eine Dichte von 8,88 x 106 Zellen/ml eingestellt, indem FGM bei 20-25 °C zur Zellsuspension aus Schritt 2.10 gegeben wird. Bewegen Sie dann das Sammelrohr mit Zellsuspension auf Eis.
- Um die ECT-Hydrogelmischung herzustellen, kühlen Sie ein 50-ml-Zentrifugenröhrchen auf Eis vor und fügen Sie die verschiedenen komponenten hinzu, die in Tabelle 2 in der folgenden Reihenfolge aufgeführt sind, um die Bildung von Luftblasen zu vermeiden.
HINWEIS: Die maximale Anzahl der vorzubereitenden ECT hängt von der in Schritt 2.9 festgelegten Gesamtzellzahl ab. Verwenden Sie 0,3 mg Kollagen pro ECT, erhalten aus einer Stammlösung mit 6-7 mg / ml. Die Konzentration der Kollagenstocklösung bestimmt das Volumen, das benötigt wird, um einen optimalen ECT-Kollagengehalt zu erhalten. Die Volumina der anderen ECT-Hydrogelkomponenten müssen entsprechend angepasst werden. Siehe Tabelle 2 für angepasste Volumina gemäß einer Kollagenstocklösung von 6,49 mg/ml. Die in Tabelle 2 beschriebenen Bände werden in diesem Protokoll als beispielhafte Richtlinie verwendet.- Das säurelösliche Kollagen-Typ-1-Hydrogel wird mit einer serologischen Pipette mit breiter Bohrungsspitze pipettiert.
- Stellen Sie den Salzgehalt der Kollagenlösung ein, indem Sie das 2x DMEM hinzufügen, während Sie das Röhrchen vorsichtig mischen.
- Neutralisieren Sie den pH-Wert durch Zugabe von 0,2 M NaOH während des vorsichtigen Mischens durch Schwenken des Röhrchens. Der Phenolrot-Indikator wechselt von gelb zu rot.
HINWEIS: Das NaOH-Volumen muss für jede einzelne Kollagencharge titriert werden, um eine optimale pH-Neutralisation zu erreichen. Die Neutralisation hängt von Faktoren wie Puffertyp und -zubereitung sowie der absoluten Kollagenkonzentration ab und beeinflusst die Kollagenmatrixbildung und die Zelllebensfähigkeit23,40. Sobald der Ionengehalt durch die Zugabe von DMEM erhöht und der pH-Wert neutralisiert ist, folgt die Selbstorganisation von Kollagen und darf nicht gestört werden. Führen Sie daher das Folgende schnell und ohne Pausen durch. - Fügen Sie die Zellsuspension (ab Schritt 3.3) tropfenweise hinzu, während Sie sie vorsichtig durch Schwenken des Röhrchens mischen.
| ECT-Nummer: | 1 | 6 | 24 | 48 | |
| inkl. 10 % Überschuss | |||||
| Zell-Kollagen-Hydrogel-Komponenten: | (μL) | (μL) | (μL) | (μL) | |
| Kollagen-Brühe (6,49 mg/ml) | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 2× DMEM | 46.2 | 305.1 | 1220.2 | 2440.4 | |
| 0,2 Mio. NaOH | 3.1 | 20.5 | 81.8 | 163.7 | |
| Zellmix in FGM (8,88×106 Zellen/ml) | 84.5 | 557.4 | 2229.7 | 4459.5 | |
| Gesamtvolumen (μL) | 180.0 | 1188.0 | 4752.0 | 9504.0 | |
| Dies ist eine beispielhafte Tabelle zur Herstellung eines Gießvolumens von 180 μL pro ECT, das insgesamt 750.000 Zellen und 0,3 mg Kollagen pro ECT enthält. | |||||
Tabelle 2: Herstellung von ECT-Hydrogel (einschließlich eines Überschusses von 10 % unter Berücksichtigung von Pipettierfehlern).
- Mischen Sie die gesamte Suspension, indem Sie nur einmal vorsichtig auf und ab pipettieren, indem Sie eine serologische Pipette mit einer breiten Bohrungsspitze verwenden, um Blasenbildung zu vermeiden und Scherspannungen zu minimieren. Stellen Sie eine vollständige Mischung sicher, indem Sie das Röhrchen 10 Mal vorsichtig schwenken und das 50-ml-Zentrifugenröhrchen, das die ECT-Hydrogelmischung enthält, während des gesamten Gießprozesses auf Eis aufbewahren.
- Benetzen Sie eine 1-ml-Pipettenspitze mit ECT-Hydrogel-Mischung vor und verteilen Sie 180 μL davon gleichmäßig in jede Form der 48-Well-Gießplatte, um übermäßige Scherkräfte zu vermeiden, die die Integrität der Kollagenmatrixanordnung beeinträchtigen können, und sicherzustellen, dass die gesamte Platte in 15-20 minuten fertig ist.
HINWEIS: Das empfohlene Gießvolumen beträgt 180 μL, kann aber auf 200 μL38 erweitert werden. Daher können, wenn gewünscht, die Volumina in Tabelle 2 auf 200 μL in einer Weise angepasst werden, die die gleichen Konzentrationen und das gleiche Verhältnis zwischen Zellen und Kollagen beibehält.- Stellen Sie sicher, dass innerhalb der Form eine vollständige Schleife gebildet wird (Abbildung 3A). Wird das ECT-Hydrogel-Gemisch diskontinuierlich aufgetragen, wird eine vollständige ECT-Ringbildung verhindert (Abbildung 3B).
- Vermeiden Sie das Pipettieren in den inneren Brunnen (Abbildung 3C) und die Bildung von Blasen während des Pipettierens (Abbildung 3D), um eine homogene und funktionelle Gewebebildung zu gewährleisten.
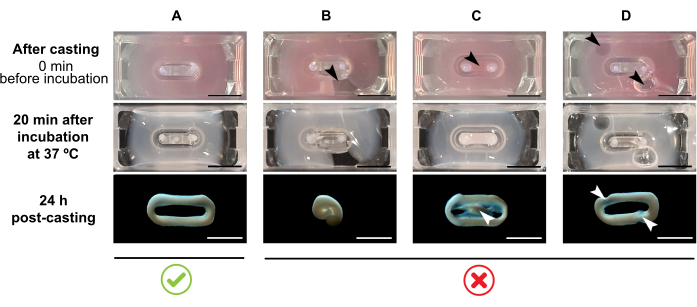
Abbildung 3: Gießen, Hydrogelbildung und ECT-Kondensation im Multi-Well-Format. Die oberen Bedienfelder veranschaulichen das Erscheinungsbild von ECT direkt nach dem Casting. Die mittleren Panels veranschaulichen das Auftreten von ECT nach 20-minütiger Inkubation bei 37 °C. Die unteren Paneele veranschaulichen den Verdichtungszustand von ECT 24 h nach der Vorbereitung, entfernt von den Polen. (A) Richtige ECT-Formation zwischen zwei Polen während der ersten 24 h. (B-D) Beispiele für Pipettierfehler, die eine korrekte ECT-Bildung verhindern. Die weißen und schwarzen Pfeile weisen auf strukturelle Defekte von ECT aufgrund von unsachgemäßem Guss hin. Maßstabsleiste: 5 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Legen Sie die 48-Well-Gießplatte vorsichtig in den Zellkultur-Inkubator und lassen Sie die ECT-Hydrogelmischung 15-30 min rekonstituieren. Nach der Inkubation erscheint es gelartig und undurchsichtig (Abbildung 3, mittleres Panel).
- Fügen Sie 600 μL von 37 °C warmem FGM pro Vertiefung hinzu, ohne das Kulturmedium direkt auf die sich bildende EKT zu pipettieren, da dies zu Gewebezerstörungen führen kann. Fügen Sie das Kulturmedium vorsichtig entlang der Brunnenwand hinzu, da sich der ECT an dieser Stelle auch nicht vom Boden lösen darf (Abbildung 4).
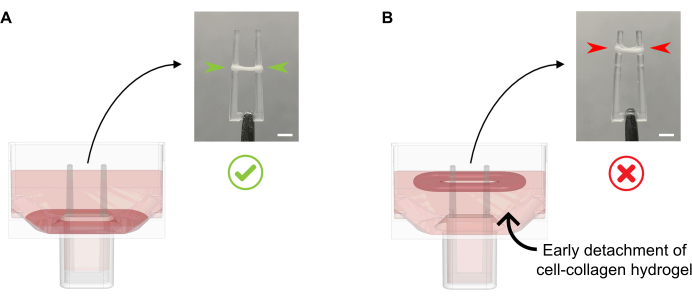
Abbildung 4: Richtige und unsachgemäße Zugabe des Kulturmediums zum frisch gegossenen ECT. (A) Beim Hinzufügen des Kulturmediums nach anfänglicher EKT-Erstarrung (20 min nach dem Gießen) muss die kondensierende ECT ungestört am Boden des Bohrlochs belassen werden. Während der nächsten 24 Stunden wird die zellgetriebene Matrixverdichtung den ECT die Rampe hinauf gleiten lassen. Die endgültige ECT-Position wird durch konkave Hohlräume in einer definierten Polhöhe gesteuert; Dadurch wird sichergestellt, dass sich alle ECT an der gleichen Position ansiedeln, um einen Vergleich der Polbiegeaktivität in paralleler ECT-Kultur zu ermöglichen. (B) Bildung von ECT löst sich von unten, während das Kulturmedium zu schnell hinzugefügt wird. Floating ECT verdichtet sich auf der mittleren Ebene der oberen Kultur. Polkontraktionskräfte sind nicht direkt vergleichbar, wenn sich die EKT an verschiedenen Positionen ansiedelt. Maßstabsleiste: 2 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
- Inkubieren Sie für 24 h.
- Ersetzen Sie das Medium danach jeden Tag mit 500 μL FGM bis zur Analyse.
HINWEIS: Nach der Anfangsphase der zellunabhängigen Gelierung beginnt die humane CF, die ECT-Hydrogelmischung weiter zu verdichten. Innerhalb von 24 h sollte die EKT deutlich verdichtet und auf das Niveau angehoben erscheinen, auf dem sie auf den flexiblen Polen gehalten wird (Abbildung 3 und Abbildung 4A).
4. Beurteilung der EKT-Verdichtung durch Messung der Querschnittsfläche (CSA) (5 min pro ECT).
HINWEIS: Die Gewebeverdichtung beginnt unmittelbar nach dem Kollagenaufbau und ist besonders in den ersten Stunden von Bedeutung. Die Verdichtung beschreibt Veränderungen, die hauptsächlich durch zellgetriebene Kompression der Matrix senkrecht zur langen Achse des Gewebes ausgelöst werden. Dieser Parameter wird durch die Bestimmung der Querschnittsfläche (CSA) des ECT bewertet.
- Verwenden Sie zu den gewünschten Zeitpunkten ein Stereomikroskop, um makroskopische Bilder der Ober- und Seitenansicht des ECT aufzunehmen (Abbildung 5C).
HINWEIS: ECT kann in den Kultivierungsbohrungen der 48-Well-Gießplatte abgebildet werden. Alternativ können Sie die EKT zur Bildgebung auf eine durchsichtige bodenige Multi-Well-Platte übertragen. Es wird empfohlen, die EKT auf den Polen abzubilden, da deren Entfernung zum Verlust der Vorspannung führt und sich das Gewebe daher innerhalb kurzer Zeit aufgrund einer Spannungsfreisetzung weiter zusammenziehen kann, was die ordnungsgemäße Bildgebung für Dimensionsanalysen behindern kann. - Verwenden Sie ein Bildverarbeitungsprogramm, um eine Zeilenscananalyse durchzuführen. Legen Sie eine Skala fest, und verwenden Sie das Werkzeug Gerade Linie, um die ECT-Durchmesser an mindestens 6 Positionen pro Arm in jeder Abbildungsebene zu verfolgen und zu messen (Abbildung 5B,C).
- Berechnen Sie den mittleren Durchmesser aus oberen und seitlichen Ansichtsebenen und berechnen Sie CSA gemäß einer elliptischen Flächengleichung:


Abbildung 5: Überwachung der ECT-Verdichtung im Zeitverlauf durch Querschnittsflächenanalyse (CSA). ECT wurden mit menschlicher CF und Kollagen Typ I erzeugt und um zwei flexible Pole für 5 Tage kultiviert. (A) Repräsentative Bilder der Kontroll-EKT, die über einen Zeitraum von 5 Tagen in flexiblen Formen platziert wurden, werden präsentiert. Maßstabsleiste = 5 mm. Solche Hellfeldbilder können auch verwendet werden, um die Polablenkungsvariation zur Abschätzung der Gewebekontraktion zu bestimmen. (B) Schematische Darstellung der Querschnittsfläche eines ECT (Durchmesser der Draufsicht in grün und Durchmesser der Seitenansicht in rosa). (C) Makroskopische Bilder von Ober- und Seitenansichten einer EKT, die mit einem Stereomikroskop aufgenommen wurden, und entsprechendes Beispiel für eine Zeilenanalyse der Durchmesser der Gewebe mit einem Bildverarbeitungsprogramm. Maßstabsleiste = 2 mm. Gemittelte Durchmesser werden aus dem Mittelwert aller Linienlängen berechnet, die auf jedem Ansichtsplan gemessen werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Überwachung der ECT-Kontraktion durch Polauslenkungsanalyse (15 min pro 48-Well-Gießplatte).
HINWEIS: Die ECT-Kultur wird in der Regel für 5 Tage durchgeführt, kann aber mindestens bis zu 20 Tage verlängert werden. Die Polauslenkung tritt aufgrund der Gewebekontraktion auf, die durch die Zellkontraktionskraft in Spannungsrichtung entlang der langen Achse des Gewebes angetrieben wird. Die Beurteilung der ECT-Kontraktion kann durch Bildgebung an jedem Tag während der Kultur durchgeführt werden.
- Stellen Sie die 48-Well-Gießplatte unter einem Aufnahmegerät mit einer integrierten Flächenkamera in festem Abstand vor, die mit einem hochauflösenden (≥ 5 Megapixel) monochromen Bildsensor ausgestattet ist.
- Verwenden Sie eine nahezu UV-nahe (~390 nm) Lichtquelle, um den Kontrast zu maximieren und so eine automatisierte Erkennung der Polspitzen zu ermöglichen, da sie einen Fluoreszenzfarbstoff enthalten (Abbildung 6A,C). Falls verfügbar, werden telezentrische Objektive für die Bildgebung empfohlen, da sie Bildverzerrungen minimieren.
HINWEIS: Alternativ können makroskopische Hellfeldbilder aus einzelnen Vertiefungen oder der gesamten Platte zusammen mit einem Maßstabsbalken für die Analyse verwendet werden (Abbildung 5A).
- Verwenden Sie eine nahezu UV-nahe (~390 nm) Lichtquelle, um den Kontrast zu maximieren und so eine automatisierte Erkennung der Polspitzen zu ermöglichen, da sie einen Fluoreszenzfarbstoff enthalten (Abbildung 6A,C). Falls verfügbar, werden telezentrische Objektive für die Bildgebung empfohlen, da sie Bildverzerrungen minimieren.
- Messen Sie den Abstand zwischen den Polen von den täglichen Aufzeichnungen (Abbildung 6C, D) mit einem Bildverarbeitungsprogramm oder einer automatisierten Analyse, indem Sie aufgezeichnete Bilder auf einer Software ausführen, die in der Lage ist, kontrastreiche helle Pixel auf einem dunklen Hintergrund zu erkennen.
- Berechnen Sie die Polauslenkung durch die Variation des Polabstands im Vergleich zum Anfangsabstand am Tag Null.
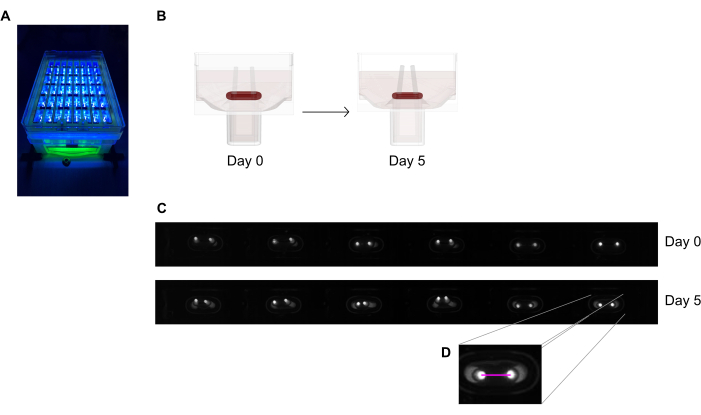
Abbildung 6: Schematischer Überblick über die Beurteilung der Gewebekontraktion nach Polablenkung. (A) Beispielhafte hochauflösende Erfassung fluoreszierender Pole in der 48-Well-Gießplatte unter UV-naher Lichtanregung. Diese Methode wird gegenüber Hellfeldbildern für eine präzisere automatisierte Verfolgung der Polspitze bevorzugt. (B) Die schematischen Zeichnungen zeigen, wie ECT-Verdichtung und -Kontraktion zu Polbiegung führt. (C) Eine exemplarische Reihe der gleichen Plattenaufzeichnungen am Tag 0 und Tag 5 nach dem Gießen. Hrsg. Die Nahaufnahme zeigt, wie man mit einem Bildverarbeitungsprogramm den Abstand (rosa Linie) zwischen den Polen misst. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
HINWEIS: Bedenken Sie, dass die Polablenkung, die durch ein helles Spitzenbild gemessen wird, aufgrund des Unterschieds in den Bildgebungsebenen nur eine Schätzung der Gewebekontraktion ist. Beachten Sie auch, dass die Anwendung von profibrotischen Substanzen wie TGF-β1 während der Gewebekultur die ECT-Verdichtung und -Kontraktion verstärkt und letztendlich zu einer frühen Gewebezerstörung führen kann.
6. Beurteilung der Steifigkeit und anderer biomechanischer Eigenschaften der ECT durch destruktive Zugmessung und Spannungs-Dehnungs-Analyse (20 min pro ECT)
HINWEIS: Eine optimale Spannungs-Dehnungs-Kurve kann drei Bereiche anzeigen: Zehenbereich, elastischer Bereich und Kunststoffbereich. Ein Beispiel für eine ECT-Spannungs-Dehnungskurve ist in Abbildung 7 dargestellt. Die Analyse einer Spannungs-Dehnungs-Kurve ermöglicht die Extraktion wichtiger biomechanischer Parameter des Gewebes wie z.B. Steifigkeit, maximale Festigkeit, Elastizität, Plastizität, Dehnbarkeit, Elastizität und Zähigkeit.
- Ernten Sie ECT, indem Sie zuerst die Trage, einschließlich ECT, mit einer Pinzette aus ihrem Brunnen ziehen. Die Trage kann dann auf ihrer Basis gehalten werden, und die ECT rutscht mit einem feinen Haken oder einer Pipettenspitze über die Keilrahmenspitzen.
- Übertragen Sie den ECT auf zwei Haken, die am stationären Arm und am Wandlerarm eines DMA-Rheometers (Extensional Dynamic Mechanical Analysis) befestigt sind, das mit einem 37 °C temperierten Organbad (sonderanfertigung) ausgestattet ist, das mit PBS gefüllt ist (Abbildung 7A).
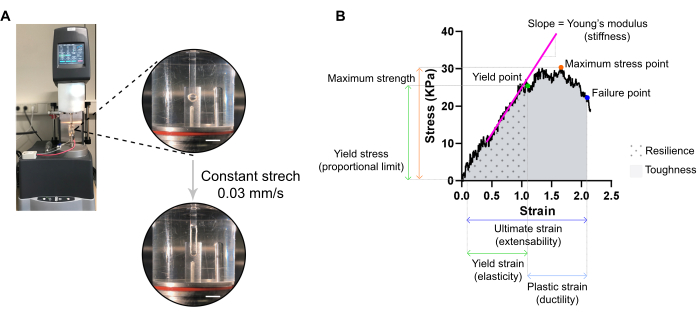
Abbildung 7: ECT destruktive Zugmessanalyse. (A) Rheologische destruktive Zugmessung an einem DMA-Rheometer (Extensional Dynamic Mechanical Analysis). Obere Hochleistungsansicht: EKT nach Montage an L0 in einer Umgebungskammer und verbunden mit einem oberen und unteren Pol für Spannungs-Dehnungs-Analysen. Bottom High Power View: ECT mit einer konstanten Rate von 0,03 mm/s bis zum Versagenspunkt bei ultimativer Dehnung belastet. Maßstabsbalken = 5 mm. (B) Spannungs-Dehnungs-Diagramm eines EKT mit den wichtigsten gemessenen Parametern. Die Obergrenze des elastischen Bereichs entspricht der Streckgrenze und der Kunststoffbereich besteht zwischen der Streckgrenze und der Versagensstelle (Duktilität). Die Steigung der linearen Phase der elastischen Region entspricht dem Elastizitätsmodul, der die Gewebesteifigkeit widerspiegelt. Die maximale Festigkeit entspricht der maximalen Zugspannung, der ein Gewebe standhalten kann. Durch die Fasermikrofrakturierung nimmt der Stress ab, bis das Gewebe die Versagensstelle erreicht. Dies geschieht bei der Enddehnung (Dehnbarkeit), wo ein plötzlicher Stressabfall aufgrund der Ruptur des Gewebes beobachtet wird. Die Belastbarkeit entspricht der Energie (kJ/m3), die das Gewebe vor der dauerhaften Verformung (bis zur Streckgrenze) aufnimmt, und wird durch die Fläche unter der Kurve (AUC) bis zur Streckgrenze angegeben. Die Zähigkeit entspricht der Gesamtenergie (kJ/m3), die das Gewebe bis zum Bruch aufnehmen kann und wird von der AUC bis zur Endbelastung abgegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Stellen Sie das Rheometer so ein, dass eine einachsige Spannung mit einer konstanten linearen Rate von etwa 1 % des Anfangsabstands zwischen den Haken pro Sekunde angelegt wird. Eine konstante Dehnungsrate von 0,03 mm/s kann mit den typischen ECT-Abmessungen verwendet werden. Tarieren Sie den Wandler, initiieren Sie die Dehnung und zeichnen Sie bis zum Punkt des EKT-Bruchs auf.
ACHTUNG: Makroskopische Bilder der EKT (Schritt 4.1.) müssen vor der Zugprüfung aufgezeichnet werden, da die CSA für die Datennormalisierung erforderlich ist.
HINWEIS: Die Spannungs-Dehnungs-Analyse, einschließlich der CSA-Berechnung, kann später nach der Zugprüfung verarbeitet werden. Verwenden Sie eine Tabellenkalkulationssoftware und eine statistische Analysesoftware zur Analyse der Daten. - Normalisieren Sie die gemessenen Kraftwerte (mN) pro ECT durch ihre cSA (mm2), um Spannungswerte (kPa) zu erhalten.
- Zeichnen Sie Spannungswerte gegen Dehnung (ein geometrisches Maß für die Gewebeverformung, das durch den relativen Abstand zwischen dem oberen und unteren Haken gegeben ist) in einem XY-Diagramm auf.
HINWEIS: Die Anfangslänge des Gewebes (Abstand zwischen oberem und unterem Haken) unmittelbar vor der Dehnung, L0, muss manuell eingestellt werden und entspricht dem Beginn der Zehenregion (Zehenregion kann je nach Gewebeeigenschaften fehlen). Jeder Dehnungspunktwert muss nach der Gleichung berechnet werden, in der Ltotal der Gesamtabstand an jedem Messpunkt ist: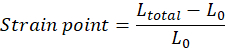
Verwenden Sie beim Plotten der Daten den Spannungswert an ausgewählter L0 für die Hintergrundsubtraktion. - Bestimmen Sie verschiedene biomechanische Parameter aus der Spannungs-Dehnungs-Kurve (verwenden Sie Abbildung 7B als Beispiel).
HINWEIS: Eine Spannungs-Dehnungs-Kurve kann drei Bereiche anzeigen: Zehen-, elastische und plastische Bereiche. Die obere Grenze der elastischen Region, bevor das Gewebe mit der Mikrofrakturierung beginnt, entspricht der Streckgrenze, und ihre Belastung ist ein Maß für die Gewebeelastizität. Der Kunststoffbereich besteht zwischen der Streckgrenze und der Versagensstelle. Der spätere Punkt entspricht einem plötzlichen Stressabfall aufgrund des Bruchs des Gewebes und definiert den ultimativen Fleck, der ein Maß für die Dehnbarkeit des Gewebes ist. Der dritte Messpunkt entspricht der Maximalfestigkeit, die durch die höchste Belastung definiert wird, die das Gewebe tragen kann, ohne während der Dehnung zu brechen. Die Belastbarkeit und Zähigkeit, die durch die Fläche unter der Kurve gegeben sind, entspricht der Energie, die das Gewebe bis zur Streckgrenze bzw. bis zum Versagenspunkt absorbiert. Für jede erhaltene Kurve entspricht die Steigung des linearen Teils des elastischen Bereichs dem Elastizitätsmodul, auch Elastizitätsmodul genannt, und ist eine mechanische Eigenschaft, die die Steifigkeit des Gewebes misst.- Extrahieren Sie aus jeder Kurve die XY-Werte (Dehnung bzw. Spannung) der Streckgrenze, des Versagenspunkts und des maximalen Spannungspunkts.
- Beurteilen Sie den Elastizitätsmodul (Steifigkeit in kPa = mN·mm-2) jedes EKT aus der Steigung des linearen Teils des elastischen Bereichs, indem Sie eine lineare Regression dieses Bereichs darstellen.
- Verwenden Sie ein statistisches Programm, um die Fläche unter der Kurve (AUC) zu berechnen, um sowohl die Belastbarkeit als auch die Zähigkeit bis zur Streckgrenze bzw. zum Versagenspunkt zu bestimmen. Berechnen Sie die AUC mit der trapezförmigen Methode. Setzen Sie die Baseline auf Null und berücksichtigen Sie nur die Peaks oberhalb der Baseline, die mindestens 10 % des Abstands vom Minimal- zum Maximalwert in der Y-Achse ausmachen.
ANMERKUNG: Die Module der Belastbarkeit und Zähigkeit werden durch σ × ε angegeben, wobei σ die Spannung (kPa) und ε die Dehnung (L/ΔL, mm/mm) ist. Elastizität und Zähigkeit sind also die Energie in kJ/m3 (kPa = kN·m-2 = kN·m·m-3 = kJ/m·m·m-3 = kJ/m3), die vom Gewebe vor der dauerhaften Verformung bzw. bis zum Bruch absorbiert wird.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
ECT erreichen innerhalb der ersten 24 h eine Verdichtung von rund 95 % im Vergleich zum anfänglichen Zell-Kollagen-Hydrogel-Volumen. Gewebeverdichtung und -kontraktion unter Kontrollbedingungen und in Gegenwart von FCS erfolgt einige Stunden nach dem Gießen und nimmt bis Tag 5 deutlich zu (Abbildung 5A). Die Polauslenkung kann in den folgenden 15 Tagen weiter zunehmen (20 Tage waren die längste getestete Zeit). Das Ausmaß der Polablenkung hängt vom Zelltyp, dem Zellzustand sowie den Zel...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Das vorgestellte Protokoll beschreibt die Erzeugung von ECT aus primärer menschlicher CF, die es ermöglicht, die mechanischen Auswirkungen dieser Zellen auf ihre extrazelluläre Matrixumgebung und umgekehrt zu untersuchen.
Die Fibroblasten müssen erweitert werden, um genügend Zellen für die geplanten ECT-Experimente (0,75 x 106 Zellen/ECT) zu erhalten. Für die beste Reproduzierbarkeit wird empfohlen, gefrorene oder aus Gewebe gewonnene Fibroblasten in 2D-Monolayer-Kultur für ...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
GLS und SL entwarfen das Manuskript. Alle Autoren waren an der Entwicklung des Protokolls beteiligt und bearbeiteten das Manuskript. TM, MT und WHZ sind wissenschaftliche Berater der myriamed GmbH. WHZ ist Gründer und Gesellschafter der myriamed GmbH.
Danksagungen
Diese Arbeit wurde von der Deutschen Gesellschaft für Kardiologie (DGK-Forschungsstipendium für GLS) und von der Deutschen Forschungsgemeinschaft (DFG durch das Projekt IGK 1816 für GLS und AD; DFG 417880571 und DFG TI 956/1-1 für MT; SFB 1002 TP C04 für MT und WHZ; SFB 1002 TP S01 für WHZ; und EXC 2067/1-390729940J für WHZ). WHZ wird gefördert durch das Bundesministerium für Wissenschaft und Bildung (BMBF durch das Projekt IndiHEART) und die Fondation Leducq (20CVD04). MT, WHZ und SL werden vom Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK) gefördert.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Cell culture reagents: | |||
| Accutase Solution | Merk Millipore | SCR005 | |
| Dissociation reagent – TrypLE Express | Gibco | 12604013 | |
| Dulbecco's Modified Eagle Medium (DMEM) powder, high glucose | Gibco | 12100061 | |
| Dulbecco’s phosphate buffered saline (DPBS), pH 7.2, -Ca2+, -Mg2+ | Gibco | 14190144 | |
| FGM-2 Fibroblast Growth Medium-2 BulletKit | Lonza | CC-3132 | |
| FBM Fibroblast Growth Basal Medium | Lonza | CC-3131 | |
| FGM-2 Fibroblast Growth Medium-2 SingleQuots, Supplements and Growth Factors | Lonza | CC-4126 | |
| Fibroblast Growth Medium 3 KIT | PromoCell | C-23130 | |
| Fibroblast Basal Medium 3 | PromoCell | C-23230 | |
| Growth Medium 3 SupplementPack | PromoCell | C-39350 | |
| Penicillin (10000 U/mL)/ Streptomycin (10000 μL/mL) | Gibco | 15140122 | |
| Sodium hydroxide solution (NaOH) 1.0 N | Sigma-Aldrich | S2770-100ML | |
| Cell sources: | |||
| Normal human cardiac fibroblasts from the ventricle (NHCF-V) | Lonza | CC-2904 | |
| Human Cardiac Fibroblasts (HCF-c) | PromoCell | C-12375 | |
| Human Cardiac Fibroblasts (HCF-p) | PromoCell | C-12377 | |
| Primary human foreskin fibroblasts-1 (HFF-1) | ATCC | SCRC- 1041 | |
| Collagen sourses: | |||
| Collagen Type I (bovine) in 0.01 M HCl | LLC Collagen Solutions | FS22024 | 6-7 mg/mL |
| Collagen Type I (rat tail) in 0.02 M HCl | Corning | 354236 | ~4 mg/mL |
| Drugs: | |||
| Latrunculin-A (Lat-A) | Enzo Life Sciences | BML-T119-0100 | |
| Plastic ware: | |||
| Cell culture plastic ware | Sarstedt and Starlab | ||
| Mesh cell strainer (Nylon, pore size 40 μm) | Falcon | 352340 | |
| myrPlate-uniform | myriamed GmbH | TM5 med | |
| Serological pipettes wide opening, sterile (10 mL) | Corning | 07-200-619 | |
| Specific instruments: | |||
| Bi-telecentric CORE lens for 1/2″ detectors | OptoEngineering | TCCR12096 | |
| Area scan camera Basler ace acA4024 | Basler | 107404 |
Referenzen
- Driesen, R. B., et al. Reversible and irreversible differentiation of cardiac fibroblasts. Cardiovascular Research. 101 (3), 411-422 (2014).
- Shi, X., et al. Elasticity of cardiac cells on the polymer substrates with different stiffness: an atomic force microscopy study. Physical Chemistry Chemical Physics. 13 (16), 7540-7545 (2011).
- Elson, E. L., Genin, G. M. Tissue constructs: platforms for basic research and drug discovery. Interface Focus. 6 (1), 20150095(2016).
- Cho, N., Razipour, S. E., McCain, M. L. TGF-beta1 dominates extracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts. Experimental Biology and Medicine. 243 (7), Maywood. 601-612 (2018).
- Cucoranu, I., et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts. Circulation Research. 97 (9), 900-907 (2005).
- Peng, H., Carretero, O. A., Peterson, E. L., Rhaleb, N. E. Ac-SDKP inhibits transforming growth factor-beta1-induced differentiation of human cardiac fibroblasts into myofibroblasts. American Journal of Physiology-Heart and Circulatory Physiology. 298 (5), 1357-1364 (2010).
- Ribeiro, A. J., et al. Contractility of single cardiomyocytes differentiated from pluripotent stem cells depends on physiological shape and substrate stiffness. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12705-12710 (2015).
- Tranquillo, R. T., Durrani, M. A., Moon, A. G. Tissue engineering science: consequences of cell traction force. Cytotechnology. 10 (3), 225-250 (1992).
- Barocas, V. H., Moon, A. G., Tranquillo, R. T. The fibroblast-populated collagen microsphere assay of cell traction force--Part 2: Measurement of the cell traction parameter. Journal of Biomechanical Engineering. 117 (2), 161-170 (1995).
- Lijnen, P., Petrov, V., Rumilla, K., Fagard, R. Stimulation of collagen gel contraction by angiotensin II and III in cardiac fibroblasts. Journal of the Renin-Angiotensin-Aldosterone System. 3 (3), 160-166 (2002).
- Baxter, S. C., Morales, M. O., Goldsmith, E. C. Adaptive changes in cardiac fibroblast morphology and collagen organization as a result of mechanical environment. Cell Biochemistry and Biophysics. 51 (1), 33-44 (2008).
- Zhou, Y., et al. Inhibition of mechanosensitive signaling in myofibroblasts ameliorates experimental pulmonary fibrosis. Journal of Clinical Investigation. 123 (3), 1096-1108 (2013).
- Lijnen, P., Petrov, V., Fagard, R. In vitro assay of collagen gel contraction by cardiac fibroblasts in serum-free conditions. Methods and Findings in Experimental and Clinical Pharmacology. 23 (7), 377-382 (2001).
- Burgess, M. L., et al. Integrin-mediated collagen gel contraction by cardiac fibroblasts. Effects of angiotensin II. Circulation Research. 74 (2), 291-298 (1994).
- Nunohiro, T., Ashizawa, N., Graf, K., Hsueh, W. A., Yano, K. Angiotensin II promotes integrin-mediated collagen gel contraction by adult rat cardiac fibroblasts. Japanese Heart Journal. 40 (4), 461-469 (1999).
- Ngu, J. M., et al. Human cardiac fibroblast extracellular matrix remodeling: Dual effects of tissue inhibitor of metalloproteinase-2. Cardiovascular Pathology. 23 (6), 335-343 (2014).
- Knezevic, V., Sim, A. J., Borg, T. K., Holmes, J. W. Isotonic biaxial loading of fibroblast-populated collagen gels: a versatile, low-cost system for the study of mechanobiology. Biomechanics and Modeling in Mechanobiology. 1 (1), 59-67 (2002).
- Delvoye, P., Wiliquet, P., Leveque, J. L., Nusgens, B. V., Lapiere, C. M. Measurement of mechanical forces generated by skin fibroblasts embedded in a three-dimensional collagen gel. Journal of Investigative Dermatology. 97 (5), 898-902 (1991).
- Kolodney, M. S., Elson, E. L. Correlation of myosin light chain phosphorylation with isometric contraction of fibroblasts. Journal of Biological Chemistry. 268 (32), 23850-23855 (1993).
- Bell, B. J., Nauman, E., Voytik-Harbin, S. L. Multiscale strain analysis of tissue equivalents using a custom-designed biaxial testing device. Biophysical Journal. 102 (6), 1303-1312 (2012).
- Wakatsuki, T., Kolodney, M. S., Zahalak, G. I., Elson, E. L. Cell mechanics studied by a reconstituted model tissue. Biophysical Journal. 79 (5), 2353-2368 (2000).
- Thomopoulos, S., et al. Fibrocartilage tissue engineering: The role of the stress environment on cell morphology and matrix expression. Tissue Engineering Part A. 17 (7-8), 1039-1053 (2011).
- Roeder, B. A., Kokini, K., Sturgis, J. E., Robinson, J. P., Voytik-Harbin, S. L. Tensile mechanical properties of three-dimensional type I collagen extracellular matrices with varied microstructure. Journal of Biomechanical Engineering. 124 (2), 214-222 (2002).
- Ongherth, A., et al. p63RhoGEF regulates auto- and paracrine signaling in cardiac fibroblasts. Journal of Molecular and Cellular Cardiology. 88, 39-54 (2015).
- Vettel, C., et al. PDE2-mediated cAMP hydrolysis accelerates cardiac fibroblast to myofibroblast conversion and is antagonized by exogenous activation of cGMP signaling pathways. American Journal of Physiology-Heart and Circulatory Physiology. 306 (8), 1246-1252 (2014).
- Jatho, A., et al. RhoA Ambivalently Controls Prominent Myofibroblast Characteritics by Involving Distinct Signaling Routes. PLoS One. 10 (10), 0137519(2015).
- Dworatzek, E., et al. Sex-specific regulation of collagen I and III expression by 17beta-Estradiol in cardiac fibroblasts: role of estrogen receptors. Cardiovascular Research. 115 (2), 315-327 (2019).
- Tiburcy, M., Meyer, T., Soong, P. L., Zimmermann, W. H. Collagen-based engineered heart muscle. Methods in Molecular Biology. 1181, 167-176 (2014).
- Schlick, S. F., et al. Agonistic and antagonistic roles of fibroblasts and cardiomyocytes on viscoelastic stiffening of engineered human myocardium. Progress in Biophysics and Molecular Biology. 144, 51-60 (2019).
- Wille, J. J., Elson, E. L., Okamoto, R. J. Cellular and matrix mechanics of bioartificial tissues during continuous cyclic stretch. Annals of Biomedical Engineering. 34 (11), 1678-1690 (2006).
- Berry, C. C., Shelton, J. C., Bader, D. L., Lee, D. A. Influence of external uniaxial cyclic strain on oriented fibroblast-seeded collagen gels. Tissue Engineering. 9 (4), 613-624 (2003).
- Stopak, D., Harris, A. K. Connective tissue morphogenesis by fibroblast traction. I. Tissue culture observations. Developmental Biology. 90 (2), 383-398 (1982).
- Bellows, C. G., Melcher, A. H., Aubin, J. E. Association between tension and orientation of periodontal ligament fibroblasts and exogenous collagen fibres in collagen gels in vitro. Journal of Cell Science. 58 (1), 125-138 (1982).
- Tranquillo, R. T. Self-organization of tissue-equivalents: the nature and role of contact guidance. Biochemical Society Symposia. 65, 27-42 (1999).
- Barocas, V. H., Tranquillo, R. T. An anisotropic biphasic theory of tissue-equivalent mechanics: the interplay among cell traction, fibrillar network deformation, fibril alignment, and cell contact guidance. Journal of Biomechanical Engineering. 119 (2), 137-145 (1997).
- Yip, A. K., et al. Anisotropic traction stresses and focal adhesion polarization mediates topography-induced cell elongation. Biomaterials. 181, 103-112 (2018).
- Santos, G. L., Hartmann, S., Zimmermann, W. H., Ridley, A., Lutz, S. Inhibition of Rho-associated kinases suppresses cardiac myofibroblast function in engineered connective and heart muscle tissues. Journal of Molecular and Cellular Cardiology. 134, 13-28 (2019).
- Kittana, N., et al. Modulating the biomechanical properties of engineered connective tissues by chitosan-coated multiwall carbon nanotubes. International Journal of Nanomedicine. 16, 989-1000 (2021).
- Kittana, N., et al. Enhancement of wound healing by single-wall/multi-wall carbon nanotubes complexed with chitosan. International Journal of Nanomedicine. 13, 7195-7206 (2018).
- Antoine, E. E., Vlachos, P. P., Rylander, M. N. Review of collagen I hydrogels for bioengineered tissue microenvironments: characterization of mechanics, structure, and transport. Tissue Engineering Part B: Reviews. 20 (6), 683-696 (2014).
- Holder, A. J., et al. Control of collagen gel mechanical properties through manipulation of gelation conditions near the sol-gel transition. Soft Matter. 14 (4), 574-580 (2018).
- Zimmermann, W. H., et al. Tissue engineering of a differentiated cardiac muscle construct. Circulation Research. 90 (2), 223-230 (2002).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten